医疗器械经营许可申请表(范本)

医疗器械经营许可申请表
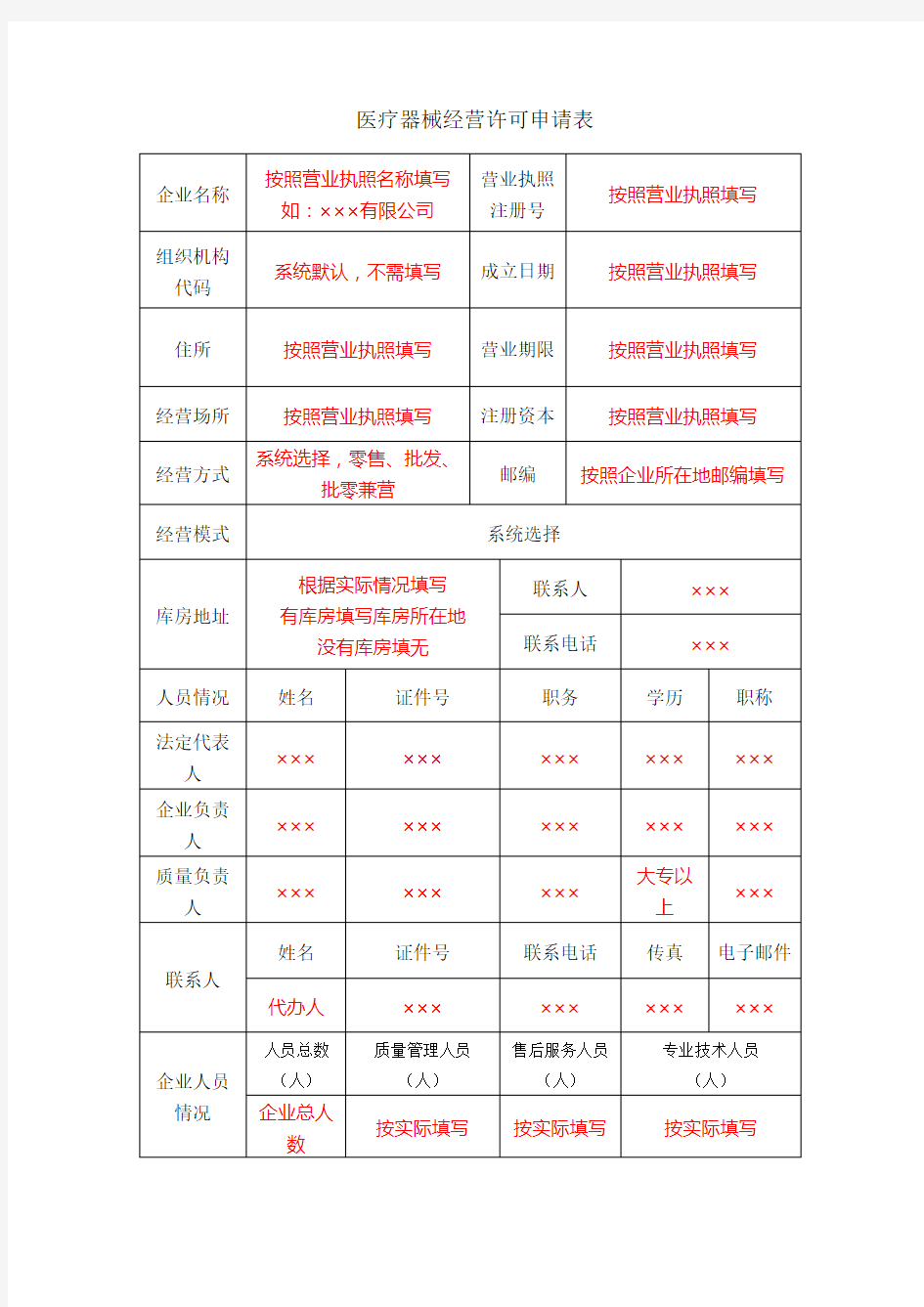
企业名称(公章):按照营业执照名称填写如:×××有限公司申请人:填写实际申请人姓名
联系电话:申请人联系电话
申请日期:不需填写
受理日期:不需填写
受理编号:不需填写
国家食品药品监督管理总局监制
医疗器械经营许可申请表
代表人、注册资本、成立日期、营业期限等按照营业执照内容填写。
2.本表经营范围应当按照国家食品药品监督管理部门颁布的医疗器械分类目录中规定的管理类别、分类编码及名称填写。
3.本表经营方式指批发、零售、批零兼营、为其他生产经营企业提供贮存、配送服务。
第一类医疗器械产品备案办事指南
第一类医疗器械产品备案办事指南 一、法定依据 1.《医疗器械监督管理条例》(国务院第650号令)第八条第一类医疗器械实行产品备案管理,第二类、第三类医疗器械实行产品注册管理。第十条第一类医疗器械产品备案,由备案人向所在地设区的市级人民政府食品药品监督管理部门提交备案资料; 2.《关于医疗器械生产经营备案有关事宜的公告》(2014年第25号). 二、备案申请材料 1.备案资料目录 2.申请人在国家食品药品监督管理总局网站()首页许可服务栏,点击网上办事,进入医疗器械生产经营备案信息系统进行网上填报; 3、网上填报后,在线打印《第一类医疗器械备案表》一式三份(申请表不得手工填写),并点击提交按钮; 4.第一类医疗器械备案表 5.安全风险分析报告 6.产品技术要求 7.产品检验报告 8.临床评价资料 9.产品说明书及最小销售单元标签设计样稿 10.生产制造信息 11.证明性文件 12.符合性声明 (二)变更备案申请资料 1.变更备案资料目录
2.变化情况说明及相关证明文件 3.证明性文件 4.符合性声明 注:备案时应一并提交含有备案表内容(含附件)的电子文档;上述材料要加盖备案人公章,或者其法定代表人、负责人签名加企业盖章。 三、备案资料要求 (一)安全风险分析报告要求 医疗器械应按照YY 0316《医疗器械风险管理对医疗器械的应用》的有关要求编制,主要包括医疗器械预期用途和与安全性有关特征的判定、危害的判定、估计每个危害处境的风险;对每个已判定的危害处境,评价和决定是否需要降低风险;风险控制措施的实施和验证结果,必要时应引用检测和评价性报告;任何一个或多个剩余风险的可接受性评定等,形成风险管理报告。 体外诊断试剂应对产品寿命周期的各个环节,从预期用途、可能的使用错误、与安全性有关的特征、已知和可预见的危害等方面的判定及对患者风险的估计进行风险分析、风险评价及相应的风险控制的基础上,形成风险管理报告。 (二)产品技术要求 产品技术要求应按照《医疗器械产品技术要求编写指导原则》编制。 (三)产品检验报告 产品检验报告应为产品全性能自检报告或委托检验报告,检验的产品应当具有典型性。 (四)临床评价资料
二类医疗器械备案申请资料.docx
申办《二类医疗器械经营企业备案》 申 请 材 料 ××××××××××有限公司 ××年××月××日 联系电话:××××××× 申请材料目录 1、《医疗器械经营企业备案申请表》 2、《营业执照》副本复印件 3、公司章程 4、企业组织机构和职能 ( 框架 ) 图 5、医疗器械经营企业从业人员情况表、拟经营产品情况表、企业设施设备情况表及企业相关人员学历资格等证明 6、各项质量管理制度目录 7、经营和仓库场所的证明文件 8、自我保证声明
申报资料一 《医疗器械经营企业备案申请表》 ××××××××××有限公司 ××年××月××日 医疗器械经营企业基本情况表(申请人填写) (此处由网上申报后打印) 拟办企业名称××××××××××有限公司隶属关系 拟注册地址××××××××××邮政编码×××××拟仓库地址×××××××××× 拟经营范围第Ⅱ 类:物理治疗设备及康复设备6826 拟法定代表人拟企业负责人拟质量管理人联系人 职工总数 场所状况(平方米)×××职务法定代表人职称其它学历本科×××职务总经理职称其它学历大专×××职务质量负责人职称学历中专×××电话×××传真×××3从事质量管理人员总数1经营面积仓储面积 70120
被委托人签字: 拟法定代表人签字: 联系电话: 年月日 年月日 申报资料二 《营业执照》副本复印件 ××××××××××有限公司 ××年××月××日 申报资料三 公司章程 ××××××××××有限公司 ××年××月××日 申报资料四 企业组织机构和智能(框架)图 ××××××××××有限公司 ××年××月××日 各部门职能 ( 责 ) 一、总经理职能 1.经理为公司的法定代表人,依法全面负责公司的日常行政和业务事务及相关活动。 2.对企业的发展提出规划,季度经营计划和财务预决算方案。 3.领导公司各部门工作,努力实现公司制定的各项经营目标。
单体药店二类医疗器械备案 申请材料
第二类医疗器械经营备案 申 请 材 料 临沭县洪康药店 2014年8月20日 联系电话:1358******* 申请备案材料目录 1、第二类医疗器械经营备案表 2、企业营业执照复印件 3、企业负责人身份证、学历复印件 4、企业质量负责人身份证、学历、职称证明复印 件
企业名称*********** 营业 执照 注册 号 *********** 组织 机 构 代 码成立 日期 2004年2月 住 所*********** 营业 期限 长期 经 营方式零售 注册 资本 *********** 经 营 ***********邮 *********** 5、企业组织机构及部门设置 6、企业经营场所地理位置图、平面图 7、企业经营场所房屋产权证明复印件、房屋租协议 8、企业经营设施和设备情况表 9、企业经营质量管理制度及工作程序目录 10、经办人授权委托书 11、自我保证声明
场 所 编 联系人 姓名身份证号联系电话传真电子邮件**************************************** 库房地址联系 电话 邮 编 经营范围 普通诊察器械类(6820):体温计、血压计;物理治疗及康复设备类(6826):磁疗器具;临床检验分析仪器类(6840):家用血糖仪及试纸、妊娠诊断试纸;医用卫生材料及敷料类(6864):医用脱脂棉、脱脂纱布、医用卫生口罩等;医用高分子材料及制品类(6866):避孕套、避孕帽。 人 员 情 况 姓名身份证号职务学历 法 定 代 表 人 企 业 负 责 人 **********************经理中专 质 量 负 责 人 **********************质量管理员大专 企业人员人员总数 (人) 质量管理人员(人)售后服务人员(人) 专业技术人员 (人)
医疗器械经营许可证行政审批网上申报流程
行政审批网上申报流程 系统地址 (1) 登录系统 (2) 2.1办理身份识别器 (2) 2.2安装驱动(两个) (2) 网上申报材料 (4) 3.1药品批发换证申报 (5) 3.2药品零售申报 (5) 3.3省局医疗器械经营申报 (5) (1)开办申报 (5) 系统地址 密码:82501762s 系统地址:https://www.360docs.net/doc/0511908921.html,:8088/shanxi/apply 或者登入https://www.360docs.net/doc/0511908921.html, 点击进入行政审批系统。如下图所示 点击这里
登录系统 2.1办理身份识别器 系统必须使用身份识别器登录。办理时需携带营业执照副本复印件一张,费用550元整在省局301办理。 2.2安装驱动(两个) (1)打开行政审批系统页面,下载驱动。如下图所示。 安装驱动。双击默认安装。期间杀毒软件或者360提示的话请点击允许执行。
(2)将身份识别器插上,打开并安装其中的驱动 安装成功后登录系统,显示如下图。初始密码为123456。 123456 网上申报材料 进入系统后开始申报资料。
3.1药品批发换证申报3.2药品零售申报 3.3省局医疗器械经营申报(1)开办申报 点击新增
填写表格需注意事项: 填写完成后保存,并上传所需办事材料。可以浏览当前电脑目录,找到所需文件,点击保存上传。如果已上传资料不符合要求,可以选择清空后重新上传。如果已经上传文件后,就会出现查看按钮,点击查看自己上传的资料。点击查看模版可以查看需要以word上传的资料的模版,按照模版填写上报。(上传附件注意事项) 上传附件示意图 医疗器械经营开办需上传附件: 注意事项: ●注扫的需扫描,没有注扫的需制作成word或者excel; ●扫描文件大小每张请控制在500KB以内; ●每项只能上传一个文件,如需上传多个文件,请将多个文件压缩成一个文件上传 序号办事材料名称说明 1 经办人、拟办企业法人、负责人、质量 管理人员身份证复印件(扫) 经办人、拟办企业法人、负责人、质量管理人员 身份证复印件(扫) 2法人委托书(扫)法人委托书 3 新开办企业的申请(详细介绍筹建情 况) 新开办企业的申请(详细介绍筹建情况) 4 企业名称预核准证明(营业执照副本复 印件)(扫) 企业名称预核准证明(营业执照副本复印件) 5 拟办企业法人个人简历拟办企业法人个人简历 6 拟办企业负责人个人简历拟办企业负责人个人简历 7 质量管理人员学历职称证明复印件 (扫) 质量管理人员学历职称证明复印件
3、医疗器械临床试验流程及操作规范
医疗器械临床试验流程及操作规范 研发部:朱立武 相关法规及指导原则 《医疗器械注册管理办法》 《医疗器械临床试验规定》 《医疗器械临床试验质量管理规范》(征求意见稿)医疗器械技术审评中心专项指导原则 临床试验操作流程及规范 试验前: 1、了解同类产品信息: 其目的:①备选对照组;②便于查阅文献资料;③设定试验范围; 企业产品的说明书和产品标准中产品的适应症、禁忌症和注意事项明确 2、调研国内外参考文献及临床资料: 文献的质量很关键 3、制定项目时间计划: 时间计划是项目管理的先决条件
4、撰写临床文案: 关键点:①同类产品的临床文献;②产品适用范围明确;③随访周期;④入选排除标准;⑤评价指标; 5、筛选临床研究单位: 筛选研究单位,确定主要研究者。理想的合作单位:☆、符和CFDA 基本要求;☆、研究者的意愿;☆、同类产品的使用情况;☆、研究费用。 6、联系统计单位: 7、制定项目预算: 8、组织召开方案讨论会: 拟定方案讨论要点,以最短的时间讨论最关键的内容:入排标准、观察随访周期、评价指标、样本量计算中各参数的设定依据,CRF数据采集的可行性完整性。 9、修订方案: 根据会上所提出的问题及解决的办法,修订临床方案。 10、申请伦理: 取得检测报告开始准备研究单位立项、根据伦理会要求准备伦理资料。重点针对知情同意书准备伦理意见回复。 11、签署临床试验协议: 临床试验项目通过伦理审批后签订临床试验协议。各研究单位的费用分配比例有差异,合理的分配费用既能够有效的控制预算又能保证项目的进度按计划执行。
12、产品备案: 13、印刷研究资料: 14、试验产品及临床资料配送: 设计各种规格临床研究用样品标签;督促并跟踪临床试验样品及临床资料的配送,保证研究单位的试验物资充足。 试验中: 15、组织召开科室启动会: 临床试验产品介绍 临床试验操作SOP介绍 各相关临床资料的填写说明 (EDC) 16、受试者入组: 督促跟踪研究者对试验方案的执行情况 确认在试验前取得所有受试者的知情同意书 确认入选的受试者合格 17、监查员跟踪督促患者随访: 了解受试者的随访率及试验的进展状况 确认所有化验单数据与报告完整 18、协助研究者完成各种表格填写: 所有病例报告表填写正确,并与原始资料一致;所有错误或遗漏均已改正或注明,经研究者签名并注明日期。 19、监查员按时提交监查报告:
医疗器械经营许可证办理流程
医疗器械许可证办理前提是注册一家新公司,所需材料和流程参考注册普通新公司。下面为大家分享下办理医疗器械经营许可证办理流程具体如下: 1、查名 2、办理营业执照 3、办理医疗器械经营许可证 4、变更经营范围(添加二类,三类医疗器械经营范围) 办理所需材料 1、三个相关医学专业毕业的大专以上(含大专)文凭产品质量监督检测人员(其中一个为质量检测负责人); 2、三个质量监督检测人员的身份证和毕业证复印件、工作简历;(食品药监局老师过来场地核查约谈的时候需要提供相关检测人员的身份证和毕业证原件,并本人到场); 3、所销售医疗器械对方生产厂家的公司营业执照、医疗器械生产企业许可证; 4、所销售医疗器械对方生产厂家的医疗器械注册证、医疗器械注册登记表; 5、所销售医疗器械对方生产厂家的委托销售授权书; 医疗器械经营许可证办理时间: 核名通过后,3-4个月左右 另附详细流程如下: 第一步工商查名 所需材料: 1.名称预先核准申请书 2.投资人身份证明 3.注册资金、出资比例
办理时间:材料齐全,名称不重复的情况下,3-5个工作日 第二步医疗器械经营企业许可证申请 (一)《受理通知书》 所需材料: (1)《医疗器械经营企业许可证申请材料登记表》; (2)《上海市医疗器械经营企业许可证申请表》; (3)工商行政管理部门出具的企业名称预核准证明文件或《营业执照》复印件; (4)拟办企业质量管理负责人的身份证、学历或者职称证明复印件及个人简历; (5)拟办企业质量管理人员的身份证、学历或者职称证明复印件; (6)拟办企业组织机构与职能或专职质量管理人员的职能; (7)拟办企业注册地址、仓库地址的地理位置图、平面图(注明面积)、房屋产权证明或者租赁协议(附租赁房屋产权证明)复印件; (8)拟办企业产品质量管理制度文件(11个文件)及储存设施、设备目录; (9)拟办企业经营范围,按照医疗器械分类目录中规定的管理类别、类代号名称确定; (10)拟销售产品的委托销售方营业执照和产品注册证(复印件)、授权书; (10)电子申报材料;(浦东药检需要); (11)其它需提供的证明文件。 附:申请材料具体要求: (1)表格内容不能缺项,字迹清楚 (2)同时上报申请表电子文本(放在软盘中)和A4规格的书面资料(传真纸不能作为资料上报)各一份 (3)申办人提交的申办材料应齐全、规范、有效
第二类医疗器械经营备案申请表(模板)
第二类医疗器械经营备案表 企业名称佛山市***公司 营业执照 注册号 1234567 组织机构 代码 1234567 成立日期 2014.6.1 住所佛山市禅城区季华五路1号营业期限2019.5.31 经营方式批零兼营注册资本50万 经营场所佛山市禅城区季华五路1号邮编528000 联系人 姓名身份证号联系电话传真电子邮件 张三1234567 1234567 1234567 1234567@https://www.360docs.net/doc/0511908921.html, 库房地址佛山市禅城区季华五路1号 联系电话1234567 邮编528000 经营范围Ⅱ类6815注射穿刺器械, Ⅱ类6816烧伤(整形)科手术器械,Ⅱ类6820普通诊察器械,Ⅱ类6821医用电子仪器设备,Ⅱ类6822医用光学器具、仪器及内窥镜设备,Ⅱ类6823医用超声仪器及有关设备,Ⅱ类6824医用激光仪器设备,Ⅱ类6825医用高频仪器设备,Ⅱ类6826物理治疗及康复设备,Ⅱ类6827中医器械,Ⅱ类6828医用磁共振设备,Ⅱ类6830医用X射线设备,Ⅱ类6831医用X射线附属设备及部件,Ⅱ类6832医用高能射线设备,Ⅱ类6833医用核素设备,Ⅱ类6834医用射线防护用品、装置,Ⅱ类6840临床检验分析仪器,Ⅱ类6841医用化验和基础设备器具,Ⅱ类6845体外循环及血液处理设备,Ⅱ类6846植入材料和人工器官,Ⅱ类6854手术室、急救室、诊疗室设备及器具,Ⅱ类6855口腔科设备及器具,Ⅱ类6856病房护理设备及器具,Ⅱ类6857消毒和灭菌设备及器具,Ⅱ类6858医用冷疗、低温、冷藏设备及器具,Ⅱ类6863口腔科材料,Ⅱ类6864医用卫生材料及敷料,Ⅱ类6865医用缝合材料及粘合剂,Ⅱ类6866医用高分子材料及制品,Ⅱ类6870软件,Ⅱ类6877介入器材,Ⅱ类6801~6813手术器械(是指包含:Ⅱ类6801基础外科手术器械, Ⅱ类6802显微外科手术器械, Ⅱ类6803神经外科手术器械, Ⅱ类6804眼科手术器械, Ⅱ类6805耳鼻喉科手术器械, Ⅱ类6806口腔科手术器械, Ⅱ类6807胸腔心血管外科手术器械, Ⅱ类6808腹部外科手术器械, Ⅱ类6809泌尿肛肠外科手术器械, Ⅱ类6810矫形外科(骨科)手术器械, Ⅱ类6812妇产科用手术器械, Ⅱ类6813计划生育手术器械),Ⅱ类6840体外诊断试剂 ** 人员情况姓名身份证号职务学历职称法定代表人张三1234567 本科主任医师企业负责人李四1234567 本科主任医师质量负责人赵五1234567 本科主任医师 企业人员情况人员总数(人)质量管理人员(人) 售后服务人员 (人) 专业技术人员(人) 20 2 8 10 经营场所情况建筑面积(㎡) 经营面积(㎡) 库房面积(㎡) 冷藏库面积(㎡) 360 100 200 60 经营场所及仓储条件经营场所条件(包括面积、用房性质、 设施设备情况等) (企业根据自身实际情况填写)
医疗器械临床试验要求
第四部分临床试验 内容提要 一、概述 二、《医疗器械临床试验规定》中应注意的问题 三、临床试验资料应注意的问题 四、临床试验方案设计中应注意的问题 五、临床试验方案和报告 第一章概述 按照《医疗器械注册管理办法》的有关要求,生产企业对医疗器械产品申请首次注册时,需提交临床试验资料。 对于境内生产的二类医疗器械,临床试验资料的提供分三种方式: 一、提供在中国境内进行临床的临床试验资料。应严格执行《医疗器械临床试验规定》(5号令) 二、提交同类产品的临床试验资料和对比说明。应执行《医疗器械注册管理办法》和《第二类医疗器械产品生产注册》的有关规定。 三、不需要提供临床试验资料。 注:第二三种情况在产品注册部分介绍。 医疗器械临床试验是产品注册前的一个重要环节(如图1所示)。
图1 流程图 第二章《医疗器械临床试验规定》中应注意的问题1、医疗器械临床试验分为医疗器械临床试用和医疗器械临床验证。医疗器械临床试用:市场上尚未出现过,验证该医疗器械理论原理、基本结构、性能等要素能否保证该器械的安全性、有效性。 医疗器械临床验证:同类产品已上市,验证该器械与已上市产品的主要结构、性能要素是否实质性等同,是否具有同样的安全性、有效性。 2、医疗器械临床试验的前提条件: a)具有复核通过的注册产品标准(产品企业标准)或相应的国家、行业标准;
b)具有自测报告,且结论合格; c)具有国务院食品药品监督管理部门会同国务院质量技术监督部门认可的检测机构出具的产品型式试验报告,且结论合格; d)需要由动物试验确认产品对人体临床试验安全性的产品,应当提交动物试验报告。首次用于植入人体的医疗器械,应当具有动物试验报告。 3、医疗器械临床试验设计应考虑受试者的权益保障,临床试验开始前应制定《知情同意书》;试验实施过程中,受试者或其法定代理人签名确认后,方可参加临床试验。 4、医疗器械临床试验方案应由医疗机构和实施者共同设计制定,报伦理委员会认可后实施;若有修改,必须经伦理委员会同意。 在医疗器械产品注册申报过程中,实施者为申请注册该医疗器械产品的单位,一般指医疗器械生产企业。 5、医疗器械临床试验应在经国务院食品药品监督管理部门会同国务院卫生行政部门认定的药品临床试验基地进行。 基地目录可在国家食品药品监督管理局的网站上查询。 (1)点击https://www.360docs.net/doc/0511908921.html,进入国家食品药品监督管理局的网站(如图2所示),选择数据查询项目,并进入。
医疗器械经营许可证办理手续
医疗器械经营许可证 医疗器械经营许可证是医疗器械经营企业必须具备的证件,开办第一类医疗器械经营企业,应当向省、自治区、直辖市人民政府药品监督管理部门备案;开办第二类、第三类医疗器械经营企业,应当经省、自治区、直辖市人民政府药品监督管理部门审查批准,并发给《医疗器械经营企业许可证》。无《医疗器械经营企业许可证》的,工商行政管理部门不得发给营业执照。《医疗器械经营企业许可证》有效期为5年。 医疗器械许可办理需考核内容 1、企业组织机构健全。应设置与经营规模和经营品种相适应的质检、采购、销售、售后服务、财务和库房等部门,部门标示清楚职责明确,责任到人。企业应建立以企业负责人为首的质量领导小组,企业负责人对经营质量负领导责任。设立分公司所提交的材料应由其公司加盖鲜章确认。 2、企业应收集并保存国家有关法律、法规、规章,并认真学习贯彻执行,学习有记录。 1)医疗器械监督管理条例 2)医疗器械注册管理办法 3)医疗器械经营企业许可证管理办法 4)一次性使用无菌医疗器械监督管理办法 5)体外诊断试剂经营企业验收标准 6)中华人民共和国产品质量法 7)中华人民共和国公司法 8)中华人民共和国合同法 9)中华人民共和国消费者权益保护法 10)中华人民共和国反不正当竞争法 11)其它有关法律、法规、规章、文件 3、企业应收集并保存与经营产品相关的国家标准或行业标准或注册产品标准,并认真学习贯彻执行,学习有记录。 4、企业应依据国家有关法律、法规结合企业实际制定各种管理制度和配套记录表格,制度上墙并建档,有定期检查和考核制度执行情况的记录。 1)经营管理制度 2)首营品种管理制度 3)产品入库验收制度 4)产品入出库复核制度 5)销售档案管理制度 6)效期产品管理制度 7)仓储保管制度 8)植入器材管理制度 9)一次性使用无菌器械管理制度 10)培训学习制度 11)质量跟踪制度 12)售后服务及用户联系制度 13)退货及不合格品管理制度 14)用户投诉处理制度 15)不良行为警示制度
医疗器械临床试验设计指导原则
医疗器械临床试验设计指导原则 (征求意见稿) 二〇一七年十一月
目录 一、适用范围 ..................... 错误!未定义书签。 二、临床试验的开展原则 ........... 错误!未定义书签。 三、医疗器械临床试验的设计原则和特点错误!未定义书签。(一)临床试验目的 ............... 错误!未定义书签。(二)器械临床试验设计需考虑的特殊因素错误!未定义书签。 1.器械的工作原理 ................ 错误!未定义书签。2.使用者技术水平和培训 .......... 错误!未定义书签。3.学习曲线 ...................... 错误!未定义书签。4.人为因素 ...................... 错误!未定义书签。(三)临床试验设计的基本类型和特点错误!未定义书签。1.平行对照设计 ................... 错误!未定义书签。(1)随机化 ...................... 错误!未定义书签。(2)盲法 ........................ 错误!未定义书签。(3)对照 ........................ 错误!未定义书签。 2.配对设计 ....................... 错误!未定义书签。 3.交叉设计 ....................... 错误!未定义书签。 4.单组设计 ....................... 错误!未定义书签。(1)与OPC比较 .................. 错误!未定义书签。(2)与PG比较 ................... 错误!未定义书签。
怎么申请医疗器械经营许可证
申报范围: 从事第三类医疗器械经营的单位 申报条 件: 一、 经营范围填写: ◆特殊管理品种首先单独填写,如:Ⅲ类:6846植入材料和人工器官、6877介入器材; Ⅲ类:6822-1塑形角膜接触镜及护理用液;Ⅲ类:6840体外诊断试剂;Ⅲ类:6815注射穿刺器械、6866医用高分子材料及制品;Ⅲ类:6822-1角膜接触镜及护理用液(塑形角膜接触镜除外) ◆有除外品种的集中填写.如: Ⅲ类:6815注射穿刺器械(一次性使用无菌医疗器械除外)、6866医用高分子材料及制品(一次性使用无菌医疗器械除外);6822医用光学器具、仪器及内窥镜设备(6822-1角膜接触镜及护理用液除外)。 二、经营场所、仓库面积要求: 1. 企业应当具有与经营范围和经营规模相适应、独立的经营场所和库房,经营场所和库房的面积应当满足经营要求。经营场所和库房不得设在居民住宅内、军事管理区(不含可租赁区)以及其他不适合经营的场所。 2. 经营隐形眼镜及其护理用液的,可以不设仓库,但应当有专柜存放。 3. 所申报的经营场所和仓库原则上在同一行政区域内就近设置。 有下列经营行为之一的,企业可以不单独设立医疗器械库房: (一)单一门店零售企业的经营场所陈列条件能符合其所经营医疗器械产品性能要求、经营场所能满足其经营规模及品种陈列需要的; (二)连锁零售经营医疗器械的; (三)全部委托为其他医疗器械生产经营企业提供储存、配送服务的医疗器械经营企业进行存储的; (四)专营医疗器械软件或者医用磁共振、医用X 射线、医用高能射线、医用核素设备等大型医用设备的; (五)省级食品药品监督管理部门规定的其他可以不单独设立医疗器械库房的情形。 三、企业人员资质的要求:
医疗器械临床试验规定
《医疗器械临床试验规定》(局令第5号) 国家食品药品监督管理局令第5号 《医疗器械临床试验规定》于2003年12月22日经国家食品药品监督管理局局务会审议通过,现予发布。本规定自2004年4月1日起施行。 二○○四年一月十七日 医疗器械临床试验规定 第一章总则 第一条为加强对医疗器械临床试验的管理,维护受试者权益,保证临床试验结果真实、可靠,根据《医疗器械监督管理条例》,制定本规定。 第二条医疗器械临床试验的实施及监督检查,应当依照本规定。 第三条本规定所称医疗器械临床试验是指:获得医疗器械临床试验资格的医疗机构(以下称医疗机构)对申请注册的医疗器械在正常使用条件下的安全性和有效性按照规定进行试用或验证的过程。 医疗器械临床试验的目的是评价受试产品是否具有预期的安全性和有效性。 第四条医疗器械临床试验应当遵守《世界医学大会赫尔辛基宣言》(附件1)的道德原则,公正、尊重人格、力求使受试者最大程度受益和尽可能避免伤害。 第五条医疗器械临床试验分医疗器械临床试用和医疗器械临床验证。 医疗器械临床试用是指通过临床使用来验证该医疗器械理论原理、基本结构、性能等要素能否保证安全性有效性。 医疗器械临床验证是指通过临床使用来验证该医疗器械与已上市产品的主要结构、性能等要素是否实质性等同,是否具有同样的安全性、有效性。 医疗器械临床试用的范围:市场上尚未出现过,安全性、有效性有待确认的医疗器械。
医疗器械临床验证的范围:同类产品已上市,其安全性、有效性需要进一步确认的医疗器械。 第六条医疗器械临床试验的前提条件: (一)该产品具有复核通过的注册产品标准或相应的国家、行业标准; (二)该产品具有自测报告; (三)该产品具有国务院食品药品监督管理部门会同国务院质量技术监督部门认可的检测机构出具的产品型式试验报告,且结论为合格; (四)受试产品为首次用于植入人体的医疗器械,应当具有该产品的动物试验报告; 其它需要由动物试验确认产品对人体临床试验安全性的产品,也应当提交动物试验报告。 第二章受试者的权益保障 第七条医疗器械临床试验不得向受试者收取费用。 第八条医疗器械临床试验负责人或其委托人应当向受试者或其法定代理人详细说明如下事项: (一)受试者自愿参加临床试验,有权在临床试验的任何阶段退出; (二)受试者的个人资料保密。伦理委员会、(食品)药品监督管理部门、实施者可以查阅受试者的资料,但不得对外披露其内容; (三)医疗器械临床试验方案,特别是医疗器械临床试验目的、过程和期限、预期受试者可能的受益和可能产生的风险; (四)医疗器械临床试验期间,医疗机构有义务向受试者提供与该临床试验有关的信息资料; (五)因受试产品原因造成受试者损害,实施者应当给予受试者相应的补偿;有关补偿事宜应当在医疗器械临床试验合同中载明。 第九条受试者在充分了解医疗器械临床试验内容的基础上,获得《知情同意书》。《知情同意书》除应当包括本规定第八条所列各项外,还应当包括以下内容: (一)医疗器械临床试验负责人签名及签名日期;
第二类医疗器械经营备案申请
第二类《医疗器械经营备案》申请 申 报 材 料 上海远南医疗器械有限公司 2015年11月30日 联系电话:177xxxxxxxxx
洛阳远南医疗器械有限公司 企业经营范围、经营方式 经营范围: 第三类:6823医用超声仪器及有关设备,6825医用高频仪器设备,6830医用X射线设备,6846植入材料和人工器官。 经营方式: 批发 洛阳远南医疗器械有限公司
2015年11月30日 洛阳远南医疗器械有限公司 企业经营范围、经营方式 经营范围: 第二类:6810矫形外科(骨科)手术器械;6821医用电子仪器设备;6840临床检验分析仪器(不含体外诊断试剂);6854手术室、急救室、诊疗室设备及器具;6864医用卫生材料及敷料;6866医用高分子材料及制品。 经营方式: 批发 洛阳远南医疗器械有限公司
2015年11月30日
洛阳远南医疗器械有限公司 经营质量管理制度、工作程序 目录 管理制度: 一、质量管理机构或者质量管理人员的职责; 二、质量管理的规定 三、采购、收货、验收的规定(包括采购记录、验收记录、随货单等)同行; 四、供货者资格审核的规定(包括供货者及产品合法性审核的相关证明文件等); 五、库房贮存、出入库管理的规定(包括温度记录、入库记录、定期检查记录、出库记录等); 六、销售和售后服务的规定(包括销售人员的授权书、购货者档案、销售记录等); 七、不合格医疗器械的管理规定(包括销毁记录等); 八、医疗器械退、换货的规定; 九、医疗器械不良事件监测和报告规定(包括停止经营和通知记录等); 十、医疗器械召回规定(包括医疗器械召回记录等); 十一、设施设备维护及验证和校准的规定(包括设施设备相关记录和档案等); 十二、卫生和人员健康的规定(包括员工健康档案等); 十三、质量管理培训及考核的规定(包括考核记录等); 十四、医疗器械质量投诉、事故调查和处理报告的规定(包括质量投诉、事故调查和处理报告相应的记录及档案等);
2013不需要医疗器械经营许可证的器械
一、《医疗器械分类目录》核定的第一类医疗器械产品 6801 基础外科手术器械 编号代 码 名称品名举例 6801- 2 基础外科用刀 手术刀柄和刀片、皮片刀、疣体剥离刀、柳叶刀、铲刀、 剃毛刀、皮屑刮刀、挑刀、锋刀、修脚刀、修甲刀、解 剖刀 6801- 3 基础外科用剪 普通手术剪、组织剪、综合组织剪、拆线剪、石膏剪、 解剖剪、纱布绷带剪、教育用手术剪 6801- 4 基础外科用钳 普通止血钳、小血管止血钳、蚊式止血钳、组织钳、硬 质合金镶片持针钳、普通持针钳、创夹缝拆钳、皮肤轧 钳、子弹钳、纱布剥离钳、海绵钳、帕巾钳、皮管钳、 器械钳 6801- 5 基础外科用镊夹 小血管镊、无损伤镊、组织镊、整形镊、持针镊、保健 镊(简易镊)、拔毛镊、帕巾镊、敷料镊、解剖镊、止血 夹 6801- 6基础外科用针、钩 动脉瘤针、探针、推毛针、植毛针、挑针、教学用直尖 针、静脉拉钩、创口钩、扁平拉钩、双头拉钩、皮肤拉 钩、解剖钩 6801- 7基础外科其它器械 刀片夹持器、麻醉口罩、麻醉开口器、照明吸引器头、 粉刺取出器、黑头粉刺压出器、皮肤刮匙、皮肤套刮器、 皮肤刮划测检器、皮肤检查尺、皮肤组织钻孔器、开口 器、卷棉子 6802 显微外科手术器械 编号代 码 名称品名举例 6802- 1 显微外科用刀、凿显微喉刀 6802- 2 显微外科用剪显微剪、显微枪形手术剪、显微组织剪6802- 3 显微外科用钳显微枪形麦粒钳、显微喉钳、显微持针钳6802- 4 显微外科用镊、夹显微镊、显微持针镊、显微止血夹 6802- 5 显微外科用针、钩显微耳针、显微喉针、显微耳钩、显微喉钩6802- 6 显微外科用其他器械显微合拢器 6803 神经外科手术器械 编号代 码 名称品名举例 6803- 2 神经外科脑内用钳银夹钳、U型夹钳、动脉瘤夹钳
医疗器械临床试验流程
实用标准文案 医疗器械临床试验管理规范*****(局令第根据国家食品药品监督管理局颁布的《医疗器械临床试验规定》号)的要求,为了进一步加强对医疗器械临床试验的管理,强化对临床试验过5特对本院医疗器械临床试验的流程及可靠,程的监督,保证临床试验结果真实、管理作如下操作规范:医疗器械临床研究流程一. 临床药理基地(门1承担临床试验的科室与实施者共111-8778389)收集设计临床试验方案、知情同意料并审 科教科审核并签订初步协审核未通(8778455 审核通财务科交伦理咨询150(门1-8778380 第一类医疗器械、多单位提交伦理委员会讨作研究项目我院为参加单 讨论未通 伦理委员讨论通成员审核 修改 至科教科签订试验合同 精彩文档. 实用标准文案 开始临床试验
二、医疗器械临床研究的管理1. 试验器械的管理必要时需经设备科审核批准方可进入临床临床试验所需器械实行专项管理,)会同87783891科室。医疗器械到达时,应通知临床药理基地办公室(电话-医疗*****试验负责人、厂方负责人一起验证器械型号、拍摄实物照片,填写“,并签字,备查。试验器械应专物专用,不得挪器械临床试验产品型号核对单”作他用。2. 临床试验阶段的管理试验负责人应加强进入实施阶段的临床试验,全面实行项目负责人负责制。试验过程中向患者及家属充分告知相关事宜并填写临床试验知情同意书;管理,应及时、准确地填写观察记录表,如实记录试验结果,在病历上做相关记录。姓名、承担临床试验的科室建立试验器械使用登记本,门诊患者内容应包括住址、单位、联系电话、门诊病历号、诊断、器械名称、规格型号、序列号、使姓名、住院号、联系电话、诊断、器械名称、用日期、时间等;住院患者应包括等,承担临床试验人员应仔细核对并在登记规格型号、序列号、使用日期、时间住院患者进行的本上双签名,登记本应由专人保管备查,试验结束后一同存档。并将登记表),(附件临床试验还需详细填写“*****医疗器械临床试验登记表”4 保存至住院病历最后一页,备查。不良事件的报告3. 医疗器械临床试验不临床试验过程中出现不良事件的,应如实填写“*****,及时按医院规定程序向临床药理基地办公室、药品监5)(附件良反应报告表”督管理部门、医院伦理委员会上报,并积极采取补救措施,分析不良事件原因。发
第二类医疗器械备案申报报告报告
申办《第二类医疗器械经营备案》 申 请 材 料 重庆******医疗科技有限公司 2016年5月24日 联系电话:***********
第二类医疗器械经营备案目录 1.第二类医疗器械经营备案表; 2.企业营业执照复印件; 3.企业法定代表人或者负责人、质量负责人的身份、学历、职称证明复印件; 4.企业组织机构与部门设置说明; 5.企业经营地址、库房地址的地理位置图、平面图、房屋产权证明和租赁协议复印件; 6.企业经营设施和设备目录; 7.企业经营质量管理制度、工作程序等文件目录; 8.经办人授权证明; 9.其他证明材料。 备案材料应完整、清晰,使用A4纸打印装订并附有目录,复印件加盖公章后与电子版一并提交。
第二类医疗器械经营备案表 企业名称重庆****医疗科技有限公司营业执照 注册号 **** 组织机构 代码 **** 成立日期****年**月** 日住所****** 营业期限永久 经营方式批零兼营注册资本伍佰万元 经营场所**** 邮编400060 联系人姓名身份证号联系电话传真电子邮件*** *** *** **** / 库房地址*** 联系电话*** 邮编*** 经营范围 人员情况姓名身份证号职务学历职称法定代表人** / 企业负责人** / 质量负责人** / 企业人员情况人员总数 (人) 质量管理人员(人) 售后服务人 员(人) 专业技术人员(人) 3 1 1 / 经营场所情况建筑面积 (㎡) 经营面积(㎡) 库房面积 (㎡) 冷藏库面积(㎡) 90.81 40 30 / 经营场所及仓储条件经营场所条件(包括面 积、用房性质、设施设备 情况等) 经营面积40㎡,房屋性质为商业用房,场所配备有 办公桌、货柜,电话、传真、电脑等设施设备。 仓储条件(包括面积、环 境控制、设施设备等) 仓库面积30㎡,地面整洁无污染源,有货架,温湿 度计、灭火器等设施设备。 本企业承诺所提交的全部备案材料真实有效,并承担因失实引发的一切法律责任。同时,保证按照法律法规的要求从事医疗器械经营活动。 法定代表人(签字)(企业盖章) 年月日
第三类医疗器械经营许可申办
从事第三类医疗器械经营许可申办 办事机构:济南市食品药品监督管理局审批办 申报范围:从事第三类医疗器械经营的单位 申报条件: 一、经营范围填写: ◆特殊管理品种首先单独填写,如:Ⅲ类:6846植入材料和人工器官、6877介入器材; Ⅲ类:6822-1塑形角膜接触镜及护理用液;Ⅲ类:6840体外诊断试剂;Ⅲ类:6815注射穿刺器械、6866医用高分子材料及制品;Ⅲ类:6822-1角膜接触镜及护理用液(塑形角膜接触镜除外) ◆有除外品种的集中填写.如: Ⅲ类:6815注射穿刺器械(一次性使用无菌医疗器械除外)、6866医用高分子材料及制品(一次性使用无菌医疗器械除外);6822医用光学器具、仪器及内窥镜设备(6822-1角膜接触镜及护理用液除外)。 二、经营场所、仓库面积要求: 1. 企业应当具有与经营范围和经营规模相适应、独立的经营场所和库房,经营场所和库房的面积应当满足经营要求。经营场所和库房不得设在居民住宅内、军事管理区(不含可租赁区)以及其他不适合经营的场所。 2. 经营隐形眼镜及其护理用液的,可以不设仓库,但应当有专柜存放。 3. 所申报的经营场所和仓库原则上在同一行政区域内就近设置。 有下列经营行为之一的,企业可以不单独设立医疗器械库房: (一)单一门店零售企业的经营场所陈列条件能符合其所经营医疗器械产品性能要求、经营场所能满足其经营规模及品种陈列需要的; (二)连锁零售经营医疗器械的; (三)全部委托为其他医疗器械生产经营企业提供储存、配送服务的医疗器械经营企业进行存储的; (四)专营医疗器械软件或者医用磁共振、医用X射线、医用高能射线、医用核素设备等大型医用设备的; (五)省级食品药品监督管理部门规定的其他可以不单独设立医疗器械库房的情形。 三、企业人员资质的要求: 企业应当具有与经营范围和经营规模相适应的质量管理机构或者质量管理人。 企业质量管理人员应当具有国家认可的相关专业学历或职称。 第三类医疗器械经营企业质量负责人应当具备医疗器械相关专业(相关专业指医疗器械、生物医学工程、机械、电子、医学、生物工程、化学、药学、护理学、康复、检验学、计算机、法律、管理等)大专以上学历或者相关专业中级以上专业技术职称,同时应当具有3年以上医疗器械经营质量管理工作经历。 企业应当设置或配备与经营规模、经营范围相适应的,并符合相关资格要求的质量管理、
第三类医疗器械经营许可与第二类医疗器械备案并联审批申报须知
第三类医疗器械经营许可与第二类医疗器械备案并联审批申报须知(20151222版) 为减少申报材料,方便相对人,中心窗口根据市政府简政放权的相关精神,对第三类医疗器械经营许可与第二类医疗器械备案实行并联审批改革。如果企业自愿,鼓励企业在申报三类许可时同时申报二类备案,二类备案日期以许可日期一致。现将申报要求告知如下: 1、适用范围:苏州市政务服务中心受理姑苏区、高新区和工业园区内的经营企业。 2、申报时,请将本文件夹中的文件(2个文件“并联专用01 经营备案材料01 第二类医疗 器械经营备案表”、“并联专用02 经营备案材料12 医疗器械经营备案电子信息表”)填写后纳入第三类许可的材料中,一并打包。申报事项以第三类许可为准。 3、本文件夹的材料请按照要求进行填写,请参照第二类经营备案申报须知。 4、取得非IVD批发三类许可的,二类经营备案范围为:非IVD批发:6801基础外科手术器 械,6802显微外科手术器械,6803神经外科手术器械,6804眼科手术器械,6805耳鼻喉科手术器械,6806口腔科手术器械,6807胸腔心血管外科手术器械,6808腹部外科手术器械,6809泌尿肛肠外科手术器械,6810矫形外科(骨科)手术器械,6812妇产科用手术器械,6813计划生育手术器械,6815注射穿刺器械,6816烧伤(整形)科手术器械,6820普通诊察器械,6821医用电子仪器设备,6822医用光学器具,仪器及内窥镜设备,6823医用超声仪器及有关设备,6824医用激光仪器设备,6825医用高频仪器设备,6826物理治疗设备,6827中医器械,6828医用磁共振设备,6830医用X射线设备,6831医用X射线附属设备及部件,6832医用高能射线设备,6833医用核素设备,6834医用射线防护用品、装置,6840临床检验分析仪器,6841医用化验和基础设备器具,6845体外循环及血液处理设备,6854手术室、急救室、诊疗室设备及器具,6855口腔科设备及器具,6856病房护理设备及器具,6857消毒和灭菌设备及器具,6858医用冷疗、低温、冷藏设备及器具,6863口腔科材料,6864医用卫生材料及敷料,6865医用缝合材料及粘合剂,6866医用高分子材料及制品,6870软件。 5、取得IVD批发三类许可的,二类经营备案范围为:IVD批发:6840体外诊断试剂。 6、取得零售三类许可的,二类经营备案范围为:零售(零售连锁):6820家用普通诊察器 械、6821家用医用电子仪器设备、6823家用超声仪器及有关设备、6824家用激光仪器设备、6826家用物理治疗及康复设备、6827家用中医器械、6840家用体外诊断试剂和检验分析仪器、6841家用化验和基础设备器具、6854家用输液制气等设备、6856家用病房护理设备及器具、6858家用冷疗冷敷设备和器具、6863个人用口腔科材料、6864家用医用卫生材料及敷料、6866家用高分子材料与制品、6870家用软件。 7、取得零售三类许可的,如申请助听器经营备案的,请特别说明。并在经营范围中增加: 6846个人用非植入助听器。 8、上述经营范围的描述,请不要随意改变。
办理医疗器械经营许可证需要的条件
办理医疗器械经营许可证需要的条件 申请人提交材料目录 1、《医疗器械经营企业许可证申请表》,《医疗器械经营企业许可证》。 2、工商行政管理部门出具的《企业名称预先核准通知书》或《工商营业执照》。 3、申请报告。 4、经营场地、仓库场所的证明文件,包括房产证明或租赁协议和出租方的房产证明的复印件。 5、经营场所、仓库布局平面图。 6、拟办法定负责人、企业负责人、质量管理人的身份证、学历证明或职称证明的复印件及个人简历。 7、技术人员一览表及学历、职称证书复印件。 8、经营质量管理规范文件目录。 9、企业已安装的产品购、销、存的信息管理系统,打印信息管理系统首页。 10、仓储设施设备目录。 11、质量管理人员在岗自我保证声明和申请材料真实性的自我保证声明,包括申请材料目录和企业对材料作出如有虚假承担法律责任的承诺; 12、凡申请企业申报材料时,办理人员不是法定代表人或负责人本人,企业应当提交《授权委托书》。 13、申请《医疗器械经营企业许可证》确认书 对申请医疗器械经营企业许可证材料的要求: 1、经营企业提交的《医疗器械经营企业许可证申请表》应有法定代表人签字或加盖企业公章;
2、《医疗器械经营企业许可证申请表》所填写项目应填写齐全、准确,填写内容应符合以下要求。 A、“企业名称”、“注册地址”与《工商营业执照》或《企业名称预先核准通知书》相同。 B、拟申请的经营范围按2002年国家药品监督管理局印发的《医疗器械分类目录》一级目录填写。 C、“注册地址”、“仓库地址”的填写应明确具体的门牌、楼层和房号。 3、法定代表人的身份证明、学历职称证明、任命文件应有效; 4、工商行政管理部门出具的《企业名称预先核准通知书》或《工商营业执照》的复印件应与原件相同,复印件确认留存,原件退回; 5、房产证明、房屋租赁证明(出租方要提供产权证明)应有效; 6、企业负责人、质量管理人的简历、学历证明或职称证明应有效; 7、企业应根据自身实际建立医疗器械质量管理档案或表格。 8、申请材料真实性的自我保证声明应由法定代表人签字并加盖企业公章,如无公章,则须有法定代表人本人签字或签章。 9、凡申请材料需提交复印件的,申请人(单位)须在复印件上注明“此复印件与原件相符”字样或者文字说明,注明日期,加盖单位公章;个人申请的须签字或签章。 10、申请材料应完整、清晰、签字,并逐份加盖公章,所有申请表格电脑打字填写,使用A4纸打印,复印使用A4纸,按照申请材料目录顺序装订成册。 11、
