高中化学必修一第四章知识点总结
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
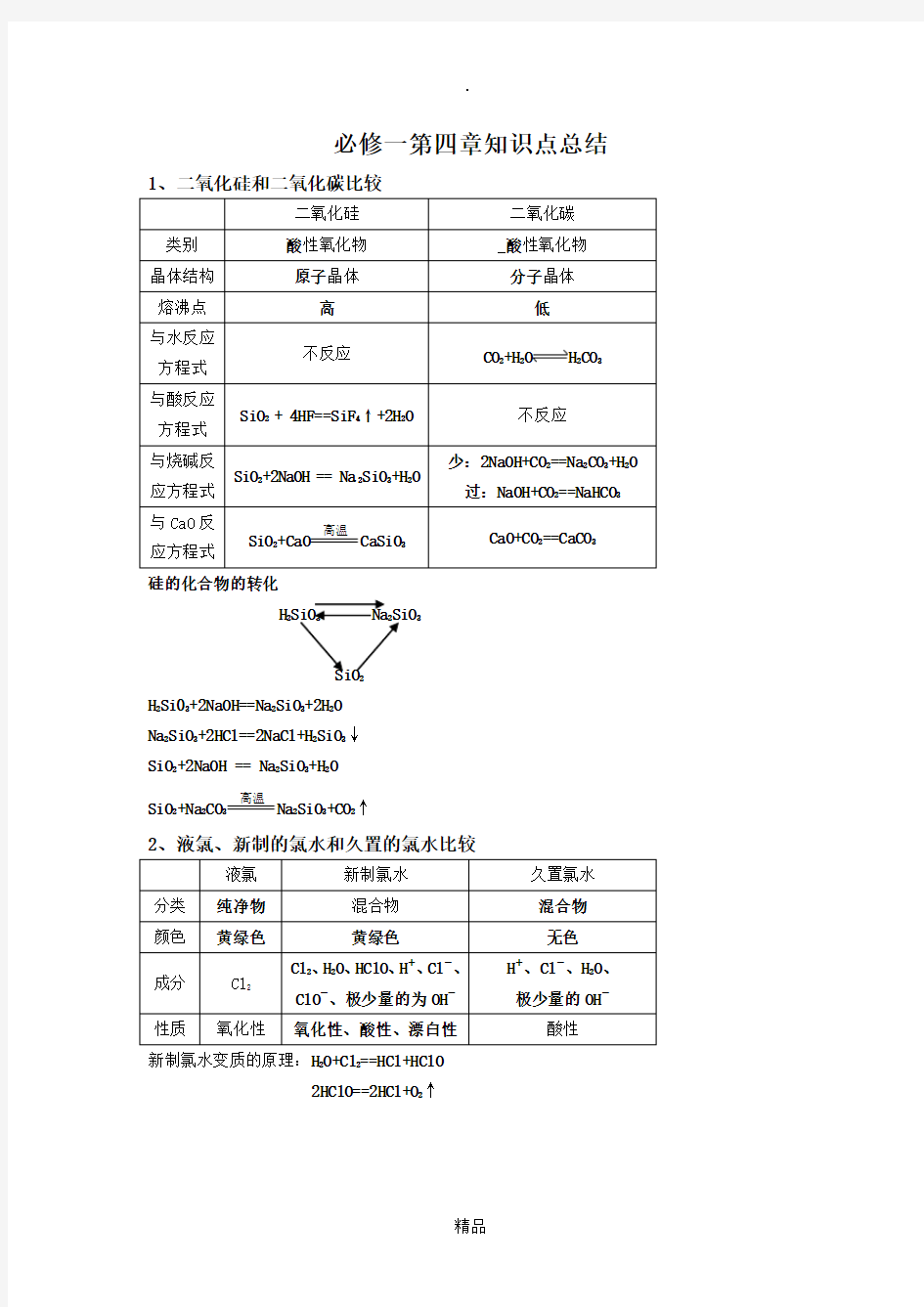
必修一第四章知识点总结1、二氧化硅和二氧化碳比较
硅的化合物的转化
H2SiO3 Na2SiO3
SiO2
H2Si03+2NaOH==Na2SiO3+2H2O
Na2SiO3+2HCl==2NaCl+H2SiO3↓
SiO2+2NaOH == Na2SiO3+H2O
SiO2+Na2CO3高温
Na2SiO3+CO2↑
2、液氯、新制的氯水和久置的氯水比较
新制氯水变质的原理:H2O+Cl2==HCl+HClO
2HClO==2HCl+O2↑
3、氯气的性质
与金属钠反应方程式2Na+Cl
2点燃
2NaCl
与金属铁反应方程式2Fe+3Cl2
点燃
2FeCl3(常温下,干燥的
铁和Cl2不反应)
与金属铜反应方程式Cu+Cl
2点燃
CuCl2
与氢气反应方程式
H2+Cl22HCl;H2+Cl22HCl
与水反应方程式H2O+Cl2 ==HCl+HClO
制漂白液反应方程式Cl2+2NaOH==NaCl+NaClO+H2O
制漂白粉反应方程式2Cl2 +2C a(O H)2==CaCl2+C a(C l O)2+2H2O
实验室制法MnO
2+4HCl(浓)△
MnCl2 +Cl2↑+2H2O
氯离子的检验试剂以及反应方程式
AgNO3溶液
Ag++Cl―==AgCl↓
Cl2的检验使湿润的KI-淀粉试纸变蓝Cl2+2KI==2KCl+I2
4、二氧化硫的性质
化学性质酸
性
与水反应方程式SO
2+H2O H2SO3与烧碱反应方程式
SO2+2NaOH==Na2SO3+H2O
Na2SO3+SO2+H2O==2NaHSO3
SO2+NaOH==NaHSO3
漂
白
性
漂白原理:由于它能跟某些有色物质生成:无色物质曾学过的具有漂白
性的物质
吸附漂白:活性炭
氧化漂白:HClO、O3、Na2O2
还
原
性
与氧气反应方程式2SO
2 + O2 2SO3
与卤素反应方程式
SO2 + Cl2 +2H2O == H2SO4+2HCl
SO2 + Br2 +2H2O == H2SO4+2HBr
SO2 + I2 +2H2O == H2SO4+2HI 氧
化
性
与硫化氢反应方程
式
SO2+2H2S == 3S↓+2H2O
5、浓硫酸和浓硝酸的性质
6强酸制弱酸
强酸+弱酸盐===弱酸+强酸盐
CaCO3+2HCl==CaCl2+H2O+CO2↑CaCO3+2H+==Ca2+++H2O+CO2↑
Na2SiO3+2HCl==2NaCl+H2SiO3↓SiO32-+2H+==H2SiO3↓
C a(C l O)2+2HCl== CaCl2+2HClO 2C l O-+2H+==2HClO
应用
(1) Na2SiO3溶液敞口放置在空气中变质
Na2SiO3+H2O+CO2==Na2CO3+H2SiO3↓SiO32-+H2O+CO2==CO32-+H2SiO3↓
Na2SiO3+2H2O+2CO2==2NaHCO3+H2SiO3↓SiO32-+2H2O+2CO2==HCO3-+H2SiO3↓
(2) 漂白粉在空气中变质
C a(C l O)2+H2O+CO2== CaCO3↓+2HClO C a2++2C l O-+H2O+CO2== CaCO3↓+2HClO
(3) 实验室制SO2
Na2SO3+2H2SO4==Na2SO4+H2O+SO2↑ SO32-+2H+==H2O+SO2↑
(3) 实验室制H2S
FeS+H2SO4==FeSO4+H2S↑ FeS+2H+==Fe2++H2S↑
(4)除杂质
CO2中混有SO2
SO2+2NaHCO3=Na2SO3+H2O+2CO2↑
CO2中混有HCl
HCl+NaHCO3=NaCl+H2O+CO2↑
SO2中混有HCl
HCl+NaHSO3= NaCl+H2O+SO2↑
7 、氨气、氨水与铵盐的性质
NH4+的检验
药品中加NaOH溶液然后加热,产生的气体使红色石蕊试纸变蓝,说明产生了NH3进而说明样品中有NH4+
如有侵权请联系告知删除,感谢你们的配合!
