标准氢电极和标准电极电势

11.10.2 标准氢电极和标准电极电势
二、标准氢电极和标准电极电势
(1)标准氢电极
为确定各不同电极的相对电极电势,目前国际上采
用标准氢电极作为标准电极,并令其电极电势为
零。
氢电极电极电势的温度系数很小。若条件控制得
当,电极电势稳定,重现性好。其构造如图11-21所示。它是由镀有铂黑﹡的铂片浸入a H+=1 的溶液中,并以P H2=100kPa 的纯净干燥氢气不断冲击到铂电极上而构成的。
氢气为一还原剂,氧气或其他氧化剂的存在会影响实验测定,而含砷、硫化物的气体易被铂黑吸附而使它失去吸附氢气的能力(即"中毒"现象),故氮气通入之前应预先流经碱性没食子酸溶液和碱性高锰酸钾溶液以净化之。
*铂黑是由许多微小铂晶体组成的,表面积很大,当光线射入经过不断反射均被吸收,因而呈现黑色。
镀铂黑的工艺为:
① 1~1.5 克铂用热硝酸洗过后用 HCl:HNO3:H2O=3:1:4 的王水溶解加入 2ml HCl得红棕色H2PtCl6(无水氯铂酸)即成镀液。
②在 100~200 mA/cm2的电流密度下,电镀 1~3 分钟,得到均匀一致的铂黑镀层。
(2)标准电极电势
将任意一待测电极(指定为阴极)与标准氢电极(阳极)组成电池,在消除液接电势后用对消法测其电动势,则此电动势的数值和符号就是待测电极电势的数值和符号。
例如,298K 时以标准氯化银电极与标准氢电极构成一电池:
测得电池电动势为 0.2224V 。则此值即为氯化银电极的标准电极电势。
又例如,298K 时,以标准锌电极与标准氢电极构成一电池,测得电池电动势为 0.763V 。但由于电池自发放电时,锌电极上实际进行的是氧化反应,锌电极应为负极。故锌电极的标准电极电势为 -0.763V 。
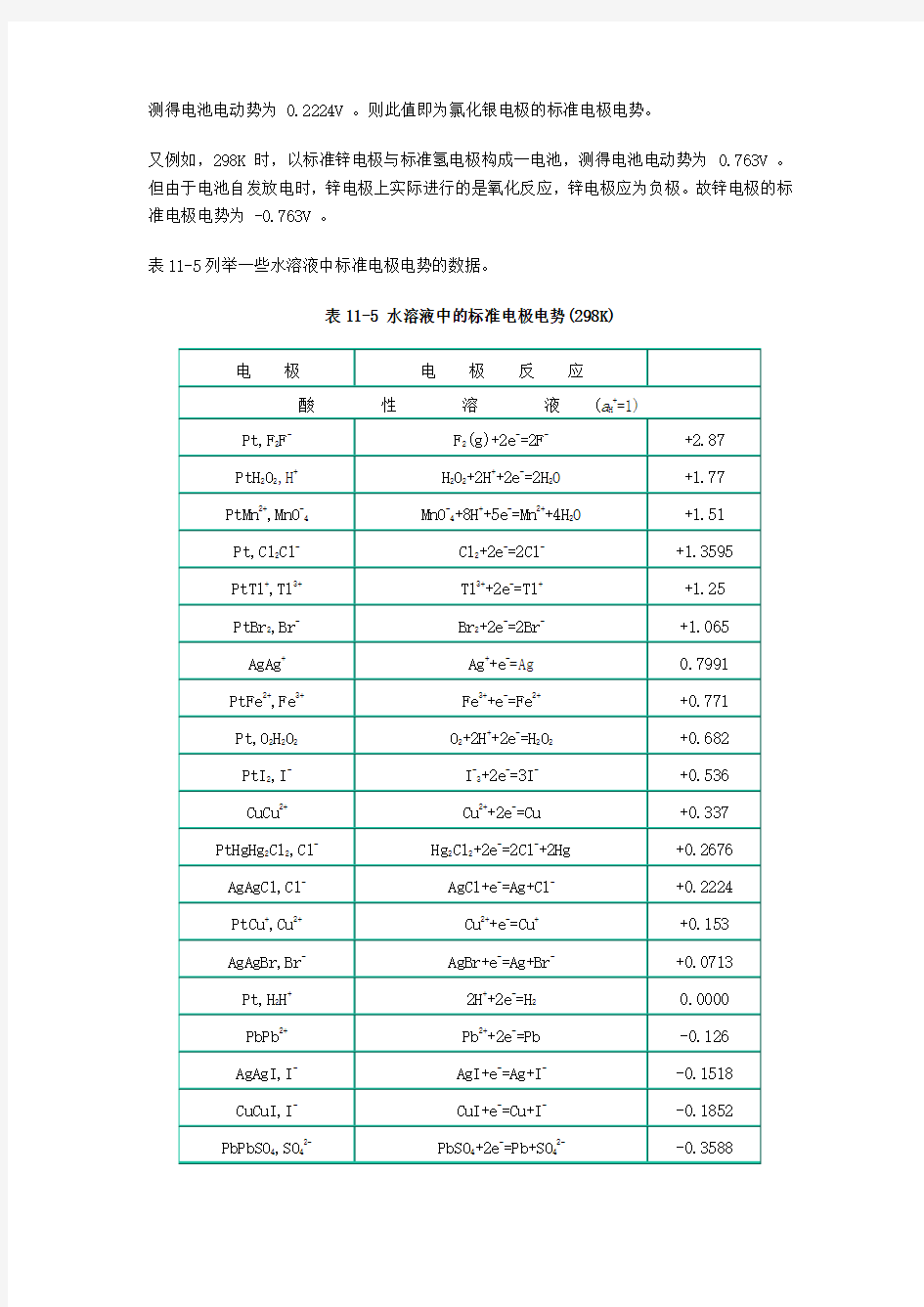
表11-5列举一些水溶液中标准电极电势的数据。
表11-5 水溶液中的标准电极电势(298K)
PtTi2+,Ti3+Ti3++e-=Ti2+-0.369 CdCd2+Cd2++2e-=Cd -0.403 FeFe2+Fe2++2e-=Fe -0.4402 CrCr3+Cr3++3e-=Cr -0.744 ZnZn2+Zn2++2e-=Zn -0.7628 MnMn2+Mn2++2e-=Mn -1.180 AlAl3+Al3++3e-=Al -1.662 MgMg2+Mg2++2e-=Mg -2.363 NaNa+Na++e-=Na -2.7142 CaCa2+Ca2++2e-=Ca -2.866 BaBa2+Ba2++2e-=Ba -2.906 KK+K++e-=K -2.925 LiLi+Li2++e-=Li -3.045 碱性溶液(a OH-=1)
PtMnO2,MnO-4MnO-4+2H2O+3e-=MnO2+4OH-+0.588 Pt,O2OH-O2+2H2O+4e-=4OH-+0.401 PtS,S2-S+2e-=S2--0.447 Pt,H2OH-2H2O+2e-=H2+2OH--0.82806 PtSO32-,SO42-SO42-+H2O+2e-=SO32-+2OH--0.93
氢电极装置和实验手续均较麻烦,一般只用作一级基准,实际使用中常用一类微溶盐电极如甘汞电极、氯化银电极和硫酸亚汞电极作为二级基准,这类电极常称为"参比电极"。
(3)参比电极
a.甘汞电极
甘汞电极是由汞、甘汞(Hg2Cl2)和一定浓度的氯化钾溶液所构成的微溶盐电极。其构造如图11-22(1)所示。此半电池可标记为:
甘汞电极制备容易,只需在纯汞表面上加一层氯化亚汞和汞的糊体,充入一定浓度的氯化钾溶液即可制成,放置数日后,电势趋于稳定,故使用极为方便。现在,常作为外参比电极使用。甘汞电极根据所用 KCl 浓度不同分为三种,数据见表11-6 。
表11-6 常用甘汞电极数据(298.15K)
由表中数据可以看出:饱和甘汞电极配制最为方便,但其温度系数较大。而0.1mol·dm-3KCl 溶液的甘汞电极温度系数最小,适用于精密测量。商品电极使用比较方便,可直接插入待测溶液中,然而其内阻较大。
b.氯化银电极
氯化银电极如图11-22所示。将银丝作为阳极在含 Cl-溶液中电解沉积上一层氯化银,插入一定浓度的氯化钾溶液中即可构成。
氯化银电极因其构成简便,故其应用日益广泛,常用作为内参比电极。
微溶盐电极相当于为溶度积制约着的金属电极,以氯化银为例,其电极反应包括以下两个步骤:
工作时,由于溶度积制约,Ag+浓度很小,故可逆性较好。
标准电极电势表
标准电极电势表 标准电极电势可以用来计算化学电池或原电池的电化学势或电极电势。本表中所给出的电极电势以标准氢电极为参比电极,溶液中离子有效浓度为1mol/L ,气体分压为100kPa ,温度为298K ,所有离子的数据都在水溶液中测得。[1][2][3][4][5][6][7][8][9]单击每栏上方的符号可将数据按元素符号或标准电极电势值排序。 注:(s ) – 固体;(l ) – 液体;(g ) – 气体;(aq ) – 水溶液;(Hg ) – 汞齐。 半反应 E° (V)[注 1] 来源 Ba + + e ? Ba(s ) ?4.38 [10][1][3] Sr + + e ? Sr(s ) ?4.10 [11][1][3] Ca + + e ? Ca(s ) ?3.8 [11][1][3] Pr 3+ + e ? Pr 2+ ?3.1 [11] ?N 2(g ) + H + + e ? HN 3(aq ) ?3.09 [6] Li + + e ? Li(s ) ?3.0401 [5] N 2(g ) + 4?H 2O + 2?e ? 2?NH 2OH (aq ) + 2?OH ? ?3.04 [6] Cs + + e ? Cs(s ) ?3.026 [5] Ca(OH) 2(s ) + 2?e ? Ca(s ) + 2 OH ? ?3.02 [11] Rb + + e ? Rb(s ) ?2.98 [4] K + + e ? K(s ) ?2.931 [5]
半反应E° (V)[注 1]来源Mg+ + e? Mg(s) ?2.93 [10] Ba2+ + 2?e? Ba(s) ?2.912 [5] ? La(s) + 3OH??2.90 [5] La(OH) Fr+ + e? Fr(s) ?2.9 [11] Sr2+ + 2?e? Sr(s) ?2.899 [5] ? Sr(s) + 2?OH??2.88 [11] Sr(OH) Ca2+ + 2?e? Ca(s) ?2.868 [5] Eu2+ + 2?e? Eu(s) ?2.812 [5] Ra2+ + 2?e? Ra(s) ?2.8 [5] Yb2+ + 2?e? Yb(s) ?2.76 [11][1] Na+ + e? Na(s) ?2.71 [5][9] Sm2+ + 2?e? Sm(s) ?2.68 [11][1] No2+ + 2?e? No(s) ?2.50 [11] ?Hf(s) + 4?OH??2.50 [11] HfO(OH)
参比电极
Ag/Ag2SO4用于铅酸蓄电池 Cd电极常用于电池制造中以控制正负极板质量,Hg/Hg2SO4常用于实验室的准确测量中[1]。它的缺点是价高、易碎和易造成环境污染。 Ag2SO4电极在文献中报道极少,几乎没有关于Ag2SO4参比电极的介绍。至今此电极尚未有作为铅酸电池中参比电极应用的报道。其主要原因可能是Ag2SO4的溶解度太高所致,Ag+离子可能会污染铅酸电池的电解质溶液。Ag2SO4在硫酸溶液中的溶解度为0.03mol/1000gH2O[2]。但是现在已经有合适的隔膜材料,可阻挡扩散污染。 Pb/PbSO4电极对Ag/Ag2SO4参比电极的电极电位: 此反应 在标准情况下(25℃、1bar)Pb/PbSO4与Ag/Ag2SO4参比电极之间的电位差为 ,E0与硫酸浓度无关。 已知Ag/Ag2SO4参比电极比Hg/Hg2SO4参比电极(同溶液)要正0.0384V,此值也与硫酸浓度无关。 PbO2/PbSO4电极对Ag/Ag2SO4参比电极的电极电位: △G0=-199.42kJ E0=1.0334V 式中a s为硫酸活度,a w为水的活度。 例如,在5mol硫酸中,PbO2/PbSO4对于同液Ag/Ag2SO4的电极电位,计算为1.0881V,如酸浓度为1mol,计算为0.9173V(硫酸平均活度系数用)
内径为3mm的薄壁尼龙管,(可用聚丙烯管代替),低部紧塞AGM,此要AGM塞长15mm,其上放上Ag、Ag2SO4、少量SiO2成胶剂和少量AR级的硫酸溶液。加入的酸量刚好把Ag2O全部转化为Ag2SO4。 此活性混合物在尼龙管中干燥(中间插银丝),将银丝与上部接头焊好,用环氧树脂封固。使用前,AGM塞和活性混合物用含合适浓度的硫酸浸泡100h以上(15mm长的AGM 需要100h来平衡酸浓度),也可将需要的酸量加入活性物上部(用针管注入),参比电极中吸收的硫酸约200mg(35%的硫酸)。 用此电极在铅酸电池中Ag2SO4会少量扩散进入电池,按fick定律估算,总量小于1mg/年。 此电极牢固,防撞击,电位重现性在1~2mV内。 用法:可在电池盖上钻一小孔放入酸中,或VRLA电池的AGM上,参比电极尖端位置对电位稍有影响。 硫酸银电极 Ag2SO4+2e=2Ag+ SO42- E Ag2SO4= E Ag2SO40-0.0591/2loga SO42- =0.653 有严格定义的电极电位,易于制备做成各种式样的电极,电位的可重现性达±1mV,电极的结构牢固,可以防震,且无毒性物质,在高温时稳定。 对于同样的硫酸溶液中的铅蓄电池负极(Pb/PbSO4电极)对Ag/Ag2SO4参比电极的电极电位为-1.009V(25℃),它与硫酸的浓度无关,已由实验证实。PbO2/PbSO4正极对Ag/Ag2SO4参比电极的电位,符合下列的关系式((25℃)。 式中a s为硫酸活度,a w为水的活度。此式也可由实验
标准氢电极
标准氢电极 品名:氢标准电极 拼音:qingbiaozhundianji 英文名称:standard hydrogen electrode 说明:由于单个电极的电势无法确定,故规定任何温度下标准状态的氢电极的电势为零,任何电极的电势就是该电极与标准氢电极所组成的电池的电势,这样就得到了“氢标”的电极势。标准状态是指氢电极的电解液中的氢离子活度为1,氢气的压强为0.1兆帕(约1大气压)的状态,温度为298.15K。 这只是一种假定的理想状态,通常是将镀有一层海绵状铂黑的铂片,浸入到H+浓度为1.0mol/L的酸溶液中,在298.15K时不断通入压力为100kPa的纯氢气,使铂黑吸附H2气至饱和,这是铂片就好像是用氢制成的电极一样。 实际测量时需用电势已知的参比电极替代标准氢电极,如甘汞电极、氯化银电极等。它们的电极势是通过与氢电极组成无液体接界的电池,通过精确测量用外推去求得的。 电极电势 一,电极电势的产生—双电层理论 德国化学家能斯特(H.W.Nernst)提出了双电层理论(electron double l ayer theory)解释电极电势的产生的原因。当金属放入溶液中时,一方面金属晶体中处于热运动的金属离子在极性水分子的作用下,离开金属表面进入溶液。金属性质愈活泼,这种趋势就愈大;另一方面溶液中的金属离子,由于受到金属表面电子的吸引,而在金属表面沉积,溶液中金属离子的浓度愈大,这种趋势也愈大。在一定浓度的溶液中达到平衡后,在金属和溶液两相界面上形成了一个带相反电荷的双电层(electron double layer),双电层的厚度虽然很小(约为10-8厘米数量级), 但却在金属和溶液之间产生了电势差。通常人们就把产生在金属和盐溶液之间的双电层间的电势差称为金属的电极电势(electrode potential),并以此描述电极得失电子能力的相对强弱。电极电势以符号E Mn+/ M表示, 单位为V(伏)。如锌的电极电势以EZn2+/ Zn 表示, 铜的电极电势以ECu2+/Cu 表示。 电极电势的大小主要取决于电极的本性,并受温度、介质和离子浓度等因素的影响。 2.标准电极电势 为了获得各种电极的电极电势数值,通常以某种电极的电极电势作标准与其它各待测电极组成电池,通过测定电池的电动势, 而确定各种不同电极的相对电极电 势E值。1953年国际纯粹化学与应用化学联合会(IUPAC)的建议,采用标准氢电极作为标准电极,并人为地规定标准氢电极的电极电势为零。 (1)标准氢电极电极符号: Pt|H2(101.3kPa)|H+(1mol.L-1) 电极反应: 2H+ + 2e = H2(g)
参比电极
参比电极 PH复合电极到底是什么意思? 复合电极是什么啊,什么意思,PH电极又是怎么回事?经常客户会问到我们这个问题,就在我们帮他们选型的时候,加了一些术语就不好理解了,所以搞电极这一块的朋友,还得把这些问题弄清楚才行啊。 我们把pH玻璃电极和参比电极组合在一起的电极就称为pH复合电极, 即pH计的复合电极。外壳为塑料的就称为塑壳pH复合电极。外壳为玻璃的就称为玻璃pH复合电极。复合电极的最大优点是合二为一,使用方便。pH复合 电极的结构主要由电极球泡、玻璃支持杆、内参比电极、内参比溶液、外壳、外参比电极、外参比溶液、液接界、电极帽、电极导线、插口等组成。 1)电极球泡:它是由具有氢功能的锂玻璃熔融吹制而成,呈球形,膜厚在0.1~0.2mm左右,电阻值250兆欧(25℃)。 2)玻璃支持管:是支持电极球泡的玻璃管体,由电绝缘性优良的铅玻璃制成,其膨胀系数应与电极球泡玻璃一致。 3)内参比电极:为银/氯化银电极,主要作用是引出电极电位,要求其电 位稳定,温度系数小。 4)内参比溶液:零电位为7pH的内参比溶液,是中性磷酸盐和氯化钾的混 合溶液,玻璃电极与参比电极构成电池建立零电位的pH值,主要取决于内参 比溶液的pH值及氯离子浓度。 5)电极塑壳:电极塑壳是支持玻璃电极和液接界,盛放外参比溶液的壳体,由聚碳酸酯塑压成型。 6)外参比电极:为银/氯化银电极,作用是提供与保持一个固定的参比电势,要求电位稳定,重现性好,温度系数小。 7)外参比溶液:为 3.3mol/L的氯化钾凝胶电解质,不易流失,无需添加。 8)砂芯液接界:液接界是构通外参比溶液和被测溶液的连接部件,要求渗 透量稳定。 9)电极导线:为低噪音金属屏蔽线,内芯与内参比电极连接,屏蔽层与外 参比电极连接。 总结这九点,是对电极的构造进行了系统的描述。从里到外,了解这些,电极的原理就好容易理解一些了。
参比电极
1.三电极体系,做电沉积,参比电极是饱和的SCE,对电极Pt电极,工作电极上的电压相对于SCE为-1V,如果参比换成Ag-AgCl电极,工作电极上的电压又是多少呢?该怎样计算呢? 在三电极体系中,简单来说参比电极的作用是用来确定工作电极电位。你可以先将其换算成相对于氢标准电极的电位,然后再换算成相对于Ag-AgCl电极的电位,这是最笨的方法。(SCE的电位相对于氢标准电极是0.2415 V,所以相对氢标准电极的电位是-1V+0.2415V=-0.7585V;Ag-AgCl电极的电位相对于氢标准电极是0.2355 V,所以相对于Ag-AgCl电极的电位应该是-0.7585V-0.2355 V=-0.994V。 2.参比电极的区别 Ag/AgCl与SCE相比,参考电位不同。但是有的资料说Ag/AgCl具有较小的温度系数。试验中要根据自己的实验体系来选择参比电极。 甘汞电极的使用和保养 使用甘汞电极时须注意: ①因甘汞电极在高温时不稳定,故它一般适用于70℃以下的测量; ②甘汞电极不宜用在强酸或强碱性介质中,因此时的液体接界电位较大,且甘汞电极可能被氧化; ③若被测溶液中不允许含有氯离子,则应避免直接插入甘汞电极,这时应使用双液接甘汞电极; ④保持甘汞电极的清洁,不得使灰尘或局外离子进入该电极内部; ⑤当电极内部溶液太少时应及时补充。 饱和甘汞电极在实验中的制备方法:取玻璃电极管,在其底部焊接一铂丝。取化学纯汞约1 mL,加入洗净并干燥的电极管中,铂丝应全部浸没。在一个干净的研钵中放一定量的甘汞(Hg2Cl2)、数滴纯净汞与少量饱和KCl溶液,仔细研磨后得到白色的糊状物(在研磨过程中,如果发现汞粒消失,应再加一点汞;如果汞粒不消失,则再加一些甘汞……以保证汞与甘汞相互饱和)。随后,在此糊状物中加入饱和KCl溶液,搅
标准氢电极和标准电极电势
11.10.2 标准氢电极和标准电极电势 二、标准氢电极和标准电极电势 (1)标准氢电极 为确定各不同电极的相对电极电势,目前国际上采 用标准氢电极作为标准电极,并令其电极电势为 零。 氢电极电极电势的温度系数很小。若条件控制得 当,电极电势稳定,重现性好。其构造如图11-21所示。它是由镀有铂黑﹡的铂片浸入a H+=1 的溶液中,并以P H2=100kPa 的纯净干燥氢气不断冲击到铂电极上而构成的。 氢气为一还原剂,氧气或其他氧化剂的存在会影响实验测定,而含砷、硫化物的气体易被铂黑吸附而使它失去吸附氢气的能力(即"中毒"现象),故氮气通入之前应预先流经碱性没食子酸溶液和碱性高锰酸钾溶液以净化之。 *铂黑是由许多微小铂晶体组成的,表面积很大,当光线射入经过不断反射均被吸收,因而呈现黑色。 镀铂黑的工艺为: ① 1~1.5 克铂用热硝酸洗过后用 HCl:HNO3:H2O=3:1:4 的王水溶解加入 2ml HCl得红棕色H2PtCl6(无水氯铂酸)即成镀液。 ②在 100~200 mA/cm2的电流密度下,电镀 1~3 分钟,得到均匀一致的铂黑镀层。 (2)标准电极电势 将任意一待测电极(指定为阴极)与标准氢电极(阳极)组成电池,在消除液接电势后用对消法测其电动势,则此电动势的数值和符号就是待测电极电势的数值和符号。 例如,298K 时以标准氯化银电极与标准氢电极构成一电池:
测得电池电动势为 0.2224V 。则此值即为氯化银电极的标准电极电势。 又例如,298K 时,以标准锌电极与标准氢电极构成一电池,测得电池电动势为 0.763V 。但由于电池自发放电时,锌电极上实际进行的是氧化反应,锌电极应为负极。故锌电极的标准电极电势为 -0.763V 。 表11-5列举一些水溶液中标准电极电势的数据。 表11-5 水溶液中的标准电极电势(298K)
参比电极的作用和安装要求
参比电极的作用和安装要求 参比电极或者半电池都是测量电解质中金属点位的一种重要装置。在整个阴极保护系统中测量各个部位的电位电流量都是非常重要的。结构-土壤之间电位是相对于一个电极进行测量。经常提到的结构对电解质的电位实际上是结构和参比电极测得的电位。电解质本身是没有电位的,结构对电解质的电位可以测量,与所用的参比电极无关。因此,在研究如何测量沿结构的电位时,必须考虑参比电极。 在阴极保护施工中进行电位测量的大部分环境中,使用标准氢电极半电池是不方便的。作为替代,使用其他的特定离子浓度溶液中的金属电极。参比电极必须是稳定的,而且所采用的参比电极对已经采集的数据要有重现性。 硫酸铜参比电极是测量埋地结构以及淡水环境中结构电位最常使用的参比电极。这种硫酸铜参比电极的组织结构是将铜棒浸泡在饱和的硫酸铜溶液中,溶液放在整个参比电极底部的带有多孔塞的不导电圆筒中。饱和溶液中的铜离子防止铜棒的腐蚀并稳定参比电极,这种构造和原理的参比电极因为其架构简单,构造小,便于在工程地上携带被称为便携式参比电极。 参比电极的产生主要是为了检测各种不同材质金属的电极电位,起一个基础参照的作用。在阴极保护工程中普遍使用的是饱和硫酸铜参比电极,因为它的电极电位有非常好的重复性可以多次使用,它的稳定性又可以保证参量的,而且构造简单,经济实惠。 参比电极是阴极保护系统不可缺少的一个非常重要的部分。参比
电极的质量直接影响到整个阴极保护系统的整个施工和检测的数据 是否准确。因此在阴极保护施工前一定要选择质量要求比较好的参比电极:首先是参比电极应该具有重复性可以作为多次使用,自身极化小,稳定性强,使用寿命长。参比电极对环境也有一定的要求,应尽量做好不容易被周围环境污染损坏,也不能污染周围被测量环境。参比电极的电位波动应该小于10mV。在实验室中,采用氢电极电位作为零电位,应为它制作起来比较麻烦,维护比较困难,因此现在工程上很少使用这种,大多数都会选择硫酸铜参比电极。 电极有很多种,在实验室中以氢电极的电位作为基础,其他电极的电位与之相比较都有不同的电位值:铜/硫酸铜参比电极(CSE)0.300V;饱和甘汞电极(SCE)0.241V;饱和氯化银电极(KCI)0.250V;锌电极(Zn)-0.80V。
参比电极技术规格书
输油(气)管道工程参比电极技术规格书
目录 第一部分工程概况和要求 (3) 1 工程概况 (3) 2 定义 (3) 3 项目总体要求 (3) 4 参考文件 (3) 第二部分现场条件 (4) 1 安装场所 (4) 2 环境条件 (4) 第三部分主要技术要求 (4) 1 硫酸铜参比电极 (4) 2 锌参比电极 (5) 3 极化探头检验和测试 (6) 4 检验和测试 (6) 5 投标书中所应包括的技术资料 (6) 6 订货后供货商应提供的技术资料 (7) 7 供货要求 (7) 第四部分数据单 (7) 附图—长效铜/硫酸铜参比电极结构示意图 —锌参比电极结构示意图 —极化电池结构示意图
第一部分工程概况和要求 1工程概况 XX工程起点是XX,终点是XX,设计输量XX,共设站场XX座,设计压力XXMPa ,管径为φXXmm,采用XX钢级的管道输送用管。 本技术规格书对长效铜/硫酸铜参比电极、锌参比电极和极化探头提出了技术、检测、供货、投标等技术要求。 2定义 本技术规格书中所涉及的名称定义如下: 项目: 业主: 设计单位: 供货商(制造商):按照本技术规格书的要求为本项目提供或生产设备/材料的公司或厂家。 3项目总体要求 3.1本技术规格书适用于XX工程,它包括对此工程中所用的参比电极的设计、制造、材料、安装、工厂测试以及运输和交货等的最低要求。 3.2本技术规格书意在指明采购参比电极的基本原则和最低要求,并不减轻供货商为其所提供的参比电极的设计、制造、装配、检测、试验、性能和安全所负的全部责任。 3.3供货商应在投标技术文件中对本技术规格书条款按顺序逐条响应,并做出必要的解释。 3.4所有单位全部采用国际单位制SI。 3.5供货商应提供业绩表。业绩表中所列出的阀门应与本工程情况类似,例如:国内或国外业主名称、联系电话、供货年份及业主使用的反馈情况。 4参考文件 4.1本技术规格书与下列图纸一起使用: 附图—长效铜/硫酸铜参比电极结构示意图 —锌参比电极结构示意图
参比电极
②,盐桥内溶液必须与两端溶液不发生反应。 例如, 3AgNO 溶液体系,就不能采用含 1Cl -离子的盐桥溶液,此时可改用43 NH NO 溶液作为盐桥溶液。因为 4NH +离子的摩尔电导率为 2173.7()S cm mol C -??,3NO -离子的摩尔电导率为 2171.42()S cm mol C -??,两者比较接近。可有效地减小液接界电势 。 ③,取措施避免盐桥溶液中的离子扩散到被测系统会对测量结果有影响。 例如,某体系采用离子选择电极测定 1Cl -离子浓度,如果选KCl 溶液作盐桥溶液,那么1 Cl -离子会扩散到被测系统中,将影响测量结果。这时可采用液位差原理使电解液朝一定方向流动,可减少盐桥溶液离子流向被测电极(参比电极)溶液内,如P264图Ⅳ-2-10所示
图中可见,由于被测溶液和参比电极溶液的液面都比盐桥溶液的液面高,因而可防止盐桥溶液离子流向被测溶液或参比电极溶液中。 Ⅱ、常见的几种盐桥 常见几种盐桥如P263图Ⅳ-2-9
1、参比电极 Ⅰ、选择参比电极的原则 ①,参比电极必须是可逆电极,它的电极电势也是可逆电势; ②,参比电极必须具有良好的稳定性和重现性。即它的电 极电势与放置时间影响不大,各次制作的同样的参比电极, 其电极电势也应相同。 ③,由金属和金属难溶盐或金属氧化物组成的参比电极属 第二类电极,如银-氯化银电极、汞-氧化汞,要求这类金属氧 化物在溶液中的溶解度很小。 ④,参比电极的选择必须根据被测体系的性质来决定。
例如,氯化物体系可选甘汞极或氯化银电极,硫酸溶液可选硫酸亚汞 电极;碱性溶液体系可选择氧化汞电极等。在具体选择时还必须考 虑减少液接电势等问题。另外还可采用氢电极作为参比电极。 Ⅱ、水溶液体系常用的电极 ①,氢电极 常用作电极电势测量的标准,在酸性溶液中也可作参比电极,尤其在测量氢超电势时,采用同一溶液中的氢电极作为参比电极,可简化计算 氢电极的电极反应为 在酸性溶液中: 222()H e H g + +→ 在碱性溶液中: 2222()2H O e H g OH -+→+ 氢电极的电极电势与溶液的 pH 和氢气压力有关 2 2 12()ln H H H RT a H F p ?+ += 式中()a H +为 H + 离子的活度, 2 H p 为氢气的压力 ( 2-H p =大气压水的饱和蒸气压)
3电化学三电极体系
.3电化学三电极体系 电化学传感器中用得最多的是三电极体系,对应的三个电极分别是工作电极、参比电极和辅助电极。三个电极组成两个回路,工作电极和辅助电极(对电极)组成的回路,用来测电流;工作电极和参比电极组成的回路,用来测电极的电位。图1.2是电化学传感器中常用的三电极体系示意图, 辅助电极又叫对电极(counter electrode ),它在整个体系中的作用是与工作电极形成回路,保持电流的畅通稳定,就好比电路里需同时具备火线和零线一样,由此可见,对电极在电化学测试体系中不可或缺。对电极保证电化学反应发生在工作电极上但又不会影响工作电极上的反应。对电极的表面积比工作电极的表面积要大,这样就能降低加在对电极上的电流密度,使它在检测过程中不容易被极化。常用的对电极材料有Ag, Pt, Ni等。 参比电极(reference electrode)是指具有己知恒定电位,且接近理想不极化的电极,基本上没有电流通过它。在电化学检测的三电极体系中,参比电极一方面在热力学上提供参比,另一方方面则是将工作电极隔离起来。为了满足电化学检测体系的需要,参比电极必须是良好的可逆电极,且电极电势要符 页脚内容1
合能斯特方程,在很小的电流流经过后,电极的电势能快速回到原状,当然电势的稳定和重现性必须很好。常用的参比电极主要有三种:标准氢电极(normal hydrogenelectrode , NHE );甘汞电极(calomel electrode ) }}0 g' 20};银/氯化银电极(Ag/AgCI协”,’‘]。其中的甘汞电极和银/氯化银电极在实验室最为常用。甘汞电极的电极反应是:Hg2Cl2 + 2e二2Hg十2C1",而银/氯化银电极的电极反应则是AgCI + e一Ag +Cl",从反应式中可看出,二者的电位皆与氯离子的浓度有关。在本课题中所使用的三电极系统中,参比电极均为银/氯化银电极。 所研究的反应发生在工作电极(working electrode)上,各种能导,一匕的材料都能用作工作电极,既可以是固体,也可以是液体。虽然对_!_作电极的材料没有很明确的限制,但是对_f作电极本身有一定的要求。最堪本的一矛a--是工作电极自身所发生的反应不会影响到所研究的电化学反应,并且电极的工作电位窗口要尽可能宽;最一暇要的是电极必须不能与溶剂或者电解质组分发生反应;电极的表面应该呈光滑镜面状态,表面面积不能太大,而且就算沾染到污物,也能通过简单的预处理使电极表面达到使用要求。固体电极使用较为广泛的有玻碳电极[f6} }l、铂电极[[g}、金电极[9-川、碳糊电极【i2]等,为了保证电极表面不存在影响检测的杂质,此类电极在使用前都必须经过严格的预处理过程[13, l4}。液体电极的典型代表是汞和汞齐电极工”,’“l,因为是液体,所以具有可重现的均相表面,制备和保存都比固体电极要容易,并且此类电极有很高的析氢电位,拓宽了负电位的工作窗口,早年被广泛用于电化学分析中,但是由于汞本身是毒性很大的物质,且容易对环境造成二次污染,近年来,该类电极逐渐淡出电化学分析领域,而被对环境更友好的新型电极所取代. 页脚内容2
一般参比电极电位和标准氢电极电位转换关系
一般氢电极, 标准氢电极和可逆氢电极辨析 武汉科思特仪器股份有限公司 氢标准电极是电化学中的一级标准电极,其电势已成为任何电化学氧化还原半反应电势的零电位基准。目前,三种氢电极,即一般氢电极(Normal Hydrogen Electrode, NHE),标准氢电极(Standard Hydrogen Electrode, SHE)和可逆氢电极(Reversible Hydrogen Electrode, RHE)经常于各类文献中被用于表示电极电势,并在不少场合出现了随意使用的趋势。然而三者却有着本质的不同。 一、一般氢电极,NHE 一般氢电极的定义为“铂电极浸在浓度为1当量浓度*(Normal Concentration, N)的一元强酸中并放出压力约一个标准大气压的氢气”。因其较标准氢电极易于制备,故为旧时电化学常用标准电极。但由于这样的电极并不严格可逆,故电压并不稳定,现在已经被弃用。 * 注:对于氢离子而言,1当量浓度=1摩尔浓度,即1 N = 1 M 二、标准氢电极,SHE 标准氢电极的定义为“铂电极在氢离子活度为1 M的理想溶液中,并与100 kPa压力下的氢气平衡共存时所构成的电极”。此种电极即当前电化学所规定的一级标准电极,其标准电极电势被人为规定为零(其绝对电势在25 ℃下为 4.44±0.02 V)。此电极反应完全可逆,但“氢离子活度为1 M的理想溶液”实际中并不存在,故而该电极只是一个理想模型。当列举其他参比电极的电势时,如无特别说明,应该都是相对于标准氢电极的电势,标注应为“vs. SHE”。 三、可逆氢电极,RHE 可逆氢电极为标准氢电极的一种。其与标准氢电极在定义上的唯一区别便是可逆氢电极并没有氢离子活度的要求,所以可逆氢电极的电势和pH有关。利用能斯特方程(Nernst Equation)可以很容易地推导出可逆氢电极电势的具体表达式:E=-0.059pH (@25 ℃)vs.SHE 综上,标准电极电位和饱和甘汞参比电极电位转换为: E RHE=E SCE+0.0591pH+E SCE0,E NHE=E SCE+E SCE0,E SHE=E SCE0。 其中,E RHE为转换后的可逆氢电极电位,E SCE为使用饱和甘汞电极的实际测量电位,E SCE0为25℃时饱和甘汞电极的标准电位(0.2415V)即E SHE,E NHE 为转换后的一般电极电位,一般文献里都是将电位转换为可逆氢电极电位(即vs.RHE)。
