碘钟反应的动力学和热力学参数的测定

“碘钟反应”的动力学和热力学参数的测定
摘要:本实验依次测定了“碘钟反应”的反应级数、速率常数和活化能,前两个量是反应动力学参数,活化能属于反应热力学参数,通过研究这三个量我们就可以大致上知道“碘钟反应”所经历的历程和反应的难易程度。毫无疑问,这些参数的测定对研究一个化学反应来说是十分重要而且有用的。 关键词:碘钟反应;反应级数;活化能
引言:本实验采用初速法测定228S O -与I -的反应级数和反应活化能,我们在室温下通过改变228S O -与I -
的物料比,从而确定“碘钟反应”中228S O -
与I -
各自的反应级数。然后根据求得的228S O -与I -
的反应级数,改变反应温度,得到不同温度下的“碘钟反应”的速率常数k ,进而根据Arrhenius 方程exp()a
E k A RT
=-,以ln k 对1
T 作图,根据图像的斜率求得本反应的活化能。
1.实验原理
在水溶液中,过二硫酸铵与碘化钾发生如下反应[1]
:
22284332S O I SO I ---
-+=+ (1)
我们事先同时加入少量的硫代硫酸钠溶液和淀粉指示剂,则(1)式中产生的少量的3I -会优先和223
S O -
反应而被还原成I -
:
222334623S O I S O I ----+=+ (2) 这样,当溶液中的硫代硫酸钠全部反应掉后,(1)式生成的碘才会和淀粉指示剂反应,使溶液呈蓝色。由上可知,控制在每个反应中硫代硫酸钠的物质的量均相同,这样从反应开始到出现蓝色的这段时间即可用来度量本反应的初速。
当反应温度和离子强度相同时,(1)式的反应速率方程可写为:
222828[][][]m n d S O k S O I dt
----= (3)
根据(1)式中的反应计量关系,可以认为:
22833[][][]
d S O d I I dt dt t
---
?-==
? (4) 根据(2)式的反应计量关系结合硫代硫酸钠的等量假设,可知
2323[]2[]
I S O t t
--
??=
?? (5) 根据(3)(4)(5)可知,
2223282[]
[][]m n S O k S O I t
---?=? (6)
移项,两边取对数可得
2282231ln
ln ln[]ln[]2[]
k m S O n I t S O ---=++?? (7) 因而固定[]I -
,以1ln
t
?对228[]S O -作图,根据直线的斜率即可求出m ;固定228[]S O -
,同理可以求出n 。然后根据求出的m 和n ,计算出在室温下“碘钟反应”的反应速率常数k 。
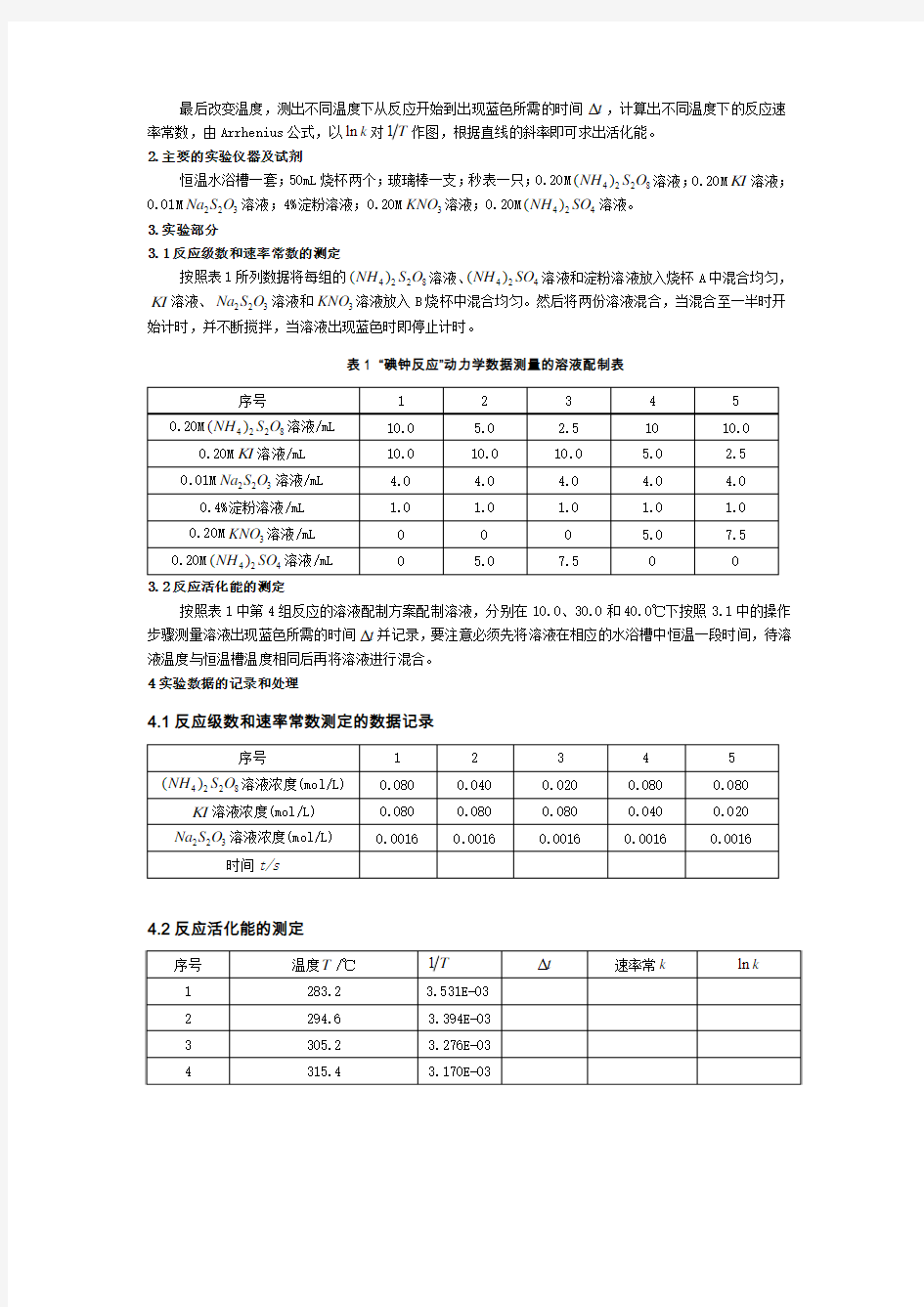
最后改变温度,测出不同温度下从反应开始到出现蓝色所需的时间t ?,计算出不同温度下的反应速率常数,由Arrhenius 公式,以ln k 对1作图,根据直线的斜率即可求出活化能。 2.主要的实验仪器及试剂
恒温水浴槽一套;50mL 烧杯两个;玻璃棒一支;秒表一只;0.20M 4228()NH S O 溶液;0.20M KI 溶液;0.01M 223Na S O 溶液;4%淀粉溶液;0.20M 3KNO 溶液;0.20M 424()NH SO 溶液。 3.实验部分
3.1反应级数和速率常数的测定
按照表1所列数据将每组的4228()NH S O 溶液、
424()NH SO 溶液和淀粉溶液放入烧杯A 中混合均匀,KI 溶液、223Na S O 溶液和3KNO 溶液放入B 烧杯中混合均匀。然后将两份溶液混合,当混合至一半时开
始计时,并不断搅拌,当溶液出现蓝色时即停止计时。
表1 “碘钟反应”动力学数据测量的溶液配制表
3.2反应活化能的测定
按照表1中第4组反应的溶液配制方案配制溶液,分别在10.0、30.0和40.0℃下按照3.1中的操作步骤测量溶液出现蓝色所需的时间t ?并记录,要注意必须先将溶液在相应的水浴槽中恒温一段时间,待溶液温度与恒温槽温度相同后再将溶液进行混合。 4实验数据的记录和处理
4.1反应级数和速率常数测定的数据记录
4.2反应活化能的测定
热力学基本状态参数
热力学基本状态参数 功和热量 1-1 工质和热力系 一、工质、热机、热源与冷源 1、热机(热力发动机):实现热能转换为机械能的设备。 如:电厂中的汽轮机、燃气轮机和内燃机、航空发动机等。 2、工质:实现热能转换为机械能的媒介物质。 对工质的要求: 1)良好的膨胀性; 2)流动性好;3)热力性质稳定,热容量大;4)安全对环境友善;5)价廉,易大量获取。如电厂中的水蒸汽;制冷中的氨气等。 问题:为什么电厂采用水蒸汽作工质? 3、高温热源:不断向工质提供热能的物体(热源)。 如电厂中的炉膛中的高温烟气 4、低温热源:不断接收工质排放热的物体(冷源) 如凝汽器中的冷却水 二、热力系统 1、热力系统和外界概念 热力系:人为划分的热力学研究对象(简称热力系)。 外界:系统外与之相关的一切其他物质。 边界:分割系统与外界的界面。在边界上可以判断系统与外界间所传递的能量和质量的形
式和数量。边界可以是实际的、假想的、固定的,或活动的。 注意:热力系的划分,完全取决于分析问题的需要及分析方法的方便。它可以是一个设备(物体),也可以是多个设备组成的系统。 如:可以取汽轮机内的空间作为一个系统,也可取整个电厂的作为系统。 2、热力系统分类 按系统与外界的能量交换情况分 1)绝热系统:与外界无热量交换。 2)孤立系统:与外界既无能量(功量、热量)交换,又无质量交换的系统。 注意:实际中,绝对的绝热系和孤立系统是不存在的,但在某些理想情况下可简化为这两种理想模型。这种科学的抽象给热力学的研究带来很大的方便。 如:在计算电厂中的汽轮机作功时,通常忽略汽缸壁的散热损失,可近似看作绝热系统。状态及基本状态参数 状态参数特点 u状态参数仅决定于状态,即对应某确定的状态,就有一组状态参数。反之,一组确定的状态参数就可以确定一个状态。状态参数的变化量仅决定于过程的初终状态,而与达到该状态的途径无关。因此,状态参数的变化量可表示为(以压力p为例): 二、基本状态参数 1.表压与真空 表压力:当气体的压力高于大气压力时(称为正压),压力表的读数(pg),如锅炉汽包、主蒸汽的压力等。 有:pg=p-pb p的计算式:p=pg+pb 真空(度):当气体的压力低于大气压力时(称为负压),负压表(真空表)的读数(pv),
自催化振荡反应综述
自催化振荡反应综述 反应产物对反应速率有加快作用的反应称为自催化反应。 在自催化反应中,反应速率既受反应物浓度的影响,又受反应产物浓度的影响。 自催化作用的特点是: 1.反应开始进行得很慢(称诱导期),随着起催化作用的产物的积累反应速度迅速加快,而后因反应物的消耗反应速度下降; 2.自催化反应必须加入微量产物才能启动; 3.自催化反应必然会有一个最大反应速率出现 最早比较成功模拟EF 振荡体系的模型FN 模型和DE 模型.其中FN 模型将BR 振荡反应分成下列三个基本反应过程: O H I H O H IO 22222365O 252++→+++- (A) O H H IO O H I 23224225++→++- (B) +-++→+H I IMA MA I 2 (C) 其中MA 代表有机底物,Furrow 与Noyes 在文献中提出了一个含有 30步反应步骤的机理来解 释上述三个反应过程。由于反应机理所包含的中 间组分及其反应步骤太多,很难用此来模拟和解释BR 振荡反应体系,故Furrow 与Noyes 通过相关化学和数学分析,最终筛选了其中的11个简单反应 步骤来模拟和分析BR 振荡体系所发生的部分实验现象。但是该反应模型只模拟了2HIO 、2I 和-I 三个组分变量,而且个别变量的模拟结果在数值上与实验相差比较大,DE 模型由十步反应步骤组成,该模型与FN 模型基本上相同,只是DE 模型比FN 模型
少了一个有机底物烯醇化的反应步骤.此外,上述两个模型所采用的机理步骤在形式上与BZ振荡反应体系FKN机理相类似,不同的是BR 反应体系,不存在金属催化剂离子氧化卤代有机底物的反应,而是变成氧化过氧化氢的反应步骤.其后研究的BR反应模型基本上都在这两个模型的基础上改变某些反应步骤,其本质和主要的反应步骤并没有太大的改变. 有些自催化反应有可能使反应体系中某些物质的浓度随时间或空间发生周期性的变化,从而发生化学振荡,所以发生化学振荡反应的必要条件之一是该反应必须是自催化反应。化学振荡现象的发生应具备以下几个条件: 1.反应必须是开放体系,且环境必须以一定的速度向体系提供某种物质和能量; 2.为了产生化学振荡反应,在整个反应序列中,至少有一步的产物有催化功能,对反应产生加速或者抑制的影响。即化学过程中有反馈的存在; 3.体系中必须能有两个准稳态存在; 4.根据Pr igogine等的理论,出现时空有序的自组织的现象的前提是远离平衡态。而化学振荡反应正是时空有序的自组织的现象。因此反应必须远离平衡态。 L dolt发现了碘钟反应。在碘钟反应中,例如1886年瑞士化学家an 两种或三种无色的液体被混合在一起,几秒钟后变成淀蓝色。 振荡反应主要有BZ振荡和BR振荡。化学振荡反应主要应用于分
化学科普阅读练习
科普阅读理解练习 1、阅读下面的科普短文 空气质量与氮氧化物有着密切的关系。一氧化氮和二氧化氮是两种重要的氮氧化物。 一氧化氮(化学式为NO)是一种无色气体,熔点-163.6℃,沸点-151℃,密度比空气略大,微溶于水。NO不稳定,易于空气中氧气发生反应,生成红棕色有刺激性气味的二氧化氮(NO2)。 实验室用铜与稀硝酸反应来制备NO。工业上可用氨气与氧气为原料,在加热和催化剂条件下制得一氧化氮。 汽车尾气(含有CO与NO等物质)是城市空气的污染源,治理的方法之一是在汽车的排气管上装一个“催化转换器”,使CO与NO 反应,生成两种可参与大气生态环境循环的无毒气体。 NO被发现广泛分布于生物体内各组织中。1992年被美国Science杂志评选为“明星分子”。NO在心、脑血管调节等方面有着十分重要的生物学作用,是心脑血管的保护神。 依据文章内容,请回答下列问题: (1)NO的物理性质。(2)NO不稳定的原因是。(3)NO可用法收集。 (4)治理NO的化学方程式为。(5)NO对人类有利的一面主要体现在。
虎门海水浸化法的办法是在海边挖两个大池注水后,将烟土抛入池中,浸泡后再投入生石灰,生石灰遇水沸腾,烟土溶解。 如今的超市中有一种称之“一拉热”方便加热食品,加热剂是分开包装的生石灰和水,使用时将绳子一拉,生石灰和水反应,放出热量,加热食品。此法也可以用于制备氢氧化钙。氢氧化钙是一种白色粉末状固体,加入水后,呈上下两层,上层水溶液称作澄清石灰水,下层悬浊液称作石灰乳或石灰浆。上层清液澄清石灰水可以检验二氧化碳,下层浑浊液体石灰乳是一种建筑材料。石灰乳也可以与纯碱进行苛化反应,用来制备烧碱。 根据以上科普短文,回答下列问题。 (1 (2 (3 (4
工程热力学知识点总结
工程热力学大总结 '
… 第一章基本概念 1.基本概念 热力系统:用界面将所要研究的对象与周围环境分隔开来,这种人为分隔的研究对象,称为热力系统,简称系统。 边界:分隔系统与外界的分界面,称为边界。 外界:边界以外与系统相互作用的物体,称为外界或环境。 闭口系统:没有物质穿过边界的系统称为闭口系统,也称控制质量。 ) 开口系统:有物质流穿过边界的系统称为开口系统,又称控制体积,简称控制体,其界面称为控制界面。 绝热系统:系统与外界之间没有热量传递,称为绝热系统。 孤立系统:系统与外界之间不发生任何能量传递和物质交换,称为孤立系统。 单相系:系统中工质的物理、化学性质都均匀一致的系统称为单相系。 复相系:由两个相以上组成的系统称为复相系,如固、液、气组成的三相系统。 单元系:由一种化学成分组成的系统称为单元系。 多元系:由两种以上不同化学成分组成的系统称为多元系。 } 均匀系:成分和相在整个系统空间呈均匀分布的为均匀系。 非均匀系:成分和相在整个系统空间呈非均匀分布,称非均匀系。 热力状态:系统中某瞬间表现的工质热力性质的总状况,称为工质的热力状态,简称为状态。 平衡状态:系统在不受外界影响的条件下,如果宏观热力性质不随时间而变化,系统内外同时建立了热的和力的平衡,这时系统的状态称为热力平衡状态,简称为平衡状态。 状态参数:描述工质状态特性的各种物理量称为工质的状态参数。如温度(T)、压力(P)、比容(υ)或密度(ρ)、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。 基本状态参数:在工质的状态参数中,其中温度、压力、比容或密度可以直接或间接地用仪表测量出来,称为基本状态参数。
热力学参数表
Standard Thermodynamic Values Formula State of Matter Enthalpy (kJ/mol) Entropy (J mol/K) Gibbs Free Energy (kJ/mol) (NH4)2O (l) -430.70096267.52496 -267.10656 (NH4)2SiF6 (s hexagonal) -2681.69296280.24432 -2365.54992 (NH4)2SO4 (s) -1180.85032220.0784 -901.90304 Ag (s) 042.55128 0 Ag (g) 284.55384172.887064 245.68448 Ag+1 (aq) 105.57905672.67608 77.123672 Ag2 (g) 409.99016257.02312 358.778 Ag2C2O4 (s) -673.2056209.2 -584.0864 Ag2CO3 (s) -505.8456167.36 -436.8096 Ag2CrO4 (s) -731.73976217.568 -641.8256 Ag2MoO4 (s) -840.5656213.384 -748.0992 Ag2O (s) -31.04528121.336 -11.21312 Ag2O2 (s) -24.2672117.152 27.6144 Ag2O3 (s) 33.8904100.416 121.336 Ag2S (s beta) -29.41352150.624 -39.45512 Ag2S (s alpha orthorhombic) -32.59336144.01328 -40.66848 Ag2Se (s) -37.656150.70768 -44.3504 Ag2SeO3 (s) -365.2632230.12 -304.1768 Ag2SeO4 (s) -420.492248.5296 -334.3016 Ag2SO3 (s) -490.7832158.1552 -411.2872 Ag2SO4 (s) -715.8824200.4136 -618.47888 Ag2Te (s) -37.2376154.808 43.0952 AgBr (s) -100.37416107.1104 -96.90144 AgBrO3 (s) -27.196152.716 54.392 AgCl (s) -127.0680896.232 -109.804896 AgClO2 (s) 8.7864134.55744 75.7304 AgCN (s) 146.0216107.19408 156.9 AgF?2H2O (s) -800.8176174.8912 -671.1136 AgI (s) -61.83952115.4784 -66.19088 AgIO3 (s) -171.1256149.3688 -93.7216 AgN3 (s) 308.7792104.1816 376.1416 AgNO2 (s) -45.06168128.19776 19.07904 AgNO3 (s) -124.39032140.91712 -33.472 AgO (s) -11.4223257.78104 14.2256 AgOCN (s) -95.3952121.336 -58.1576 AgReO4 (s) -736.384153.1344 -635.5496 AgSCN (s) 87.864130.9592 101.37832 Al (s) 028.32568 0 Al (l) 8.6608835.22928 6.61072 Al (g) 326.352164.4312 285.7672 Al(BH4)3 (l) -16.3176289.1144 144.7664 Al(BH4)3 (g) 12.552379.0704 146.44 Al(CH3)3 (l) -136.3984209.4092 -10.0416
碘钟反应实验报告
碘钟反应 实验目的 1.了解浓度、温度对反应速率的影响。 2.学习测定K2S2O8氧化KI的反应速率常数及活化能的原理和方法。 3.练习用计算法、作图法处理实验数据。 二实验原理 水溶液中,K 2S 208与KI发生如下反应的离子方程式 S2O82- +2 1-= |2 + 2 SO42- 在温度和离子强度不变,反应速率与反应物浓度的关系可近似表示为即动力学方程: V = -d [S2O82-] /dt= k [S2O82-]m[ I -]n 通常人们认为S2O82-氧化I-通常经历两个步骤 S z O g2 + I = [IS2O8] 0000000000000 (1) [IS2O8^- + I- = 12 + 2 SO42-0 0000000 (2) 反应(1)为速控步骤,则其速率方程为 -d[S2O82-]/dt= k[S2O82-][l-] 若[I-]不变([门>>[S2O82-])则其速率方程为 -d[S2O82-] / dt= k i [S2O82-] k i= k[l-],上述反应假定为准一级反应,则 In [S2O82-] = — k i t +ln [S2O82-] 0
以In [S2O82-]对时间t作图,即可求得反应速率常数k 1
为了保持[I -]不变,本实验采用加入S 2O 32 方法: 2 S 2O 32-+ 12 = 2 1- + S 4O 62-此反应很快,可认为瞬间完成。由加入的 Na 2S 2O 3的体积及其浓度,可以算出每次溶液呈现蓝色时所消耗的 Na 2S 2O 3的量,从而求出此时刻的S 2O 82-,得到一系列K 2S 2O 8的浓度 及其对应的反应时间,从而求的速率常数k i ,改变反应温度,可求得 不同反应温度的k 1值,根据阿仑尼乌斯公式 K = Ae — Ea/RT 取对数 lnK = — Ea/RT+lnA 装置和流程简图 仪器: 恒温槽,电子秒表,微量注射器,量筒(10ml ),移液管(25ml , 10ml), 吸耳 球,环形搅拌器,大试管,容量瓶,烧杯 试剂: (K 2 S 2 O 8 0 .0 5 0 mol L-1) KI (0.01 2 5 mol L-1)淀粉(1%,W 流程: 1 .恒温槽调至所需温度,恒温。 2 .大试管装入2 5 ml 蒸馏水,10 恒温10分钟 K 2 S 20 8放入容量瓶中7恒温10分钟 3. 用微量注射器取3 0 0卩l Na2S 20 3注入大试管中,用环 形搅拌器 使其混合均匀。 4. 移液管取10 ml 已恒温K 2S 2 O 8注入大试管,流出一半时 计 时,至溶液颜色变蓝,暂停秒表,记下时间读数,立即再加 入3 0 0 卩l Na2S 20 3,搅拌溶液,开动秒表,继续计时 颜色变化暂停记 时,重复记五次。 以InK 对1/T 作图, 求出直线斜率,即可求得活化能 Ea (0. 10 0 mol L-1) Na 2S 2O 3 /V) ml KI 溶液,2 ml 淀粉液,7
碘钟实验
实验药品29%过氧化氢溶液、丙二酸、硫酸锰、可溶性淀粉、碘酸钾、1mol/L硫酸实验步骤1.配置甲溶液:量取97mL29%的过氧化氢溶液,转移入250mL容量瓶里,用蒸馏水稀释到刻度,得3.6mol/L过氧化氢溶液。 2.配置乙溶液:分别称取 3.9g丙二酸和0.76g硫酸锰,分别溶于适量水中。另称取0.075g可溶性淀粉,溶于50mL左右沸水中。把三者转移入250mL容量瓶里,稀释到刻度,得到含0.15mol/L丙二酸、0.02mol/L硫酸锰、和0.03%淀粉的混合溶液 3.配置丙溶液:称取10.75g碘酸钾溶于适量热水中,再加入20mL1mol/L硫酸溶液酸化。转移入250mL容量瓶里,稀释到刻度,得到0.2mol/L碘酸钾和0.08mol/L硫酸的混合溶液。 4.将甲、乙、丙三组溶液以等体积混合在锥形瓶中,这混合溶液分别含过氧化氢 1.2mol/L、丙二酸0.05mol/L、硫酸锰0.0067mol/L、碘酸钾0.067mol/L、淀粉0.01%。 “时钟反应”就是一种自催化反应,如碘酸盐与亚硫酸氢盐的反应,产物I-又是反应物,因而在经历一定诱导期后,反应速率急速增加。 2KIO3+5H2O2+H2SO4→I2+K2SO4+6H2O+5O2↑(1) I2+5H2O2+K2SO4→2KIO3+4H2O+H2SO4(2) I2+CH2(COOH)2→CHI(COOH)2+I-+H+(3) I2+CHI(COOH)2→CI2(COOH)2+I-+H+(4) I-+I2=I3-(5) 丙二酸的加入是为了以I3-的形式“贮存”I2,以增大I2的溶解度。这样能延长变色时间周期和循环次数。显然蓝色是由碘分子与淀粉溶液作用的结果。5个反应累加结果发现是 H2O2→H2O+O2↑。如果向反应器中不断加入碘酸盐、丙二酸、双氧水反应物,同时产物通过溢流管不断离开反应器,这样可以使化学钟无限期走下去。 也存在其它时钟反应: IO3- + 3SO32-===I- + 3SO42- IO3- + 5I- + 6H+ ===3I2 + 3H2O 3I2 + 3SO32- + 3H2O===6I- + 6H+ + 3SO42- 或 5H2O2 + 2HIO3===5O2 + I2 + 6H2O I2 + 5H2O2===2HIO3 + 4H2O 在KIO3、KHSO3的酸性混合溶液中加入少量KI和淀粉,不断地搅拌,有下列反应发生:IO3-+5I-+6H+=3I2+3H2O I2+HSO3-+H2O=2I-+]+HSO4-+2H+ 当反应进行到15min时,溶液突然变成蓝色,随之又很快消失,这一反应被称为时钟反应。有人用它来解释生物钟现象。
饱和水蒸气温度-压力-密度-热力学参数对照表
当空气中所含水蒸气的量达到最大时就称这种空气为“饱和湿空气”,与饱和湿空气对应的压力称为“饱和水蒸气压力”,用符号Ps表示.水蒸气压力p与饱和水蒸气压力Ps的比值称为相对湿度Rh,与饱和水蒸气压力Ps 对应着的相对湿度为:Rh=100% 。 饱和水蒸气温度-压力-密度-热力学参数对照表 温度t ℃绝对压强p kPa 水蒸汽的密度ρ kg·m-3 焓H kJ·kg-1 汽化热r kJ·kg-1 液体水蒸汽 0 0.61 0.00 0.00 2491.10 2491.10 5 0.87 0.01 20.94 2500.80 2479.86 10 1.23 0.01 41.87 2510.40 2468.53 15 1.71 0.01 62.80 2520.50 2457.70 20 2.33 0.02 83.74 2530.10 2446.30 25 3.17 0.02 104.67 2539.70 2435.00 30 4.25 0.03 125.60 2549.30 2423.70 35 5.62 0.04 146.54 2559.00 2412.10 40 7.38 0.05 167.47 2568.60 2401.10 45 9.58 0.07 188.41 2577.80 2389.40 50 12.34 0.08 209.34 2587.40 2378.10 55 15.74 0.10 230.27 2596.70 2366.40 60 19.92 0.13 251.21 2606.30 2355.10 65 25.01 0.16 272.14 2615.50 2343.10
(推荐)氯化钙热力学物性参数
氯化钙热力学物性参数 1氯化钙理化性质及其应用 氯化钙的相对密度为2.15g/cm3,熔点782℃、沸点 1600℃以上。具有极强的吸湿性,暴露于空气中极易潮解。易溶于水,同时放出大量的热。文献[1]详细介绍了氯化钙的应用和生产工艺:氯化钙的应用按级别分为:工业级氯化钙[2]和食品级氯化钙[3]。 1.1工业级氯化钙 工业级氯化钙具有遇水发热且凝点低的特点,可用于融雪和除冰[4-6]。并有吸水性强的功能,还可用作干燥剂,如用于氮气、氧气、氢气等气体的干燥。还是港口消雾[7]和路面集尘[8]、织物防火的最佳材料[9]。氯化钙水溶液是冷冻机用和制冰用的重要制冷介质[10]。另外氯化钙还可当作脱水剂、防冻剂、絮凝剂及生产色淀颜料的沉淀剂等。 1.2食品级氯化钙应用 在食品生产中,氯化钙可用于食品加工的稳定剂、稠化剂、吸潮剂、口感改良剂等。在医药领域,氯化钙还可用于药物合成的原料。 1.3氯化钙用于热泵 氯化钙主要是用于化学热泵(Chemical Heat Pump 简称CHP),它是利用不同条件下的一对耦合的可逆化学反应所产生的吸收放热现象来实现热量的传递的,它是一种将热能转化为化学能,从而将
蓄热机和热泵机合二为一的新型节能技术[11]。文献[11]研究了化学热泵为CaCl 2/CH 3OH 体系,它利用了如下化学反应: 23232()2()CaCl CH OH g CaCl CH OH s ??→+?←?? 该反应是一个气固两相的可逆络合反应,反应的正方向是放热反应。 以CaCl 2/CH 3OH 体系设计的化学热泵的工作原理图如下: 下面是氯化钙的部分热力学性质图表:
热力学基本状态参数
功和热量 1-1 工质和热力系 一、工质、热机、热源与冷源 1、热机(热力发动机):实现热能转换为机械能的设备。 如:电厂中的汽轮机、燃气轮机和内燃机、航空发动机等。 2、工质:实现热能转换为机械能的媒介物质。 对工质的要求: 1)良好的膨胀性; 2)流动性好;3)热力性质稳定,热容量大;4)安全对环境友善;5)价廉,易大量获取。如电厂中的水蒸汽;制冷中的氨气等。 问题:为什么电厂采用水蒸汽作工质? 3、高温热源:不断向工质提供热能的物体(热源)。 如电厂中的炉膛中的高温烟气 4、低温热源:不断接收工质排放热的物体(冷源) 如凝汽器中的冷却水 二、热力系统 1、热力系统和外界概念 热力系:人为划分的热力学研究对象(简称热力系)。 外界:系统外与之相关的一切其他物质。 边界:分割系统与外界的界面。在边界上可以判断系统与外界间所传递的能量和质量的形式和数量。边界可以是实际的、假想的、固定的,或活动的。 注意:热力系的划分,完全取决于分析问题的需要及分析方法的方便。它可以是一个设备(物体),也可以是多个设备组成的系统。 如:可以取汽轮机内的空间作为一个系统,也可取整个电厂的作为系统。 2、热力系统分类 按系统与外界的能量交换情况分 1)绝热系统:与外界无热量交换。 2)孤立系统:与外界既无能量(功量、热量)交换,又无质量交换的系统。 注意:实际中,绝对的绝热系和孤立系统是不存在的,但在某些理想情况下可简化为这两种理想模型。这种科学的抽象给热力学的研究带来很大的方便。 如:在计算电厂中的汽轮机作功时,通常忽略汽缸壁的散热损失,可近似看作绝热系统。状态及基本状态参数 状态参数特点
碘钟实验(新、选)
1.碘钟反应
2 碘钟反应
1.1过氧化氢型碘钟 药品:硫酸,双氧水,碘酸钾,硫代硫酸钠,淀粉 向硫酸酸化的过氧化氢溶液中加入碘酸钾、硫代硫酸钠和淀粉的混合溶液。此时在体系中存在两个主要反应,化学方程式为: H2O2(aq)+3I?(aq)+2H+→I3?+2H2O I3?(aq)+2S2O32?(aq) →3I?(aq)+S4O62?(aq) 1.2碘酸盐型碘钟 药品:硫酸,碘酸钾,亚硫酸氢钠,淀粉 向用硫酸酸化的碘酸盐中加入亚硫酸氢钠(以及少量淀粉溶液),此时体系中出现如下反应: IO3? (aq) + 3HSO3? (aq) →I? (aq) + 3HSO4?(aq)
然后过量的碘酸根离子与碘离子发生归中反应: IO3? (aq) + 5I? (aq) + 6H+ (aq) →3I2 + 3H2O (l) 接着亚硫酸氢钠将生成的碘还原: I2 (aq) + HSO3? (aq) + H2O (l) →2I? (aq) + HSO4?(aq) + 2H+ (aq) 药品:硫酸,过硫酸钾,碘化钾,淀粉,硫代硫酸钠 通过过硫酸钾、过硫酸钠或过硫酸铵将碘离子氧化成碘单质。加入硫代硫酸钠可以将碘单质还原回碘离子。化学方程式如下: 2I?(aq) + S2O82?(aq) →I2 (aq)+ 2SO42?(aq) I2 (aq) + 2S2O32?(aq) →2I?(aq) + S4O62?(aq) 将卢戈氏碘液、氯酸钠和高氯酸混合,化学方程式如下: I3? →I? + I2 ClO3? + I? + 2H+ →HIO +HClO2 ClO3? + HIO + H+ →HIO2 + HClO2 ClO3? + HIO2 →IO3? + HClO2[1] 最新文件仅供参考已改成word文本。方便更改
碘钟实验
下面介绍一个简单的碘钟实验 [编辑] 实验药品29%过氧化氢溶液、丙二酸、硫酸锰、可溶性淀粉、碘酸钾、1mol/L硫酸 [编辑] 实验步骤1.配置甲溶液:量取97mL29%的过氧化氢溶液,转移入250mL容量瓶里,用蒸馏水稀释到刻度,得3.6mol/L过氧化氢溶液。 2.配置乙溶液:分别称取 3.9g丙二酸和0.76g硫酸锰,分别溶于适量水中。另称取0.075g 可溶性淀粉,溶于50mL左右沸水中。把三者转移入250mL容量瓶里,稀释到刻度,得到含0.15mol/L丙二酸、0.02mol/L硫酸锰、和0.03%淀粉的混合溶液。 3.配置丙溶液:称取10.75g碘酸钾溶于适量热水中,再加入20mL2mol/L硫酸溶液酸化。转移入250mL容量瓶里,稀释到刻度,得到0.2mol/L碘酸钾和0.08mol/L硫酸的混合溶液。 4.将甲、乙、丙三组溶液以等体积混合在锥形瓶中,这混合溶液分别含过氧化氢1.2mol/L、丙二酸0.05mol/L、硫酸锰0.0067mol/L、碘酸钾0.067mol/L、淀粉0.01%。混合后,反应液由无色变为蓝紫色,几秒后褪为无色,接着又称琥珀色变逐渐加深,蓝紫色又反复出现,几秒后又消失,这样周而复始地呈周期性变化。这种振荡反应,又叫“碘钟反应”。振荡周期约为8秒,反复振荡能持续10多分钟。 [编辑] 注意事项1.碘钟反应速率与温度有关 2.丙溶液会随室温降低,碘酸钾以晶体析出,微热又溶解。甲溶液不宜放置太久,否则过氧化氢分解失效而导致实验失败。 3.不可随意更改药品用量 “碘钟”反应 Ⅰ、目的要求 用初速法测定过硫酸根与碘离子的反应速率常数和反应级数。 Ⅱ、仪器与试剂 混合反应器10mL、5mL移液管10mL刻度移液管 秒表0.100mol?dm-3 (NH4)2S2O8(K2S2O8)溶液0.005mol?dm-3Na2S2O3标准溶液 0.100 mol?dm-3KI溶液 0.100mol?dm-3 (NH4)2SO4(K2SO4)溶液0.5%淀粉指示剂 Ⅲ、实验原理 过硫酸根与碘离子的反应式如下: 如事先同时加入少量硫代硫酸钠标准溶液和淀粉指示剂,则(2-21-1)式产生的碘便很快被还原为碘离子: 直到S2O32-消耗完,游离碘遇上淀粉即显示蓝色。从反应开始到蓝色出现所经历的时间,即可作为反应初速的计量。由于这一反应能自身显示反应进程,故常称为“碘钟”反应。1.反应级数和速率常数的确定 当温度和溶液的离子强度一定时,(2-21-1)式的速率方程可写成: 在测定反应级数的方法中.反应初速法能避免反应产物干扰,求得反应物的真实级数。 如果选择一系列初始条件,测出对应于析出碘量为△[I2]的蓝色出现时间△t,则反应的初始速率是:
也谈基于化学核心素养的教学设计
也谈基于化学核心素养的教学设计 ——“氧化还原反应复习”同课异构课堂教学思考 宋美真 (浙江省淳安中学 311700) 【摘要】呈现两位老师在“同课异构”教研活动中“氧化还原反应复习”的课堂教学,对比评析,提出确立学科素养的教学目标、形成过程化教学手段、构建情景化教学模式等基于化学核心素养的教学设计策略。 【关键词】核心素养“境脉”过程教学教学情境 前段时间有幸聆听了两堂“氧化还原反应复习”的“同课异构”课堂教学交流课,为了更好的比较,我将他们的教学环节、教学内容、师生活动、设计意图设计成表格形式呈现如下: 教学过程设计一:氧化还原反应复习——汪老师
教学过程设计二:“碘”藏智慧——氧化还原反应再认识王老师 从两堂课的教学过程设计不难发现,汪老师和王老师他们的本质区别在于教学目标不同,从而形成不同的教学脉络和教学意图:汪老师的教学目标在于落实“双基”,掌握氧化还原的概念与应用。整个过程的设计均是以习题设置的方式助概念的理解,是一堂传统的复习课模式;而王老师的课堂教学目标在于培养学生分析问题、解决问题的能力,所以她的教学设计通过从实际生活中寻找知识的应用,让生活走进化学,实验研究化学,用化学解释生活,“境脉”清晰,明暗交错,是基于化学学科核心素养而进行教学内容设计的,这正是当前我们所要追求的一种新型教学理念。下面就基于化学学科素养的教学设计谈谈我的浅陋想法。 1 确立核心素养为本的教学目标 教学目标是教学设计的指挥棒,确立核心素养为本的教学目标是时代的要求。教学目标是在不断的变化与发展的,从原来的“双基”目标(基础知识与基本技能)到后来的“三维”目标(知识与技能、过程与方法、情感态度与价值观)再到现在的学科素养目标(立德树人);从原来的知识本位发展到现在能力素养本位,即以前的知识传授发展到现在的以提高学生的核心素养的根本转化。核心素养最本质的就是在陌生的环境中能解决问题的能力,是一种信息迁移能力和处理问题的思维方式。在这样的教学
工程热力学基本概念及重要公式
工程热力学基本概念及 重要公式 Company number:【WTUT-WT88Y-W8BBGB-BWYTT-19998】
第一章基本概念1.基本概念 热力系统:用界面将所要研究的对象与周围环境分隔开来,这种人为分隔的研究对象,称为热力系统,简称系统。 边界:分隔系统与外界的分界面,称为边界。 外界:边界以外与系统相互作用的物体,称为外界或环境。 闭口系统:没有物质穿过边界的系统称为闭口系统,也称控制质量。 开口系统:有物质流穿过边界的系统称为开口系统,又称控制体积,简称控制体,其界面称为控制界面。 绝热系统:系统与外界之间没有热量传递,称为绝热系统。 孤立系统:系统与外界之间不发生任何能量传递和物质交换,称为孤立系统。 单相系:系统中工质的物理、化学性质都均匀一致的系统称为单相系。 复相系:由两个相以上组成的系统称为复相系,如固、液、气组成的三相系统。 单元系:由一种化学成分组成的系统称为单元系。 多元系:由两种以上不同化学成分组成的系统称为多元系。 均匀系:成分和相在整个系统空间呈均匀分布的为均匀系。 非均匀系:成分和相在整个系统空间呈非均匀分布,称非均匀系。 热力状态:系统中某瞬间表现的工质热力性质的总状况,称为工质的热力状态,简称为状态。 平衡状态:系统在不受外界影响的条件下,如果宏观热力性质不随时间而变化,系统内外同时建立了热的和力的平衡,这时系统的状态称为热力平衡状态,简称为平衡状态。
状态参数:描述工质状态特性的各种物理量称为工质的状态参数。如温度(T)、压力(P)、比容(υ)或密度(ρ)、内能(u)、焓(h)、熵(s)、自由能(f)、自由焓(g)等。 基本状态参数:在工质的状态参数中,其中温度、压力、比容或密度可以直接或间接地用仪表测量出来,称为基本状态参数。 温度:是描述系统热力平衡状况时冷热程度的物理量,其物理实质是物质内部大量微观分子热运动的强弱程度的宏观反映。 热力学第零定律:如两个物体分别和第三个物体处于热平衡,则它们彼此之间也必然处于热平衡。 压力:垂直作用于器壁单位面积上的力,称为压力,也称压强。 相对压力:相对于大气环境所测得的压力。如工程上常用测压仪表测定系统中工质的压力即为相对压力。 比容:单位质量工质所具有的容积,称为工质的比容。 密度:单位容积的工质所具有的质量,称为工质的密度。 强度性参数:系统中单元体的参数值与整个系统的参数值相同,与质量多少无关,没有可加性,如温度、压力等。在热力过程中,强度性参数起着推动力作用,称为广义力或势。 广延性参数:整个系统的某广延性参数值等于系统中各单元体该广延性参数值之和,如系统的容积、内能、焓、熵等。在热力过程中,广延性参数的变化起着类似力学中位移的作用,称为广义位移。 准静态过程:过程进行得非常缓慢,使过程中系统内部被破坏了的平衡有足够的时间恢复到新的平衡态,从而使过程的每一瞬间系统内部的状态都非常接近平衡状态,整个过程可看作是由一系列非常接近平衡态的状态所组成,并称之为准静态过程。
碘钟反应实验报告
碘钟反应实验报告 班级:高二理十 实验员:江嘉伟曹俊章和毅方蕾潘隽晗谢辰谢延靖朱海蓓朱正真方屹舟方杜娟指导老师:蔡建 实验时间:2017年12月 一、实验目的 掌握碘钟反应反应过程及原理。 二、实验器材 29%过氧化氢溶液、丙二酸、硫酸锰、可溶性淀粉、碘酸钾、1mol/L硫酸。 三、实验步骤 1.配置甲溶液:量取97ml29%过氧化氢溶液转移入250ml容量瓶里,用蒸馏水稀释至刻 度。 2.配置乙溶液:分别称取 3.9g丙二酸、0.76g硫酸锰病5溶于适量水中。另称0.075g可溶 性淀粉溶于50ml沸水中。将三者转移入250ml容量瓶里,用蒸馏水稀释至刻度。 3.配置丙溶液:称取10.75g碘酸钾溶于适量热水中,再加入20ml1mol/L硫酸溶液酸化, 转移入250ml容量瓶里,用蒸馏水稀释至刻度。 4.将甲、乙、丙三组溶液以等体积混合在锥形瓶中,观察现象。 四、实验现象 混合后产生大量微小气泡,且反应液由无色变为琥珀色,几秒后褪为无色,接着又变为琥珀色且逐渐加深,随机变为蓝紫色,几秒后又褪为无色,呈周期性变化。经测定,振荡周期约为11秒,持续时间约为10分钟。 五、实验原理 首先在酸性溶液中,碘酸根氧化过氧化氢得碘离子、水和氧气。(气体符号省略,下同)IO3-+3H2O2==I -+3H2O+3O2 同时,二价锰离子具有较强的还原性,可以还原过氧化氢,生成琥珀色的三价锰离子,于是溶液呈琥珀色。反应刚开始时,浓度较低的碘离子也参与反应并被氧化为碘。 2Mn2++2H2O2+4H++2I-==2Mn3++4H2O+I2 生成的碘会与具有活泼α-H的丙二酸反应,结果是碘取代了丙二酸中的α-H。 I2+HOOCCH2COOH==I-+H++HOOCHICOOH 溶液中存在的三价锰离子此时会将碘代丙二酸氧化成二氧化碳,观察到的大量气泡就是二氧化碳和第一步产生的氧气。随着反应进行,三价锰离子消耗殆尽,溶液渐渐褪成无色。 4Mn3++HOOCCHICOOH+2H2O==2CO2+HCOOH+4Mn2++5H++I- 当碘离子浓度达到一定程度时便会和碘酸根发生归中反应得到碘,碘与淀粉形成蓝紫色包合物,此时观察到溶液显蓝紫色。 5I-+IO3-+6H+==3I2+3H2O 此时碘又会继续和丙二酸反应,重复上述步骤,于是有“无色――蓝紫色――琥珀色”的周期
碘钟反应_-_zh
碘钟反应 一、实验目的 1.掌握“碘钟”反应的原理。学会运用“碘钟”反应设计动力学实验的方法。 2.测定过硫酸根与碘离子的反应速率常数.反应级数和反应活化能. 二、实验原理 在水溶液中,过二硫酸铵与碘化钾发生如下反应: 22284332S O I SO I --- -+=+ (1) 为了能够测定一定时间(Δt )内S 2O 82-浓度的变化量,在混合过二硫酸铵、碘化钾溶液 的同时加入一定体积已知浓度并含有淀粉(指示剂)的Na 2S 2O 3 溶液,在式(1)进行的同时,有下列反应进行: 222334623S O I S O I ----+=+ (2) 反应(2)进行得非常快,而反应(1)却缓慢得多,故反应(1)生成的I 3 -立即与S 2O 32-作用生成无色的S 4O 62-和I ?,因此反应开始一段时间内溶液无颜色变化,但当Na 2S 2O 3耗尽,反应(1)生成的微量碘很快与淀粉作用,而使溶液呈现特征性的蓝色。由于此时(即Δt ) S 2O 32-全部耗尽,所以S 2O 82-的浓度变化相当于全部用于消耗Na 2S 2O 3。由上可知,控制在每个反应中硫代硫酸钠的物质的量均相同,这样从反应开始到出现蓝色的这段时间可作为反应初速的计量。由于这一反应能显示自身反应进程,故称为“碘钟”反应。 1、反应级数和速率常数的确定 当反应温度和离子强度相同时,(1)式的反应速率方程可写为: 222828[][][]m n d S O k S O I dt ----= (3) 在测定反应级数的方法中,反应初速法能避免反应产物的干扰求的反应物的真实级数。 如果选择一系列初始条件,测得对应于析出碘量为Δ[I 2]的蓝色出现的时间Δt ,则反应的初始速率为: 22833[][][] d S O d I I dt dt t ---?-== ? (4) 根据(2)式的反应计量关系结合硫代硫酸钠的等量假设,可知 2323[]2[] I S O t t --??= ?? (5) 根据(3)(4)(5)可知, 2223282[] [][]m n S O k S O I t ---?=? (6) 移项,两边取对数可得 2282231ln ln ln[]ln[]2[] k m S O n I t S O ---=++?? (7) 因而固定[]I -,以1 ln t ?对ln 228[]S O -作图,根据直线的斜率即可求出m ;固定228[]S O -,同理可以求出n 。然后根据求出的m 和n ,计算出在室温下“碘钟反应”的反应速率常数k 。 2、反应活化能的确定
工程热力学基础简答题
工程热力学基础简答题
————————————————————————————————作者:————————————————————————————————日期:
1、什么是叶轮式压气机的绝热效率? 答: 2、压缩因子的物理意义是什么? 它反映了实际气体与理想气体的偏离 程度,也反映了气体压缩性的大小,Z>1表示实际气体较理想气体难压缩,Z<1表示实际气体较理想气体易压缩。 3、准平衡过程和可逆过程的区别是什么? 答:无耗散的准平衡过程才是可逆过程,所以可逆过程一定是准平衡过程,而准平衡过程不一定是可逆过程。 4、什么是卡诺循环?如何求其效率? 答:卡诺循环包括四个步骤:等温吸热,绝热膨胀,等温放热,绝热压缩。 5、余隙容积对单级活塞式压气机的影响? 答:余隙容积的存在会造成进气容积减少,所需功减少。余隙容积过大会使压缩机的生产能力和效率急剧下降,余隙容积过小会增加活塞与气缸端盖相碰撞的危险性 6、稳定流动工质焓火用的定义是如何表达的?
答:定义:稳定物流从任意给定状态经开口系统以可逆方式变化到环境状态,并只与环境交换热量时所能做的最大有用 功。 7、写出任意一个热力学第二定律的数学表达式、 答: 8、理想气体经绝热节流后,其温度、压力、热力学能、焓、熵如何变化? 答:温度降低,压力降低,热力学能减小、焓不变、熵增加。 9、冬季室内采用热泵供暖,若室内温度保持在20度,室外温度为-10度时,热泵的供暖系数理论上最高可达到多少? 答: 10、对于简单可压缩系统,实现平衡状态的条件是什么?热力学常用的基本状态参数有哪些? 答:热平衡、力平衡、相平衡;P、V、T 11、简述两级压缩中间冷却压气机中,中间冷却的作用是什么?如何计算最佳中间压力? 答:减少高压缸耗功,利于压气机安全运行,提高容积效率, 降低终了温度;中间压力: 12、混合理想气体的分体积定律是什么?写出分体积定律 的数学表达式。
碘钟实验,BZ震荡试验,蓝瓶子实验
碘钟实验 药品: 29%过氧化氢溶液、丙二酸、硫酸锰、可溶性淀粉、碘酸钾、1mol/L硫酸 步骤: 1.配置甲溶液:量取97mL29%的过氧化氢溶液,转移入250mL容量瓶里,用蒸馏水稀释到刻度,得3.6mol/L过氧化氢溶液。 2.配置乙溶液:分别称取 3.9g丙二酸和0.76g硫酸锰,分别溶于适量水中。另称取0.075g 可溶性淀粉,溶于50mL左右沸水中。把三者转移入250mL容量瓶里,稀释到刻度,得到含0.15mol/L丙二酸、0.02mol/L硫酸锰、和0.03%淀粉的混合溶液。 3.配置丙溶液:称取10.75g碘酸钾溶于适量热水中,再加入20mL1mol/L硫酸溶液酸化。转移入250mL容量瓶里,稀释到刻度,得到0.2mol/L碘酸钾和0.08mol/L硫酸的混合溶液。 4.将甲、乙、丙三组溶液以等体积混合在锥形瓶中,这混合溶液分别含过氧化氢1.2mol/L、丙二酸0.05mol/L、硫酸锰0.0067mol/L、碘酸钾0.067mol/L、淀粉0.01%。 注意: 1.碘钟反应速率与温度有关 2.丙溶液会随室温降低,碘酸钾以晶体析出,微热又溶解。甲溶液不宜放置太久,否则过氧化氢分解失效而导致实验失败。 B-Z震荡试验 试剂: A溶液:3g丙二酸+6mL 1:1硫酸+0.2g硝酸铵+44mL水 B溶液:2.5g溴酸钾+50mL水 邻菲啰啉:0.7g硫酸亚铁+0.5g邻菲啰啉注: 步骤: 1.烧杯中加入8mLA液和8mLB液混合并观察(无-黄-无)记录周期。 2.再加入1mL邻菲啰啉观察(无-黄-无)记录周期 蓝瓶子实验 试剂: 0.1%亚甲基蓝溶液、30%NaOH溶液、葡萄糖、蒸馏水。锥形瓶、试管、滴管、橡胶塞、烧杯、酒精灯、量筒、托盘天平、温度计、计时器。 步骤: 1 锥形瓶中加50mL水,1.5克葡萄糖,逐滴滴入8~10滴0.1%亚甲基蓝,振荡至溶液呈蓝色 2 加入2mL30%NaOH溶液,振荡试管,静置锥形瓶,观察并记录现象。再振荡锥形瓶至溶液变蓝,又静置锥形瓶,连续记录两次振荡周期(NaOH的用量不能太多)。 3 将溶液分装在两个小试管中,1号试管装满,2号试管装半管,均用塞子塞好,振荡,静置 4 把1号试管溶液分一半到3号试管中,再在3号试管中加5滴0.1%亚甲基蓝,塞好两支试管,振荡、静置 5 将1、3号试管置于40℃水浴中,约10min后振荡、静置(水浴加热至40℃,水温不能太高。否则,溶液变黄失效) 现象: 1.溶液呈蓝色 2. 溶液褪色约25秒 3. 1试管始终呈无色2试管振荡后变蓝,然后自下而上褪色约45秒 4. 1试管振荡后变蓝,然后自下而上褪色19秒3试管振荡试管后蓝色较1试管深,然后自下而上褪色,16秒 5. 振荡后迅速变蓝,然后迅速褪色2~3秒
神奇的化学反应
神奇的化学反应 ①大象牙膏: 实验药品:高锰酸钾双氧水洗洁精 实验仪器:搪瓷盘药匙烧杯量筒 实验过程:先向量筒中撒入一勺高锰酸钾,并加入几毫升的洗洁精,加一点水稀释一下,然后迅速向量筒中倒入过氧化氢,大量泡沫随之涌出。 ※注意事项:高锰酸钾与双氧水对皮肤都有一定的腐蚀性,实验时尽量不要总在自己的皮肤上,如果不慎弄在身上了要迅速用水洗净。反应结束后会有大量的泡沫,并且会带出高锰酸钾、二氧化锰等,请参赛者清洗干净。 ②碘钟反应(震荡反应的一种) 实验药品:双氧水碘酸钾硫酸淀粉丙二酸硫酸锰 实验仪器:玻璃棒烧杯量筒 实验过程:事先配制三种溶液A.102.5ml30%的双氧水溶液稀释至250ml B.10.7gKIO3加10ml 2mol/l的硫酸,稀释至250ml C.取0.075g淀粉溶于少量热水并加 3.9g丙二酸和0.845g硫酸锰稀释至250ml 。参赛者实验时用三支量筒分别量取A、B、C各50ml,同时加入至洁净的250ml烧杯,用玻璃棒略搅拌后静置。溶液的颜色会有规律的不断变化。 ※注意事项:该实验现象明显但不易成功,反应原理复杂,参赛者解说时不用对原理进行详细阐述
③超级烟火颜色反应的另一种版本 实验药品:氯酸钾小块单晶冰糖氯化钠氯化锂碳酸钾氯化钙氯化锶氯化钡等盐 实验仪器:搪瓷盘铁架台铁圈药匙大试管酒精灯火柴镊子实验过程:用药匙向试管中放入少量的氯酸钾晶体,再放入一点氯化钠等盐(一个试管只放一种特征颜色的盐),将试管倾斜夹在铁架台上,用酒精灯加热试管使盐彻底融化,然后用镊子夹一小块单晶冰糖放到试管中,激烈的反应随之开始,并产生特征的颜色个光。 ※注意事项:加热时要预热,试管口不能对着人,放入冰糖时一定要迅速,反应后实验者也后退,防止发生危险。反应后因试管可能受强热而断裂所以要在试管下方放着搪瓷盘承接,防止炙热物烫伤人。 ④火山爆发(重铬酸按生热分解) 实验药品:重铬酸铵镁条 实验仪器:搪瓷盘小烧杯火机药匙 实验过程:将重铬酸铵放到小烧杯中,中间插上镁条,将装满重铬酸铵的烧杯放在搪瓷盘上,点燃镁条,反应开始。 ※注意事项:点燃镁条后迅速将手拿开,反应结束后不要马上触摸烧杯,防止烫伤,待冷却后再将反应产物处理到制定容器中。 ⑤壮观的喷雾试验 实验药品:双氧水高锰酸钾 实验仪器:小烧杯锥形瓶药匙 实验过程:向锥形瓶中倒入一小烧杯的双氧水,再迅速向锥形瓶中放
