用ImageJ对Western DNA和Blot图片灰度分析

用ImageJ对W estern Blot图片灰度分析
教程收集于互联网来源中生网
The good news is that even if you don't have access t o a photo editing program such as Photoshop, you can now do all the same analyses using free programs. My favorite option is the freely available ImageJ from the National Institut es of Health.
The homepage for ImageJ is here: https://www.360docs.net/doc/018423511.html,/ij/index.html wherein you can find links t o the download, document ation, additional plugins and so on.
Once ImageJ is inst alled, open it up and open your scanned film file. We'll start the ImageJ section by duplicating the method outlined above for Phot oshop.
1. Open your file.
2. Under Image>Type click on 8-bit t o convert the image to grayscale.
3. Go to the menu Process>Subt ract Background. Try a rolling ball radius of 50. This removes some of the background coloration from your image.
4. Go to Analyze>Set Measurements, and click the boxes for Area, Mean Gray Value, and Int egrated D ensit y.
5. Go to Analyze>Set Scale, and ent er "pixels" in the box next t o Unit of length.
6. Go to Edit>Invert (or hit Ct rl+Shift+I) t o invert the colors on the image. Now the dark areas are light, and the light areas are dark. As outlined above, this has the benefit of making the measured values for bands increase with increasing prot ein expression.
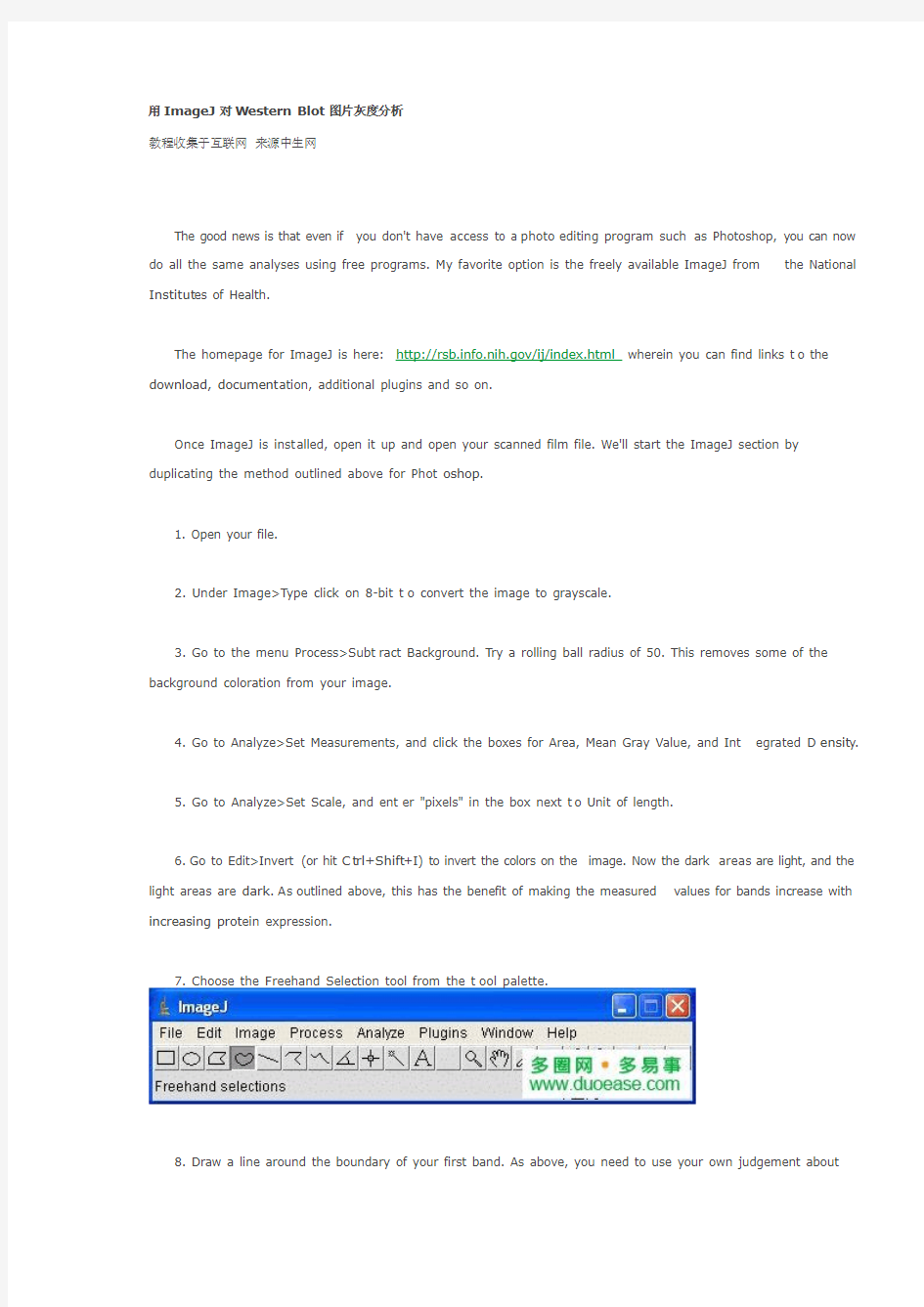
7. Choose the F reehand Selection tool from the t ool palette.
8. Draw a line around the boundary of your first band. As above, you need to use your own judgement about
where t he edges of the band are, and what is simply background noise.
9. Hit the m key to take a measurement of the enclose area that you select ed. The Result s window should pop up, and each of the measurements you select ed in step 4 should appear. Not e that the Integrated Density column is simply the Area and Mean Gray Value columns multiplied together.
10. Use the Freehand Selection tool to select the next band, and press m to take the measurement. Repeat this for each of you bands, including the st andard.
11. When you are finished, you can go to the Edit menu in the Results window, and choose Copy All. You can then paste the results into a spreadsheet for lat er use.
教你使用ImageJ分析电泳条带灰度比-ImageJ使用教程
ImageJ这套软件可以自动帮你你计算细胞数,也可以定量分析DNA电泳或是Western blot条带。
step 1.首先打开软件后,开启图档
step 2.请先做校正,选择Analyze底下的Calibrate选项,再选择校正的模式,使用Uncalibrate OD,再按ok
按下ok之后会出现校正的图形
Step 3.在要分析的第一条(first lane)加上一个长型框(工具列第一个选项),再按下Analyze/Gels/select first L ane快速键(Ctr+1),此时框架中会出现一个号码1,之后可以移动框架到第二个lane再选择Analyze/Gels/select second Lane快速键(Ctr+2),当然可以一直加下去,最后按Analyze/Gels/plot Lanes快速键(Ctr +3)。
Step 4.分析以后会出现图型表示你刚选择的框内的影像强度,此时可以看到有几个比较高的区段,就是我们想定量的band,使用直线工具(工具列第五个选项)先将图形中高点为有band的区域和没有band的区域分开再,使用魔术棒工具(工具列第八个选项)点选要分析的区域。
Step 5.当我们点选分析时,在result的对话视窗会出现分析的数据,依序点选就会出现每个band的值。
注:当我们选择分析的条带也可以是横向选取,就可以只比较相同大小的DNA的含量,同样也可以应用在western blot 或其它类似实验条带的分析上
mageJ是一个用Java语言开发的图像处理和分析平台,具备多种图像处理和分析功能, 下载地址:http://www.uhnresearch.ca/facilities/wci f/download.php。该软件是一个免费软件,支持插件技术,而且开放源代码。ImageJ在医学影像学诊断领域的应用非常广泛,以下就I该软件在医学显微图像处理方面(血清蛋白电图谱分析)的应用进行探讨,与战友们交流。
一、软件准备
下载并安装ImageJ: 得益于Java 的跨平台性优势,ImageJ可以运行在L inux、Mac OS和Windows等平台上,这也是该软件的一大优势,是其得以广泛应用的原因之一。ImageJ的运行需要JAV A运行环境(JRE11311或Java 11411SDK)的支持,从官方网站上下载的压缩包中已包含JRE11311。此外, 从SUN 的官方网站(下载地址: http: / /java1sun1com / j2 se / )还可以免费下载各种版本的JA V A运行
环境。运行ImageJ 最少需要64M内存,建议配置256M内存,这样在处理大幅图像或序列图像时就不会有停顿感。二、实验分析:
分析电泳图谱: (1)启动ImageJ ,打开采集的图像。用方形图像选择工具在图像上圈定一个电泳图谱(注意要将各个条带都全部框住) , 然后按1 键(相应的菜单操作为:Anal y ze→Gels→Select First Lane) ,标记和选定该电泳图谱。如果一幅图像上有多个电泳图谱,将鼠标放在该方框的中央,按住鼠标拖动方框(注意不要改变方框大小)将其放在下一个电泳图谱上,按2键(相应的菜单操作为: Anal y ze→Gels→Select Next Lane) ,分别标记和选定这些电泳图谱。(2)所有电泳图谱都标记完毕后,按3键(相应的菜单操作
为:Anal y ze→Gels→P lot Lanes)生成所有选定电泳图谱的光密度分布曲线。用直线工具在每一条曲线上划一条基线,使得曲线上的每一个波峰都能与基线围成一个封闭区域。如果生成的曲线较多,可以用手形工具上下移动图像执行此操作。(3)选用魔术棒工具,在曲线上的每一个波峰的封闭区域内单击鼠标,程序自动计算该封闭区域的面积,一个曲线上的所有波峰的面积都计算完毕后执行Analyze →Gels→Label P eaks,程序自动计算每一波峰的面积百分比,并标记在曲线上。此值即为该电泳图谱上各个条带的含量百分比。(4)一个电泳图谱分析完毕后,执行Analyze→Gels→ResetCounter将计数器回零,重复第3步操作,分析下一个电泳图谱的光密度曲线。统计学处理:用E xcel 2000进行t检验。
另有实例参考文献一篇,上传至QQ群共享邮箱。
用ImageJ对Western DNA和Blot图片灰度分析
用ImageJ对W estern Blot图片灰度分析 教程收集于互联网来源中生网 The good news is that even if you don't have access t o a photo editing program such as Photoshop, you can now do all the same analyses using free programs. My favorite option is the freely available ImageJ from the National Institut es of Health. The homepage for ImageJ is here: https://www.360docs.net/doc/018423511.html,/ij/index.html wherein you can find links t o the download, document ation, additional plugins and so on. Once ImageJ is inst alled, open it up and open your scanned film file. We'll start the ImageJ section by duplicating the method outlined above for Phot oshop. 1. Open your file. 2. Under Image>Type click on 8-bit t o convert the image to grayscale. 3. Go to the menu Process>Subt ract Background. Try a rolling ball radius of 50. This removes some of the background coloration from your image. 4. Go to Analyze>Set Measurements, and click the boxes for Area, Mean Gray Value, and Int egrated D ensit y. 5. Go to Analyze>Set Scale, and ent er "pixels" in the box next t o Unit of length. 6. Go to Edit>Invert (or hit Ct rl+Shift+I) t o invert the colors on the image. Now the dark areas are light, and the light areas are dark. As outlined above, this has the benefit of making the measured values for bands increase with increasing prot ein expression. 7. Choose the F reehand Selection tool from the t ool palette. 8. Draw a line around the boundary of your first band. As above, you need to use your own judgement about
ImageJ对WesternBlot进行灰度分析
Image J 对Western blot 条带进行灰度分析 Image J软件:Windows 版本 第一步:软件安装 1.下载地址:https://www.360docs.net/doc/018423511.html,/ij/download.html 2.下载windows 32位带Java版本,双击软件安装。 第二步:界面介绍 1.软件界面 第三步:图片分析 1.下图为样板图片 2.导入图片:File> Open> Sample1.jpg 图片导入后,Sample1.jpg在新的窗口中打开
3.图片类型设置:Image> Type> 8 bit 4.去除图片背景:Process> Subtract Background> …
4.1Subtract Background 窗口:Rolling ball radius 设为50 pixels, 勾选light background,可选preview,点击“OK”确定 5.工具栏:选择“矩形选框”
6.最大化“Sample1.jpg”窗口,便于矩形选择,矩形选择第一个泳道 7.标记“矩形选框”为1:矩形选择后,调整矩形至合适大小,按下数字键 “1”,或者Analyze> Gels> Select Fist Lane。 8.选择“泳道2”:拖动“1”的矩形框,会出现两个矩形选框,拖动矩形框 至泳道2,调整位置,并按下数字键“2”,Image J 会自动调整大小使“矩形框2”与“矩形框1”保持同一水平。 9.继续拖动,会出项新的“矩形选框”,调增至泳道3,并按下数字键“2” (注意:是按下数字键“2”),重复9至6个泳道全部选择。 10.所有泳道选择后,按下数字键“3”,出现分析图谱。
westernblot原理及步骤
westernblot原理及步骤 1.western blot 即蛋白免疫印迹( Western Blot) 是将电泳分离后的细胞或组织总蛋白质从凝胶转移到固相支持物NC膜或PVDF 膜上,然后用特异性抗体检测某特定抗原的一种蛋白质检测技术,现已广泛应用于基因在蛋白水平的表达研究、抗体活性检测和疾病早期诊断等多个方面。 2.原理 简单来说就是原理是通过特异性抗体对凝胶电泳处理过的细胞或生物组织样品进行着色。通过分析着色的位置和着色深度获得特定蛋白质在所分析的细胞或组织中表达情况的信息 3.步骤 (一)蛋白样品制备 培养的细胞(定性) 1.去培养液后用温的PBS冲洗2~3遍(冷的PBS有可能使细胞脱落)。 2.对于6孔板来说每孔加200~300uL,60~80℃的1×loading buffer。 3.刮下的细胞在EP管中煮沸10min,期间vortex 2~3次。 4.用干净的针尖挑丝,将团块弃掉,如果没有团块但有拉丝现象,可将EP管置于0℃后在 5.14000~16000g离心2min,再次挑丝。若无团块也无丝状物但溶液有些粘稠,可使用1ml注射器反 6.复抽吸来降低溶液粘滞度,便于上样。 7.待样品恢复到室温后上样。 培养的细胞(定量) 1.去培养液后用温的PBS冲洗2~3遍(冷的PBS有可能使细胞脱落)。
2.加入适量的冰预冷的裂解液后置于冰上10~20min。 3.刮下的细胞收集在EP管后超声(100~200w)3s,2次。 4.12000g离心,4℃,2min。 5.取少量上清进行定量。 6.将所有蛋白样品调至等浓度,充分混合沉淀后加loading buffer后直接上样最好,剩余溶液(溶于1×loading buffer)可以低温储存,-70℃一个月,-20℃一周,4℃1~2天,每次上样前98℃,3min。 (二)SDS-PAGE电泳 (1)清洗玻璃板 (2)灌胶与上样 (3)电泳 (三)转膜 (四)免疫反应 (五)化学发光,显影,定影 (六)凝胶图象分析将胶片进行扫描或拍照,用凝胶图象处理系统分析目标带的分子量和净光密度值。
用imagej进行WB定量分析
ImagJ是一款简单的图像处理与分析软件,可以用来进行WB定量分析。 一、利用ImagJ对WB条带进行灰度分析 1、File——》open 打开WB片子 2、把图片转化成灰度图片 image——》type——》8-bit 3、消除背景影响 process——》subtract background 选择50基本可以 4、设置定量参数 analyze——》set measurements,点击面积,平均密度和灰度值及Integrated Density 5、设置单位 analyze——》set scale ,在“unit of length”的方框里输入“pixels” 6、把图片转换成亮带,Edit——》invert 7、选择Freehand Selection,尽量把条带圈起来,点击键盘m,出来IntDen灰度值 当测定完所有条带,选结果中的“Edit ”的“SelectAll”,然后复制数据“IntDen”到Excel表即可进行分析 8、复制数据IntDen进行分析 二、利用ImagJ对WB条带进行密度分析 1、File——》open 打开WB片子 2、如条带不正,需修正 image——》transform——》rotate 调节angle值,直到条带水平为止 3、选中矩形选项,圈中第一个条带,然后analyze——》gels——》select first lane(快捷键ctrl+1),然后移动第一个条带上的矩形到第二个条带上,analyze——》gels——》select second lane(快捷键ctrl+2),最后analyze——》gels——》plotlanes 4、选中直线工具,将开口的波峰关闭 5、选中魔棒工具,点击波峰可以显示波峰下面积,即条带的密度值 6、以第一个数值为基数,其他数值与第一个数值的比值为相对密度 The protocol of imageJ for quantitative analysis of Western blotting: - open an image - transfer the image to 8-bits image → type: 8 bits - Process → substract background 50 - analyze → set measurements: pick area, mean gray value, integrated density. - analyze → set scale, fill “unit of length” with “pixels” - switch the image to bright bands edit → invert - freehand selection, choose the target area on the im age (e.g. a band), type a “m” for measurement, then we get the result from a new window. - after measuring all of the bands, pick the “edit” of the result window. “select all”, copy the integrated density values to excel to analyze.
westernblot详细图解
Western免疫印迹(Western Blot)是将蛋白质转移到膜上,然后利用抗体进行检测的方法。对已知表达蛋白,可用相应抗体作为一抗进行检测,对新基因的表达产物,可通过融合部分的抗体检测。 与Southern或Northern杂交方法类似,但Western Blot采用的是聚丙烯酰胺凝胶电泳,被检测物是蛋白质,“探针”是抗体,“显色”用标记的二抗。 经过PAGE分离的蛋白质样品,转移到固相载体(例如硝酸纤维素薄膜)上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶或同位素标记的第二抗体起反应,经过底物显色或放射自显影以
检测电泳分离的特异性目的基因表 达的蛋白成分。该技术也广泛应用 于检测蛋白水平的表达。 实验材料蛋白质样品 试剂、试剂盒丙烯酰胺SDS Tris-HCl β-巯基乙醇 ddH2O 甘氨酸Tris 甲醇PBS NaCl KCl Na2HPO4 KH2PO4 ddH2O 考马斯亮兰乙酸脱脂奶粉硫酸镍胺H2O2 DAB试剂盒 仪器、耗材 电泳仪电泳槽离心机离心管硝酸纤维素 膜匀浆器剪刀移液枪刮棒 实验步骤一、试剂准备 1. SDS-PAGE试剂:见聚丙烯酰胺凝胶电泳实验。 2. 匀浆缓冲液:1.0 M Tris-HCl(pH 6.8) 1.0 ml;10%SDS 6.0 ml;β-巯基乙醇0.2 ml;ddH2O 2.8 ml。 3. 转膜缓冲液:甘氨酸2.9 g;Tris 5.8 g;SDS 0.37 g;甲醇200 ml;加ddH2O定容至1000 ml。
westernblotting蛋白质印迹实验的流程
实用标准文案 细胞总蛋白的提取 (1)离心后,弃去上清液,将收集的细胞用手指轻弹重悬于剩余的少量上清液中,转移至1.5ml 离心管内,用1×PBS溶液洗涤2次,每次加入1mL PBS溶液,1000r/min,4℃离心5min,弃上层液体。洗涤两次后,将上清液完全去除,用手指轻弹细胞团,使其分散重悬(若不分散,则无法与裂解液充分混匀)。 (2)每管加入细胞团等体积的含蛋白酶抑制剂cocktail的RIPA细胞裂解液;如需检测磷酸化蛋白,则需另加入磷酸酶抑制剂。使细胞裂解液与细胞充分混匀,冰上裂解30min。如暂不提取蛋白,也可在洗涤细胞2次后加入含蛋白酶抑制剂cocktail和磷酸酶抑制剂的1×PBS约100μL,1000r/min,4℃离心5min后,完全弃上层液体,置于-80℃冰箱保存备用。 (3)冰上超声处理细胞,每次超声2s,间隔3s,约10-20次。 (4)13000r/min,4℃离心15min,收集上清溶液至另一干净并预冷的1.5mL离心管中,于-80℃冰箱保存备用。 2. BCA法测定蛋白质浓度 (1)配制工作液 根据标准品及待测样品的个数,按BCA试剂A和试剂B体积比为50:1配制足量BCA工作液,充分混匀,置于常温备用。 (2)配制标准品 取原标准品BSA(2mg/mL)约100μL,取出50μL,用ddH2O按对数法稀释成如下浓度:1mg/mL、0.5mg/mL、0.25 mg/mL、0.125 mg/mL、0.0625 mg/mL;设置96孔板第
一横排第一孔为空白孔,第二横排第一、二孔加入20μL 1×PBS,从第三横排起,精彩文档.实用标准文案 按浓度梯度由低到高依次取20μL标准品至96孔板中,每一浓度做2个平行孔。 (3)稀释待测样品 取5μl待测蛋白样品,用ddH2O稀释到50μL,分别取20μL至96孔板中,每一浓度做2个平行孔; (4)分别加入200μL BCA工作液到蛋白标准品及待测样品中,轻轻混匀,并去掉每孔中的气泡,置于温箱37℃孵育30min。 (5)将96孔板取出后用酶标仪测定OD570nm值。 (6)根据标准品的OD570nm值绘制标准曲线,并根据标准曲线计算得到待测样品的蛋白质浓度。 蛋白质变性 (1)根据预计将要上样的蛋白质样品质量(25μg-50μgμg,是蛋白质而定),取适量体积的蛋白质样品于预冷的EP管中,加入5×SDS上样缓冲液(体积约为蛋白质样品体积的25%),通过调节上样缓冲液的体积将各样品混合液的终体积调节至相仿。用封口膜将离心管封口,7000r/min离心点离样品混合液3s,使其混合均匀。 (2)将放置样品混合液的架子置于盛有适量dd H2O的磁盘中,用电磁炉加温至100℃,煮沸5min。点离样品,使其混合均匀。
westernblot原理及步骤
westernblot原理及步骤 Western blot基本原理: 在电场的作用下将电泳分离的多肽从SDS-PAGE凝胶转移至一种固相支持体,然后用这种多肽的特异抗体来检测。 Western blot应用: 目的蛋白的表达特性分析; 目的蛋白与其他蛋白的互作; 目的蛋白的组织定位; 目的蛋白的表达量分析; 蛋白样品的制备: 1 水溶液提取法:稀盐和缓冲系统的水溶液对蛋白质稳定性好、溶解度大,是提取蛋白质最常用的的溶剂,操作相对麻烦,重复性一般; 2 有机溶剂提取法; 3 离心管柱提取法:超快速,易用,高产及重复性强; 4 通过层析或电洗脱法制备目的蛋白。 Western blot注意事项和常见问题:
1 我的细胞提取液有的有沉淀,有的很清亮,为什么呢? 答:有沉淀可能因为你的蛋白没有变性完全,可以适当提高SDS 浓度,同时将样品煮沸时间延长;也不排除你的抗原浓度过高,这时再加入适量上样缓冲液即可。 2 我做的蛋白质分子量很小(10 KD),请问怎么做WB? 答:可以选择0.2 μm的膜,同时缩短转移时间。也可以将两张膜叠在一起,再转移。 3 最后显色时用DAB好还是ECM好? 答:DAB 有毒,但是比较灵敏,是HRP 最敏感的底物;ECM结果容易控制,但被催化时灵敏度差一点,但如果达到阀值,就特别灵敏,可以检测pg 级蛋白,具体可以根据你实验的情况。 4 要验证某个细胞上有无该蛋白的存在,需要做免疫组化和western blot试验吗?做这两个试验时的一抗和二抗可以共用吗? 答:①免疫组化可以用来进行定位,但是不能精确定量,而且有时会有假阳性,不易与背景区分;Western blot可以特异性检测某个蛋白质分子,进行定量,但是不能定位。
WB灰度值测定
Image J测到了WB条带灰度值关于用Image J量化westernblot条带灰度值,在网上一直盛传着两种操作方法,然鹅~小伙伴们却一直不确定到底哪种才是正确的测量灰度方法,甚至将灰度与光密度弄混淆。今天咱们一起就这个机会学习下,请先看看你是用以下那种方法测量灰度值?以下是两种方法的具体操作。 方法一:1、打开Image J软件→左上角file→Open 选择自己的条带图片(事先把条带摆正)2、把图片转化成灰度图片:Image→type→8-bit 3、第一个矩形工具→选上所有条带 4、analyze→Gels→select first lane→Gels→plot lanes(在这第四步也可以分开选取,如:框选第一个条带→analyze→Gels→select firstlane→将第一个框拖移到余下条带→Gels→select nextlane) 5、选中直线工具,将开口波峰关闭
6、选中魔棒工具(正数第七个),点击波峰,就得出所有area值。 方法二 1、打开Image J软件→左上角file→Open 选择自己的条带图片(事先条带弄正) 2、把图片转化成灰度图片:Image→type→8-bit 3、扣除背景:Process→Subtract Background→50pixels 并勾选Light Background 5、设定参数:Analyze→set measurement→勾选Area、Mean gray value、Min & max gray value、Integrated density 6、Analyze→set scale→unit of length选项里改为pixels,确定
蛋白质印迹法westernblot
蛋白质印迹法 蛋白质印迹法(免疫印迹试验)即Western Blot。它是分子生物学、生物化学和免疫遗传学中常用的一种实验方法。 其基本原理是通过特异性抗体对凝胶电泳处理过的细胞或生物组织样品进行着色。通过分析着色的位置和着色深度获得特定蛋白质在所分析的细胞或组织中表达情况的信息。 蛋白免疫印迹(Western Blot )是将电泳分离后的细胞或组织总蛋白质从凝胶转移到固相支持物NC膜或PVDF膜上,然后用特异性抗体检测某特定抗原的一种蛋白质检测技术,现已广泛应用于基因在蛋白水平的表达研究、抗体活性检测和疾病早期诊断等多个方面。 中文名蛋白质印迹法外文名Western Blot 蛋白免疫印迹Western Blot 类似方法1 Southern Blot 杂交方法 类似方法2 Northern Blot 杂交方法 使用材料聚丙烯酰氨凝胶电泳⑴
原理 与Southern Blot 或Northern Blot 杂交方法类似,但Western Blot法采用的是聚丙烯酰胺凝胶电泳,被检测物是蛋白质,“探针”是抗体,“显色”用标记的二抗。经过PAG(聚丙烯酰胺凝胶电泳)分离的蛋白质样品,转移到固相载体(例如硝酸纤维素薄膜)上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶或同位素标记的第二抗体起反应,经过底物显色或放射自显影以检测电泳分离的特异性目的基因表达的蛋白成分。该技术也广泛应用于检测蛋白水平的表达。⑴ 分类 Western Blot 显色的方法主要有以下几种: i. 放射自显影 ii. 底物化学发光ECL iii. 底物荧光ECF iv. 底物DAB呈色
(完整版)WesternBlot(免疫印迹法)实验方法步骤
Western Blot(免疫印迹法)实验方法步骤 发布日期:2008-8-25 热门指数:4360 Western Blot(免疫印迹法) 主要包括以下4个基本步骤: n 样品制备 n 电泳分离 n 蛋白的膜转移 n 免疫杂交与显色――蛋白检测 溶液和试剂 n 1X 磷酸盐缓冲液(PBS) n Modified RIPA buffer Tris-HCl: 50 mM, pH 7.4 ; NP-40: 1% ;Na-deoxycholate: 0.25% ;NaCl: 150 mM ;EDTA: 1 mM ;P MSF: 1 mM ;Aprotinin, leupeptin, pepstatin: 1 microgram/ml each ;Na3VO4: 1 mM ;NaF: 1 mM n 1X SDS 样品缓冲液 62.5 mM Tris-HCl (pH 6.8 于25°C), 2% w/v SDS, 10%甘油,50 mM DTT, 0.01% w/v溴酚蓝 n 转移缓冲液 25 mM Tris base, 0.2 M 甘氨酸, 20%甲醇(pH 8.3) n 10X Tris缓冲盐(TBS) 准备1L 10X TBS: 24.2 g Tris base, 80 g NaCl;用1N HCl调pH为7.6 n 脱脂奶粉或BSA n 甲醇 n TBS/T缓冲液 1X TBS, 0.1% Tween-20 n 封闭缓冲液(TBS/T)
1X TBS, 0.1% Tween-20加5% w/v脱脂奶粉或BSA n 一抗的稀释 1X TBS, 0.1% Tween-20 加5% BSA (多抗)或5%脱脂奶粉(单抗) Note:一般来说, BSA被推荐用于多克隆抗体,脱脂奶粉用于单克隆抗体,这样可得到较高的信噪比。抗体的稀释度参考抗体说明书或根据实验确定。 n 预染的蛋白质Marker,可用于监测转膜的效率 样品制备 原始样品可为细胞、组织、培养上清、免疫沉淀或亲和纯化的蛋白,以下为定性检测目的蛋白时细胞样品的处理方法,其余的样品制备方法参阅相关文献。 1.培养细胞或药物处理。 2.弃培养基,用1X PBS漂洗细胞2次,去尽残留培养基。 3.加入1X SDS样品缓冲液(6-well plate, 100 μl /w或75 cm2plate, 500-1000 μl/瓶),刮落细胞,转移到Ep管。注意:冰上操作。 4.超声10~15秒剪切DNA以减低样品粘性。 5.煮沸样品5 minutes。 6.离心12000g, 5 min,取上清。 7.电泳分离:上样15μl~20 μl 至SDS-PAGE 胶(10 cm x 10 cm)电泳。 如要定量检测某蛋白的表达水平,应用RIPA裂解液(1 ml per 107cells/100 mm dish/150 cm2flask)裂解细胞,收集裂解液至离心管中,在振荡器上混匀4~15min,14000g离心15min(4℃),弃沉淀,用B radford法或其它蛋白质测定方法测定上清中蛋白浓度以调整上样体积和上样量,进行Western杂交时还需设置内或外参照,通常用beta-actin。 注意:一般上样20~30 μg已足够,如待检蛋白为低丰度蛋白,可加大上样量至100μg,但电泳条带易拖尾,可制备亚细胞组份或采用更敏感的检测方法。 电泳分离(参照SDS-PAGE电泳方法) 转膜 杂交膜的选择是决定Western blot成败的重要环节。应根据杂交方案、被转移蛋白的特性以及分子大小等因素,选择合适材质、孔径和规格的杂交膜。用于Western blot的膜主要有两种:硝酸纤维素膜(NC) 和PVDF膜。NC膜是蛋白印迹实验的标准固相支持物,在低离子转移缓冲液的环境下,大多数带负电荷的蛋白质会与膜发生疏水作用而高亲和力的结合在一起,但在非离子型的去污剂作用下,结合的蛋白还可以被
WesternBlot结果条带分析
W e s t e r n B l o t结果条带 分析 Revised final draft November 26, 2020
W e s t e r n B l o t结果条带全面分析 1.空白 原因:比较多,如果单纯一张没有任何显色,最可能是一抗加成其他抗体,或者二抗种属加错了,比如兔的加成鼠的。 解决办法:仔细检查抗体是否加错,确认转膜没有问题。上面的图片展示的是一点信号都没有,如果是这样大部分情况是抗体加错了。如果中间出现了细微的条带,可能原因是蛋白上样量太少,一抗浓度过低,显色液失效。另外如果转膜出现了问题,比如膜放反了,自然是一个白片。 2.高背景 原因:封闭不够好,一抗浓度高,洗膜时间和次数不够。 解决办法:降低一抗浓度,增加洗膜时间和次数。 3.非特异性条带 原因:一抗非特异性与蛋白结合 解决办法:更换一抗 4.条带中出现边缘规则的白圈 原因:电转中膜和胶之间存在气泡。 解决办法:转膜前去掉膜和胶之间的气泡 5.出现黑点和黑斑 原因:膜上其他部位与一抗或者二抗非特异性结合 解决办法:封闭结束之后要洗。 6.条带拖尾 原因:蛋白量太大,一抗浓度和时间太长 解决办法:根据情况调整蛋白量,同时一抗浓度和时间也可以缩短。 7.出现非均一性背景 原因:膜可能曾经干过 解决办法:在每一步的操作过程中,都需要注意不要让膜干。 8.某个条带变形 原因:SDSPAGE胶中存在气泡或者某不溶性颗粒 解决办法:配胶过程中要小心,使用无杂质的液体。另外配胶用的水,SDS,Tris缓冲液要注意不要有杂质。 9.条带呈哑铃状 原因:配置胶有问题,胶凝固后不均一 解决办法:把胶配好,不合格的胶坚决不用 10.最边缘条带弯曲 原因:电泳电流不均一 解决办法:换用新的电泳槽;不使用两边的两孔 其他问题 (1)蛋白分子量偏高或者偏低。可能是胶的浓度与目的蛋白的浓度不对应。 (2)蛋白质降解。蛋白质降解后很可能会在比原来位置低的地方出现主带,然后会出现一些其他带,最主要特点是所有的条带比正常的都低,并且条带模糊不清晰。 (3)所有条带连成一片没有间隔。原因最可能是上样量过多,其次是样品弥散(比如电泳长时间停止样品弥散)。 (4)整个条带呈“︶”状:凝胶冷却不均一,电泳槽老化。 (5)整个条带呈“︵”:凝胶左右两头没有凝固好 (6)溴酚蓝拖尾:样品溶解不好。 (7)纵向的纹理:上样样品中存在不溶性颗粒 (8)溴酚蓝很粗:浓缩胶浓缩效果不好,可能是浓缩胶太短,或者是浓缩胶配错。
westernblot详细图解详细版.docx
Western免疫印迹(Western Blot) 是将蛋白质转移到膜上,然后利用 抗体进行检测的方法。对已知表达 蛋白,可用相应抗体作为一抗进行 检测,对新基因的表达产物,可通 过融合部分的抗体检测。 与Southern或Northern杂交方法 类似,但Western Blot采用的是聚 丙烯酰胺凝胶电泳,被检测物是蛋 白质,“探针”是抗体,“显色”用标记 的二抗。 经过PAGE分离的蛋白质样品,转 移到固相载体(例如硝酸纤维素薄 膜)上,固相载体以非共价键形式 吸附蛋白质,且能保持电泳分离的 多肽类型及其生物学活性不变。以 固相载体上的蛋白质或多肽作为抗 原,与对应的抗体起免疫反应,再 与酶或同位素标记的第二抗体起反 应,经过底物显色或放射自显影以 检测电泳分离的特异性目的基因表 达的蛋白成分。该技术也广泛应用 于检测蛋白水平的表达。 实验材料蛋白质样品 试剂、试剂盒丙烯酰胺SDS Tris-HCl β-巯基乙醇 ddH2O 甘氨酸Tris 甲醇PBS NaCl KCl Na2HPO4 KH2PO4 ddH2O 考马斯亮兰乙酸脱脂奶粉硫酸镍胺H2O2 DAB试剂盒 仪器、耗材电泳仪电泳槽离心机离心管硝酸纤维素膜匀浆器剪刀移液枪刮棒 实验步骤一、试剂准备 1. SDS-PAGE试剂:见聚丙烯酰胺凝胶电泳实验。 2. 匀浆缓冲液:1.0 M Tris-HCl(pH 6.8) 1.0 ml;10%SDS 6.0 ml;β-巯基乙醇0.2 ml;ddH2O 2.8 ml。 3. 转膜缓冲液:甘氨酸2.9 g;Tris 5.8 g;
SDS 0.37 g;甲醇200 ml;加ddH2O定容至1000 ml。 4. 0.01 M PBS(pH7.4):NaCl 8.0 g;KCl 0.2 g;Na2HPO4 1.44 g;KH2PO4 0.24 g;加ddH2O至1000 ml。 5. 膜染色液:考马斯亮兰0.2 g;甲醇80 ml;乙酸2 ml;ddH2O118 ml。包被液(5%脱脂奶粉,现配):脱脂奶粉1.0 g 溶于20 ml的0.01 M PBS中。 6. 显色液:DAB 6.0 mg;0.01 M PBS 10.0 ml;硫酸镍胺0.1 ml;H2021.0 μl。 二、蛋白样品制备 1. 单层贴壁细胞总蛋白的提取 (1)倒掉培养液,并将瓶倒扣在吸水纸上使吸水纸吸干培养液(或将瓶直立放置一会儿使残余培养液流到瓶底然后再用移液器将其吸走)。 (2)每瓶细胞加3 ml 4℃预冷的PBS (0.01M pH7.2~7.3)。平放轻轻摇动1 min 洗涤细胞,然后弃去洗液。重复以上操作两次,共洗细胞三次以洗去培养液。将PBS弃净后把培养瓶置于冰上。 (3)按1ml裂解液加10 μl PMSF(100 mM),摇匀置于冰上。(PMSF要摇匀至无结晶时才可与裂解液混合。) (4)每瓶细胞加400 μl含PMSF的裂解液,于冰上裂解30 min,为使细胞充分裂解培养瓶要经常来回摇动。 (5)裂解完后,用干净的刮棒将细胞刮于培养瓶的一侧(动作要快),然后用枪将细胞碎片和裂解液移至1.5 ml离心管中。(整个操作尽量在冰上进行。) (6)于4℃下12000 rpm离心5 min。(提
WesternBlot原理和操作方法(全)讲解
Western Blot 原理和操作方法(全) Western Blot 工作原理 蛋白质的电泳分离是重要的生物化学分离纯化技术之一,电泳是指带电粒子在电场作用下,向着与其电荷相反的电极移动的现象.根据所采用的支持物不同,有琼脂糖凝胶电泳,淀粉凝胶电泳,聚丙烯酰胺凝胶电泳等.其中,聚丙烯酰胺凝胶电泳(PAGE)由于无电渗作用,样品用量少(1-100μg),分辨率高,可检出10-9-10-12mol 的样品,凝胶机械强度大,重复性好以及可以通过调节单体浓度或单体与交联剂的比例而得到孔径不同的凝胶等优点而受到广旱挠τ? SDS-PAGE是最常用的定性分析蛋白质的电泳方式,特别是用于蛋白质纯度检测和测定蛋白质分子量. PAGE能有效的分离蛋白质,主要依据其分子量和电荷的差异,而SDS-PAGE(SDS 变性不连续聚丙烯酰胺凝胶电泳)的分离原理则仅根据蛋白质的分子量的差异,因为SDS-PAGE的样品处理液是在要跑电泳的样品中假如含有SDS和巯基乙醇(2-ME)或二巯基赤藓醇(DTT),其可以断开半胱氨酸残基之间的二硫键,破坏蛋白质的四级结构,SDS是一种阴离子表面活性剂即去污剂,它可以断开分子内和分子间的氢键,破坏蛋白质分子的二级及三级结构,并与蛋白质的疏水部分相结合,破坏其折叠结构,电泳样品假如样品缓冲液后,要在沸水中煮3-5分钟使SDS与蛋白质充分结合形成SDS-蛋白质复合物,SDS-蛋白质复合物在强还原剂巯基乙醇存在时,蛋白质分子内的二硫键被打开而不被氧化,蛋白质也完全变性和解聚,并形成榛状结构,稳定的存在于均一的溶液中,SDS与蛋白质结合后使SDS-蛋白质复合物上带有大量的负电荷,平均每两个氨基酸残基结合一个SDS分子,这时各种蛋白质分子本身的电荷完全被SDS掩盖,远远超过其原来所带的电荷,从而使蛋白质原来所带的电荷可以忽略不计,消除了不同分子之间原有的电荷差别,其电泳迁移率主要取决于亚基分子质量的大小,这样分离出的谱带也为蛋白质的亚基. 样品处理液中通常加入溴酚蓝染料, 溴酚蓝指示剂是一个较小的分子,可以自由通过凝胶孔径,所以它显示着电泳的前沿位置,当指示剂到达凝胶底部时,即可停止电泳. 另外样品处理液中也可加入适量的甘油或蔗糖以增大溶液密度,使加样时样品溶液可以沉入样品加样槽底部. 重要参数 ①聚丙烯酰胺凝胶(PAG)制备原则:由于孔径的大小取决于单体和双体丙烯酰胺在凝胶中的总浓度(T)以及双体占总浓度的百分含量即交联度(C)决定的,因而制胶之前必须首先知道这两个参数.一般可以由下述公式计算: T%=(a+b)/m*100%; 和C%=a/(a+b)*100% 其中: a=双体(bis)的重量;b=单体(arc)的重量;m=溶液的体积(ml) ②当分析一个未知样品时,常常先用7.5%的标准凝胶制成4-10的梯度凝胶进行试验,以便选择理想的胶浓度.如果蛋白质的分子量已知,可参考下表选择所需凝胶浓度: 蛋白质分子量范围(Da) 适宜的凝胶浓度(%) <104 20-30
Westernblot实验步骤及注意事项
Westernblot实验步骤及注意事项 Westernblot 实验步骤 1. 组织块称重 2. 利用液氮、研钵粉碎组织块 3. 加入RIPA缓冲液(每克组织3 ml RIPA),PMSF(每克组织30μl,10 mg/ml PMSF),利用Polytron进一步匀浆(15,000转/分*1分钟)维持4℃ 4. 加入PMSF(每克组织30μl,10 mg/ml PMSF),冰上孵育30分钟 5. 移入离心管4℃约20,000 g(约15,000转)15分钟 6. 上清液为细胞裂解液可分装-20℃保存 7. 进行Bradford比色法测定蛋白质浓度 8. 取相同质量的细胞裂解液(体积*蛋白质浓度),并加等体积的2×电泳加样缓冲液 9. 沸水浴中3分钟 10. 上样 11. 电泳(浓缩胶20mA,分离胶35mA) 12. 电转膜仪转膜(100mA 40分钟) 13. 膜用丽春红染色,胶用考马斯亮蓝染色 14. Westernblot 试剂盒显色 15. 分析比较记录 western blot的实验步骤及注意事项的资料 1. 把聚丙烯酰胺凝胶中的蛋白质电泳转移到硝酸纤维膜上。 1)转移缓冲液洗涤凝胶和硝酸纤维素膜,将硝酸纤维素膜铺在凝胶上,用5ml移液管在凝胶上来回滚动去除所有的气泡。 2)在凝胶/滤膜外再包一张3mm滤纸(预先用转移缓冲液浸湿),将凝胶夹在中间,保持湿润和没有气泡。薄膜滤纸按照厂家建议方法放入电泳装置中,凝胶面向阴极。/凝胶/)将此滤纸3.
4)将上述装置放入缓冲液槽中,并灌满转移缓冲液以淹没凝胶。 5)按照厂家所示接通电源开始电泳转移。 6)转移结束后,取出薄膜和凝胶,弃去凝胶。 2. 将薄膜漂在氨基黑中快速染色,直至分子量标准显现时取出,记录下标准位置。 3. 用100ml水洗涤纤维素膜,必要时可用脱色缓冲液。 4. 膜置印迹缓冲液中于37℃保温1小时。 5. 室温下,用PBS-Tween缓冲液洗涤薄膜。 6. 用封口机将薄膜封入塑料袋中,尽可能不留空气。 7.袋的一角剪一缓冲液的小口,用透析袋夹紧。 8.混合:NGS(100微升),印迹缓冲液中的抗体(10毫升),加在装薄膜的袋中,于室温下摇动2小时(或4℃过夜) 9.用总体积300ml PBS-Tween缓冲液,分4次在一浅盘中洗涤薄膜,每次75ml。 10.将连接生物素的羊抗兔IgG(40微升溶于10毫升印迹缓冲液/100微升NGS)加在袋内,于室温下摇动1小时。 11.按步骤9洗涤。 12.加入抗生素蛋白-HRP(40微升溶于10毫升印迹缓冲液/100微升NGS),于室温下摇动。 注意事项: western blot中转移在膜上的蛋白处于变性状态,空间结构改变,因此那些识别空间表位的抗体不能用于western blot检测。这种情况可以将表达目的蛋白的细胞或细胞裂解液中的所有蛋白先生物素化,再用酶标记亲和素进行western blot。实验中取胶和膜需带手套。 Western实验步骤 Western,也称Western blot、Western blotting、Western印迹,是用抗体检测蛋白的重要方法之一。Western 可以参 考如下步骤进行操作。 1. 收集蛋白样品(Protein sample preparation) O 可以使用适当的裂解液,例如碧云天生产的Western及IP细胞裂解液,裂解贴壁细胞、悬浮细胞或组织样品。对于某些特定的亚 细胞组份蛋白,例如细胞核蛋白、细胞浆蛋白、线粒体蛋白等,可以参考相关文献提取这些亚细胞组份蛋白,也可以使用试剂盒 进行抽提,例如碧云天生产的细胞核蛋白与细胞浆蛋白抽提试剂盒。 O 收集完蛋白样品后,为确保每个蛋白样品的上样量一致,需要测定每个蛋白样品的蛋白浓度。根据所使用的裂解液的不同,需要 采用适当的蛋白浓度测定方法。因为不同的蛋白浓度测定方法对于一些去垢剂和还原剂等的兼容性差别很大。如果使用碧云天生
两分钟学习凝胶分析软件BandScan
两分钟学习凝胶分析软件BandScan(Step by step ) 转载请注明来自丁香园 发布日期: 2005-07-02 12:14 文章作者: palmyard 文章编辑: admin Step by step to BandScan >>By Palmyard. 按:现在有很多常用的分子生物学软件,但对于初学者,尤其是不太擅长计算机者,使用起来有相当难度。琢磨说明书,或者自己一点点试验,难免觉得头绪纷繁,乃至兴味索然。后来我发现,其实用一个实例,从头到尾示范一遍,可以在几分钟内直观地学会这个软件的基本使用方法。其他的一些情况就可以自己去摸索了,这样学起来很快。因此我打算做一个常用分子生物学软件STEP BY STEP的系列。这个想法在心里很久了,但是一直没有时间付诸实践,的确是因为没有较为空闲的时间。今天就从BandScan这个软件开始。由于不是很熟悉制作过程,奋战一整天,终于完成了第一个实例学习。 BandScan是一个很常用的凝胶图像分析软件,我们用它重要是为了分析蛋白表达量。现在,我就以我自己表达的一个蛋白图,来示范这个软件分析的过程。最后结果是得到目的蛋白占总蛋白的百分数。 1.安装软件BandScan5.0。主程序可以在网上找到(请搜索以往的帖子或用google搜索BandScan_dl.exe)。安装以后加个补丁(如果找不到补丁可以email我zhuzhang@https://www.360docs.net/doc/018423511.html,,这有4.3、4.5和5.0的补丁,请尽量自己先找一下)。 2.安装好以后就会在桌面上出现BandScan的图标。双击打开。 3.打开后的界面如图。
.打开一张扫描好的电泳图。BandScan可以识别TIF和JPG格式的图片,很方便。打开工具栏上的file/open tiff,jpg file format,选中待分析的图片。
最详细的WesternBlot过程步骤详解
最详细的W e s t e r n B l o t 过程步骤详解
最详细的W e s t e r n B l o t 过程步骤详解 Pleasure Group Office【T985AB-B866SYT-B182C-BS682T-STT18】
Western Blot详解(原理、分类、试剂、步骤及问题解答) Western免疫印迹(Western Blot)是将蛋白质转移到膜上,然后利用抗体进行检测。对已知表达蛋白,可用相应抗体作为一抗进行检测,对新基因的表达产物,可通过融合部分的抗体检测。 本文主要通过以下几个方面来详细地介绍一下Western Blot技术: 一、原理 二、分类 i.放射自显影 ii.底物化学发光ECL ECF iv.底物DAB呈色 三、主要试剂 四、主要步骤 五、实验常见的问题指南 1.参考书推荐 2.针对样品的常见问题 3.抗体 4.滤纸、胶和膜的问题 的相关疑问 6.染色的选择 7.参照的疑问
8.缓冲液配方的常见问题 9.条件的摸索 10.方法的介绍 11.结果分析 一、原理 与Southern或Northern杂交方法类似,但Western Blot采用的是聚丙烯酰胺凝胶电泳,被检测物是蛋白质,“探针”是抗体,“显色”用标记的二抗。经过PAGE分离的蛋白质样品,转移到固相载体(例如硝酸纤维素薄膜)上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶或同位素标记的第二抗体起反应,经过底物显色或放射自显影以检测电泳分离的特异性目的基因表达的蛋白成分。该技术也广泛应用于检测蛋白水平的表达。 二、分类 现常用的有底物化学发光ECL和底物DAB呈色,体同水平和实验条件的是用第一种方法,目前发表文章通常是用底物化学发光ECL。只要买现成的试剂盒就行,操作也比较简单,原理如下(二抗用HRP标记):反应底物为过氧化物+鲁米诺,如遇到HRP,即发光,可使胶片曝光,就可洗出条带。
分析测量图象软件Imagepro(DOC)
分析测量图象软件Imagepro-Plus教程 一、入门 Imageproplus(IPP)的主要用途是分析测量图象。本人使用该程序进行生物图象分析有一段时间,写此帖的主要目的还是与大家交流使用心得,并总结一下使用方法。 如果你是刚接触IPP,最好先从本帖看起,并同时打开你电脑上的IPP程序照着操作。学会一个软件需要花一段时间的,两分钟不可能学会。两小时也太短。但我相信,照着我这几个帖子作下来,至少是可以用IPP干一点事情了。 打开IPP后的界面是这样的,该从何处下手呢?
既然是处理图片,当然是先要打开一张要处理的图片嘛 这张照片中的黄色部分是免疫组化染色的阳性表达成分。处理目标是通过测量图片中黄色部分的"黄"度来反映相应蛋白表达的的“量”。对该图片进行观察,可以看到图片中主要有三种主要颜色,一是染成蓝色的细胞核,二是呈现出黄色的胞浆,三是细胞间的空隙区域,呈现出浅蓝色,是为背景。 所以首先要把图片中呈现黄色的区域给挑选出来,这部分区域是我们最感兴趣的地方,叫作AOI(area of interest)。AOI是IPP中最有用最重要的概念。如何能够准确地选取AOI就是使用IPP的关键操作。一旦准确地选取了AOI,下面的测量分析就好办了。 对不同的图片,需灵活地使用各种适当的AOI工具,就这张图片来说,AOI是黄色区域,因此用颜色分类的AOI工具是最有效的。 点击measure---count/size,弹出分类测量窗口
在窗口中选中manual,再点击select color,弹出颜色选择窗口segmentation,这个工具是IPP最有特色的颜色选取工具之一。用好这个工具是使用IPP的要点。
