Synthesis of olivine LiFePO4 cathode materials by mechanical alloying using iron(III) raw material

Journal of Power Sources 146(2005)
534–538
Synthesis of olivine LiFePO 4cathode materials by mechanical
alloying using iron(III)raw material
Cheol Woo Kim a ,?,Moon Hee Lee a ,Woon Tae Jeong b ,Kyung Sub Lee a
a
Department of Materials Science and Engineering,Hanyang University,Seoul 133-791,Korea b
Eco-nano Research Center,Korea Institute of Science and Technology(KIST),Seoul 130-650,Korea
Available online 31May 2005
Abstract
Olivine LiFePO 4has been produced using Fe 2O 3raw material by mechanical alloying (MA)and subsequent ?ring.X-ray diffraction (XRD)and M¨o ssbauer spectroscopy analysis revealed that LiFePO 4prepared by MA had a well-ordered olivine-type LiFePO 4structure with an ionic state of Fe 2+by the reduction of Fe 3+precursor.It showed a maximum discharge capacity of 160mAh g ?1at C/20(8.5mA g ?1)when cycled from 2.5to 4.3V .Compared to the LiFePO 4prepared by conventional solid-state method,MA synthesized LiFePO 4a displayed higher charge/discharge capacity and more stable cycle life because of the improvement of the electronic conductivity.It was originated from uniformly distributed ?ne particles and an increased speci?c surface area by MA process.?2005Elsevier B.V .All rights reserved.
Keywords:LiFePO 4;Cathode material;Olivine-type iron phosphate;Mechanical alloying
1.Introduction
Olivine-type LiFePO 4have been known as an interesting cathode material for lithium ion batteries since it was ?rst pro-posed by Padhi et al.[1]because of its low cost and safety.The early drawback with LiFePO 4was its extremely low elec-tronic conductivity.Many works have been reported that the poor electrical conductivity of LiFePO 4can be overcome by adding conductive carbon and by treating the particle surface with nanocrystalline carbon [2–5].But these approaches of adding conductive carbon led to a loss in energy density due to the electrochemically inertness of the carbon.Also the use of the Fe 2+precursor compound is relatively high cost and has problems for mass production.
Recently,Barker et al.[6]reported that LiFePO 4and LiFe 0.9Mg 0.1PO 4were synthesized by a carbothermal reduction (CTR)technique,which is based on the C →CO transition,starting with Fe 2O 3that is very cheap and readily available.In the present study,the same concept has been applied to the technique of mechanical alloying (MA)
?
Corresponding author.Tel.:+82222814914;fax:+82222814914.E-mail address:water?ower 00@https://www.360docs.net/doc/0113562947.html, (C.W.Kim).
process.Previously,we have reported on the effectiveness of synthesizing LiFePO 4and LiFePO 4/C composite from a Fe 2+precursor by mechanical alloying (MA)[7].In this work,LiFePO 4was synthesized from Fe(III)by MA and subsequent ?ring under the assumption that the following reaction occurred:
LiOH ·H 2O +0.5(Fe 2O 3)+(NH 4)2H ·PO 4+0.5C →LiFePO 4+3H 2O +2(NH 3)+0.5CO
(1)
The electrochemical properties and cycle life of prepared powders were investigated and compared with those of a sample synthesized by conventional solid-state reaction.2.Experimental
LiOH ·H 2O (Aldrich,≥98%),Fe 2O 3(Aldrich,≥99%),(NH 4)2H ·PO 4(Aldrich,≥99%),and acetylene black pow-ders were used as starting materials.The MA process was carried out for 4h under argon atmosphere using a shaker type ball miller (SPEX 8000M)rotating at around 1000rpm.Detailed MA conditions were described in a previous study
0378-7753/$–see front matter ?2005Elsevier B.V .All rights reserved.doi:10.1016/j.jpowsour.2005.03.058
C.W.Kim et al./Journal of Power Sources146(2005)534–538535
[7].The mechanical-alloyed powders were then?red from 500to900?C for30min in a tube-type vacuum furnace at a pressure10?6Torr.For comparison,another LiFePO4sam-ple was prepared by the solid-state reaction under different ?ring condition.The mixture,which the same starting ma-terials were thoroughly mixed in an agate mortar,was?rst decomposed at450?C for5h and then reground and?red at 900?C for10h(denoted as SS450+900),which was the two-step?ring condition employed in the conventional solid-state reaction process.
The crystal structures of the prepared sample powders were characterized by X-ray diffraction(Rigaku D-MAX 3000)using Cu K?radiation.The M¨o ssbauer spectra were recorded(Austin Science,Inc.,USA)using57Co in Rh ma-trix as the source of radiation at room temperature.The powder morphology and particle size distribution were in-vestigated by?eld emission scanning electron microscopy (FE-SEM),and a particle size analyzer(PSA).The spe-ci?c surface area of the powder particles was measured by Brunauer–Emmett–Teller(BET),and the electrical conduc-tivity of the prepared samples was also measured by a four-point probe method.
The cathodes used for electrochemical characterization were fabricated by blending the prepared active material pow-ders with carbon black and polytetra?uoroethylene(PTFE) binder in a weight ratio of75:20:5.Two-electrode electro-chemical cells consisting of lithium metal foil as the negative electrode,polypropylene separator,and an electrolyte of1M LiPF6in EC:DMC(1:1,vol.)were assembled in an argon-?lled glove box.The electrochemical cycle tests were per-formed using an automatic galvanostatic charge–discharge unit(Maccor series4000)at various C rates,C/x(x=1,5, 10,20)(1C=170mA g?1)between2.5and4.3V at ambient temperature(25±2?C).
3.Results and discussion
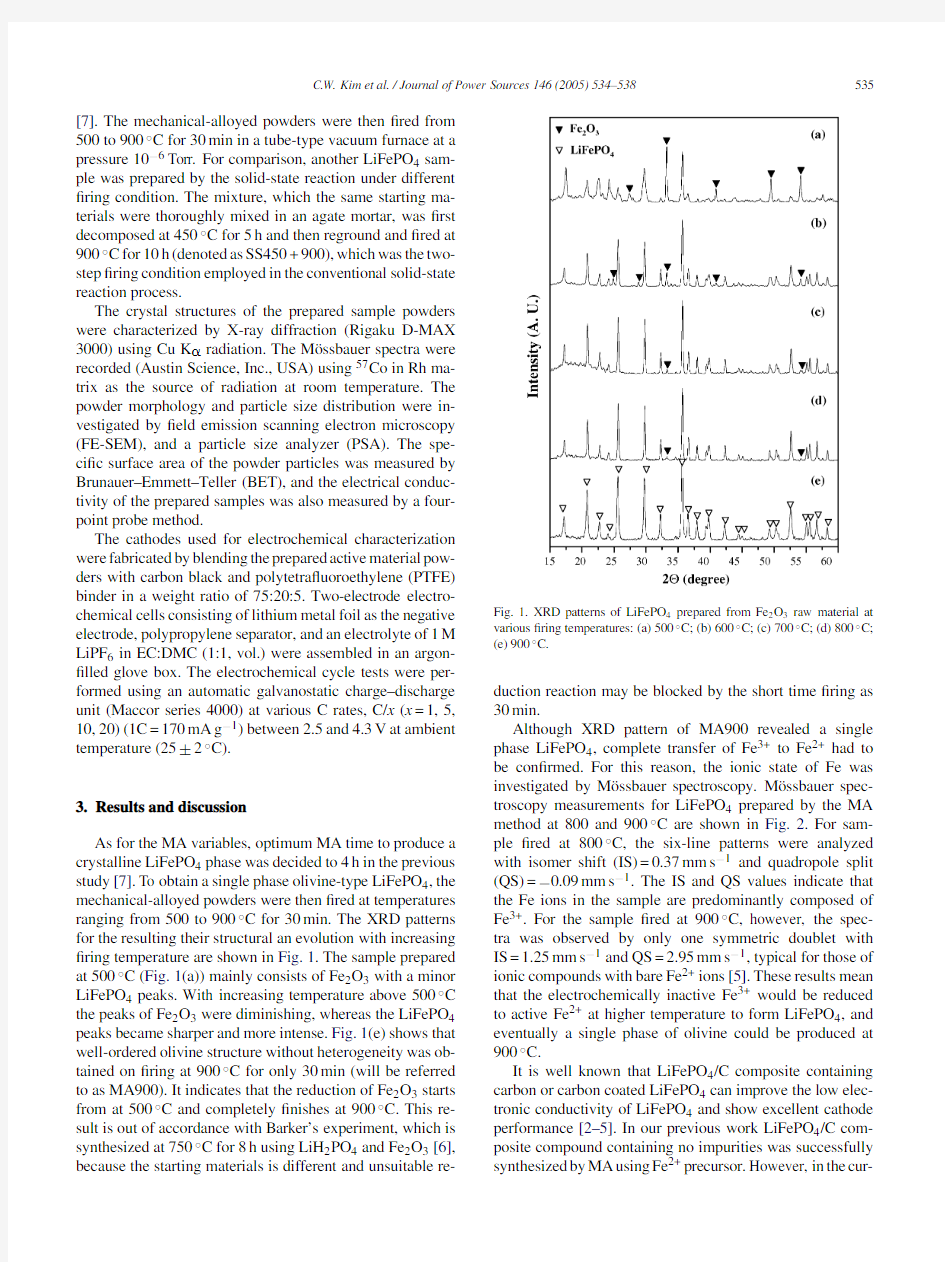
As for the MA variables,optimum MA time to produce a crystalline LiFePO4phase was decided to4h in the previous study[7].To obtain a single phase olivine-type LiFePO4,the mechanical-alloyed powders were then?red at temperatures ranging from500to900?C for30min.The XRD patterns for the resulting their structural an evolution with increasing ?ring temperature are shown in Fig.1.The sample prepared at500?C(Fig.1(a))mainly consists of Fe2O3with a minor LiFePO4peaks.With increasing temperature above500?C the peaks of Fe2O3were diminishing,whereas the LiFePO4 peaks became sharper and more intense.Fig.1(e)shows that well-ordered olivine structure without heterogeneity was ob-tained on?ring at900?C for only30min(will be referred to as MA900).It indicates that the reduction of Fe2O3starts from at500?C and completely?nishes at900?C.This re-sult is out of accordance with Barker’s experiment,which is synthesized at750?C for8h using LiH2PO4and Fe2O3[6], because the starting materials is different and unsuitable
re-Fig.1.XRD patterns of LiFePO4prepared from Fe2O3raw material at various?ring temperatures:(a)500?C;(b)600?C;(c)700?C;(d)800?C;
(e)900?C.
duction reaction may be blocked by the short time?ring as 30min.
Although XRD pattern of MA900revealed a single phase LiFePO4,complete transfer of Fe3+to Fe2+had to be con?rmed.For this reason,the ionic state of Fe was investigated by M¨o ssbauer spectroscopy.M¨o ssbauer spec-troscopy measurements for LiFePO4prepared by the MA method at800and900?C are shown in Fig.2.For sam-ple?red at800?C,the six-line patterns were analyzed with isomer shift(IS)=0.37mm s?1and quadropole split (QS)=?0.09mm s?1.The IS and QS values indicate that the Fe ions in the sample are predominantly composed of Fe3+.For the sample?red at900?C,however,the spec-tra was observed by only one symmetric doublet with IS=1.25mm s?1and QS=2.95mm s?1,typical for those of ionic compounds with bare Fe2+ions[5].These results mean that the electrochemically inactive Fe3+would be reduced to active Fe2+at higher temperature to form LiFePO4,and eventually a single phase of olivine could be produced at 900?C.
It is well known that LiFePO4/C composite containing carbon or carbon coated LiFePO4can improve the low elec-tronic conductivity of LiFePO4and show excellent cathode performance[2–5].In our previous work LiFePO4/C com-posite compound containing no impurities was successfully synthesized by MA using Fe2+precursor.However,in the cur-
536 C.W.Kim et al./Journal of Power Sources146(2005)
534–538
Fig.2.M¨o ssbauer spectra of the LiFePO4prepared by MA and subsequent ?red at800and900?C,respectively.
rent study,the specimen prepared with3wt.%carbon using Fe2O3raw material revealed the presence of second phase of Fe2P as shown in Fig.3(a).When a large amount of carbon is added in excess of12wt.%,most of the LiFePO4disappeared and iron phosphide was predominantly produced(Fig.3(b)). It seemed that carbon in excess of the stoichiometric amount shown in Eq.(1)reduced the phosphate and generated Fe2P as follows Eq.(2).
Fe2O3+PO4+7C→Fe2P+7CO(2) On the other hand,SS450+900prepared by convention
solid-state method through two-step and long time heat
treat-
Fig.3.XRD patterns of(a)LiFePO4/C composite compound(3wt.%)and (b)LiFePO4/C composite compound(12wt.%),(b)LiFePO4prepared con-ventional solid-state reaction
method.
Fig.4.SEM images of MA900and SS450+900.
ment produced single phase LiFePO4with no second phase (Fig.3(c)).
Electron micrographs of LiFePO4prepared by the MA and SS methods are presented in Fig.4.The particle size distri-bution of MA900ranged from0.1to2?m,while that of the SS450+900ranged from around1–10?m with non-uniform morphology.The particle size distributions of the samples were in good agreement with the results determined by PAS. The results of the mean particle size determined by PSA,sur-face area by BET,and electronic conductivity for MA900and SM450+900are summarized in Table1.The MA900particle size was much smaller,whereas their surface area and elec-tronic conductivity were higher than SS450+900particles. It is considered that MA process can reduce the particle size by the high energy ball milling and by a markedly reduced ?ring time.This would cause the surface area of LiFePO4to increase,which would enhance the electronic conductivity. These results correspond well with the study of Yamada et al.[5]who reported that improvements in the conductivity could be achieved by synthesizing small and homogeneously sized powders.
The second charge and discharge curves of the Li/LiFePO4 cells obtained from the MA and SS methods are shown in Fig.5.The cells were cycled between2.5and4.3V at a cur-rent density of C/20(8.5mA g?1)rate.Typical two-phase reactions between LiFePO4and FePO4with a3.4V plateau were observed in both samples[1].The discharge capacity
C.W.Kim et al./Journal of Power Sources 146(2005)534–538
537
Table 1
The powder properties of LiFePO 4prepared by different synthesis method Sample ID Synthesis condition
Surface area (m 2g ?1)Ave.particle size (?m)Electronic conductivity (S cm ?1)MA900MA+900?C,30min
8.5 1.45 1.2×10?7SS450+900
Simple mixture (450?C,5h +900?C,10h)
1.2
5.78
1.7×10?
9
Fig.5.The charge/discharge curves of MA900and SS450+900at C/20rate.
of the SS450+900sample was 130mAh g ?1,which is 76%level of the theoretical capacity.On the other hand,MA900exhibited excellent cell performance with a discharge capac-ity of 160mAh g ?1,which is 94%level of the theoretical ca-pacity.The discharge capacity of MA900is similar or higher discharge capacity than LiFePO 4/C composite compound re-ported in the recent studies [8–11].
Fig.6shows the variation of the speci?c discharge capac-ity with the number of cycles.The charge/discharge current density was relatively high at the C/5rate with a cut-off volt-age of 2.5–4.3V at room temperature.The sample
prepared
Fig.6.Cycle life of LiFePO 4prepared by the MA method and solid-state reaction method (cycle between 2.5and 4.3V ,C/5).
by MA has a higher discharge capacity and a more stable cy-cle life than the conventional solid-state synthesized sample.The cycling retention rate of MA900after 50cycles was about 89%of its maximum capacity,whereas the retention rate for SS450+900was 62%.Consequently,it could be concluded that mechanical alloying enhanced the electronic conductiv-ity and improved the cell performances of LiFePO 4prepared from Fe 3+precursor.
4.Conclusion
Olivine-type LiFePO 4was successfully synthesized from Fe 2O 3by MA method,and subsequent ?ring at 900?C for only 30min.A single phase LiFePO 4/C composite could not be produced with carbon in excess of the stoichiometric amount because the Fe 2P was created by a reduction reaction of phosphate at high temperature.The well-crystallized lithium iron phosphate consisting of uniformly and ?ne particles had a higher discharge capacity of 160mAh g ?1,and better electrochemical cycling behavior compared to LiFePO 4prepared by the conventional solid-state reaction.It is recon?rmed that the MA process could be the one of the viable methods to produce olivine-type LiFePO 4for lithium rechargeable batteries.
Acknowledgement
This work was supported by Korea Research Foundation Grant (KRF-2003-041-D20299).
References
[1]A.K.Padhi,K.S.Nanjundaswamy,J.B.Goodenough,J.Electrochem.
Soc.144(1997)1188.
[2]N.Ravet,J.B.Goodenough,S.Besner,M.Simoneau,P.Hovington,
Abstract 127,The Electrochemical Society and The Electrochemical Society of Japan Meeting Abstracts,vol.99-2,Honolulu,HI,October 17–22,1999.
[3]H.Huang,S.C.Yin,L.F.Nazar,Electrochem.Solid-State Lett.4
(2001)A170.
[4]Z.Chen,J.R.Dahn,J.Electrochem.Soc.149(2002)A1184.
[5]A.Yamada,S.C.Chung,K.Hinokuma,J.Electrochem.Soc.148
(2001)A224.
[6]J.Barker,M.Y .Saidi,J.L.Swoyer,Electrochem.Solid-State Lett.6
(2003)A53.
[7]S.J.Kwon,C.W.Kim,W.T.Jeong,K.S.Lee,J.Power Sources 137
(2004)93–99.
538 C.W.Kim et al./Journal of Power Sources146(2005)534–538
[8]P.P.Prosini,D.Zane,M.Pasquali,Electrochim.Acta46(2001)
3517.
[9]S.Franger,F.Le Cras,c.Bourbon,Rouault,Electrochem.Solid-State
Lett.5(2002)A231.[10]P.P.Prosini,M.Carewska,S.Scaccia,P.Wisniewski,S.Passerini,
M.Pasquali,J.Electrochem.Soc.149(2002)A886.
[11]G.Arnold,J.Garche,R.Hemmer,S.Strobele, C.V ogler,M.
Wohlfahrt-Mehrens,J.Power Sources119–121(2003)247.
普通员工辞职申请书范文【三篇】
普通员工辞职申请书范文【三篇】 尊敬的xx人力资源部: 您好! 因为个人职业规划和一些现实因素,经过慎重考虑之后,特此提出离职申请,敬请批准。 在xx工作一年多的时间里,我有幸得到了各位领导及同事们的倾心指导及热情协助,在本职工作和音乐专业技能上,我得到了很大水准的提升,在此感谢xx提供给我这个良好的平台,这个年多的工作经验将是我今后职业生涯中的一笔宝贵财富。 在这里,特别感谢各位领导在过去的工作、生活中给予的大力支持与协助;尤其感谢xx,xx等,一年来对我的信任和关照,感谢所有给予过我协助的同事们。 望批准我的申请,并请协助办理相关离职手续,在正式离开之前我将认真继续做好当前的每一项工作。 祝公司事业蓬勃发展,前景灿烂。 申请人:### 20xx年xx月xx日 【篇二】 尊敬的韩总: 作为一名在酒店工作了大半年的员工,我对酒店有着一种格外亲切的感觉。每一个人在他年轻的时候,都有很多第一次,我当然也不例外。
我的第一份工作是在酒店,我最青春的三年也是在酒店度过的。 在这里,我学会了很多东西,能够跟同事们在一起工作,我觉得很开心,这里的每一位都是我的大哥大姐,我的叔叔阿姨,是他们教给了 我在学校里面学不到的知识,如何为人、如何处事、如何工作……在 酒店里,领导们也对我十分的关心,从刚进入酒店开始,我就感受到 从上至下的温暖。因为我是酒店里年龄还一般,还不算小,也从来没 有在这么大的集体里生活过,自不过然的,心里面就会产生一种被呵 护的感觉。这是一种以前在集体里未曾有过的感觉,很温馨,很自豪,而且它一直陪伴着我,直到我离开…… 但这种感觉不会随着我的离开而走远,我想我永远也不会忘记, 毕竟我以前生活在一个温暖而又温馨的集体里。韩总,还记得第一次 跟您近距离接触和理解是在20xx.3.16号。随着时间的流逝,斗转星移,您多年积累的工作经验与个人才华也得到充分的施展。您是我们 酒店的经理。在我上班之前,制定了一系列的政策与方针,重新定位 了酒店的经营策略,持续地尝试新的机制与奖励、分配办法,力争让 酒店的经济效益持续迈上新高,也让酒店员工的福利待遇如芝麻开花 一般节节高樊。,这才是为员工谋利益的举动,这才是一位被员工在 心里面所认可的经理。 而我,作为这个集体的一份子,更加感觉到您对员工的关心与培养。您肯定想到,酒店要想在竞争激烈的社会中立于不败之地,人才 的培养与发展是不可忽视的环节之一。因为我自身水平的不足,近期 的工作让我觉得力不从心,所以想公司提出了辞呈,忘领导批准。 申请人:### 20xx年xx月xx日 【篇三】 尊敬的公司领导:
流体的物理性质
流体的物理性质 流体流动与输送过程中,流体的状态与规律都与流体的物理性质有关。因此,首先要了解流体的常见物理和化学性质,包括密度、压力、黏度、挥发性、燃烧爆炸极限、闪点、最小引燃能量、燃烧热等。 一、密度与相对密度 密度是用夹比较相同体积不同物质的质量的一个非常重要的物理量,对化工生产的操作、控制、计算等,特别是对质量与体积的换算,具有十分重要的意义。 流体的密度是指单位体积的流体所具有的质量,用符号ρ表示,在国际单位制中,其单位是ke/m3。 式中m——流体的质量,kg; y——流体的体积,m3。 任何流体的密度都与温度和压力有关,但压力的变化对液体密度的影响很小(压力极高时除外),故称液体是不可压缩的流体。工程上,常忽略压力对液体的影响,认为液体的密度只是温度的函数。例如,纯水在277K时的密度为1000kg/m3,在293K时的密度为998.2kg /m3,在373时的密度为958.4kg/ms。因此,在检索和使用密度时,需要知道液体的温度。对大多数液体而言,温度升高,其密度下降。
液体纯净物的密度通常可以从《物理化学手册》或《化学工程手册》等查取。液体?昆合物的密度通常由实验测定,例如比重瓶法、韦氏天平法及波美度比重计法等。其中,前两者用于精确测量,多用于实验室中,后者用于快速测量,在工业上广泛使用。 在工程计算中,当混合前后的体积变化不大时,液体混合物的密度也可由下式计算,即: 式中ρ—液体混合物的密度,kg/ms; ρ1、ρ2、ρi、ρn——构成混合物的各纯组分的密度,ks/m3; w1、w2、wi、wn——混合物中各组分的质量分数。 气体具有明显的可压缩性及热膨胀性,当温度、压力发生变化时,其密度将发生较大的变化。常见气体的密度也可从《物理化学手册》或《化学工程手册》中查取。在工程计算中,如查压力不太高、温度不太低,均可把气体(或气体混合物)视作理想气体,并由理想气体状态方程计算其密度。 由理想气体状态方程式 式中ρ—气体在温度丁、压力ρ的条件下的密度,kg/m3; V——气体的体积,ITl3; 户——气体的压力,kPa; T一—气体的温度,K; m--气体的质量,kg;
发光材料的合成及发光材料制备技术(精)
1 02121289.9 一种有机电致发光材料及其应用 2 02134788. 3 稀土高分子光致发光材料及其合成方法 3 01124165.9 一种纳米级超长余辉硅铝复合盐类发光材料及其制备方法 4 01133301.4 电致发光材料包膜 5 02130973. 6 一种电致发光磷光材料及其应用 6 01136619.2 一种非放射性环保蓄能发光材料及其制备方法 7 02134210.5 含硒杂环化合物的聚合物及其在制备发光材料中的应用 8 02125386.2 一种合成长余辉发光材料的新方法 9 02155860.4 允许由给体转移有机材料以便在有机发光二极管器件内形成层的设备 10 02124569.X 亚甲基吡咯金属络合物、使用该络合物的发光元件材料以及发光元件 11 02132760.2 含有高可见发光效率的CdTe纳米晶透明聚合物体相材料的制备方法 12 01804068.3 发光元件材料和使用该材料的发光元件 13 99816847.5 光致发光的半导体材料 14 02124757.9 脂环式环氧化合物、其制造方法和组成物及发光二极管用密封材料 15 02135615.7 有机电致发光材料8-羟基喹啉铝的制备方法 16 01138882.X 超长余辉高亮度蓝紫色发光材料的制备方法 17 01138883.8 铝酸盐高亮度长余辉发光材料及其制备方法 18 02157031.0 用于转移有机材料以形成有机发光装置中的结构层的方法 19 03112784.3 纳米发光复合材料及其制备方法 20 03113677.X 含镉氧化物长余辉发光材料及其制备方法 21 02103614.4 基于纳米材料的发光气敏传感器及纳米材料的成膜工艺
辞职报告文本辞职报告范文大全
辞职报告文本辞职报告范文大全 辞职报告 (篇一) 尊敬的领导: 我很遗憾自己在这个时候向公司正式提出辞职申请。 来到公司也已经快两年了,在这近两年里,得到了公司各位同事的多方帮助,我非常感谢公司各位同事。正是在这里我有过欢笑,也有过泪水,更有过收获。公司平等的人际关系和开明的工作作风,一度让我有着找到了依靠的感觉,在这里我能开心的工作,开心的学习。或许这真是对的,由此我开始了思索,认真的思考。 但是最近我感觉到自己不适合做这份工作,同时也想换一下环境。我也很清楚这时候向公司辞职于公司于自己都是一个考验,公司正值用人之际,公司新的项目的启动,所有的后续工作在公司上下极力重视下一步步推进。也正是考虑到公司今后在这个项目安排的合理性,本着对公司负责的态度,为了不让公司因我而造成的决策失误,我郑重向公司提出辞职。 我考虑在此辞呈递交之后的2—4周内离开公司,这样您将有时间去寻找适合人选,来填补因我离职而造成的空缺,同时我也能够协助您对新人进行入职培训,使他尽快熟悉工作。 能为公司效力的日子不多了,我一定会把好自己最后一班岗,做好工作的交接工作,尽力让项目做到平衡过渡。离开这个公司,离开
这些曾经同甘共苦的同事,很舍不得,舍不得领导们的尊尊教诲,舍不得同事之间的那片真诚和友善。 在短短的两年时间我们公司已经发生了巨大可喜的变化,我很遗 憾不能为公司辉煌的明天贡献自己的力量。我只有衷心祝愿公司的业绩一路飙升!公司领导及各位同事工作顺利! (篇二) 尊敬的办公室人力资源管理领导: 我向公司正式提出辞职。 我自**日进入公司,到现在已经一年有余了,正是在这里我开始 踏上了社会,完成了自己从一个学生到社会人的转变。在过去的一 年多里,公司给予了我许多学习和锻炼的机会,开阔眼界、增长见识。我对公司给予的照顾表示忠心的感谢!但是,经过近段时间的思考, 我越来越迷惘!我越来越觉得现在的工作、生活离自己想要的越来越远。所以,我必须离开,去过我思想深处另一种有别于目前的生活。我想,生活应该是在选择到适合自己的道路以后,再持之以恒地坚持! 公司目前已经过了一年最忙的时间,是充电、整顿、储备人才的 时刻。相信,我的离开会很快有新生力量补充。因为这不是我想要的工作、生活状态,所以,我现在对工作没有激情、对生活也极其懒散。本着对公司负责的态度,为了不让公司其他同事受到我消极情绪 * ,也为了不让公司因为我出现业务上的纰漏等,我郑重向公司提出辞职,望公司给予批准! 祝公司稳步发展,祝公司的领导和同事们前程似锦、鹏程万里!
金属钠的性质与应用
金属钠的性质与应用
————————————————————————————————作者: ————————————————————————————————日期: ?
第二单元 钠、镁及其化合物 第1课时 金属钠的性质与应用 知识内容 必考要求 加试要求 1.钠的物理性质与用途。 2.钠的化学性质(跟非金属、酸、某些氧化物的反应)。 3.钠的生产原理。 4.过氧化钠的主要性质。 a b a a c b c 目标定位 1.掌握钠的物理性质和化学性质。 2.了解钠元素在自然界中的存在形式,了解钠的生产原理和主要用途。 3.理解Na2O 和Na 2O 2的组成、性质和应用。 一 钠的性质及应用 1.物理性质 颜色、状态 熔、沸点 密度 硬度 银白色块状固体 熔、沸点较低 比水小 硬度小、质地软 2.钠的化学性质 (1)钠与氧气反应 按表中要求完成实验,并将观察到的实验现象及其原因解释填入表中。 实验操作 实验现象 原因解释 钠的新切面呈银白色,具有金属光泽,在空气中很快变暗 钠是活泼金属,在空气中极易被氧化,生成Na2O 把一小块金属钠放在坩埚中,加热 钠先熔化为银白色小球;然后燃烧,火焰呈黄色;最后生成淡黄色固体 金属钠熔点低,加热时与O2反应生成Na 2O2
①钠在常温下与氧气反应的化学方程式是4Na+O2==2Na2O,在加热点燃时反应的化学方程 式是2Na+O2错误!Na2O2。由此你能得出的结论是。 ②通过以上实验过程,可以说明钠具有的性质有哪些?并分析说明在实验室中应怎样保存金属钠? (2)钠与水反应 在小烧杯中加入约1/2的水,滴入1~2滴酚酞溶液,将切好的钠投入到水中,盖上表面皿,观察实验现象。填写下表: 实验现象原因分析 钠浮在水面上钠的密度比水小 钠熔成光亮小球反应放热且钠熔点低 四处游动生成气体 发出“嘶嘶”响声,且很快消失反应剧烈 溶液变红色反应生成物显碱性 钠与水反应的化学方程式是2Na+2H2O==2NaOH+H2↑,氧化剂是H2O,还原剂是Na。3.钠的制备和用途 (1)制备 工业上电解熔融NaCl可以得到金属钠:2NaCl错误!未定义书签。2Na+Cl2↑(填电解方程式)。 (2)用途 ①钠和钾的合金常温下呈液态,可用于快中子反应堆作热交换剂。 ②高压钠灯发出的黄光射程远,透雾能力强,常用作路灯。 ③金属钠还可以用于钛、锆、铌、钽等金属的冶炼。如Na与TiCl4反应:TiCl4+4Na\o(=====,700~800 ℃)Ti+4NaCl。 归纳总结 有关钠的反应 (1)钠在常温下与O2反应生成Na2O,加热条件下生成Na2O2,钠与O2的反应产物是由温度决定的,而不是由O2的量决定的。 (2)钠与水(滴有酚酞)反应的实验现象可概括为5个字——“浮”、“熔”、“游”、“响”、“红”。 (3)钠与酸反应是先酸后水;钠与盐溶液反应是先水后盐,并不能置换出不活泼金属。
发光材料制备方法
发光材料的制备方法 随着发光材料基质类型的不断发展,其制备方法也逐渐趋于多样化[7~10]针对各种基质的特点,相应发展出了溶胶-凝胶法、高温固相法、燃烧合成法、微波加热法、水热法、喷雾热解法、化学沉淀法、电弧法等制备技术。这些制备方法的基本原理有着显著的差别,适用性也有所不同,具有较强的针对性。 1、溶胶—凝胶法 溶胶一凝胶法(Sol-Gel)是低温合成材料的一种新工艺,它最早是用来合成玻璃的,但近十多年来,一直是玻璃陶瓷等先进材料合成技术研究的热点,其原理是将组成元素的金属无机或有机化合物作为先驱体,经过水解形成凝胶,这些凝胶经过烘干成为玻璃粉末并进行成型,再在较低温度下进行烧结,形成玻璃陶瓷。溶胶一凝胶法是应用前景非常广泛的合成方法。它是采用特定的材料前驱体在一定条件下水解,形成溶胶,然后经溶剂挥发及加热等处理,使溶胶转变成网状结构的凝胶,再经过适当的后处理工艺形成纳米材料的一种方法。 利用溶胶一凝胶法(Sol-Gel)制备发光材料时,把选好的基质材料制成溶液,配以激活剂、助溶剂等的有机化合物溶液或化合物的水溶液,混合均匀,溶液静化数小时后形成凝胶,经干燥、灼烧除去有机物后,再在一定气氛下烧结成产品,得到发光材料粉体。范恩荣[11]用溶胶一凝胶新工艺制备出硅酸锌、硅酸钙发光材料。 此方法制备发光材料具有均匀性好,烧结温度低,反应容易控制,材料的发光带窄,发光效率高等优点。但存在着要使用金属有机溶剂,成本高、操作繁琐、生产周期长,凝胶在烧结过程中收缩较大,制品易变形,对发光性能有一定影响等缺点。 溶胶-凝胶技术作为一种先进的工艺方法,具有反应温度低、对基材的尺寸与形状没有过高要求、仪器费用低、操作简单、材料性能调节余地大等特点,可以很方便地通过改变参与反应的有机与无机组分的含量来实现纳米涂层性能的调节。 溶胶是分散介质中基本单元尺寸为1~100 nm的固体粒子而形成的分散体系。在Sol-Gel涂层制备中,溶胶的制备可分为有机途径和无机途径两种。有机途径是通过有机醇盐的水解与缩聚而形成溶胶;无机途径则是通过某种方法制得
高铁酸盐
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。 (1)工业上用湿法制备高铁酸钾(K 2 FeO 4)的流程如下图所示: ①反应I的化学方程式为。 ②反应II的离子方程式为。 ③加入饱和KOH溶液的目的是。(2)高铁酸钾是一种理想的水处理剂,其处理水的原理 为,__________。 (3)干法制备K 2 FeO 4的反应中,氧化剂与还原剂的物质的量之比为。 (4)高铁电池是正在研制中的可充电干电池,上图为该电池和常用的高 能碱性电池的放电曲线,由此可得出的高铁电池的优点有、。 (1)①2NaOH + C l 2=NaCl + NaClO + H 2 O(2分) ②3ClO- + 10OH- + 2Fe 3+=2FeO 42- + 3Cl- + 5H 2 O(2分) ③增大K + 浓度,促进K 2 FeO 4晶体析出(2分) (2)高铁酸钾有强氧化性,能杀菌消毒产生的Fe(OH) 3有吸附性,有絮凝作用(2分)(3)3∶1(2分)(4)放电时间长工作电压稳定(2分) 下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体。
提示:4FeS +11O 2高温,2Fe 2 O 3+8SO 2 2 请填写下列空白: (1)在周期表中,组成单质G的元素位于第________周期________族。 (2)在反应⑦中氧化剂与还原剂的物质的量之比为________。 (3)在②、③、⑥、⑨中既属于化合反应又属于非氧化还原反应的是________(填序号)。(4)反应④的离子方程式是_____________________________________。 、KOH共熔,可制得一种“绿色”环保高效净水剂K 2 FeO 4(高铁(5)将化合物D与KNO 3 酸钾),同时还生成KNO 和H 2 O。该反应的化学方程式是________________________。 2 (1)四Ⅷ (2)1∶2 (3)③ (4)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O (5)Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O
辞职申请书范文大全500字
辞职申请书范文大全500字 辞职申请书500字 辞职一般是提前30天向上级或公司递交辞职,无需公司批准,30天之后您就能顺利辞职了,以下是为大家搜集的范文,欢迎阅读! 尊敬的公司领导: 由于工作调动,现正式向公司提出调离原工作岗位。 舍不得,舍不得这里的人,舍不得自己曾经的付出。每一次出差、每一次报价、每一次谈判、每一次争吵,在飞机上、在吉普车上、在会议室里、在工地上,所有这一切,都充斥着我的记忆,那么清晰,就像是在昨天。但时间的指针总是忠诚地一步一步往前走,昨天终究会结束。 在公司四年半的时间里,我收获了很多,除了朋友和知识,更 重要的是,我到了成长的快乐。感谢命运,让我在最青春的年华里遇到了装备公司;感谢公司领导,你们的关注和欣赏让我一直充满自信,你们的指点和教诲让我在成长的路上少走了很多弯路;感谢公司的同事,和你们的沟通,轻松愉悦;感谢我自己,能够一直保持着一份纯净,真诚地付出,真诚地享受每一次收获。
鉴于目前的身体及生活状态,自认为不能够为公司创造更大的价值,现向公司提出辞职。 虽然我不能在这里继续“战斗”下去,但真心的希望,xx公司能够梦想成真,在世界的舞台上舞出属于自己的精彩。 此致 敬礼! 辞职人: 20xx年xx月xx日 尊敬的x总: 您好! 转眼间,我到公司已有X年了,这X年的工作时间里,虽然我的工作并不是尽善尽美,但在公司同事们的帮助,尤其是您的信任与教导下,我也努力的去完成每一项您布置给我的工作,都用了自己的
热情努力去对待。凭心而论,我开始对基础工程毫无了解,但在您这里我基本了解了基础工程,使我学到了很多东西,特别是一些做人的道理和对生活的理解。在这里,我真诚的对袁总说一声:谢谢您了! 但犹豫再三,经过了长时间的考虑,我还是写了这封辞职申请书。 加入公司以来,您对我的信任、教导与严格要求,令我非常感动,也成为激励我努力工作的动力。在您及同事们的热心指导与悉心帮助下,我在工程技术和管理能力方面都有了一定的提高。我常想,自己应该用一颗感恩的心,去回报您及公司对我的栽培,真的想用自己的努力去做好您交给的每一份工作任务,但自己的能力真的很有限,有很多地方没有做得能让您满意,所以对过去工作中失误与不足的地方,我真诚的对您说声抱歉,请您原谅! 经过这段时间的思考,我觉得我可能技术能力方面有所不足, 也缺少工作的积极性和脚踏实地的工作精神,没能很好的适应这个工作,所以一直没有把工作做到令您满意的程度。这是我在以后的人生中需要注意的地方,也是袁总经常教导我的地方,我一定会铭记于心! 再一次真诚地感谢您及公司全体同事对我的关爱与帮助!
盐酸羟胺的用途
盐酸羟胺的用途 盐酸羟胺(Hydroxylamine Hydrochloride ),也叫盐酸胶或羟基氯化铵和羟胺盐酸盐(Oxamrnonium;Hydroxyarnmonium Chloride ),分子式:NH2OH-HCl,分子量:69.5。其理化性质为:白色针状结晶,比重1.67 ,熔点:152℃(分解),溶于水、乙醇、甘油,不溶于乙醚.易吸潮,受潮后逐渐分解,有腐蚀性。本品有毒,对皮肤有刺激性。小鼠羟口为400毫克/公斤。盐酸羟胺是羟胺系列产品中重要的产品,是重要的化工原料和有机合成中间体,具有广泛的用途。盐酸羟胺常用于制备肪,尤其是用于合成己内酞胺的环己酮肪,己内酰胺作为尼龙的单体,是一种重要的是有机化工产品,世界总产能约480万t/a,主要用于纤维生产,生产主要集中于美国、德国、荷兰、日本等发达国家,在亚洲除日本外,其他各国每年均需大量进口。盐酸羟胺用于生产己内酰胺的用量约占盐酸羟胺总量的80%以上。除此之外,盐酸羟胺的主要用途 有: 1)合成医药、农药等化学产品 盐酸羟胺也可用于合成多种医药、农药及染料,如抗癌药羟墓脉、新诺明农药灭多虫一及染料靛红等,相关物质结构如下:
2)合成高价值有机合成中间体 盐酸羟胺作为一种有机合成中间体,还可用于合成结构更为复杂的高价值中间体,如用于农药、医药和染料合成的重要中间体羟胺-O-磺酸、广泛用于合成多种医药、香料、农药、液晶材料和缓蚀剂等的对羟基苯甲睛、用于合成甾体激素半抗原的重要中间体羧甲基羟胺半盐酸盐。用于合成肽、抗生素、氨基酸、蛋白质的重要中间体N-羟基丁二酞亚胺,相关化合物及其合成反应式如下:
金属钠的性质
《金属钠》教学案例 一、知识背景 从知识的安排上,在第一章从实验学习化学和第二章化学物质及其变化的基础上,本章开始介绍具体的元素化合物的知识。钠的性质是本章重点内容之一,在高考试题中出现的频率较高。通过钠的学习,可以巩固金属与非金属、酸和水之间的反应,并为碱金属、卤素等元素的学习奠定基础,因此本节内容起到承上启下的作用。本节以初中学过的有关金属的性质为基础,选取典型的金属如钠、镁、铝、铁等进一步学习拓展金属的性质,所以学好本节内容有着重要实际意义。 二、情境描述 课堂引入用金属钠的氧化物做了一个小实验“水能生火”。这时激发学生兴趣,同学们讨论这个物质是什么,水可以灭火,怎么能生火?然后引入课题“这就是我们今天要学习的金属钠” 。接下来为了进一步学习金属钠的性质,我进行演示实验:钠与水的反应,并通过投影进行思考:1.观察钠的保存,为什么需要保存在煤油中?2.钠主要以什么形式存在于自然界中?3.用小刀能切动钠,这说明了钠的什么性质?4.描述钠与水反应的现象,并从中反应出钠的哪些物理性质?5.如果钠燃烧起来,能否用水扑灭?加深学生对知识的理解和掌握,还能激发学生进行思考和讨论。在最后让学生对本节内容进行总结。 三、主要内容 一、金属钠(Na ) 1. 钠的物理性质: ①从煤油中取出一小块新切的钠,观察颜色——银白色,带有金属光泽; ②用小刀可以切分钠,说明什么性质?——质地软; 【板书】1.钠的物理性质: 颜色 密度 熔点 硬度 银白色、有金属光泽 钠的密度比水小,比煤 油的大 低于100℃ 质软 2.钠的化学性质: 【板书】2.钠的化学性质: (1)金属钠与空气中氧气反应 现象:钠与氧气反应加热后,钠先熔成小 加热: 常温:
发光材料的制备
实验三微波法制备蓝色荧光粉Ca1-x Sr x F2:Eu 一、实验目的 1. 掌握共沉淀-微波法制备荧光粉的方法 2. 熟悉微波反应装置以及具体的实验操作 3. 制备纳米复合荧光粉 二、主要仪器与药品 1、仪器 烧杯,胶头滴管,瓷坩埚(100ml、20ml)各一个,分析天平,离心机,烘箱,微波炉,紫外灯 2、药品 硝酸钙,硝酸锶,三氧化二铕(Eu2O3),氟化铵,硝酸,活性炭(炭粒) 三实验原理与技术 共沉淀法是将沉淀剂加入到混合金属盐溶液中,促使各组分均匀混合沉淀,然后加热分解以获得产物的方法。化学共沉淀法的优势在于它不仅可以将原料提纯与细化,而且可以在制备过程中完成反应及掺杂过程。这种方法具有工艺简单、经济,反应物混合均匀,焙烧温度较低、时间较短、产品性能良好等优点。但制备过程中仍有不少问题有待解决,例如过程中易引入杂质,形成的沉淀呈胶体状态导致洗涤和过滤方面的问题,如何选择适宜的沉淀剂和控制制备条件等。 微波合成法是近年来迅速发展起来的一种新合成方法,应用于光致发光材料的制备,已获得了多种粒度细小、分布均匀、色泽纯正、发光效率高的荧光粉。这种方法是将原料按比例混合后研磨,装入特定的反应器,在微波炉中加热反应20—40min,取出后进行简单的后处理即得成品。微波热合成法的显著优点是反应彻底、快速、高效、节能、洁净、经济,使用方法和设备简单,只需家用微波炉即可。用此法合成的产品疏松.粒度小。分布均匀,色泽纯正,发光效率高,有较好的应用价值; 氟化物性能稳定,不易潮解,透光率好,而且生产成本低,有着有机物和硫化物无法比拟的优点。通过对其进行稀土掺杂,可以制备出与植物光合作用所吸收光谱相匹配的新型高效转光剂。但是目前文献报道的大都是通过高温固相法
简短辞职申请书范文大全
简短辞职申请书范文大全 想必每一位在职场混迹多年的职场人士都应曾经写过辞职信之类的。在现在这个发展速度如此之快的社会,跳槽也就成了常见现象。而离职前的辞职信是必写的。下面就是小编给大家带来的简短辞职申请书范文大全,希望大家喜欢! 尊敬的xx: 我自xx年来到公司,工作中得到公司和您的培养,个人得到了很大的成长,公司的文化和环境也令我工作得非常开心。 现由于个人原因,我不得不提出辞职,希望能于x年x月x日正式离职,请公司批准我的这份辞职书。并请公司在x月x日前安排好人员接替我的工作,我将尽心交接。 再次对您x年来的培养和指导表示衷心的感谢。 最后祝您及公司的所有同事一切顺利! 此致 敬礼 辞职人:xxx 20xx年x月x日 尊敬的X经理: 您好! 感谢公司在我入职以来的培养关心和照顾,从X年X月份来到[公司]至今,我学到了很多东西,今后无论走向哪里,从事什么,这段经历都是一笔宝贵的财富,我为在彩卡的这段工作经历而自豪。 而今,由于个人原因提出辞职,望领导批准。 辞职人: 20xx年x月x日
公司人事部: 我因为要去美国留学,故需辞去现在的工作,请上级领导批准。 公司的企业文化感化了我,我对公司是深有感情的。我留学归来之后,仍愿意回公司就职。 感谢公司领导和同事在工作中对我的关心和支持,并祝公司兴隆。 辞职人:xxx 20xx年x月x日 尊敬的公司领导: 在递交这份辞呈时,我的心情十分沉重。现在由于我的一些个人原因的影响,无法为公司做出相应的贡献。因此请求允许离开。 当前公司正处于快速发展的阶段,同事都是斗志昂扬,壮志满怀,而我在这时候却因个人原因无法为公司分忧,实在是深感歉意。 我希望公司领导在百忙之中抽出时间受理我的离职事项。 感谢诸位在我在公司期间给予我的信任和支持,并祝所有同事和朋友们在工作和活动中取得更大的成绩。 辞职人: 20xx年x月x日 尊敬的xx: 自xx年入职以来,我一直很喜欢这份工作,但因某些个人原因,我要重新确定自己未来的方向,最终选择了开始新的工作。 希望公司能早日找到合适人手开接替我的工作并希望能于今年5月底前正式辞职。如能给予我支配更多的时间来找工作我将感激不尽,希望公司理解!在我提交这份辞呈时,在未离开岗位之前,我一定会尽自己的职责,做好应该做的事。 最后,衷心的说:“对不起”与“谢谢”! 祝愿公司开创更美好的未来!
盐酸羟胺的合成
盐酸羟胺的合成 1、反应机理 由肟制备羟胺的过程实质为肟的酸催化分解,肟的催化分解已见报道,其中,亲核催化剂催化机理如下: 而当分解反应在水中、酸催化下进行时,其机理为酮亚胺化的逆反应,如下所示: 2、原料和仪器 丙酮肟:纯度为98.0% 丁酮肟:纯度为99.5% 环己酮厉:纯度为99.0% 盐酸:浓度为35.0%
相关物质的物性参数见表1. 表1相关物质的物性参数 仪器:恒温水槽,三颈烧瓶,滴液漏斗,冷凝管,搅拌器,低温恒温槽,加热套,真空千燥器等。 分析方法 盐酸羟胺纯度的分析 在中性溶液中,铵盐与甲醛作用,生成六次甲基四胺和相当于铵盐含量的酸,生成的酸用碱标准溶液进行中和滴定。具体操作如下: 称取0.5g样品称准至0.0002g。将其溶解于新鲜的蒸馏水中,移入100mI容量瓶中,稀释至刻度,得试料。量取试料20m1,加10m16N 硫酸及20m1新制备的25%硫酸铁按溶液,摇匀,缓缓煮沸5min,加250m1新鲜的蒸馏水,加2mI磷酸,于60℃用0.1N高锰酸钾标准溶液滴定至溶液呈粉红色,同时做空白试验。盐酸羟胺含量X(%)按下式计算:
3、实验过程 盐酸羟胺的制备反应式如下所示: 500ml三口瓶中加入酮肟45m1(40g)升温至70℃搅拌下于25-30滴/min 的速度缓缓加入35%的盐酸38m1,并不断地蒸出生成的丁酮,在此温度下反应1.5h,反应完成,共能收集到丁酮水溶液40m1,羟测试衡算,其中约含丁酮18g釜中的水相盐酸羟胺水溶液羟过-10℃冷冻析出、过滤抽吸得盐酸羟胺晶体,然后滤液羟过负压蒸馏浓缩,再进行冷析,反复数次,将所得盐酸羟胺晶体一起称重。得盐酸羟胺晶体25g.结晶母液能配制盐酸作下一轮水解反应的原料。
人教版高一化学必修一 3.1金属钠的性质知识点总结
一.金属钠 1.钠的物理性质 颜色硬度密度熔点导电导热性 2.钠的化学性质 钠原子最外层只有一个电子,在化学反应中钠原子容易失去最外层的一个电子,具有很强的还原性,是一种活泼的金属元素。 (1)跟非金属单质(如与O2,Cl2反应)反应: 与O2常温: 点燃: 与Cl2 (2)钠与水反应 现象: 离子方程式:----------------------------------------------------------------------------------- (3)钠与酸反应:钠与酸的反应比水反应更激烈,极易爆炸。 (4)钠与盐溶液反应:先考虑钠与水反应生成NaOH,再考虑NaOH是否与盐反应。 例如:①钠与CuSO4溶液反应 钠与硫酸铜反应的离子方程式:-------------------------------------------------------- ②钠与FeCl3溶液反应:--------------------------------------------------------------------- 3.钠的制取保存及用途: (1)制取: (2)保存:密封保存,通常保存在煤油或石蜡油中。 4.钠的存在与用途 自然界中钠只能以化合态的形态存在,主要以氯化钠的形式存在。钠是一种强还原剂,工业上用它还原金属钛、锆、铌等;反应如:4Na+TiCl4(熔融)=Ti+4NaCl,另外钠和钾的合金在常温下呈液态,是原子反应堆的导热剂;钠也可用于制高压钠灯。 5.钠的化合物 (1).氧化钠和过氧化钠的比较 比较内容Na2O Na2O2 颜色、状态 氧的化合价 电子式 稳定性 生成条件 物质类别碱性氧化物过氧化物(不是碱性氧化物) 与水反应 与CO2反应
(完整版)高一化学金属钠的性质与应用练习题
高一化学金属钠的性质与应用练习题 一、选择题 1.通过你的观察和推理,判断下列实验室中对于少量Na的保存方法正确的是() A.保存在水中B.密封,保存在广口瓶中 C.用铝箔包裹,密封在广口瓶中D.密封,保存在煤油中 2.钠与水反应的现象与钠的下列性质无关的是() A.钠的熔点较低B.钠的密度比水的小 C.钠的硬度小D.钠有很强的还原性 3.下列有关钠的叙述中,错误的是() A.钠的很活泼,可以用来冶炼金属钛、锆、铌等 B.钠的化学性质非常活泼,钠元素只能以化合态存在于自然界 C.钠是一种灰黑色的固体 D.钠的质地软,可用小刀切割 4.关于钠原子与钠离子,下列叙述错误的是() A.它们相差1个电子层B.它们的化学性质相似C.钠原子比钠离子稳定D.钠原子、钠离子均为钠元素 5.金属钠着火后,可用于灭火的物质和器
材有() A.水B.泡沫灭火器C.干冰灭火剂D.干砂 6.取一小块钠放在玻璃燃烧匙里加热,下列实验现象正确的是() ①金属先熔化②在空气中燃烧火焰呈黄色③燃烧时火星四射 ④燃烧后生成淡黄色固体⑤燃烧后生成白色固体 A.①②③B.①②④才.①②⑤D.①③⑤ 7.钠的下列用途与其化学性质无关的是() A.制过氧化钠B.原子反应堆的导热剂. C.冶炼金属钛D.制取贵重金属
钽 8.将一小块钠投入盛有5mL饱和石灰水的试管中,不可能观察到的现象是() A.钠熔成光亮的小球,在液面四处游动B.有气体产生 C.溶液底部有银白色的物质D.溶液变浑浊 9.(2002年上海春季考题)在烧杯中加入水和苯(密度:0.88g/cm3)各50mL。将一小粒金属钠(密度:0.97g/cm3)投入烧杯中。观察到的现象可能是() A 钠在水层中反应并四处游动 B 钠停留在苯层中不发生反应 C 钠在苯的液面上反应并四处游动D.钠在苯与水的界面处反应并可能作上、下跳动
发光材料的制备方法及制备的发光材料的制作流程
本技术涉及发光材料技术领域,提供一种发光材料的制备方法及制备的发光材料,所述方法包括:(1)按照化学计量比称取原材料La2O3、4MgCO3·Mg(OH)2·5H2O、H3BO3、Er2O3在研钵中充分研磨,使材料混合均匀;其中,Er3+掺杂的含量为330%;(2)放入坩埚中,在马弗炉中400600℃预烧结1.53h;(3)取出研磨2060min;(4)放入坩埚,置于马弗炉中9001000℃烧结610小时;(5)冷却后,取出烧结体,充分研磨,得到Er3+掺杂的 LaMgB5O10荧光材料。本技术方法简单、成本低廉,所制备的发光材料粒径小、稳定性好,而且发光效率得到了很大提高。 技术要求 1.一种发光材料的制备方法,其特征在于,包括: (1)按照化学计量比称取原材料La2O3、4MgCO3·Mg(OH)2·5H2O、H3BO3、Er2O3在研钵中充分研磨,使材料混合均匀;其中,不同化学计量使Er3+掺杂的含量为3-30%; (2)放入坩埚中,在马弗炉中400-600℃预烧结1.5-3h; (3)取出研磨20-60min; (4)放入坩埚,置于马弗炉中900-1000℃烧结6-10小时; (5)冷却后,取出烧结体,充分研磨,得到Er3+掺杂的LaMgB5O10荧光材料。 2.根据权利要求1所述的发光材料的制备方法,其特征在于,研磨时间为40-90min。 3.根据权利要求1所述的发光材料的制备方法,其特征在于,所述坩埚为氧化铝坩埚。 4.根据权利要求1所述的发光材料的制备方法,其特征在于,预烧结的温度为500℃。 5.根据权利要求1或4所述的发光材料的制备方法,其特征在于,预烧结的时间为2小时。 6.根据权利要求1所述的发光材料的制备方法,其特征在于,烧结的温度为900℃。 7.根据权利要求1或6所述的发光材料的制备方法,其特征在于,烧结时间为8小时。
高铁酸钾的制备及含量测定
高铁酸钾的制备及含量测定 摘要: 高铁酸钾是六价铁化合物,具有很强的氧化能力,优良的絮凝能力和高效的杀菌功效,无二次污染,是一种高效的绿色处理剂,具有良好的发展前景。但高铁酸钾的制备工艺复杂、稳定性差、成本较高,仍没有实现大规模生产。本文使用了湿法制备高铁酸钾,即用次氯酸盐法在冰水浴的环境中制取高铁酸钾,在制取过程中首先要除去NaCl 的干扰,其次在实验过程要注意KOH 的用量,当量过多时,产品的粘稠度会增加,不易烘干,产率偏高;在检验是否生成高铁酸钾方面,可利用化学反应检验其强氧化性来证明。 关键词: 高铁酸钾 制备 氧化性 含量测定 引言: 高铁酸钾的制备方法通常有高温氧化法、电解法和次氯酸钠法,其中以次氯酸钠法工艺较成熟;本实验拟通过次氯酸盐法制备高铁酸钾,之后再用零下18C ?的乙醇或者乙醚洗涤产品,称重计算产率,期间制得高铁酸钾之后要对它进行检测看是否有高铁酸钾。 试剂及仪器: NaClO (aq) O H NO Fe 2339)(?(s) NaOH (s) KOH (s) 乙醚(零下18C ?) 冰块 烧杯、玻璃棒、药勺、砂芯漏斗、滤瓶、铁架台、电炉、量筒、表面皿 实验部分: 1 实验原理:次氯酸盐氧化法的制备原理: 3NaClO+2Fe(NO 3)3+10NaOH====2Na 2FeO 4+3NaCl+6NaNO 3+5H 2O Na 2FeO 4+4KOH====K 2 FeO 4+2 NaOH 2 取NaClO (有效氯)5.2%)20.0ml ,加入NaOH 固体10.01g (使NaOH 接近饱 和,析出次氯酸钠中的NaCl )。N a O H 加入过程在冰浴中完成,使体系温度不致升高,并 加入电磁子不断搅拌。加入后期置于室温,增加NaOH 的溶解度,促进NaCl 的析出。 3 称取5.15g O H NO Fe 2339)(?固体,在冰浴下分批加入上述溶液中,电磁子不断搅 拌下,固体表面依次变红、暗紫、紫黑色。不断搅拌下,溶液变灰,逐渐向暗紫色、紫红色、紫黑色转变,即有高铁酸钠生成。(大约需要40~60分钟) 4 将溶液转至离心管中,离心10分钟,留上清液(深紫红色)。沉淀物中因为含有高
离职申请书怎么写范文5篇
离职申请书怎么写范文5篇 工作当中几乎每个人都会有经历辞职,那么大家知道离职申请书怎么写吗?下面就是给大家带来的离职申请书怎么写范文5篇,希望大家喜欢! 辞职报告怎么写模板 辞职理由 辞职之前必须想好理由,不管是世界那么大,我想去看看。还是老子就是不想干了。 书面格式 标题:标题一般有辞职报告、辞职书、辞职函、辞职申请等不同的写法,书面一般多用辞职书 称谓:在工作中称呼一般都是“尊敬的XXX”格式,你想谁递交辞职书就写TA的尊称。 正文: ①空格2字符,问好。如:您好。
②辞职理由,短到几个字,长到几百字,个人自由发挥。例如:世界那么大,我想去看看。 ③尾段可以写写对公司的祝福等等。如:祝公司业绩蒸蒸日上。 结语:结尾要求写上表示敬意的话。如“此致——敬礼”等。 署名:写上自己的名字,辞职人:XXX 。署名的格式,为*末尾换行后起,然后署名下面加上日期. 日期:辞职报告写的当天日期,当然公司的规定不同,可以灵活的变动。 注意事项 不要说上司坏话。如果你认为有必要向管理层反映一下上司的问题,要尽量以委婉的言辞口头提出。 不要满纸抱怨,抨击公司制度。 不要指责同事,尤其忌讳把同事的“罪行”白纸黑字写在辞职书上。 离职申请书范文【一】 尊敬的罗总: 您好!
首先感谢您在我工作期间对我照顾与支持,感谢公司给我这个平台,让我锻炼让我成长。 很遗憾在这个时候向xx正式写出辞职报告,或许我还不是正式职工,不需要写这封辞职信。当您看到这封信时我大概也不在这里上班了。 来到这里也快两个月了,开始感觉这里的气氛就和一个大家庭一样,大家相处得融洽和睦。在这里有过欢笑,有过收获,当然也有过痛苦。虽然多少有些不快,不过在这里至少还是学了一些东西。在这一个多月的工作中,我确实学习到了不少东西。然而工作上的毫无成就感总让自己彷徨。我开始了思索,认真地思考。思考的结果连自己都感到惊讶——或许自己并不适合xx 这项工作。而且到这里来工作的目的也只是让自己这一段时间有些事可以做,可以赚一些钱,也没有想过要在这里发展。因为当初连应聘我都不知道,还是一个朋友给我投的资料,也就稀里糊涂地来到了这里。一些日子下来,我发现现在处境和自己的目的并不相同。而且我一直以为没有价值的事情还不如不做,现在看来,这份工作可以归为这一类了。n多的时间白白浪费掉了。我想,应该换一份工作去尝试了。 离开这里,离开这些曾经同甘共苦的同事,确实很舍不得,舍不得同事之间的那片真诚和友善。但是我还是要决定离开了,我恳请xx和领导们原谅我的离开。
1盐酸羟胺
盐酸羟胺溶液的提纯:用“巯基锦纤维管除汞法”提纯盐酸羟胺溶液。在内径6-8mm、长约100mm、一端拉细的玻璃管中,或在500ml分液漏斗的玻璃管中, 填充0.1-0.2g硫基棉纤维,将待净化试液以10ml/min的流速流过1-2次即可除 尽汞。 盐酸羟胺中的痕量汞可以永活性炭吸附后过滤。盐酸羟胺盐酸溶液需要现用现 配,可以采用10%盐酸羟胺甘油溶液(仅用少量盐酸抑制盐酸羟胺不水解生成 碱性盐沉淀Sn(OH)Cl即可),代替盐酸羟胺盐酸溶液作为还原剂。此外甘油的 还原性可以阻止空气中的氧对Sn的氧化作用,盐酸羟胺甘油溶液不需要特殊保 存也能长期使用。(关于冷原子荧光测汞法灵敏度和稳定性影响因素的探讨,包 晓莹,四川环境1991年第10卷第2期:66-70)。 产品名称盐酸羟胺 产品英文名Hydroxyamine hydrochloride 产品别名盐酸胲 分子式NH2OH-HCl 产品用途用作医药和有机合成的原料 CAS号5470-11-1 毒性防护 本品剧毒,对皮肤有刺激性。小鼠经口LD50为400mg/kg。生产设备应密闭,防止跑、冒、滴、漏,操作人员应穿戴防护用具。溅及皮肤时,可用大量水冲洗。 包装储运 采用内层衬塑料袋,中层衬纸袋,外层用聚乙烯的编织袋,再用木桶或纸桶包装,每袋25kg。本品易吸潮,加热时可深度分解,故需密封存放于干燥处,防潮、防热。按有毒物品规定贮运。 物化性质 白色针状结晶,易潮解。相对密度1.67(20/4℃)。熔点159℃(分解)。溶于水、乙醇和甘油,不溶于乙醚。 质量标准HGB 3044-76分子量 结构式 消耗定额 原料名称规格消耗,kg/t 1、亚硝酸钠合成法亚硝酸钠工业级1500 亚硫酸氢钠工业级4550 丙酮工业级1300 硫酸工业级1600 盐酸30% 2180 2、硝基甲烷法硝基甲烷95% 1200 盐酸30% 1500
金属钠练习题
高一中秋节作业 一、选择题(每小题只有一个选项符合题意) 1、将一小块金属钠久置于空气中,有下列现象:①生成白色粉末;②变暗;③生成白色固体;④发生潮解变为液体,这些现象的先后顺序是 A.①②③④B.④③②①C.②③④①D.①③④② 2、金属钠不仅能跟氧气、水等无机物反应,还能跟酒精、醋酸等有机物反应。要研究金属钠跟酒精反应的性质以及它与水反应的异同点,下列研究方法中没有用到的是 A.实验法 B.观察法C.分类法 D.比较法 3、钠与水反应时的现象与钠的下列性质无关的是() A 钠的熔点低 B 钠的密度比水小 C 钠的硬度小 D 钠与水反应产生氢气 4、钠与水反应时产生的各种现象如下:①钠浮在水面上;②钠沉在水底;③钠熔化成小球; ④小球迅速游动逐渐减小,最后消失;⑤发出嘶嘶的声音;⑥滴入酚酞后溶液显红色。其中正确的一组是() A.①②③④⑤ B.全部 C.①②③⑤⑥ D.①③④⑤⑥ 5、取一小块金属钠,放在燃烧匙里加热,下列实验现象正确的描述是:①金属先熔化;②在空气中燃烧,放出黄色火花;③燃烧后得白色固体;④燃烧时火焰为黄色;⑤燃烧后生成浅黄色固体物质 ( ) A.①② B.①②③ C.①④⑤ D.④⑤ 6、一小块钠暴露在空气中一段时间,发生的反应是( ) ① 4Na+O2=2Na2O② 2Na+O2=Na2O2 ③ Na2O+H2O=2NaOH④ 2NaOH+CO2=Na2CO3+H2O A.① B.②④ C.①③ D.①③④ 7.下列各组中的两种物质作用时,反应条件(温度、反应物用量)改变,不会引起产物种类改变的是 ( ) A. Na和O2 B. Ca(OH)2和CO2 C. Na2O2和CO2 D. C和O2 8.下列有关钠的叙述中,错误的是 A、钠的还原性很强,可以用来冶炼金属钛、锆、铌等 B、钠的化学性质非常活泼,钠元素只能以化合态(化合物的形式)存在于自然界 C、钠是一种灰黑色的固体 D、钠的质地软,可用小刀切割 9、将少量金属钠分别投入下列物质的水溶液中,有气体放出,且溶液质量减轻的是A.HCl B.NaOH C.K2SO4 D.CuSO4 10、下列关于Na和Na+的叙述中,错误的是 A.它们相差一个电子层 B.它们的化学性质相似 C.钠原子,钠离子均为同一元素 D. 灼烧时,它们的焰色反应都呈黄色 11.在烧杯中加入水和苯各50ml,将一小粒金属钠投入烧杯中,观察到的现象可能是 A.钠在水层中反应并四处游动B.钠停留在苯层中不发生反应
