碳族元素学习笔记——无机化学

碳族元素预习笔记
一、碳族元素通性
1、原子结构性质
⑴相似性:
?外层电子构型:ns2np2
气态氢化物的通式:RH4
最高价氧化物对应的水化物通式为H2RO3或R(OH)4
⑵递变性
?+2价化合物主要氧化态稳定性:由上至下逐渐增强
+4价化合物主要氧化态稳定性:由上至下逐渐减弱
但铅(Ⅱ)化合物稳定性高于铅(Ⅳ),铅(Ⅳ)本身为强氧化剂。
?熔沸点降低(锡和铅反常),单质密度逐渐增大
?金属性增强,非金属性减弱,(由于半径不断增大,原子核对外层电子引力变小所致)
?最高价氧化物对应水化物的酸性减弱
(最高价氧化物对应的酸举个例子解释:碳酸H2CO3。(HO)2-CO连接一个氧原子,氧原子强吸电子作用导致碳原子电子云密度下降,对应的碳原子同样要从羟基上边多取电子,那么最终结果就是羟基氧
原子再把和氢原子公用的电子对拉向自己。那么此时氢原子是缺电子的,就会很容易电离。氢原子
越缺电子越容易电离;那么对应的中心原子越吸电子,氢原子就越缺电子。所以从上到下,元素原
子电负性减弱,吸电子能力减弱,自然氢离子电离能力减弱,酸性减弱。)
?氢化物的稳定性减弱
?第一电离能:由碳至铅逐渐减小(同主族由上至下半径增大,更易失去最外层电子)特殊:锡<铅?熔沸点:由碳至铅逐渐减小(碳、硅为原子晶体,锗、锡、铅为金属晶体)
二、元素的成键特性
⒈碳:①共价键(sp:CO sp2:乙烯 sp3:甲烷):碳碳,碳氢,碳氧键键能大,稳定,因此碳氢氧
可形成多种有机化合物。
②以碳酸盐的形式存在于自然界中
2.硅:①硅氧四面体形式存在(石英,硅酸盐矿)
②硅硅,硅氧,硅氢键较弱,可形成有机化合物但数量较少
3.锡铅:①离子键(+2氧化态,SnO、PbO +4氧化态,SnCl4)
②共价键(+4氧化态,SnO、PbO2)
二、碳及其化合物
1.单质(三种同素异形体)
①金刚石:结构:sp3杂化,原子晶体,五个碳原子构成正四面体
性质:硬度最大,熔沸点很高(由于其为空间网状结构),无色透明,不导电,化学惰性,但800°C以上与空气反应成CO2
②石墨:结构:sp2杂化,层状原子晶体,每层上的碳原子各提供一个含成单电子的p轨道形成大π
键
层与层之间靠分子见作用力结合在一起。
性质: 灰黑色,硬度小,熔沸点低于金刚石;
化学惰性,500°C可被空气氧化成CO2,也可被浓热HClO4氧化成CO2
7C+4HClO4=2H2O+2Cl2↑+7CO2↑
良好导电性(因为每个碳原子均为sp2杂化,并贡献剩余一个p轨道上的电子形成大π键,
π电子可以自由移动)
润滑剂(同一层晶面上碳原子间通过共价键结合,层与层之间以分子间作用力结合,由于层与层之间的作用力很小,故很容易在层间发生相对滑动。因为这些结构上的特
点,导致它的强度、硬度很低,可以起到很好的减磨作用)
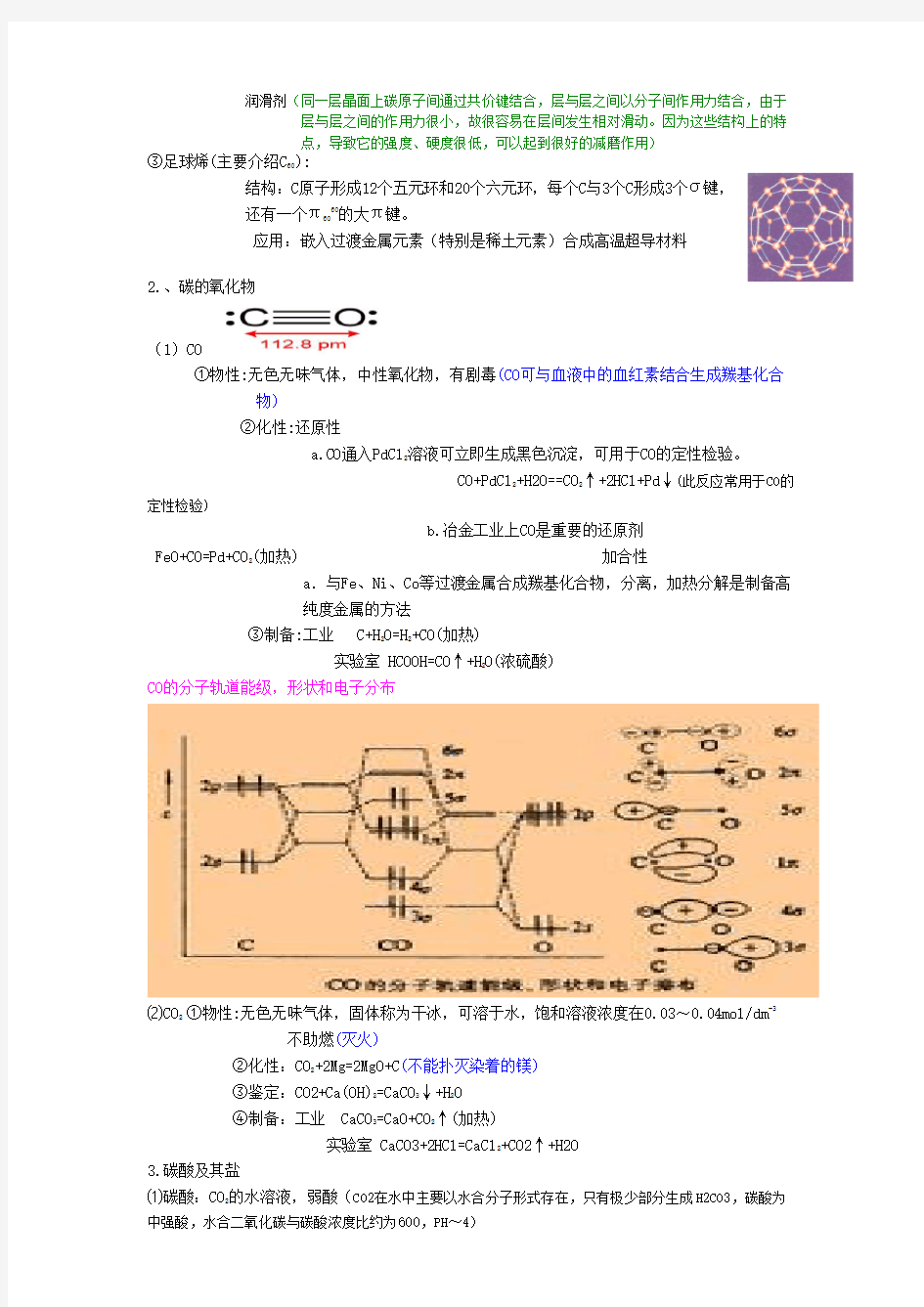
③足球烯(主要介绍C60):
结构:C原子形成12个五元环和20个六元环,每个C与3个C形成3个σ键,
还有一个π6060的大π键。
应用:嵌入过渡金属元素(特别是稀土元素)合成高温超导材料
2.、碳的氧化物
(1)CO
①物性:无色无味气体,中性氧化物,有剧毒(CO可与血液中的血红素结合生成羰基化合
物)
②化性:还原性
a.CO通入PdCl2溶液可立即生成黑色沉淀,可用于CO的定性检验。
CO+PdCl2+H2O==CO2↑+2HCl+Pd↓(此反应常用于CO的定性检验)
b.冶金工业上CO是重要的还原剂
FeO+CO=Pd+CO2(加热) 加合性
a.与Fe、Ni、Co等过渡金属合成羰基化合物,分离,加热分解是制备高
纯度金属的方法
③制备:工业 C+H2O=H2+CO(加热)
实验室 HCOOH=CO↑+H2O(浓硫酸)
CO的分子轨道能级,形状和电子分布
⑵CO2 ①物性:无色无味气体,固体称为干冰,可溶于水,饱和溶液浓度在0.03~0.04mol/dm-3
不助燃(灭火)
②化性:CO2+2Mg=2MgO+C(不能扑灭染着的镁)
③鉴定:CO2+Ca(OH)2=CaCO3↓+H2O
④制备:工业 CaCO3=CaO+CO2↑(加热)
实验室 CaCO3+2HCl=CaCl2+CO2↑+H2O
3.碳酸及其盐
⑴碳酸:CO2的水溶液,弱酸(CO2在水中主要以水合分子形式存在,只有极少部分生成H2CO3,碳酸为中强酸,水合二氧化碳与碳酸浓度比约为600,PH~4)
⑵碳酸盐
①难溶的正盐酸式盐溶解度较大,易溶的正盐酸式盐溶解度较小。NaHCO3比Na2CO3难溶。
(HCO3—离子在它们的晶体中通过氢键结合成链使可溶性的碳酸氢盐的溶解度小于正盐的。)
②阳离子的计划性和变形性越大,碳酸盐热稳定性越低;正盐比酸式盐稳定。
Na2CO3>MgCO3>Al2(CO3)3 BeCO3 正盐比酸式盐稳定(是因为H+是正电荷、小半径的离子,电荷密度集中, H+的反极化作用削弱了C—O键,使得HCO3-不稳定。比如NaHCO3热稳定性差,而Na2CO3热稳定 性好) ③碳酸盐均易水解 三、硅及其化合物 1.单质(无定形态,晶体) ①物性:熔沸点高,硬而脆,灰色,金属外貌 ②化性 a.常温下溶于碱液:Si+2OH-+H2O=SiO32-+2H2↑ Si+4OH-=SiO44-+2H2↑ b.与金属和非金属反应:2Mg+Si=Mg2Si Si+Cl2=SiCl4(400°C) Si+O2= SiO2 Si+C=SiC (2000°C) 3Si+2N2=Si3N4(1000°C) Si+2S =SiS2(高温) 2Mg+Si=Mg2Si c.硅遇氧化性酸发生钝化,可溶于HF-HNO3的混合酸中: 3Si+4HNO3+18HF=3H2SiF6+4NO+8H2O 硅与氢氟酸:Si+4HF=SiF4+2H2↑ d.高温下与水蒸气反应:Si(s)+3H2O(g)=H2SiO3(s)+2H2(g)(加热) ③制备(粗硅) SiO2+2C=Si+2CO↑(加热) SiCl4+2Zn=Si+2ZnCl2(加热) SiO2+CaC2=Si+Ca+2CO SiH4=Si+2H2(加热) 2.二氧化硅——二氧化硅不与水反应,即与水接触不生成硅酸,但人为规定二氧化硅为硅酸的酸酐 ①结构:Si与O以四面体形式连接在一起,形成原子晶体 ②物性:溶沸点高(SiO?中Si—O键的键能很高),无色,难溶于酸(氢氟酸及热浓磷酸除外) ③化性:能溶于热碱 SiO2+2NaOH=Na2SiO3+H2O 能溶于氢氟酸 SiO2+6HF=H2SiF6+2H2O(玻璃容器不能盛放浓碱溶液和氢氟酸; 在高温下,二氧化硅能被碳、镁、铝还原: SiO ?+2C=Si+2CO↑ 若c 过量,则发生反应: Si+C= SiC (金刚砂)(高温) 注:SiO ?是表示组成的最简式,仅是表示二氧化硅晶体中硅和氧的原子个数之比 3.硅酸及其盐 ⑴硅酸(正硅酸 H 4SiO 4;焦硅酸 H 6SiO 7;偏硅酸 H 2SiO 3;二偏硅酸 H 2SiO 5) 性质:二元弱酸,溶解性小,PH≥14时,主要以SiO32-形式存在;PH 在11~13.5之间,主要以Si2O52-存在;PH<11缩合成较大同多酸根离子;PH 再低时,以硅酸凝胶析出;PH=5.8,胶凝速率最快。 ⑵硅酸盐 ①溶解性:除碱金属硅酸盐可溶外,其它皆难溶。常用的为可溶盐为Na 2SiO 3水溶液,又称为水玻 璃、泡花碱。长期贮放NaOH 、Na 2CO 3的瓶子不用玻璃塞,而用橡胶塞。 ②硅酸盐的水解:SiO 32-水解呈碱性,若在其中加入NH 4+ 或通入CO 2则会发生完全水解: SiO 32- + 2NH 4+ + 2H 2O → H 2SiO 3↓ + 2NH 3·H 2O SiO 32- +2CO 2+2H 2O==H 2SiO 3+2HCO 3ˉ 用途:Na2SiO3常做黏合剂,黏合瓦楞纸,洗涤剂添加物 ③常见硅酸盐组成结构结构: a.单聚硅酸根 单个的硅氧四面体,Si:O=1:4 正硅酸根 SiO 44- b. 二聚硅酸根 焦硅酸根 Si 2c.链聚硅酸根 个氧原子。阴离结构,如石棉 [Si n O 3n+1](2n+2)- d.片状聚硅酸根 层状结构,片层之间靠金属离子的静电引力结合在一起,如云母 e.网络状聚硅酸根 硅氧四面休间通过共用 4 个氧原子而组成各种三维网络结构。如果在某个硅氧四面体中有铝原子代替了硅原子,形成的铝硅酸根网络骨架中就带了负电荷,因此在骨架的空隙中必须有平衡骨架负电荷的阳离子存在。如用作催化剂或催化剂载体的沸石分子筛 f.分子筛——人工合成铝硅酸盐 自然界中存在的某些硅酸盐和铝硅酸盐具有笼形三维结构,可以有选择地吸附一定大小的分子,称为沸石分子筛。优点:分子筛的选择性远远高于活性炭等吸附剂 四、锗、锡、铅及其化合物 1.单质 ⑴锗①物性:半金属,结构与金刚石相同,有灰白色金属光泽,熔点1210k,硬度较大 ②化性(还原性):常温下不与氧反应,高温下被氧化; 不与稀盐酸,稀硫酸反应,能被浓硫酸和浓硝酸氧化(GeO2.nH2O): Ge+2H2SO4+(n-2)H2O==Geo2· nH2O+2SO2↑ Ge+4HNO3+(n-2)H2O==nGe2·nH2O+4NO2↑ 碱性溶液中能被氧化成锗酸盐: Ge+2OH- +H2O ==GeO32- +2H2↑ ③制备:含锗矿石→GeCl4→精馏提纯→GeO2→还原→Ge (超纯锗用区域熔融法制备,制造半导体的超纯锗纯度高达99.99999% ) GeS2+3O2==GeO2+2SO2 GeO2+4HCl==GeCl4+2H2O GeCl4+4H2O==GeO2+4HCl 上面2步重复进行 GeO2(纯)+2H2==Ge+2H2O 碱溶液与锗的作用很弱,但与熔融的碱在空气中,能使锗迅速溶解 ⑵锡①物性:银白色金属,硬度低,熔点505k,表面有一层保护膜,在空气中和水中都能稳定存在 同素异形体:灰锡←286K→白锡←434K→脆锡 (α型) (β型)(γ型) 金刚石型立方晶系四方晶系正交晶系 合金:a.马口铁(Fe-Sn):制作水桶、烟筒等 b.青铜(Cu-Sn) c.焊锡(Pb-Sn) ②化性灰锡(α锡)<286K→白锡(β锡)>434K→脆锡,低温下锡的自行毁坏,称为锡疫 Sn+O2=SnO2 Sn+2X2=SnX4 (X=Cl,Br) Sn+2HCl=SnCl2+H2↑ 3Sn+8HNO3(稀)=3Sn(NO3)2+2NO↑+4H2O(与冷的极稀硝酸反应) Sn+4HNO3(浓)=H2SnO3+4NO2↑+H2O(与浓硝酸反应) Sn+2OH-+4H2O=Sn(OH)62-+2H2↑(与苛性碱溶液作用放出氢) Sn + H2SO4 = SnSO4 + H2↑ Sn+4H2SO4(浓)=Sn(SO4)2 +2SO2 + 4H2O SnS + Na 2S 2 → Na 2 SnS 3 (棕色固体溶解在二硫化钠溶液中 。) SnS 2+ Na 2 S → Na 2 SnS 3 (黄色固体溶解在硫化钠溶液中。) ③制备: Sn在自然界主要以氧化物(锡石SnO2)状态存在。 以锡石为原料,焦炭为还原剂,高温下制得粗锡: 矿石→氧化焙烧→金属氧化物→酸溶分离→SnO2→还原→Sn SnO2(s)+2C(s)=Sn(l)+2CO(g) 粗锡电解精炼得到纯锡 ⑶铅①物性:新切开的铅呈银白色,很快表面生成碱式碳酸铅保护膜而显灰色; 密度大(制造铅球,钓鱼坠),硬度小 熔点为601k(制造低熔点合金:保险丝); 能抵挡X射线的穿射(制作X射线防护品) ②化性:铅难溶于稀盐酸和稀硫酸 3Pb+8HNO3(稀)==3Pb(NO3)2+2NO↑+4H2O Pb+2HAc==Pb(Ac)2+H2↑ (PbCl2、PbSO4难溶于水,附着在铅表面阻碍反应进行H2在铅上的超电势较大) 铅易与稀硝酸和醋酸反应 3Pb+8HNO3(稀)=3Pb(NO3)2+2NO↑+4H2O Pb+2HAc=Pb(Ac)2+H2↑) 两性,可溶于碱 Pb+OH-+2H2O=Pb(OH)3-+H2↑ ③制备方铅矿→浮选(漂浮选矿)→焙烧→PbO→还原→Pb 2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) (加热) PbO(s)+CO(g)=Pb(l)+CO2(g) (加热) 2.化合物 ⑴氧化物和氢氧化物 ①锡、铅的氧化物 a.物性:SnO(随制备方法不同而呈黑色和绿色), SnO2(冷时白色,加热变黄色,六方、斜方或四方晶系粉末,在空气中加热时稳定)二氧化锡可以溶于氢氧化钠(强碱溶液)生成锡(IV)酸盐二氧化锡与碘化钾反应(SNO2+2KI=I2+K2SNO2)二氧化锡 (黄色,亦名密陀僧),PbO2(棕黑色) Pb2O3(橙色可看作PbO·PbO2) Pb3O4(红色,亦称红铅,铅丹可看作2PbO·PbO2) Pb在空气中加热与氧气反应生成红色PbO(α型),488℃时红色PbO转化成黄色PbO(β 型) PbO2~600k→Pb2O3~700k→Pb2O3~800k→PbO b.化性:PbO易溶于硝酸,但难溶于碱,而PbO2稍溶于碱而难溶于硝酸,SnO2与NaOH共熔生成锡酸钠Na2SnO3 二价锡盐的热溶液与碳酸钠作用可得SnO Sn2+ + CO32-= SnO + CO2↑ 锡在空气中燃烧可得SnO2 Sn + O2= SnO2 铅在空气中加热即得PbO 2Pb + O2= 2PbO PbO2在酸性介质中有强的氧化性: 5PbO2 + 2Mn2+ + 4H+= 5Pb2+ + 2MnO4- + 2H2O PbO2 + 4HCl = PbCl2 + Cl2↑ + 2H2O PbO2其实是酸性氧化物,它并不与硝酸反应,所以四价产物就是PbO2 Pb3O4+4HNO3==PbO2+2Pb(NO3)2+2H2O C.鉴别:Pb3O4 + 4HNO3= 2Pb(NO3)2 + PbO2 + 2H2O Pb2+ + CrO42-= PbCrO4(黄↓,鉴别Pb2+) 惰性电子对效应:Pb6s26p2,6s2电子不易失去,一旦失去,夺回的倾向很强 d.制备:必须在碱性条件下完成 Pb(OH)3- + ClO-= PbO2 + Cl- + OH- + H2O Pb(Ac)4水解所得PbO2最纯Pb(Ac)4+ 2H2O =PbO2↓+ 4HAc ②锡、铅的氢氧化物 a.在Sn(II)或Sn(IV)的酸性溶液中加入NaOH溶液,生成白色Sn(OH)2沉淀或Sn(OH)4 胶状沉淀,Sn(OH)2和Sn(OH)4都是两性氧化物,既可溶于酸,又可溶于碱,前者以碱性为主,后者以酸性为主 Sn2+ + 2OH-= Sn(OH)2↓ Sn(OH)2 + OH-= Sn(OH)3- 加热Sn(OH)2的悬浊液可得到红色,不稳定的SnO.Sn或SnO在空气中加热被氧化成浅黄色的SnO2, 冷却时显白色 经过高温灼烧的SnO2不再和酸碱反应,但可溶于熔融碱生成锡酸盐 b.在浓强碱溶液中,Sn(OH)3-部分地歧化为Sn(OH)62-和浅黑色的Sn: 2Sn(OH)3-= Sn(OH)62- + Sn↓ c.向Sn(IV)溶液中加碱或通过SnCl4水解都可得到活性的α-锡酸,反应式如下: SnCl4 + 6H2O =α-H2Sn(OH)6↓+ 4HCl d.α-锡酸既可溶于酸溶液,也可溶于碱溶液,在溶液中静置或加热就逐渐晶化,变成β-锡酸,Sn 和浓硝酸作用只能得到不溶于酸的惰性β-锡酸SnO2·nH2O,β-锡酸既难溶于酸溶液,又难溶于碱溶液 e.经高温灼烧过的SnO2,不再和酸、碱反应,但却能溶于熔融碱生成锡酸盐 f.Pb(OH)2是以碱性为主的两性物,溶于酸溶液生成Pb2+,溶于碱溶液生成[Pb(OH)3-] 递变性整理 Ge(OH)2 Sn(OH)2 Pb(OH)2碱性增大 xGeO2·yH2O xSnO2·yH2O PbO2酸性减弱 (酸性介质)GeO2 Sn4+ PbO2氧化性增强 (碱性介质)HGeO2- Sn(OH)62- PbO2氧化性增强 (酸性介质)Pb2+ Sn2+ Ge2+还原性增强 (碱性介质)Pb(OH)3- Sn(OH)3- HGeO2-还原性增强 SiF4 (g) SiCl4 (l)SiBr4(l) SiI4 (s)溶沸点:低高 五、碳族元素卤化物 1.Si的卤化物 ⑴化性:水解性:室温下SiCl4为无色带刺激性的液体,在潮湿空气中水解产生白色的烟雾: SiCl4 + 4H2O = H4SiO4 + 4HCl SiF4为无色带刺激性臭味的气体、易溶于水并水解: SiF4 + 4H2O = H4SiO4 + 4HF SiF4 + 2HF = 2H+ + SiF62-(酸性比H2SO4强) ⑵制备: SiO2 + 4HF = SiF4↑ + 2H2O Si(s) + 2Cl2(g) = SiCl4(l) 根据热力学上的反应耦合制备SiCl4: SiO2 + 2C + 2Cl2= SiCl4 + 2CO 但SiO2比 SiCl4稳定,需和焦炭共热: 2C + O2= 2CO 2.锗、锡、铅的卤化物 卤化物可以分成MX2和MX4两大类。四碘化铅和四溴化铅不能稳定存在 ⑴Sn2+ 的还原性:在酸碱中,还原能力都比较强(这两个反应用于鉴定Sn2+) 2HgCl2 + SnCl2 + 2HCl = Hg2Cl2↓(白) + H2SnCl6 Hg2Cl2 + SnCl2= H2SnCl6 + 2Hg↓(黑) ⑵3HSnO2- + 2Bi3+ + 9OH-= 3Sn(OH)62- + 2Bi↓(黑) + H2O(鉴定Bi3+) ⑶易水解: SnCl2 + H2O = Sn(OH)Cl↓ + H+ + Cl-(配制SnCl2溶液时要加盐酸和锡粒) 六、碳族元素硫化物 1.颜色、溶解性、酸碱性 +2 +4 SnS↓(灰褐) SnS2↓(黄) PbS↓(黑) ── 碱性酸性 以上硫化物均难溶于水和非氧化性稀酸,而GeS和GeS2在水中有一定的溶解度。 2.与NaOH和碱性硫化物反应: 3SnS2 + 6NaOH = 2Na2SnO3 + Na2SnS3 + 3H2O GeS2(白) + Na2S = Na2GeS3(硫代锗酸钠) SnS2(黄) + Na2S = Na2SnS3 SnS2 + (NH4)2S = (NH4)2SnS3 3.硫代酸盐遇酸分解: SnS32- + 2H+ = SnS2↓ + H2S 4.GeS和SnS属于低价态的硫化物,有较强的还原性,可以被氧化性的过硫化钠Na2S2氧化: GeS + Na2S2= GeS2 + Na2S SnS + Na2S2= SnS2 + Na2S 5.PbS不溶于Na2S和Na2S2溶液,但可用浓HCl和稀HNO3将其溶解: PbS + 4HCl(浓) = H2[PbCl4] + H2S 3PbS + 8HNO3= 3Pb(NO3)2 + 3S + 2NO + 4H2O 七、碳族元素在自然界中的分布 1.碳:在地壳中的质量百分含量为0.027% 12C、13C、14C三种同位素 煤、石油、天然气、动植物、二氧化碳(空气中约0.03%体积) 无机物:石灰石(CaCO3)、白云石(CaCO3·MgCO3)、菱镁矿(MgCO3)2.硅:在地壳中的质量百分含量为28.2% Si与O键合成各种链状、层状、立体状结构 硅酸盐形式存在于土壤、泥沙 水晶、硅酸盐矿物如石英、沸石、云母、滑石、高岭土、长石 3.在地壳中的质量百分含量:锗0.0005% 锡:0.0002% 铅:0.0013% 硫化物和氧化物形式存在: 锗石矿 Cu2S·FeS·GeS2硫银锗矿4Ag2S·GeS2 锡石矿 SnO2 方铅矿 PbS 碳族元素.碳及其化合物 1复习重点 1. 碳族元素原子结构的特点、碳族元素化合价为正四价和正二价; 2. 碳族元素的性质及其递变规律; 3. 碳和硅的性质、用途。 2. 难点聚焦 碳和硅的化学性质 项目 CO 2 SiO 2 类别 酸性氧化物 酸性氧化物 晶体类型 分子晶体 原子晶体 熔点和沸点 低 高,硬度大 化学性质 CO2+H 2O H 2CO 3 不溶于水,与水也不反应 CO 2 +2NaOH =Na 2CO<^H 2O SiO 2+2NaOH =Na 2SiO 3+H 2O 化学性 质 还 原 性 与单质反 应 点燃 C +O 2—CO 2 2C +O 2 点燃 2CO A Si +O2—SiO 2 Si + 2F 2 =SiF 4 高温 C +2S(g)=CS 2 Si+2H 2高温SiH 4 (不稳定) 与氧化物 反应 C +2CuO —CO 2 +2Cu 3C + Fe 2O 3 高温 3CO +2Fe 电炉 2C +SiO 2——2CO +Si 2C + SiO 2 高温 2CO +SiC Si +2FeO 高温 SiO 2 + 2Fe 与酸反应 △ C+4H NO 3(浓)=CO 2 +4NO 2 + 2H 2O A C + 2H 2SO 4(浓)= O 2 + 2SO 2 +2H 2O 不与HNO 3、H 2SO 4等反应, Si +4HF=SiF 4 + 2H 2 与水或碱 溶液反应 C + H 2O(g)高温CO + H 2 Si+2NaOH + H 2^ Na 2SiO^2H 2 与CaO 反应 3C +CaO ^^aC 2 +CO 时间:4.24 主持人:xxx 地点:会议室参加人:全体教师 主题:师德在教育教学中的重要性 师德是社会公德的一个组成部分,它是符合教师职业特点的一种行业公德。它又是社会文化长期积淀的特定的一种道德观念、道德准则、道德行为的综合体。同时,作为社会的一种道德观念,它与其他的观念一样,具有鲜明的时代特征——不同历史时期的师德观必定反映出其不同时代的特征,新时期的师德内涵也应体现新时代的精神风貌。因此,人们应从时代特点看待教师形象,教师更应以新的风貌展现于改革的浪潮中,社会应赋予师德以新时期所特有的内涵。否则,错误地理解师德内涵不仅会影响教师队伍的建设,对社会主义教育事业造成不良后果,还将直接影响到社会主义建设的伟业。清楚的理解师德的内涵,对新时期的师德建设有着十分重要的意义。 一、教师应怎样理解师德。 首先,新时期的师德应表现为一种对社会强烈的使命感和责任感,就是为建设社会的物质财富和精神财富奉献自己取之于社会的文化财富和精神财富。这种使命和责任着眼于对全体学生的培养,着眼于学生德、智、体、美等多方面全面发展。 其次,新时期的师德应体现时代赋予教师的时代特征。不仅体现在教师自我较高的科学文化素养和道德修为,还包括先进的社会观、教育观、教学观、师生关系观。 再次,新时期历史时期虽为师德加入了新的内涵,还应认识到师德也表现为一种文化传统、道德传统,教师的形象有历史赋予的光环。率先垂范、为人师表、有学问等素质便是历史赋予师德形象的必要因素。子曰:“躬自厚而薄责于人”、“以身立教、为人师表”又曰“其身正,不令而行;其身不正,虽令不从。”教师的工作是培养人的工作,而最能起到深远影响的是教师的人格因素。有人将教师喻为学生人生的引路人,是十分有道理的。 第四,教师还应认识到教师本身在时代的社会价值,不宜妄自菲薄。“教师是人类灵魂的工程师。”“教师是太阳底下最光辉的职业。” 因此,作为教师要看重自我,懂得自重。陶行知先生说:“要人敬的,必先自敬,重师首先师自重。” 二、社会应怎样理解师德。 首先,教师是一种社会人。教师作为一种职业,它就具有一般普通人从业的特点,教师不是不食人间烟火的神。在社会上,人们特别是家长及教育行政的领导们,要清楚的认识到教师首先是普通人,然后才是从事教育行业的教师。 其次,教师作为一种职业,与其他职业一样,有着本行业的特点,人们应尊重行业的特点,应尊重学校那样的育人圣地。教师在 20XX年高中测试 高 中 试 题 试 卷 科目: 年级: 考点: 监考老师: 日期: 第七章硅和硅酸盐工业 第一节碳族元素 Ⅰ学习重点 1.根据碳族元素原子结构特点,理解为什么碳族元素化合价为正四价和正二价. 2.掌握和解释碳族元素的性质及其逆变规律. 3.了解硅和二氧化硅的结构,掌握硅,二氧化碳,硅酸盐的重要性质. 4.了解硅、二氧化硅的用途. Ⅱ学习难点 1.用原子结构理论解释碳族元素的性质及其递变规律. 2.硅、二氧化硅、硅酸盐的化学性质. 一、选择题 1.下列气态氢化物中最不稳定的是() A.CH4 B.SiH4 C.H2O D.HCl 2.下列说法中,正确的是() A.碳是非金属元素,所以碳单质都是绝缘体 B.硅的导电性介于金属和绝缘体之间 C.锗的非金属性比金属性强 D.锗不存在气态氢化物 3.在元素周期表中,下列有关碳族元素的递变规律正确的是() A.自上而下元素的金属性逐渐增强 B.自上而下元素的非金属性逐渐增强 C.自上而下元素单质颜色逐渐变浅 D.自上而下元素单质溶、沸点逐渐升高 4.碳族元素通常显+2价的原因是() A.得到2个电子 B.只有两个p电子参加反应 C.一个s电子和一个p电子参加反应 D.只有两个s电子参加反应 5.最近科学家制得一种新的分子,它具有空心的类似足球状结构,化学式为C60.下列说法中,正确的是() A.C60是一种新型的化合物 B.C60和石墨都是碳的同素异形体 C.C60中含有离子键 D.C60的式量为720 6.去味剂可以消除冰箱里的一股特殊气味,下列物质可以做去味剂的是() A.干冰 B.活性炭 C.氯气 D.二氧化碳 7.纯净的碳酸氢钙试样在高温下分解,当剩余的固体质量为原试样质量的一半时,碳酸氢钙的分解率是() A.50% B.75% C.92.7% D.100% 8.下列关于硅的说法中,不正确的是() A.硅是地壳中含量较丰富的元素 B.在自然界里,硅存在于各种矿物质和岩石中的形式是硅酸 碳族元素及其化合物 碳族元素通性 1、原子结构性质 相似性: 最外层电子构型:ns2np2 气态氢化物的通式:RH4 最高价氧化物对应的水化物通式为H2RO3或R(OH)4 递变性 +2价化合物主要氧化态稳定性:由上至下逐渐增强 +4价化合物主要氧化态稳定性:由上至下逐渐减弱 铅(Ⅱ)化合物稳定性高于铅(Ⅳ),铅(Ⅳ)本身为强氧化剂。 熔沸点降低(锡和铅反常),单质密度逐渐增大 金属性增强,非金属性减弱,(由于半径不断增大,原子核对外层电子引力变小所致) 最高价氧化物对应水化物的酸性减弱 氢化物的稳定性减弱 第一电离能:由碳至铅逐渐减小(同主族由上至下半径增大,更易失去最外层电子) 特殊:锡<铅熔沸点:由碳至铅逐渐减小(碳、硅为原子晶体,锗、锡、铅为金属晶体) 二、元素的成键特性 ⒈碳:①共价键(sp:CO sp2:乙烯 sp3:甲烷):碳碳,碳氢,碳氧键键能大,稳定,因此碳氢氧可形成多种有机化合物。 ②以碳酸盐的形式存在于自然界中 2.硅:①硅氧四面体形式存在(石英,硅酸盐矿) ②硅硅,硅氧,硅氢键较弱,可形成有机化合物但数量较少 3.锡铅:①离子键(+2氧化态,SnO、PbO +4氧化态,SnCl4) ②共价键(+4氧化态,SnO、PbO2) 碳及其化合物 1.单质(三种同素异形体) ①金刚石:结构:sp3杂化,原子晶体,五个碳原子构成正四面体 性质:硬度最大,熔沸点很高(由于其为空间网状结构),无色透 明,不导电,化学惰性,但800°C以上与空气反应成CO2 ②石墨:结构:sp2杂化,层状原子晶体,每层上的碳原子各提供一个含成单电子的p轨道形成大π键层与层之间靠分子见作用力结合在一起。 性质: 灰黑色,硬度小,熔沸点低于金刚石; 化学惰性,500°C可被空气氧化成CO2,也可被浓热HClO4氧化成CO2 7C+4HClO4=2H2O+2Cl2↑+7CO2↑ 良好导电性(因为每个碳原子均为sp2杂化,并贡献剩余一个p轨道上的电子形成大π键,π电子 可以自由移动) 润滑剂(同一层晶面上碳原子间通过共价键结合,层与层之间以分子间作用力结合,由于层与层之间的作用力很小,故很容易在层间发生相对滑动。因为这些结构上的特点,导致它的强度、硬度很低,可以起到很好的减磨作用) ③足球烯(主要介绍C60): 结构:C原子形成12个五元环和20个六元环,每个C与3个C形成3个σ键, 还有一个π6060的大π键。 应用:嵌入过渡金属元素(特别是稀土元素)合成高温超导材料 师德师风学习笔记 通过今天的师德师风学习,我更加明确了自己所肩负的重任,认识到了师德师风建设的重要性。通过此次学校组织师德师风教育学习,在全面提高教学质量的思想指导下,我谈下面的几点体会: 一、爱岗敬业。首先,要热爱教育事业,要对教学工作有“鞠躬尽瘁”的决心。既然我们选择了教育事业,就要对自己的选择无怨无悔,不计名利,积极进取,开拓创新,无私奉献,力求干好自己的本职工作,尽职尽责地完成每一项教学工作,不求最好,但求更好,不断的挑战自己,超越自己。在教育教学过程中,不断丰富自身学识,努力提高自身能力、业务水平,严格执行师德师规,有高度的事业心、责任心、爱岗敬业。坚持“一切为了学生,为了学生的一切”,树立正确的人才观,重视对每个学生的全面素质和良好个性的培养,不用学习成绩作为唯一标准来衡量学生,与每一个学生建立平等、和谐、融洽、相互尊重的关系,关心每一个学生,尊重每一个学生的人格,努力发现和开发每一个学生的潜在优秀品质,坚持做到不体罚或变相体罚学生。正确处理教师与学生家长的关系,在与家长联系上相互探究如何使学生发展的方法、措施,在教育教学过程中,利用学科特点加强对学生的思想教育,提高他们的思想政治素质,激发他们的学习积极性,努力提高教育教学质量。 二、爱心是师德素养的重要表现。崇高的师爱表现在对学生一视同仁,绝不能厚此薄彼,按成绩区别对待。要做到“三心俱到”,即 “爱心、耐心、细心”,无论在生活上还是学习上,时时刻刻关爱学生,特别对那些学习特困生,更是要“特别的爱给特别的你”,切忌易怒易暴,言行过激,对学生要有耐心,对学生细微之处的好的改变也要善于发现,并且多加鼓励,培养学生健康的人格,树立学生学习的自信心,注重培养他们的学习兴趣,提高教学质量。 三、积极进取,提高业务素养。有句话说的好,没有学不会的学生,只有不会教的老师。这就向老师提出了更高的要求,不断提高自身素质,不断完善自己,以求教好每一位学生。怎样提高自身素质呢?这就要求我们一定要与时俱进,孜孜不倦的学习,积极进取,开辟新教法,并且要做到严谨治学,诲人不倦、精益求精,厚积薄发,时时刻刻准备着用“一眼泉的水”来供给学生“一碗水”。 四、以身作则、率先垂范。教师的一言一行对学生的思想、行为和品质具有潜移默化的影响,教师一言一行,一举一动,学生都欢模仿,将会给学生带来一生的影响,因此,教师一定要时时处处为学生做出榜样,凡是教师要求学生要做到的,自己首先做到;凡是要求学生不能做的,自己坚决不做。严于律已,以身作则,才能让学生心服囗服,把你当成良师益友。身正为师,老师首先要成为有道德的人。作为学生,都愿意接近有师德的教师。而作为教师,自然也都愿意与有教养的学生打交道。所以,要做一个让学生和教师都愿意接近的教师,你本身就应当是一个有道德的人。学生在学校里学习,既受同学的影响也受教师的影响,而更主要的是受教师的影响。学生愿意接近的教师,比学生不愿意接近的教师,对学生的影响要大得多。可见, 无机化学课程教学大纲 课程名称: 无机化学 课程编码:0730011 英文名称: Inorganic Chemistry 学 时: 96 其中实验学时:32 学 分: 5 开课学期: 1 适用专业: 化学工程与工艺 课程类别: 必修 课程性质: 专业基础课 先修课程: 一、课程性质及任务 无机化学是材料与化工学院各专业的第一门化学基础课,在培养学生的化学素质中起着承前启后的作用。无机化学是在中学化学的基础上授以学生无机化学的知识与理论,并为后续专业课程的学习打下良好的基础。 要求掌握化学反应的一般原理(包括化学反应热效应ΔrHm的计算,化学反应方向的判断,化学反应的ΔrGm和ΔrSm的计算,化学平衡及其移动原理,Kθ与T的关系,影响化学反应速率的因素,质量作用定律,反应速率理论,活化能的概念,K与T的关系等)。 要求掌握酸碱的电离理论、质子理论、电子理论及无机化学四大平衡原理(缓冲溶液、溶度积规则、配合物的概念、原电池、电极电势及其应用等) 初步掌握原子结构、分子结构和晶体结构理论(包括微观粒子运动特性、量子数、原子轨道、电子云、核外电子排布规则、元素周期系及原子性质的周期性规律,VB理论、MO理论、键参数、杂化轨道理论、晶体类型、分子间作用力、晶格能、离子极化作用);掌握主族元素和过渡元素及其化合物的通性和特性,并能用无机化学基本知识和理论加以解释。 二、课程的教学要求 1. 理论部分 (1)化学反应速率 了解化学反应速率方程(质量作用定律)和反应级数的概念。能用活化能和活化分子概念说明浓度、分压、温度、催化剂。对均相反应速率的影响。了解影响多相反应速率的因素。 (2)化学平衡 掌握化学平衡概念及平衡移动规律,理解反应速率和化学平衡在实际应用中需综合考虑的必要性。掌握弱电解质的解离度、稀释定律、溶液的酸碱性和pH值、解离平衡、盐的水解、同离子效应、缓冲溶液、溶解-沉淀平衡、溶度积规则、氧化还原平衡和电极电势、配位平衡等内容,并能分析多重平衡系统中的成分及其相互影响。能用平衡常数(kθ)进行有关计算。能计算一元弱酸、一元弱碱的解离平衡组成以及同离子效应和缓冲溶液的pH值。能用溶度积规则判断沉淀的产生、溶解。能用氧化值法、离子电子法配平氧化还原反应方程式;能通过能斯特方程式计算说明浓度(含酸度)、分压对电极电势的影响;会用电极电势判断氧化剂、还原剂的相对强弱和氧化还原反应的方向;会应用元素标准电势图讨论元素的有关性质。能计算配体过量时配位平衡的组成。 (3)化学反应中的能量关系 能用Δf Hm计算化学反应的反应热效应。学习用ΔrGm判断化学反应的方向。 1 (1)碳 与O 2反应 O 2(足量): O 2(不足): 与氧化 物反应 CuO : (冶炼金属) SiO 2: (制取粗硅) H 2O :C +H 2O(g)=====CO +H 2(制取水煤气) 与强氧化 性酸反应 浓H 2SO 4: 浓HNO 3:C +4HNO 3(浓) =====CO 2↑+4NO 2↑+2H 2O) 2013届高三一轮复习碳.硅及其化合物的性质及应用 广州市第五中学 汪爱华 【考纲要求】 1.了解碳.硅元素单质及其重要化合物的主要性质及应用. 2.了解碳.硅元素单质及其重要化合物对环境质量的影响 【教学建议】 1. 用对比类比的归纳的方法对碳、硅单质及氧化物的主要性质及应用的基础知识进行整 理,分成小组,采用思考讨论交流的形式,完成知识点网络的搭建。 2. 关于碳.硅元素单质及其重要化合物对环境质量的影响,可从高考题中总结,让学生熟悉 热点,同时结合元素周期律和结构的理论知识帮助学生理解的基础上加深记忆。 【课时安排】 第1课时:碳、硅单质及氧化物的主要性质及应用 第2课时:硅酸、硅酸盐和无机非金属材料. 【教学过程】 【知识重现1】 1.C 、Si 单质的存在形态、物理性质及用途 (1)碳在自然界既有________态又有________态。碳的同素异形体有________、________、无定形碳、________等。 (2)硅在地壳中的含量占第____位,仅次于____,全部以________态存在,是一种亲____元素,单质硅有________和________形两种。晶体硅是良好的________材料,在计算机等电子工业,可用作____________、大规模____________等。硅是人类将________能转化为____能的常用材料,所以硅还用于制造________。 2.碳、硅单质的化学性质 碳、硅在参与化学反应时,一般表现还原性。 (2)Si ??? 与非金属单质反应??? O 2: F 2 :Si +2F 2 ===SiF 4 Cl 2:Si +2Cl 2=====△ SiCl 4 与氢氟酸反应:Si +4HF===SiF 4 ↑+2H 2 ↑ 【及时练习】 1.下列关于碳族元素的叙述,不正确的是 ( ) A .碳族元素的化合物主要是共价化合物 高温 △ 无机化学精品课程习题库: 第1章第2章 第4章 第5章 第6章 第7章 第8章 第9章 第10章 第11章 第12章(1) 第12章(2) 第13章 第14章 第15章 第16章 第17章 第11章 配位化合物 一.是非题(判断下列各项叙述是否正确,对的在括号中填“√ ”,错的填“×”)。 1.1复盐和配合物就象离子键和共价键一样,没有严格的界限。 ( ) 1.2 Ni(NH 3)2Cl 2无异构现象,[Co(en)3]Cl 3有异构体。 ( ) 1.3配离子 AlF 63-的稳定性大于 AlCl 63-。 ( ) 1.4已知[CaY]2-的K θ为6.3×1018,要比[Cu(en)2]2+的K θ= 4.0×1019小,所以后者更难离解。 () 1.5 MX 2Y 2Z 2类型的化合物有 6 种立体异构体。 ( ) 1.6内轨配合物一定比外轨配合物稳定。 ( ) 1.7当CO 作为配体与过渡金属配位时,证明存在“反馈π键”的证据之一是CO 的键长介于单键和双键之间。 ( ) 1.8 Fe 3+和 X-配合物的稳定性随 X-离子半径的增加而降低。 ( ) 1.9 HgX 4-的稳定性按 F-I-的顺序降低。 ( ) 1.10CuX2-的稳定性按的Cl-Br-I-CN-顺序增加。 () 二.选择题(选择正确答案的题号填入) 2. 1 根据晶体场理论,在一个八面体强场中,中心离子d 电子数为()时,晶体场稳定化能最大。 a. 9 b. 6 c. 5 d. 3 2. 2 下列各配离子中,既不显蓝色有不显紫色的是() a. Cu(H2O) b. Cu(NH3) c. CuCl d. Cu(OH) 2. 3 下列化合物中,没有反馈 π 键的是() a. [Pt(C 2H 4)Cl 3]- b. [Co(CN)6]4- c. Fe(CO)5 d. [FeF 6]3- 2. 4 在下列锰的化合物中,锰的氧化数最低的化合物是() a. HMn(CO)5 b. Mn(NO)3(CO) ?? →?? →??→??→24+ 24 +24+ 24 + 第1-3课时 教师活动学生活动设计意图【提问】有人提出:现代化学 是以碳和硅为首的化学,你知道哪些有关碳和硅及其化合物的知识?(见附1)举例。 引入课题, 激发学生求知 欲。 【板书】 第一节碳族元素 一、碳族元素 1.结构特点 【提问】画出C、Si的原子结构示意图和电子式,比较它们的相似与不同。 【讲解】对学生的回答给予正确的评价,重复正确答案后板书。 【板书】相似点:最外层4e。 不同点:核电荷数、电子层数、 原子半径。一学生到黑板板书,其 余在笔记本上写。 比较C、Si原子结构的异同。 使学生明确碳 族元素原子结构特点。 续表 教师活动学生活动设计意图 【板书】2.性质变化规律 指导学生阅读课本1~2页,总结规律,填写下表: 【投影】(见附2) 【组织讨论】从物质结构角度分析金刚石比晶体硅的熔点高的原因? 阅读课文,总结规律, 填表。 讨论后回答: 都为原子晶体,但碳原 子半径比硅的小,碳原子间 键长比硅的短,键能比硅的 大,所以熔点高。 认识碳族 元素,掌握碳族 元素原子结构 与性质变化的 关系。 明确物质 结构与物理性 质的关系。 【讲解】下面我们通过实 验比较碳和硅的非金属性强弱。 【实验】Mg2Si和盐酸反应 【板书】 观察、比较硅烷、甲烷 的稳定性,确定非金属性碳 比硅强。 比较硅烷 和甲烷的稳定 性,验证非金属 性碳比硅强。 Mg2Si+4HCl=SiH4↑ +2MgCl2 SiH4+2O2=SiO2+2H2O (自然) 【展示】金刚石、石墨图 片,C60结构图片,硅、锡、铅实物样品。【讲解】碳族元素从上到下由非金属递变为金属的趋势非常明显。碳族元素C、Si、Ge、Sn元素的+4价稳定,而+4价的Pb有强氧化性,Pb 的+2价稳定。观察、记忆: C、Si:非金属 Ge:金属性比非金属 性强 Sn、Pb:金属 直观了解碳族元素。 【板书】 二、碳及其化合物的性质【讲解】碳族元素的代表 物之一——碳及其化合物的知识我们已经学习过一部分,下面分别讨论和总结:CH4、C、CO、CO2的氧化性和还原性——从碳的化合价分析;CO2、Na2CO3的化学性质——从物质类别分析。【投影小结】(见附3)分组讨论、总结: 一组:CH4、C 二组:CO、CO2 三组:Na2CO3 (举出反应实例) 总结碳及 其无机化合物 性质。 续表 教师活动学生活动设计意图 【实验】将CO2通入澄清石灰水中,当出现大量沉淀时暂停实验。 继续通入CO2至沉淀完全溶解。练习:将a mol CO2通入含b mol Ca(OH)2的澄清石灰水中,讨论a∶b为何值时: 产物为CaCO3、H2O______ 产物为Ca(HCO3)2______ 产物为CaCO3、Ca(HCO3)2、观察,写出有关化学方程式:CO2+Ca(OH)2= CaCO3↓+H2O 观察,写出有关化学方程式: CaCO3+CO2+H2O= Ca(HCO3)2 (一学生黑板板书) 练习、讨论。 a∶b=1∶1 a∶b=2∶1 1∶1<a∶b<2∶1 使学生明确CO2与碱反应可以得到正盐或酸式盐。定量讨论CO2与碱反应。 师德师风学习笔记 在参加幼儿园教师《师德》学习时,里面就讲了关于幼儿园教师师德的话题,其中有一段是这样讲的:“师德是一名教师从业的基础与根本,作为一名幼儿教师,应具备基本的专业素质的同时,更应具有高尚的师德。”接下来围绕幼儿教师的师德展开讨论,从师德和幼儿教师职业道德;幼儿教师职业道德形成的心理基础;幼儿教师职业道德的自我养成;幼儿教师对待工作的道德要求四个方面结合具体案例具体详细地讲述了幼儿教师如何养成良好的职业道德,已经在对待工作方面应具备怎样道德精神。 关于师德建设的重要性已经成为当今教育工作中的一项根本要求,作为一名教师,具备良好的师德也早已成为国家对教师职业道德规范的职责要求,在构成教师素质诸要素中,师德处于首要地位,这已被全社会所公认。目前,幼儿园教师的师德之所以成为全社会普遍关注的热门话题,原因之一除了独生子女政策导致每个家庭对于孩子的教育与关爱超过了任何国家与我国历朝历代以外,其次就是幼儿教师与其他教师一样在经济浪潮的大环境中出现了师德素质下滑的问题。因此师德建设也成为教育行政部门和幼儿园管理工作中加强教师队伍建设和园所园风建设的一项重要工作。 建立一支高素质的幼儿园教师队伍对发展学前教育,提高学前教育质量有着重大的战略意义。经过几年的幼儿园管理工作和教师队伍建设的实践,在师德建设中虽然取得了一定的成效和经验,但是也存在着诸多问题与困难。当前,探索与构建科学合理、可操作性强、富有时 代特色的幼师师德建设实践模式,已成为学前教育事业发展的重大课题。下面是我们在师德建设中的一些做法和成绩,也有相应的反思与解决不了的难题,在这里和大家共同探讨。 所谓师德师风,即教师的职业道德修养及其表现出来的人生观、价值观及其价值取向下的工作作风和教师思想素质,具体表现包括对国内外政治的关心和了解、对从事的幼教职业的热爱和投入、对本班组教师与同事的团结和协作、对幼儿及家长的尊重和家庭教育指导、对幼教学术的严谨和进取、对自己的终身学习的职业追求和自律以及对国内外幼教理论的吸纳与借鉴等各个方面的综合状况,它是教师队伍建设和教育水平的提高的关键所在。 通过本课程的学习,我更好地了解自己应该具备怎样的道德,更重要地是告诉我该怎样在日常工作中树立良好的职业道德,将观念践行于实践中。 第29卷第3期2014年6月 大学化学 UNIVERSITY CHEMISTRY Vol.29No.3 Jun.2014 中国科学技术大学无机化学实验 课程建设的探索与实践* 黄微** 李婉 刘卫 刘济红 田红军 (中国科学技术大学化学实验教学中心 安徽合肥230026) 摘要 结合中国科学技术大学国家级化学实验教学示范中心的建设,介绍了无机化学实验课程在建设过程中的一些探索与实践,探讨了在建设课程体系二更新实验内容二提升学生兴趣二强化过程管理二加强师资建设等方面所采取的措施,以及所取得的初步成效,并对课程今后的发展提出了展望三 关键词 无机化学实验 教学改革 课程体系 过程管理 无机化学实验是中国科学技术大学(以下简称中科大)面向化学与材料科学学院二少年班学院二地空学院的一年级本科生所开设的实验课程,年授课学时为200,年授课人数约300三作为新生进入高校后的第一门实验课,无机化学实验在整个化学教学中占有举足轻重的地位三因此,如何通过该课程的教学,在传授知识的同时,逐步提高低年级本科生学习化学的兴趣,培养学生的实验操作能力与分析观察能力,激发学生的创新意识,是该课程建设过程中亟需解决的问题[1?2]三近年来,笔者所在的无机化学实验课程组密切配合安徽省精品课程 无机化学”的课堂教学,在建设实验教学体系二更新课程内容二提升学生兴趣二强化过程管理二加强师资建设等方面采取了多项举措,获得了一定成效三现就我们在课程建设过程中的探索和实践与各位同仁探讨,以期作为参考三 1 合理建设课程体系 无机化学实验的授课对象为刚跨入大学校门的新生,他们在学习方法和思维习惯上还处于由中学生到大学生的角色转变阶段,因此,在课程设置方面,我们依照学生在不同阶段所具备的知识水平与认知情况,对无机化学实验的教学内容进行了合理设计与编排,根据循序渐进的原则,分3层次开展实验教学三 针对大部分新生实验基础薄弱,实验知识缺乏的情况,在一年级的第一学期(即秋季学期),课程组开设了无机化学实验(上)(必修课,80学时)三内容设计以传授学生基本实验知识二训练学生基本操作为目标三因此,该阶段的教学内容以基础型和验证型实验为主,如 硝酸钾的制备及提纯”, 容量分析操作”, 由废铁屑制备莫尔盐”三实验内容包括称量二溶解二加热二过滤二结晶二移液和滴定操作等三实验时,教师对每个基本操作进行演示,讲解操作要点,并认真观察学生操作情况,及时纠正错误操作三通过该阶段的实验训练,学生的实验技能有了逐步提高,实验操作开始较为自如,数据的精密度和准确度均有所提高[3]三 在学生掌握了基本实验知识,进行了较为充分的基本实验技能训练之后,实验教学的重心应转移至培养学生发现问题二分析问题二解决问题的能力上三因此,在一年级第二学期(即春季学期)的无机化学实验(下)(必修课,80学时)中,我们逐步增加了综合型实验的比例三实验项目既有经典的综合型实 * **基金资助:国家级实验教学示范中心建设项目;2012年安徽省教学研究项目(No.2012jyxm020);中国科学技术大学本科教学研究 项目;2013年度安徽省重大教学改革项目 通讯联系人,E?mail:hwnk@https://www.360docs.net/doc/17457831.html, 师德师风学习笔记 ***中学 *** 作为一名人民教师,要忠诚党的教育事业,要有广博的知识、更要有高尚师德、优良的师风。师德建设决定教师队伍建设的成败,教师素质的高低又直接决定着培养人材素质的高低;教师的素质直接影响着学校的教风和学生的学风,决定着教育事业发展的成败。 陶行知先生说过:“学高为师,德高为范。”说的都是为师者不仅要有广博的知识,更要有高尚的师德。优良的师德、高尚的师风是搞好教育的灵魂。 科技兴国、科技强国、科技富国是我们党在近期以来的发展战略。随着高科技的发展,国际间高科技、高水平的多样竞争,归根到底是人才的竞争,特别多种人才的竞争。传统型的、简单的手工、高体力支出低收获的劳动方式已经落后,祖国的建设需要各方面的人才,而人才的培养靠的是教育,振兴民族的希望通过学习增强了自己的教育法制理念;通过学习先进事迹,树立了向模范人物学习、当好人民教师的信念。通过学习,我认为: 搞好教育工作要有恒心。所谓恒心,就是忠诚于党的教育事业,要把自己的身心全部投入到所从事的教师职业之 中,一生一世为党的教育事业努力,有成效地工作。 搞好教育要有爱心。爱是教育的基础,没有爱的教育不会是成功的教育,没有爱,就没有真正的教育。爱学校、爱教师、爱学生、师生之爱、生生之爱,是学校教育教学工作良好开展的基础,作为教师要树立正确的学生观,尊重和信任学生,真诚关心学生的进步和成长,要做学生的良师益友。 搞好教育工作要注重业务素质的提高。注重业务素质的提高是现代教育发展的需要。随着信息技术对教育的影响,要求我们的教师必须对教育的思想、观念、模式、内容、方法要有更深的造诣,必须掌握现代教育技术。 师德师风学习,就是要使全体教师真正认识这次活动的重要意义。通过学习教育法令法规、提高教师的教育法律意识和规范行为品德;通过学习模范事迹,掀起学英模促工作的新局面,树立信心,努力工作,使自己成为一名优秀的人民教师。 通过学习《宪法》、《教师法》、《教育法》、《未成年人保护法》、《刑法》,使我懂得要时刻用相关法律法规来规范和鞭策自己,在传授科学文化知识的同时,还要保护学生的身心健康,保障学生合法权益。 教师作为一支具有高素质的社会队伍,学好、用好法律 广西师范大学精品课程、重点课程统计表 附件3 广西师范大学精品课程、重点课程统计表 一、自治区级精品课程 序号 课程名称 课程负责人 所属学院 批准年度 1 无机化学 梁福沛 化学化工学院 2003 2 中国古代文学 张明非(莫道才) 文学院(中文系) 2003 3 中国近代史 唐凌 历史文化与旅游学院 2003 4 中学物理课程与教学论 罗星凯 物理与电子信息学院 2004 5 文学概论 张利群 文学院(中文系) 2004 6 马克思主义哲学 谭培文 政治与行政学院 2006 7 综合英语 李 晓 外国语学院 2006 8 高等代数与解析几何 易 忠 数学科学学院 2006 9 有机化学 苏桂发 化学化工学院 2006 10 普通动物学 周善义 生命科学学院 2006 11 大学英语 柏敬泽 外国语学院 2007 二、自治区级重点课程 序号 课程名称 课程负责人 所属学院 批准年度 1 中国古代文学 张明非 文学院 1996 2 文学概论 王 杰 文学院 1996 3 中国古代史 刘祥学 历史文化与旅游学院 1996 4 田径运动 卢林平 体育学院 1996 5 中学物理教材教学及实验研 究 罗星凯 物理与电子工程学院 1996 6 高等代数 易 忠 数学科学学院 1996 7 马克思主义哲学 王祥俊 政治与行政学院 1996 8 无机化学 李舒婷 化学化工学院 1996 9 美学 王朝元 文学院 1999 10 广西地方史 廖国一 历史文化与旅游学院 1999 11 法学基础理论 周世中 法学院 1999 12 教学论 蒋士全 教育科学学院 1999 13 普通动物学 黄乘明 生命科学学院 1999 14 有机化学 王恒 化学化工学院 1999 13.4锗、锡、铅及其化合物 1、锗、锡、铅单质 (1)物理性质: ①Ge:锗晶格结构与金刚石相同,具有灰白色的金属光泽,粉末状呈暗蓝色,硬度比较大,熔点为1210K。高纯锗是一种良好的半导体材料。 ②Sn:白锡是银白色金属,硬度低,熔点为505K。Sn有三种同素异形体:灰锡(α型)、白锡(β型) 和脆锡。 白锡是银白色略带蓝色的金属,有延展性,可以制成器皿。在常温下,锡是正方晶系的晶体结构,即为白锡。温度低于286K时,白锡将慢慢转换为粉末状地灰锡(无定形),温度越低,转化速度越快,在225K时转变速度最快,因此,锡制品长期处于低温状态会自行毁坏,变成一堆粉末。这种变化先是从某一点开始,然后迅速蔓延,这种锡的“疾病”还会传染给其他“健康”的锡器,被称为“锡疫”。 由于锡怕冷,因此在冬天要特别注意别使锡器受冻。有许多铁器常用锡焊接的,也不能受冻。1912年,斯科特、鲍尔斯、威尔逊、埃文斯、奥茨一行人登上冰天雪地的南极洲探险,他们带去的汽油全部奇迹般地漏光了,致使燃料短缺,探险队遭到了全军覆灭的灭顶之灾。原来汽油桶是用锡焊接的,一场锡疫使汽油漏得无影无踪,造成这样一场惨祸。 温度高于434K时,白锡可以转化为具有斜方晶系的晶体结构的斜方锡。斜方锡很脆,一敲就碎,展性很差,叫做“脆锡”。。 ③Pb:铅是密度很大(11.35g·cm-3)、熔点低(601K)的金属,新切开为银白色,很快在表面生成碱式碳酸铅保护膜而呈暗灰色。铅是银白色的金属(与锡比较,铅略带一点浅蓝色),十分柔软,用指甲便能在它的表面划出痕迹。用铅在纸上一划,会留下一条黑道道。在古代,人们曾用铅作笔。“铅笔”这名字,便是从这儿来的。 所有可溶铅盐和铅蒸气都有毒,一旦发生铅中毒,应注射EDTA-HAc的钠盐溶液,使Pb2+形成稳定的配离子从尿中排出解毒。 (2)化学性质: ①Ge:常温下不与空气中的氧反应,但高温下能被氧气氧化成GeO2,。 Ge不与稀盐酸、稀硫酸反应,但能被浓硫酸和浓硝酸氧化成水合二氧化锗(GeO2·nH2O)。在碱性溶液中能被过氧化氢氧化为锗酸盐。 Ge+4HNO3(浓) GeO2·H2O↓+4 NO2↑+H2O ②Sn:常温下由于锡表面有一层保护膜,所以在空气和水中能稳定存在。 Sn+O2SnO2 Sn +2X2SnX4(X=Cl、Br) Sn在冷的稀盐酸中溶解缓慢,但迅速溶于热浓盐酸中: Sn +2HCl SnCl2+H2↑ 3Sn+8HNO3(极稀)3Sn(NO3)2↓+2NO ↑+4H2O Sn+4HNO3(浓) H2SnO3(β)↓+4N O2↑+H2O 碳族元素和硼族元素 第1题(共6分) 实验室制备少量硅一般采用镁粉还原SiO2的方法,然后用稀盐酸洗涤产品以除去杂质。某同学在进行上述操作时,在制得的产品中加HCl洗涤时突然起火。 (1)请用化学方程式解释: ①稀盐酸洗涤产品可除去哪些主要杂质? ②为什么加HCl洗涤时突然起火? (2)请设计一个实验来验证你的解释。(不必画出装置图,也不必指出具体化学药品,不要写方程式,只要 简明指出方法。) 1.(共6分) (1) ① 2HCl+MgO H2O+MgCl2 2HCl+Mg H2↑+MgCl2 ② SiO2+4Mg Mg2Si +2MgO Mg2Si+4HCl SiH4+2MgCl2 SiH4+2O2SiO2+2H2O (2) 在N2保护下(或惰性气体),对硅烷气体进行检验。 SiH4+2KMnO4H2+K2SiO3+2MnO2↓+ H2O (不要求) (方程式各1分,检验1分) 第2题(8分) C60的发现开创了国际科学的一个新领域,除C60分子本身具有诱人的性质外,人们发现它的金属掺杂体系也往往呈现出多种优良性质,所以掺杂C60成为当今的研究热门领域之一。经测定C60晶体为面心立方结构,晶胞参数a=1420pm。在C60中掺杂碱金属钾能生成盐,假设掺杂后的K+填充C60分子堆积形成的全部八面体空隙,在晶体中以K+和C60-存在,且C60-可近似看作与C60分子半径相同的球体。已知C的范德华半径为170pm,K+的离子半径133pm。 11-1 掺杂后晶体的化学式为;晶胞类型为; 如果为C60-顶点,那么K+所处的位置是;处于八面体空隙中心的K+到最邻近的C60-中心的距离是pm。 11-2 实验表明C60掺杂K+后的晶胞参数几乎没有发生变化,试给出理由。 11-3 计算预测C60球内可容纳的掺杂原子的半径。 第11题(8分) 11-1 KC60面心立方晶胞体心和棱心710pm (各1分,共4分) 11-2 C60分子形成面心立方最密堆积,由其晶胞参数可得C60分子的半径: 师德师风学习笔记 Coca-cola standardization office【ZZ5AB-ZZSYT-ZZ2C-ZZ682T-ZZT18】 师德师风学习笔记 通过今天的师德师风学习,我更加明确了自己所肩负的重任,认识到了师德师风建设的重要性。通过此次学校组织师德师风教育学习,在全面提高教学质量的思想指导下,我谈下面的几点体会: 一、爱岗敬业。首先,要热爱教育事业,要对教学工作有“鞠躬尽瘁”的决心。既然我们选择了教育事业,就要对自己的选择无怨无悔,不计名利,积极进取,开拓创新,无私奉献,力求干好自己的本职工作,尽职尽责地完成每一项教学工作,不求最好,但求更好,不断的挑战自己,超越自己。在教育教学过程中,不断丰富自身学识,努力提高自身能力、业务水平,严格执行师德师规,有高度的事业心、责任心、爱岗敬业。坚持“一切为了学生,为了学生的一切”,树立正确的人才观,重视对每个学生的全面素质和良好个性的培养,不用学习成绩作为唯一标准来衡量学生,与每一个学生建立平等、和谐、融洽、相互尊重的关系,关心每一个学生,尊重每一个学生的人格,努力发现和开发每一个学生的潜在优秀品质,坚持做到不体罚或变相体罚学生。正确处理教师与学生家长的关系,在与家长联系上相互探究如何使学生发展的方法、措施,在教育教学过程中,利用学科特点加强对学生的思想教育,提高他们的思想政治素质,激发他们的学习积极性,努力提高教育教学质量。 二、爱心是师德素养的重要表现。崇高的师爱表现在对学生一视同仁,绝不能厚此薄彼,按成绩区别对待。要做到“三心俱 到”,即“爱心、耐心、细心”,无论在生活上还是学习上,时时刻刻关爱学生,特别对那些学习特困生,更是要“特别的爱给特别的你”,切忌易怒易暴,言行过激,对学生要有耐心,对学生细微之处的好的改变也要善于发现,并且多加鼓励,培养学生健康的人格,树立学生学习的自信心,注重培养他们的学习兴趣,提高教学质量。 三、积极进取,提高业务素养。有句话说的好,没有学不会的学生,只有不会教的老师。这就向老师提出了更高的要求,不断提高自身素质,不断完善自己,以求教好每一位学生。怎样提高自身素质呢这就要求我们一定要与时俱进,孜孜不倦的学习,积极进取,开辟新教法,并且要做到严谨治学,诲人不倦、精益求精,厚积薄发,时时刻刻准备着用“一眼泉的水”来供给学生“一碗水”。 四、以身作则、率先垂范。教师的一言一行对学生的思想、行为和品质具有潜移默化的影响,教师一言一行,一举一动,学生都欢模仿,将会给学生带来一生的影响,因此,教师一定要时时处处为学生做出榜样,凡是教师要求学生要做到的,自己首先做到;凡是要求学生不能做的,自己坚决不做。严于律已,以身作则,才能让学生心服囗服,把你当成良师益友。身正为师,老师首先要成为有道德的人。作为学生,都愿意接近有师德的教师。而作为教师,自然也都愿意与有教养的学生打交道。所以,要做一个让学生和教师都愿意接近的教师,你本身就应当是一个有道德的人。 高一化学第七章《碳族元素和无机非金属材料》 单元检测试题 (考试时间:60分钟,满分:100分) 一、选择题(每小题只有一个正确选项,将其序号填入相应括号内,共45分): 1.下列主族元素中,元素的原子相对来说最不易得电子,也不易失电子的是() (A)ⅠA (B)ⅡA (C)ⅣA (D)ⅦA 2.检验生石灰中混有杂质碳酸钙和石英,应选用的试剂是() (A)水(B)盐酸(C)稀硫酸(D)氢氧化钠溶液 3.最近,科学家研制出一种新分子C60,它具有空心足球状结构,下列说法正确的是() (A)C60是一种新型的化合物(B)C60的熔点高于石墨 (C)C60和石墨都是碳的同素异形体(D)C60的摩尔质量为720 4.下列物质不属于硅酸盐工业产品的是() (A)水泥(B)玻璃(C)陶瓷(D)水晶 5.过量的河沙、纯碱和生石灰熔化后生成下列物质中的() ①水泥;②玻璃;③瓷器;④混凝土;⑤一种硅酸盐产品 (A)①④(B)②⑤(C)③(D)② 6.下列叙述正确的是()(A)石灰窑、玻璃熔炉出来的气体主要成分相同 (B)用石灰抹墙和用水泥砌墙过程的硬化原理相同 (C)玻璃、陶瓷、水泥制成的容器均可用来贮存氢氟酸 (D)酸均不能与酸性氧化物发生反应 7.下列材料中能高质量传导光的是()(A)氮化硅陶瓷(B)氧化铝陶瓷(C)光导纤维(D)玻璃 8.锗酸铋(简称BGO)是我国研制成功的一种性能优良的闪烁晶体材料,其中锗处于最高价态,铋元素(Bi)价态与它跟氯形成某种共价氯化物所呈的价态相同,且此氯化物中铋具有8电子稳定结构。BGO的化学式为()(A)Bi3Ge3O15(B)Bi4Ge3O12(C)Bi4Ge3O16(D)Bi3Ge3O12 9.已知PbSO4为白色难溶物,PbO为黄色固体。将SO2气体徐徐通入悬浮着棕色PbO2的热水中,一段时间后,发生的现象为() 师德师风学习笔记一 师德主要从教师的人格特征中显示出来,历代的教育家提出的“为人师表”、“以身作则”、“循循善诱”、“诲人不倦”、“躬行实践”等,既是师德的规范,又是教师良好人格的品格特征的体现。师德”,它是教师和一切教育工作者在从事教育活动中必须遵守的道德规范和行为准则,以及与之相适应的道德观念、情操和品质。但是教师的道德素质并不是指规范、准则本身,而是教师把这些规范、准则逐步内化,成为教师从事教育事业的准则。 师德师风学习笔记二 在学生心目中,教师是社会的规范、道德的化身、人类的楷模、父母的替身。他们都把师德高尚的教师作为学习的榜样,模仿其态度、情趣、品行、乃至行为举止、音容笑貌、板书笔迹等。因此,可以说教师道德素质比教师文化素质更为重要。师德才是教师的灵魂,是教师人格特征的直接体现。既要言教,又要身教,身教重于言教。这无疑对教师提出了更高的要求。教师要“为人师表”。首先就要特别强调教师的自重、自省、自警、自励、自强,以身作则,言行一致。要学生做的,自己首先要做到;禁止学生做的,自己坚决不做,在行动上为学生做出表率。 师德师风学习笔记三 教师的作用在于“教育”学生,教会学生做人的根本,形成学生高尚的人格。如“天下兴亡,匹夫有责”的爱国主义思想,“天行健,君子以自强不息”的人生进取精神,“地势坤,君子以厚德载物”的博大胸怀,“杀身成仁”、“舍生取义”的高尚气节,,“富贵不能淫,贫贱不能移,威武不能屈”的大丈夫品格,以及信、义、诚、达、礼等一些优秀的人格层面,这就是做人的根本。正如明清之际的思想家孙奇逄所说,教人读书,首先要使受教育者“为端人,为正士,在家则家重,在国则国重,所谓添一个丧元气进士,不如添一个守本分平民”。但是,关键还在于教师本身是否具备这些品质。学生对老师的信奉程度是同其受益程度成正比例的。西汉文学家、思想家、教育家扬雄指出:“务学不如务求师。师者,人之模范也。” 师德师风学习笔记四 教师只有处处要以大局为重,克服个人主义,自觉遵守宪法和社会公德守则,遵守校纪校规,以模范行为为学生做出表率才可能教育学生遵规守纪。因此,教师要认真学习党和国家现行的各项方针政策和社会主义市场经济的法律条文,强化法制观念,在学法的同时,要懂法、守法、护法,以身作则;在学生中碳族元素.碳及其化合物
4.24师德师风政治学习笔记
{高中试卷}高一化学碳族元素测试[仅供参考]
碳族元素及其化合物
最新师德师风学习笔记
无机化学课程教学大纲 - 长春理工大学精品课
碳硅及其化合物教学设计
中南大学无机化学精品课程习题库
碳族元素-教案
师德师风学习笔记
中国科学技术大学无机化学实验课程建设的探索与实践
师德师风学习笔记 (1)
广西师范大学精品课程、重点课程统计表
碳族元素-备课笔记-锗、锡、铅及其化合物
十年奥赛真题分类汇总-碳族元素和硼
师德师风学习笔记
高一化学碳族元素和无机非金属材料同步测试题
师德师风学习笔记 (2)
