甘蔗组培快繁技术实验报告

甘蔗组培快繁技术
生物08本尚丽萍 34号组员:陈洁程燕娜
甘蔗是禾本科甘蔗属植物,是世界上重要的糖料作物,也是中国蔗糖工业的重要支柱。在甘蔗栽培上,通常是以蔗茎节上的腋芽繁殖,或在每年砍伐后,利用残留在土中的茎基上的腋芽作宿根繁殖。茎段繁殖速度慢,用种量大,而且种茎在远途运输中颇为不便,每年秋植蔗种来源难以解决,这对快速繁殖良种甘蔗以满足甘蔗生产的需要极为不利,因此,采用组织培养的方法,规模化生产遗传性状整齐一致的种苗供生产上应用,现将甘蔗组培快繁技术介绍如下。
1材料与方法
1.1材料
甘蔗腋芽及茎尖
1.2方法
1.2.1 材料处理
将所取外植体腋芽(带少量茎节组织)、茎尖(带部分新叶包裹)用洗衣粉水洗净,清水冲洗半小
液处理15分钟,用无菌蒸时,在消过毒的接种间超净工作台上用75%酒精浸泡30秒,再用0.1%HgCl
2
馏水冲洗4-5次后待接种。
1.2.2 培养基
诱导外植体培养基:MS+BA 1mg/L+活性炭1g/L+2%蔗糖+琼脂8g/L。
诱导腋芽增殖培养基:MS+BA 5mg/L+活性炭0.5g/L+20g/L蔗糖;MS+BA 10mg/l+活性炭0.5g/L+2%蔗糖。
诱导生根增殖培养基:1/2MS+NAA 2mg/L+IBA0.4mg/L+多效唑2mg/L。
1.2.3培养过程
将处理好的材料接入诱导外植体培养基中进行培养,光照时间10-12小时/天,光照强度(自然散射或荧光灯照明)1500-2000lux,培养温度25-30℃。培养3-5天后,若培养基出现混浊,说明已污染,应立即清除。培养10-15天,芽转绿将边缘褐色部分剥除转入同样培养基中培养,芽长到2-3cm时,转入诱导腋芽增殖培养基中,如此重复进行,直到所需数量后转入诱导生根培养基中进行生根培养,根长至3-5cm后进入炼苗阶段。
将幼苗不开口移到自然光照下锻炼2-3d,让幼苗接受强光的照射,然后再开口练苗1-2d。从试管中取出发根的幼苗,用自来水洗掉根部粘着的培养基。但要轻轻除去,应避免造成伤根。栽植时用一个筷子粗的竹签在基质中插一小孔,然后将小苗插入,注意幼苗较嫩,防止弄伤,栽后把苗周围基质压实,栽前基质要浇透水。栽后轻浇薄水。再将苗移入高湿度的环境中。保证空气湿度达90%以上。
2关键技术
本实验的关键步骤是诱导甘蔗腋芽,在诱导甘蔗腋芽过程中很容易发生污染以及褐变,所以在外植体的选取上尽量选取较嫩的腋芽或者茎尖分生组织以减少污染和褐变,清洗时要彻底,外植体的消毒时间要充足,以及在培养基中添加活性炭减少褐变。
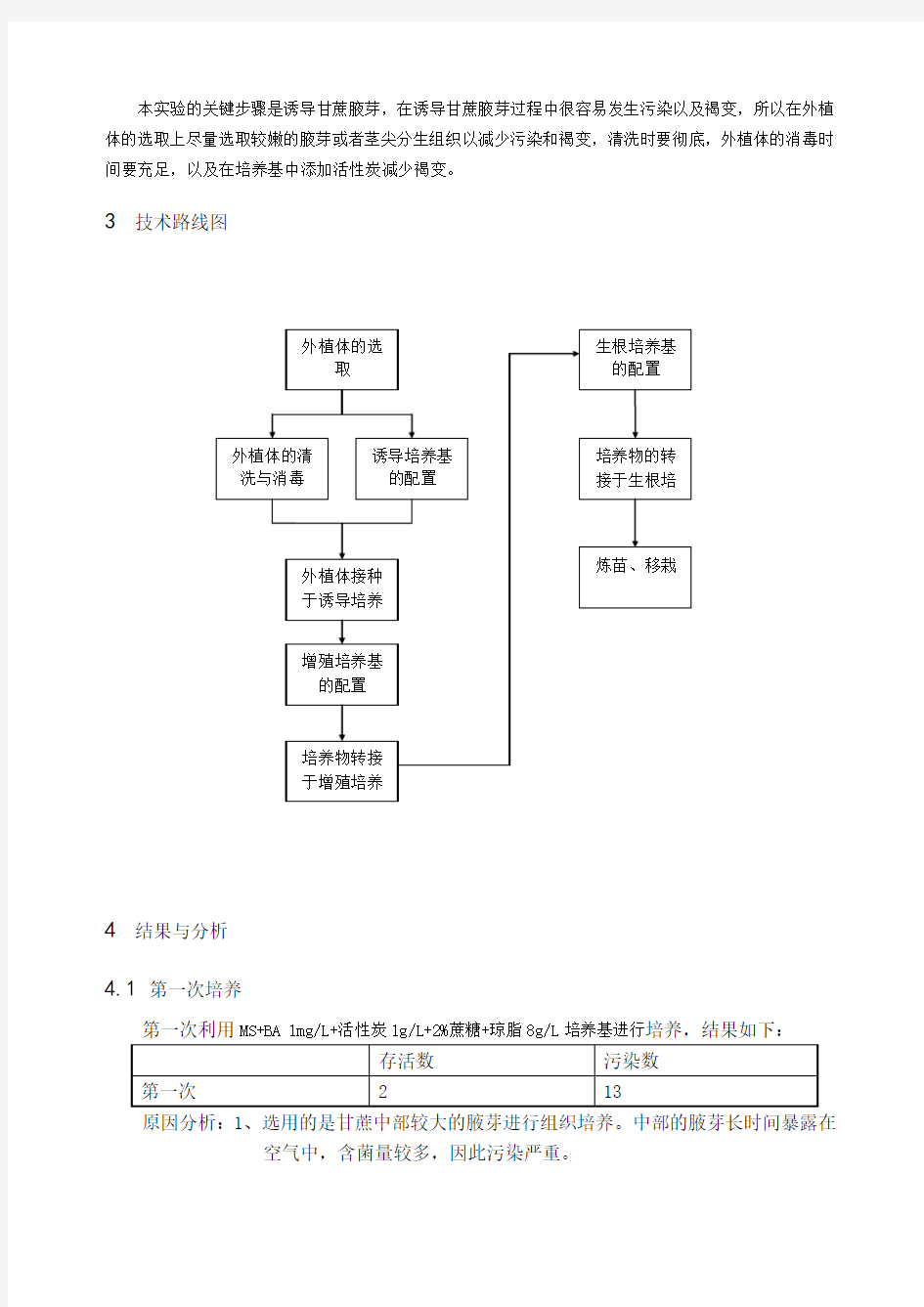
3技术路线图
4结果与分析
4.1 第一次培养
第一次利用MS+BA 1mg/L+活性炭1g/L+2%蔗糖+琼脂8g/L培养基进行培养,结果如下:
原因分析:1、选用的是甘蔗中部较大的腋芽进行组织培养。中部的腋芽长时间暴露在空气中,含菌量较多,因此污染严重。
2、外植体清洗时间不足,消毒时间过短。
3、接种取材时较大,将腋芽处的部分茎节一同接入培养基中,加大了含菌
量和污染的可能。
4.2 第二次培养
第二次利用MS+BA 1mg/L+活性炭1g/L+2%蔗糖+琼脂8g/L培养基进行培养,结果如下:
原因分析:1、选用的是甘蔗中上部生长状况良好的腋芽进行组织培养。中上部的腋芽含菌量依然较多,因此仍有污染现象出现。
2、外植体清洗时间较第一次延长,消毒时间也延长,因此存活率高于第一
次的培养。
3、接种时只取腋芽部分,并剥去腋芽的最外层,目的是去除受伤害的细胞。
4.3 第三次培养
第三次利用MS+BA 1mg/L+活性炭1g/L+2%蔗糖+琼脂8g/L培养基进行培养,结果如下:
原因分析:1、配置培养基时量取准确,PH值调整准确,分装灭菌后检查瓶盖是否松懈,及时旋紧。
2、选用的是甘蔗上部生长状况良好,没有暴露在空气中的腋芽进行组织培
养,此处腋芽含菌量较少,因此污染现象明显降低。
3、外植体清洗时间及消毒时间参考第二次消毒的时间。
4、接种时只取腋芽部分,并剥去腋芽的最外层,目的是去除受伤害的细胞。
接种是采用不同的接种方法,包括直插、斜插等。结果发现去外层和直
插的培养物存活率高于其它。
5、接种过程中不说话,双手不离开操作台。
甘蔗组培快繁技术实验报告
甘蔗组培快繁技术 生物08本尚丽萍 34号组员:陈洁程燕娜 甘蔗是禾本科甘蔗属植物,是世界上重要的糖料作物,也是中国蔗糖工业的重要支柱。在甘蔗栽培上,通常是以蔗茎节上的腋芽繁殖,或在每年砍伐后,利用残留在土中的茎基上的腋芽作宿根繁殖。茎段繁殖速度慢,用种量大,而且种茎在远途运输中颇为不便,每年秋植蔗种来源难以解决,这对快速繁殖良种甘蔗以满足甘蔗生产的需要极为不利,因此,采用组织培养的方法,规模化生产遗传性状整齐一致的种苗供生产上应用,现将甘蔗组培快繁技术介绍如下。 1材料与方法 1.1材料 甘蔗腋芽及茎尖 1.2方法 1.2.1 材料处理 将所取外植体腋芽(带少量茎节组织)、茎尖(带部分新叶包裹)用洗衣粉水洗净,清水冲洗半小 液处理15分钟,用无菌蒸时,在消过毒的接种间超净工作台上用75%酒精浸泡30秒,再用0.1%HgCl 2 馏水冲洗4-5次后待接种。 1.2.2 培养基 诱导外植体培养基:MS+BA 1mg/L+活性炭1g/L+2%蔗糖+琼脂8g/L。 诱导腋芽增殖培养基:MS+BA 5mg/L+活性炭0.5g/L+20g/L蔗糖;MS+BA 10mg/l+活性炭0.5g/L+2%蔗糖。 诱导生根增殖培养基:1/2MS+NAA 2mg/L+IBA0.4mg/L+多效唑2mg/L。 1.2.3培养过程 将处理好的材料接入诱导外植体培养基中进行培养,光照时间10-12小时/天,光照强度(自然散射或荧光灯照明)1500-2000lux,培养温度25-30℃。培养3-5天后,若培养基出现混浊,说明已污染,应立即清除。培养10-15天,芽转绿将边缘褐色部分剥除转入同样培养基中培养,芽长到2-3cm时,转入诱导腋芽增殖培养基中,如此重复进行,直到所需数量后转入诱导生根培养基中进行生根培养,根长至3-5cm后进入炼苗阶段。 将幼苗不开口移到自然光照下锻炼2-3d,让幼苗接受强光的照射,然后再开口练苗1-2d。从试管中取出发根的幼苗,用自来水洗掉根部粘着的培养基。但要轻轻除去,应避免造成伤根。栽植时用一个筷子粗的竹签在基质中插一小孔,然后将小苗插入,注意幼苗较嫩,防止弄伤,栽后把苗周围基质压实,栽前基质要浇透水。栽后轻浇薄水。再将苗移入高湿度的环境中。保证空气湿度达90%以上。 2关键技术
植物组培实验室配置清单
植物组培实验室建设 目录 1、功能简述 (1) 1)准备室 (1) 2)灭菌室 (1) 3)缓冲间 (2) 4)无菌操作室 (2) 5)培养室 (2) 6)驯化室 (3) 7)温室 (3) 8)辅助实验室(非必要) (3) ①细胞学实验室 (3) ②生理生化分析室 (4) 2、设备及耗材清单 (4) 1)试验设备清单 (4) 2)常备试剂清单 (6) ①MS培养基必备试剂 (7) ②常备激素及辅助试剂 (7)
植物组培实验室建设 1、功能简述 植物组织培养实验室一般应包括准备室、洗涤灭菌室、无菌操作室、培养室、缓冲间,这也是组织培养实验所必须具备的基本条件。要培养成大田苗还要有相应的驯化室、温室。 1)准备室 用途:又叫化学实验室,进行一切与实验有关的准备工作。完成所使用的各种药品的贮备、称量、溶解、器皿洗涤、晾置、培养基配制与分装、培养基和培养器皿的灭菌、培养材料的预处理等。 设备:准备室应具备实验台、药品柜、水池、落水架、仪器、药品、防尘橱(放置培养容器)、冰箱、天平(0.1g、0.0001g分度各一台)、干热消毒柜(可省去)、蒸馏水器(可省去)、酸度计(又称pH计,为节约成本和减少维护可用pH试纸代替)、过滤灭菌器、培养皿、培养瓶、三角瓶、试管、电磁炉、水浴锅、漏斗、量筒、刻度移液管(为操作简便起见可购买移液枪1ml、5ml各一个代替)、玻璃棒、酒精灯、镊子、试管架、琼脂、纱布、棉塞、封口膜、大量元素、微量元素、蔗糖、有机物和植物激素的母液(详细内容见附表)、NaOH、盐酸、滤纸、脱脂棉、橡皮筋、牛皮纸等。 图1 准备室图2 灭菌室 2)灭菌室 用途:完成各种器具的保存、培养基的灭菌等。 1
植物组织培养报告
植物组织培养报告内部编号:(YUUT-TBBY-MMUT-URRUY-UOOY-DBUYI-0128)
大蒜茎尖的组织培养 谢婷婷江宋青万嫣文吕凌宇一、实验目的 掌握植物组织培养的相关理论知识及操作方法; 通过自行设计并完成实验,提高动手能力和思维能力; 利用植物细胞的全能性,使大蒜茎尖经过脱分化作用形成愈伤组织,再分化为有结构的组织和器官,最终增殖培育出大量品质优良的大蒜试管苗。二、实验原理 植物组织培养是利用植物细胞的全能性原理。植物组织培养是在无菌环境下,将离体的植物器官、组织以至单个细胞,在人工配置的培养基上培养,使其能够继续生长,甚至分化发育成一完整植株的过程。植物的组织在培养条件下,原来已经分化停止生长的细胞,又能重新分裂,形成没有组织结构的细胞团,即愈伤组织。这一过程称为“脱分化”。已经脱分化的愈伤组织,在一定条件下,又能重新分化形成输导系统以及根和芽等组织和器官,这一过程称“再分化”。 三、实验材料、试剂和器材 1 供试材料 以购于府前菜场的大蒜为实验材料,实验在丽水学院生态学院组培实验室进行。 2 仪器与设备 超净工作台、培养事、电子天平、烧杯、容量瓶、玻璃棒、量筒、移液
管。 3 试剂 70%酒精、95%酒精、0.1%升汞、蔗糖、琼脂条、6-BA(1.5 mg/L;2.0 mg/L)、2,4-D(2.0 mg/L)、NAA(1.0 mg/L;)、IBA(2.0 mg/L)、10倍的大量元素、100倍的微量元素、100倍的铁盐、100倍的有机物。 四、实验步骤 1.培养基的配制及灭菌 诱导培养基:MS+6-BA 2.0 mg/L+2,4-D 2.0 mg/L 出芽培养基:MS+6-BA 1.5 mg/L+NAA 1.0 mg/L 生根培养基:MS+IBA 2.0 mg/L (1)将MS母液(10倍的大量元素、100倍的微量元素、100倍的铁盐、100倍的有机物)按顺序排列、检查是否失效。 (2)在装有3/4蒸馏水的容器中加入0.7%琼脂和3%蔗糖,加热溶化。(3)依次吸取适量各种母液移到容器中。 (4)用蒸馏水定容到相应体积。 (5)调节pH值(用0.1M的NaOH或HCl调节)至5.8-6.0。 (6)向培养基中加入适量激素。 (7)将配制好的培养基进行分装(20-30ml/瓶)。 (8)用两层称量纸包扎瓶口,并用橡皮筋扎牢,然后在高压灭菌锅中121 ℃下灭菌 20 min 。取出三角烧瓶放在台子上,冷却后备用。接种操作所需的一切用具(烧杯、培养皿、灭菌水等),需同时灭菌。 (9)将灭菌后的培养基于常温下放置一星期,观察有无污染。
组织培养实验报告
植物组织培养实验报告 一、实验目的 1.掌握无菌操作的植物组织培养方法; 2.通过配置ms培养基母液,掌握母液的配置和保存方法; 3.通过诱导豌豆根、茎、 叶形成愈伤组织学习愈伤组织的建立方法; 4.通过诱导豌豆茎、叶形成愈伤组织学习愈伤组织的建立方法; 5.了解植物细胞通 过分裂、增殖、分化、发育, 最终长成完整再生植株的过程, 加深对植物细胞的全能性的理 解。 二、实验原理(一)植物组织培养 植物组织培养是把植物的器官,组织以至单个细胞,应用无菌操作使其在人工条件下, 能够继续生长,甚至分化发育成一完整植株的过程。植物的组织在培养条件下,原来已经分 化停止生长的细胞,又能重新分裂,形成没有组织结构的细胞团,即愈伤组织。这一过程称 为“脱分化作用”,已经“脱分化”的愈伤组织,在一定条件下,又能重新分化形成输导系统 以及根和芽等组织和器官,这一过程称“再分化作用”。(二)植物细胞的全能性 植物细胞的全能性即是每个植物的本细胞或性细胞都具有该植物的全套遗传基因,在一 定培养条件下每个细胞都可发育成一个与母体一样的植株。(三)组织的分化与器官建 成 外植体诱导出愈伤组织后,经过继代培养,可以在愈伤组织内部形成一类分生组织即具 有分生能力的小细胞团,然后,再分化成不同的器官原基。有些情况下,外植体不经愈伤组 织而直接诱导出芽、根。 (四)培养基的组成 培养基中各成分的比例及浓度与细胞或组织的生长或分化所需要的最佳条件相近,似成 功地使用该培养基进行组织培养的主要条件。营养培养基一般由无机营养、碳源和能源、维 生素、植物激素(生长调节剂)和包括有机氮、酸和复杂物质的添加剂组成。 三、实验器材 高压灭菌锅、超净工作台、烘箱、培养室镊子、记号笔、橡皮筋、玻 璃器皿、三角烧瓶、烧杯、量筒、剪刀、棉塞、绳子、牛皮纸、酒精灯、喷雾器等。 四、实验材料 豌豆种子 五、实验药品 药品、70% 酒精、 0.1% 升汞、ms培养基、蒸馏水、naoh、 84消毒液、蔗糖、琼脂 等。 六、实验步骤 (一)培养基母液的配制 表1.ms培养基个成分的含量(单位:mg/l) 表2.ms培养基所需母液以及扩大倍数 名称大量元素微量元素 ca盐 mg盐 fe盐有机肌醇激素 扩大倍数 50 50 50 50 50 100 100 100 定容体积(ml) 500 500 500 500 500 200 200 50 吸取毫升数/l 20 20 20 20 20 10 10 5 (注:吸取毫升数为每升培养基所吸取的母液的体积) 表3.配制母液所需的药品及称取量
甘蔗收获机械种类介绍
甘蔗收获机械种类介绍 甘蔗生产全程机械化包括耕整地、种植、中耕施肥、植保、收获、装运等工序,而收获包括切梢、切割、清理和装运等作业工序,其工作量最多,也最为艰苦,约占生产甘蔗总作业量的55%。其中各工序的时间比例为:收割占17.0%,剥叶占59.3%,清理打捆占10.9%,装运占12.8%。 甘蔗机械收获按收获方式分有分段式收获和联合收获两种,其中分段式收获机械包括甘蔗割铺机、甘蔗剥叶机、甘蔗装载机等类型,多数属于整杆式收获机械;而甘蔗联合收获机包括整杆式联合收获机和切段式联合收获机两大类型。国内外已研制的甘蔗收获机械的机型及主要性能参数。 甘蔗割铺机 甘蔗割铺机多数为自走式的小型割铺机或配套中小型轮式拖拉机,较为方便在甘蔗田间转移作业,配套动力多数为4kW~25kW,一般由圆盘切割刀、带拨指的链式扶蔗器和铺放装置等组成。作业时扶蔗器把倒伏的甘蔗植株扶起来,同时蔗根被圆盘切割刀切断后经铺放装置横向铺放在地面上。其结构特点:一般安装地面仿形机构,割台高低可调。代表机型如日本久保田公司生产的NB-11K型,中国农机研究院研制的前置式甘蔗割铺机等。
甘蔗剥叶机 多数为小型自走式剥叶机或手扶拖拉机作为配套动力式,以方便在蔗田间移动作业,适应横向铺放成堆的甘蔗剥叶作业。剥叶元件的使用寿命,剥叶效果是剥叶部件设计的关键,也是甘蔗收获机械设计的难点。过去国内外研制的剥叶机均采用橡胶剥叶部件,由于橡胶部件易磨损,寿命短,且对于弯曲、大小不均的甘蔗植株适应性差而未能大面积应用。而近年研制的剥叶机通过采用尼龙丝状和剥刷总成等剥叶部件,综合性能有所提高。广西大学研制的4ZB-6A型甘蔗剥叶机,采用上、下剥刷总成结构,其主要技术指标已达到国外同类机型的水平。 甘蔗装载机 甘蔗装载机主要有3种型式:一是料斗式装载机,安装在拖拉机上可升降的专用料斗,紧随着甘蔗剥叶机一起前行,承接削叶机构切断后的甘蔗段,装满后卸入地边的包装袋中。二是抓吊式装载机,安装有升降机构,可把成堆的甘蔗抓吊入运输卡车。三是提升式装载机,采用双链式提升结构,多数是移动式,配置小型柴油机,可安装在手扶拖拉机上,方便转移,也有由电动机驱动的固定式。广西南宁市农机化技术推广站研制的5S-15型手扶拖拉机式甘蔗提升装载机。
花卉组培快繁技术及产业化运用
花卉组培快繁技术及产业化运用 一、组培快繁技术 组织培养的依据是植物细胞的全能性,即指具有完整细胞核的植物细胞,都具有形成完整植株所必须的全部遗传信息,从而具备发展成完整植株的能力,在适宜的培养条件下任何一个细胞都可以发育成一个新的个体。组织培养是在无菌条件下利用人工培养基培养植物的细胞、组织、器官等外植体,使其形成完整小植株的繁殖方法,根、茎、叶、花器官,甚至细胞及原生质体等均可作为组培的材料。 1.1 花卉组培概况 组培技术自20世纪60年代开始运用于生产以来,已经在农作物的脱毒、快繁、育种等各个方面取得了令人瞩目的成绩,我国20世纪70年嗲以后才开始快繁技术的研究,20世纪80年代以后开始运用。兰花是最早运用也是最成功花卉,通过原球茎的增殖,一个茎尖外植体一年可以繁殖种苗几十万株,形成了当时的“兰花工业”。之后此技术开始运用于月季、香石竹、菊花、唐菖蒲、非洲菊等许多花卉作物的种苗生产,此外在脱毒培养、种质保存、新品种培育等方面也开展了较多的工作。利用组培快繁技术能短时、高效的提供性状一致的优质种源这一特性,在加速选育种过程中获得的性状优良的品种、品系及生产过程中出现的芽变、名、优、新品种及有利用价值的野生花卉的迅速推广及运用上起到了积极的推动作用,各科研院校和企业着力于花卉的组培技术研究及生产开发,形成了一批集科研和开发于一体的大型花卉种苗企业,就云南来讲,有年产200万株以上组培室8-10家。对培养基、环境因子的影响进行了深入研究,探讨了玻璃化、畸形、黄化、变异的形成机理和防治措施,种苗快繁是组织培养技术在生产中运用最为广泛的一项技术,近几年在花卉种苗工厂化生产中广泛运用,对推动花卉产业的发展起到了积极的促进作用。 1.2 组培程序 1.2.1材料选择 首先在引种、试种及市场调查的基础上,选适栽的优良种品种,并在其中挑选花色纯正、健壮、无病虫害的优良单株作为取材母株,然后根据其组培特性取合适的部位作为外植体。 1.2.2材料消毒 将材料在洗涤剂溶液中清洗干净后,在0.1%-0.2%氯化汞中消毒10-20min,再在0.1%-0.2%次氯酸钠溶液中浸泡10min,用无菌水漂洗3次,在整个消毒过程中,要不断的摇动容器器,使其能够均匀全面的消毒。灭军剂种类和浓度是决定进种成功的关键。 1.2.3生长和分化 将外植体接种于含有各种营养物质和激素的培养基中,MS培养基是运用最为广泛和有效的培养基,它适于多数花卉作物组织培养,生长素和细胞分裂素的种类和浓度因花卉种类和品种以及诱导、增殖、生根等不同阶段而有所不同,经过愈伤组织和不定芽的诱导和分化及丛芽增添制,形成许多芽丛,最后将达到生根
植物组织培养实验报告
植物组织培养实验报告 学院:生命科学技术学院 班级:11生物技术(制品) 学号:2011192017 姓名:李鹏
植物组织培养实验报告 实验一植物组织培养母液的配制 一、实验目的 1.了解植物组织培养基本培养基的组分及其作用。 2.学习掌握植物组织培养MS培养基的配制方法。 二、实验原理 培养基是植物组织培养中离体组织赖以生存和发育的条件。大多数培养基的成分是有无机盐、有机化合物(碳源、维生素、肌醇、氨基酸等)、生长调节物质、水分和其他附加物等五大类物质组成。 无机盐类由大量元素和微量元素组成。大量元素中,氮类化合物主要以硝酸类和铵类化合物的形式存在,但在培养基中多用硝酸类,也可以将硝酸类和铵类混合使用;磷和硫常用磷酸盐和硫酸盐来提供;钾是培养基中主要的阳离子;钙、钠、镁的需要量较少。微量元素包括碘、锰、铜、锌、钴、铁。培养基中的铁离子,大多数以螯合物的形式存在,即硫酸亚铁与乙二胺四乙酸二钠的混合。 有机化合物包括碳源、维生素、肌醇、氨基酸等。培养中的植物组织和细胞的光合作用较弱,因此,需要在培养基中附加一些碳水化合物物来提供营养需要。培养基中的碳水化合物通常为蔗糖。蔗糖除了作为培养基的碳源和能源外,对维持培养基的渗透压也起着重要的作用。在培养基中加入维生素有助于细胞的分裂和增长。一般包括VB1、B6、烟酸、生物素、叶酸、泛酸钙、VC。肌醇在糖类的相互转化、维生素和激素的利用等方面具有重要的催进作用。 常用的植物生长调节物质包括以下三类:①生长素类:吲哚乙酸(IAA)、萘乙酸(NAA)、二氯苯氧乙酸(2,4-D)②细胞分裂素:玉米素(ZT)6-苄基嘌呤(6-BA)和激动素(KT)。③赤霉素:组织培养中使用的赤霉素只有一种,即赤霉酸(GA3)。 培养基中的其他附加物包括人工合成和天然的有机物附加物。其中最为常见的为酵母提取物。琼脂作为培养基的支持物,也是最常用的邮寄附加物,他可以是培养基呈固体状态,以利于组织和细胞的培养。 植物组织培养是否成功,在很大的程度上取决于培养基的选择之上。目前普遍使用的是MS培养基。MS固体培养基可用于诱导愈伤组织,或用于胚胎、茎段、茎尖及花药的培养等。MS培养基的硝酸盐、钾和铵的含量略高于其他的培养基,也是它被普遍使用的原因之一。 三、实验材料、试剂、配方和仪器设备 1.试剂 NH 4NO 3 ,KNO 3 ,KH 2 PO 4 ,CaCl 2 ·2H 2 O ,MgSO 4 ·7H 2 O,FeSO 4 ·7H 2 O Na 2-EDTA,MnSO 4 ·4H 2 O,ZnSO 4 ·7H 2 O,H 3 BO 3 ,KI,Na 2 MoO 4 ·2H 2 O CuSO 4 ·5H 2 O,CoCl 2 ·6H 2 O,肌醇,甘氨酸,盐酸硫胺素,盐酸吡哆醇,烟酸, 蒸馏水。 2.仪器设备 电子天平,烧杯(50ml、100ml、500ml)量筒(1000ml、100ml、25ml),容量瓶(1000ml、500ml、100ml),移液管(10ml,5ml,1ml)试剂瓶,玻璃棒数支,药匙,称量纸等。
植物组培实验报告
姓名班级学号实验日期 科目植物生理学实验实验名称Effects of Hormones on Morphogenesis in Plant Tissue Culture 合作者指导教师成绩 Effects of Hormones on Morphogenesis in Plant Tissue Culture Introduction The technology of plant tissue culture is based on the principle of totipotency which means the capacity to generate a whole plant from any cells or an explant.During the plant tissue culture,the hormones affect largely on morphogenesis,such as Auxin and Cytokinin.And the content and ratio of these hormones can make different results.NAA is the routine reagent of auxine and6-BA is the reagent of cytokinin.For the tissue culture,we prepare the Murashige and Skoog’s medium(MS medium).The MS medium contains hormones,macronutrients and micronutrients(detailed ingredients are in Table 2-1).The pH in the medium will be adjusted with1M NaOH.We should prepare10MS media with hormones. During the whole operation of tissue culture,six potential source of contamination are air,water, growth media,equipment,explant and people.We use the laminar flow hood to remove most of microbes from air flow.The water and the media have been autoclaved.The tools should be kept sterile in the70%alcohol and flamed by alcohol burner.And we sterilize the explants with Ca(ClO)2and70% ethanol and sterile water. We use the NAA to induce the callus to generate root. Materials Fresh young leaves of tobacco(Nicotiana tabacum) MS medium:NH4NO3,KNO3,CaCl2,MgSO4,KH2PO4,MnSO4?H2O,ZnSO4?7H2O,KI,Na2MoO4?2H2O,CuSO4?5H2O,CoCl2?6H2O,Na2EDTA,FeSO4?7H2O,Nicotinic acid,Pyridoxine HCl(VB6), Thiamine HCl(VB1).Glycine,Mesoinositol. Agar,HgCl2,NAA,6-BA.2%Ca(ClO)2,sterile distilled water,70%ethanol,Beaker,Balance,10 Bottles,pH test strips,Laminar flow hood,Tween-80,Scissor,Forceps,Scalpels,Alcohol lamp. Method Part1:Prepare10bottles of culture. 1.Wash10bottles and dry them for a group. 2.Our group’s task:Weigh50mg6-BA and mix with sterile distilled water to be50mL1mg/ml solution in a bottle and mark the stock solution name,the date,and our group number. 3.Other groups prepare the MS medium culture,agar,NAA and sugar.In Table2-1,MS=100ml A+ 1ml B+10ml C+5ml D+10ml E.Every3group prepare1L medium=MS+1mg/ml6-BA+ 0.2mg/L NAA+3%sugar+0.7%agar.Boil the solution with induction cooker to mix thoroughly. 4.Adjust the pH of medium to 5.8with1M NaOH or HCl. 5.Repackage the1L medium to the bottles of3groups.10bottles of each group,30ml for each bottle. 6.Sterilize the culture bottles by autoclaving at115℃for30min.Store them at room temperature. Part2:Operation of plant tissue culture. 1.The space in the laminar flow hood has been sterilized by UV light for15min.We place all items in well order to start working. 2.Rinse4young leaves as explants in tap water for10-30min.The next operations are all aseptic.
园林植物快繁技术试卷
园林植物快繁技术(2007.9) 一、单项选择题(本大题共17小题,每小题1分,共17分) 每小题列出的四个备选项中只有一个是符合题目要求的,请将其代码填写在题后的括号内。错选、多选或未选均无分。 1、将培养体转移到新的培养基的过程,称为 A. 初代培养 B.继代培养 C.固体培养 D.平板培养 2、固体培养基中,常加入的凝固剂是 A.琼脂 B.活性炭 C.蔗糖 D.抗生素 3、花药和花粉培养时,对多数植物而言,花粉最容易诱导成功时期为 A.单核中期至单核晚期 B.双核期至三核期 C.三核期 D.减数分裂前期至中期 4、1960年,在快速繁殖和脱病毒上有重要贡献的法国人是 A. Murashige B. Cocking C. Morel D. Haberlandt 5、对外植表面灭菌时,较难从外植体上去除的消毒剂是 A.次氯酸钾 B.升汞 C.乙醇 D.过氧化氢 6、花药培养中,染色体加倍常用的诱变剂是 A. KT B. 蔗糖 C.聚乙二醇 D.秋水仙素 7、植物组织培养的理论基础是 A.植物细胞全能性 B.植物细胞学 C.细胞学说 D.植物生理学 8、利用母液配制MS培养基1升时,需吸取100X微量元素母液、称取0.7%琼脂的量 分别为 A.5ml;7.0g B.10ml;7.0g C10ml;0.7g D.5ml;0.7g 9、对于热不稳定物质,如IAA,常采用灭菌方式为 A.表面消毒 B.高压蒸汽灭菌 C.干热灭菌 D.过滤灭菌 10、细胞分裂素的主要作用是 A.促进细胞分裂和分化 B.促进细胞伸长和分裂 C.促进脱落和衰老 D.加速细胞的伸长生长 11、花粉培养时,小孢子的第一次分裂从不均等分裂变为均等分裂,分裂后形成两个大 小、形态和染色深浅相同的细胞,而后再继续分裂发育为花粉胚,该雄核发育途 径是 A.营养细胞发育途径 B.营养细胞和生殖细胞同时发育类型 C.生殖细胞发育类型 D.花粉均等分裂途径 12、植物无糖组织培养中,植物体的碳源是 A.蔗糖 B.氨基酸 C.CO2 D.活性炭 13、悬浮培养时,细胞数目扩增生长曲线呈 A.Z形 B.S形 C.L形 D.W形 14、配制NAA母液时,需先用下列哪种溶液溶解,再进行定容? A.蒸馏水 B.乙醇 C.盐酸 D.丙酮 15、培养基的湿热灭菌时,一般灭菌的温度是 A.75摄氏度 B.100摄氏度 C.121摄氏度 D.160摄氏度 16、植物组织培养实验室中,接种室最常用的装置是 A.摇床 B.电子平台 C.高压蒸汽灭菌锅 D.超净工作台
植物组织培养实验报告
植物组织培养实验报告 摘要:以大豆子叶为外植体,在MS培养基上附加不同浓度、不同种类的植物激素,以研究不同激素组合和不同浓度对大豆子叶愈伤诱导率的影响,并练习无菌操作。实验结果显示第2组即MS+6-BA(2.0mg/L)+NAA(1.0mg/L)和第 3 组即MS+KT(0.5mg/L)+2,4-D(1.0mg/L) 培养基中愈伤组织诱导率较高,为较佳的愈伤组织诱导组合。 关键词:大豆;植物组织培养;无菌操作;愈伤组织 1.材料与方法 1.1实验材料:大豆子叶 1.2实验试剂与仪器 (1)试剂:75%酒精、MS干粉、蔗糖、琼脂、植物生长调节剂(NAA、2,4-D、KT、6-BA)、无菌水、升汞、NaOH溶液 (2)仪器:超菌净工作台、圆纸片、培养皿、封口膜、称量纸、千分之一天平、不锈钢杯子、移液枪、试管、高压灭菌锅、注射器、酒精灯、镊子、手术刀、搁置架、烧杯、电炉。 1.3实验方法 1.3.1培养基的配制与灭菌 1.3.1.1 配制培养基的准备阶段 (1)准备80个培养试管及封口膜,2个小培养皿、1个大培养皿,用洗衣粉、自来水洗净,再用蒸馏水把每个培养试管、润洗一下。带晾干后将试管编号1-80;(2)在称量纸上用百分之一天平分别称取1.5g 琼脂4份,7.5g 蔗糖4份,在烧杯里用千分之一天平上称取1.185g MS干粉4份(烧杯不要清洗);
(3)剪小圆纸片40,均分在两个小培养皿小能从中自由取出为宜;剪大圆纸片10,均分在两个大培养皿中。然后分别用报纸包好。 (4)把接种工具手术刀、镊子、剪刀等用报纸包好。 1.3.1.2 配制培养基 (1)在装有MS干粉的烧杯中按下表加入植物生长调节剂 实验所用的所有激素浓度均为0.5mg/mL 激素的加样量(ml) 编号培养基配置 6-BA NAA KT 2,4-D 1 MS+6-BA(1.0mg/L)+NAA(0.5mg/L) 0.5 0.25 2 MS+6-BA(2.0mg/L)+NAA(1.0mg/L) 1.0 0.5 3 MS+KT(0.5mg/L)+2,4-D(1.0mg/L) 0.25 0.5 4 MS+KT(1.0mg/L)+2,4-D(2.0mg/L) 0. 5 1.0 (2)用量筒量取250ml(稍多)蒸馏水,取一个不锈钢杯子加入150ml蒸馏水和称量好的琼脂,在电炉子加热沸腾2min,再加入混合好的MS培养基1号和蔗糖,混合沸腾2min,用剩余的蒸馏水定容至250ml; (3)当温度降到60℃左右时,将溶液pH 调至5.8,一般加4滴NaOH溶液即可;(4)取编号1-20的培养试管,用大量注射器以每瓶12.5ml 左右培养基分装在培养试管中,用封口膜封口,4支一捆捆扎好。 (5)用相同的方法配置2-4号培养基,并分装、捆扎。 1.3.1.3高压湿热灭菌 (1)将包好的接种工具,包好的培养皿,以及分装好的试管一起放到高温灭菌
甘蔗收割机
第一章概述 §1-1甘蔗收割机研究背景 农业的根本出入在于机械化,实现农业机械化不但是为了有效的解决“三农”问题,减轻农民的负担,加速建设我国社会主义现代化农业,缓和加入WTO之后我国蔗糖业所受到的严重冲击,而且对于推进生产力的发展,加快世界工业化进程,都有着十分重要的意义。当今世界机床业已经有了很大的发展,无论是CNC系列还是加工中心,世界上的装备业已经具备了相当的水平。工业机械的飞速发展,小麦收割机、水稻收割机等谷物联合收割机的更新换代,大大的推进了当今世界工业化的进程,这也同样使得甘蔗联合收割机的发明研究成为十分的必要与迫切。 一、农业机械概况 (一)农业机械的类型 农业机械分固定作业和田间作业两大类。固定作业的农业机械在作业过程中位置固定不动,其工作部件由内燃机、电动机或由拖拉机的动力输出装置驱动,如各种农产品加工机械等。田间作业的农业机械有自走式及由拖拉机牵引、悬挂、半悬挂等几种类型。它们各自的特点如下: 自走式:本身具有发动机、行走装置、操向装置等。可独立进行田间作业,机动灵活,视野良好,设计时不受拖拉机结构、性能等的限制。但结构较复杂,成本较高。 牵引式:由拖拉机牵引作业,在工作或运输时其重量均由本身具有的轮子承受。机组的稳定性好,对不平地面的适应性强。但机动性较差,金属消耗量大。 悬挂式:悬挂在拖拉机的悬挂装置上,在运输时全部重量由拖拉机承受。结构紧凑,重量轻,机动性好。但大型、宽幅机具的稳定性和对地表适应性较差,机具重量受拖拉机悬挂装置提升能力的限制。 半悬挂式:悬挂在拖拉机的悬挂装置上,但本身还具有转子。在运输时承受机组的部分重量,可减轻悬挂装置所需的提升力。其优缺点介于牵引式和悬挂式之间。 有些田间作业如播种、施肥、施农药等,还可由装有各种工作部件的农用飞机来完成。 (二)对农业机械的一般要求 农业机械以土壤、作物、牲畜以及水、肥、农药等各种物料为工作对象。由于这些工作对象在类型、品种和特性上的多样性,对各类农业机械的要求也有很大的差异。这些要求还由于不同地区、不同农作物对各项作业要求的不同(含禽畜饲养方式的不同)而存在不同程度的差异。因此,农业机械应能适应各种不同的条件和不同的农作制,满足各项农业技术要求。 农业机械的设计还必须考虑到在使用新的农业机械以后,能够通过提高劳动生产率,抢赶农
蓝莓组培快繁技术实例 · 附配方
蓝莓(Vaccinium corymbosum)属杜鹃花科,越橘属植物。起源于北美,多年生灌木小浆果果树。因果实呈蓝色,故称为蓝莓国际粮农组织将其列为人类五大健康食品之一。 本试验以蓝莓半木质化茎段为外植体,并通过瓶外生根技术,建立起植株再生体系。 1 材料与方法 1.1 外植体材料及培养条件 1.1.1 外植体选择 高灌蓝莓半木质化茎段。 1.1.2 外植体预处理及灭菌 剪取蓝莓半木质化枝条,立即去掉上部叶片带回室内,剪成带有一个叶芽2-3厘米长茎段,在流动自来水中冲洗20-30分钟,在超净工作台上用75%酒精消毒2-3分钟,用无菌水冲洗3次,吸干水后在0.1%升汞中消毒5-8分钟,用无菌水冲洗3次,吸干水分,剪去茎段两端约 0.5-1厘米,立即接种到初代培养基中。 1.1.3 培养条件 诱导培养基:改良WPM + ZT 1.0mg/L 增殖培养基:改良WPM + IAA 0.1mg/L + ZT 2.0mg/L 复壮培养基:改良WPM + IBA 0.1mg/L WPM具体改良为:以硝酸钙 684mg/L、硝酸钾 190mg/L、EDTA铁钠 73.4mg/L和盐酸硫胺素0.1mg/L代替原WPM培养基中的硫酸钾、氯化钙、硫酸亚铁和乙二胺四乙酸钠。 以上培养基均加蔗糖3%,琼脂0.7%,pH值5.2。 培养温度为25℃,光照强度为2000lx,光照时长为12-16时/天。
2 结果与分析 2.1 初代诱导培养 将处理好的外植体立即接种到诱导培养基中,5-6天叶芽开始萌动,10天开始展叶,20天腋芽长到1厘米长,30天腋芽长到1.5-2.5厘米长。 2.2 继代增殖培养 将初代培养长出的茎剪成1.5-2厘米长茎段转接到增殖培养基中。30-35天增殖5-7倍,增殖苗生长健壮。 2.3 复壮培养 将继代苗剪成1-1.5厘米茎段,转接到壮苗培养基,复壮培养30-40天,复壮苗高5-6厘米且粗壮。 2.4 瓶外生根培养
组培实验报告
学号姓名 学院 专业、班级 实验课程名称红豆杉愈伤组织的诱导培养 1. 实验设备及材料 (1)主要实验用具和仪器 冰箱,普通天平,分析天平,各种型号的试剂瓶(棕色和白色)、电炉,三角瓶,移液管,量筒,烧杯,容量瓶,玻璃棒,医用口杯,精密pH试纸(pH5.4~7.0),药勺,称量纸,标签纸,封口膜,橡皮筋,电炉,高压蒸汽灭菌锅、100ml三角瓶、500ml 搪瓷杯、25ml量筒、10ml和5ml吸管、解剖刀、已灭菌培养皿、酒精棉球、小块纱布、已灭菌培养皿和滤纸、枪状镊子、眼科手术剪、手术刀、酒精灯、100ml三角瓶、500或1000ml搪瓷杯、50ml量筒等。 (2)药品和试剂 硝酸铵、硝酸钾、氯化钙、硫酸镁、磷酸二氢钾、碘化钾、硫酸锰、硫酸锌、钼酸钠、硫酸铜、氯化钴、乙二胺四乙酸二钠、硫酸亚铁、甘氨酸、盐酸硫胺素、盐酸吡哆素、烟酸、肌醇、2,4-D(2,4-二氯苯氧乙酸)、NAA(α-萘乙酸)、6-BA (6-苄基腺嘌呤)、浓盐酸、氢氧化钠、95%酒精、蒸馏水等。MS培养基母液、琼脂、蔗糖、生长调节物质、蒸馏水、1mol·L-1HCl、1mol·L-1NaOH、愈伤组织继代培养基、75%酒精。(3)实验材料 红豆杉种子 处于脱分化进程中的外植体 2.实验方法步骤及注意事项 I、MS培养基母液和常用试剂的配制 (1)培养基的成分 目前,不论液体培养还是固体培养,大多数植物组织培养中所用的培养基都是由无机营养物、碳源、维生素、生长调节物质和有机附加物等几大类物质组成。 (2)培养基的配制方法 配制培养基的最简单的方法是用市售培养基干粉溶解在蒸馏水里,加上蔗糖、琼脂和其他必要的补加物,再加入蒸馏水使之达到最终的容积。最后调节pH值,高压灭菌,于是制成所需要的培养基。 如果没有培养基干粉,则可采用以下两种方法来配制: 一个是按照配方规定的数量分别称量出各种成分,分别使它们溶解于水,然后再将它们混合在一起。 另一个是先配制一系列的浓缩贮备液(母液),贮存在2~4℃冰箱内,待配培养基时取出,按比例稀释配用。此法较为常用。 (3)MS培养基母液的配制 母液的配制有两种方法:
甘蔗收获机全液压系统设计反思
甘蔗收获机全液压系统设计反思摘要:全液压系统是目前甘蔗收获机中的最核心装置,液压技术是目前研究甘蔗收获机技术的一个重要方向。本文结合当前的研究成果,介绍了当前适应性较强、系统较为稳定、技术也更为成熟的切段式甘蔗收割机的工作原理,分析了各个环节液压系统的设计,仅供参考。 关键词:切段式甘蔗收获机;全液压系统;机械设计 1甘蔗收获机工作原理 切段式甘蔗收获机在进行收割作业时首先利用分禾器将缠绕在一块和倒伏的甘蔗相分离,扶起倒伏的甘蔗,将行间内的甘蔗集中在收获机的工作范围之内,利用压倒辊推倒甘蔗,使用底部切刀圆盘将甘蔗旋转切断,接着运用输送系统将已经切断的甘蔗输送到除杂装置上,利用切段装置将其切成甘蔗段,再利用鼓风机吹走甘蔗叶子和甘蔗梢的杂物,使较重的甘蔗段落入甘蔗收集袋里或者输送臂上,最后将甘蔗运送出去[1]。切段式甘蔗收获机功能比较齐全,自动化程度较高,但是要求收割后的甘蔗必须在相应的时间范围内运送至糖厂进行加工,不然甘蔗内的糖分就会减少或变质。 2全液压系统在甘蔗收获机中的技术应用 甘蔗收获机由多个分散在机器内部的模块构成,如果过多采用齿轮、皮带、链条等零件,一方面会使机器结构更加复杂,甚至难以实现;另一方面则会导致机器可靠性降低。与其他作物收获机相比,甘蔗收获机面临的工作环境更为恶劣,在收割过程中出现故障的可能性
应较大,比如在收割过程中,甘蔗叶和甘蔗田里的藤蔓等杂物会缠住各机器部件,砍甘蔗时迸出的糖浆也会凝固在传动轴的附近,使机器负荷较重,容易导致机器被卡死[2]。采用液压技术有助于进一步简化收获机的各项结构,能够方便控制收获机的各项功能参数,有利于优化各模块之间的动力分配,有助于从总体上提升甘蔗收获机的性能,增强其可靠性。甘蔗收获机的行走系统需要能够适应田间作业的频繁前进、后退等多种复杂状况,在收获过程中,甘蔗收获机需要在保持发动机转速恒定的基础上不断调节行进速度以应对经常改变的作业条件,因此一般会选取轮边式静压驱动以简化行走系统结构。液压传动装置动态性能较为出色,能够使前进后退保持相同的速度,而且即使快速转换方向和加减速度也不会对传动系统和甘蔗收获机造成损坏,操作方式也相对简单,只需要操作杆就能完成变速、转向、前进及后退等动作,简便的操作能够很大程度上减轻操控者的劳动强度,有助于其将全部精力运用于当前作业中,能够有效提高生产效率[3]。利用液压技术进行转向驱动,能够开阔甘蔗流通的空间范围,使转向作业更加方便省力。 3甘蔗收获机全液压系统设计优化 甘蔗收获机的全液压传动方式包括转向行走回路、割台回路、切段回路、排杂风机回路、升降台输送回路和切梢刀盘回路等多项系统构成,其中消耗功率较多的是前几种回路[4]。甘蔗收获机行走液压系统中设计了两个控制变量液压马达和变量泵,组成了补油回路和控制油路共用的闭式液压系统,液压系统中实现能量转化的过程是通过压
苹果树组培快繁技术实例 · 含配方
苹果的组织培养是采用无菌培养技术,将来自优良植物的茎尖、腋芽、叶片、鳞片、块根和球茎等器官以及它们的组织切片进行离体培养,使之在短期内获得大量遗传性一致的个体的方法。由于离体技术处理严格,所以很容易脱除一些细菌病原及病毒,是复壮品种的有效措施。已成功脱除的病毒和病害有苹果褪绿叶斑病毒、花叶病病毒、轮纹病等。苹果矮化砧、抗寒砧的组织培养也已成功。苹果脱毒组培技术流程具体如下。
一 外植体材料选择与处理 早春,将上年芽接或切接的盆栽长富2号苹果苗移人温室,待新梢长出3~5片新叶时,放入热处理箱中,37℃恒温热处理30d或32℃与37℃每8h变换一次,变温热处理60d。脱毒率可达80%以上。热处理结束后,从盆栽苗嫩梢上采集生长旺盛、长约2~3cm顶梢,流水冲洗10min,去掉小叶。70%乙醇浸泡30s,蒸馏水冲洗后放入0.1%HgCI。中消毒10min,无菌水冲洗3~5次,解剖镜下迅速剥取1.0mm的茎尖进行分离培养,接种于起始培养基上。
二 培养基制备 1.1 芽诱导 适宜苹果芽诱导培养基为:MS+6-BA1.0mg/L+NAA0.1mg/L。诱导的芽生长正常可发育成新梢。 1.2 继代培养 选择诱导的芽丛切割成单芽茎段,转接于设计的继代培养基上。适宜的苹果继代培养基为:MS+6-BA1.0mg/L+NAA0.05mg/L+蔗糖4%+琼脂0.36mg/L。培养条件:光照强度2000~ 2500lx,光照时间14~16h/d,适宜温度为25℃±2.0℃。40d后增殖6.1倍。 1.3 生根培养 选择生长正常的继代培养苗,剪成单芽茎段,插入生根培养基中,苹果适宜的生根培养基为:1/2MS+IAA1.5mg/L+蔗糖25%+琼脂0.36%。培养30d后,平均4~6条根/苗,长达0.5~1.0cm。根白且粗,多直接生于茎基部。
植物组织培养实验室(组培室)规划设计
植物组织培养实验室 (组培室规划设计 2009年 05月 31日星期日 10:18一、实验室要求 理想的组织培养实验室应该建立在安静、清洁、远离污染源的地方, 最好在常年主风向的上风方向, 尽量减少污染。规模化生产的组织培养实验室最好建在交通方便的地方, 便于培养产品的运送。 实验室的建设均需考虑两个方面的问题:一是所从事的实验的性质, 即是生产性的还是研究性的, 是基本层次的还是较高层次的; 二是实验室的规模, 规模主要取决于经费和实验性质。 无论实验室的性质和规模如何,实验室设置的基本原则是:科学、高效、经济和实用。一个组织培养实验室必须满足 3个基本的需要:实验准备 (培养基制备、器皿洗涤、培养基和培养器皿灭菌、无菌操作和控制培养。此外,还可根据从事的实验要求来考虑辅助实验室及其各种附加设施,使实验室更加完善。 在进行植物组织培养工作之前,首先应对工作中需要哪些最基本的设备条件有个全面的了解, 以便因地制宜地利用现有房屋, 或新建、改建实验室。实验室的大小取决于工作的目的和规模。以工厂化生产为目的,实验室规模太小,则会限制生产,影响效率。在设计组织培养实验室时, 应按组织培养程序来没计, 避免某些环节倒排, 引起日后工作混乱。植物组织培养是在严格无菌的条件下进行的。要做到无菌的条件, 需要一定的设备、器材和用具, 同时还需要人工控制温度、光照、湿度等培养条件。 二、实验室组成 (一基本实验室 基本实验室包括准备室、洗涤灭菌室、无菌操作室、培养室、缓冲间,是组织培养实验所必须具备的基本条件。如进行工厂化生产,年产 4万 -20万, 需 3-4间实验用房,总面积 60平方米。
植物组织培养实验报告
植物组织培养实验报告 一实验目的 让植物组织经过脱分化作用,形成愈伤组织,经过再分化作用,愈伤组织又能重新分化为有结构的组织和器官,最终形成完整的植株。 二实验原理 植物组织培养是把植物的器官,组织以至单个细胞,应用无菌操作使其在人工条件下,能够继续生长,甚至分化发育成一完整植株的过程。植物的组织在培养条件下,原来已经分化停止生长的细胞,又能重新分裂,形成没有组织结构的细胞团,即愈伤组织。这一过程称为“脱分化作用”,已经“脱分化”的愈伤组织,在一定条件下,又能重新分化形成输导系统以及根和芽等组织和器官,这一过程称“再分化作用”。植物激素在此过程中起着重要的作用,吲哚乙酸(IAA )和 6 –苄基氨基腺嘌呤(6 – BA )的比例,决定了根和芽的分化。 三实验器材 (一)试剂 乙醇、IAA 或 2 ,4 – D 、HgCl 2 (或次氯酸钠)、6- 苄基氨基腺嘌呤(6-BA ) MS 培养基 (二)仪器设备 培养室,高压灭菌锅,水浴锅,解剖刀,三角烧瓶(100mL ),烧杯,量筒,培养皿,超净工作台,分析天平,长镊子,剪刀,橡皮筋等 三实验步骤 1. 配制培养基 (1 )愈伤组织诱导培养基:MS 培养基(蔗糖含量为10 g/L ,2,4 – D 含量为 2 mg/L ,琼脂10 g/L )。 (2 )试验培养基:在MS 培养基中按表33 – 1 加入IAA 和6–BA 。 吲哚乙酸先用少量0.1 mol/L NaOH 溶解,6- 苄基氨基腺嘌呤先用少量0.1 mol/L HCl 溶解,然后用蒸馏水稀释,再加入培养基中。 2. 培养基灭菌 将配好的培养基加入琼脂加热溶解,调至pH 5.8 ,趁热分装于100 mL 三角烧瓶中,每瓶约20 mL 。待培养基冷却凝固后,用两层称量纸包扎瓶口,并用橡皮筋扎牢,然后在高压灭菌锅中121 ℃( 1 kg/cm 2 )下灭菌20 min 。取出三角烧瓶放在台子上,
