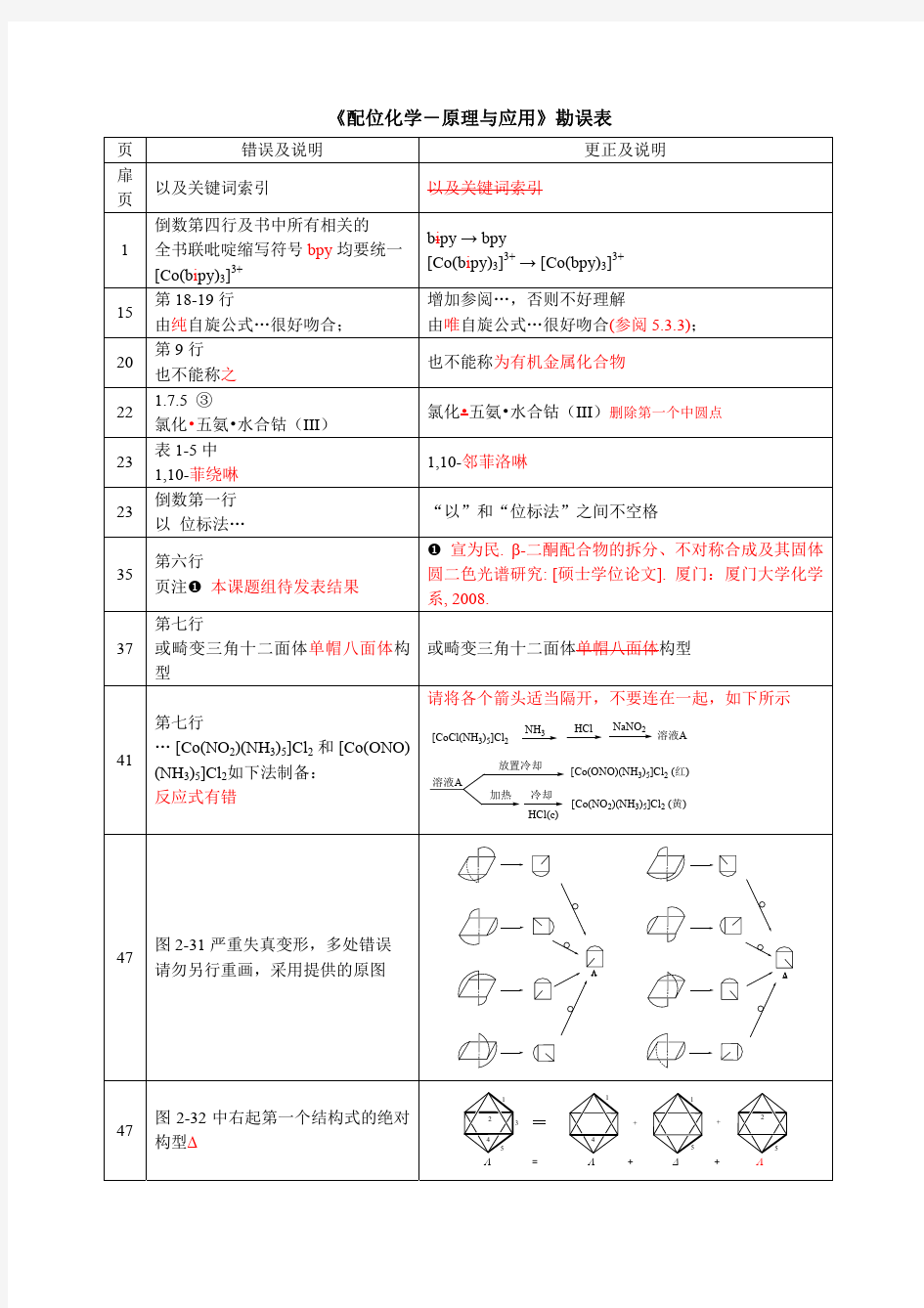
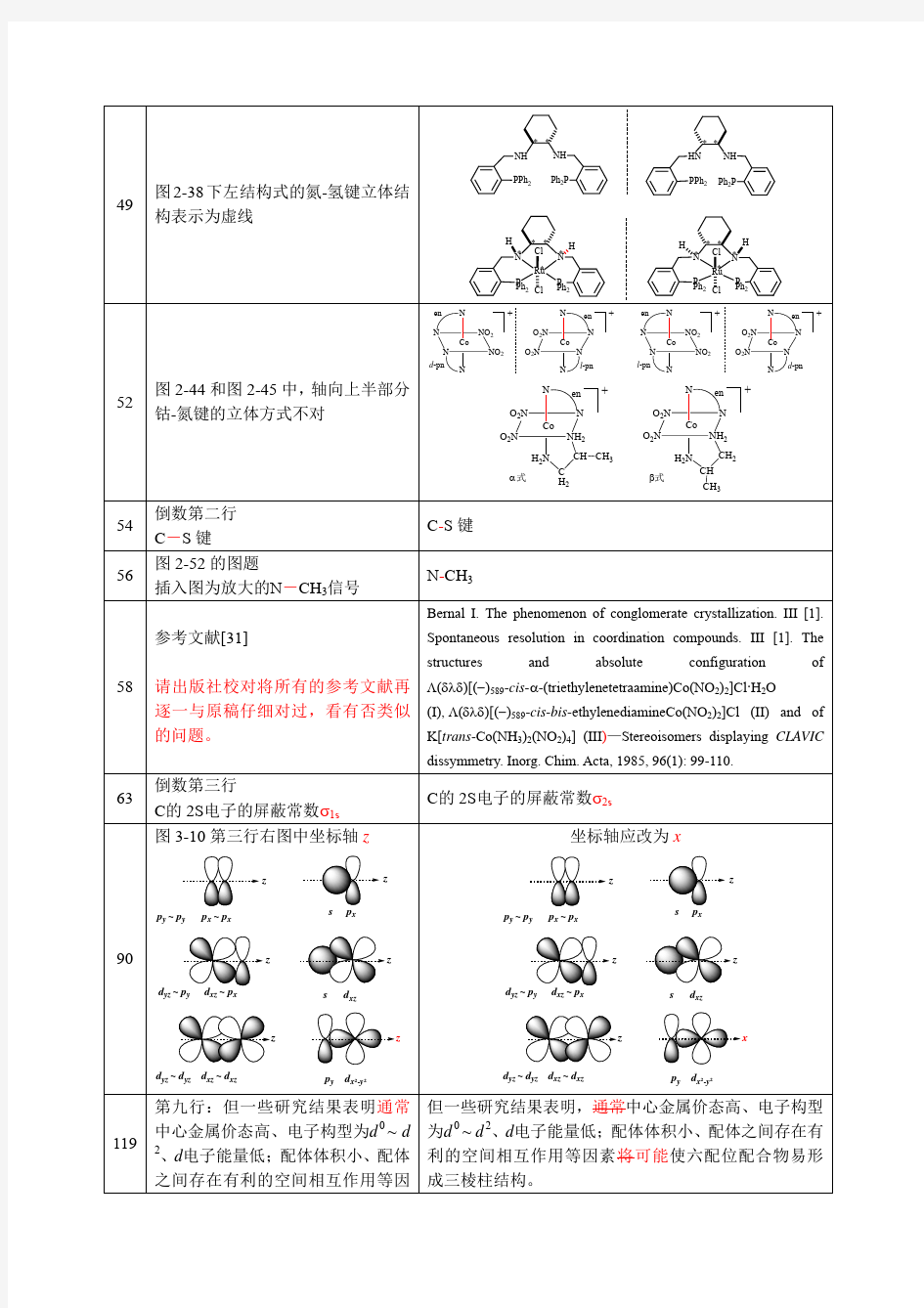
章慧配位化学勘误表
《配位化学-原理与应用》勘误表
258 倒数10行
以及用于验证相关的理论计算…
以及被用来验证相关的理论计算…
258 倒数第一行
圆偏振发光光谱
圆偏振发射光谱
259 第六行
…医学和材料科学等…
…医学、材料科学、超分子化学和纳米化学等…
263 6.3节下第七行以及全书所有内容中
当含发色团的手性分子…
请将书中所有发色团都改成生色团,以求前后一致
当含生色团的手性分子…
273 第12行
…{Δ-(?)D-[Co(ox)(en)2]+}、
{Λ-(?)D-u-fac-[Co(ida)2]?}和
{Λ-(+)D-[Co(ox)(en)2]+}、
{Δ-(+)D-u-fac-[Co(ida)2]?}的单晶…
说明:“和”的前后分别为一个化合物,而不是两个化
合物,这两个化合物比较特殊,属于离子对或复杂络合
物,即所谓的非对映异构体盐。
…{Δ-(?)D-[Co(ox)(en)2]}+{Λ-(?)D-u-fac-[Co(ida)2]}?和
{Λ-(+)D-[Co(ox)(en)2] }+{Δ-(+)D-u-fac-[Co(ida)2] }?的单
晶…
277 第四行
在结构上的不对称程度更大…
在结构上的非对称程度更大…
295 倒数11行
而Λ-[Fe(phen)3]2+和Λ-[Ru(phen)3]2+
等…
而Λ-[Ru(phen)3]2+和Λ-[Os(phen)3]2+等…
298 倒数10行
…或配体内的n?π跃迁
…或配体内的n?π?跃迁
304 倒数第三行
例如,对于CD光谱测试,狭缝宽度
通常选择为2~3 nm。以上测试参数
的选择需根据样品性质的不同,通
过测试实验来进一步确定,详见文
献[103]。
例如,对于固体样品的透射CD光谱测试,应根据不同的
测试波段选择合适的狭缝宽度,并要求将样品放置在尽
可能靠近光电倍增管(检测器)的位置上[103,104]。以上测试
参数的选择需根据样品性质的不同,通过测试实验来进
一步确定,详见综合化学实验教材[104]。
305 倒数第三行
每个R,R-ptn配体形成船式或椅式构
象的柔性六员螯环本应对中心金属
发色团的光学活性有主要贡献的六
个配位氮原子的排布对正八面体构
型的偏离不大,故该配合物的光学
活性可能主要来源于螯环上非配位
的不确定位置的原子排布(参阅
6.4.2)。
每个螯合R,R-ptn配体形成船式或椅式构象的柔性六员
螯环。本应对中心金属生色团的光学活性有主要贡献的
六个配位氮原子的排布对正八面体构型的偏离不大,故
该配合物的光学活性可能主要来源于螯环上非配位的
可移动的原子排布(参阅6.4.2)。
306 第六行
而后者是可以被单晶X射线衍射所
测定的。
而后者是可以被单晶X射线衍射所确定的。
306 倒数第二行
…对各种形态CD光谱的影响,以获
得…
…对各种形态CD光谱的影响,并结合理论计算,以获
得…
309 参考文献[83]
Karpishin T B, Stack T D P, Raymound K N. Karpishin T B, Stack T D P, Raymound K N. Stereoselectivity in chiral Fe(III) and Ga(III) tris(catecholate) complexes effected by
?→?快
[Cr(NH 3)6]3+ + NH 2?[Cr(NH 2)(NH 3)4]2+ + 2NH 3?→
?快
[Cr(NH 3)6]3+ + NH 2?391 倒数第12行
④ 由于羧基和羟基的存在,水溶性增加,因此卡铂和Enloplatin 对肾脏
的伤害减少。Enloplatin 比顺铂有更低的肾毒性和更宽的剂量范围。 ④ 由于羧基和羟基的存在,水溶性增加,因此卡铂和Zeniplatin 的毒性作用比顺铂有所降低。Zeniplatin 的某些抗肿瘤活性比顺铂和卡铂高。
394 第20行
(2) 电子转移催化rac - [Co(en)3]Cl 3
的不对称转化 rac -与[Co(en)3]Cl 3之间不要空格
(2) 电子转移催化rac -[Co(en)3]Cl 3的不对称转化 398
图8-14中的文字说明 notobserved
not observed
修改后的图8-14在另一个文件《…图表问题》中 401 倒数第九行参考文献[41, 46] 改为[41, 45]
401 倒数第八行
(?)-[4,5]-pineno bipyridine ,继而得到
(S ,S )-(+)-[4,5] -CHIRAGEN[6] pineno 与bipyridine 之间以及[4,5]与-CHIRAGEN[6]之间不要空格
(?)-[4,5]-pinenobipyridine ,继而得到(S ,S )-(+)-[4,5]-CHIRAGEN[6] 402 图8-21图题参考文献[47] 改为[46] 402 第十行参考文献[47, 48] 改为[46, 47] 403 第九行参考文献[49] 改为[48]
404
表8-1
第三列文字排列不整齐 最好均居中排列
修改后的表8-1在另一个文件《…图表问题》中 406 第十一行参考文献[50] 改为[49]
406
页注
H? kansson 等…
H?与kansson 之间不空格 H?kansson 等…
409 第12行 苯的同系物
说明:苯的同系物是指分子里含有
一个苯环,组成符合C n H 2n-6(n ≥6)的环烃。 苯的同系物衍生物
409
倒数第8行
(是否语序被编辑调整过?我查过我最后给章老师的原稿不是这样的?) 例如:在1H-NMR 中被去屏蔽的质子信号。虽然金属苯环上的质子也存在被去屏蔽现象,但金属中心对这一效应有强烈的影响,特别当该质子处于金属邻位时[10]。 410 第1行
金属苯也能形成此类配合物,可用
于稳定一些金属杂环。 金属苯也具有类似反应性,可以作为配体与过渡金属形成η6-配合物。 413 第7行 铱杂环七三烯配合物19 铱杂环庚三烯配合物19 414 第1行 Hoffman Hoffman n
417 第3行 NBD 降冰片二烯(NBD ) 439 附录4 能及图 能级图
421 综合习题和思考题 全书综合习题和思考题 422
倒数第一行 d n 组态 …有效磁矩与理论磁矩… d 与n 之间不要空格 d n 组态 …实测磁矩与理论磁矩…
423 第6题表格中 [Ru(bipy )3]2+
[Ru(bpy )3]2+ 这个问题贯穿在全书中,请统一修改!
426 C4v群表中的最后一行第三列中的特
征标0未与前几行对齐
请对齐
439 d2能级图3T2 (t2e) 括号中t应为斜体3T2 (t2e)
439 d3能级图4T1 (t2e2)、4T2 (t22e)、4A2 (t23)括号中t应为斜体4T1 (t2e2)、4T2 (t22e)、4A2 (t23)
最后一个(t23)中3与2不是分数的关系,而是上下标
439 d4能级图5T1 (t22e2) 括号中t应为斜体5T1 (t22e2)
440 d7能级图请找出原图进行对照,为何d7图中没有出现实线???
另外,这些能级图的出处我暂时找不到,请小宋看看复印件上是否有留底,最好引用一下。
440 d7与d8能级图d7与d8能级图上的B = XX文字没有在一行中对齐,请调整一下。
441 pp 441-450 结构图见附件配化习题选解结构式最好全部核对一遍
442 12题绝对构型标注错误较多见附件配化习题选解结构式442 12题 (2) 1结构式画得不对称见附件配化习题选解结构式
442 12题 (2) 2左起第一个结构式画得
缺一条边
见附件配化习题选解结构式
445 第六行
4T
2
←4A2和4T1←4A2。
4A
2
→4T2和4A2→4T1。
448 第一行综合习题和思考题全书综合习题和思考题
448 1(5)
而[Fe(phen)3]2+中的 π键级为2.5。
而[Fe(phen)3]3+中的 π键级为2.5。
448 倒数第12行
3a、3b、4a、4b与相应的结构式没
有对齐
请见附件配化习题选解结构式
448 倒数第五行
则有效磁矩μeff与唯自旋磁矩μS可能
不符。
则实测磁矩μeff与唯自旋磁矩μS可能不符。
无机化学 第12章 配位化学基础习题及全解答-教学提纲
第12章 配位化学基础 1 M 为中心原子,a, b, d 为单齿配体。下列各配合物中有顺反异构体的是 (A ) (A ) Ma 2bd (平面四方)(B ) Ma 3b (C ) Ma 2bd (四面体)(D ) Ma 2b (平面三角形) 2 在下列配合物中,其中分裂能最大的是 (A ) (A ) Rh(NH 3)36+ (B )Ni(NH 3) 36+ (C ) Co(NH 3)36+ (D ) Fe(NH 3)36+ 3 在八面体强场中,晶体场稳定化能最大的中心离子d 电子数为 (B ) (A ) 9 , (B ) 6 , (C )5 , (D )3 4 化合物[Co(NH 3)4Cl 2]Br 的名称是 溴化二氯?四氨合钴(III ) ; 化合物[Cr(NH 3)(CN)(en)2]SO 4的名称是 硫酸氰?氨?二乙二胺合铬(III )。 5 四硫氰·二氨合铬(Ⅲ)酸铵的化学式是 NH 4[Cr (SCN )4(NH 3)2] ; 二氯·草酸根·乙二胺合铁(Ⅲ)离子的化学式是[Fe Cl 2(C 2O 4)en]- 4 。 6. 下列物质的有什么几何异构体,画出几何图形 (1)[Co(NH 3)4Cl 2]+ (2)[Co(NO 2)3(NH 3)3] 答:(1)顺、反异构(图略),(2)经式、面式异构(图略)。 7.根据磁矩,判断下列配合物中心离子的杂化方式,几何构型,并指出它们属于何类配合物(内/外轨型。 (1)[Cd (NH 3)4]2+ μm =0 ; (2)[Ni(CN)4]2- μm =0 ; (3)[Co(NH 3)6]3+ μm =0 ; (4)[FeF 6]3- μm =5.9μB ; 答:
中级无机化学习题和答案
中级无机化学习题 第二章 对称性与群论基础 1、利用Td 点群特征标表(右表)回答下列问题 (1)、群阶,对称操作类数,不可约表示数 (2)、SO 42-离子中S 原子3p x 轨道及3d xy 轨道所属的不可约表示 (3)、可约表示Г(10,-2,2,0,0)中包括了 哪些不可约表示?SO 42-离子是否表现为红外活性?SO 42-离子是否表现为拉曼活性的? 解:(1)点群的阶h=8;对称操作类=5;不可约表示数=5 (2)S 原子的P X 轨道所属不可约表示为T 2表示。 (3)()01231)2(811018 1 11=??+?-?+??=?Γ?=∑i A g h a χ;同理 02 =A a ;11=T a ;12=T a ;2=E a ;故可约表示E T T 221)0,0,2,2,10(⊕⊕=Γ- 因T 2表示中包含(x,y,z )和 (xy,xz,yz),故既表现为红外活性又表现为拉曼活性。 2 (1)、点群的阶,对称操作类数,不可约表示数 (2)、NH 3分子中偶极矩所属的不可约表示 (3)可约表示Г(6,0,2)中包括了哪些不可约表示? 解:(1)点群的阶h=6; 对称操作类=3;不可约表示数=3 (2)NH 3分子中偶极矩所属不可约表示为A 1表示 (3)()21231021616 1 11=??+??+??=?Γ?= ∑i A g h a χ;同理 02=A a , 2=E a ; 故可约表示E A 221)2,0,6(⊕=Γ 3 (1)、点群的阶,对称操作类数,不可约表示数 (2)、SF 5Cl 分子中S 原子Px 轨道所属的不可约表示 (3)、可约表示Г(4,0,0,-2,0)中包括了哪些不可约表示?
配位化学第一组第三章作业
第三章配合物在溶液中的稳定性作业 1.下列各组中,哪种配体与同一种中心离子形成的配合物稳定性较高,为什么? (1)Cl- , F-和Al3+(2)Br-,I-和Hg2+ (3)2CH3NH2,en和Cu2+(4)Br-,F- 和Ag+ (5)RSH,ROH和Pt2+(6)Cl-,OH-和Si4+ (7)RSH,ROH和Mg2+ 解(1)F-与Al3+形成配合物更稳定,因为F-电负性大,离子半径更小(2)I-与Hg2+更稳定,因为碘离子的电负性较大,离子半径更小(3 )2CH3NH2与Cu2+形成的配合物更稳定,因为它的碱性比en更强与形成的配合物更稳定 (4)Br-与Ag+形成的配合物更稳定,因为与Ag+形成配合物Br-变形性比F-强 (5)RSH与Pt2+形成配合物更稳定,因为在与Mg2+形成配合物时S 的半径小于O的半径 (6)OH-与Si4+形成的配合物更稳定,因为在与Si4+形成配合物时OH-的电荷比更多 (7)RSH与Mg2+形成配合物更稳定,因为在与Mg2+形成配合物时S 的半径小于O的半径 2.写出下列,配体与中心离子形成的配合物的稳定次序。 解(1)CH3NH2,en,NH2-NH2,NH2-OH和Cu2+ en > CH3NH2 > NH2-NH2 > NH2OH
(2)R3CCOOH,CH3COOH,Cl3CCOOH,I3CCOOH和Fe3+ R3CCOOH > CH3COOH > I3CCOOH > Cl3CCOOH (3)NH3,NH2-NH2,NH2-OH,R-OH和Ag+ NH3 > NH2-NH2 > NH2-OH > R-OH (4)N, NH2 与Zn2+ N> NH2 (5)NH2 O2N, NH2 C H3, NH2 NO2与Cu2+ NH2 C H3> NH2 NO2> NH2 O2N (6) N OH, N OH CH3 与Ni2+ N OH CH3 > N OH CH3 3.下列二组试剂与同一种金属离子形成螯合物时,估计lg k的大小次序:
第三章 第四节 配合物与超分子
第四节配合物与超分子 [核心素养发展目标] 1.能从微观角度理解配位键的形成条件和表示方法,能判断常见的配合物。2.能利用配合物的性质去推测配合物的组成,从而形成“结构决定性质”的认知模型。 3.了解超分子的结构特点与性质。 一、配合物 1.配位键 (1)概念:由一个原子单方面提供孤电子对,而另一个原子提供空轨道而形成的化学键,即“电子对给予—接受”键。 (2)表示方法:配位键常用A—B表示,其中A是提供孤电子对的原子,叫给予体,B是接受孤电子对的原子,叫接受体。 如:H3O+的结构式为;NH+4的结构式为。 (3)形成条件 形成配位键的一方(如A)是能够提供孤电子对的原子,另一方(如B)是具有能够接受孤电子对的空轨道的原子。 ①孤电子对:分子或离子中,没有跟其他原子共用的电子对就是孤电子对。如、 、分子中中心原子分别有1、2、3对孤电子对。含有孤电子对的微粒:分子如CO、NH3、H2O等,离子如Cl-、CN-、NO-2等。 ②含有空轨道的微粒:过渡金属的原子或离子。一般来说,多数过渡金属的原子或离子形成配位键的数目基本上是固定的,如Ag+形成2个配位键,Cu2+形成4个配位键等。 2.配合物 (1)概念 通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物称为配位化合物,简称配合物。如[Cu(NH3)4]SO4、[Ag(NH3)2]OH等均为配合物。 (2)组成 配合物[Cu(NH3)4]SO4的组成如下图所示:
①中心原子:提供空轨道接受孤电子对的原子。中心原子一般都是带正电荷的阳离子(此时又叫中心离子),最常见的有过渡金属离子:Fe3+、Ag+、Cu2+、Zn2+等。 ②配体:提供孤电子对的阴离子或分子,如Cl-、NH3、H2O等。配体中直接同中心原子配位的原子叫做配位原子。配位原子必须是含有孤电子对的原子,如NH3中的N原子,H2O中的O原子等。 ③配位数:直接与中心原子形成的配位键的数目。如[Fe(CN)6]4-中Fe2+的配位数为6。 (3)常见配合物的形成实验 实验操作实验现象有关离子方程式 滴加氨水后,试管中首先出现蓝色沉淀,氨水过量后沉淀逐渐溶解,得到深蓝色的透明溶液,滴加乙醇后析出深蓝色晶体Cu2++2NH3·H2O===Cu(OH)2↓+2NH+4、Cu(OH)2+4NH3=== [Cu(NH3)4]2++2OH-、 [Cu(NH3)4]2++SO2-4+H2O===== 乙醇[Cu(NH3)4]SO4·H2O↓ 溶液变为红色Fe3++3SCN-Fe(SCN)3滴加AgNO3溶液后,试管 中出现白色沉淀,再滴加氨水后沉淀溶解,溶液呈无色Ag++Cl-===AgCl↓、AgCl+2NH3===[Ag(NH3)2]++Cl- (4)配合物的形成对性质的影响 ①对溶解性的影响 一些难溶于水的金属氢氧化物、氯化物、溴化物、碘化物、氰化物,可以溶解于氨水中,或依次溶解于含过量的OH-、Cl-、Br-、I-、CN-的溶液中,形成可溶性的配合物。如Cu(OH)2+4NH3===[Cu(NH3)4]2++2OH-。 ②颜色的改变 当简单离子形成配离子时,其性质往往有很大差异。颜色发生变化就是一种常见的现象,根据颜色的变化就可以判断是否有配离子生成。如Fe3+与SCN-形成硫氰化铁配离子,其溶液显红色。
无机化学-第12章-配位化学基础习题及全解答-
1 / 7 第12章 配位化学基础 1 M 为中心原子,a, b, d 为单齿配体。下列各配合物中有顺反异构体的是 (A ) (A ) Ma 2bd (平面四方)(B ) Ma 3b (C ) Ma 2bd (四面体)(D ) Ma 2b (平面三角形) 2 在下列配合物中,其中分裂能最大的是 (A ) (A ) Rh(NH 3)36+ (B )Ni(NH 3) 36+ (C ) Co(NH 3)36+ (D ) Fe(NH 3)36+ 3 在八面体强场中,晶体场稳定化能最大的中心离子d 电子数为 (B ) (A ) 9 , (B ) 6 , (C )5 , (D )3 4 化合物[Co(NH 3)4Cl 2]Br 的名称是 溴化二氯?四氨合钴(III ) ; 化合物[Cr(NH 3)(CN)(en)2]SO 4的名称是 硫酸氰?氨?二乙二胺合铬(III )。 5 四硫氰·二氨合铬(Ⅲ)酸铵的化学式是 NH 4[Cr (SCN )4(NH 3)2] ; 二氯·草酸根·乙二胺合铁(Ⅲ)离子的化学式是[Fe Cl 2(C 2O 4)en]- 4 。 6. 下列物质的有什么几何异构体,画出几何图形 (1)[Co(NH 3)4Cl 2]+ (2)[Co(NO 2)3(NH 3)3] 答:(1)顺、反异构(图略),(2)经式、面式异构(图略)。 7.根据磁矩,判断下列配合物中心离子的杂化方式,几何构型,并指出它们属于何类配合物(内/外轨型。 (1)[Cd (NH 3)4]2+ μm =0 ; (2)[Ni(CN)4]2- μm =0 ; (3)[Co(NH 3)6]3+ μm =0 ; (4)[FeF 6]3- μm =5.9μB ; 答: 8判断下列配离子属何类配离子 9 配合物K 3 10 计算下列金属离子在形成八面体配合物时的CFSE/Dq (1) Cr 2+ 离子,高自旋;
第一章 配位化学 绪论
第一章配位化学的早期历史及Werner配位理论 第一节早期研究及链式理论 一、早期研究 1、配合物的发现 最早有记录的配合物:1704年,德国Diesbach 得到的普鲁士蓝 KCN.Fe(CN)2.Fe(CN)3。 真正标志研究开始:1793年Tassaert发现CoCl3.6NH3 当时无法解释稳定的CoCl3和NH3为何要进一步结合,形成新化合物。 2、配合物性质研究 1)Cl-沉淀实验(用AgNO3) 配合物可沉淀Cl-数目现在化学式 CoCl3.6NH3 3 [Co(NH3)6]Cl3 CoCl3.5NH3 2 [Co(NH3)5Cl]Cl2 CoCl3.4NH3 1
[Co(NH3)4Cl2]Cl IrCl3.3NH3 0 [Ir(NH3)3Cl3] 2)电导率测定 配合物摩尔电导(Ω-1) 离子数目现在化学式 PtCl4.6NH3 523 5 [Pt(NH3)6]Cl4 PtCl4.5NH3 404 4 [Pt(NH3)5Cl]Cl3 PtCl4.4NH3 229 3 [Pt(NH3)4Cl2]Cl2 PtCl4.3NH3 97 2 [Pt(NH3)3Cl3]Cl PtCl4.2NH3 0 0 [Pt(NH3)2Cl4] 二.链式理论(Chain theory) 为解释这些实验结果,1869年瑞典Lund大学Blomstrand教授及其学生Jorgensen(后任丹麦Copenhagen大学教授)提出链式理论。
当时认为元素只有一种类型的价——氧化态,N为5价,Co为3价,Cl为1价。 NH3—Cl CoCl3.6NH3 Co—NH3—NH3—NH3—NH3—Cl NH3—Cl Cl CoCl3.5NH3 Co—NH3—NH3—NH3—NH3—Cl NH3—Cl Cl CoCl3.4NH3 Co—NH3—NH3—NH3—NH3—Cl Cl Cl
第一章 配位化学基础要点
绪论 导课:配位化学一般是指金属和金属离子同其他分子或离子相互反应的化学。它是在无机化学的基础上发展起来的一门独立的、同时也与化学各分支学科以及物理学、生物学等相互渗透的具有综合性的学科。配位化学所涉及的化合物类型及数量之多、应用之广,使之成为许多化学分支的汇合口。现代配位化学几乎渗透到化学及相关学科的各个领域,例如分析化学、有机金属化学、生物无机化学、结构化学、催化活性、物质的分离与提取、原子能工业、医药、电镀、燃料等等。因此,配位化学的学习和研究不但对发展化学基础理论有着重要的意义,同时也具有非常重要的实际意义。 一、配位化学的任务 配位化学是研究各类配合物的合成、结构、性质和应用的一门新型学科。 配合物的合成是重点,结构与性质研究是难点,研究方法是关键。应用是落脚点。二、配位化学的学科基础 配位化学的学科基础是无机化学,分析化学、有机化学、物理化学和结构化学。配位化学已成为许多化学分支的汇合口。 配位化学是许多新兴化学学科的基础。如:超分子化学,酶化学,蛋白质化学,生物无机化学,材料化学,化学生物学,药物化学,高分子化学等。 三、配位化学的研究方法 1、合成方法:要求掌握有机和无机化学的合成技术,特别是现今发展起来的水热技术、微波技术、微乳技术、超临界技术等。 2、结构研究:元素分析、紫外光谱、红外光谱、质谱、核磁共振、荧光光谱、X-衍射等。 3、性质研究:电位滴定、循环伏安、磁天平、变温磁化率、交流磁化率、电子顺磁共振、光电子能谱、E-扫描、催化性质、凝胶电泳、园二色谱、核磁共振研究与细胞及DNA 的作用。 4、应用:催化反应用于有机合成、金属酶的模拟、分子识别、金属药物、非线性光学材料、分子磁体、介孔材料、分子机器等。 四、配位化学的学习方法 1、课前预习:在上课以前,把下一次课的内容先粗略的看一次,把自己看不懂的内容做上记号,有时间再认真的看一次,如果仍看不懂,做好记录,等待课堂解决。 2、上课:根据课前预习的难度,对较难理解的部分认真听讲,理解教师的分析思路,学习思考问题和解决问题的方法。在教材上作好批注。 3、复习:对在课堂上没有弄懂的问题在课间问主讲教师,下课后对整个课堂内容复习一次并作好复习笔记。 五、课程的内容安排:
江西理工大学配位化学第一章作业
1.写出下列配合物或配离子的化学式 ⑴六氟合铝酸钠(III) ⑵二氯化一氰?四氨?水合钴(III) ⑶二氯化异硫氰酸跟?五氨合钴(III) ⑷五氨?亚硝酸根合钴 (III) 离子 ⑸二(乙酰丙酮根)合铜(III) ⑹二氰化 (u氯)?二 (氨基合铂 (II)) 答:⑴ Na3[AlF6] ⑵ [Co(CN)(NH3)4(H2O)] ⑶ [Co(NCS)(NH3)5]Cl2 ⑷ [Co(NH3)5NO2]2+ ⑸[Cu(acac)2] ⑹[Pt2(NH2)2Cl2](CN)2 2.指出下列配体中的配位原子,并说明它是单齿还是多吃配体?(1)CH3-C=NO*H (2)CH2-N*HCH2CH2-N*H2 CH3-C=NO*H CH2-N*HCH2CH2-N*H2 (3) CH2COO*- -*00CH2C-*NHCH2N* CH2COO*- (4)ONO- (5)SCN-(6)RNC- (7)*NH(CH2COO*-)2 答:(1) 配位原子为O,多齿配体; (2)配位原子为N,多齿配体; (3)配位原子为O和N,多齿配体;(4)配位原子为O,单齿配体; (5)配位原子为S,单齿配体; (6)配位原子为N,单齿配体; (7)配位原子为N和O,多齿配体;
3.命名下列配合物或配离子 (1) K[Au(OH)4] (2)[Ce(en)3]Cl3 (3) [Co(H2O)4Cl2]Cl (4) [Cr(NH3)2(H2O)2(Py)2]Cl3 (5)[Co(NCS)(NH3)5]2+ (6) [Fe(CN)5(CO)]3- (7) Cl Cl Cl Al Al Cl Cl Cl (8) NH [(H3N)4Co Cr(NH3)2Cl2]Cl2 ONO 答:(1)四羟基合金(Ⅲ)酸钾 (2)三氯化三(乙二胺)合铈(Ⅲ) (3)氯化二氯?四水合钴(Ⅲ) (4)三氯化二氨?二水?二吡啶合铬(Ⅲ) (5)异硫氰根?五氨合钴(Ⅲ)离子 (6)五氰?羰基合铁(Ⅲ)离子 (7)二μ—氯双(二氯合铝(Ⅲ)) (8)二氯化μ—亚氨基—μ—亚硝酸根—二氯二氨合铬(Ⅲ)—四氨合钴(Ⅱ) 答:(1)一氯.硝基.二氨合铂(Ⅱ) 平面四边形 (2)二氯.二羟基.二氨.合铂(Ⅳ) 三角双锥
无机化学 第12章 配位化学基础习题及全解答
无机化学第12章配位化学基础习 题及全解答 第12章配位化学基础1 M为中心原子,a, b, d 为单齿配体。下列各配合物中有顺反异构体的是Ma2bd Ma3b Ma2bd Ma2b 2 在下列配合物中,其中分裂能最大的是Rh(NH3)6 Ni(NH3) 6 Co(NH3)6 Fe(NH3)6 3 在八面体强场中,晶体场稳定化能最大的中心离子d 电子数为9 , 6 , 5 , 3 4 化合物[Co(NH3)4Cl2]Br 的名称是溴化二氯?四氨合钴;化合物[Cr(NH3)(CN)(en)2]SO4的名称是硫酸氰?氨?二乙二胺合铬。 5 四硫氰·二氨合铬酸铵的化学式是NH4[Cr42] ;二氯·草酸根·乙二胺合铁离子的化学式是[Fe Cl2en] 4 。 6. 下列物质的有什么几何异构体,画出几何图形[Co(NH3)4Cl2]
[Co(NO2)3(NH3)3] 答:顺、反异构,经式、面式异构。7.根据磁矩,判断下列配合物中心离子的杂化方式,几何构型,并指出它们属于何类配合物[Cd (NH3)4]μm=0 ;[Ni(CN)4] μm=0 ;[Co(NH3)6] μm=0 ;[FeF6] μm=μB ;答:序配离子[Cd(NH3)4] [Ni(CN)4] [Co(NH3)6] [FeF6] 3-3+22+3+3-2+ 2-+ 3?3?3?3?-d电子数磁矩/μm 10 8 6 5 0 0 0 杂化方式SP dSP dSP SPd 322323几何构型正四面体平面正方形内/外轨外轨型内轨型内轨型外轨型正八面体正八面体8判断下列配离子属何类配离子序号9 配合物K3[Fe(CN)5(CO)]中配离子的电荷应为-3 —,配离子的空间构型为八面体,配位原子为C,中心离子的配位数为 6 ,d 电子在t2g 和eg轨道上的排布方式为t2g eg —60配离子[Fe(en)3] [Mn(CN)6] [Co(NO2)6] 4-4-2+△o与P关系△o<P
第11章 配合物结构
第十一章配合物结构 & 主要内容: q 配合物的空间构型和磁性 q 配合物的化学键理论 & 重点难点: q 配合物的结构理论,包括价键理论、晶体场理论和分子轨道理论。并根据这些理论解释配合物的有关性质。 q 由试验测得的磁矩算出未成对电子数;推测中心离子的价电子的分布情况和中心离子采取的杂化方式;确定配合物是内轨型还是外轨型,来解释配合物的相对稳定性。 q 根据晶体场分裂能与电子成对能的相对大小,判断在晶体场中中心离子的价电子在不同轨道中的分布,推论配合物类型,确定配合物的磁性,估算出配合物磁矩数值,进一步可计算晶体场稳定化能,说明配合物的相对稳定性。 & 教学目的: q 熟悉配合物价键理论的基本要点、配合物的几何构型与中心离子杂化轨道的关系。 q 了解内轨型、外轨型配合物的概念、中心离子价电子排布与配离子稳定性、磁性的关系q 了解配合物晶体场理论的基本要点;了解八面体场中d电子的分布和高、低自旋的概念,推测配合物的稳定性、磁性;了解配合物的颜色与d-d跃迁的关系。 & 授课学时 4学时 §11.1配合物空间构型和磁性 11.1.1 配合物的空间构型 配合物分子或离子的空间构型与配位数的多少密切相关。
由图可见,配合物的空间构型除了与配位数密切相关外,还与配体种类有关,例如,配位数 同样是4,但为四面体构型,而则为平面正方形。 11.1.2 配合物的磁性 磁性:物质在磁场中表现出来的性质。 顺磁性:被磁场吸引的性质。例如:O 2,NO,NO 2 等物质具有顺磁性。 反磁性:被磁场排斥的性质。大多数物质具有反磁性。 铁磁性:被磁场强烈吸引的性质。例如:Fe,Co,Ni属于铁磁性物质。 物质的磁性与内部的电子自旋有关。若电子都是偶合的,由电子自旋产生的磁效应彼此抵消,这 种物质在磁场中表现反磁性;反之,有未成对电子存在时,才会在磁场中显示磁效应,可用磁矩(μ)。 式中,μ为磁矩,单位是B.M.(玻尔磁子), n为未成对电子数。 可用未成对电子数目n估算磁矩μ。 n 0 1 2 3 4 5 μ/B.M. 0 1.73 2.83 3.87 4.90 5.92 物质的磁性亦可用磁天平测定。实验测得的磁矩与估算值略有出入,总趋势比较吻合。
第十一章 配合物结构
第十一章配合物结构 (11-1) 如果配合物具有平面四方形和八面体空间构性,这类配合无可能存在几何异构体。 (1)[Co(NH3)4(H2O)2]3+具有八面体空间构性,其顺、反几何异构体为: (3),(4)与(1)类似,请自行完成。 (2)[PtCl(NO2)(NH3)2]为平面四方形构型,其顺、反几何异构体为: (5)[IrCl3(NH3)3]为八面体构型,属[MX3A3]型配合物,其顺、反几何异构体分别称为面式和经式异构体: (11-3) 磁矩是研究配合物结构的重要实验数据之一。决定配合物磁矩的最最重要因素是中心离子或原子的未成对电子数,由试验测得磁矩后,可以推测出未成对电子数,进而确定形成体的价层电子排布、杂化轨道类型及配合物的空间构型。 [Co(H2O)6]2+的μ=4.3B.M,Co2+为3d7电子构型,推知Co2+的未成对电子数n=3,其价层电子排布为: 配合无为正八面体的空间构型。 [Mn(CN)6]4-:μ=1.8B.M,Mn2+为3d5电子构型,n=1。其价层电子分布为: 配合物的空间构型为八面体。 自行回答[Ni(NH3)6]2+的相关问题。 *如果已经确定配合物个体的空间构型,可推知形成体的杂化轨道类型,再确定其价层电子排布和未成对电子数,从而可估算出该配合物磁矩。(11-2)题就属这种情况,请自行完成本体的解答。同样,也可完成(11-5)题。 (11-4) 本题的解体思路与(11-3)相同。这里,主要是对三种常见的螯合剂en,C2O42-,EDTA 的配位原子种类和数目要进一步熟悉;同时对内轨型和外轨型配合物的概念要很了解。 [Co(en)3]2+:μ=3.82B.M,Co2+为3d7, n=3,每个en有两个配位原子N。Co2+ 的价层电子分布为: Co2+采用sp3d2杂化轨道成键,为外轨型配合物(即成键轨道为ns,np,nd),是正八面体空间构型。 [Fe(C2O4)33-]的5.75B.M,Fe3+为,n=5,其价层电子分布为: 1C2O42-个有2个配位O,Fe3+以sp3d2杂化轨道成键,是外轨型八面体配合物。[Co(EDTA)]-的,n=0,Co3+的价层电子分布为: 每个EDTA中有2个N和4个O为配位原子,Co3+以d2sp3杂化轨道与EDTA成键,该螯合物空间构型为八面体,是内轨型配合物(其成键轨道为(n-1)d,ns,np)。
2018安徽安徽高中化学竞赛无机化学第十三章 配位化学基础
第十三章配位化学基础 13. 1. 01 配位化合物的定义: 由于配位化合物涉及的化学领域非常广泛,所以要严格定义配位化合物很困难。目前被化学界基本认可的方法是首先定义配位单元,而后在配位单元的基础上,进一步定义配位化合物。 由中心原子或离子和几个配体分子或离子以配位键相结合而形成的复杂分子或离子,称为配位单元。[ Co(NH3)6 ]3+,[ Cr(CN)6 ]3-和[ Ni(CO)4 ] 都是配位单元。分别称作配阳离子、配阴离子和配分子。 含有配位单元的化合物称为配位化合物,也叫络合物。例如 [ Co(NH3)6 ]Cl3,K3 [ Cr(CN)6 ],[ Ni(CO)4 ] 都是配位化合物。 [ Co(NH3)6 ] [ Cr(CN)6 ] 也是配位化合物。判断配位化合物的关键在于物质中是否含有配位单元。 13. 1. 02 配位化合物的內界和外界: 在配位化合物中,配位单元称为内界,外界是简单离子。例如 [ Co(NH3)6 ]Cl3中,[ Co(NH3)6 ]3+是内界,Cl-是外界。又如 K3 [ Cr(CN)6 ] 中,[ Cr(CN)6 ]3-是内界,K+是外界。 配位化合物中可以无外界,如[ Ni(CO)4 ] 中就没有外界, [ Co(NH3)6 ] [ Cr(CN)6 ] 中也没有外界。但配位化合物不能没有内界。 在溶液中,内外界之间是完全解离的,例如在水溶液中 [ Co(NH3)6 ]Cl3==== [ Co(NH3)6 ]3++ 3 Cl- 13. 1. 03 配位化合物的中心和配体: 内界配位单元由中心和配体构成。例如在配位单元[ Co(NH3)6 ]3+ 中,Co3+为中心,NH3为配体。中心又称为配位化合物的形成体。中心多为金属离子,尤其是过渡金属离子;而配体经常是阴离子或分子。 13. 1. 04 配位原子和配位数: 配体中给出孤电子对与中心直接形成配位键的原子,叫配位原子。配位单元中,中心周围的配位原子的个数,叫配位数。 配位单元[ Co(NH3)6 ]3 + 的中心Co3+的周围有6个配体NH3,每个NH3中有一个N 原子与Co3+直接配位。N 是配位原子,Co 的配位数是6。
配位化学第一章作业
1.写出下列配合物或配离子的化学式 ?六氟合铝酸钠(III) ?二氯化一氰?四氨?水合钴(III) ?二氯化异硫氰酸跟?五氨合钴(III) ?五氨?亚硝酸根合钴(III) 离子 ?二(乙酰丙酮根)合铜(III) ?二氰化(u-氯)?二(氨基合铂(II)) 答:? Na3[AlF6] ? [Co(CN)(NH3)4(H2O)] ? [Co(NCS)(NH3)5]Cl2 ? [Co(NH3)5NO2]2+ ?[Cu(acac)2] ?[Pt2(NH2)2Cl2](CN)2 2.指出下列配体中的配位原子,并说明它是单齿还是多吃配体? (1)CH3-C=NO*H (2)CH2-N*HCH2CH2-N*H2 CH3-C=NO*H CH2-N*HCH2CH2-N*H2 (3) CH2COO*- -*00CH2C-*NHCH2N* CH2COO*- (4)ONO- (5)SCN-(6)RNC- (7)*NH(CH2COO*-)2 答:(1)配位原子为O,多齿配体;(2)配位原子为N,多齿配体;(3)配位原子为O和N,多齿配体;(4)配位原子为O,单齿配体;
(5)配位原子为S,单齿配体;(6)配位原子为N,单齿配体; (7)配位原子为N和O,多齿配体; 3.命名下列配合物或配离子 (1) K[Au(OH)4] (2)[Ce(en)3]Cl3 (3)[Co(H2O)4Cl2]Cl (4) [Cr(NH3)2(H2O)2(Py)2]Cl3 (5)[Co(NCS)(NH3)5]2+ (6) [Fe(CN)5(CO)]3- (7) Cl Cl Cl Al Al Cl Cl Cl (8) NH [(H3N)4Co Cr(NH3)2Cl2]Cl2 ONO 答:(1)四羟基合金(Ⅲ)酸钾 (2)三氯化三(乙二胺)合铈(Ⅲ) (3)氯化二氯?四水合钴(Ⅲ) (4)三氯化二氨?二水?二吡啶合铬(Ⅲ) (5)异硫氰根?五氨合钴(Ⅲ)离子 (6)五氰?羰基合铁(Ⅲ)离子 (7)二μ—氯双(二氯合铝(Ⅲ)) (8)二氯化μ—亚氨基—μ—亚硝酸根—二氯二氨合铬(Ⅲ)—四氨合钴 (Ⅱ)
第一章 配位化学的基础知识
第一章配位化学的基础知识 第一节配合物的基本概念 研究配合物的化学称配位化学Coordination chemistry 或称配合物化学Chemistry of Coordination Compounds 络合物化学Complex Chemistry 1891年Werner提出配位理论 Werner配位理论的主要要点: 1 配合物内中心离子(原子)有两种化合价,一种是主价,一种是副价,主价即表示氧化态,副价则表示配位数, NH3 NH3 NH3 Co NH3Cl3 NH3 NH3 2 把配合物分成内界和外界 3 提出了配合物的空间结构 配合物的定义:凡是有含有孤对电子(或 电子)的离子或分子与具有能接受孤对电的适当空轨道的离子或分子或原子所结合而成的离子或分子 经典的配合物配合物离子与异电荷离子构成的电中性化合物如KAu(CN)2 带电荷的配合物称为配离子如Au(CN)2- , Ag(CN)2- 配合物本身为分子如Ni(CO)4, [Pt(NH3)2Cl2] 配合物的组成: [Cu (NH3)4]2+SO42- 中心离子配位键配位原子配位体配位数配离子电荷外界离子 中心离子(原子):金属离子 配位体:与中心离子相结合的阴离子或分子
配位原子 配位体中直接与中心离子结合的原子称为配位原子 配位原子在周期表中的位置: C N O F P S Cl As Se Br Te I 配位数:配合物中,与中心离子直接结合的配位原子的总数, 多齿配体: 第二节 配合物的稳定常数 [Cu(NH 3)4]SO 4溶于水时,内外界之间完全离解 [Cu(NH 3)4]SO 4=[Cu(NH 3)4]2+ + SO 42- [Cu(NH 3)4]2+ 进一步离解成[Cu(NH 3)3]2+ [Cu(NH 3)2]2+ [Cu(NH 3)]2 + Cu 2+ 氨的浓度高时可能形成[Cu(NH 3)6]2+ 1 配离子的逐级和积累稳定常数 只讨论单核单配的情况 配合物形成的反应方程式和平衡常可表示为: ML L M =+ (1) ]][[] [1L M ML K = 2ML L ML =+ (2)
中级无机化学习题和答案
中级无机化学习题 第二章对称性与群论基础 1利用Td点群特征标表(右表)回答下列问题 (1 )、群阶,对称操作类数,不可约表示数 (2)、SQ2-离子中S原子3p x轨道及3d xy轨道所属的不可约表示 (3)、可约表示r(10,- 括了哪些不可约表示?SQ?离子是否 表现为红外活性?SQ2-离子是否表现 为拉曼活性的? 解:(1)点群的阶h=8;对称操作类=5; 不可约 表示数=5 (2)S原子的P X轨道所属不可约表示为T2表示。 1 1 (3)a A1 1g i 11 10 1 8 ( 2) 1 3 2 10 ;同理 h 8 a A2 0;a T1 1 ;a T2 1 ;3E 2 ;故可约表示(10, 2,2,0,0) T1 T2 2E 因T2表示中包含(x,y,z )和(xy,xz,yz), 故既表现为红外活性又表现为拉曼活性。 2. 利用C3v点群特征标表(见下表)回答下列问题 (2)、NH分子中偶极矩所属的不可约表示 (3、可约表示r( 6, 0, 2)中包括了哪些不可约表示?解:(1、点群的阶h=6;对称操作类=3;不可约 表示数=3 (2)NH分子中偶极矩所属不可约表示为A表示 1 1 (3) a A1g i 161 201 321 2 ;同理 h 6 a A2 0 , a E 2 ;故可约表示(6,0,2) 2A1 2E 3
(2) 、SECI分子中S原子Px轨道所属的不可约表示 (3) 、可约表示r( 4, 0, 0, -2 , 0)中包括了哪些不可约表示?
-1 △o =20300cm 4、试用特征标表的分析 MnO 的杂化方式。(要求有分析的详细过程) 第三章配位化学基础 属离子的t 2g 轨道变成了 * MO(中心金属离子的d 电子将填入其中),能量升高,结果使 减小。上述分子轨道的形成和电子的占据相当于形成了 L M 键。 2 ?第二过渡系金属离子 皿+水化焓与原子序数的关系如右图所示,试解释之。 解:① M 2 H 2O M (H 2O)2 H 0 ; CFSE(晶体场稳定化能) 随d n (d 电子数增加) 呈双峰变化,给5分; ②从 H °中扣出CFSE 后其 H :随d n 变化呈直线关系。 3、 什么叫Jahn-Teller 效应?指出下列配离子中,哪些会发生结构变形? ( 10分) (1) Cr(H 2O)6 ; (2) Ti(H 2O)3 ; (3) Fe(CN): ; (4) Mn(H 2。);; (5) Cu(H 2O)6 ; (6) MnF ; ; (7) CdCl ; ; (8) Ni(CN) 4。 4. 试用晶体场理论解释 Ti(H 2O)62+的吸收光谱 1配位体与中心金属离子的 成键作用将影响配合物的分裂能,假 定配位体的 轨道能量低于中心金属离子的 轨道,且已被电子所 填满。请画出在八面体场中, 这种 成键作用的分子轨道能级图, 分 析其对配合物的 △ o 的影响。 解:中心金属离子的 e g 轨道与配体的 轨道对称性不匹配,保留非 键。中心金属离子有 对称性的是t 2g 轨道,当其与能量较低的已被 电子填满的配体的 轨道组成分子轨道时,其成键 MC 更接近于配 体的 轨道(即配体上的 电子将进占 成键分子轨道),而中心金 e g * t 2g e g * *( t 2g *) ■-—— 飞2g ) ML n 血 过證系密国离f?】的水介範
无机化学 第12章 配位化学基础习题及全解答-
第12章配位化学基础 1 M为中心原子,a, b, d 为单齿配体。下列各配合物中有顺反异构体的是(A)(A) Ma2bd(平面四方)(B) Ma3b (C) Ma2bd(四面体)(D) Ma2b(平面三角形) 2 在下列配合物中,其中分裂能最大的是(A) (A) Rh(NH3)3 6+(B)Ni(NH 3) 3 6 +(C) Co(NH 3) 3 6 +(D) Fe(NH 3) 3 6 + 3 在八面体强场中,晶体场稳定化能最大的中心离子d 电子数为(B)(A) 9 , (B) 6 , (C)5 , (D)3 4 化合物[Co(NH3)4Cl2]Br 的名称是溴化二氯?四氨合钴(III); 化合物[Cr(NH3)(CN)(en)2]SO4的名称是硫酸氰?氨?二乙二胺合铬(III)。 5 四硫氰·二氨合铬(Ⅲ)酸铵的化学式是 NH4[Cr(SCN)4(NH3)2] ; 二氯·草酸根·乙二胺合铁(Ⅲ)离子的化学式是[Fe Cl2(C2O4)en]-4。 6. 下列物质的有什么几何异构体,画出几何图形 (1)[Co(NH3)4Cl2]+ (2)[Co(NO2)3(NH3)3] 答:(1)顺、反异构(图略),(2)经式、面式异构(图略)。 7.根据磁矩,判断下列配合物中心离子的杂化方式,几何构型,并指出它们属于何类配合物(内/外轨型。 (1)[Cd (NH3)4]2+ μm=0 ;(2)[Ni(CN)4]2-μm=0 ; (3)[Co(NH3)6]3+μm=0 ;(4)[FeF6]3-μm=5.9μB; 答:
8判断下列配离子属何类配离子 9 配合物K3[Fe(CN)5(CO)]中配离子的电荷应为 -3 —,配离子的空间构型为 八面体 ,配位原子为 C (碳) ,中心离子的配位数为 6 ,d 电子在t 2g 和e g 轨道上的排布方式为 t 2g 6 e g 0 — ,中心离子所采取的杂化轨道方式为 d 2sp 3 ,该配合物属 反 磁性分子。 10 计算下列金属离子在形成八面体配合物时的CFSE/Dq (1) Cr 2+ 离子,高自旋; (2) Mn 2+离子,低自旋; (3) Fe 2+离子,强场; (4) Co 2+离子,弱场。 解:(1) Cr 2+ 离子,高自旋:d 4,t 2g 3 e g 1 ,(-4×3+6×1)Dq = -6Dq ; (2) Mn 2+ 离子,低自旋:d 5,t 2g 5 e g 0,(-4×5)Dq+2P = -20Dq+2P ; (3) Fe 2+ 离子,强场: d 6,t 2g 6 e g 0,(-4×6)Dq+2P = -24Dq+2P ; (4) Co 2+ 离子,弱场: d 7 ,t 2g 5 e g 2 ,(-4×5+6×2)Dq = -8Dq 。 11 判断下列各对配合物的稳定性的高低:(填“ >”或“< ”) (1)[Cd(CN)4]2-、[Cd(NH 3)4]2+ ;(2) [AgBr 2]-、[AgI 2]-;(3)[Ag(S 2O 3)2]3- 、[Ag(CN)2]- (4) [FeF]2+、 [HgF]+ ;(5)[ Ni(NH 3)4]2+、[Zn(NH 3)4]2+ 答:(1) [Cd(CN)4]2->[Cd(NH 3)4]2+, CN -是比NH 3更强的配体; (2) [AgBr 2]-<[AgI 2]-, Ag + 属于软酸,I -属于软碱,而Br -属于交界碱; (3) [Ag(S 2O 3)2]3-<[Ag(CN)2]- CN -是比S 2O 32-更强的配体; (4) [FeF]2+ > [HgF]+ ; F -属于硬碱,Fe 3+ 属于硬酸,而Hg 2+ 属于软酸; (5) [ Ni(NH 3)4]2+ <[Zn(NH 3)4]2+ 查表发现:logK f (Zn(NH 3)42+ )=9.46, 而logK f (Ni(NH 3)42+ )=7.96 。 12 已知△0([Co(NH 3)6]3+ )=23000cm -1 ,△0([Co(NH 3)6]2+ )=10100cm -1 ,通过计算证明 f K
配位化学:第一章 配位化学的基本概念
第一章配位化学的基本概念 一、什么是配位化合物 二、配合物的组成 三、配合物的命名 四、配合物的异构现象 一、什么是配位化合物 1. 配合物的形成 1.1 铜氨络离子的形成 ?向氯化铜溶液中逐滴加入NH3·H2O溶液,首先得到蓝色Cu(OH)2沉淀。 ?继续向溶液中加入NH3·H2O溶液,Cu(OH)2沉淀则逐渐溶解,溶液变为深蓝色?向溶液中加入95%乙醇,则可以得到深蓝色沉淀,抽滤后,取少量沉淀,用水溶解,加入过量NaOH (10%)溶液,溶液无明显变化 CuSO4 + 2NH3·H2O → Cu(OH)2↓ + 2NH4+ NH3·H2O ——-——→ [Cu(NH3)4]SO4(深蓝色) + 4H2O [Cu(NH3)4]SO4 ——配位化合物 [Cu(NH3)4]2+ ——配离子 (1)定义:具有孤对电子的离子或分子和具有空轨道的原子或离子组成的化合物。 二、配合物的组成 内界: 中心体(原子或离子)与配位体,以配位键成键 外界:与内界电荷平衡的相反离子 (1)中心离子(或原子):提供空的价电子轨道 ①过渡金属阳离子。 ②某些非金属元素:如[SiF6]2-中的Si(IV) 。 ③中性原子:如Ni(CO)4和Fe(CO)5中的Ni 和Fe (2)配体的分类 按配体所含配位原子的数目分: 单齿配体:只含一个配位原子的配体(NH3,H2O等) 多齿配体:含有两个或两个以上的配位原子的配体 (3)配位数:直接与中心原子结合的配位原子的数目。 ①若为单齿配体,配位数=配位体数。 例:[Ag(NH3)2]+ 、[Cu(NH3)4]2+、[CoCl3(NH3)3]和 [Co(NH3)6]3+的配位数分别为2、4、6和6。 ②若为多齿配体,配位数≠配位体数。 例:[Cu(en)2]2+的配位数为4,Cu-edta的配位数为6。 一般中心原子的配位数为2,4,6,8。最常见的4,6。而5,7或更高配位数则较少见。(4)配离子的电荷:中心原子和配体电荷的代数和。 也可根据外界离子的电荷数来决定配离子的电荷数。 例:K3[Fe(CN)6]和K4[Fe(CN)6] 三、配合物的命名 配合物:[Cu(NH3)4] Cl2 氯化四氨合铜(II);
第十一章配位化合物
第十一章配位化合物 一、判断题: 1. 已知K2 [ Ni (CN)4 ]与Ni (CO)4 均呈反磁性,所以这两种配合物的空间构型均为平面正方形。 2.某配离子的逐级稳定常数分别为K、K、K、K,则该配离子的不稳定常数K= K·K·K·K。 3.HgS 溶解在王水中是由于氧化还原反应和配合反应共同作用的结果。 4.在多数配位化合物中,内界的中心原子与配体之间的结合力总是比内界与外界之间的结合力强。因此配合物溶于水时较容易解离为内界和外界,而较难解离为中心离子(或原子)和配体。 5.Zn2+只能形成外轨型配合物。 6.Fe2+既能形成内轨型配合物又能形成外轨型配合物。 二、选择题: 1.下列配合物中,属于内轨型配合物的是......................................()。 (A) [ V(H2O)6 ]3+,μ = 2.8 B. M.;(B) [ Mn (CN) ]4-,μ = 1.8 B. M.;。 6 (C) [Zn (OH)4]2-,μ = 0 B. M.;(D) [ Co(NH3)6 ]2+,μ = 4.2 B. M.。 2.配合物(NH4 )3[ SbCl6 ]的中心离子氧化值和配离子电荷分别是()。 (A) + 2 和? 3; (B) + 3 和? 3; (C) ? 3 和 + 3; (D) ? 2 和 + 3。 3. 第一过渡系列二价金属离子的水合热对原子序数作图时有两个峰,这是由于( ) (A) 前半系列是6配位,后半系列是4配位 (B) d电子有成对能 (C) 气态离子半径大小也有类似变化规律 (D) 由于晶体场稳定化能存在,使水合热呈现这样的规律 4 Fe(Ⅲ)形成的配位数为 6 的外轨配合物中,Fe3+离子接受孤对电子的空轨道是 ( ) (A) d2sp3 (B) sp3d2 (C) p3d3 (D) sd5 5. [NiCl4]2-是顺磁性分子,则它的几何形状为 ( ) (A) 平面正方形 (B) 四面体形 (C) 正八面体形 (D) 四方锥形 6.下列配离子的形成体采用sp杂化轨道与配体成键且μ = 0 B.M.的是.........()。 (A) [Cu (en)2]2+; (B)[CuCl2]-; (C)[AuCl4]-; (D) [BeCl4]2-。 7. [Ni(en)3]2+离子中镍的价态和配位数是 ( ) (A) +2,3 (B) +3,6 (C) +2,6 (D) +3,3 8. [Co(SCN)4]2-离子中钴的价态和配位数分别是( ) (A) -2,4 (B) +2,4 (C) +3,2 (D) +2,12 9. 0.01mol氯化铬( CrCl3·6H2O )在水溶液中用过量AgNO3处理,产生0.02molAgCl沉淀,此氯 化铬最可能为 ( ) (A) [Cr(H2O)6]Cl3 (B) [Cr(H2O)5Cl]Cl2·H2O (C) [Cr(H2O)4Cl2]Cl·2H2O (D) [Cr(H2O)3Cl3]·3H2O 10. 在[Co(en)(C2O4)2]配离子中,中心离子的配位数为 ( ) (A) 3 (B) 4 (C) 5 (D) 6 11. 在 K[Co(NH3)2Cl4] 中,Co 的氧化数和配位数分别是( ) (A) +2 和4 (B) +4 和6 (C) +3 和6 (D) +3 和 4 12. 在 [Ru(NH3)4Br2]+中,Ru 的氧化数和配位数分别是( ) (A) +2 和4 (B) +2 和6 (C) +3 和6 (D) +3 和 4
