放大内镜联合窄带成像技术对早期胃癌的诊断价值比较重点

·临床经验·放大内镜联合窄带成像技术对早期胃癌
的诊断价值比较
姜舒馨宫爱霞葛林梅夏楠冷敬李梅刘艳洁
【摘要】目的比较普通内镜与放大内镜联合窄带成像技术(ME-NBI)在早期胃癌及癌前病
变诊断中的价值。方法回顾性分析因早期胃癌或癌前病变行内镜黏膜下剥离术(ESD)并临床资
料完整的患者56例,其中术前行普通内镜检查21例;行ME-NBI检查35例,21例行ME-NBI下
靶向活检。以ESD术后病理诊断结果为诊断早期胃癌金标准,计算各检查方法的准确度、敏感度、
特异度、阳性预测值、阴性预测值,并进行比较。结果ME-NBI诊断早期胃癌的敏感度、准确度均
高于普通内镜下活检[96.0%(24/25)比45.5%(5/11)和88.6%(31/35)比61.9%(13/21)],差异有统
计学意义(P<0.01或<0.05)。ME-NBI下靶向活检诊断早期胃癌的敏感度高于普通内镜下活检
[86.7%(13/15)比45.5%(5/11)],差异有统计学意义(P<0.05)。ME-NBI和ME-NBI下靶向活检对
早期胃癌检出率比较差异无统计学意义(P>0.05)。结论ME-NBI及ME-NBI下靶向活检对早期
胃癌及癌前病变的诊断价值均优于普通内镜下活检;ME-NBI与ME-NBI下靶向活检对早期胃癌
的检出率相近。
【关键词】胃肿瘤;胃镜;活组织检查;回顾性研究;窄带成像;癌前病变
基金项目:大连市科技计划(2014E14SF169)
胃癌的早期发现、及时治疗对改善患者预后、提高生命
质量具有重大意义。目前临床工作中,内镜下活检为诊断胃
黏膜病变的金标准,但由于早期胃癌的病灶表浅,检出率较
低,且多项研究结果显示,内镜下活检结果与胃黏膜实际病
变性质存在一定的差异[1-3]。如何提高早期胃癌的检出率成
为如今消化内镜领域的研究热点之一,一系列内镜新技术应
运而生,其中,放大内镜联合窄带成像技术(magnifying endoscopy with narrow band imaging,ME-NBI)正逐渐广泛应用于临床,以提高胃黏膜病变的诊断水平。本研究旨在比较
普通内镜与ME-NBI对早期胃癌及癌前病变的诊断价值,为
临床应用提供参考。
资料与方法
1.一般资料:回顾性分析2013年7月至2015年12月因早期胃癌或癌前病变于我院行内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)治疗并临床资料完整的患者56例。纳入标准:因胃黏膜平坦型病变入院且顺利完成ESD,术前内镜检查完善,术后标本完整,病理结果确切。排除标准:胃黏膜隆起型或凹陷型病变等不适于行ESD 治疗者;病变未能完整切除者;中转外科手术者。其中,ESD 术前行普通内镜检查21例,行ME-NBI检查35例。
2.方法:ME-NBI采用Olympus GIF-H260Z电子胃镜,先端部前置黑色软帽,主机采用Olympus具有窄带成像技术(NBI)的EVIs-260系统。ME-NBI对早期胃癌的诊断参照VS分类标准[4-5];病理诊断参照维也纳分类[6]及2010年消化系统肿瘤WHO分类[7]。以ESD术后标本的病理诊断结果作为金标准。
3.观察指标:计算不同检查方法的准确度、敏感度、特异度、阳性预测值、阴性预测值等,分析内镜下活检与ME-NBI 对早期胃癌及癌前病变的诊断价值。
4.统计学方法:采用SPSS13.0软件进行统计分析,计数资料比较采用χ2检验或Fisher确切概率法,P<0.05为差异有统计学意义。
结果
1.两种检查方法结果比较:ME-NBI诊断早期胃癌的准确度、敏感度均高于普通内镜下活检,差异有统计学意义(P<0.01或<0.05);两者特异度、阳性预测值、阴性预测值比较差异无统计学意义(P>0.05),见表1~3和图1A、1B。表121例行内镜黏膜下剥离术患者术前普通内镜检查与
术后病理检查结果比较(例)
术后病理
早期胃癌
非癌性病变
合计
普通内镜
早期胃癌
5
2
7
非癌性病变
6
8
14
合计
11
10
21
DOI:10.3760/cma.j.jssn.1673-4904.2017.01.022
作者单位:116011大连医科大学附属第一医院消化内镜科通信作者:宫爱霞,Email:gongaixiadmu@https://www.360docs.net/doc/1b7066356.html,
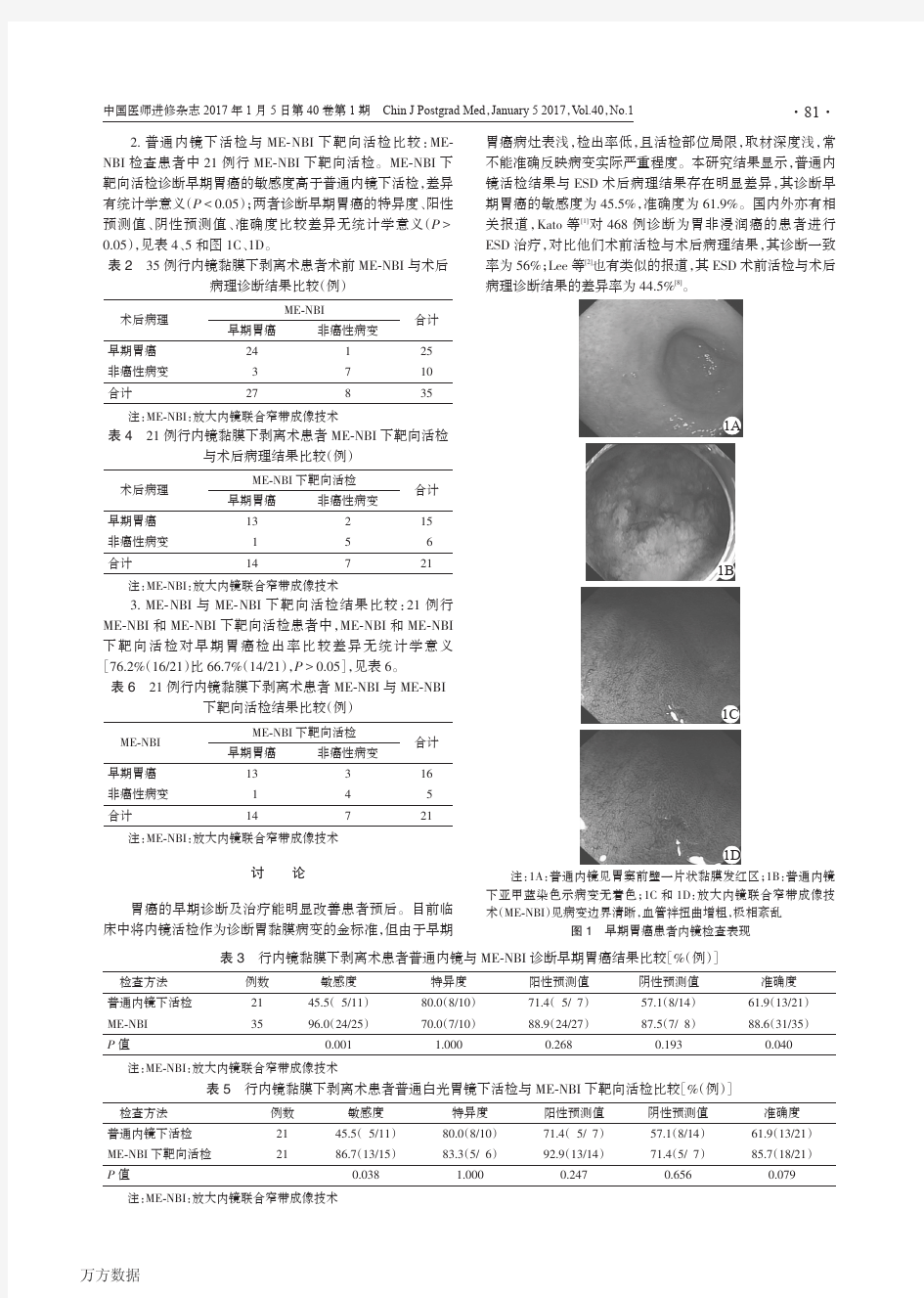
2.普通内镜下活检与ME-NBI下靶向活检比较:ME-NBI检查患者中21例行ME-NBI下靶向活检。ME-NBI下靶向活检诊断早期胃癌的敏感度高于普通内镜下活检,差异有统计学意义(P<0.05);两者诊断早期胃癌的特异度、阳性预测值、阴性预测值、准确度比较差异无统计学意义(P>0.05),见表4、5和图1C、1D。
表235例行内镜黏膜下剥离术患者术前ME-NBI与术后
病理诊断结果比较(例)
术后病理
早期胃癌非癌性病变合计
ME-NBI
早期胃癌
24
3
27
非癌性病变
1
7
8
合计
25
10
35
注:ME-NBI:放大内镜联合窄带成像技术
表421例行内镜黏膜下剥离术患者ME-NBI下靶向活检
与术后病理结果比较(例)
术后病理
早期胃癌非癌性病变合计
ME-NBI下靶向活检
早期胃癌
13
1
14
非癌性病变
2
5
7
合计
15
6
21
注:ME-NBI:放大内镜联合窄带成像技术
3.ME-NBI与ME-NBI下靶向活检结果比较:21例行ME-NBI和ME-NBI下靶向活检患者中,ME-NBI和ME-NBI 下靶向活检对早期胃癌检出率比较差异无统计学意义[76.2%(16/21)比66.7%(14/21),P>0.05],见表6。
表621例行内镜黏膜下剥离术患者ME-NBI与ME-NBI
下靶向活检结果比较(例)
ME-NBI 早期胃癌非癌性病变合计
ME-NBI下靶向活检
早期胃癌
13
1
14
非癌性病变
3
4
7
合计
16
5
21
注:ME-NBI:放大内镜联合窄带成像技术
讨论
胃癌的早期诊断及治疗能明显改善患者预后。目前临床中将内镜活检作为诊断胃黏膜病变的金标准,但由于早期胃癌病灶表浅,检出率低,且活检部位局限,取材深度浅,常不能准确反映病变实际严重程度。本研究结果显示,普通内镜活检结果与ESD术后病理结果存在明显差异,其诊断早期胃癌的敏感度为45.5%,准确度为61.9%。国内外亦有相关报道,Kato等[1]对468例诊断为胃非浸润癌的患者进行
ESD治疗,对比他们术前活检与术后病理结果,其诊断一致率为56%;Lee等[2]也有类似的报道,其ESD术前活检与术后病理诊断结果的差异率为44.5%[8]。
1A
1B
1C
1D
注:1A:普通内镜见胃窦前壁一片状黏膜发红区;1B:普通内镜下亚甲蓝染色示病变无着色;1C和1D:放大内镜联合窄带成像技术(ME-NBI)见病变边界清晰,血管袢扭曲增粗,极相紊乱
图1早期胃癌患者内镜检查表现
表3行内镜黏膜下剥离术患者普通内镜与ME-NBI诊断早期胃癌结果比较[%(例)]
检查方法
普通内镜下活检ME-NBI
P值例数
21
35
敏感度
45.5(5/11)
96.0(24/25)
0.001
特异度
80.0(8/10)
70.0(7/10)
1.000
阳性预测值
71.4(5/7)
88.9(24/27)
0.268
阴性预测值
57.1(8/14)
87.5(7/8)
0.193
准确度
61.9(13/21)
88.6(31/35)
0.040
注:ME-NBI:放大内镜联合窄带成像技术
表5行内镜黏膜下剥离术患者普通白光胃镜下活检与ME-NBI下靶向活检比较[%(例)]
检查方法
普通内镜下活检ME-NBI下靶向活检P值例数
21
21
敏感度
45.5(5/11)
86.7(13/15)
0.038
特异度
80.0(8/10)
83.3(5/6)
1.000
阳性预测值
71.4(5/7)
92.9(13/14)
0.247
阴性预测值
57.1(8/14)
71.4(5/7)
0.656
准确度
61.9(13/21)
85.7(18/21)
0.079
注:ME-NBI:放大内镜联合窄带成像技术
可以看出,普通内镜活检结果与胃黏膜实际病变性质存在一定的差异,对于活检提示非癌性病变并不能除外早期癌可能,易造成早期胃癌的漏诊。因此,学者们不断寻找可以提高早期胃癌诊断水平的内镜新技术。近年,ME-NBI逐渐广泛应用于临床,其对早期胃癌诊断的准确度已逐渐得到了学者们的认可[4,8]。本研究结果显示,ME-NBI诊断早期胃癌的敏感度为96.0%,准确度为88.6%,均明显高于普通内镜下活检。因此,对于普通内镜下活检提示低级别上皮内瘤变的患者,我们认为必要时可进一步行ME-NBI检查,明确病变性质,避免早期胃癌的漏诊。
本研究结果显示,ME-NBI对诊断早期胃癌存在一定的假阳性结果,其特异度为70.0%。有研究结果显示,部分低级别上皮内瘤变的病灶ME-NBI下亦存在不规则微血管、不规则的微腺管结构等表现,易与早期胃癌混淆,导致其特异度偏低[8]。其次,内镜医师对ME-NBI下病灶毛细血管及表面微结构形态的判断存在较强的主观性,因此,有待进一步更客观地确定ME-NBI对早期胃癌的诊断标准。
本研究结果显示,ME-NBI能够清晰显示病变最严重的部位,指导靶向活检,使ME-NBI下靶向活检诊断早期胃癌的敏感度明显高于普通内镜下活检。因此,对普通内镜下可疑早期胃癌或癌前病变的病灶,我们认为可考虑暂不予活检,建议其进一步行ME-NBI检查,行ME-NBI下靶向活检,提供更准确的活检部位,减少取活检块数,提高诊断准确度。
我们通过比较发现,ME-NBI与ME-NBI下靶向活检对早期胃癌的检出率相近。因此,我们认为对既往已行普通内镜下活检的患者,若ME-NBI对病灶诊断与前者相符,则可考虑不必再次行ME-NBI下靶向活检,尽量减少病理活检对组织造成的损伤;若两者结果不符,可行ME-NBI下靶向活检进一步明确诊断。
综上所述,我们对胃黏膜病变的诊断流程有以下观点:对于普通内镜下可疑早期胃癌的病灶,可暂不行病理活检,而是近期行ME-NBI检查,并行ME-NBI下靶向活检;对于已行普通内镜下活检者,若ME-NBI对病灶诊断与前者相符,则可考虑不必再次行ME-NBI下靶向活检,若两者结果不符,可行ME-NBI下靶向活检以明确诊断;对于ME-NBI 检查高度可疑早期胃癌但无病理结果支持者,可考虑行诊断性ESD,一方面,可以及时处理活检漏诊的早期胃癌,避免延误病情,另一方面,积极ESD治疗还可以有效切除胃黏膜的癌前病变,阻断其进展成为胃癌。
虽然ME-NBI对胃黏膜病变性质的诊断、ESD治疗前病变评估等方面具有较高的价值,但目前尚未有明确指南提出其可完全替代病理活检。并且,尽管ME-NBI对消化道早期癌诊断已逐渐得到业界认可,相关研究繁多,但对于ME-NBI 下胃黏膜细微结构组织的分型、胃黏膜病变的诊断标准等方面尚无指南颁布,有待进一步研究。相信随着ME-NBI在临床上的进一步开展及完善,其将对胃癌的早期诊断及治疗发挥重要的临床作用。
参考文献
[1]Kato M,Nishida T,Tsutsui S,et al.Endoscopic submucosal dissection as a treatment for gastric noninvasive neoplasia:a multicenter study by Osaka University ESD Study Group[J].J Gastroenterol,2011,46(3):325-331.DOI:10.1007/s00535-010-0350-1.
[2]Lee CK,Chung IK,Lee SH,et al.Is endoscopic forceps biopsy enough for a definitive diagnosis of gastric epithelial neoplasia?[J]. J Gastroenterol Hepatol,2010,25(9):1507-1513.DOI:10.1111/ j.1440-1746.2010.006367.x.
[3]张游,令狐恩强,卢忠生,等.术前活检在胃黏膜病变内镜黏膜
下剥离术治疗中的价值分析[J].中国继续医学教育,2011,3 (12):86-89.DOI:10.3969/j.issn.1674-9308.2011.12.014. [4]Yao K,Anagnostopoulos GK,Ragunath K.Magnifying endoscopy for diagnosing and delineating early gastric cancer[J].Endoscopy, 2009,41(5):462-467.DOI:10.1055/s-0029-1214594. [5]Yao K.How is the VS(vessel plus surface)classification system applicable to magnifying narrow-band imaging examinations of gastric neoplasias initially diagnosed as low-grade adenomas?[J]. Gastric Cancer,2012,15(2):118-120.DOI:10.1007/s10120-011-0132-3.
[6]Dixon MF.Gastrointestinal epithelial neoplasia:Vienna revisited [J].Gut,2002,51(1):130-131.
[7]李增山,李青.2010年版消化系统肿瘤WHO分类解读[J].中
华病理学杂志,2011,40(5):351-354.DOI:10.3760/cma.j.issn. 0529-5807.2011.05.019.
[8]Tao G,Xing-Hua L,Ai-Ming Y,et al.Enhanced magnifying endoscopy for differential diagnosis of superficial gastric lesions identified with white-light endoscopy[J].Gastric Cancer,2014,17 (1):122-129.DOI:10.1007/s10120-013-0250-1.
(收稿日期:2016-07-06)
(本文编辑:张莉)
中英文摘要撰写要求
摘要应概述研究的目的、方法、结果(包括主要数据)和结论,应具有独立性和自含性,即不阅读全文就能获得必要的信息。中文摘要一般400字左右,英文摘要可略详于中文摘要(约250个实词)。中、英文摘要的主要内容应一致。摘要应着重反映新内容和作者特别要强调的观点。不必列出本学科已成为常识的内容。不要简单地重复文题中已有的信息。摘要采用第三人称的写法,不列图、表,不引用文献,不加评论和解释。中文摘要中使用英文缩略语,应于首次使用时注出其中文全称,无需同时将其英文全称注出;对尚无合适汉语译名的新术语,可使用原文或译出后加括号注明原文。英文摘要中的缩略语,应于首次使用时将其英文全称注出。
·读者·作者·编者·
早期胃癌的内镜诊断
早期胃癌的内镜诊断 (1)隆起型早期癌的形态学特点 按山田分类法,将胃内隆起型病变分成4型。I型为轻度隆起,周边隆起界限不清楚,隆起坡度较缓慢,又称丘状隆起。Ⅱ型则为有明显界限的隆起。在Ⅱ、Ⅲ型的基础上,又分出两个亚型。即:扁平型和鼻状隆起型。这两个亚型是胃内恶性病变的特点,大部分为早期癌。 胃内隆起型早期癌由于组织学类型的不同,其形态也有不同,其中包括隆起的大小、形态及表面形状。胃内隆起大部分直径均在10一40cm之间,仅少数例外。它们的隆起高度以0.5cm为界限,高于0.5cm为I型,而低于0.5cm为Ⅱa型早期癌。隆起的表面性状是区分良恶性的主要条件。早期癌特有的表面结构是大小不等的结节或颗粒状,隆起边缘不整。隆起型早期癌大部分位于中度到重度肠上皮化生的区域,该区域黏膜表面形成大小不等、形态各异的胃小区或结节,而其大小不等、形态各异的程度主要依赖于肠上皮化生的程度。隆起型早期癌的表面性状与其周围黏膜结构的这种类似性,正是黏膜及黏膜下癌的形态学特征。随着癌组织浸润加深,以上表面性状将不存在,而出现糜烂、溃疡或结节。 当隆起型早期癌最大直径小于1.0cm时,其表面可以是光滑的,但有边缘不规则等特点。 隆起型病变包括良性形态及恶性形态两类。良性形态包括:丘状、半球状、亚蒂状、有蒂状、有蒂分叶状;其表面光滑,边缘整齐,但约3%仍有恶性可能。恶性形态包括:平盘状、平盘状伴凹陷、花瓣状、结节状;其表面均不平或呈颗粒状、结节状;其边缘不规整。组织学80%以上为恶性。 早期癌一般小于2cm,一般Ⅱa型早期癌隆起高度小于0.5cm,可分成细微隆起、平盘状隆起伴中心凹陷。共同特点为:隆起是扁平型、边缘不整齐、表面呈颗粒状,为黏膜层癌的特征表现,若扁平隆起中心部有凹陷、浅糜烂者,则为黏膜下浸润的表现,大部为早期Ⅱa型或Ⅱa+Ⅱc型癌。 I型早期癌的隆起高度往往大于0.5cm,表面呈结节状、颗粒状。若隆起为广基块状或大结节应为进展期癌。 (2)凹陷型早期癌的形态学特点 凹陷型早期癌包括:Ⅱc型、m型及Ⅱc+Ⅲ型等混合型。 Ⅱc型早期癌与凹陷型早期癌的绝大部分,凹陷糜烂深度一般不超过2~3mm,凹陷的边缘呈不规则的锯齿状,浸润深度决定了其界限的清楚与否。侵入深时,界限明显;侵入浅时(局限于黏膜层时),界限不清晰。凹陷中心部黏膜不规则,呈颗粒状或小结节状、不平坦,有时可见残留岛状黏膜,由再生上皮构成,其存在为早期癌的有力证据。凹陷中心发红、充血、质脆、黏膜皱襞中、呈切割样或笔尖样,为癌的黏膜层浸润。 不同组织类型的Ⅱc型早期癌其表现性状也有所不同。未分化型:表面不平,有结节、颗粒及黏膜中断都比较明显。Ⅱc型早期癌其溃疡周边或部分边缘往往伴有Ⅱc样改变,表现为:溃疡边缘不整或浅糜烂。凹陷型早期癌一般无包块形成,其周围隆起应考虑进展期胃癌的可能。在溃疡型早期癌的追查中,会发现中心部溃疡缩小,周边Ⅱc样改变会增大,甚至中心部瘢痕形成,周围Ⅱc进一步扩展,之后,中心溃疡又会再出现。这种改变在长时间内可反复出现,称为“恶性周期”。临床上仅根据治疗后溃疡愈合而诊断为良性溃疡,有时是不恰当的。 有人认为糜烂型是一种值得重视的凹陷性病变,并将其分成4型,其中Ⅱ型含癌的几率较高。
内镜下黏膜切除治疗早期胃癌的临床研究
内镜下黏膜切除治疗早期胃癌的临床研究 王洪升,刘运祥,黄留业,车金标 (青岛大学医学院附属烟台毓璜顶医院 消化内科,山东 烟台 264000) 摘要:目的 探讨内镜下黏膜切除(EMR)治疗早期胃癌的临床疗效、安全性及优越性。方法 选择2011年9月-2012年5月经胃镜检查发现的39例早期胃癌病人行EMR治疗,及同期行手术治疗的46例早期胃癌病人,观察两组的疗效、并发症、住院时间及住院总费用。结果 内镜下黏膜切除治疗早期胃癌的术后出血率、死亡率、住院时间及住院费用明显少于外科手术治疗(P<0.05)。结论 EMR治疗早期胃癌是一种安全有效的治疗方法,可以在一定规模的医院进行推广及普及。 关键词:内镜下黏膜切除;早期胃癌;治疗;外科手术;并发症 中图分类号:R735.2 文献标识码:A The clinical study of endoscopic mucosal resection for early gastric cancer WANG Hong-sheng,LIU Yun-xiang,HUANG Liu-ye,et al (Department of Gastroenterology,Yantai Yuhuangding Hospital affiliated to Medical College Qingdao University,Yantai Shandong 264000,P.R.China) Abstract:【Objective】To evaluate endoscopic mucosal resection(EMR)in the treatment of early gastric cancer in the clinical efficacy,safety and superiority.【Methods】Select patients with early gastric cancer found by gastroscopy from September 2011 to may 2012.39 cases with EMR treatment,and 46 cases of the same period with surgical treatment were observed among efficacy,complications,length of stay hospital and Hospitalization costs.【Resluts】Endoscopic mucosal resection was significantly less than surgical treatment in bleeding rate,mortality,length of stay and hospital costs(P<0.05).【Conclusion】EMR is a safe and effective treatment of early gastric cancer treatment,it can be Spread Universal in the certain scale of hospital. Key words:endoscopic mucosal resection(EMR);early gastric cancer;therapy;surgery;complications 癌症是一个世界性的问题,由于我国人口基数大,这一问题在我国尤为突出。胃癌的发病率和死亡率均居我国各类肿瘤的首位[1]。早期胃癌(EGC)是指无论有无淋巴结转移,病变限止于黏膜或黏膜下层的胃癌。早期胃癌多无症状或症状较为轻微,不易引起人们的重视,容易漏诊。目前对于胃癌的治疗仍以手术为主,放化疗为辅,早期胃癌一旦确诊并予以根治,5年内的生存率可达90%[2] 。随着内镜技术的改进,早期确诊率的提高,内镜医师经验的积累,内镜治疗逐渐成为治愈胃肠道早期肿瘤的一种有效方法。内镜下治疗与手术治疗患者的5年生存率相似。内镜下黏膜切除术(Endoscopic Mucosal Resection,EMR)是最早应用于治疗早期胃癌的内镜治疗方法。本研究对39例行内镜下黏膜切除术治疗和同期46例行外科手术治疗的患者,对比二者的疗效、并发症、住院时间、住院费用。 1 资料与方法 1.1 一般资料 选择2011年9月-2012年5月经胃镜检查取病理发现的早期胃癌39例行EMR治疗。EMR组39例,男性27例,女性12例,最大年龄76岁,最小年龄42岁,平均年龄54.7±6.5岁。同期手术组46例,男性32例,女性14例,最大年龄69岁,最小年龄40岁,平均年龄50.5±8.9岁。所选择的病例在性别、年龄方面没有明显差别。 1.2器械及设备 1.2.1器械 小探头超声胃镜(FUJIN SP720)、色素胃镜(OLYMPUS GLF-H260)、圈套器、爱尔博高频电切装置、注射针、钛夹1.2.2药品 止血:8%去甲肾上腺素、0.01%肾上腺素盐水、注射用血凝酶、奥曲肽;固定液:10%福尔马林;黏膜下注射液:0.01%肾上腺素盐水;术后用药:抗生素(左氧氟沙星、甲硝唑),黏膜保护剂(胃苏颗粒、瑞巴派特片),抑酸剂(雷贝拉唑、埃索美拉唑)。 1.3方法 1.3.1术前准备 术前常规禁食,查血常规、肝功、肾功、电解质、乙肝五项、输血前检验、血型、凝血四项、胸部CT、腹部CT、心脏彩超、心电图,评估患者一般状况。术前常规行小探头超声胃镜检查,确定病变位置及浸润层次。术前向患者及家属交代手术方法及手术过程,可能出现的并发症及意外,取得患者及家属的理解与信任并签署手术知情同意书。患者术前处于较好的心理状态,有焦虑、紧张、恐惧等给予安定镇静。 1.3. 2.1 EMR治疗 根据病灶的大小及形态选择不同的切除方法[3-5]。①标准切除:在病灶黏膜层注入0.01%肾上腺素盐水2-10mL,将病变托起,应用圈套器将其电切,回收送病理。(见图1-6) 图1 图2 图3 6 通讯作者:黄留业,E-mail:huangliuye-yhd@https://www.360docs.net/doc/1b7066356.html,。
放大内镜和窄带成像技术发现早期胃癌(组织分型及浸润深度)
放大内镜和窄带成像技术发现早期胃癌(组织分型及浸润深 度) VS 经典分型在区分癌与非癌上发挥了重要作用,后期学者又进一步对MV/MS 分型细化,以期预测组织学分型和早癌浸润深度,从而为后期内镜或外科治疗提供决策。 在预测组织学分型上,2010 年Akira 推出基于MV 的胃早癌ME+NBI 分型,即FNP(精细网格,fine network pattern),CSP(螺旋型,corkscrew pattern)(图1),此前一直被定义为「未分类型」的表型被进一步细化为IIL-1(小叶内环型-1,intra-lobular loop pattern-1),ILL-2(小叶内环型-2, intra-lobular loop pattern-2)(图2)。根据研究结果,FNP 与ILL-1 大部分为分化型腺癌,而CSP 多为未分化型腺癌。ILL-2 主要分布于分化型腺癌,但也可在未分化腺癌中存在。此外,64% 未分化ILL-2 腺癌中可见CS(螺旋状)微血管(图3),但在分化腺癌中未见此现象发生。 图1 FNP 与CSP 分型。A FNP 为MV 的精细网络状结构;B CSP 为MV 的螺旋型结构 图2 ILL-1 与ILL-2 分型。A ILL-1 为包含环形MV 的绒毛状腺体结构;B ILL-2 为上述基础上出现腺体断裂 图3 IIL-2 型胃癌中出现CS 型MV。A 胃体中部后壁一 0-IIc 型早癌;B NBI 可见不规则茶色区域;C ME+NBI:断
裂绒毛状腺体上可见CS 型MV;D 病理示黏膜固有层未分化腺癌相反,Masashi 等另辟蹊径,从癌灶周围非癌黏膜表型推测癌灶组织学类型,将癌灶周围非癌黏膜的ME+NBI 表现分为以下四型:A 点状型(圆形或针眼点状);B 短线状(扩张、垂直长凹痕结构);C 条纹型(管样,小梁嵴样结构);D 颗粒型(绒毛、乳头状结构)(图4)。该分型由sakaki 的胃黏膜ME+NBI 七类分型简化而来。C 与D 预测着分化型癌的组织类型,其理论基础是 C 和 D 表型为黏膜萎缩相关表型,是分化型癌(肠型)发生基础。B 型为HP (-)炎性黏膜表型,萎缩程度较 C 和 D 轻,预测未分化型癌组织学类型,也间接反映了不同于分化型癌的发生路径。 图4 胃癌周围黏膜的ME+NBI 分型。a-d 分别对应A-D 分型以下为ABCD 分型应用实例: 图5 A 白光下病灶经靛胭脂染色后,病变为平坦结节形高分化腺癌,周围黏膜呈细颗粒样萎缩表现;B 放大后观察,可见小绒毛状结构(D 型) 图6 A 胃体中部前壁可见凹陷型未分化型早癌,褪色,大小约10 mm;B 放大观察,背景黏膜为B 型(短线状)2014 年Takashi 等通过多元逐步回归分析认为MV 结构缺失(AMSP,absent microsurface pattern)为区分未分化癌与分化型癌重要因素,并通过ROC 曲线判定出边界值为50%,
早期胃癌的内镜治疗进展
早期胃癌的内镜治疗进展 宋新明李明哲 中山大学附属第一医院 胃癌是我国高发恶性肿瘤之一,也是世界范围内第二位癌症死亡原因[1],多数患者确诊时已为胃癌晚期。近年来,随着消化内镜诊治技术不断发展,早期胃癌的发现和诊断水平有了显著提高,并出现了内镜下黏膜切除术(endoscopic mucosal resection,EMR) 和内镜黏膜下剥离术(endoscopic submucosal dissection,ESD) 等一系列安全有效的微创治疗早期胃癌的方法。内镜下切除早期胃癌可极大地提高胃癌患者生活质量且预后良好,已成为早期胃癌新的治疗方向。本文就早期胃癌的内镜下治疗进展作一介绍。 一、诊断和术前分期 早期诊断是决定胃癌预后的关键。早期胃癌(early gastric cancer,EGC)指局限于黏膜或黏膜下的胃癌, 无论局部淋巴结有无转移[2]。根据日本国家癌症中心的报告,局限于黏膜层和黏膜下层的早期胃癌5年生存率高达99%和96%。随着消化内镜诊断技术的广泛开展以及临床医生对恶性肿瘤防范意识的提高,早期胃癌的检出率逐年升高, 约占我国胃癌病例的10%左右[3],但与日本相比仍有不小差距,日本自开展国家胃癌筛查项目以来,早期胃癌已占胃癌病例的40%以上。 无淋巴结转移是决定ECG内镜下手术的先决条件。研究表明,当肿瘤位于黏膜层时其淋巴结阳性率约2%~3%,而黏膜下肿瘤淋巴结阳性率约10%左右[4]。因此,准确判断肿瘤浸润深度是决定ECG内镜手术的关键。超声内镜(Endoscopic ultrasonography,EUS) 是目前判断肿瘤浸润深度的可靠方法,Okada 最近研究表明,直径小于30mm的分化型胃癌,EUS诊断准确率高达% (259/295),肿瘤较大(直径大于30mm) 或未分化胃癌,其诊断准确率有所下降,分别为% (10/23)和75% (42/56)[5]。Kutup对123例患者回顾性分析表明,EUS总体准确率
NBI窄带成像内镜基本原理及临床应用
窄带成像内镜 又称为内镜窄带成像术(Narrow Band Imaging,NBI),是一种新兴的内镜技术,它是利用滤光器过滤掉内镜光源所发出的红蓝绿光波中的宽带光谱,仅留下窄带光谱用于诊断消化道各种疾病。NBI内镜技术主要的优势在于:不仅能够精确观察消化道黏膜上皮形态,如上皮腺凹结构,还可以观察上皮血管网的形态。这种新技术能够更好地帮助内镜医生区分胃肠道上皮,如Barrett食管中的肠化生上皮,胃肠道炎症中血管形态的改变,以及胃肠道早期肿瘤腺凹不规则改变,从而提高内镜诊断的准确率。 1简介编辑 内镜窄带成像术(NBI)作为一种新兴的内镜技术,已初步显示出它在消化道良、恶性疾病的诊断价值。NBI的窄带光谱有利于增强消化道黏膜血管的图像,在一些伴有微血管改变的病变,NBI系统较普通内镜有着明显的优势。目前,NBI已在多领域广泛开展,应用范围除消化道外,还包括耳鼻咽喉、呼吸道、妇科内镜与腹腔镜外科等。 2用途编辑 具NBI功能的内镜其外形和常规操作与普通内镜基本一致,在操作中可随时切换至NBI模式观察病灶。对于附带NBI功能的变焦放大内镜而言,在对病灶近距离放大观察后再开启NBI 模式,能更清晰地了解病灶表面的黏膜凹窝形态及血管等,方便对病灶进行定性与靶向活检。目前,NBI在临床工作中的应用包括: ①微小病灶的早期发现与诊断;②联合放大内镜观察其细微结构,进一步评价其特性并预测组织病理学结果;③作为病灶靶向活检及内镜下治疗的定位手段。 NBI技术的应用大大提高了中下咽部早期癌、食管上皮内癌、Barrett食管、早期胃癌、结肠早期癌的诊断及检出率。 NBI图像中血管和粘膜的颜色对比率明显更大,易于对食管上皮微血管(IPCL)的形态观察和评价,尤其是对无经验的内镜医师更易于发现病变。与组织学金标准相比,使用NBI内镜对IPCL的评价预测肿瘤浸润深度的精确性可达85%,因此,日本内镜学会建议在食管鳞癌的筛检中应常规使用HR-NBI。Barrett食管是食管腺癌唯一癌前病变,使用NBI加放大内镜联合检查Barrett食管,较传统电子内镜更容易呈现鳞柱上皮交界处,能更清晰地显示Barrett 上皮血管网的形态,并能较好地对Barrett上皮进行粘膜腺凹形态分型。资料显示,放大内镜、NBI加放大内镜和靛胭脂染色放大内镜能清楚地显示上皮腺凹的比例分别为14%、61%和70%。另外,通过活检证实其对异型增生诊断的准确性分别为42%、73%和79%。表明NBI 加放大内镜优于普通放大内镜,具有与染色放大内镜相近的诊断率。 大多数的胃癌被认为来源于一系列粘膜改变,经历Hp相关性胃炎、萎缩性胃炎、肠上皮化生和上皮内瘤变到肿瘤。越来越多研究证明,胃粘膜表面微血管结构的观察可以提高胃癌前病变和早癌诊断的敏感性。放大内镜结合NBI系统虽然不能取代组织学检查,但是能预测胃癌的组织学的特征。NBI放大内镜通过照射到胃黏膜中肠化上皮顶端可产生淡蓝色冠(LBC),人们根据这一特点应用NBI放大内镜在萎缩性胃炎中识别肠上皮化生的区域。临床观察结果显示,NBI识别肠上皮化生的敏感性为89%,特异性为93%。因此,NBI放大内镜通过淡蓝色冠这一特点,能较准确地发现胃黏膜中的肠上皮化生。 由于放大内镜在结肠癌的诊断中应用较成熟,且结肠黏膜较薄,微血管易见。因此,NBI系统对结肠疾病的鉴别和诊断帮助较大。NBI系统观察黏膜表面变化,判断肿瘤或非肿瘤病变的符合率比普通内镜和染色内镜高,敏感性强。NBI对结肠增生性息肉、腺瘤和早期癌的诊断敏感性为95.7% ,特异性为87.5%,准确性为92.7%。 3原理编辑 传统的电子内镜使用氙灯作为照明光,这种被称为“白光”的宽带光谱实际上是由R/G/B(红/绿/蓝)3种光组成的,其波长分别为605nm、540nm、415nm。NBI系统采用窄带滤光器代
早期胃癌的内镜诊断和治疗进展
早期胃癌的内镜诊断和治疗进展 1 早期胃癌的定义及分型 早期胃癌(early gastric cancer,EGC)这一概念最早由日本内镜学会1962年提出[1],定义为癌肿位于黏膜和黏膜下未达肌层,无论有无淋巴结转移。EGC 又分为黏膜癌(M-Carcinoma,MC)及黏膜下癌(SM-Carcinoma,SMC)。早期胃癌的概念是就癌肿的浸润深度而言,在内镜就大小而言,与EGC相关的有小胃癌、微小胃癌、超微小癌三个概念。小胃癌指的是直径为6-10 mm的EGC,小胃癌指直径在5 mm以下的癌灶,超微小癌,又叫“一点癌”系胃癌黏膜标本为恶性,但是手术切除的标本却找不到癌灶[1]。 1962年日本内镜协会按胃癌侵犯深度不同,将早期胃癌分为三型:Ⅰ型(隆起型);Ⅱ型(平坦型),又分为Ⅱa(微隆起)、Ⅱb(表面平坦)、Ⅱc(浅凹陷);Ⅲ型(凹陷型),这一分类方法2002年在巴黎会议上被西方学者接受[2],现在成为早期胃癌的主要分类方法。 2 早期胃癌的临床病理特征 淋巴结转移[3]:EGC约有7%~29%的病例可发生区域性淋巴结转移,EGC 淋巴结转移率较低,易被临床医生所忽视。但是EGC有无淋巴结转移为影响预后的最主要因素之一。因而强调认识EGC淋巴结转移规律及术中彻底廓清受累淋巴结的重要性。EGC还具有浅表性扩散和多灶性生长的特点,浅表性扩散的EGC具有沿黏膜和黏膜下层向胃壁四周呈扩延性生长的倾向[4]。 3 早期胃癌的内镜诊断 胃癌的预后与诊断的早晚有密切关系,早期诊断是提高疗效的关键。日本的EGC的诊断率最高,达50%,我国报道仅为10%左右[5]。 3.1 普通电子胃镜:普通电子胃镜可以直接观察胃内形态变化,并可以取病变组织活检,多块组织活检可以提高诊断率。对黏膜粗糙、色泽改变、表面有白
内镜黏膜下剥离术治疗早期胃癌19例分析
内镜黏膜下剥离术治疗早期胃癌19例分析【关键词】早期胃癌;内镜粘膜下剥离术;治疗 早期胃癌(EGC)是指胃癌病变位于黏膜或黏膜下层,而无论病灶大小和是否有淋巴结转移。近年来开展的EGC内镜黏膜下剥离术(ESD)取得了良好的治疗效果,同时免除了传统手术治疗的风险及术后对生活质量带来的严重影响。我院自2008年1月至10月共采用ESD治疗EGC 19例,并取得良好疗效,现将其治疗、并发症及预后分析如下。 1 资料与方法 1. 1 临床资料 2008年1月至10 月我院消化内镜中心确诊为EGC并行ESD治疗的患者共19例。其中男11例,女8例;年龄47~85岁,平均年龄63. 5岁。病灶分布:贲门部6处,占31. 6%;胃角部4处,占21. 1% ;胃窦部9处,占47. 3% 。所有病灶均经超声胃镜证实病变局限于黏膜层或黏膜下层,未达肌层。病灶直径20~75mm,平均46 mm。 1. 2 ESD方法 1. 2. 1 器械采用Olympus XQ240型胃镜,针状刀、IT刀,Hook刀、Flex刀、透明帽、电止血钳、ERBEICC-200内镜治疗电子系
统等。
1. 2. 2 ESD步骤首先用针状刀沿病灶周边约0. 5mm进行标记,标记后用1:10 000肾上腺素美兰生理盐水进行黏膜下注射,使病灶均匀隆起,然后用针状刀行环周预切开,切开后用IT刀或者针状刀进行剥离,直至黏膜剥离完全。用三爪钳取出病变。手术过程中出血用氩气刀局部止血。 1. 2. 3 组织学检查及疗效评价切除标本经福尔马林固定后,送病理科进行进行组织学检查。组织学疗效评价根据Neuhaus H 等[1]报道的方法进行: 切缘无癌细胞可以视为完全治愈性切除;切缘可能存在癌细胞为可能治愈性切除;非以上两种情况为组织学非治愈性切除,因为分块切除无法进行组织学评估,因此分块切除被认为是非治愈性切除。 1. 2. 4 并发症分析及随访主要分析的并发症包括腹痛、出血、穿孔、消化道狭窄梗阻等。随访方法:所有ESD患者均详细记录联系方式,于术后6月、12月通知患者进行胃镜检查。在原切除部位及其周围1cm范围内取材进行病理学检验。 2 结果
早期胃癌的胃镜诊断进展
万方数据
早期胃癌的胃镜诊断进展 作者:王向前, 郭亚民 作者单位:王向前(青海大学医学院 青海 西宁 810001), 郭亚民(青海省人民医院 青海 西宁 810007) 刊名: 中国保健营养(中旬刊) 英文刊名:China Hwalth Care & nutrition 年,卷(期):2014,24(4) 参考文献(15条) 1.Suzuki H;Gotoda T;Sasako M Detection of early gastric cancer:misunderstanding the role of mass screemng 2006(04) 2.Kentaro S;Kiichi S;Yao K New diagnostic Approaches for Early Detection of Gastric Cancer[]] 2004(22) 3.周英勇;夏扣平染色内镜提高早期胃癌、癌前病变检出率的临床研究 2011 4.Peitz U;Malfertheiner P Chromoendoscopy:from a research tool to clinical progress 2002(03) 5.Yao K;Iwashita A;Yao T Early gastric cancer:proposal for a new diagnostic system based on microvascular architecture as visualized by magnified endoscopy 2004 6.刘国焰,邱荣锋放大内镜对早期胃癌的诊断价值[期刊论文]-广东医学 2010(12) 7.Probsta A;Messmann H Endoscopic therapy for early gastric cancers-from EMR to ESD,from guideline criteria to expanded criteria 2009(03) 8.严超,朱正纲,诸琦,燕敏,陈军,刘炳亚,尹浩然,林言箴内镜超声检查在早期胃癌术前分期的应用[期刊论文]-中华肿瘤杂志2003(4) 9.张阳德,李罗丝激光诱导组织自体荧光光谱技术在消化道恶性肿瘤早期诊断中的应用[期刊论文]-中国医学工程 2006(1) 10.陈颖,陈丽娜,俞丽芬,刘晓天,吴巍,马文芳,陆玮,吴云林早期胃癌在体固有荧光光谱特征分析[期刊论文]-上海交通大学学报(医学版) 2007(5) 11.Kobayashi M;Tajiri H;Seike E Detection of early gastric cancer by a real-time auto fluorescence imaging system 2001 12.娜仁满都拉,王雪东,王红英窄带成像系统在早期胃癌中的应用[期刊论文]-中国实用医药 2012(8) 13.张晓华,刘吉勇窄带成像技术在早期胃癌内镜诊断中的应用[期刊论文]-山东医药 2009(7) 14.李文波,李延青共聚焦激光显微内镜对早期胃癌的识别和分类[期刊论文]-中华临床医师杂志(电子版) 2012(12) 15.刘倩怡,彭侠彪,李素英,阮巍山,叶建明内镜智能分光比色对诊断早期胃肿瘤的临床研究[期刊论文]-新医学 2013(1) 引用本文格式:王向前.郭亚民早期胃癌的胃镜诊断进展[期刊论文]-中国保健营养(中旬刊) 2014(4)
白光内镜下发现早期胃癌的技巧(干货满满)
白光内镜下发现早期胃癌的技巧(干货满满) 教你如何发现和诊断早期胃癌。来源丨消化道早期癌内镜诊断技巧图谱(修订版) (内容已获出版社授权发布) 我国的胃癌发病率与日本和韩国相近,但是,当前我国胃镜下检出的早期胃癌仅占全部胃癌的10% 左右,远低于日本(约70%)和韩国(约50%)的水平。早期胃癌检出率的差异,除了无症状人群筛查率的不同外,与内镜医师的早癌诊断能力也有很大关系。由于早期胃癌与进展期胃癌相比,内镜下形态有明显的不同,内镜医师如果对早期胃癌的认识不足,就容易造成漏诊(图2-3-1)。 图2-3-1早期胃癌漏诊病例 A. 病例1,初次胃镜检查,胃角小弯可见一凹陷型病灶,高度可疑早期癌,但内镜医师未注意到该病灶,未取活检; B. 病例1,3 年后该患者复查胃镜,发现胃角小弯进展期癌,活检病理示低分化腺癌; C. 病例2,初次胃镜检查,胃窦后壁可见一发白的凹陷型病灶,可疑早期癌,活检病理示轻度异型增生,但未密切随诊; D. 病例2,2 年后复查胃镜,胃窦后壁可见进展期癌,活检病理示印戒细胞癌; E. 病例3,初次胃镜检查,幽门口8 点钟方向可见一发红的浅凹陷,但内镜医师未注意到该病灶,未活检; F. 病例3,2 年后复
查胃镜,可见幽门口7 ~8 点钟方向进展期癌,活检病理示印戒细胞癌 白光内镜下发现早期胃癌的技巧 胃镜下检出早期胃癌包括发现病灶和诊断病灶两个步骤。发现病灶,即在内镜下“找到”可疑的病灶;诊断病灶,即通过对可疑病灶的内镜下形态分析,包括普通白光内镜、染色内镜、放大内镜、NBI 等方法,大致判定该病灶为良性或可疑恶性,然后对可疑恶性的病灶行活检,最终通过病理确诊。因此,在内镜下发现可疑病灶是诊断早期胃癌最重要的第一步。首先是规范化的胃镜操作,要尽可能地看到全部的胃黏膜区域,不能留有视野上的“盲区”。如果根本就没有看到病灶,是不可能诊断早期胃癌的。 胃镜检查前,需要常规提前服用去泡剂和去黏液剂。泡沫和黏液的附着会极大地影响病灶的检出,对染色和NBI 放大观察也有不利的影响(图2-3-2)。笔者所在科室常用的方法是在胃镜检查前20min,让患者口服50ml 的西甲硅油+ 链霉蛋白酶混合溶液,然后在检查过程中视情况做进一步冲洗。患者在胃镜检查时,剧烈的呕吐和胃壁的挛缩也会影响病灶的检出,使用镇静药,如丙泊酚或咪唑唑仑(无痛胃镜检查),以及使用解痉药,如丁溴东莨菪碱、盐酸消旋山莨菪碱(654-2)或阿托品可以减轻患者的呕吐和胃壁挛缩。对有青光眼和严重前列腺肥大的患者,可以使用胰高血糖素替
早期胃癌的胃镜诊断
早期胃癌的胃镜诊断进展 朱黎明1,戴强t,吴云林2 (1.上海交通大学医学院附属第三人民医院消化科,上海201900; 2.上海交通大学医学院附属瑞金医院消化科,上海200025) 胃癌是常见的消化道肿瘤之一。严重影响人们的生命和生活质量。进展期胃癌预后不佳。5年生存率仅20%一40%,而早期胃癌(early gastric cancer,EGC)的5年生存率高达80%一90%。许多文献显示,约半数EGC患者无任何症状.出现症状时往往已是进展期胃癌。因此。胃癌的早期诊断显得尤为重要,如能在胃癌的早期阶段通过一系列的手段和技术检查出来。对于提高术后生存率和生活质量有着深远的意义。内镜是诊断消化道病变的主要手段。近10年来,出现了许多内镜领域里的新技术.对于提高EGC的检出率有很大的帮助。本文就针对EGC的内镜诊断新进展作一综述。 超声内镜 一、超声内镜(EUS)的特点和对EGC浸润深度判断的优势 EUS是将超声波和内镜结合起来的一种内镜检查方法,通过将超声探头导入胃腔贴近病灶进行扫描,可清晰观察病灶的浸润深度以及探查胃周围淋巴结和附近脏器转移情况.为EGC 的确诊和治疗前TNM分期而选择合理的治疗方式提供依据。正常胃黏膜娃示5层回声。分别是高回声.低回声.高回声.低回声.高回声5层清晰结构.分别对应组织学界面层为黏膜层.黏膜下层.固有肌层.浆膜层。胃癌声像表现在低回声病灶取代几层或全层结构.形成缺损、不规则、中断等现象。病灶局限在第3层高回声内为EGC。EGC在EUS的典型表现是低回声的不规则病灶.黏膜层及黏膜下层结构紊乱、破坏或增厚.第2层低回声区或第3层高回 声区不规则狭窄、隆起、回声不均匀等表现。EUS易于鉴别EGC与进展期胃癌,对隆起型和平坦型胃癌的浸润深度的判断准确率明显高于凹陷型。Barbour等121运用EUS对209例胃食管交界腺癌患者进行手术前肿瘤分级后认为,EUS可以准确预测早期和进展期肿瘤,从而可以帮助进展期肿瘤患者在手术前治疗。吕瑛等认为EUS诊断早期胃食管癌浸润深度的总准确率达93.8%,对病变内镜可切除性的评估总准确率为89.2%。但EUS鉴别黏膜内癌和黏膜下癌的准确率则相对较低,报道不一。Kim等141回顾性分析206例术前行EUS检查的EGC患者术后组织学分化程度和浸润深度.认为EUS估计EGC的肿瘤侵犯深度受到肿瘤组织分化程度和大小的影响。对于低分化或范围>3 cm的肿瘤侵犯程度判断不够准确。另一位日本学者也得出类似结论.认为EUS对于判断溃疡型或黏膜下浸润的EGC深度准确率低于隆起型或分化型EGC,不宜行内镜下治疗嘲。同时,肿瘤的位置不同亦影响EUS的观察。如胃底、体部的EUS观察较胃窭部更容易,内镜医师的操作熟练程度和经验、以及超声的频率不同等诸多原因都会影响EGC的诊断。 二、EUS可协助判断EGC淋巴结转移 EUS还可用于显示和判断EGC、尤其是黏膜下癌有无区域淋巴结转移。正常淋巴结在超声声像图表现为椭圆或圆形的低回声结节,边界清晰,回声均匀。有时成群出现。现在多认为圆形、低回声或内部回声不均匀、以及与肿瘤部位回声相同者多为转移淋巴结。而炎性淋巴结多为高回声、椭圆形,周边模糊。EUS探及的边界清楚、回声低或与病灶紧密相连的淋巴结常为转移性。EUS在判断胃周围淋巴结转移方面较准确。EUS对于胃癌浸润的深度和范围、近处转移淋巴结和距癌灶边缘3 cm以上远处转移淋巴结诊断.尤其贲门部的近处癌灶具极大的诊断价值和独到之处。对临床和普通胃镜下怀疑胃癌但多次活组织检查(活检)阴性的患者EUS是最佳选择。对术后随访发现残余癌或复发癌有很大意义,在EUS引导下做针吸活检有助于微小胃癌的检出。EUS鉴别EGC与进展期胃癌的准确牢达70%~80%.是术前准确判断EGC 有效的方法之一。并可用来指导黏膜下EGC切除术。最近又推出了电子EUS,可将胃黏膜细分至7层甚至9层。更提高了EGC诊断的敏感性。
早期胃癌诊断技术进展
早期胃癌诊断技术进展 (作者:___________单位: ___________邮编: ___________) 【关键词】早期胃癌 早期胃癌(early gastric carcinoma, EGC)是指局限于黏膜内(M)或黏膜下层(SM)的胃癌,而不考虑是否存在淋巴结转移。根据日本胃肠道内窥镜学会(1962年)以及日本胃癌协会(1998年)制定的标准,EGC的大体形态分为3型:隆起型(Ⅰ型)、平坦型(Ⅱ型)及凹陷型(Ⅲ型),其中平坦型(Ⅱ型)又可分为浅表隆起型(Ⅱa)、浅表平坦型(Ⅱb)及浅表凹陷型(Ⅱc)。 自从提出早期胃癌这个概念以来,对早期胃癌诊断的研究发展迅速,除了传统的放射学检查、内窥镜检查、细胞学检查方法外,一些新的检查方法相继出现,如单克隆抗体、基因诊断、内镜超声(EUS)等,并且深入到分子生物学领域,成为早期胃癌诊断的重要手段和办法。这些检查办法,对正确评估肿瘤性质、浸润程度、转移情况和如何治疗均有重要指导意义。 1 放射学检查
1.1 X线检查 常规钡餐检查对胃黏膜的微细结构显示不足,不能作为EGC的检查方法。胃气钡双重对比影像学检查可以通过双对比像、黏膜像、充盈像和压迫像等清晰地显示病变,四种检查方法还可相互补充证实,提高EGC的检出率。胃双重造影法将双对比法和传统方法结合,实现了钡检技术由经验技巧性转向规范化和程序化,使病变显示和认识的质量有更可靠的保障。目前,X线不仅能够证实胃癌是否存在,同时还能够对浸润深度和范围做出诊断。日本每年用放射影像学方法普查大约500万人,胃癌检出率为0.12%,其敏感度为82.4%,特异度为77.2%。我国也开展了该项普查,胃癌检出率为0.1%,其中EGC占71.4%。放射影像学检查可疑者必须经内窥镜检查,以明确诊断[1]。 1.2 薄层螺旋CT 虽然薄层螺旋CT目前已经广泛应用于进展期胃癌的术前分期,但对于判断EGC的淋巴结状况,其准确率、敏感性和特异性并不优于内窥镜超声,因为EGC的淋巴结转移多局限于胃周淋巴结。Kunisaki 等[2]的一组EGC资料显示,螺旋CT诊断正确率为89%,敏感性为73%,特异性为93%,而内窥镜超声的诊断正确率、敏感性和特异性分别为90%、84%和96%。此外,CT模拟胃镜诊断EGC的阳性符合率达到70%以上,甚至可显示直径仅为1cm的黏膜病灶[3,4]。 2 内窥镜检查 2.1 普通内窥镜检查 临床工作证实胃镜检查安全可靠。有研究表明,胃镜对胃癌诊断的
