催化裂化汽油改质反应动力学模型研究_杨光福

文章编号:0253-2409(2007)03-0297-05
收稿日期:2006-10-11;修回日期:2007-02-11。
基金项目:教育部新世纪优秀人才支持计划(NCET -04-0107)。
联系作者:高金森,T e:l 010-********;E-m ai:l js gao @bjpeu https://www.360docs.net/doc/1f16363652.html, .。
作者简介:杨光福(1979-),男,湖北荆门人,博士研究生,从事催化裂化方面的研究。E -m ai :l fl ys h eep04@163.co m 。
催化裂化汽油改质反应动力学模型研究
杨光福,王 刚,田广武,高金森
(中国石油大学(北京)重质油国家重点实验室,北京 102249)
摘 要:以催化裂化反应机理为基础,针对催化裂化汽油改质过程,把催化裂化汽油和产品按馏程和化学组成集总,建立了催
化裂化汽油改质的六集总反应动力学模型,通过对实验数据的回归,求取了反应动力学速率常数,反应活化能和反应的指前因子。结果表明,该模型对原料和反应条件变化有较好的适应性,能较好预测不同条件下的产率分布和汽油组成,有助于降低汽油烯烃质量分数的研究。
关键词:催化裂化汽油;改质;烯烃;降低;反应动力学模型中图分类号:TE624.4 文献标识码:A
K ineticm odel of FCC naph t ha olefi n refor mu l ation
YANG G uang -fu ,W ANG G ang ,T I A N G uang -w u ,GAO Ji n -sen
(Sta te K ey La bo ra t o r y o f H eavy O il P ro cessi ng,Ch i na U n i v ersity o f P etro leu m (Be iji ng ),Beiji ng 102249,China )
Abstract :A six -lu m p kine ticm ode lw a s derived on the ba sis of FCC reacti o n m echan is m t o represent the FCC naphtha o l e fin refo r m ulation .Lu m psw ere defi n ed no t on ly by their bo ili n g range but a lso by the ir che m ical co m-po siti o ns .Rate constants ,frequent facto rs and acti v ation energ iesw ere esti m ated based on t h e experi m en tal da ta .The propo sed m odel co ul d no t on ly predict successfully the y ie l d s ,but also pr o v i d e m o re info r m ati o n o f the che m ica l com po sitions o f naphtha .The m ode l is useful fo r the study o f how to reduce t h e o lefi n conten t o f FCC naphtha .K ey words :FCC naph t h a ;refor m ulati o n ;o lefi n s ;reduction ;kine tic m ode l 中国车用汽油中催化裂化汽油所占比例高达80%左右,汽油作为主要的发动机燃料,随着环保法规排放标准的提高,烯烃的质量分数受到严格限制。因此,催化裂化汽油降烯烃已经成为催化裂化技术急需解决的问题。许多针对汽油降烯烃的催化裂化技术竞相出现,如M I P [1]
、MGD [2,3]
、FDFCC 以及两段提
升管催化裂化新技术
[4~8]等。中国石油大学(北京)
重质油国家重点实验室研发了/催化裂化汽油辅助反
应器改质降烯烃技术0[9,10]
。该技术以常规催化裂化工艺为基础,依托原有催化裂化装置,再增设一个单独的改质反应器,利用这一单独的反应器和常规催化裂化催化剂对催化裂化汽油进行催化改质。该技术的主要特点是在生产符合汽油标准的情况下,最大限度地减小改质过程中汽油的损失。吴青等
[11]
和邹圣
武等[12]
针对FDFCC 工艺建立了集总动力学模型,但是对于催化裂化汽油低温改质的动力学模型的报道较少。本研究对催化裂化汽油改质的动力学模型进行了研究,在经典正碳离子反应机理的基础上,通过对催化裂化汽油改质反应的合理假设,简化反应网
络,建立了六集总反应动力学模型,通过对实验数据
的回归,求取了反应动力学速率常数,反应活化能和反应的指前因子。
1 实验部分
实验主要在小型催化裂化固定流化床实验装置上进行,详细流程见文献[13]。实验所用原料为华北石化公司的催化裂化汽油,大港催化裂化汽油和胜利催化裂化汽油,其组成见表1。实验所用催化剂为华北石化公司的催化裂化平衡剂,其性质见表2。改质反应后气体利用HP6890炼厂气分析仪进行分析,得到气体的体积组成,然后根据理想气体状态方程求得质量组成。液体产品用荷兰AC 公司的高温模拟蒸馏仪测定馏程分布。以C 13的235e 沸点作为边界,作为汽油和柴油的划分标准。改质反应前后的汽油利用带有FI D 检测器的SP-3420色谱来分析烃类的组成。所采用色谱柱是PONA 毛细管色谱柱。反应后的催化剂用快速精密定碳仪进行定碳分析。
第35卷第3期2007年6月
燃 料 化 学 学 报
Jo urna l o f Fuel Chem istry and T echno l og y
V o.l 35No .3
Jun .2007
表1 原料汽油的PONA 组成分析T ab l e 1 PONA compositi on of FCC naphthas
Ite m
Content w /%
n -parraffi n i -pa rraffi n
o lefi n c -parraffi n arom ati c H uabe i FCC napht ha 5.6027.6837.836.3022.59Shengli FCC naphtha
4.6021.7449.978.391
5.30D agang FCC naphtha
4.49
20.60
51.15
5.45
18.34
表2 催化剂的性质
T able 2 P roperti es o f t he H uabe i FCC equ ili bri um catalyst P ara m eter
V al ue Po re vo l u m e v /c m 3#g -10.24Su rface a rea A /m 2#g -1
96A verage partic l e s i ze d /L m 62Par tic l e si ze distributi o n w /%0L m ~20L m 0.20L m ~40L m 16.60L m ~80L m 71.20L m ~105L m 87.30L m ~149L m 96.4M icro acti v ity i ndex 66C arbon con t ent/w /%0.07A ppa rent bu l k density /g #c m -10.88M e t a l content w /10-6 Fe 5760 N a 2300 N i 15770 V 440 Sb
3900
2 催化裂化汽油改质降烯烃六集总动力学模型的建立
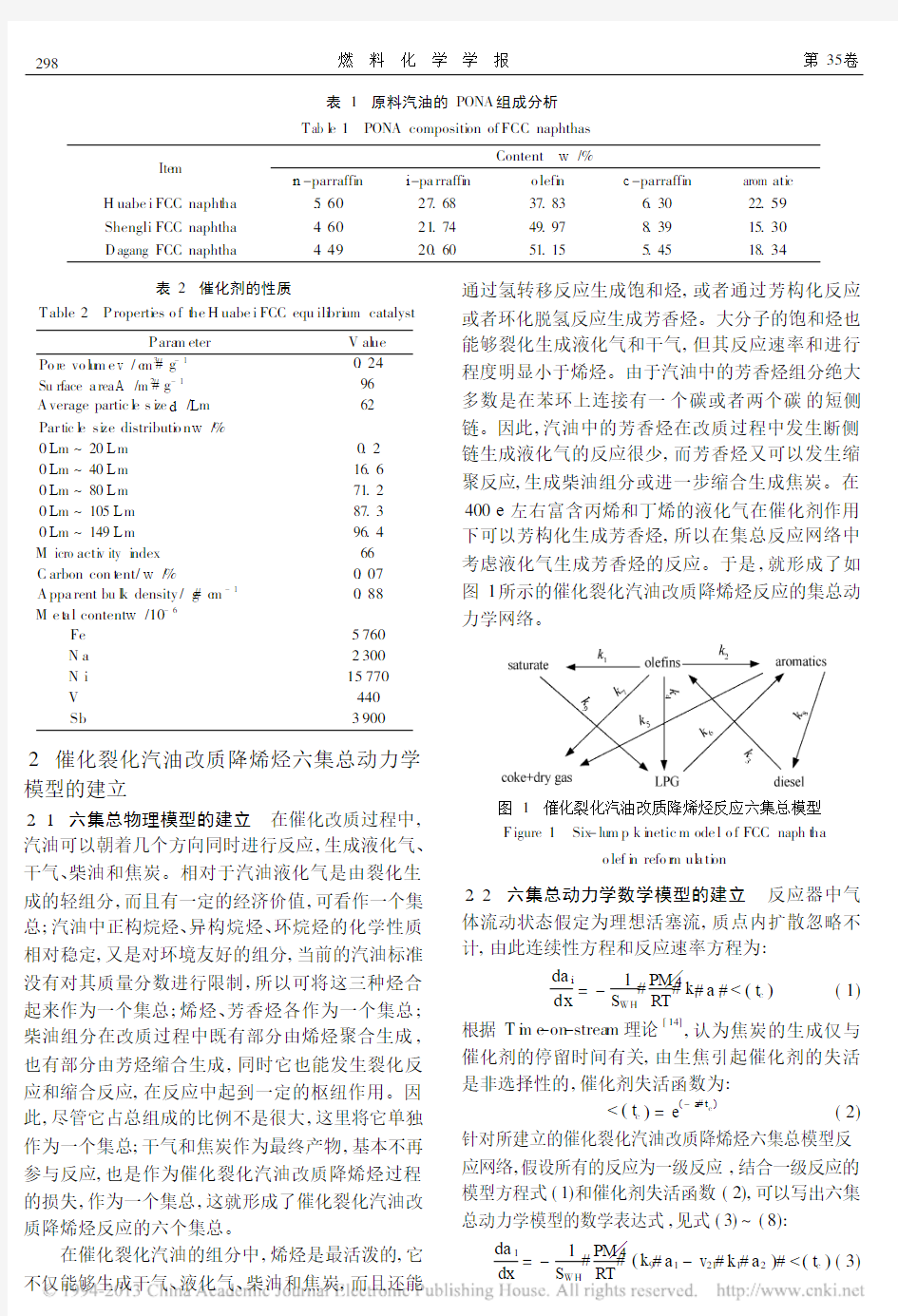
2.1 六集总物理模型的建立 在催化改质过程中,汽油可以朝着几个方向同时进行反应,生成液化气、干气、柴油和焦炭。相对于汽油液化气是由裂化生成的轻组分,而且有一定的经济价值,可看作一个集总;汽油中正构烷烃、异构烷烃、环烷烃的化学性质相对稳定,又是对环境友好的组分,当前的汽油标准没有对其质量分数进行限制,所以可将这三种烃合起来作为一个集总;烯烃、芳香烃各作为一个集总;柴油组分在改质过程中既有部分由烯烃聚合生成,也有部分由芳烃缩合生成,同时它也能发生裂化反应和缩合反应,在反应中起到一定的枢纽作用。因此,尽管它占总组成的比例不是很大,这里将它单独作为一个集总;干气和焦炭作为最终产物,基本不再参与反应,也是作为催化裂化汽油改质降烯烃过程的损失,作为一个集总,这就形成了催化裂化汽油改质降烯烃反应的六个集总。
在催化裂化汽油的组分中,烯烃是最活泼的,它
不仅能够生成干气、液化气、柴油和焦炭,而且还能
通过氢转移反应生成饱和烃,或者通过芳构化反应
或者环化脱氢反应生成芳香烃。大分子的饱和烃也能够裂化生成液化气和干气,但其反应速率和进行程度明显小于烯烃。由于汽油中的芳香烃组分绝大多数是在苯环上连接有一个碳或者两个碳的短侧链。因此,汽油中的芳香烃在改质过程中发生断侧链生成液化气的反应很少,而芳香烃又可以发生缩聚反应,生成柴油组分或进一步缩合生成焦炭。在400e 左右富含丙烯和丁烯的液化气在催化剂作用下可以芳构化生成芳香烃,所以在集总反应网络中考虑液化气生成芳香烃的反应。于是,就形成了如图1所示的催化裂化汽油改质降烯烃反应的集总动力学网络。
图1 催化裂化汽油改质降烯烃反应六集总模型F igure 1 Six -lu m p k i netic m ode l o f FCC naph t ha
o lef i n refo r m ul a ti on
2.2 六集总动力学数学模型的建立 反应器中气体流动状态假定为理想活塞流,质点内扩散忽略不
计,由此连续性方程和反应速率方程为:
da i dx =-1S WH #P ?M RT
#k i #a i #<(t c )
(1)
根据T i m e -on -strea m 理论
[14]
,认为焦炭的生成仅与
催化剂的停留时间有关,由生焦引起催化剂的失活
是非选择性的,催化剂失活函数为:
<(t c )=e
(-a #t c )
(2)
针对所建立的催化裂化汽油改质降烯烃六集总模型反应网络,假设所有的反应为一级反应,结合一级反应的模型方程式(1)和催化剂失活函数(2),可以写出六集总动力学模型的数学表达式,见式(3)~(8):
da 1dx =-1S WH #P ?
M RT
#(k 9#a 1-v 21#k 1#a 2)#<(t c )(3)
298
燃 料 化 学 学 报第35卷
da 2dx =-1S WH #P ?
M RT
#
(k 1+k 2+k 4+k 7)#a 2-v 52#k 3#
a 5#<(t c )(4)
da 3dx =-1S WH #P ?M RT
#k 5#a 3-v 23#k 2#a 2-v 43#k 6
#a 4#<(t c )
(5)
da 4dx =1S WH #P ?M RT
#v 14#k 9#a 1+v 24#k 4#a 2-k 6
#a 4#<(t c )(6)da 5dx =1S WH #P ?
M RT #v 35#k 5#a 3-k 3#a 5#<(t c ) (7)
a 6=
1-a 1#M 1-a 2#M 2-a
3#M 3-a 4#M 4-a 5#M 5/M 6(8) 根据催化裂化汽油改质六集总动力学模型的数学表达式,利用最小二乘法原理,采用改进的M ar -quardt 算法,结合动力学原始实验数据,分别求取了370e 、400e 、430e 和460e 时的反应速率常数,计算结果见表3。并根据反应速率常数和A rrhenius 关系式求取了指前因子和活化能,结果见表4。 由表3可知,网络模型中柴油裂化生成烯烃的反应速率常数最大,说明其反应最快,正好与分子越大越易裂化的规律吻合。比较生成焦炭的两个反应,由于汽油中没有多环芳烃,烯烃是积炭的主要来源。 由表4可以看到,除液化气生成芳烃反应的活化能为负值,其他反应的活化能都大于20kJ/m o l 。催化裂化汽油改质降烯烃反应的液化气中烯烃的质量分数很高,达到60%,在裂化催化剂作用下,液化气可以生成短侧链的芳烃,与此同时,长侧链的芳烃也存在断侧链生成液化气的反应,反应的总体方向是由液化气到芳烃,但裂化反应的活化能要大于液化气芳构化的活化能,所以总体的活化能为负。其余反应的活化能都在20kJ/m o l~130kJ/m o l 。烃类催化裂化反应的活化能为42kJ /m o l~125kJ/m o ,l 热裂化反应的活化能为210kJ/m o l~293kJ/m o ,l 而氢转移反应的活化能比催化裂化的活化能要小,催化裂化汽油改质降烯烃反应过程中,发生的反应基
本都属于氢转移反应、裂化反应,没有热裂化反应发生,因此,在实验中也只能发现极少量的干气生成。
表3 六集总模型反应速率常数估算T ab l e 3 K i netic con stan ts o f the si x-l u m p m ode l R eacti on /(g /c m 3)-1
#h -1T e m perature
t /e 370400
430
460
k 112.8288
19.811222.037424.3010k 22.216512.989924.883645.1978k 349.1516138.3395202.3757286.9787k 40.34471.09001.88793.1261k 516.004529.302736.599044.8879k 672.648461.709847.939142.0190k 70.26630.87761.36052.0347k 80.12090.39010.60020.8910k 9
6.4181
8.57489.538410.5182
表4 六集总动力学模型的指前因子和活化能T able 4 F requency facto rs and apparent ac tiva tion
energ i e s o f t he six -lu m p m o de l
R eacti o n F requency fac t o rs/(g /c m 3)-1#h -1
A pparent ac tiva ti on
energ i e s E /kJ #m o l -1
k 1
2.10@10326.
7934k 27.24@1010127.8943k 36.97@10774.8494k 41.81@10794.2525k 56.29@10443.7474k 60.72-24.7674k 73.27@10686.2578k 81.12@10684.7271k 9
3.40@102
20.
9513
3 模型计算值与实验值的对比
为了检验所建集总动力学模型的计算准确性,用求取的反应速率常数计算了370e 、400e 、430e 和460e 时,不同反应时间和剂油比下,各集总的产率,并与实验值进行对比,前五个集总相对误差较小,第六个集总干气+焦炭在产物中仅占1%~3%,其相对误差比较大。将四个反应温度点下的平均误差列入表5,由表5可知,相对误差较小。由上述分析可知,所建立的催化裂化汽油改质降烯烃六集总动力学模型的准确性较好。
表5 计算的各集总质量分率与实验值的平均相对误差T ab l e 5 Com par ison o f m ode l pred i c ted y ie l ds w ith expe ri m enta l results
T e m pera ture t /e
Sa t urates w /%
O l ef i n w /%
A rom ati c w /%
L PG w /%D iese l w /%
3702.612.31-4.493.128.444001.601.20-2.152.404.42430-1.870.86-0.121.522.61460
-2.30
-1.20
-2.20
-0.10
-2.55
4 集总动力学模型的预测性能
为了检验所建立的催化裂化汽油改质降烯烃六
299
第3期杨光福等:催化裂化汽油改质反应动力学模型研究
集总动力学模型的预测性能,利用表4的数据,根据A rrhen ius 公式求取不同温度下的反应速率常数,然后利用这些常数来预测改质后各集总的质量分数。4.1 改质后产品分布随反应温度的变化 在进水速率2g /s 、进油时间23s 、催化剂藏量60g 、进油量8g ,370e ~460e 产物的质量分数随温度的变化趋势见图2。由图2可见,随反应温度的升高,液化气、干气+焦炭质量分数逐渐增加,汽油、柴油的质量分数逐渐降低。烯烃的转化率、饱和烃以及芳香烃的增加率随温度变化见图3。由图3可知,随改质温度的升高,烯烃的转化率不断增加,芳香烃的增加率有所提高,而饱和烃的增加率有所降低。这与实验规律
一致。
图2 反应温度对产物组成分布的影响
F igure 2 E ffect o f reacti on te m perature on pro duct y ie l
d
图3 反应温度对烯烃转化率、饱和烃和
芳香烃增加率的影响
F i gure 3 E ffec t o f reaction te m perature o n the
naphtha com po sition
4.2 改质后产品分布随空速的变化 固定剂油比为7和进水速率为2g /s ,预测430e 时,改质后各产品产率和汽油的烃组成与反应空速的关系见图4和图5。随空速的增大,汽油的产率不断增加,柴油的产率缓慢降低,干气+焦炭先是迅速降低,而后趋
于某一个值,液化气的先稍有增加,而后降低;汽油
中饱和烃的质量分数先增加,而后慢慢降低,芳香烃质量分数先增加后降低,在20h
-1
~30h -1
芳香烃的
质量分数达到最大,而烯烃的质量分数一直上升。其结果与实验规律一致。
图4 空速对产物组成分布的影响F i gure 4 E ffec t o fW H S V on t he product y ie l d
图5 空速对烯烃转化率、饱和烃和芳香烃增加率的影响F igure 5 E ffect o f W HSV on the naphtha com po siti on
4.3 模型对不同原料的适应性 在W H SV 为40h -1
、剂油比为6、反应温度为400e 下,对大港石
化和胜利石化的催化裂化汽油在小型固定流化床改质降烯烃实验数值与模型计算数值见表6。
表6 大港和胜利催化裂化汽油实验值与模型计算值比较
T ab le 6 C om pa rison o f m ode l predicted y i e l ds o f D agang and Sheng li FCC napht ha w ith experi m enta l results
Ite m D ag ang FCC naph t ha pred i c t ed exper m i ent a l Sheng li FCC naphtha predicted experm i ental Satura tes
w /%43.6543.6946.9346.05O l ef i n w /%24.5225.3524.6125.43A rom atic w /%21.1220.8618.4018.90L PG w /%5.796.205.426.02D i ese l w /%3.390.903.201.01D ry ga s+co ke w /%
1.54
3.00
1.49
2.50
300
燃 料 化 学 学 报第35卷
由表6可以看出,饱和烃、烯烃、芳香烃和液化气集总的计算值与实验值偏差较小。因此,该模型对不同组成的原料同样适用。
5 结 语
以催化裂化反应机理为基础,针对催化裂化汽油低温改质的过程,把催化裂化汽油和产品按馏程
和化学组成集总,建立了催化裂化汽油改质的六集总反应动力学模型,通过对实验数据的回归,求取了反应动力学速率常数,反应活化能和反应的指前因子,该模型对原料和反应条件变化有较好的适应性,能较好预测不同条件下的产率分布和汽油组成。符号说明:
a i -气体中i 集总的浓度,m o l #g -1x -无因次相对高度S W H -重时空速,h -1?M -平均分子量
k i -i 集总的反应速率常数,[g /c m 3]-1#h -1A -催化剂失活常数5-失活函数
t c -催化剂的停留时间,s p -反应压力,Pa R -气体常数T -反应温度,K
参考文献:
[1] 许友好,张久顺,龙军.生产清洁汽油组分的催化裂化新工艺M IP[J].石油炼制与化工,2001,32(8):1-5.
(XU Y ou-hao,ZHANG J i u -s hun,LONG Jun .A m odified FCC proces s M IP for m ax i m iz i ng is o-paraffi n s i n crack ed n aphtha[J].Pet roleum
Process i ng and Petroche m icals ,2001,32(8):1-5.)
[2] 钟孝湘,张执刚,黎仕克.催化裂化多产液化气和柴油工艺技术的开发与应用[J].石油炼制与化工,2001,32(11):1-5.(ZHONG X iao -xiang ,ZHANG Zh -i gang,L I Sh -i ke .D evel opm en t and app lication of M GD t echnology fo r produci n g m ore LPG and LCO
[J ].Petro l eum Processi ng and Petroch e m i cals ,2001,32(11):1-5.)
[3] 胡勇仁,彭永强,张执刚.催化裂化多产液化气和柴油技术在广石化的工业应用[J].石油炼制与化工,2001,32(12):16-20.(HU Yong-ren ,
PENG Y ongq -iang ,ZHANG Z h-i gang .I ndu stri al app li cati on of M GD techno l ogy i n FCCU [J].Petro leum Processi n g and Petroche m icals ,2001,32(12):16-20.)
[4] 王刚,高金森,
徐春明,冯钰.催化裂化过程中热裂化反应与二次反应的研究[J].燃料化学学报,2005,33(4):440-441.(W ANG G ang ,
GAO Ji n-s en,XU C hun -m ing ,FENG Y u .S t ud i es on t her m al crack i ng and s econd ary reaction s i n FC C process[J].J ou rnal of
FuelC he m istry and T echno l ogy ,2005,33(4):440-441.)
[5] W ANG L,YANG B,W ANG G.New FC C process m i n i m i z es gas o li ne o l efi n,i ncrease propy l ene[J].O ilGas J ,2003,101(6):52-58.[6] 李成霞,高永地,李春义,山红红,杨朝合.重油催化裂解多产乙烯丙烯催化剂的研究[J].燃料化学学报,2006,34(1):47-50.(LI Chen g -x i a ,GAO Yong -d,i L I C hun-y ,i SHAN H ong -hong ,YANG Chao -he .S t udy on t he catal y sts for cat alyti c pyro l ys i s o f heavy o il t o
ethy l ene and p ropy lene[J].J ou rnal of Fu elC he m istry and Techno l ogy ,2005,34(1):47-50.)
[7] 张建芳,山红红,李正.两段提升管催化裂化新技术的开发:I 两段串联提升管反应器[J].石油学报(石油加工),2000,16(5):66-69.
(ZHANG J i an-fang ,SHAN H on g -hong ,L I Zhen g .N e w devel opm en t of FCC through t w o-s t aged ris er i n series :I The react or of t w o -st aged ris er[J].A ct a Petro l ei S i n ica(Petroleum Processi ng Secti on),2000,16(5):66-69.)[8] 李正,张建芳,山红红.两段提升管催化裂化新技术的开发:II 提高轻质产品收率,降低催化汽油烯烃含量[J].石油学报(石油加工),2001,17(5):27-30.
(LI zh eng ,ZHANG J i an-fang ,SHAN H ong -hong .D evelopm ent o f t w o -st aged ris er FCC techno l ogy :II Increase o f t he li gh t fraction y i el d and decreas e of the o l efi n con t en t i n gas o li ne[J].A ct a Petrolei S i n ica(Pet roleum Pro cessi ng Secti on),2001,17(5):27-30.)
[9] 白跃华,高金森,李盛昌,徐春明.催化裂化汽油辅助提升管降烯烃技术的工业应用[J ].石油炼制与化工,2004,35(10):17-21.
(BA I Y ue -hua ,GAO Ji n-sen,L I Sheng-chang ,XU Chun -m i ng .C o mm erci al appli cati on o f sub si d i ary riser for FCC naph t h a o l efi n reducti on [J ].Petro l eum Processi ng and Petroch e m i cals ,2004,35(10):17-21.)
[10] 高金森,徐春明,卢春喜,毛羽,石秦岭,王爱平,刘洪安.滨州石化催化裂化汽油辅助提升管改质降烯烃技术工业化[J].炼油技术
与工程,2005,35(6):8-10.(GAO Ji n-s en,XU Chun -m i ng ,LU C hun -x ,i M AO Y u ,SH I Q i n-li ng,W ANG A -i p i ng,L I U Hong -an .C o mm erci alization of aux ili ary ris er FCC for naph t ha o l efi n redu cti on techno l ogy i n B i nzhou petroche m ical com pany [J].Petro l eum Refi nery Eng i neeri ng ,2005,35(6):8-10.)
[11] 吴青,何鸣元.催化裂化汽油改质过程的八集总动力学模型研究[J].炼油工程与技术,2004,34(11):22-27.
(W U Q i ng,HE M i ng -yuan.S t udy on eigh t l um p i ng dyna m ic m odels for FCC gasoli ne upgrad i ng [J].Petroleum Refi nery Eng i neeri ng ,2004,34(11):22-27.)
[12] 邹圣武,侯栓弟,龙军,周健,孙铁栋,张占柱.基于汽油烯烃转化的催化裂化动力学模型[J].化工学报,2004,55(11):1793-1799.(ZOU Sheng-w u,HOU S huan -d,i LONG Jun,ZHOU Ji an ,SUN T ie -dong,ZHANG Zhan -zhu .K i n eti c m odelo f cat alyti c crack i ng based on
o l efi n reacti on m echan is m [J].Journal o f C he m i cal Indu stry and Eng i neeri ng (C h i na),2004,55(11):1793-1799.)
[13] 孟祥海,徐春明,高金森.大庆常压渣油催化裂解反应规律研究[J].化学反应工程与工艺,2003,19(4):358-365.
(M ENG X i ang-ha,i XU C hun -m i ng ,GAO J i n -sen .S t ud i es on the reacti ons o f Daq i ng at m os pheri c resi due cat a l yti c pyro l y sis[J].C he m i cal R eacti on Eng i neeri ng and T echno l ogy ,2003,19(4):358-365.)
[14] CORM A A,M I GUEL P J ,ORCH ILLE S A V.K i n eti cs of t h e cat alytic crack i ng o f paraffi nes at very short ti m e on strea m [J].J C ata,l 1994,
145(1):58-64.
301
第3期杨光福等:催化裂化汽油改质反应动力学模型研究
南京大学《物理化学》练习 第十章 化学动力学基础(一)
第十章化学动力学基础(一) 返回上一页 1. 298 K时N2O5(g)分解反应半衰期t1/2为5.7 h,此值与N2O5的起始浓度无关,试求: (1) 该反应的速率常数. (2) 作用完成90%时所须的时间. 2. 某人工放射性元素放出α粒子,半衰期为15 min ,试问该试样有80%分解,需时若干? 3. 把一定量的PH3(g)迅速引入温度为950 K的已抽空的容器中,待反应物达到该温度时开始计时(此时已有部分分解),测得实验数据如下: t/s 0 58 108 ∞ P/kPa 35.00 36.34 36.68 36.85 已知反应 4pH3(g) P4(g) + 6H2(g) 为一级反应,求该反应的速率常数k值(设在t=∞时反应基本完成) 4. 在某化学反应中随时检测物质A的含量,1小时后,发现A已作用了75%,试问2小时后A还剩余多少没有作用?若该反应对A 来说是: (1) 一级反应. (2) 二级反应(设A与另一反应物B起始浓度相同) (3) 零级反应(求A作用完所用时间) 5. 在298 K时, NaOH与CH3COOCH3皂化作用的速率常数k2与NaOH与CH3COOC2H5皂化作用的速率常数k2' 的关系为k2=2.8k2' .试问在相同的实验条件下,当有90% CH3COOCH3被分解时, CH3COOC2H5的分解百分数为若干?
6. 对反应2NO(g) +2H2(g)---> N2(g) +2H2O(l) 进行了研究,起始时NO与H2的物质的量相等.采用不同的起始压力相应的有不同的半衰期,实验数据为: p0 /kPa 47.20 45.40 38.40 33.46 26.93 t1/2/min 81 102 140 180 224 求该反应级数为若干? 7. 反应A+B P的动力学实验数据如下, [A]0/(mol·dm-3) 1.0 2.0 3.0 1.0 1.0 [B]0/(mol·dm-3) 1.0 1.0 1.0 2.0 3.0 r0/(mol·dm-3·s-1) 0.15 0.30 0.45 0.15 0.15 若该反应的速率方程为 ,求x和y的值. 8. 碳的放射性同位素在自然界树木中的分布基本保持为总碳量的 1.10×%.某考古队在一山洞中发现一些古代木头燃烧的灰烬,经分析的含 量为总碳量的9.87×%,已知的半衰期为5700年,试计算这灰距今约有多少年? 9. 某抗菌素在人体血液中呈现简单级数的反应,如果给病人在上午8点注射一针抗菌素,然后在不同时刻t测定抗菌素在血液中的浓度c(以mg/100 cm3表示),得到以下数据 t/h 4 8 12 16 c /(mg/100 cm3) 0.480 0.326 0.222 0.151 (1) 确定反应的级数. (2) 求反应的速率常数k和半衰期t1/2.
化学动力学
1.某反应进行时,反应物浓度与时间成线性关系,则此反应的衰期与反应物初始浓度(A) A.成正比 B.成反比 C.平方成反比 D.无关 解析:反应为零级反应 2.已知二级反应的半衰期t?=1/k2c0,则t?应为(B) A.2/k2c0 B.1/3k2c0 C.3/k2c0 D.4/k2 c0 解析:t?=1/k2c0×1/4÷(1-1/4)=1/3k2c0 3.某反应只有一种反应物,其转化率达到75%的时间是转化率达到50%的时间 的两倍,反应转化率达到64%的时间转化率达到x%的时间的两倍,则x为 ( C ) A.32 B.36 C.40 D.60 解析:一级反应的特点:t1/2 : t3/4 : t7/8= 1 : 2 : 3 t = 1/k1ln[1/(1?α)] t(64%)/t(x%)=2=ln[1/(1?0.64)]/ln[1/(1?x %)] [1/(1?x %)]2= 1/0.36 ? 1?x % =0.6 x % = 0.4 4.某反应,其半衰期与起始浓度成反比,则反应完成87.5%所需时 间t1与完成50%的时间t2之间的关系是 ( C ) A.t1=t2 B.t1=4t2 C.t1=7t2 D.t1=5t2 解析:二级反应的特点:t1/2 : t3/4 : t7/8= 1 : 3 : 7 5.有关过渡态反应速率理论的叙述中,不正确的是 ( D ) A.反应分子组实际经历途径中每个状态的能量都很低.
B.势能垒是活化络合物分子在马鞍点的能量与反应分子的平均能量之差. C.活化络合物在马鞍点的能量最高. D.反应分子组越过马鞍点后可能返回始态 解析:过渡态理论假设:反应体系沿生成物方向越过势能面鞍点后,不会再返回 6.化学动力学中,反应级数是个宏观的概念,实验的结果,其值(C) A.只能是正整数 B.只能是0、1、2、3…… C.可正、可负、可为零、可以是整数、也可以是分数 D.无法确定 解析:反应级数可正、可负、可为零、可以是整数、也可以是分数 7.在一定的T、P下,HI(g)的摩尔生产焓△fHm<0,而HI(g)d的分解反应HI(g)→1/2H2(g)+1/2I2(g),过程的△rHm>0。则此反应过程活化能Ea(D) A. <△rHm B.= △rHm C.<-△fHm D. >△rHm 解析:设该反应的活化能为Ea,1逆反应的活化能为Ea,2 Ea,1-Ea,2=△rHm=-△fHm(HI,g) >0 Ea,1= Ea,2+△rHm 故Ea,1>△rHm 8.下列双分子反应中 (1) Br+Br→Br2 (2)CH3CH+ CH3COOH→CH3CH2COOCH3+H2O (3)CH4+Br2→CH3Br+HBr 碰撞理论中方位因子P的相对大小是(B) A.P1>P2>P3 B. P1>P3>P2 C. P1<P2<P3 D. P1<P3<P2
第二章 化学反应动力学基础(答案)
第二章 反应动力学基础 一、填空题 1. 生成主产物的反应称为 主反应 ,其它的均为 副反应 。 2. 化学反应的总级数为n ,如用浓度表示的速率常数为C K ,用逸度表示的速率常数f K ,则C K =n f K 。 3. 化学反应的总级数为n ,如用浓度表示的速率常数为C K ,用气体摩尔分率表示的速率常数y K , 则C K = n p RT ???? ?? y K 。 4. 化学反应速率式为βαB A C A C C K r =-,用浓度表示的速率常数为C K ,假定符合理想气体状态方程,如用压力表示的速率常数P K ,则C K =____)()(βα+RT ___P K 。 5. 反应A + B → C ,已知115.0-=s k ,则反应级数n= 1 。 6. 反应3A → P ,已知s l mol k ?=/15.0,则反应级数n=___0____。 7. 活化能的大小直接反映了 反应速率 对温度的敏感程度。 8. 对于一非恒容均相化学反应B A B A αα?,反应组分A 的化学反应速率=-A r Vdt dn r A A -=- 。( V d t dn r A A -=-、 Vdt dn r B A -=-、dt dC r A A -=-、dt dC r B A -=-) 9. 气相反应A + B → 3P + S 进料时无惰性气体,A 与B 以1∶1摩尔比进料,则膨胀因子A δ=____2___。 10. 气相反应3A + B → P + S 进料时无惰性气体,A 与B 以2∶1摩尔比进料,则膨胀因子A δ=___-2/3____ 11. 在一间歇恒容反应器中进行如下平行反应12k k A P A S ??→??→,P 为目的产物,已知0A c 的单位为[]/mol L ,1k 的单位为1s -????,2k 的单位为[]/L mol s ?,活化能12E E >。则R A = )(221A A C k C k +- 。目的产物P 的瞬时选择性P S = 1212A A A k c k c k c + ,为了提高P S ,A c 要控制得较 低 ,T 要控制得较 高 。
化学反应动力学习题
化学动力学基础(习题课) 1. 某金属的同位素进行β放射,经14d(1d=1天后,同位素的活性降低6.85%。求此同位素的蜕变常数和半衰期;要分解 90.0%,需经多长时间? 解:设反应开始时物质的质量为100%,14d后剩余未分解者为100%-6.85%,则 代入半衰期公式得 一、是非题 下列各题中的叙述是否正确?正确的选“√”,错误的选“×”。 √× 1.反应速率系数k A与反应物A的浓度有关。 √× 2.反应级数不可能为负值。 √× 3.对二级反应来说,反应物转化同一百分数时,若反应物的初始浓度愈低,则所需时间愈短。 √× 4.对同一反应,活化能一定,则反应的起始温度愈低,反应的速率系数对温度的变化愈 敏感。 √× 5. Arrhenius活化能的定义是。
√× 6.若反应A?Y,对A为零级,则A的半衰期。 二、选择题 选择正确答案的编号: 某反应,A → Y,其速率系数k A=6.93min-1,则该反应物A的浓度从1.0mol×dm-3变到0.5 mol×dm-3所需时间是: (A)0.2min;(B)0.1min;(C)1min;(D)以上答案均不正确。 某反应,A → Y,如果反应物A的浓度减少一半,它的半衰期也缩短一半,则该反应的级数 为: (A)零级;(B)一级;(C)二级;(D)以上答案均不正确。 三、填空题 在以下各小题的“ 1.某化学反应经证明是一级反应,它的速率系数在298K时是k=( 2.303/3600)s-1,c0=1mol×dm-3。 (A)该反应初始速率u0为 (B)该反应的半衰期t1/2 (C)设反应进行了1h,在这一时刻反应速率u1为 2.只有一种反应物的二级反应的半衰期与反应的初始浓度的关系为 3.反应A → B+D中,反应物A初始浓度c A,0=1mol×dm-3,初速度u A,0=0.01mol×dm-3×s-1,假定该反 应为二级,则其速度常数k A为t1/2为。 4.某反应的速率系数k=4.62′10-2min-1,则反应的半衰期为 5.反应活化能E a=250kJ×mol-1,反应温度从300K升高到310K时,速率系数k增加
化学动力学基础(一、二)习题
化学动力学基础(一、二)习题
化学动力学基础(一、二)习题 一、选择题: 1、某反应的速率常数k=0.0462分-1,又知初始浓度为0.1mol.dm-3,则该反应的半衰期为: (A) 1/(6.93×10-2×0.12) (B) 15分(C) 30分(D) 1/(4.62×102×0.1)分 答案:(B) 2、某一级反应, 当反应物的浓度降为起始浓度的1%时,需要t1秒, 若将反应物的浓度提高一倍, 加快反应速率, 当反应物浓度降低为起始浓度的1%时, 需时为t2, 则: (A ) t1﹥t2(B) t1=t2 (C) t1﹤t2(D) 不能确定二者关系 答案:(B) 3、某反应物反应掉7/8所需的时间恰好是它反应掉1/2所需时间的3倍, 则该反应的级数是: (A) 零级(B) 一级反应(C) 三级反应(D) 二级反应 答案:(B )
4、反应A→B(Ⅰ);A→D(Ⅱ), 已知反应Ⅰ的活化能E1大于反应Ⅱ的活化能E2, 以下措施中哪一种不能改变获得B和D的比例: (A)提高反应温度(B) 降低反应温度 (C) 延长反应时间(D) 加入适当的催化剂 答案:C 5、由基元步骤构成的复杂反应:2A→2B+C A+C→2D,以C物质的浓度变化表示反应速率的速率方程(已知:-dC A/dt=K A1C A2-K A2C B2C c+K A3C A C C ) 则 (A)dC c/dt=K A1C A2-K A2C B2C c+K A3C A C C (B)dC c/dt=1/2K A1C A2-1/2K A2C B2C c+1/2K A3C A C C (C)dC c/dt=2K A1C A2-2K A2C B2C c+2K A3C A C C (D)dC D/dt=-K A3C A C C 答案:(B) 6、反应Ⅰ, 反应物初始浓度C0’, 半衰期t1/2’, 速率常数K1, 反应Ⅱ, 反应物初始浓度C0”, 半衰期t1/2”, 速率常数K2,
第十一章 化学动力学基础(一)习题
化学动力学基础(一) 一、简答题 1.反应Pb(C 2H 5)4=Pb+4C 2H 5是否可能为基元反应?为什么? 2.某反应物消耗掉50%和75%时所需要的时间分别为t 1/2和 t 1/4,若反应对该反应物分别是一级、二级和三级,则t 1/2: t 1/4的比值分别是多少? 3.请总结零级反应、一级反应和二级反应各有哪些特征?平行反应、对峙反应和连续反应又有哪些特征? 4.从反应机理推导速率方程时通常有哪几种近似方法?各有什么适用条件? 5.某一反应进行完全所需时间时有限的,且等于k c 0(C 0为反应物起始浓度),则该反应是几级反应? 6. 质量作用定律对于总反应式为什么不一定正确? 7. 根据质量作用定律写出下列基元反应速率表达式: (1)A+B→2P (2)2A+B→2P (3)A+2B→P+2s (4)2Cl 2+M→Cl 2+M 8.典型复杂反应的动力学特征如何? 9.什么是链反应?有哪几种? 10.如何解释支链反应引起爆炸的高界限和低界限? 11.催化剂加速化学反应的原因是什么? 二、证明题 1、某环氧烷受热分解,反应机理如下: 稳定产物?→??+?+??→??++??→??? +??→?432134 33k k k k CH R CH R CH RH CO CH R H R RH
证明反应速率方程为()()RH kc dt CH dc =4 2、证明对理想气体系统的n 级简单反应,其速率常数()n c p RT k k -=1。 三、计算题 1、反应2222SO Cl SO +Cl →为一级气相反应,320℃时512.210s k --=?。问在320℃ 加热90min ,22SO Cl 的分解百分数为若干?[答案:11.20%] 2、某二级反应A+B C →初速度为133105---???s dm mol ,两反应物的初浓度皆为 32.0-?dm mol ,求k 。[答案:11325.1---??=s mol dm k ] 3、781K 时22H +I 2HI →,反应的速率常数3-1-1HI 80.2dm mol s k =??,求2H k 。[答 案:113min 1.41---??=mol dm k ] 4、双光气分解反应32ClCOOCCl (g)2COCl (g)→可以进行完全,将反应物置于密 闭恒容容器中,保持280℃,于不同时间测得总压p 如下: [答案: 1.1581a =≈;-14-12.112h 5.8710s k -==?] 5、有正逆反应均为一级反应的对峙反应: D-R 1R 2R 32L-R 1R 2R 3CBr 已知半衰期均为10min ,今从D-R 1R 2R 3CBr 的物质的量为1.0mol 开始,试计算10min 之后,可得L-R 1R 2R 3CBr 若干?[答案:0.375mol] 6、在某温度时,一级反应A →B ,反应速率为0.10mol ·dm -3·s -1时A 的转化率 为75%,已知A 的初始浓度为0.50mol ·dm -3,求(1)起始反应初速率;(2)速率常数。[答案:r 0=0.40s -1 ; k = 0.80 dm 3·mol -1·s -1 ] 7、在某温度时,对于反应A+B →P ,当反应物初始浓度为0.446和0.166mol ·dm -3 时,测 得反应的半衰期分别为4.80和12.90min ,求反应级数。[答案:2] 8、某二级反应,已知两种反应物初始浓度均为0.1mol ·dm -3,反应15min 后变
催化反应动力学报告
催化裂化集总反应动力学模型研究进展 摘要:分析和介绍了国内外催化裂化装置建模和稳态模拟方面的研究和进展。对催化裂化反应集总方法及相应的反应网络进行归纳,并讨论其优缺点;推导了动力学模型方程并着重探讨方程求解算法以及模型中动力学参数、催化剂失活因子和装置因素的估计方法。对催化裂化集总反应动力学模型的研究进展进行了综述,从中可见复杂反应体系集总反应动力学模型的发展历程。 1.引言 催化裂化是炼油工业最重要的二次加工工艺之一,其目的是将重质油转化成更有价值的轻端产品。由于油品组成复杂,很难用常规的动力学方法研究该高度偶联的反应体系,集总(1umping)理论的出现为催化裂化反应动力学的研究开辟了新的途径。近些年来,催化裂化在新技术、新工艺等方面取得了很大的进展,同时在集总动力学模型的开发和应用研究上也取得了引人注目的成绩。如蜡油的三集总、四集总、五集总、十集总、十一集总和渣油的六集总、十一集总、十三集总等动力学模型的开发,其中有些模型已经成功地应用于工业装置并取得明显的经济效益。本论文将综合评述催化裂化集总动力学模型的研究现状,为模型的进一步开发和研究提供指导。 1963年由Aris 等和We i 等创立的反应速率常数矩阵法,解决了复杂反应体系内反应强耦联这一难题,使对复杂的耦联反应体系进行解耦成为了可能。但由于复杂反应体系内原料与产物组分繁多,且每一组分又能进行不止一种的反应,故而建立详细描述每一组分反应行为的动力学模型是不可能的,必须进行一定的简化处理。所谓集总即是将反应系统中众多的单一化合物,按其动力学特性相似的原则,归并为若干个虚拟的单一组分(集总),然后去开发这些虚拟的集总组分间的反应网络,建立简化了的集总反应网络的动力学模型。集总反应动力学模型是在深刻认识反应机理的基础上将复杂的反应网络简化处理,从而开辟了一条动力学研究的新途径。集总理论最早应用于催化裂化过程,其后又应用于催化重整、延迟焦化、渣油加氢等其它过程。本文将通过回顾、总结催化裂化集总反应动力学模型的发展来见证集总理论及集总反应动力学模型的发展历程。 2 催化裂化集总反应动力学模型集总划分原则的发展 从集总划分原则的角度,可将催化裂化集总反应动力学模型的发展分为三个阶段。 2.1 第一阶段 20世纪60年代后期,Week man 等最早将集总理论成功运用于催化裂化过程,建立了催化裂化三集总反应动力学模型。该模型根据馏程的不同将反应物和产物归并为未转化的原料油、汽油和气体+ 焦炭三个集总。结果表明该模型能够较准确地预测给定原料油的转化率、生成汽油的选择性和最佳操作条件等。由于该模型参数少,计算简便,预测结果准确,在指导工业装置设计操作优化等方面显示出了强大的作用。催化裂化三集总反应动力学模型开创了集总理论在催化裂化反应动力学领域应用的先河,它肯定了将集总方法运用于复杂
化学反应动力学基础-学生整理版
5202 反应 2O 3→ 3O 2的速率方程为 - d[O 3]/d t = k [O 3]2[O 2]-1 , 或者 d[O 2]/d t = k '[O 3]2[O 2]-1,则速率常数 k 和 k ' 的关系是: ( ) (A) 2k = 3k ' (B) k = k ' (C) 3k = 2k ' (D) -k /2 = k '/3 5203 气相反应 A + 2B ─→ 2C ,A 和 B 的初始压力分别为 p A 和 p B ,反应开始时 并无 C ,若 p 为体系的总压力,当时间为 t 时,A 的分压为: ( ) (A) p A - p B (B) p - 2p A (C) p - p B (D) 2(p - p A ) - p B 5204 对于反应 2NO 2= 2NO + O 2,当选用不同的反应物和产物来表示反应速率时,其相互关系为:( ) (A) -2d[NO 2]/d t = 2d[NO]/d t = d[O 2]/d t (B) - d[NO 2]/2d t = d[NO]/2d t = d[O 2]/d t = d ξ /d t (C) - d[NO 2]/d t = d[NO]/d t = d[O 2]/d t (D) - d[NO 2]/2d t = d[NO]/2d t = d[O 2]/d t = 1/V d ξ /d t 5207 气相基元反应 2A k 1 B 在一恒容的容器中进行,p 0为 A 的初始压力, p t 为时间 t 时反应 体系总压,此反应速率方程 d p t / d t = 。 - k (2p t - p 0)2 5208 有一反应 mA → nB 是一简单反应,其动力学方程为 -d c A / d t = kc A m , c A 的单位为 mol ·dm -3, 时间单位为 s ,则: (1) k 的单位为 ___________ mol 1- m ·dm 3( m -1)·s -1 (2) 以d c B /d t 表达的反应速率方程和题中给的速率方程关系为 B A A A 1d 1d 'd d m m c c k c k c n t m t m =-== 5209 反应 2N 2O 5─→ 4NO 2+ O 2 在328 K 时,O 2(g)的生成速率为0.75×10-4 mol ·dm -3·s -1。 如 其间任一中间物浓度极低, 难以测出, 则该反应的总包反应速率为 _______________mol ·dm -3·s -1, N 2O 5 之消耗速率为__________ mol ·dm -3·s -1,NO 2之生成速率为_______________mol ·dm -3·s -1 。0.75×10-4, 1.50×10-4, 3.00×10-4 5210 O 3分解反应为 2O 3─→3O 2 ,在一定温度下, 2.0 dm 3容器中反应。实验测出O 3每秒消耗1.50× 10-2 mol, 则反应速率为_______________mol ·dm -3·s -1氧的生成速率为_______________mol ·dm -3·s -1, d ξ /d t 为_______________ 0.75×10-2, 2.25×10-2, 1.50×10-2.。 5211 2A +B =2C 已知反应某一瞬间, r A =12.72 mol ·dm -3·h -1, 则 r B = , r C =_____________r B =6.36 mol ·dm -3·h -1, r C =12.72mol ·dm -3·h -1 5212分别用反应物和生成物表示反应A +3B =2C 的反应速率, 并写出它们间关系为: 。 r A =13r B =12 r C 5222 有关基元反应的描述在下列诸说法中哪一个是不正确的: ( ) (A) 基元反应的级数一定是整数 (B) 基元反应是“态-态”反应的统计平均结果 (C) 基元反应进行时无中间产物,一步完成 (D) 基元反应不一定符合质量作用定律 5223 400 K 时,某气相反应的速率常数k p = 10-3(kPa)-1·s -1,如速率常数用 k C 表示,则 k C 应为: (A) 3.326 (mol ·dm -3)-1·s -1 k C = k p (RT ) (B) 3.0×10-4 (mol ·dm -3)-1·s -1 (C) 3326 (mol ·dm -3)-1·s -1 (D) 3.0×10-7 (mol ·dm -3)-1·s -1 5224 如果反应 2A + B = 2D 的速率可表示为:
十七集总催化重整反应动力学模型研究_模型的建立
第15卷 第1期 石油化工高等学校学报 Vol.15 No.1 2002年3月 JOURNAL OF PETROCHEMICAL UN IV ERSITIES Mar.2002 文章编号:1006-396X(2002)01-0015-03 十七集总催化重整反应动力学模型研究(Ⅰ) ———模型的建立 丁福臣1, 周志军1, 杨桂忠1, 靳广洲1, 郑灌生2, 盖增旗2 (1.北京石油化工学院化学工程系,北京102600; 2.中国石化北京燕山石油化工股份有限公司炼油厂,北京102500) 摘 要: 按照集总理论的指导原则,从催化重整反应机理出发,提出了包含17个集总组分的催化重整反应网络,将重整物料按分子大小集总为C6、C7、C8和C+9,每一个碳数的化合物又划分为正构烷烃、异构烷烃、环烷烃和芳香烃4个集总,裂化产物C-5作为一个集总。集总组分与组分之间主要发生烷烃脱氢环化、环烷烃脱氢芳构化、烷烃异构化和加氢裂化反应,简化了一些发生几率小或对过程影响小的反应,如芳香烃和环烷烃的开环裂化反应、C-5组分的二次裂化反应等。以此反应网络建立的动力学模型比较简单实用,能更好地预测产品的芳烃产率分布和汽油辛烷值。 关键词: 催化重整; 动力学模型; 集总 中图分类号: O643.38 文献标识码:A 催化重整作为生产芳烃和高辛烷值汽油的主要途径,同时为炼厂提供了大量的副产氢气,在炼油化工企业占有举足轻重的地位。动力学模型的研究与开发对于重整装置的反应器设计,产物组成和产品质量的预测,以及优化生产操作,能带来巨大的经济效益,因此是工艺技术研究的重要方面。 在催化重整过程中,构成重整物料的组分繁多,单体烃化合物达二三百种,有众多连串和并行反应同时交叉进行,构成复杂的反应网络体系,而且反应体系间发生强偶联,给动力学研究造成很大困难。1959年,Smith首先采用四组分简化处理催化重整动力学[1],Wei等人进一步提出和完善了集总理论(Lumping)[2],使复杂反应体系的动力学研究有了突破性的进展。所谓集总理论,即是将体系中那些动力学性质相似的组分用一个虚拟组分来代替,然后构造这些虚拟集总组分的反应网络,研究它们的动力学。 近年来,国内外学者对催化重整反应机理进行了大量的研究,简化了动力学表征的方法,并在此基础上开发了许多重要的催化重整反应模型,有的并已成功地应用于工业生产过程中。具有代表性的模 收稿日期:2001-03-19 作者简介:丁福臣(1964-),男,山东郓城县,副教授,硕士。型有:Smith的四集总模型[1]、Ramage等的十三集总模型[3]、翁惠新等的十六集总模型[4]、Froment的二十八集总模型[5]等。有些模型已开发出应用软件,成功地用于工业过程的离线优化或在线控制,为企业创造了巨大的经济效益。 本文根据集总理论原则,在研究重整反应机理的基础上,提出十七集总组分的催化重整反应网络及动力学模型,以更好地预测产品的芳烃产率分布和汽油辛烷值。 1 组分集总和反应网络模型 根据催化重整反应机理和反应的动力学及热力学特点,为满足实际应用的需要,本着尽量简化和实用的原则,提出十七集总反应动力学模型,主要基于以下考虑: (1) 重整物料中C5及C5以下组分含量少,一般为裂化反应产物,对重整反应影响小,可归并为一个集总组分C-5。 (2) 根据集总理论的原则,反应特性相差大的组分应分别集总[2]。Ramage[3]在十三集总模型中,认为C6~C8同类烃的反应特性相差较大,应分别集总,而C8及C8以上的同类烃反应规律非常相近,可作为一个集总组分处理。翁惠新等[4]在十六集总模型中也引用了这样的做法。但本文考虑到模型的
化学反应动力学基础(一)-学生
5202 反应 2O 3→ 3O 2的速率方程为 - d[O 3]/d t = k [O 3]2[O 2]-1 , 或者 d[O 2]/d t = k '[O 3]2[O 2]-1,则速率常数 k 和 k ' 的关系是: ( ) (A) 2k = 3k ' (B) k = k ' (C) 3k = 2k ' (D) -k /2 = k '/3 5203 气相反应 A + 2B ─→ 2C ,A 和 B 的初始压力分别为 p A 和 p B ,反应开始时 并无 C ,若 p 为体系的总压力,当时间为 t 时,A 的分压为: ( ) (A) p A - p B (B) p - 2p A (C) p - p B (D) 2(p - p A ) - p B 5204 对于反应 2NO 2= 2NO + O 2,当选用不同的反应物和产物来表示反应速率时,其相互关系为:( ) (A) -2d[NO 2]/d t = 2d[NO]/d t = d[O 2]/d t (B) - d[NO 2]/2d t = d[NO]/2d t = d[O 2]/d t = d ξ /d t (C) - d[NO 2]/d t = d[NO]/d t = d[O 2]/d t (D) - d[NO 2]/2d t = d[NO]/2d t = d[O 2]/d t = 1/V d ξ /d t 5207 气相基元反应 2A k 1 B 在一恒容的容器中进行,p 0为 A 的初始压力, p t 为时间 t 时反应 体系总压,此反应速率方程 d p t / d t = 。 - k (2p t - p 0)2 5208 有一反应 mA → nB 是一简单反应,其动力学方程为 -d c A / d t = kc A m , c A 的单位为 mol ·dm -3, 时间单位为 s ,则: (1) k 的单位为 ___________ mol 1- m ·dm 3( m -1)·s -1 (2) 以d c B /d t 表达的反应速率方程和题中给的速率方程关系为 B A A A 1d 1d 'd d m m c c k c k c n t m t m =-== 5209 反应 2N 2O 5─→ 4NO 2+ O 2 在328 K 时,O 2(g)的生成速率为0.75×10-4 mol ·dm -3·s -1。 如其间任一中间物浓度极低, 难以测出, 则该反应的总包反应速率为 _______________mol ·dm -3·s -1, N 2O 5之消耗速率为__________ mol ·dm -3·s -1,NO 2之生成速率为_______________mol ·dm -3·s -1 。0.75×10-4, 1.50×10-4, 3.00×10-4 5210 O 3分解反应为 2O 3─→3O 2 ,在一定温度下, 2.0 dm 3容器中反应。实验测出O 3每秒消耗1.50×10-2 mol, 则反应速率为_______________mol ·dm -3·s -1氧的生成速率为_______________mol ·dm -3·s -1, d ξ /d t 为_______________ 0.75×10-2, 2.25×10-2, 1.50×10-2.。 5211 2A +B =2C 已知反应某一瞬间, r A =12.72 mol ·dm -3·h -1, 则 r B = , r C =_____________r B =6.36 mol ·dm -3·h -1, r C =12.72mol ·dm -3·h -1 5212分别用反应物和生成物表示反应A +3B =2C 的反应速率, 并写出它们间关系为: 。r A = 13r B =1 2 r C 5222 有关基元反应的描述在下列诸说法中哪一个是不正确的: ( ) (A) 基元反应的级数一定是整数 (B) 基元反应是“态-态”反应的统计平均结果 (C) 基元反应进行时无中间产物,一步完成 (D) 基元反应不一定符合质量作用定律 5223 400 K 时,某气相反应的速率常数k p = 10-3(kPa)-1·s -1,如速率常数用 k C 表示,则 k C 应为: (A) 3.326 (mol ·dm -3)-1·s -1 k C = k p (RT ) (B) 3.0×10-4 (mol ·dm -3)-1·s -1 (C) 3326 (mol ·dm -3)-1·s -1 (D) 3.0×10-7 (mol ·dm -3)-1·s -1 5224 如果反应 2A + B = 2D 的速率可表示为:
第二章动力学
第二章化学动力学 三复习题和习题解答 3.1 宏观反应动力学 3.1.1判断正误 1. 质量作用定律只适用于基元反应。() 2. 对于平行反应,其产物浓度之比等于速率常数之比。() 3. 一般来说,活化能较大的反应对温度更敏感。() 4. 确定动力学速率方程的关键是确定反应级数。() 5. 确定反应级数的常用方法有积分法和微分法。() 6. 利用尝试法确定反应级数只适用于简单级数的反应。() 7.阿伦尼乌斯方程仅适用于基元反应。() 8. 化学反应的摩尔恒容反应热与正向反应和逆向反应的活化能有一定关系。() 9. 基元反应的分子数是个微观的概念。() 10.化学反应的反应级数与反应分子数是一回事。() 11. 化学反应的反应级数只能是正整数。() 12. 在工业上,放热的对行反应存在一个最佳反应温度。() 13. 对于酶催化反应,通常作用条件较温和。() 14. 不同级数反应的速率常数,其量纲是不一样。() 15. 不能只利用速率常数的量纲来判断反应级数。() 16. 不同级数反应的半衰期与浓度的关系是不一样的。() 17. 若某反应的半衰期与浓度无关,则该反应为零级反应。() 18. 在一级、二级和三级反应速率方程中,浓度与时间的直线关系是不同的。() 19. 化学反应动力学主要研究反应的速率与机理问题。() 20. 通常用瞬时速率表示反应速率。() 答案除7,10,11,15,17错外,其余都正确。 3.1. 2 选择题 1. 基元反应的分子数是个微观的概念,其值()
(a)可为0、l、2、3 (b)只能是1、2、3这三个正整数 (c)也可是小于1的数值(d)可正,可负,可为零 2. 化学反应的反应级数是个宏观的概念、实验的结果,其值() (a)只能是正整数(b)一定是大于1的正整数 (c)可以是任意值(d)一定是小于1的负数 3. 已知某反应的级数是一级,则可确定该反应一定是() (a)简单反应(b)单分子反应 (c)复杂反应(d)上述都不对 4. 基元反应2A→B,为双分子反应,此反应的级数() (a)可能小于2 (b)必然为1 (c)可能大于2 (d)必然为2 5. 某反应速率常数单位是mol·l-1·s-1,该反应级数为() (a)3级 (b)2级 (c)1级 (d)0级 6. 某反应物反应了3/4所需时间是反应了1/2所需时间的2倍,则该反应级数为() (a) 0级 (b) 1级 (c) 2级 (d) 3级 7. 某反应在指定温度下,速率常数是k=4.62×10-2min-1,反应物的初始浓度为0.1mol·l-1,则该反应的半衰期为() (a) 15min (b) 30min (c) 150min (d) 不能求解 8. 某反应进行时,反应物浓度与时间成线性关系,则此反应的半衰期与反应物初始浓度的关系是() 38
反应动力学
反应动力学-正文 研究化学反应速率以及各种因素对化学反应速率影响的学科。传统上属于物理化学的范围,但为了满足工程实践的需要,化学反应工程在其发展过程中,在这方面也进行了大量的研究工作。绝大多数化学反应并不是按化学计量式(见化学计量学)一步完成的,而是由多个具有一定程序的基元反应(一种或几种反应组分经过一步直接转化为其他反应组分的反应,或称简单反应)所构成。反应进行的这种实际历程称反应机理。 一般说来,化学家着重研究的是反应机理,并力图根据基元反应速率的理论计算来预测整个反应的动力学规律。化学反应工程工作者则主要通过实验测定,来确定反应物系中各组分浓度和温度与反应速率之间的关系,以满足反应过程开发和反应器设计的需要。 反应速率反应速率r i为反应物系中单位时间、单位反应区内某一组分i的反应量,可表示为: 反应区体积可以采用反应物系体积、催化剂质量或相界面面积等,视需要而定。同一反应物系中,不同组分的反应速率之间存在一定的比例关系,服从化学计量学的规律。例如对于反应: (1) 有 (2) 对于反应物,反应速率r i前用负号;对于反应产物,r i前用正号。 反应速率方程反应速率方程表示反应温度和反应物系中各组分的浓度与反应速率之间的定量关系,即: (3) 式中C为反应物的浓度向量;T为反应温度(绝对温度)。大量实验表明,温度和浓度通常是独立地影响反应速率的,故式(3)可改写为: (4) 式(4)中f T(T)即反应速率常数k,表示温度对反应速率的影响。对多数反应,k服从阿伦尼乌斯关系(即1889年瑞典人S.阿伦尼乌斯创立的反应动力学方程): (5) 式中A为频率因子,或称指前因子;E为反应活化能;R为摩尔气体常数。频率因子为与单位时间、单位体积内反应物分子碰撞次数有关的参数;反应活化能表示发生反应必须克服的能峰,活化能高则反应难于进行,活化能低,则易于进行。频率因子和活化能两者共同决定一
化学反应动力学
化学反应动力学 既是异想天开,又实事求是,这是科学工作者特有的风格,让我们在 无穷的宇宙长河中探索无穷的真理吧。 郭沫若 经典化学热力学从静态的角度(相对静止)去研究化学反应,解决了化学反应进行中能量转换、过程方向、限度、以及各种平衡性质的计算问题。由于经典热力学只研究过程的起始状态与终结状态,不研究过程的各瞬间状态,故对于一个化学反应,其实际产量是多少?需要多少时间?反应中经历了怎样的过程等问题,经典热力学无法解决,这些问题均有待于化学反应动力学来解决。 “静止是相对的,而运动则是绝对的”,化学动力学是从动态的角度(绝对运动) 去研究化学反应即化学运动全过程的学科,它的任务较热力学更为复杂和艰巨。化学动力学的主要任务是研究反应速率和探求反应机理,具体可包括三方面内容:1.研究化学反应过程的各种因素(如分子结构、温度、压力、浓度、介质、催化剂等)对化学反应速率的影响;2.揭示化学反应宏观与微观的机理(反应物按何种途径、经何步骤才转化为最终产物);3.定量地研究总包反应与各种基元反应。 如果一个化学反应在热力学上判断是可能发生的,要使这种可能性变为现实,则该 反应必须要以一定的速率进行,可以说“速度就是效率,速度就是效益”。化学反应的体系内的许多性质及外部条件都会影响平衡和反应速率,平衡问题和速率问题是相互关连的,由于目前仍未有处理它们相关的定量方法,故还需要分别去研究平衡问题和化学反应速率问题。化学动力学作为一门独立的学科,近百年来发展相对较为迅速,但目前动力学理论与热力学相比,尚有较大差距。本章着重介绍了化学动力学的唯象规律、有关反应机理及反应速率理论的基本内容。 1、反应速率 反应物分子经碰撞后才可能发生反应,在一定温度下,化学反应的速率正比于反应分子的碰撞次数,而在单位体积中,单位时间内的碰撞次数又与反应物的浓度成正比,可见反应速率与反应物浓度直接相关,反应速率就是参加反应的某一物质的浓度随时间的变化率。 对于等容体系中进行的反应:aA+bB →dD+eE ,可以分别用体系中各物质的浓度变化 写出速率表示式,如反应物消耗速率 (负号表示反应期间反应物浓度是减少,以保证速率为正值),产物生成速率: dt dC r dt dC r B B A A -=-=,
动力学方程拟合模型(DOC)
动力学方程拟合模型 动力学方程拟合模型主要分为幂函数型模型和双曲线型模型。 在幂函数型动力学方程中,温度和浓度被认为是独立地影响反应速率的,可以表示为: 在双曲线型动力方程中强调模型方程中的吸附常数不能靠单独测定吸附性质来确定,而必须和反应速率常数一起由反应动力学实验确定。这说明模型方程中的吸附平衡常数并不是真正的吸附平衡常数,模型假设的反应机理和实际反应机理也会有相当的距离。双曲线型动力学方程的一般表达形式为 上述两类动力学模型都具有很强的拟合实验数据的能力,都既可用于均相反应体系,也可用于非均相反应体系。对气固相催化反应过程,幂函数型动力学方程可由捷姆金的非均匀表面吸附理论导出,但更常见的是将它作为一种纯经验的关联方式去拟合反应动力学的实验数据。虽然,在这种情况中幂函数型动力学方程不能提供关于反应机理的任何信息,但因为这种方程形式简单、参数数目少,通常也能足够精确地拟合实验数据,所以在非均相反应过程开发和工业反应器设计中还是得到了广泛的应用。 1.幂函数拟合 刘晓青[1]等人研究了HNO3介质中TiAP萃取Th(Ⅳ)的动力学模式和萃取动力学反应速率方程。 对于本萃取体系,由反应速率方程的一般形式可知: 可用孤立变量法求得各反应物的分反应级数a、b与c,从而确立萃取动力学方程。
第一步:分级数的求算 1.求a 固定反应物中TiAP和HNO3的浓度, 当TiAP的浓度远远大于体系中Th的初始浓 度时,可以认为体系中TiAP浓度在整个萃 取过程中没有变化而为一定値,则速率方程 可以简化为 两边取对数后得: ln{-d[Th-]/dt}=aln[Th]+ln1,用ln{-d[Th-]/dt} 对ln[Th]作图得到一条直线(r=0.9973),其斜率即为a。结果如图1所示,从图中可知斜率为1.05,即此动力学速率方程中Th(Ⅳ)的分反应级数a=1.05。 2.求b和c 同求Th(Ⅳ)分反应级数类似,固定反应物中Th(Ⅳ)和HNO3的浓度,则速率方程可以简化为 固定反应物中Th(Ⅳ)和TiAP的浓度,则速率方程可以简化为 画图可得:
第七章 化学反应动力学
第七章化学反应动力学 一.基本要求 1.掌握化学动力学中的一些基本概念,如速率的定义、反应级数、速率系数、基元反应、质量作用定律与反应机理等。 2.掌握具有简单级数反应的共同特点,特别就是一级反应与a = b的二级反应的特点。学会利用实验数据判断反应的级数,能熟练地利用速率方程计算速率系数与半衰期等。 3.了解温度对反应速率的影响,掌握Arrhenius经验式的4种表达形式,学会运用Arrhenius经验式计算反应的活化能。 4.掌握典型的对峙、平行、连续与链反应等复杂反应的特点,学会用合理的近似方法(速控步法、稳态近似与平衡假设),从反应机理推导速率方程。学会从表观速率系数获得表观活化能与基元反应活化能之间的关系。 5.了解碰撞理论与过渡态理论的基本内容,会利用两个理论来计算一些简单反应的速率系数,掌握活化能与阈能之间的关系。了解碰撞理论与过渡态理论的优缺点。 6.了解催化反应中的一些基本概念,了解酶催化反应的特点与催化剂之所以能改变反应速率的本质。 7.了解光化学反应的基本定律、光化学平衡与热化学平衡的区别,了解光敏剂、量子产率与化学发光等光化反应的一些基本概念。 二.把握学习要点的建议 化学动力学的基本原理与热力学不同,它没有以定律的形式出现,而就是表现为一种经验规律,反应的速率方程要靠实验来测定。又由于测定的实验条件限制,同一个反应用不同的方法测定,可能会得到不同的速率方程,所以使得反应速率方程有许多不同的形式,使动力学的处理变得比较复杂。反应级数就是用幂函数型的动力学方程的指数与来表示的。由于动力学方程既有幂函数型,又有非幂函数型,所以对于幂函数型的动力学方程,反应级数可能有整数(包括正数、负数与零)、分数(包括正分数与负分数)或小数之分。对于非幂函数型的动力学方程,就无法用简单的数字来表现其级数。对于初学者,要求能掌握具有简单级数的反应,主要就是一级反应、a = b的二级反应与零级反应的动力学处理方法及其特点。
第六章-化学反应动力学习题解答
第六章 化学反应动力学 思考题解答 一、是非题(判断下列说法是否正确,并说明理由) 1. 错 2. 对 3. 错 4. 错 5. 错 6. 错 7. 对 8. 对 9.错 10. 对 二、选择题 1. B 2. A. 3. B. 4. D. 5 .C 6.D. 7. A. 8. B 9. B. 10. C. 习题解答 1.请根据质量作用定律,写出下列各基元反应或复合反应中 A d d c t 与各物质浓度的关系。 (1)2A + B 2P k ?? → (2)A + 2B P + 2S k ??→ (3)22A + M A M k ??→+ (4)2A B (5)2A 2B+D B+A 2D (6) 解: (1)2A A B d 2d c kc c t - = (2)2A A B d d c kc c t -=(3)2 A A M d 2d c kc c t -= (4)2A 2 B 1A d 2+2d c k c k c t -=- (5)222 A 1 B D 1A 2A B 2D d 2+2+d c k c c k c k c c k c t ---=-- (6)A 1A 2A 3C d d c k c k c k c t -=+- 2.某人工放射性元素放出α粒子,半衰期为15min 。试问多长时间后该试样能分解掉80%。 解:由题意得该反应为一级反应,符合一级反应的条件,则 11 2 ln 2 t k = 得 1k = ln 2 15 =0.0462mol -1 由积分定义式 1ln a k t a x =- 令 0.8x y a ==得 11ln 1k t y =- 则 t=34.84min k 1 k-1 k 1 k- k k
