SO2吸收仿真实验
实验11 SO2吸收仿真实验
一、实验目的
(1)了解填料塔的基本结构及其吸收净化酸雾的工作原理。
(2)实验分析填料塔净化效率的影响因素。
二、实验装置和虚拟设备
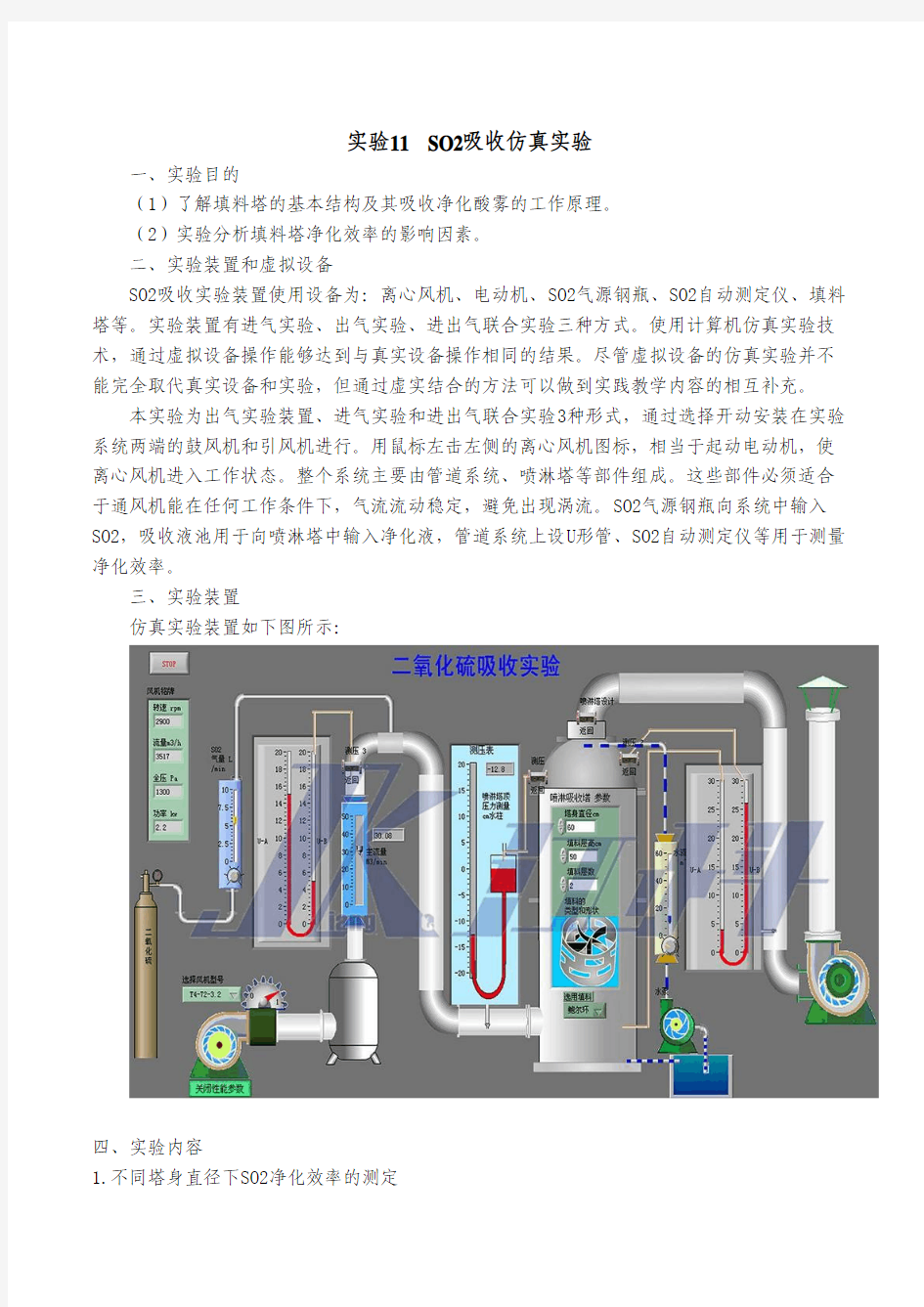
SO2吸收实验装置使用设备为:离心风机、电动机、SO2气源钢瓶、SO2自动测定仪、填料塔等。实验装置有进气实验、出气实验、进出气联合实验三种方式。使用计算机仿真实验技术,通过虚拟设备操作能够达到与真实设备操作相同的结果。尽管虚拟设备的仿真实验并不能完全取代真实设备和实验,但通过虚实结合的方法可以做到实践教学内容的相互补充。
本实验为出气实验装置、进气实验和进出气联合实验3种形式,通过选择开动安装在实验系统两端的鼓风机和引风机进行。用鼠标左击左侧的离心风机图标,相当于起动电动机,使离心风机进入工作状态。整个系统主要由管道系统、喷淋塔等部件组成。这些部件必须适合于通风机能在任何工作条件下,气流流动稳定,避免出现涡流。SO2气源钢瓶向系统中输入SO2,吸收液池用于向喷淋塔中输入净化液,管道系统上设U形管、SO2自动测定仪等用于测量净化效率。
三、实验装置
仿真实验装置如下图所示:
四、实验内容
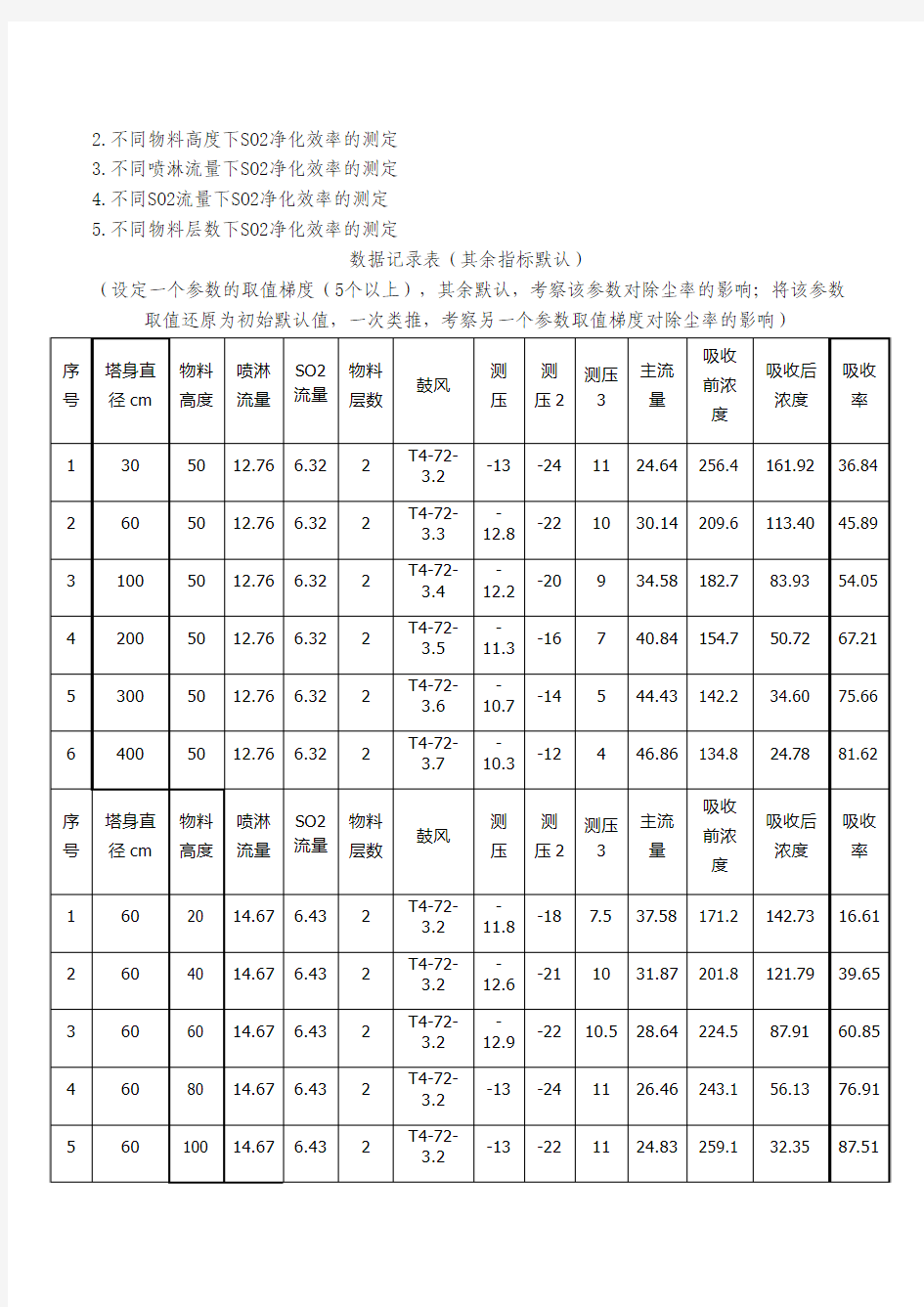
1.不同塔身直径下SO2净化效率的测定
2.不同物料高度下SO2净化效率的测定
3.不同喷淋流量下SO2净化效率的测定
4.不同SO2流量下SO2净化效率的测定
5.不同物料层数下SO2净化效率的测定
数据记录表(其余指标默认)
(设定一个参数的取值梯度(5个以上),其余默认,考察该参数对除尘率的影响;将该参数取值还原为初始默认值,一次类推,考察另一个参数取值梯度对除尘率的影响)
碱液吸收气体中的二氧化硫
实验四碱液吸收气体中的二氧化硫 一、实验意义和目的 本实验采用填料吸收塔,用5%NaOH或Na2CO3溶液吸收SO2。通过实验可初步了解用填料塔的吸收净化有害气体研究方法,同时还有助于加深理解在填料塔内气液接触状况及吸收过程的基本原理。通过实验要达到以下目的: 1.了解用吸收法净化废气中SO2的效果; 2.改变气流速度,观察填料塔内气液接触状况和液泛现象; 3.测定填料吸收塔的吸收效率及压降; 4.测定化学吸收体系(碱液吸收SO2) 二、实验原理 含SO2的气体可采用吸收法净化。由于SO2在水中溶解度不高,常采用化学吸收方法。吸收SO2吸收剂种类较多,本实验采用NaOH或Na2CO3溶液作吸收剂,吸收过程发生的的主要化学反应为: 2NaOH+SO2 —→ Na2SO3+H 2O Na2CO3+SO2 —→ Na2SO3+CO2 Na2SO3+SO2+H2O —→2NaHSO3; 实验过程中通过测定填料吸收塔进出口气体中SO2的含量,即可近似计算出吸收塔的平均净化效率,进而了解吸收效果。气体中SO2含量的测定采用:甲醛缓冲溶液吸收一盐酸付玫瑰苯胺比色法。 实验中通过测出填料塔进出口气体的全压,即可计算出填料塔的压降;若填料塔的进出口管道直径相等,用U型管压差计测出其静压差即可求出压降。 三、实验装置、流程仪器设备和试剂 (一)实验装置、流程、仪器设备和试剂 实验装置流程如图1所示 图1 SO2吸收实验装置
1一空压机;2一缓冲罐;3一转子流量计(气);4一毛细管流量计;5—转子 流量计(水);6一压差计;7一填料塔;8一S02钢瓶;9一混合缓冲器;10— 受液槽;11一高位液槽;12、13一取样口;14一压力计;15一温度计;16一 压力表;17一放空阀;18—泵 图2:SO2吸收试验装置 吸收液从高位液槽通过转子流量计,由填料塔上部经喷淋装置进人塔内,流经填料表面,由塔下部排到受液槽。空气由空压机经缓冲罐后,通过转子流量计进人混合缓冲器,并与SO2气体相混合,配制成一定浓度的混合气。SO2来自钢瓶,并经毛细管流量计计量后进人混合缓冲器。含SO2的空气从塔底进气口进人填料塔内,通过填料层后,尾气由塔顶排出。 (二)实验仪器设备 空压机压力7 kg/cm2,气量3.6m3 /h 1台 液体SO2钢瓶1瓶 填料塔D=700mm H=650mm 1台 填料Φ=5~8mm瓷杯若干 泵扬程3m,流量4001/h 1台 缓冲罐容积lm3l个 高位槽500×400 x×600m 1个 混合缓冲罐0.5m3 1个 受液槽500×400×600mm 1个 转子流量计(水)10-100L/hLZB-10 1个 转子流量计(气)4-40m3/hLZB-40 1个 毛细管流量计0.1-0.3mm 1个 U型管压力计200mm 3只
水吸收_低浓度二氧化硫_填料吸收塔_设计
水吸收低浓度SO2填料吸收塔设计 第一部分设计任务、依据和要求 一、设计任务及操作条件 1、混合气体(空气中含SO 2 气体的混合气体)处理量为90 kmol/h 2、混合气体组成:SO 2 含量为7.6%(摩尔百分比),空气为:92.4%(mol/%) 3、要求出塔净化气含SO 2为:0.145%(mol/%),H 2 O为:1.172 kmol/h 4、吸收剂为水,不含SO 2 5、常压,气体入塔温度为25°C,水入塔温度为20°C。 二、设计内容 1、设计方案的确定 2、填料吸收塔的塔径、填料层高度及填料层压强的计算。 3、填料塔附属结构的选型与设计。 4、填料塔工艺条件图。 三、H2O- SO2 在常压20 °C下的平衡数据
四、 气体与液体的物理性质数据 气体的物理性质: 气体粘度()0.0652/G u kg m h =? 气体扩散系数20.0393/G D m s = 气体密度31.383/G kg m ρ= 液体的物理性质:液体粘度 3.6/()L u kg m h =? 液体扩散系数625.310/L D m s -=? 液体密度 3998.2/L kg m ρ= 液体表面张力 4273/92.7110/L dyn cm kg h σ==? 五、 设计要求 1、设计计算说明书一份 2、填料塔图(2号图)一张
第二部分 SO2净化技术和设备 一、SO2的来源、性质及其危害: 1、二氧化硫的来源 二氧化硫的来源很广泛,几乎所有企业都要产生二氧化硫,最主要途径是含硫化石燃料的燃烧。大约一吨煤中含有5-50kg硫,一吨石油中含有5-30kg硫。这些燃料经燃烧都产生并排放出二氧化硫,占所有排放总量的96%. 二氧化硫的来源包括微生物活动,火山活动,森林火灾以及海水飞沫。主要有自然来源和人为来源两大类: 自然来源主要是火山活动,喷出的火山气体中含有大量的二氧化硫气体,地质深处的天然硫元素在火山喷发过程中燃烧氧化为二氧化硫,随火山灰一起喷射到大气中。地球上57%的二氧化硫来自自然界,沼泽、洼地、大陆架等处所排放的硫化氢,进入大气,被空气中的氧氧化为二氧化硫。自然排放大约占大气中全部二氧化硫的一半,通过自然循环过程,自然排放的硫基本上是平衡的。 人为来源则指在人类进行生产、生活活动中,使用含硫及其化合物的矿石进行燃烧,以及硫矿石的冶炼和硫酸、磷肥纸浆的生产等产生的工业废气,从而使其中一部分或全部的硫以二氧化硫的形式排放到大气中,形成二氧化硫污染。这部分二氧化硫占地球上二氧化硫来源的43%。随着化石燃料消费量的不断增加,全世界认为排放的二氧化硫在不断在增加,其中北半球排放的二氧化硫占人为排放总量的90%。我国的能源主要依靠煤炭和石油,而我国的煤炭、石油一般含硫量较高,因此,火力发电厂、钢铁厂、冶炼厂、化工厂和炼油厂排放出的大量二氧化硫和二氧化碳是造成我国大气污染的主要原因。由于我国部分地区燃用高硫煤,燃煤设备未能采取脱硫措施,致使二氧化硫排放量不断增加,造成严重的环境污染。 2、二氧化硫的性质 (1)物理性质: 二氧化硫又名亚硫酸酐,英文名称: sulfur dioxide 。无色气体,有强烈刺激性气味。分子量64.07 密度为1.4337kg/m3 (标准状况下),密度比空气大。溶解度:9.4g/mL(25℃)熔点-76.1℃(200.75K)沸点-10℃ (263K)
二氧化硫性质检验实验改进
(此处可用于收集,或继续组装其他性质实验装置:如 组装与H2S反应装置。还可以通过通水方法排进气体) (热水) (品红溶液)(石蕊试液)(溴水)(酸性KMnO4)(蘸有NaOH的棉花)微型化学实验应用——二氧化硫性质检验实验改进 (河北省张家口市宣化一中化学教研组李彤075100) 一.改进实验目的 二氧化硫是一种具有刺激性气味的有毒气体,性质多样,具有酸性、漂白性、还原性等, 能使品红、溴水、氯化铁溶液、酸性高锰酸钾溶液褪色。整个实验装置包括制备装置、性 质实验装置和尾气处理装置,故在班级做演示实验时仪器较多,同时易造成S02扩散,污染 教室环境,严重威胁师生的健康,。为此,我们对该实验进行改进,使操作更加简便、实验时 间短、药品用量少、效果明显,而且方便展台演示、便于学生观察,有效的防止了S02的逸 散,有助于学生环保意识的养成。 二.实验仪器及试剂: 仪器:具支试管(带双孔塞)、导管、橡胶管(若干)、分液漏斗、干燥管、烧杯(带热水)、铁架台(带铁夹) 药品:70%浓硫酸、Na2SO3固体、FeCl3溶液、品红溶液、石蕊试液、溴水、酸性KMnO4、蘸有NaOH的棉花。 三.实验仪器装置图及仪器的组装说明 向具支试管中加入少量亚硫酸钠粉末,分液漏斗中注入少量浓硫酸,用注射器从橡胶管 处向输液管处注入药品。关闭上面的止水夹,打开下面的止水夹,旋转分液漏斗的玻璃旋塞, 是浓硫酸滴下与亚硫酸钠反应,观察四个输液管中的现象;关闭下面的止水夹,打开上面的 止水夹,继续做其他实验。(实验完毕后,还可从此导管处通水,将装置中的残余S02全部排 出。) 实验完毕后,从分液漏斗中注入一定量的浓氢氧化钠片刻后,再拆仪器。 五.装置改进的意义
大气污染控制工程实验教学大纲
大气污染控制工程实验教学大纲 大纲制定(修订)时间:2017年6月 课程名称:大气污染控制工程课程编码:080241010 课程类别:专业课课程性质:必修 适用专业:环境工程 课程总学时:56 实验(上机)计划学时:8 开课单位:环境与化学工程学院 一、大纲编写依据 本实验大纲是依据2017版的《大气污染控制工程》课程设置而进行的。 二、实验课程地位及相关课程的联系 课程主要是针对大气污染控制技术的理解和掌握进行的,是针对《大气污染控制工程》课程设置而进行的。 三、本课程实验目的和任务 培养环境工程师的实践分析和管理处理大气污染控制的能力,提高学生的工程教育素质,掌握大气污染控制的基本理论和基本实验方法。 1、掌握粉尘真密度的测定原理;掌握碱液吸收二氧化硫的原理。 2、提高学生的工程教育素质,掌握大气污染控制的基本理论和基本实验方法;会使用的仪器有真空干燥器,二氧化硫吸收塔,大气采样器等。 3、掌握粉尘真密度的测定方法;掌握碱液吸收二氧化硫的吸收过程及吸收塔的操作过程。 四、实验基本要求 掌握大气污染控制技术,锻炼学生的综合实验能力。充分应用学生已学到的基本知识和基本技能。在教师的引导下,充分发挥学生的潜在能力,完成一些给大气污染控制方面的实验,并学会自己设计、准备完成一个综合实验,培养检验学生自学能力。 1、实验项目和实验内容的选定及其选定原则说明 选定实验有:(1)粉尘真密度的测定; (2)碱液吸收二氧化硫。 选定的原则: (1)选定一种测定粉尘物理性质的方法; (2)选定一种大气污染物的控制技术。 2、每个实验项目应达到的教学要求和具体规定 选定的实验有验证型的,也有综合性的实验,要求学生在预习后,能独立完成实验项目,并能完成实验报告。 五、实验内容和学时分配(若为选作实验项目要在序号前加“*”,并说明选作要求)
水吸收二氧化硫填料塔课程设计..
《化工原理课程设计》报告 设计任务书 (一)设计题目 试设计一座填料吸收塔,用于脱除混于空气中的SO2,混合 气体的处理为2500m3/h,其中SO2(体积分数)8﹪。要求塔 板排放气体中含SO2低于0.4%,采用清水进行吸收。(二)操作条件 常压,20℃ (三)填料类型 选用塑料鲍尔环、陶瓷拉西环填料规格自选 (四)设计内容 1、吸收塔的物料衡算 2、吸收塔的工艺尺寸计算 3、填料层压降的计算 4、吸收塔接管尺寸的计算 5、绘制吸收塔的结构图
6、对设计过程的评述和有关问题的讨论 7、参考文献 8、附表 目录 一、概述 (4) 二、计算过程 (4) 1. 操作条件的确定 (4) 1.1吸收剂的选择 (4) 1.2装置流程的确定 (4) 1.3填料的类型与选择 (4) 1.4操作温度与压力的确定 (4) 2. 有关的工艺计算 (5) 2.1基础物性数据 (5) 2.2物料衡算 (6) 2.3填料塔的工艺尺寸的计算 (6) 2.4填料层降压计算 (11) 2.5吸收塔接管尺寸的计算 (12) 2.6附属设备……………………………………………… ..12 三、评价 (13) 四、参考文献 (13) 五、附表 (14)
一、概述 填料塔不但结构简单,且流体通过填料层的压降较小,易于用 耐腐蚀材料制造,所以它特别适用于处理量小,有腐蚀性的物 料及要求压降小的场合。液体自塔顶经液体分布器喷洒于填料 顶部,并在填料的表面呈膜状流下,气体从塔底的气体口送入,流过填料的空隙,在填料层中与液体逆流接触进行传质。因气 液两相组成沿塔高连续变化,所以填料塔属连续接触式的气液 传质设备。 二、设计方案的确定 (一) 操作条件的确定 1.1吸收剂的选择 因为用水作吸收剂,同时SO2不作为产品,故采用纯溶剂。 1.2装置流程的确定 用水吸收SO2属于中等溶解度的吸收过程,故为提高传 质效率,选择用逆流吸收流程。 1.3填料的类型与选择 用不吸收SO2的过程,操作温度低,但操作压力高,因 为工业上通常选用塑料散堆填料,在塑料散堆填料中,塑
二氧化硫的性质实验探究
二氧化硫的性质实验探究 一、实验教学目标 知识目标: (一)通过简单介绍二氧化硫的实验室制法,使学生掌握好实验室制取二氧化硫的反应原理,实验装置,并利用设计的装置制取二氧化硫,用于动手实验,提高学生分析和解决实际问题的能力。 (二)通过分组实验探究,归纳出二氧化硫的性质。 能力目标: 让学生通过动手、观察、比较、思考提高归纳、总结、应用等各方面的能力。 情感目标: (一)培养学生良好的学习习惯,善于探索的思维方法,把课堂主动权交给学生。 (二)通过实验探究,培养学生求实、创新、合作的科学品质。 (三)通过师生、生生合作学习,研究性学习,体验探究成功的乐趣,激发学生探究欲。 (四)通过探究二氧化硫的性质实验,使学生掌握科学的试验方法,培养学生的逻辑思维能力和动手能力。 (五)了解二氧化硫的物理性质;掌握二氧化硫的特殊性、漂白性和还原性。 (六)通过改进实验培养实验设计能力、观察能力、分析能力、探究能力和合作学习能力, 二、实验内容设计 实验探究1:用干燥的矿泉水瓶收集一瓶二氧化硫,然后向矿泉水瓶中注入蒸馏水,请仔细观察实验现象,为什么注射蒸馏水而不是自来水? 实验探究2:向变瘪的矿泉水瓶中注入石蕊溶液,观察实验现象,这说明什么? 实验探究3:用干燥的试管收集二氧化硫,用橡胶塞塞住,然后用注射器吸10mL的品红溶液向试管注入品红溶液,观察实验现象,这说明什么? 实验探究4:用干燥的试管收集二氧化硫,用橡胶塞塞住,然后用注射器吸10mL的酸性高锰酸钾溶液向试管注入酸性高锰酸钾溶液,观察实验现象,这说明什么? 实验探究5:给实验探究3和实验探究4的试管加热,对比实验,认真观察实验现象;然后向其滴加酸性氯化钡溶液,观察实验现象,这又说明什么? 三、实验方法设计 教学目标的达成,需要适当的教学方法。本节课是实验教学课,所以以实验为主,通过分组实验、活动探究、演示实验、对比探究、合作交流、讨论归纳相结合的教学方法。给学生自己动手实验,让学生积极的思考,最后由学生自己来归纳总结。让学生在体会实验探究快乐的同时,也顺利的完成教学目标。 四、教学过程设计
(完整版)二氧化硫教案讲解
人教版高中化学新教材必修(1) 第四章非金属及其化合物 第三节硫和氮的化合物(第一课时) 教学设计思路分析 一、教材分析 本节内容为人教版高中化学新教材必修(1)第四章第三节,是典型的元素及其化合物知识。本节内容在教材中起承上启下的作用,通过之前对硅、氯单质及其化合物知识的学习,为学习本节内容做准备。同时,通过学习硫和氮的化合物知识,为本章第四节的学习做铺垫。在本节的学习中,通过实验现象,了解硫、氮非金属及其重要化合物的主要性质,认识其在生产中的应用和对生态环境的影响。因此,本节内容主要对SO2、NO、NO2进行全面剖析,分析氮氧化物和SO2性质及其对大气的污染,以及减少向大气中排放氮氧化物、二氧化硫的措施,同时让学生在生活中身体力行去保护环境。因此在教学安排上,第一课时二氧化硫的性质及其对环境的影响,以及有关的预防措施。第二课时氮的氧化物的性质及其对环境的影响。 因此,本节课学习第一课时二氧化硫的性质及其对环境的影响。本节内容安排上,先学习其性质和用途,再认识其引起环境污染的原因,思考解决的措施,提高学生的环境意识。同时本课时内容联系实际,学生易接受。教材编排的目的明确,给更多时间让学生自己去探索,获取知识。同时提供相关的拓展阅读,开拓学生的知识。 二、学情分析 学生通过学习本章前两节的知识,对非金属的认识有了一定的知识基础,对非金属元素及其化合物的知识也有了一个的整体思路。利用非金属元素的多种变价以及氧化还原反应知识,学生能从氧化还原反应的角度去分析简单的化学反应。同时,本课时的学习也贴切生活,涉及漂白、酸雨等知识,学生容易接受,而且通过学习,也有助于学生利用所学知识解决生活中的实际问题和现象,使他们以后对生活中的事物保持思考习惯,对身边的事物保持科学的态度。同时,对于刚步入高中学习的学生而言,虽然之前学习了元素及其化合物的相关知识,也有了一定的认识,但是,对其系统的学习方法还没有掌握,还不能认识到物质性质的多样性,及物质有其一般规律,也有其特殊性质。对于大部分学生,他们的实验操作能力,观察分析能力需要提高。对于实验的设计,这是学生的短板,也是学生所恐惧的板块,需要不断给他们锻炼的机会,克服畏惧心理、提高实验设计能力。
水吸收二氧化硫过程填料塔设计
齐齐哈尔大学 化工原理课程设计说明书水吸收SO2填料塔(3200m3/h) 学院:食品与生物工程学院 专业班:生工112班 姓名:蒋燕妮 学号: 2011053072 指导教师:赵国君 设计时间:2014.06.23—07.06
摘要 吸收是利用混合气体中各组分在液体中的溶解度的差异来分离气态均相混合物的 一种单元操作。在化工生产中主要用于原料气的净化,有用组分的回收等。 气液两相的分离是通过它们密切的接触进行的,在正常操作下,气相为连续相而液相为分散相,气相组成呈连续变化,气相中的成分逐渐被分离出来。填料塔是气液呈连续性接触的气液传质设备,属微分接触逆流操作过程。塔的底部有支撑板用来支撑填料,并允许气液通过。支撑板上的填料有整砌和乱堆两种方式。填料层的上方有液体分布装置,从而使液体均匀喷洒于填料层上。填料层的空隙率超过90%,一般液泛点较高,单位塔截面积上填料塔的生产能力较高,研究表明,在压力小于0.3MPa时,填料塔的分离效率明显优于板式塔。 这次课程设计的任务是用水吸收空气中的二氧化硫,然后再进行解吸处理得到二氧化硫。要求设计包括塔径、填料塔高度、塔管的尺寸等,需要通过物料衡算得到所需要的基础数据,然后进行所需尺寸的计算得到各种设计参数,为图的绘制打基础,提供数据参考。 关键词:水;二氧化硫;吸收;填料塔;物料衡算
Abstract Absorption is an important unit operation in the differences in solubility using mixture gas in the liquid in the separation of gaseous homogeneous mixture. In the chemical production is mainly used for purifying raw gas, recovery of valuable components etc.. Separation of gas-liquid two-phase is close contact with them, in normal operation, the gas phase as the continuous phase and the liquid phase is dispersed phase, gas phase composition of a continuous change, the gas phase composition was gradually isolated. The tower is gas-liquid in gas-liquid mass transfer equipment of continuous contact, belonging to differential contact counter-current operation. At the bottom of the tower with a supporting plate for supporting the filler, and allow the liquid through the. The support plate and a whole masonry filler has two ways. The liquid distribution device above the filler layer, so that the liquid is uniformly sprayed on the filler layer. Void filler layer rate exceeds 90%, the general flooding points higher, the tower unit cross-sectional area of packing tower production capacity is higher, research shows that, the pressure is less than 0.3MPa, the separation efficiency of packed tower is obviously better than that of the plate tower. The curriculum design task is the absorption of sulfur dioxide in air with water, and then desorption with sulfur dioxide. Design requirements including the tower diameter, height of packed tower, tower tube size, need through the material balance to get basic data needed, and then calculate the required size of the various design parameters, for drawing foundation, to provide data for reference. Keywords: water; sulfur dioxide; absorption; packed tower; material balance
空气中二氧化硫的测定实验报告
空气中二氧化硫的测定实验报告
实验十三空气中二氧化硫含量的测定 (甲醛溶液吸收-盐酸副玫瑰苯胺分光光度法) 一、概述 )又名亚硫酸酐,分子量为二氧化硫(SO 2 64.06,为无色有很强刺激性气体,沸点-10℃;熔点-76.1℃;对空气的相对密度 2.26。极易溶于水,在0℃时,1L水可溶解79.8L,20℃溶解39.4L。也溶于乙醇和乙醚。二氧化硫是一种还原剂,与氧化剂作用生成三氧化硫或硫酸。 二氧化硫对结膜和上呼吸道粘膜具有强烈辛辣刺激性,其浓度在0.9mg/m3或大于此浓度就能被大多数人嗅觉到。吸入后主要对呼吸器官的损伤,可致支气管炎、肺炎,严重者可致肺水肿和呼吸麻痹。 二氧化硫是大气中分布较广,影响较大的主要污染物之一,常常以它作为大气污染的主要指标。它主要来源于以煤或石油为燃料的工厂企
业,如火力发电厂、钢铁厂、有色金属冶炼厂和石油化工厂等.此外,硫酸制备过程及一些使用硫化物的工厂也可能排放出二氧化硫。 测定二氧化硫最常用的化学方法是盐酸副玫瑰苯胺比色法,吸收液是四氯汞钠(钾)溶液,与二氧化硫形成稳定的络合物。为避免汞的污染,近年用甲醛溶液代替汞盐作吸收液。 二、实验目的 1. 通过对空气中二氧化硫含量的监测,初步掌握甲醛溶液吸收-盐酸副玫瑰苯酚风光光度法测定空气中的二氧化硫含量的原理和方法。 2.在总结监测数据的基础上,对校区环境空气质量现状(二氧化硫指标)进行分析评价。 三、实验原理 1.二氧化硫的基本性质 二氧化硫(SO2)又名亚硫酸酐,分子量为64.06,为无色有很强刺激性的气体,沸点为
-10℃,熔点为-76.6℃,对空气的相对密度为2.26。极易溶于水,在0℃时,1L水可溶解79.8L SO2,20℃溶解39.4L SO2,也溶于乙醇和乙醚。SO2是一种还原剂,与氧化剂作用生成SO3或H2SO3。 2.盐酸副玫瑰苯酚分光光度法 测定SO2最常用的化学方法是盐酸副玫瑰苯酚分光光度法,吸收液是Na2HgCl4或K2HgCl4溶液,与SO2形成稳定的络合物。为避免汞的污染,近年来用甲醛溶液代替汞盐作吸收液。 SO2被甲醛缓冲溶液吸收后,生成稳定的羟甲基磺酸加成化合物,与盐酸副玫瑰苯胺作用,生成紫红色化合物,用风光光度计在570mm处进行测定。 测定范围为10mL样本溶液中含0.3—20μg SO2。若采样体积为20L,则可测浓度范围为0.015—1.000mg/m3。 3.方法特点
二氧化硫吸收塔的设计计算
(一)设计方案的确定 用水吸收S02,为提高传质效率,选用逆流吸收过程。因用水作为吸收剂,且S02不作为产品,故采用纯溶剂。 (二)填料的选择 该系统不属于难分离的系统,操作温度及压力较低,可采用散装填料,系统中有S02,有一定的腐蚀性,故考虑选用塑料鲍尔环,由于系统压降无特殊要求,考虑到不同尺寸鲍尔环的传质性能选用D g38塑料鲍尔填料。 (三)设计步骤 本课程设计从以下几个方面的内容来进行设计 (1)吸收塔的物料衡算; (2)填料塔的工艺尺寸计算;主要包括:塔径,填料层高度,填料层压降; (3)设计液体分布器及辅助设备的选型; (4)绘制有关吸收操作图纸。 (四)基础数据 1、液相的物性数据 对于低浓度的吸收过程,溶液的物性数据可以近似取水的物性数据,由手册查得,20℃时水的有关物性数据如下: 密度 ρ=998.2 kg/m3 L 粘度 μ=0.001 Pa·s=3.6 kg/(m·h) L
表面张力 L σ=73 dyn/cm=940 896 kg/h 2 S02在水中的扩散系数 L D =1.47×10-5 cm 2 /s=5.29×10-6 m 2 /h 2、 气相的物性数据 混合气体的平衡摩尔质量 M =0.08×64.06+0.92×29=31.80g/mol 混合气体的平均密度 G ρ=101.331.808.31427320??+() =1.322 kg/m 3 混合气体的粘度可以近似取空气的粘度,查手册20℃时空气的粘度为 G μ=1.81×10-5 Pa ·s=0.065 kg/(m ·h) 查手册得S02在空气中的扩散系数为 G D =0.108 cm 2 /s =0.039 m 2 /h 3、 气液相平衡数据 查手册,常压下20℃时: S02在水中的亨利系数 E=3.55×1O 3 kPa 相平衡常数为 m E P = =3.55×1O 3 /101.3=35.04 溶解度系数 L s H EM ρ= =998.2/3.55×1O 3 /60.06=0.00468 kmol/h 相平衡关系为 1.153266.7667 6y x = 4、填料的填料因子及比表面积数据
清水吸收二氧化硫化工原理课程设计毕业设计(论文)
摘要 在化工生产中,气体吸收过程是利用气体混合物中,各组分在液体中溶解度或化学反应活性的差异,在气液两相接触是发生传质,实现气液混合物的分离。在化学工业中,经常需将气体混合物中的各个组分加以分离,其目的是: ①回收或捕获气体混合物中的有用物质,以制取产品; ②除去工艺气体中的有害成分,使气体净化,以便进一步加工处理;或除去工业放空尾气中的有害物,以免污染大气。根据不同性质上的差异,可以开发出不同的分离方法。吸收操作仅为其中之一,它利用混合物中各组分在液体中溶解度或化学反应活性的差异,在气液两相接触时发生传质,实现气液混合物的分离。 一般说来,完整的吸收过程应包括吸收和解吸两部分。在化工生产过程中,原料气的净化,气体产品的精制,治理有害气体,保护环境等方面都要用到气体吸收过程。填料塔作为主要设备之一,越来越受到青睐。二氧化硫填料吸收塔,以水为溶剂,经济合理,净化度高,污染小。此外,由于水和二氧化硫反应生成硫酸,具有很大的利用。 本次化工原理课程设计,我设计的题目是:炉气处理量为m3 4200炉气吸过程填料吸收塔设计。本次任务为用水吸收二氧化硫常压填料塔。具体设计条件如下: 1、混合物成分:空气和二氧化硫; 2、二氧化硫的含量:0.05(摩尔分率) 3、操作压强;常压操作 4、进塔炉气流量:h 4200 m3 5、二氧化硫气体回收率:95% 吸收过程视为等温吸收过程。
目录 摘要 .................................................................................................................................................. I 第一章 设计方案的确定 (1) 1.1流程方案 (1) 1.2设备方案 (1) 1.3流程布置 (1) 1.4吸收剂的选择 (1) 第二章 填料的选择 (2) 2.1对填料的要求 (2) 2.2填料的种类和特性 (2) 2.3填料尺寸 (3) 2.4填料材质的选择 (3) 第三章 工艺计算 (4) 3.1气液平衡的关系 (4) 3.2吸收剂用量及操作线的确定 (4) 3.2.1吸收剂用量的确定 (4) 3.2.2操作线的确定 (5) 3.3塔径计算 (5) 3.3.1采用Eckert 通用关联图法计算泛点速率f u : (5) 3.3.2操作气速 (7) 3.3.3塔径计算 (7) 3.3.4喷淋密度U 校核 (7) 3.3.5单位高度填料层压降(Z P )的校核 (8) 3.4填料层高度计算 (9) 3.4.1传质系数的计算 (9) 3.4.2填料高度的计算 (12) 第四章 填料塔内件的类型与设计 (13) 4.1 塔内件的类型 (13) 第五章 辅助设备的选型 (16) 5.1管径的选择 (16) 5.2泵的选取: (17) 5.3风机的选型: (17) 第六章 填料塔附属高度计算 (17) 第七章 分布器简要计算 (18) 第八章 关于填料塔设计的选材 (18) 参考文献 (19) 附录 (20) 附图 (21) 致谢 (22)
二氧化硫的测定实验报告
实验六大气中二氧化硫的测定 环境工程李婷婷2110921109 一、实验目的 1、练习使用大气采样器,掌握其操作过程; 2、掌握二氧化硫测定的实验原理。 二、实验原理 二氧化硫被四氯汞钾溶液吸收后,生成稳定的二氯亚硫酸盐络合物,再与甲醛及盐酸副玫瑰苯胺作用,形成紫红色络合物,根据颜色深浅,比色定量。 四氯汞钾:HgCl2+2KCl=K2[HgCl4] 吸收SO2:[HgCl4]2-+SO2+H2O=[HgCl2SO3]2-+2H++2Cl- 二氯亚硫酸盐络合物 加盐酸和甲醛: [HgCl2SO3]2-+HCHO+2H+=HgCl2+HOCH2SO3H 羟基甲基磺酸 加副品红,显色:
三、实验步骤 1、样品采集: 用内装5mL四氯汞钾吸收液的多孔玻板吸收管,以0.5L/ min流量采气10-20L,在采样、样品运输及存放过程中应避免日光直接照射。 2、标准曲线的绘制: 取8支具塞比色管,按表配制标准色列: 各管中加入0.50mL氨基磺酸胺溶液,摇匀。再加入0.50mL甲醛溶液及1.50mL盐酸副玫瑰苯胺溶液,摇匀。当室温为15~20℃,显色30min;室温为20~25℃,显色20min;室温为25~30℃,显色15min。用10mm比色皿,在波长575nm处,测定吸光度。 3、样品测定: 将吸收管中的样品溶液全部移入比色管中,用少量水洗涤吸收管,并入比色管中,使总体积为5mL。以下步骤同标准曲线的绘制。 四、实验结果与分析 大气中二氧化硫的浓度X SO2(mg SO2/m3): X SO2 = (A-A。)B S/V0
式中:A——样品溶液吸光度; A0——试剂空白液吸光度; B S———核准因子,μg/吸光度单位; V0——换算为标准状态下(0℃,101325Pa)的采样体积,L B S=[W1/(A1-A0)+ W2/(A2-A0 ) +… W N/(A N-A0 ) ]/n 式中:W N为SO2的含量(μg) n为标液份数 V0= Vt*273/(273+t)*P/101.3 式中:Vt为采样温度为t,压力为P的采样体积,L P:现场采样压力,K Pa 经实验测得,二氧化硫的标准曲线如下: 代入公式B S=[W1/(A1-A0)+ W2/(A2-A0 ) +… W N/(A N-A0 ) ]/n,得: B S=12.40361。0.04 实验采样时P=102.8Kpa,T=280K,采样流量为0.5L/ min,时间为30min,所以采样体积为Vt=15L,代入公V0=Vt*273/(273+t)*P/101.3得:V0=14.84156L。 实验测得样品吸光度为A=0.111,A0=0.063,由以上计算可知B S=12.404,V0=14.842L,代入公式X SO2 =(A-A。)B S/V0,可得:X SO2=0.04 mg SO2/m3。
水吸收SO2过程填料吸收塔的设计
一设计任务书 (一)设计题目 过程填料吸收塔的设计:试设计一座填料吸收塔,用于脱除焙烧水吸收SO 2 炉送出的混合气体(先冷却)中的SO2,其余为惰性组分,采用清水进行吸收。 (二)操作条件 (1)操作压力常压 (2)操作温度25℃ (三)设计容 (1)吸收塔的物料衡算; (2)吸收塔的工艺尺寸计算; (3)填料层压降的计算; (4)液体分布器简要设计; (5)吸收塔接管尺寸计算; (6)绘制吸收塔设计条件图; (7)对设计过程的评述和有关问题的讨论。 二设计方案简介 2.1方案的确定 用水吸收SO 属中等溶解度的吸收过程,为提高传质效率,选用逆流吸收流 2 不作为产品,故采用纯溶剂。 程。因用水作为吸收剂,且SO 2 2.2填料的类型与选择 的过程,操作温度及操作压力较低,工业上通常选用塑料散对于水吸收SO 2 装填料。在塑料散装填料中,塑料阶梯环填料的综合性能较好,故此选用DN38聚丙烯阶梯环填料。
阶梯环是对鲍尔环的改进。与鲍尔环相比,阶梯环高度减少了一半,并在一端增加了一个锥形翻边。由于高径比减少,使得气体绕填料外壁的平均路径大为缩短,减少了气体通过填料层的阻力。锥形翻边不仅增加了填料的机械强度,而且使填料之间由线接触为主变成以点接触为主,这样不但增加了填料间的空隙,同时成为液体沿填料表面流动的汇集分散点,可以促进液膜的表面更新,有利于传质效率的提高。阶梯环的综合性能优于鲍尔环,成为目前所使用的环形填料中最为优良的一种。 2.3设计步骤 本课程设计从以下几个方面的容来进行设计 (一) 吸收塔的物料衡算;(二) 填料塔的工艺尺寸计算;主要包括:塔径,填料层高度,填料层压降;(三) 设计液体分布器及辅助设备的选型;(四) 绘制有关吸收操作图纸。 三 、工艺计算 3.1基础物性数据 3.1.1 液相物性数据 对低浓度吸收过程,溶液的物性数据可近似取纯水的物性数据。由手册查得,25℃时水的有关物性数据如下: 密度为 ρL =997.1 kg/m 3 粘度为 μL =0.0008937 Pa·s=3.2173kg/(m·h) 表面力为σL =71.97 dyn/cm=932731 kg/h 2 SO 2在水中的扩散系数为 D L =1.724×10-9m 2/s=6.206×10-6m 2/h (依Wilke-Chang 0.518r 0.6 ()1.85910M T D V φμ-=?计算,查《化学工程基础》) 3.1.2 气相物性数据 设进塔混合气体温度为25℃, 混合气体的平均摩尔质量为 M Vm =Σy i M i =0.1×64.06+0.9×29=32.506g/mol 混合气体的平均密度为
二氧化硫实验方法
3二氧化硫的测定 3.1 方法与原理 环境空气甲醛吸收-副玫瑰苯胺分光光度法:二氧化硫被甲醛缓冲溶液吸收后,生成稳定的羟甲基磺酸加成化合物,在样品溶液中加入氢氧化钠使加成化合物分解,释放出的二氧化硫与副玫瑰苯胺、甲醛作用,生成紫红色化合物,用分光光度计在波长577 nm 处测量吸光度。 3.2 试剂和材料 (1)碘酸钾(KIO 3),优级纯,经110℃干燥2 h 。 (2)氢氧化钠溶液,c (NaOH )=1.5 mol/L :称取6.0 g NaOH ,溶于100 ml 水中。 (3)环己二胺四乙酸二钠溶液,c (CDTA-2Na)=0.05 mol/L :称取1.82 g 反式1,2-环己二胺四乙酸[简称CDTA],加入氢氧化钠溶液6.5 ml ,用水稀释至100 ml 。 (4)甲醛缓冲吸收贮备液:吸取36%~38%的甲醛溶液5.5 ml ,CDTA-2Na 溶液20.00 ml ;称取2.04 g 邻苯二甲酸氢钾,溶于少量水中;将三种溶液合并,再用水稀释至100 ml ,贮于冰箱可保存1年。 (5)甲醛缓冲吸收液;用水将甲醛缓冲吸收贮备液稀释100倍。临用时现配。 (6)氨磺酸钠溶液,ρ (NaH2NSO3)=6.0 g/L :称取0.60 g 氨磺酸[H2NSO3H]置于100 ml 烧杯中,加入4.0 ml 氢氧化钠(4.2),用水搅拌至完全溶解后稀释至100 ml ,摇匀。此溶液密封可保存10 d 。 (7)碘贮备液,c (1/2I2)=0.10 mol/L :称取12.7 g 碘(I2)于烧杯中,加入40 g 碘化钾和25 ml 水,搅拌至完全溶解,用水稀释至1 000 ml ,贮存于棕色细口瓶中。 (8)碘溶液,c (1/2I2)=0.010 mol/L :量取碘贮备液50 ml ,用水稀释至500 ml ,贮于棕色细口瓶中。 (9)淀粉溶液,ρ(淀粉)=5.0 g/L :称取0.5 g 可溶性淀粉于150 ml 烧杯中,用少量水调成糊状,慢慢倒入100 ml 沸水,继续煮沸至溶液澄清,冷却后贮于试剂瓶中。 (10)碘酸钾基准溶液,c (1/6KIO3)=0.100 0 mol/L :准确称取3.566 7 g 碘酸钾溶于水,移入1 000 ml 容量瓶中,用水稀至标线,摇匀。 (11)盐酸溶液,c (HCl)=1.2 mol/L :量取100 ml 浓盐酸,加到900 ml 水中。 (12)硫代硫酸钠标准贮备液,c (Na 2S 2O 3)=0.10 mol/L :称取25.0 g 硫代硫酸钠,溶于1 000 ml ,新煮沸但已冷却的水中,加入0.2 g 无水碳酸钠,贮于棕色细口瓶中,放置一周后备用。如溶液呈现混浊,必须过滤。 标定方法:吸取三份20.00 ml 碘酸钾基准溶液分别置于250 ml 碘量瓶中,加70 ml 新煮沸但已冷却的水,加1g 碘化钾,振摇至完全溶解后,加10 ml 盐酸溶液,立即盖好瓶塞,摇匀。于暗处放置5 min 后,用硫代硫酸钠标准溶液滴定溶液至浅黄色,加2 ml 淀粉溶液,继续滴定至蓝色刚好褪去为终点。硫代硫酸钠标准溶液的浓度按式(1)计算: (1) 式中:c 1——硫代硫酸钠标准溶液的浓度,mol/L ; 1020.00mol /C L V ?= ()
化工原理课程之二氧化硫吸收设计
目录 目录 (1) 摘要 (3) 第1章绪论................................................................................... 5 1·1吸收技术概况........................................................................... 51·2吸收设备的发展6? 1.3吸收在工业生产中的应用7? 第2章设计方案?7 2.1吸收剂的选择7? 2.2吸收流程的选择 (8) 2.2.1气体吸收过程分类 (8) 2.2.2吸收装置的流程 (9) 2.3吸收塔设备及填料的选择9? 2.3.1吸收塔设备9? 2.3.2填料的选择?10 2.4吸收剂再生方法的选择 (10) 2.5操作参数的选择......................................................................... 11 第3章吸收塔的工艺计算11? 3.1基础物性数据 (11) 3.1.1液相物性数据..................................................................... 11 3.1.2气相物性数据?12 3.1.3气液相平衡数据?12 3.2物料衡算 (12) 3.3塔径计算 (13)
3.3.1塔径的计算....................................................................... 13 3.3.2泛点率校核:14? 3.3.4液体喷淋密度得校核: (14) 3.4填料层高度的计算14? 3.4.1传质单元数的计算 (14) 3.4.2传质单元高度的计算 ................................................................. 15 3.4.3填料层高度的计算16? 3.5填料塔附属高度的计算 (17) 3.6液体分布器计算1?7 3.6.1液体分布器的选型18? 3.6.2布液孔数的计算?18 3.6.3布液计算........................................................................... 18 3.7其他附属塔内件的选择?18 3.7.1填料支承装置的选择18? 3.7.2填料压紧装置1?9 3.7.3塔顶除雾器19? 3.8吸收塔的流体力学参数计算 .................................................................................................................................. 20 3.8.1吸收塔的压力降 (20) 3.8.2吸收塔的泛点率 (21) 3.8.3气体动能因子 (21) 3.9附属设备的计算与选择21? 3.9.1离心泵的选择与计算21? 3.9.2吸收塔主要接管尺寸选择与计算22? 工艺设计计算结果汇总与主要符号说明 ........................................................................................................................ 23设计过程的评述和有关问题的讨论26? 主要参考文献27? 结束语 (28) 吸收操作系统的工艺流程图 (29) 吸收操作系统的设备条件图?30
水吸收二氧化硫填料塔的设计
化工原理课程设计题目水吸收二氧化硫填料塔得设计 教学院化工与材料工程学院 专业班级材化0901 学生姓名 学生学号 指导教师 2011年 7月5 日
课程设计任务书 1、设计题目:处理量为2750m3/h水吸收二氧化硫过程填料吸收塔得设计; 矿石焙烧炉送出得气体冷却到20℃后送入填料塔中,用20℃清水洗涤洗涤除去其中得SO 2 。 入塔得炉气流量为2750m3/h,其中进塔SO 2得摩尔分率为0、05,要求SO 2 得吸收率为95%。吸收 塔为常压操作,因该过程液气比很大,吸收温度基本不变,可近似取为清水得温度。吸收剂得用量为最小用量得1、5倍。 2、工艺操作条件: (1)操作平均压力常压 (2)操作温度t=20℃ (3)选用填料类型及规格自选。 3、设计任务: 完成干燥器得工艺设计与计算,有关附属设备得设计与选型,绘制吸收系统得工艺流程图与吸收塔得工艺条件图,编写设计说明书。 化工原理教研室 2011年5月
目录 第1章绪论 (1) 1、1吸收技术概况 (1) 1、2吸收设备得发展 (1) 1、3吸收在工业生产中得应用 (2) 第2章设计方案 (2) 2、1吸收剂得选择 (4) 2、2吸收流程得选择 (4) 2、2、1吸收工艺流程得确定 (4) 2、3吸收塔设备及填料得选择 (4) 2、3、1吸收塔得设备选择 (4) 2、3、2填料得选择 (5) 2、4吸收剂再生方法得选择 (6) 2、5操作参数得选择 (7) 第3章吸收塔得工艺计算 (9) 3、1基础物性数据 (9) 3、1、1液相物性数据 (9) 3、1、2气相物性数据 (9) 3、1、3气液相平衡数据 (9) 3、2物料衡算 (10) 3、3填料塔得工艺尺寸得计算 (11) 3、3、1塔径得计算 (11) 3、3、2泛点率校核 (11) 3、3、3填料规格校核: (11) 3、3、4液体喷淋密度校核 (11) 3、4填料塔填料高度计算 (12) 3、4、1传质单元高度计算 (12) 3、4、2传质单元数得计算 (14) 3、5填料塔附属高度计算 (14) 3、6液体分布器计算 (15) 3、6、1液体分布器 (15) 3、6、2布液孔数 (17) 3、6、3 液体保持管高度 (17) 3、7其她附属塔内件得选择 (17) 3、7、1填料支承板 (17) 3、7、2除沫器(除雾器) (17) 3、7、3管口结构 (18) 3、8吸收塔得流体力学参数得计算 (19) 3、8、1吸收塔得压力降 (19) 3、8、2吸收塔得泛点率 (20)
