【南方凤凰台】2017版高考化学一轮复习专题一化学基础知识课时3氧化还原反应导学案(新)

课时3 氧化还原反应
(本课时对应学生用书第11~15页)
【课时导航】
【自主学习】
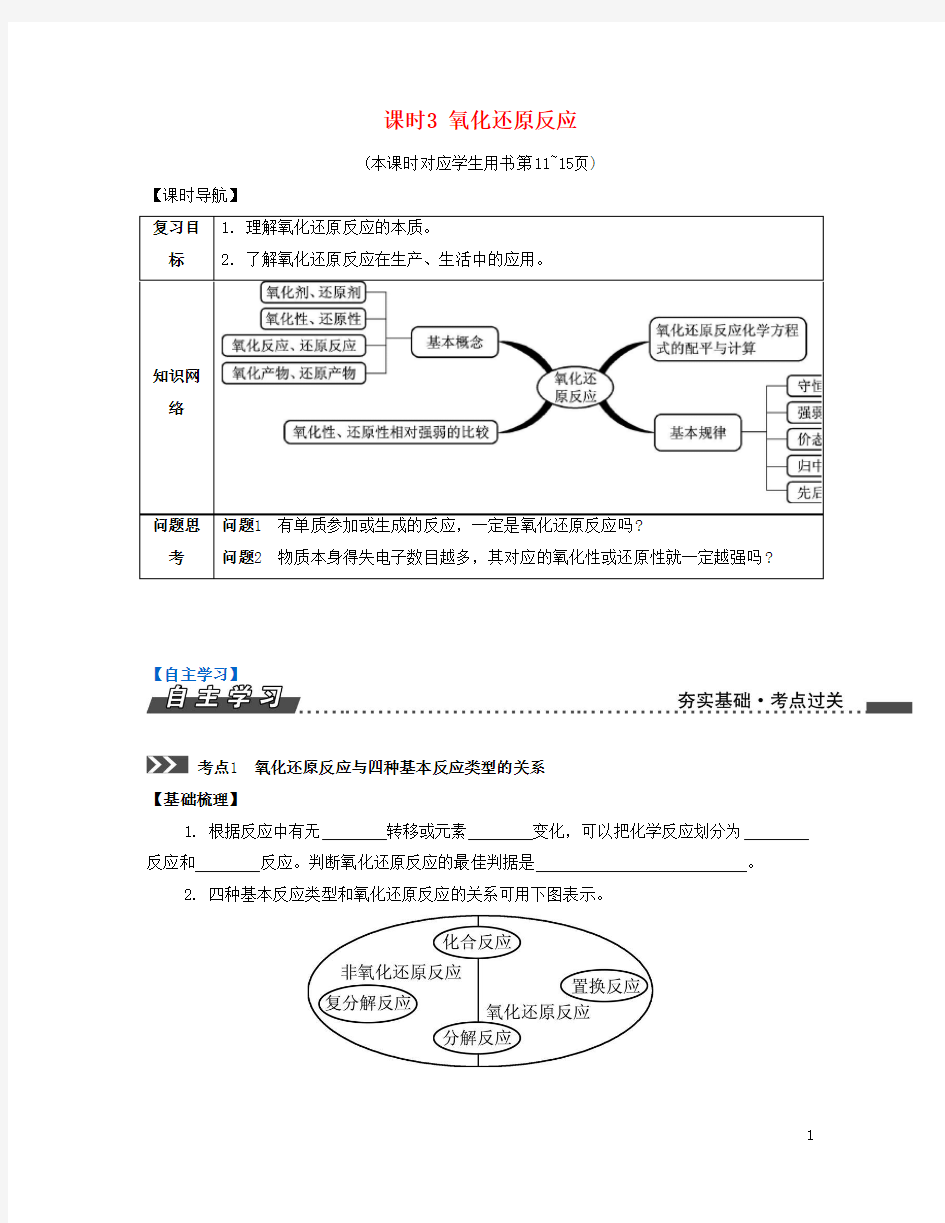
考点1 氧化还原反应与四种基本反应类型的关系 【基础梳理】
1. 根据反应中有无 转移或元素 变化,可以把化学反应划分为 反应和 反应。判断氧化还原反应的最佳判据是 。
2. 四种基本反应类型和氧化还原反应的关系可用下图表示。
【举题说法】
例题1 (2015·盐城期中)下列反应既属于氧化还原反应,又属于化合反应的是( )
A. 2Fe+3Cl 22FeCl3
B. Fe2O3+3CO2Fe+3CO2
C. CaO+CO 2CaCO3
D. H2SO4+2NaOH Na2SO4+2H2O
【答案】 A
【解析】氧化还原反应的特征是有化合价的升降,化合反应是两种或两种以上的物质反应生成一种物质,A正确。
变式1 下列说法错误的是( )
A. 置换反应一定是氧化还原反应
B. 化合反应不可能是氧化还原反应
C. 分解反应可能是氧化还原反应
D. 凡是氧化还原反应,都不可能是复分解反应
【答案】 B
【解析】因有元素化合价变化的反应属于氧化还原反应,置换反应中一定存在元素化合价的变化,则置换反应一定是氧化还原反应,A正确;例如有单质参加的化合反应中存在元素化合价的变化,是氧化还原反应,B错;例如有单质生成的分解反应中存在元素化合价的变化,是氧化还原反应,C正确;复分解反应中一定没有元素化合价的变化,则氧化还原反应一定不是复分解反应,D正确。
对氧化还原反应与四种基本反应类型之间关系的认识误区
2
O
3N
3Na
22O
以上两个反应是同素异形体之间的转化,虽涉
考点2 氧化还原反应的基本概念
【基础梳理】
1. 氧化还原反应的判断
(1) 氧化还原反应的本质特征是,实质是。
(2) 氧化还原反应的有关概念
2. 氧化还原反应电子转移的表示方法
(1) 双线桥法:①标变价、②画箭头、③算数目、④说变化。
用双线桥法标出铜和浓硝酸反应电子转移的方向和数目:。
(2) 单线桥法:箭头由失电子原子指向得电子原子,线桥上只标电子转移的数目,不标“得”、“失”字样。
用单线桥法标出铜和浓硝酸反应电子转移的方向和数目:。
3. 常见氧化剂和还原剂
(1) 常见氧化剂
(2) 常见还原剂
(3) 具有中间价态的物质既有氧化性又有还原性
Fe2+、S
2-
3
O
、SO2主要表现,H2O2主要表现。
【举题说法】
例题2 (2015·四川高考)下列物质在生活中应用时,起还原作用的是( )
A. 明矾作净水剂
B. 甘油作护肤保湿剂
C. 漂粉精作消毒剂
D. 铁粉作食品袋内的脱氧剂
【答案】 D
【解析】明矾净水时铝离子发生水解反应,没有元素化合价的变化,A错;甘油作护肤保湿剂,利用的是其物理性质,没有元素化合价的变化,B错;漂粉精作消毒剂,氯元素的化合价降低,作氧化剂,C错;铁粉作食品袋内的脱氧剂,Fe与氧气反应,铁的化合价升高,作还原剂,起到还原作用,D正确。
变式2 (2016·南京、盐城一模)硫酸亚铁煅烧反应为2FeSO4(s)SO2(g)+Fe2O3(s)+SO3(g),有关说法正确的是( )
A. 该反应中FeSO4既作氧化剂,又作还原剂
B. SO2能使溴水褪色,说明SO2具有漂白性
C. 该反应中每生成1 mol Fe2O3转移电子数约为1×6.02×1023
D. 该反应生成的气体通入足量BaCl2溶液中,可得到BaSO3和BaSO4两种沉淀
【答案】 A
【解析】FeSO4中铁元素的化合价升高,硫元素的化合价部分降低,FeSO4既作氧化剂又
作还原剂,A正确;SO2与溴水发生氧化还原反应:SO2+Br2+2H2O H2SO4+2HBr,SO2是还原剂,
体现的是还原性,而不是漂白性,B错误;该反应中每生成1mol Fe2O3转移电子数约为2×6.02×1023,C错误;SO2与BaCl2溶液不反应,SO3与BaCl2溶液反应生成BaSO4沉淀,D错误。
氧化性和还原性相对强弱的比较
1. 根据反应原理判断
对于自发的氧化还原反应一般有如下对应关系:氧化剂+还原剂还原产物+氧化产物。氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
如K2Cr2O7+14HCl(浓)2KCl+2CrCl3+3Cl2↑+7H2O,氧化性:K2Cr2O7>Cl2,还原性:HCl>CrCl3。
2. 根据“表”判断
(1) 根据元素周期表判断
(2) 依据金属活动性顺序
注意是Fe2+、Sn2+、Pb2+,不是Fe3+、Sn4+、Pb4+。
(3) 依据非金属活动性顺序
3. 根据与同一物质反应的情况(反应条件、剧烈程度等)判断
反应要求越低、反应越剧烈,对应物质的氧化性或还原性越强,如是否加热、反应温度高低、有无催化剂、反应物浓度大小等。
例如:2KMnO4+16HCl(浓)2KCl+2MnCl2+5Cl2↑+8H2O(常温)、MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O(加热),可得氧化性:KMnO4>MnO2。
4. 根据产物价态高低判断
还原剂相同,若氧化产物价态不同,则价态越高,氧化剂的氧化性越强。
如2Fe+3Cl22FeCl3、Fe+S FeS,可得氧化性:Cl2>S。
5. 根据电化学原理判断
(1) 原电池:两种不同的金属构成原电池的两极(稀硫酸、稀盐酸等非氧化性酸作电解质),还原性:负极金属>正极金属。
(2) 电解池:氧化性强的金属阳离子优先在阴极放电,还原性强的非金属阴离子优先在阳极放电。
6. 氧化性、还原性强弱与外界条件有关
(1) 浓度:一般而言,同种氧化剂浓度大者氧化性强。如氧化性:浓硝酸>稀硝酸。
(2) 温度:如MnO2只与热的浓盐酸反应生成Cl2,不与冷的浓盐酸反应。
(3) 溶液的酸碱度:一般在酸性环境下,氧化剂的氧化性较强,如KClO3在酸性条件下能将Cl-氧化成Cl2,在中性条件下不能氧化Cl-。
考点3 氧化还原反应的常见规律
【基础梳理】
1. 守恒规律
(1) 质量守恒:反应前后元素的种类和质量不变。
(2) 得失电子守恒:氧化剂得电子总数与还原剂失电子总数,化合价升高的总价态化合价降低的总价态。
(3) 电荷守恒:在有离子参加的氧化还原反应中,反应前后离子的电荷数。
2. 竞争规律——“强强联手”:若存在多种氧化剂与多种还原剂反应时,氧化剂中氧化性的最先和还原性最强的还原剂反应。
3. 价态规律:以硫(S)元素为例
说明:当元素化合价处于最高价态时,仅有氧化性,但不一定具有强氧化性,如CO2等;当元素的化合价处于最低价态时,仅有还原性,但不一定具有强还原性,如CH4;当元素的化合价处于中间价态时,既有氧化性又有还原性,如SO2。
4. 强弱规律:强氧化剂+强还原剂弱还原产物+弱氧化产物。
【举题说法】
例题3 (2015·姜堰期中)氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,还原剂
的还原性大于还原产物的还原性。现有以下反应①Cl2
+2KBr2KCl+Br2、
②KClO3+6HCl3Cl2↑+KCl+3H2O、③2KBrO3+Cl 2Br2+2KClO3,下列说法正确的是( )
A. 上述三个反应都有单质生成,所以都是置换反应
B. 氧化性由强到弱的顺序为 KBrO3>KClO3>Cl2>Br2
C. 反应②中还原剂与氧化剂的物质的量之比为6∶1
D. 反应③中1 mol还原剂完全反应,氧化剂得到电子的物质的量为2 mol
【答案】 B
【解析】根据置换反应的概念分析,反应②中有单质生成但反应物中没有单质参加,不是置换反应,A错;反应①中氧化剂是氯气,氧化产物是溴,所以氯气的氧化性大于溴,反应②中氧化剂是氯酸钾,氧化产物是氯气,氯酸钾的氧化性大于氯气,反应③中氧化剂是溴酸钾,氧化产物是氯酸钾,所以溴酸钾的氧化性大于氯酸钾,氧化性强弱顺序是
KBrO3>KClO3>Cl2>Br2,B正确;反应②KClO3
+6HCl3Cl2↑+KCl+3H2O中,氧化剂是氯酸钾,还
原剂是参加反应的氯化氢的5
6,所以还原剂和氧化剂的物质的量之比是5∶1,C错;反应③中
还原剂是氯气,氧化剂是溴酸钾,该反应中1 mol Cl2完全反应,氧化剂得到电子的物质的量为10 mol,D错。
变式3 下列实验操作与预期目的或所得结论一致的是 ( )
【答案】 BC
【解析】 硫酸酸化的H 2O 2溶液中,H 2O 2、N -3O 都能把Fe 2+氧化成Fe 3+
,A 错;在酸性条件下,Fe 2+
与N -3O 发生氧化还原反应,3Fe 2++N -3O +4H
+
3Fe 3+
+NO↑+2H 2O ,试管口出现红棕色气
体,为一氧化氮与氧气反应生成红棕色的二氧化氮,B 正确;Cu+2Fe
3+
Cu 2++2Fe 2+
,氧化剂的
氧化性强于氧化产物,C 正确;因还原性:Fe 2+
>Br -
,向含有少量FeBr 2的FeCl 2溶液中加入适量氯水,先将亚铁离子氧化,D 错。
“价态归中,互不交叉”
同种元素不同价态发生氧化还原反应时,归纳如下: ①价态相邻能共存(如浓硫酸能够干燥二氧化硫气体); ②价态相间能归中(2H 2S+SO 2
3S↓+2H 2O);
③归中价态不交叉,价升价降只靠拢。
考点4 氧化还原反应的配平步骤 【基础梳理】
【举题说法】
例题4 (1) (2015·安徽高考)配平化学方程式:
NaBO 2+ SiO 2+ Na+ H 2
NaBH 4+ Na 2SiO 3
(2) (2015·浙江高考)完成以下氧化还原反应的离子方程式:
Mn -4O + C 22-4O +
Mn 2+
+ CO 2↑+ H 2O
【答案】 (1) 1 2 4 2 1 2 (2) 2 5 16H +
2 10 8
【解析】 (1) 该反应中H 元素化合价由0价变为-1价、Na 元素化合价由0价变为+1价,根据转移电子守恒、原子守恒配平化学方程式为NaBO 2+2SiO 2+4Na+2H 2
NaBH 4+2Na 2SiO 3。(2) 此
反应中Mn 由+7价降低到+2价,得到5个电子,C 由+3价升高到+4价失去1个电子,2个C 失去2个电子,故高锰酸根与草酸根的化学计量数分别为2和5,据此配平得
2Mn -4O +5C 22-4O +16H
+2Mn 2+
+10CO 2↑+8H 2O 。
变式4 (1) 请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个化学方程式并配平:
+ + + + H2O
(2) 用KMnO4氧化溶质质量分数为36.5%的浓盐酸可制得氯气,其中锰被还原成+2价,试写出反应的化学方程式:。
(3) 硫能与浓硫酸发生反应,请写出该反应的化学方程式:。
(4) 完成并配平化学方程式:3H2O2+Cr2(SO4)3+10KOH2K2CrO4+ +
【答案】(1) 30HNO324FeSO48Fe(NO3)3
8Fe2(SO4)33N2O↑15
(2) 2KMnO4+16HCl(浓)2KCl+2MnCl2+5Cl2↑+8H2O
(3) S+2H2SO4(浓)3SO2↑+2H2O
(4) 3K2SO48H2O
【解析】(1) 所给的物质组合中,HNO3中氮元素位于最高价,具有氧化性,对应还原产物为N2O,能将具有还原性的FeSO4氧化为Fe2(SO4)3,根据化合价升降相等和原子守恒配平得
30HNO3+24FeSO48Fe(NO3)3+8Fe2(SO4)3+3N2O↑+15H2O。(2) Mn元素的化合价由+7价降低为+2价,KMnO4作氧化剂,HCl作还原剂,Cl元素的化合价由-1价升高为0价,生成氯气,由得失电子守恒及质量守恒可知,该反应为2KMnO4+16HCl2KCl+2MnCl2+5Cl2↑+8H2O。(3) S为0价,浓硫酸中S为+6价,根据化合价归中可知产物为+4价的二氧化硫,根据化合价升降相等和原子守恒配平得:S+2H2SO43SO2↑+2H2O。(4) Cr2(SO4)3作还原剂,Cr的化合价升高生成K2CrO4,因此H2O2作氧化剂,O的化合价降低生成水,根据原子守恒可知产物还有K2SO4,根据质量守恒配平得3H2O2+Cr2(SO4)3+10KOH2K2CrO4+3K2SO4+8H2O。
【题组训练】
1. 氯气通入含有亚铁离子的溶液中的离子方程式为。【答案】Cl2+2Fe2+2Fe3++2Cl-
2. 铜和稀硫酸不反应,往其中加入H2O2后溶液很快变成蓝色,反应的离子方程式为。
【答案】Cu+H2O2+2H+Cu2++2H2O
3. 过氧化氢加入硫酸亚铁溶液中的离子方程式为。
【答案】H2O2+2H++2Fe2+2Fe3++2H2O
4. FeSO4溶液在空气中变质的离子方程式为。
【答案】4Fe2++O2+4H+4Fe3++2H2O
5. 铜和稀硫酸不反应,向其中通入氧气后,反应的离子方程式为。【答案】2Cu+O2+4H+2Cu2++2H2O
6. 二氧化硫使溴水褪色的离子方程式为。
【答案】SO2+Br2+2H2O S
2-
4
O
+4H++2Br-
7. 用酸性KMnO4溶液检验Fe2(SO4)3溶液中混有的FeSO4,反应的离子方程式为。
【答案】Mn
-
4
O
+5Fe2++8H+Mn2++5Fe3++4H2O
8. 氯化铁和金属铜反应的化学方程式为。【答案】2FeCl3+Cu2FeCl2+CuCl2
9. 二氧化硫通入氯化铁溶液中的离子方程式为。
【答案】SO2+2Fe3++2H2O2Fe2++S
2-
4
O
+4H+
10. 二氧化硫通入酸性高锰酸钾溶液中的离子方程式为。
【答案】5SO2+2Mn
-
4
O
+2H2O2Mn2++5S
2-
4
O
+4H+
1. 氧化还原反应计算时,首先必须找全所有化合价变化的元素,不能缺漏,然后根据得失电子守恒(或化合价升降守恒)进行计算。
2. 氧化还原反应配平的一些特殊方法
整体配平法:有些复杂的氧化还原反应中同时有两种元素化合价升高或降低,或者一种反应物中有两种元素化合价发生变化,这时要进行整体配平。
零价配平法:一些无法用常规方法确定化合价的物质发生了氧化还原反应,令各元素化合价均为0价,然后计算出各元素化合价的升降值。
缺项配平法:所缺物质一般为水或酸、碱等介质,它们与化合价的升降变化无关,先配平发生氧化还原反应的物质,再根据质量守恒和电荷守恒配平其余的物质。
有机配平法:在有机反应中一般先假设H元素化合价为+1价,O元素化合价为-2价,然后再根据正、负化合价代数和为0确定有机物中C元素的化合价。
【随堂检测】
1. 下列关于氧化还原反应的说法正确的是( )
A. 得到电子的物质是还原剂
B. 置换反应一定是氧化还原反应
C. 得电子发生氧化反应
D. 原子失电子化合价降低
【答案】 B
【解析】得到电子的物质是氧化剂,A错;置换反应一定存在元素化合价的升降,为氧化还原反应,B正确;得电子发生还原反应,C错;原子失电子,化合价升高,被氧化,D错。
2. (2015·江阴五校联考)下列反应属于氧化还原反应,且水既不是氧化剂又不是还原剂的是
( )
A. 2Na+2H2O2NaOH+H2↑
B. 2F2+2H2O4HF+O2
C. CaO+H2O Ca(OH)2
D. Cl2+H2O HCl+HClO
【答案】 D
【解析】A中水是氧化剂,B中水是还原剂,C是非氧化还原反应,D中的氯气既是氧化剂又是还原剂,水既不是氧化剂又不是还原剂,D正确。
3. (2015·扬州期末)工业上通过2Al2O3+3C+6Cl
24AlCl3+3CO2制取无水氯化铝,下列说法正
确的是( )
A. AlCl3是氧化产物
B. Cl2是氧化剂
C. 每生成1 mol CO2,转移4个电子
D. C发生还原反应
【答案】 B
【解析】AlCl3是还原产物,A错;Cl2是氧化剂,B正确;每生成1 mol CO2,转移4 mol电子,C错;C元素失去电子,化合价升高,被氧化,发生氧化反应,D错。
4. (2015·上海高考)工业上将Na2CO3和Na2S以1∶2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。在该反应中( )
A. 硫元素既被氧化又被还原
B. 氧化剂与还原剂的物质的量之比为1∶2
C. 每生成1 mol Na2S2O3,转移4 mol电子
D. 相同条件下,每吸收10 m3 SO2就会放出2.5 m3 CO2
【答案】AD
【解析】由反应中S元素的化合价变化可知,硫元素既被氧化又被还原,A正确;
2Na2S+Na2CO3+4SO
23Na2S2O3+CO2中,Na2S为还原剂,SO2为氧化剂,则氧化剂与还原剂的物质的量之比为2∶1,B错;反应中每生成3 mol Na2S2O3,转移8 mol电子,则生成1 mol Na2S2O3,
转移8
3 mol电子,C错;根据化学方程式可知,每
4 mol SO
2参与反应就会放出1 mol CO2,则相
同条件下,每10 m3 SO2参与反应就会放出2.5 m3 CO2,D正确。
【问题思考和基础梳理答案】
【参考答案】
问题思考
问题1 不一定。判断一个反应是否是氧化还原反应,应从氧化还原反应的特征——反应前后是否有元素化合价的变化来判断,如果没有化合价的变化,则不是氧化还原反应,如3O22O3。
问题2 物质氧化性或还原性的强弱,不是看它得失电子数目的多少,而是得失电子能力的强弱。如同一主族的非金属单质,在反应中得电子数目相等,但氧化性并不相同;同一主族的金属单质,在反应中失电子数目相等,但还原性并不相同。钠在反应中失电子数少于镁,但钠的还原性大于镁;氯气在反应中得电子数小于氮气,但氯气的氧化性大于氮气。
基础梳理
考点1 电子化合价氧化还原非氧化还原反应前后元素化合价有无升降
考点2 1. (1) 元素化合价的变化电子的转移(2) 得到氧化性还原反应还原性氧化反应失去
2. (1) (2)
3. (1) X-H2O或OH-Mn2+SO2NO2或NO K2MnO4、MnO2或Mn2+FeSO4H2O或OH-
(2) H+或H2O CO或CO2CO2SO3或H2SO4S I2Na2SO4 Fe2(SO4)3
(3) 还原性氧化性
考点3 1. (1) 相等(2) 等于(3) 相等 2. 最强
考点4 化合价同种相等
趁热打铁,事半功倍。请老师布置同学们完成《配套检测与评估》中的练习第5~6页。
【课后检测】
课时3 氧化还原反应
1. (2015·南通中学期中)加入氧化剂能实现的转化是 ( )
A. MnO2→MnSO4
B. Na2O2→O2
C. KI→KIO3
D. AlCl3→Al(OH)3
2. 下列关于氧化还原反应的原理分析正确的是()
A. 失电子越多,该物质的还原性越强
B. 含有最高价元素的化合物一定具有强氧化性
C. 氧化剂氧化其他物质时,本身被还原
D. 某元素由化合态变成游离态一定被还原
3. (2015·扬州中学质检)以下化学反应不属于氧化还原反应的是( )
A. 2Na+2H2O2NaOH+H2↑
B. N2H4+O2N2+2H2O
C. FeO+2HCl FeCl2+H2O
D. NO+NO2+Na2CO32NaNO2+CO2
4. (2015·苏州模拟)下列应用不涉及氧化还原反应的是( )
A. Na2O2用作呼吸面具的供氧剂
B. 工业上电解熔融状态的Al2O3制备Al
C. 工业上利用热纯碱溶液清洗油污
D. 用焰色反应鉴定是否有钾元素存在
5. 下列反应能说明卤素非金属性强弱顺序是Cl>Br>I的是( )
①2HClO4+Br22HBrO4+Cl2
②2NaBr+Cl22NaCl+Br2
③2KI+Cl22KCl+I2
④2KI+Br22KBr+I2
A. ①②③
B. ①②④
C. ②③④
D. ①②③④
6. (2015·宿迁期中联考)氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C2AlN+3CO合成。下列叙述正确的是( )
A. 该反应中氧化剂与还原剂的物质的量之比为3∶1
B. AlN是还原产物
C. AlN的摩尔质量为41 g
D. 上述反应中,每生成1 mol AlN需转移6 mol电子
7. (2015·宿迁期中联考)下列反应中都有水参加,其中水既不作氧化剂,又不作还原剂的氧化还原反应是( )
A. 2Na+2H2O2NaOH+H2↑
B. Na2O+H2O2NaOH
C. Cl2+H2O HCl+HClO
D. NaH+H2O NaOH+H2↑(NaH中H为-1价)
8. FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是( )
A. 加入KSCN溶液一定不变红色
B. 溶液中一定含Fe2+
C. 溶液中一定含Cu2+
D. 剩余固体中一定含铜
9. (2015·南京期末)在FeCl3和CuCl2混合液中,加入一定量的铁粉,充分反应后,对溶液中阳离子(不考虑H+)的描述不正确的是( )
A. 容器底部没有固体,溶液中仅有Fe2+
B. 容器底部固体有铜和铁,溶液中只有Fe2+
C. 容器底部固体为铜,溶液中可能有Cu2+和Fe2+
D. 容器底部固体为铜和铁,溶液中有Cu2+和Fe2+
10. 在100 mL含等物质的量的HBr和H2SO3的混合液里通入0.01 mol Cl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。原溶液中HBr和H2SO3的物质的量浓度都等于( )
A. 0.007 5 mol·L-1
B. 0.008 mol·L-1
C. 0.075 mol·L-1
D. 0.08 mol·L-1
11. (2015·无锡期末)已知2FeCl 2+Cl 22FeCl 3;2NaBr+Cl 2
2NaCl+Br 2;
6FeCl 2+3Br 2
2FeBr 3+4FeCl 3。现将少量Cl 2通入到FeBr 2溶液中,请选出下列与事实对应的化
学方程式( ) A. FeBr 2+Cl 2FeCl 2+Br 2
B. 2FeBr 2+3Cl 22FeCl 3+2Br 2
C. 6FeBr 2+3Cl 22FeCl 3+4FeBr 3
D. 4FeBr 2+3Cl 22FeCl 2+2FeBr 3+Br 2
12. (2013·上海高考)已知氧化性:Br 2>Fe 3+
。FeBr 2溶液中通入一定量的Cl 2,发生反应的离子方程式为aFe 2+
+bBr -+cCl 2
dFe 3++eBr 2+fCl
-
下列选项中的数字与离子方程式中的a 、b 、c 、d 、e 、f 一一对应,其中不符合反应实际的是( )
A. 2 4 3 2 2 6
B. 0 2 1 0 1 2
C. 2 0 1 2 0 2
D. 2 2 2 2 1 4
13. (2014·全国大纲卷)已知:将Cl 2通入适量KOH 溶液,产物中可能有KCl 、KClO 、KClO 3,且
--c(Cl )
c(ClO )的值与温度高低有关。当n(KOH)=a mol 时,下列有关说法错误的是( )
A. 若某温度下,反应后--c(Cl )
c(ClO )=11,则溶液中
--3c(ClO )c(ClO )=12 B. 参加反应的氯气的物质的量等于1
2a mol
C. 改变温度,反应中转移电子的物质的量n e 的范围:12a mol≤n e ≤5
6a mol D. 改变温度,产物中KClO 3的最大理论产量为1
7a mol
14. (2015·上海高考)下列反应中的氨气与反应4NH 3+5O 24NO+6H 2O 中的氨气作用相同的是
( ) A. 2Na+2NH 32NaNH 2+H 2 B. 2NH 3+3CuO 3Cu+N 2+3H 2O C. 4NH 3+6NO 5N 2+6H 2O D. 3SiH 4+4NH 3Si 3N 4+12H 2
15. (2014·上海高考)用FeCl 3溶液腐蚀印刷电路板上的铜,向所得溶液中加入铁粉,对加入铁粉充分反应后的溶液分析合理的是( ) A. 若无固体剩余,则溶液中一定有Fe 3+
B. 若有固体存在,则溶液中一定有Fe
2+
C. 若溶液中有Cu 2+
,则一定没有固体析出 D. 若溶液中有Fe 2+
,则一定有Cu 析出
16. 从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO 4+5FeS 2+12H 2O
7Cu 2S+5FeSO 4+12H 2SO 4下列说法正确的是( )
A. Cu 2S 既是氧化产物又是还原产物
B. 5 mol FeS 2发生反应,有10 mol 电子转移
C. 产物中的S 2-4O 有一部分是氧化产物
D. FeS 2只作还原剂
17. (2015·无锡模拟)某稀硫酸和稀硝酸的混合溶液200 mL ,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g ;向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是( )
A. 原混合酸中N -3O 的物质的量浓度为2 mol·L
-1
B. OA 段产生的是NO ,AB 段的反应为Fe+2Fe
3+
3Fe 2+
,BC 段产生的是氢气
C. 第二份溶液中最终溶质为FeSO 4
D. 原混合酸中H 2SO 4的物质的量浓度为2.5 mol·L -1
18. 某反应的反应物和产物如下:KMnO 4+KI+H 2SO 4——MnSO 4+I 2+KIO 3+K 2SO 4+H 2O 。 (1)该反应的氧化剂是 。
(2)如果该反应的化学方程式中I 2和KIO 3的化学计量数都是5,则: ①KMnO 4的化学计量数是 。
②配平上面的化学方程式,并用单线桥法标出电子转移的方向和数目: 。
19. (2015·姜堰期末)结合氯气的相关知识解决下列问题。
(1)在实验室中制取Cl 2,下列收集Cl 2的装置正确的是 (填字母)。
将Cl 2通入水中,所得溶液中具有氧化性的含氯粒子有 。
(2)氯气可用于生产漂白粉。由于盐酸浓度不同,漂白粉与盐酸混合发生反应的反应类型不同。
漂白粉与稀盐酸发生复分解反应,离子方程式为 。 漂白粉与浓盐酸发生氧化还原反应,离子方程式为 。 (3)某实验小组向100 mL FeI 2溶液中逐渐通入Cl 2,会依次发生如下反应: a. Cl 2+2I
-
2Cl -
+I 2
b. Cl 2+2Fe 2+
2Cl -+2Fe
3+
c. 5Cl 2+I 2+6H 2O
10Cl -
+2I -3O +12H
+ 其中Fe 3+
、I 2的物质的量随n(Cl 2)的变化如下图所示。
2017年高考化学真题分类汇编(13个专题)及5套高考试卷烃
专题9 有机化合物 Ⅰ—生活中常见的有机物 1.(2017?北京-7)古丝绸之路贸易中的下列商品,主要成分属于无机物的是 A.瓷器B.丝绸C.茶叶D.中草药 A.A B.B C.C D.D 【答案】A 【解析】含有碳元素的化合物为有机物,有机物大多数能够燃烧,且多数难溶于水;无机 物指的是不含碳元素的化合物,无机物多数不能燃烧,据此分析。 A、瓷器是硅酸盐产品,不含碳元素,不是有机物,是无机物,故A正确; B、丝绸的主要成分是蛋白质,是有机物,故B错误; C、茶叶的主要成分是纤维素,是有机物,故C错误; D、中草药的主要成分是纤维素,是有机物,故D错误。 【考点】无机化合物与有机化合物的概念、硅及其化合物菁优网版权所有 【专题】物质的分类专题 【点评】本题依托有机物和无机物的概念考查了化学知识与生活中物质的联系,难度不大,应注意有机物中一定含碳元素,但含碳元素的却不一定是有机物。 Ⅱ—有机结构认识 2.(2017?北京-10)我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如下。下列说法不正确的是 A.反应①的产物中含有水 B.反应②中只有碳碳键形式
C.汽油主要是C5~C11的烃类混合物 D.图中a的名称是2﹣甲基丁烷 【答案】B 【解析】A.从质量守恒的角度判断,二氧化碳和氢气反应,反应为CO2+H2=CO+H2O,则产物中含有水,故A正确; B.反应②生成烃类物质,含有C﹣C键、C﹣H键,故B错误; C.汽油所含烃类物质常温下为液态,易挥发,主要是C5~C11的烃类混合物,故C正确;D.图中a烃含有5个C,且有一个甲基,应为2﹣甲基丁烷,故D正确。 【考点】碳族元素简介;有机物的结构;汽油的成分;有机物的系统命名法菁优网版权【专题】碳族元素;观察能力、自学能力。 【点评】本题综合考查碳循环知识,为高频考点,侧重考查学生的分析能力,注意把握化 学反应的特点,把握物质的组成以及有机物的结构和命名,难度不大。 C H, 3.(2017?新课标Ⅰ-9)化合物(b)、(d)、(p)的分子式均为66 下列说法正确的是 A. b的同分异构体只有d和p两种 B. b、d、p的二氯代物均只有三种 C. b、d、p均可与酸性高锰酸钾溶液反应 D. b、d、p中只有b的所有原子处于同一平面 【答案】D 【解析】A.(b)的同分异构体不止两种,如,故A错误 B.(d)的二氯化物有、、、、、, 故B错误 KMnO溶液反应,故C错误 C.(b)与(p)不与酸性4 D.(d)2与5号碳为饱和碳,故1,2,3不在同一平面,4,5,6亦不在同 一平面,(p)为立体结构,故D正确。 【考点】有机化学基础:健线式;同分异构体;稀烃的性质;原子共面。 【专题】有机化学基础;同分异构体的类型及其判定。 【点评】本题考查有机物的结构和性质,为高频考点,侧重考查学生的分析能力,注意把 握有机物同分异构体的判断以及空间构型的判断,难度不大。 Ⅲ—脂肪烃
2017高考化学 全国II卷 解析版
2017年普通高等学校招生全国统一考试 化学试题(全国II) 7.下列说法错误的是 A.糖类化合物也可称为碳水化合物 B.维生素D可促进人体对钙的吸收 C.蛋白质是仅由碳、氢、氧元素组成的物质 D.硒是人体必需的微量元素,但不宜摄入过多 【解析】 A.糖类化合物也可称为碳水化合物,是沿用下来的叫法,故A正确; B.维生素D可促进人体对钙的吸收,故B正确; C.蛋白质含有C、H、O、N、S等元素,故C错误; D.硒是人体必需的微量元素,但不宜摄入过多,摄入过多可能会导致脱发等,故D正确; 【答案】C 8.阿伏加德罗常数的值为A N。下列说法正确的是 NH+的数量为0.1A N A.1 L 0.1 mol·1L-NH4Cl溶液中,4 B.2.4 g Mg与H2SO4完全反应,转移的电子数为0.1A N C.标准状况下,2.24 L N2和O2的混合气体中分子数为0.2A N D.0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2A N 【解析】 A.NH4+能够发生水解,故NH4+的数量小于0.1N A,故A错误; B. 2.4 g Mg与H2SO4完全反应,转移的电子数为0.2N A,故B错误; C.标准状况下,2.24LN2和O2的混合气体的物质的量为0.1mol,故混合气体的分子数为0.1N A; D. H 2+ I2 2HI,反应前后气体分子数不变,故其分子总数为0.2N A,故D正确; 【答案】D 9.a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;
d与a同族。下列叙述正确的是 A.原子半径:d>c>b>a B.4种元素中b的金属性最强C.c的氧化物的水化物是强碱 D.d单质的氧化性比a 单质的氧化性强 【解析】 a、b、c、d为短周期主族元素,且a原子核外电子总数与b原子次外层的电子数相同,故a为O,d与a同族,故d为S,c所在周期数与族数相同,故c为Al,则b为Na或Mg; A.原子半径b>c>d>a,故A错误; B.4种元素种b的失电子能力最强,故其金属性最强,故B正确; C.c的氧化物的水化物是氢氧化铝,为两性氢氧化物,故C错误; D.O2的氧化性强于S,故D错误; 【答案】B 10 A.乙烯和溴发生加成反应生成1,2-二溴乙烷,结论正确,故A正确; B.乙醇和水都可与金属钠反应产生可燃性气体,但钠反应更剧烈,故乙醇分子中的氢与水分子中的氢活性不同,故B错误; C.用乙酸浸泡水壶中的水垢,可将其清楚,利用的是强酸制弱酸,故乙酸的酸性强于碳酸,故C错误; D.甲烷和氯气在光照下反应后的混合气体中含有HCl能够使湿润的
高三数学南方凤凰台高2021届高2018级高三一轮数学提高版完整版学案第一章
第1讲 集合及其运算 A 应知应会 一、 选择题 1. (2019·全国卷Ⅱ)设集合A ={x |x 2-5x +6>0},B ={x |x -1<0},则A ∩B 等于( ) A. (-∞,1) B. (-2,1) C. (-3,-1) D. (3,+∞) 2. (2019·全国卷Ⅲ)已知集合A ={-1,0,1,2},B ={x |x 2≤1},则A ∩B 等于( ) A. {-1,0,1} B. {0,1} C. {-1,1} D. {0,1,2} 3. (2019·宁德质检)已知集合A ={x |x ≥1},B ={x |x 2-2x -3<0},则A ∪B 等于( ) A. {x |1≤x <3} B. {x |x >-1} C. {x |1 B 巩固提升 一、 填空题 1. (2018·南通模拟)已知集合A ={0,e x },B ={-1,0,1},若A ∪B =B ,则x =________. 2. (2018·青岛模拟)设集合A ={x |(x +3)(x -6)≥0},B =? ??? ??x |2x ≤14 ,则(?R A )∩B =________. 3. (2019·张家口期末)已知全集U =Z,A ={x |x =3n -1,n ∈Z},B ={x ||x |>3,x ∈Z},则A ∩(?U B )中元素的个数为________. 4. (2019·深圳调研)已知集合M ={x |x >0},N ={x |x 2-4≥0},则M ∪N =________. 二、 解答题 5. 设集合U ={2,3,a 2+2a -3},A ={|2a -1|,2},?U A ={5},求实数a 的值. 6. 已知全集S ={1,3,x 3+3x 2+2x },A ={1,|2x -1|},如果?S A ={0},则这样的实数x 是否存在?若存在,请说明理由. 杨浦区2016学年度第一学期高中等级考质量调研 高三年级生命科学学科试卷 本试卷共8页。满分100分。考试时间为60分钟。请在答题纸上填写学校、姓名、准考证号,并将核对后的条形码贴在指定位置上。答案全部涂、写在答題纸上,不要超过答题框,否则不得分。 一. 单选题(共40分。每小题只有一个正确选项) 1. 构成细胞内生命物质的主要有机成分是 A .蛋白质和核酸 B .糖类和蛋白质 C .蛋白质和脂质 D .糖类和核酸 2. 如图是细胞发生的一系列变化过程,有关分析正确的是 A . 过程①表示细胞生长 B . 过程②表示细胞分化 C . 过程②染色体数会减半 D . 过程③表示细胞分裂 3. 在电子显微镜下,颤藻和水稻叶肉细胞中都能被观察到的结构是 A .叶绿体和液泡 B .内质网和核糖体 C .核糖体和细胞膜 D .细胞核和线粒体 4. 将紫色洋葱表皮细胞置于30%的蔗糖溶液中,光镜下所能看到的现象是 ①区域1扩大 ②区域1缩小 ③区域2紫色变浅 ④区域2紫色加深 ⑤原生质层与细胞壁逐渐分离 ⑥细胞膜、液泡膜结构清晰 A . ①③⑤ B . ①④⑤ C . ②④⑤ D . ①④⑥ 5. 下列关于测量蚕豆叶下表皮保卫细胞长度的实验操作,正确的是 A .要使视野的右下方物像移到视野中央,须将装片移向左上方 B .从低倍镜转到高倍镜时,轻轻地转动物镜使高倍镜到位 C .高倍镜放大了观察视野,增大了放大倍数 D .测量细胞长度时,应尽量使目镜测微尺与被测细胞平行并重叠 6. 剧烈运动时人体骨骼肌细胞进行呼吸作用,下列叙述中,错误..的是 A .人剧烈运动时骨骼肌能同时产生乳酸和CO 2 B .该细胞有氧呼吸产物与酵母菌有氧呼吸的产物相同 C .会使溴代麝香草酚蓝水溶液的颜色发生蓝→绿→黄的变化 D .该细胞呼吸产物与乳酸菌细胞呼吸的产物相同 7. 下列化学反应属于氧化分解反应的是 ①核酸→核苷酸 ②葡萄糖→丙酮酸 ③麦芽糖→葡萄糖 ④丙酮酸→二碳化合物+水 1 2 2017年江苏化学高考试题及含答案 2017年普通高等学校招生全国统一考试(江苏卷) 化学 注意事项 考生在答题前请认真阅读本注意事项及各题答题要求 1.本卷满分为120分,考试时间为100分钟。考试结束后,请将本试卷和答题卡一并交回。 2.答题前,请务必将自己的姓名、准考证号用0.5毫米黑色墨水的签字笔填写在试卷及答题卡的规定位置。3.请认真核对监考员在答题卡上所粘贴的条形码上的姓名、准考证号与本人是否相符。 4.作答选择题,必须用2B铅笔将答题卡上对应选项的方框涂满、涂黑;如需改动,请用橡皮擦干净后,再选涂其他答案。学科.网作答非选择题,必须用0.5毫米黑色墨水的签字笔在答题卡上的指定位置作答,在其他位置作答一律无效。 5.如需作图,须用2B铅笔绘、写清楚,线条、符号等须加黑、加粗。 可能用到的相对原子质量: H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 K 39 Ca 40 Mn 55 Fe 56 Cu 64 Zn 65 Ag 108 选择题 单项选择题:本题包括10小题,每小题2分, 共计20 分。每小题只有一个 ....选项符合题意。 1. 2017 年世界地球日我国的主题为“节约集约利用资源,倡导绿色简约生活”。下列做法应提倡的是 A.夏天设定空调温度尽可能的低 B.推广使用一次性塑料袋和纸巾 C.少开私家车多乘公共交通工具 D.对商品进行豪华包装促进销售 2. 下列有关化学用语表示正确的是 A. 质量数为31的磷原子: 3115P B. 氟原子的结构示意图: C. CaCl 2的电子式: D.明矾的化学式: Al2(SO4)3 3. 下列有关物质性质与用途具有对应关系的是 A. Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂 B. ClO2具有还原性,可用于自来水的杀菌消毒 C. SiO2硬度大,可用于制造光导纤维 D. NH3易溶于水,可用作制冷剂 4.下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是 第八章 解析几何 第41讲 直线的斜率与方程 A 应知应会 一、 选择题 1. (2019·开封模拟)过点A (-1,-3),斜率是直线y =3x 的斜率的-1 4 的直线方程为 ( ) A. 3x +4y +15=0 B. 3x +4y +6=0 C. 3x +y +6=0 D. 3x -4y +10=0 2. 直线2x cos α-y -3=0??? ?α∈????π6,π3 的倾斜角的取值范围是 ( ) A. ????π6,π3 B. ????π4,π3 C. ????π4,π2 D. ????π4,2π 3 3. (2019·湖北四地七校联考)已知函数f (x )=a sin x -b cos x (a ≠0,b ≠0),若f ????π4-x =f ????π4+x ,则直线ax -by +c =0的倾斜角为( ) A. π4 B. π3 C. 2π3 D. 3π 4 4. 如果A ·C <0且B ·C <0,那么直线Ax +By +C =0不通过( ) A. 第一象限 B. 第二象限 C. 第三象限 D. 第四象限 5. (2019·张家口模拟)若直线mx +ny +3=0在y 轴上的截距为-3,且它的倾斜角是直线3 x -y =33 的倾斜角的2倍,则( ) A. m =-3 ,n =1 B. m =-3 ,n =-3 C. m =3 ,n =-3 D. m =3 ,n =1 二、 解答题 6. 求过点A (1,3),斜率是直线y =-4x 的斜率的1 3 的直线方程. 7. 求适合下列条件的直线方程. (1) 经过点P(3,2),且在两坐标轴上的截距相等; (2) 求过点(2,1)且在x轴上的截距与在y轴上的截距之和为6的直线方程. B巩固提升 一、填空题 1. 直线x+3y+1=0的倾斜角是________. 2. 过点P(2,3)且在两坐标轴上截距相等的直线方程为________. 3. 已知直线l:(a-2)x+(a+1)y+6=0,则直线l恒过定点________. 4. (2019·江苏姜堰中学)已知△ABC的三个顶点A(-5,0),B(3,-3),C(0,2),则BC边上中线所在的直线方程为________. 二、解答题 5. (2019·启东检测)已知直线l:(2+m)x+(1-2m)y+4-3m=0. (1) 求证:不论m为何实数,直线l过一定点M; (2) 过定点M作一条直线l1,使夹在两坐标轴之间的线段被M点平分,求直线l1的方程. 6. 如图,射线OA,OB分别与x轴正半轴成45°和30°角,过点P(1,0)作直线AB分别交 OA,OB于A,B两点,当AB的中点C恰好落在直线y=1 2x上时,求直线AB的方程. (第6题) 2017年杨浦区区高考数学一模试卷含答案 2016.12 一、填空题(本大题满分54分)本大题共有12题,1-6每题4分,7-12每题5分。 1、若“a b >”,则“33 a b >”是 命题。(填:真,假) 2、已知(],0A =-∞,(),B a =+∞,若A B R = ,则a 的取值范围是 。 3、294z z i +=+(i 为虚数单位),则z = 。 4、若ABC ?中,4a b +=,o 30C ∠=,则ABC ?面积的最大值是 。 5、若函数()2 log 1 x a f x x -=+的反函数的图像过点()2,3-,则a = 。 6、过半径为2的球O 表面上一点A 作球O 的截面,若OA 与该截面所成的角是o 60,则该截面的面积是 。 7、抛掷一枚均匀的骰子(刻有12345,6, ,,,)三次,得到的数字以此记作,,a b c ,则a bi +(i 为虚数单位)是方程2 20x x c -+=的根的概率是 。 8、设常数0a >,9 ()a x x + 展开式中6x 的系数为4,则()2lim n n a a a →∞ +++= 。 9、已知直线l 经过点() 5,0-且方向向量为()2,1-,则原点O 到直线l 的距离为 。 10、若双曲线的一条渐近线为20x y +=,且双曲线与抛物线2 y x =的准线仅有一个公共点,则此双曲线的标准方程为 。 11、平面直角坐标系中,给出点()1,0A ,()40B ,,若直线10x my +-=上存在点P ,使得 2PA PB =,则实数m 的取值范围是 。 12、函数()y f x =是最小正周期为4的偶函数,且在[]2.0x ∈-时,()21f x x =+,若存在 12,,,n x x x 满足120n x x x ≤<<< , 且 ()()()()()()122312016n n f x f x f x f x f x f x --+-++-= ,则n n x +最小值 为 。 二、选择题(本大题满分20分) 2017全国统一高考化学试题及答案(新课标1卷) 2017年普通高等学校招生全国统一考试 化学试题及答案(新课标1卷) 注意事项: 1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。 2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上,写在本试卷上无效。。 3.考试结束后,将本试卷和答题卡一并交回。 可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 K 39 Ti 48 Fe 56 I 127 一、选择题:本题共13个小题,每小题6分,共78分。 在每小题给出的四个选项中,只有一项是符合题目 要求的。 7.下列生活用品中主要由合成纤维制造的是 A.尼龙绳B.宣纸C.羊绒衫D.棉衬衣 8.《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。” 文中涉及的操作方法是 A.蒸馏B.升华C.干馏D.萃取 9.已知(b)、(d)、(p)的分子式均为C6H6,下列说法正确的是 A.b的同分异构体只有d和p两种 B.b、d、p的二氯代物均只有三种 C.b、d、p均可与酸性高锰酸钾溶液反应 D.b、d、p中只有b的所有原子处于同一平面10.实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液 用于吸收少量氧气),下列说法正确的是 A.①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液 B.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度 C.结束反应时,先关闭活塞K,再停止加热 D.装置Q(启普发生器)也可用于二氧化锰与浓 盐酸反应制备氯气 第二章 基本初等函数 第6讲 函数的概念及其表示方法 A 组 应知应会 一、 选择题 1. (2019·北京一模)已知函数f (x )=x 3-2x ,则f (3)等于( ) A. 1 B. 19 C. 21 D. 35 2. (2019·石家庄二模)设集合M ={x |0≤x ≤2},N ={y |0≤y ≤2},给出如下四个图形,其中能表示从集合M 到集合N 的函数关系的是( ) A B C D 3. (2019·厦门质检)已知函数f (x )=???? ?3x ,x ≤0,-????12x ,x >0, 则f (f (log 23))等于( ) A. -9 B. -1 C. -13 D. -1 27 4. (2019·河南名校段测)设函数f (x )=?????log 3x ,0<x ≤9,f (x -4),x >9, 则f (13)+2f ????13 的值为( ) A. 1 B. 0 C. -2 D. 2 5. (2019·河北衡水)若函数y =x 2-3x -4的定义域为[0,m ],值域为??? ?-25 4,-4 ,则实数m 的取值范围是( ) A. (0,4] B. ????32,4 C. ????32,+∞ D. ??? ?3 2,3 二、 解答题 6. (1) 已知f (x )是二次函数且f (0)=2,f (x +1)-f (x )=x -1,求f (x )的解析式. (2) 已知函数f (x )的定义域为(0,+∞),且f (x )=2f ???? 1x ·x -1,求f (x )的解析式. 7. 已知 f (x )=x 2-1, g (x )=? ?? ??x -1,x >0,2-x ,x <0. (1) 求f (g (2))和g (f (2))的值; (2) 求f (g (x ))和g (f (x ))的表达式. 杨浦区2016学年第一学期期末期末质量调研 初三英语练习卷2017.1 (满分150分,考试时间100分钟) (本卷有七大题,共94小题。试题均采用连续编号。所有答案务必按照规定在答题纸上完成,做在试卷 上不给分。) Part 1 Listening (第一部分听力) I. Listening Comprehension (听力理解)(共30分) A. Listen and choose the right picture (根据你所听到的内容,选出相应的图片)(6分) 1._______ 2. _______ 3._______ 4. _______ 5. _______ 6._______ B. Listen to the dialogue and choose the best answer to the question you hear (根据你所听到的对话和问题,选择最恰当的答案)(8分) 7. 8. A) Shy. B) Pretty. C) Serious. D) Active. 8. A) A teacher. B) A TV host. C) A bank clerk D) A writer. 9. A) 2:00. B) 2:15. C) 2:30. D) 2:45. 10. A) By check. B) By cash. C) By credit card. D) By Apple Pay. 11. A) A TV guide. B) A part-time job. C) A plan for movies D)A choices of courses 12. A) The shoes are too heavy. C) She doesn’t like the shoes. B) Cookies. B) The ground is wet. D) It is raining outside. 13. A) Some Chinese were hit by local people. C) Some tourists were killed in a flash flood. B) An earthquake occurred there last night. D) Some tourists were injured in a car accident. 14. A) A good website helped Alina get some customers. B) Alina helps people by donating clothes and furniture. C) Alina borrowed money from the bank to start her business. D) Alina’s business is to give people advice on creati ng website. 2017年高考化学真题全国卷Ⅲ 理科综合能力测试(化学部分) 可能用到的相对原子质量:H-1 Li-7 C-12 N-14 O-16 S-32 K-39 Cr-52 Mn-55 Fe-56 第?卷 7(化学与生活密切相关。下列说法错误的是( ) A(PM2.5是指粒径不大于2.5 μm的可吸入悬浮颗粒物 B(绿色化学要求从源头上消除或减少生产活动对环境的污染 C(燃煤中加入CaO可以减少酸雨的形成及温室气体的排放 D(天然气和液化石油气是我国目前推广使用的清洁燃料 8(下列说法正确的是( ) A(植物油氢化过程中发生了加成反应 B(淀粉和纤维素互为同分异构体 C(环己烷与苯可用酸性KMnO溶液鉴别 4 D(水可以用来分离溴苯和苯的混合物 9(下列实验操作规范且能达到目的的是( ) 目的操作 在50 mL酸式滴定管中装入盐酸,调整初始读数为A 取20.00 mL盐酸 30.00 mL后,将剩余盐酸放入锥形瓶 清洗碘升华实验所用试管先用酒精清洗,再用水清洗 B 测定醋酸钠溶液pH 用玻璃棒蘸取溶液,点在湿润的pH试纸上 C 固体0.158 g,放入100 mL容量瓶中,称取KMnO4-1D 配制浓度为0.010 mol?L的KMnO溶液 4加水溶解并稀释至刻度 10(N为阿伏加德罗常数的值。下列说法正确的是( ) A11A(0.1 mol 的B中,含有0.6N个中子 A+B(pH=1的HPO溶液中,含有0.1N个H 34A C(2.24 L(标准状况)苯在O中完全燃烧,得到0.6N个CO分子 2A2 D(密闭容器中1 mol PCl与1 mol Cl反应制备 PCl(g),增加2N个P-Cl325A 键 11(全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a 常用掺有石墨烯的S材料,电池反应为:16Li+xS = 8LiS(2?x?8)。下列说法错882x误的是( ) - 1 - +-A(电池工作时,正极可发生反应:2LiS+2Li+2e = 3LiS2624 B(电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g C(石墨烯的作用主要是提高电极a的导电性 D(电池充电时间越长,电池中的LiS量越多 22 12(短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外电子数纸盒为21。下列关系正确的是( ) W X Y Z A(氢化物沸点:W 绝密★启用前 2017年普通高等学校招生全国统一考试 理科综合能力测试 注意事项: 1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。 2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上,写在本试卷上无效。。 3.考试结束后,将本试卷和答题卡一并交回。 可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl35.5 K39 Ti 48 Fe 56 I 127 一、选择题:本题共13个小题,每小题6分。在每小题给出的四个选项中,只有一项是符 合题目要求的。 1. 细胞间信息交流的方式有多种。在哺乳动物卵巢细胞分泌的雌激素作用于乳腺细胞的过程中,以及精子进入卵细胞的过程中,细胞间信息交流的实现分别依赖于 A. 血液运输,突触传递 B. 淋巴运输,突触传递 C. 淋巴运输,胞间连丝传递 D. 血液运输,细胞间直接接触 2. 下列关于细胞结构与成分的叙述,错误的是 A. 细胞膜的完整性可用台盼蓝染色色法进行检测 B. 检测氨基酸的含量可用双缩脲试剂进行显色 C. 若要观察处于细胞分裂中期的染色体可用醋酸洋红液染色 D. 斐林试剂是含有Cu2+的碱性溶液,可被葡萄糖还原成砖红色 3. 通常,叶片中叶绿素含量下降可作为其衰老的检测指标。为研究激素对叶片衰老的影响,将某植物离体叶片分组,并分别置于蒸馏水、细胞分裂素(CTK)、脱落酸(ABA)、CTK+ABA溶液中,再将各组置于光下。一段时间内叶片中叶绿素含量变化趋势如图所示,据图判断,下列叙述错误的是 第三章 导数及其应用 第15讲 导数的几何意义和四则运算 A 应知应会 一、 选择题 1. 已知f (x )=x (2 018+ln x ),若f ′(x 0)=2 019,则x 0等于( ) A. e 2 B. 1 C. ln 2 D. e 2. 若函数f (x )= 33 x 3 +ln x -x ,则曲线y =f (x )在点(1,f (1))处的切线的倾斜角是( ) A. π6 B. π3 C. 2π3 D. 5π6 3. 已知函数f (x )=ln (x +1)·cos x -ax 在(0,f (0))处的切线倾斜角为45°,则a 等于( ) A. -2 B. -1 C. 0 D. 3 4. (2019·泰安一模)已知函数f (x )满足f ????x 2 =x 3-3x ,则函数f (x )的图象在x =1处的切线斜率为( ) A. 0 B. 9 C. 18 D. 27 5. 已知曲线y =sin x 在点P (x 0,sin x 0)(0≤x 0≤π)处的切线为l ,则下列各点中不可能在直线l 上的是( ) A. (-1,-1) B. (-2,0) C. (1,-2) D. (4,1) 二、 解答题 6. 求下列函数的导数. (1) y =5 x 3 ; (2) y =1x 4 ; (3) y =-2sin x 2 ? ???1-2cos 2x 4 ; (4)y =log 2x 2-log 2x . 7. 已知曲线y =x 3+x -2在点P 0处的切线l 1平行于直线4x -y -1=0,且点P 0在第三象限. (1) 求P 0的坐标; (2) 若直线l ⊥l 1,且l 也过切点P 0,求直线l 的方程. 2017年高考真题化学试题 全国Ⅱ卷 7.(2017·全国卷Ⅱ)下列说法错误的是( ) A .糖类化合物也可称为碳水化合物 B .维生素D 可促进人体对钙的吸收 C .蛋白质是仅由碳、氢、氧元素组成的物质 D .硒是人体必需的微量元素,但不宜摄入过多 [答案]C [详解]蛋白质基本组成元素是碳、氢、氧、氮,有些蛋白质含包括硫、磷等元素。 8.(2017·全国卷Ⅱ)阿伏加德罗常数的值为A N 。下列说法正确的是( ) A .1L0.1mol·1 L -NH 4Cl 溶液中,4NH + 的数量为0.1A N B .2.4gMg 与H 2SO 4完全反应,转移的电子数为0.1A N C .标准状况下,2.24LN 2和O 2的混合气体中分子数为0.2A N D .0.1mol H 2和0.1mol I 2于密闭容器中充分反应后,其分子总数为0.2A N [答案]D [详解]A 、因铵根离子水解,其数量小于0.1N A ,A 错误;B 、2.4gMg 为0.1mol ,完全反应转移的电子为0.2N A ,B 错误;C 、标准状况下,2.24L 任何气体所含有的分子数都为0.1N A ,C 错误;D 、虽然0.1mol H 2和0.1mol I 2于密闭容器中不能完全反应,但因该反应是气体分子数不变的反应,其分子总数一定为0.2A N ,正确。 9.(2017·全国卷Ⅱ)a,b,c,d 为原子序数依次增大的短周期主族元素,a 原子核外电子总数与b 原子次外层的电子数相同;c 所在周期数与族数相同;d 与a 同族,下列叙述正确的是( ) A .原子半径:d>c>b>a B .4种元素中b 的金属性最强 C .c 的氧化物的水化物是强碱 D .d 单质的氧化性比a 单质的氧化性强 [答案]B [详解] a 、b 、c 、d 原子序数依次增大,由a 核外电子数与b 的次外层相同,只能为2或8,则a 为He 或O ,但He 不是主族元素,则a 为氧元素;又因为a 、d 同主族,则d 为硫元素;c 原子周期数等于族序数,且在8~16之间,则c 为Al 元素;b 序数在8~13之间且为第三周期,则b 是Na 或Mg ;故a 、b 、c 、d 分别 2017全国1卷理综化学试题及答案 2017年高考全国Ⅰ卷理科综合化学试题 对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 K 39 Ti 48 Fe 56 I 127 一、选择题: 7.下列生活用品中主要由合成纤维制造的是 A.尼龙绳B.宣纸C.羊绒衫D.棉衬衣 8.《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是 A.蒸馏B.升华C.干馏D.萃取 9.已知(b)、(d)、(p)的分子式均为C6H6,下列说法正确的是 A.b的同分异构体只有d和p两种 B.b、d、p的二氯代物均只有三种 C.b、d、p均可与酸性高锰酸钾溶液反应 D.b、 d、p中只有b的所有原子处于同一平面 10.实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。下列说法正确的是 A. ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液 B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度 C. 结束反应时,先关闭活塞K,再停止加热 D. 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气 与 2 (HX )lg (H X)c c -的变化关系 C. NaHX 溶液中(H )(OH )c c +-> D. 当混合溶液呈中性时,2(Na )(HX )(X )(OH )(H )c c c c c +- --+>>>= 26.(15分) 凯氏定氮法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量。已知: NH 3+H 2BO 3=NH 3·H 3BO 3;NH 3·H 3BO 3+HCl= NH 4Cl+H 3BO 3。 回答下列问题: (1)a 的作用是_________________________________。 (2)b 中放入少量碎瓷片的目的是______________________________。f 的名称是_______________。 (3)清洗仪器:g 中加蒸馏水;打开K 1,关闭K 2、K 3,加热b ,蒸气充满管路;停止加热,关闭K 1,g 中蒸馏水倒吸入c ,原因是_________________________________________________________________; 打开K 2放掉水。重复操作2~3次。 (4)仪器清洗后,g 中加入硼酸(H 3BO 3)和指示剂。铵盐试样由d 注入e ,随后注入氢氧化钠溶液,用蒸馏水冲洗d ,关闭K 3,d 中保留少量水。打开K 1,加热b ,使水蒸气进入e 。 ①d 中保留少量水的目的是___________________________________________________________ ②e 中主要反应的离子方程式为 杨浦区2017学年度第一学期高中等级考模拟质量调研 高三年级化学学科试卷2017.12 相对原子质量:H-1 C-12 N-14 O-16 Br-80 Ag-108 一、选择题(本题共40分,每小题2分,只有一个正确答案) 1.对291117Ts中数字的叙述正确的是 A.291是Ts元素的相对原子质量B.291是Ts元素的质量数 C.117是291117Ts的质子数D.117是291117Ts的中子数 2.漂粉精暴露在潮湿的空气中易失效其原因与下列叙述无关的是()A.HClO的酸性比和H2CO3弱B.次氯酸钙能与碳酸反应 C.HClO见光易分解D.Ca(ClO)2是正盐 3.石油分馏的原理是利用物质的() A.沸点差异B.密度差异C.溶解度差异D.化学性质差异 4.离子晶体具有的性质是() A.易导热B.易融化C.熔化状态下导电D.有延展性 5.下列有关本的说法,错误的是() A.分子中所有原子共平面B.分子中无碳碳双键、碳碳单键 C.不能发生加成反应D.能发生取代反应 6.工业上仅以食盐和水为原料,不能得到了产品是() A.烧碱B.NaClO溶液C.盐酸D.氮肥NH4Cl 7.两个容积相同的容器中分别盛有O2和空气,在同温、同压下,两容器中的气体一定具有相同的() A.原子数B.分子数C.质量D.密度8.反应物X生成Z的能量变化如图所示,该反应的热化学方程式为() A.2X(g)→Z(g)+(a-b)kJ B.2X(g)→Z(g)+(b-a)kJ C.2X(g)→Z(g)+(c-a)kJ D.2X(g)→Z(g)+(b-c)kJ 9.对NH3有关性质的描述,错误的是() A.NH3极易溶于水 B.NH3具有还原性 C.NH3在一定条件下能分解 D.右图中浓盐酸换成浓硫酸时现象相同 1.下列生活用品中主要由合成纤维制造的是 A.尼龙绳 B.宣纸 C.羊绒衫 D.棉衬衣 2.《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是 A.蒸馏 B.升华 C.干馏 D.萃取 3.化合物(b)、(d)、(p)的分子式均为C6H6,下列说法正确的是A.b的同分异构体只有d和p两种 B.b、d、p的二氯代物均只有三种 C.b、d、p均可与酸性高锰酸钾溶液反应 D.b、d、p中只有b的所有原子处于同一平面 4.实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是 A.①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液 B.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度 C.结束反应时,先关闭活塞K,再停止加热 D.装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气 5.支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是 A.通入保护电流使钢管桩表面腐蚀电流接近于零 B.通电后外电路电子被强制从高硅铸铁流向钢管桩 C.高硅铸铁的作用是作为损耗阳极材料和传递电流 D.通入的保护电流应该根据环境条件变化进行调整 6.短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是A.X的简单氢化物的热稳定性比W的强 2017年杨浦区初三一模语文试题 一、文言文阅读(共40分) (一)默写(15分) 1、昨夜江边春水生,。(《观书有感(其二)》) 2、,五十弦翻塞外声。(《破阵子·为陈同甫赋壮词以寄》) 3、,雪尽马蹄轻。(《观猎》) 4、六十而耳顺,,。(《孔孟论学》) 5、若夫日出而林霏开,。(《醉翁亭记》) (二)阅读下面的词,完成6-7题(4分) 江城子〃密州出猎 (宋)苏轼 老夫聊发少年狂。左牵黄,右擎苍。锦帽貂裘,千骑卷平冈。为报倾城随太守,亲射虎,看孙郎。 酒酣胸胆尚开张。鬓微霜,又何妨?持节云中,何日遣冯唐?会挽雕弓如满月,西北望,射天狼。 6、词中的“卷”字,既写出了出猎场面的,更表现了出猎者的精神面貌。(2分) 7、下列对这首词理解恰当的一项是()(2分) A.本词开篇“聊”“狂”两字,虽隐有怨愤之情,但更多见作者豪迈气概。 B.本词中词人以孙权、冯唐自比,表达了期盼得到朝廷重用的强烈愿望。 C. 本词结句卒章显志,传神描绘了作者驰骋于沙场,为国杀敌的英雄形象。 D. 本词表面写的是一次秋猎,实则表达了词人报效国家的志向和豪迈气概。 (三)阅读下文完成8-10题(9分) 黔之驴 ①黔无驴,有好事者船载以入。至则无可用,放之山下。虎见之,庞然大物也,以为神,蔽林间窥之。稍出近之,慭慭然莫相知。 ②他日,驴一鸣,虎大骇,远遁;以为且噬己也,甚恐。然往来视之,觉无异能者;益习其声,又近出前后,终不敢搏。稍近,益狎,荡倚冲冒。驴不胜怒,蹄之。虎因喜,计之曰:“技止此耳!”因跳踉大?,断其喉,尽其肉,乃去。 8、本文作者是代著名文学家。(2分) 9、用现代汉语翻译下面的句子(3分) 稍出近之,慭慭然莫相知。 10、下列对文章内容的理解错误的一项是() A.第①段交代了黔之驴的由来及虎初见驴时的反应。 B.第②段描绘了虎惧驴、察驴、戏驴、吃驴的经过。 C.标题直指写作意图,讽刺了外强中干的上层人物。 D.本文启示我们要有真才实学,否则必将陷入困境。 (四)阅读下文,完成11-14题(12分) 孙子荆与王武子 孙子荆年少时欲隐,语王武子:“当枕石漱流”,误曰:“漱石枕流。”王曰:“流可枕,石可漱乎?”孙曰:“所以枕流,欲洗其耳;所以漱石,欲砺其齿。” 2017年(新课标2) 7.下列说法错误的是 A .糖类化合物也可称为碳水化合物 B .维生素D 可促进人体对钙的吸收 C .蛋白质是仅由碳、氢、氧元素组成的物质 D .硒是人体必需的微量元素,但不宜摄入过多 8.阿伏加德罗常数的值为A N 。下列说法正确的是 A .1 L 0.1 mol·1 L -NH 4Cl 溶液中,4NH +的数量为0.1A N B .2.4 g Mg 与H 2SO 4完全反应,转移的电子数为0.1A N C .标准状况下,2.24 L N 2和O 2的混合气体中分子数为0.2A N D .0.1 mol H 2和0.1 mol I 2于密闭容器中充分反应后,其分子总数为0.2A N 9.a 、b 、c 、d 为原子序数依次增大的短周期主族元素,a 原子核外电子总数与b 原子次外层的电子数相同;c 所在周期数与族数相同;d 与a 同族。下列叙述正确的是学科*网 A .原子半径:d>c>b>a B .4种元素中b 的金属性最强 C .c 的氧化物的水化物是强碱 D .d 单质的氧化性比a 单质的氧化性强 10.下列由实验得出的结论正确的是 11.用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为24224H SO H C O -混合溶液。 下列叙述错误的是 A .待加工铝质工件为阳极 B .可选用不锈钢网作为阴极 C .阴极的电极反应式为:3Al 3e Al +- += D .硫酸根离子在电解过程中向阳极移动 12.改变0.11mol L -?二元弱酸2H A 溶液的pH ,溶液中的2H A 、HA -、2A - 的物质的量分数(X)δ随pH 的变化 如图所示[已知22(X)(X)(H A)(HA )(A ) c c c c δ--= ++]。 下列叙述错误的是 A .pH=1.2时,2(H A)(HA )c c -= B .22lg[(H A)] 4.2K =- C .pH=2.7时,22(HA )(H A)(A )c c c -->= D .pH=4.2时,2(HA )(A )(H )c c c --+== 13.由下列实验及现象不能推出相应结论的是 26.(14分)水泥是重要的建筑材料。水泥熟料的主要成分为CaO 、SiO 2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示: 回答下列问题: (1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是__________,还可使用___________代替硝酸。 (2)沉淀A 的主要成分是_________________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____________________________________。 (3)加氨水过程中加热的目的是___________。沉淀B 的主要成分为_________、_________(写化学式)。 (4)草酸钙沉淀经稀H 2SO 4处理后,用KMnO 4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴 定反应为:4MnO -+H ++H 2C 2O 4→Mn 2+ +CO 2+H 2O 。 实验中称取0.400 g 水泥样品,滴定时消耗了0.0500 mol·L ?1的KMnO 4溶液36.00 mL ,则该水泥样品中钙的质量分数为______________。2017年上海杨浦生命科学一模试卷及答案
2017年江苏化学高考试题及含答案
高三数学南方凤凰台高2021届高2018级高三一轮数学提高版完整版学案第八章
2017年杨浦区高考数学一模试卷含答案
2017全国统一高考化学试题及答案(新课标1卷)
高三数学南方凤凰台高2021届高2018级高三一轮数学提高版完整版学案第二章
杨浦区2017年一模手敲Word版附答案
2017年高考化学真题全国卷Ⅲ及答案
(完整版)2017年全国高考理综一卷生物部分
高三数学南方凤凰台高2021届高2018级高三一轮数学提高版完整版学案第三章
2017年全国Ⅱ卷高考真题化学试题(解析版)
2017全国1卷理综化学试题及答案
2017上海市杨浦区高三化学一模试卷
2017年全国卷1高考化学试题和答案
2017年上海杨浦区初三一模语文试题(附答案)
2017年新课标2高考化学真题含答案
