Leica TCS SP5激光共聚焦显微镜系统软件操作手册

Leica TCS SP5激光共聚焦显微镜系统软件操作手册
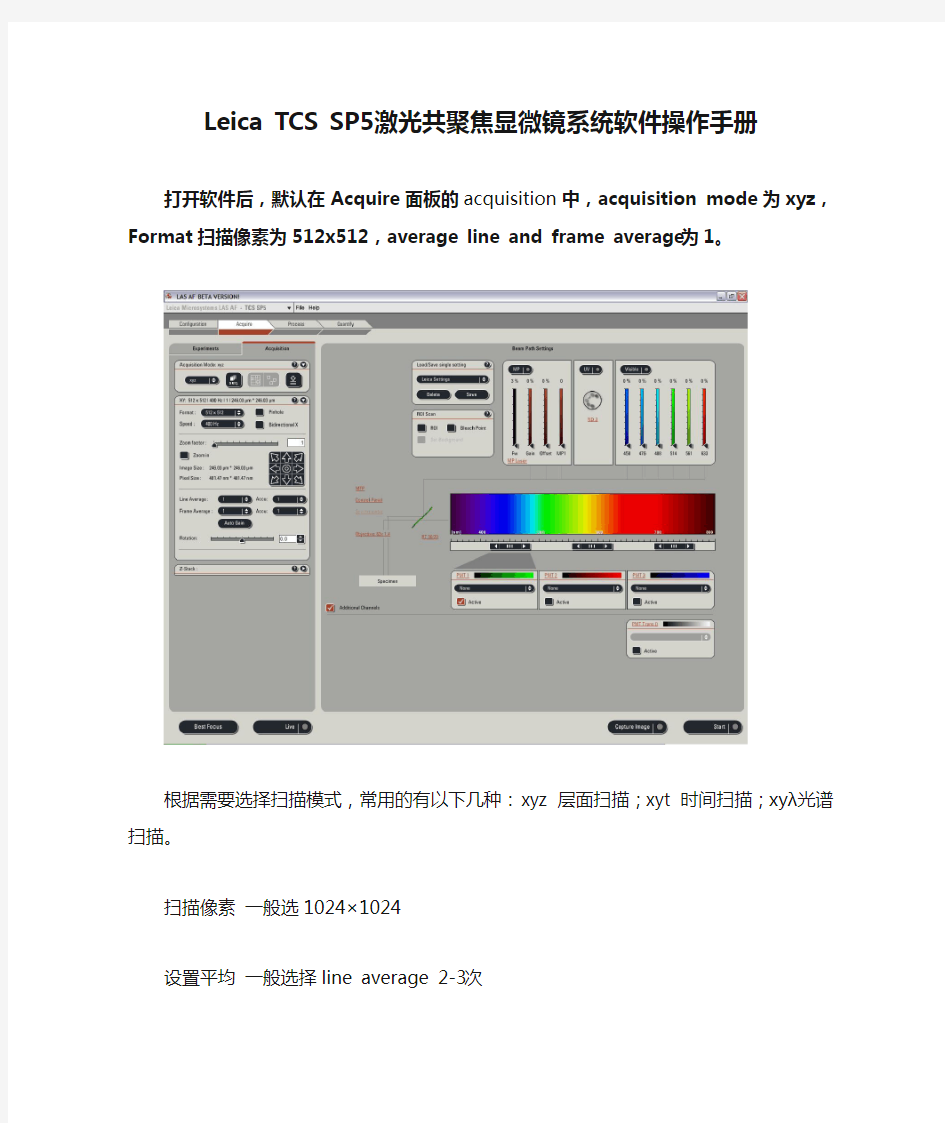
打开软件后,默认在Acquire面板的acquisition中,acquisition mode为xyz,Format扫描像素为512x512,average line and frame average 为1。
根据需要选择扫描模式,常用的有以下几种:xyz 层面扫描;xyt 时间扫描;xyλ光谱扫描。扫描像素一般选1024×1024
设置平均一般选择line average 2-3次
保存图像方法
注意:一般在扫描结束后统一保存,为免数据丢失,可以从获取第一张图片后就要开始保存,以后每获取一张图片保存一次。
1、保存Leica .lif 文件
进入Acquire 面板的Experiment 中,右键点击Experiment,从弹出菜单中选中“Save Experiment “Experiment” as…”,保存lif文件到自己的文件夹中并取名。
2、导出lif文件
右键点击Experiment,从弹出菜单中选中“Export Experiment as tiff”,选择目标文件夹,选中rawdata导出单通道图片。
如需导出overlay 图片,则再次右键点击Experiment,从弹出菜单中选中“Export
Experiment as tiff”,选择目标文件夹,选中overlay 导出多通道合成图片。
一、获取单一荧光图像
1、在beam path setting 中的load/save single setting 中选择所标记荧光的光路设置方法。
2、点击live开始连续扫描,优化图像质量。
调节z position选择需扫描层面,调节gain和offset 使图像亮度和背景到达到合适的状态,Zoom调节电子放大倍率。
点击stop,停止扫描。
3、选择像素1024×1024
4、点击capture image获取图像。
5、保存图像。
二、获取多荧光图像
1、点击seq ,出现sequential scan面板。
2、在sequential scan面板中点击scan 1,在beam path setting 中选择所标记的一种荧光的光路设置方法。
点击live开始连续扫描,优化图像质量。
调节z position选择需扫描层面,调节gain和offset 使图像亮度和背景到达到合适的状态,Zoom调节电子放大倍率。
点击stop,停止扫描。
在sequential scan面板中点击“+”,点击scan 2,在beam path setting 中选择所标记的另一
种荧光的光路设置方法,点击live开始连续扫描,优化图像质量。
标记了几种荧光就添加几种方法。
选择“between frames ”模式。
3、选择像素1024×1024,点击Start获取图像。
4、保存图像。
三、获取多层荧光图像
1、在beam path setting 中选择所标记荧光的光路设置方法。
2、打开Z-stack 面板。
3、点击live开始连续扫描,优化图像质量。
调节z position选择需扫描层面,设置begin和end ,调节gain和offset 使图像亮度和背景到达到合适的状态,Zoom调节电子放大倍率。
点击stop,停止扫描。
在Z-stack 面板中确定Nr. Of steps (在选择层面中确定需扫描张数)
4、点击start获取图像。
5、如需将扫描图像叠加,选择Process 面板,选择visualization 3D projection ,点击apply ,即可生成叠加图像。
6、保存图像。
四、获取时间序列图像
1、Acquisition mode 改为xyt。
2、根据需要拍摄图像的时间间隔和图像质量调整fomat 和line average值。
3、在beam path setting 中的load/save single setting 中选择所标记荧光的光路设置方法。
如是多种荧光则选择点击seq,设置序列扫描。
4、点击live开始连续扫描,优化图像质量。
调节z position选择需扫描层面,调节gain和offset 使图像亮度和背景到达到合适的状态,Zoom调节电子放大倍率。
点击stop,停止扫描。
5、点击start获取图像。
6、保存图像。
激光共聚焦显微镜的原理与应用范围
激光共聚焦显微镜的原理与应用范围 激光扫描共聚焦显微镜是采用激光作为光源,在传统光学显微镜基础上采用共轭聚焦原理和装置,并利用计算机对所观察的对象进行数字图象处理的一套观察、分析和输出系统。把光学成像的分辨率提高了30%~40%,使用紫外或可见光激发荧光探针,从而得到细胞或组织内部微细结构的荧光图像,在亚细胞水平上观察生理信号及细胞形态的变化,成为形态学,分子生物学,神经科学,药理学,遗传学等领域中新一代的研究工具。 1激光扫描共聚焦显微镜(LSCM)的原理 从基本原理上讲,共聚焦显微镜是一种现代化的光学显微镜,它对普通光镜从技术上作了以下几点改进: 1.1用激光做光源因为激光的单色性非常好,光源波束的波长相同,从根本上消除了色差。1.2采用共聚焦技术在物镜的焦平面上放置了一个当中带有小孔的挡板,将焦平面以外的杂散光挡住,消除了球差;并进一步消除了色差 1.3采用点扫描技术将样品分解成二维或三维空间上的无数点,用十分细小的激光束(点光源)逐点逐行扫描成像,再通过微机组合成一个整体平面的或立体的像。而传统的光镜是在场光源下一次成像的,标本上每一点的图像都会受到相邻点的衍射光和散射光的干扰。这两种图像的清晰度和精密度是无法相比的。 1.4用计算机采集和处理光信号,并利用光电倍增管放大信号图 在共聚焦显微镜中,计算机代替了人眼或照相机进行观察、摄像,得到的图像是数字化的,可以在电脑中进行处理,再一次提高图像的清晰度。而且利用了光电倍增管,可以将很微弱的信号放大,灵敏度大大提高。由于综合利用了以上技术。可以说LSCM是显微镜制作技术、光电技术、计算机技术的完美结合,是现代技术发展的必然产物。 2LSCM在生物医学研究中的应用 目前,一台配置完备的LSCM在功能上已经完全能够取代以往的任何一种光学显微镜,它相当于多种制作精良的常用光学显微镜的有机组合,如倒置光学显微镜、紫外线显微镜、荧光显微镜、暗视野显微镜、相差显微镜(PH)、微分干涉差显微镜(DIC)等,因此被称为万能显微镜,通过它所得到的精细图像可使其他的显微镜图像无比逊色。
德国Zeiss 激光共聚焦显微镜 快速操作手册
德国Zeiss 激光共聚焦显微镜快速操作手册德国 Zeiss 激光扫描共聚焦显微镜快速操作手册制作: 光学仪器(上海)制作:Zeiss 光学仪器(上海)国际贸易有限公司孙凯 2009 年 6 月目录:目录:1 系统的组成系统组成及光路示意图实物照片说明实物照片说明2 系统的使用2.1 开机顺序软件的快速使用说明2.2 软件的快速使用说明快速使用显微镜的2.3 显微镜的触摸屏控制2.4 关机顺序3 系统的维护1 系统的组成激光扫描共聚焦显微镜系统主要由:电动荧光显微镜、扫描检测单元、激光器、电脑工作站及各相关附件组成。激光扫描共聚焦显微镜系统主要由:电动荧光显微镜、扫描检测单元、激光器、电脑工作站及各相关附件组成。系统组成及光路示意图:系统组成及光路示意图: 组成及光路示意图电动荧光显微镜扫描检测单元激光器电脑工作站实物照片说明:实物照片说明: 电动荧光显微镜扫描检测单元CO2 培养系统控制器激光器电脑工作站2 系统的使用2.1 开机顺序 )打开稳压电源(绿色按钮)(1)打开稳压电源(绿色按钮) 等待 2 分钟(电压稳定)后,再开其它开关) “ ”(2)主开关 MAIN SWITC H “ON” “ ”电脑系统SYSTEMS/PC “ON” “ ”扫描硬件系统COMPONENTS “ON” )(3)打开电动显微镜开关打开荧光灯开关 (注:具有 5 档光强调节旋钮) ) 离子激光器主开关”(4)Ar 离子激光器主开关“ON”顺时针旋转钥匙至“—”预热等待约分钟,预热等待约 15 分钟,”将激光器扳钮由“Standby”扳至”状态,“Laser run”状态,即可正常使用 ) ,(5)打开电脑开关,进入操作系统注:键盘上也具有电脑开关 2.2 软件的快速使用说明(1)电脑开机进入操作系统界面后,双击桌面共聚焦软件 ZEN 图标(2)进入 ZEN 界面,弹出对话框: ”——“Start System”——初始化整个系统,用于激光扫描取图、分析等。“Image Processing”——不启动共聚焦扫描硬件,用于已”存图像数据的处理、分析。(3)软件界面: 功能界面切换:扫描取图( ) 图像处理( 、图像处
激光扫描共聚焦显微镜的原理和应用
激光扫描共聚焦显微镜的原理和应用 一、激光扫描共聚焦显微镜的原理 传统的光学显微镜使用的是场光源,标本上每一点的图像都会受到邻近点的衍射或散射光的干扰;激光扫描共焦显微镜(Laser Scanning Confocal Microscope,LSCM)采用点光源照射样本,在焦平面上形成一个轮廓分明的小的光点,该点被照射后发出的荧光被物镜搜集,并沿原照射光路回送到由双色镜构成的分光器。分光器将荧光直接送到探测器。光源和探测器前方都各有一个针孔,分别称为照明针孔和探测针孔。照明针孔与探测针孔相对于物镜焦平面是共轭的,焦平面上的点同时聚焦于照明针孔和发射针孔,焦平面以外的点被挡在探测针孔之外不能成像,这样得到的共聚焦图像是标本的光学切面,避免了非焦平面上杂散光线的干扰,克服了普通显微镜图像模糊的缺点,因此能得到整个焦平面上清晰的共聚焦图像。 原理图 二、激光扫描共聚焦显微镜组成特点 LSCM由显微镜光学系统,激光光源,扫描装置和检测系统构成,整套仪器由计算机控制,各部件之间的操作切换都可在计算机操作平台界面中方便灵活地
进行。显微镜是LSCM的主要组件,它关系到系统的成像质量。通常有倒置和正置两种形式,前者在切片、活细胞检测等生物医学应用中使用更广泛。 三、激光扫描共聚焦显微镜的应用 (一)细胞的三维重建 普通荧光显微镜分辨率低,显示的图像结构为多层面的图像叠加,结构不够清晰。LSCM能以0.1μm的步距沿轴向对细胞进行分层扫描,得到一组光学切片,经A/D转换后作为二维数组贮存。这些数组通过计算机进行不同的三维重建算法,可作单色或双色图像处理,组合成细胞真实的三维结构。旋转不同角度可观察各侧面的表面形态,也可从不同的断面观察细胞内部结构,测量细胞的长宽高、体积和断层面积等形态学参数。通过模拟荧光处理算法,可以产生在不同照明角度形成的阴影效果,突出立体感。通过角度旋转和细胞位置变化可产生三维动画效果。LSCM的三维重建广泛用于各类细胞骨架和形态学分析、染色体分析、细胞程序化死亡的观察、细胞内细胞质和细胞器的结构变化的分析和探测等方面。(二)静态结构检测 1.细胞原位检测核酸 用于细胞核定位及其形态学观察、检测细胞内DNA的复制及断裂情况以及染色体定位观察。 2.原位检测蛋白质、抗体及其他分子 原位检测蛋白质、抗体及其他分子 免疫荧光标记技术 检测荧光蛋白 3.检测细胞凋亡 检测细胞凋亡不同时期细胞形态、细胞凋亡相关蛋白
激光共聚焦扫描显微镜简介
激光共聚焦扫描显微镜简介 一、激光共聚焦显微镜的基本组成 激光扫描共聚焦显微镜(laser scanning confocal microscope LSCM)是20世纪80年代发展起来的一项具有划时代意义的高科技新产品,是当今世界最先进的细胞生物学分析仪器。激光共聚焦显微镜利用激光作为光源,在传统光学显微镜基础上采用共轭聚焦的原理和装置,以及通过针孔的选择和PMT的收集,并带有一套对其所观察到的对象进行数字图像分析处理的系统软件。与传统光学显微镜相比,它具有更高的分辨率,实现多重荧光的同时观察并可形成清晰的三维图象等优点。所以它问世以来在生物学的研究领域中得到了广泛应用。 激光共聚焦显微镜主要有四部分组成:1、显微镜光学系统。2、扫描装置。3、激光光源。4、检测系统。整套仪器由计算机控制,各部件之间的操作切换都可在计算机操作平台界面中方便灵活地进行。 1.1 显微镜光学系统 显微镜是LSCM的主要组件,它关系到系统的成象质量。显微镜光路以无限远光学系统可方便地在其中插人光学选件而不影响成象质量和测量精度。物镜应选取大数值孔径平场复消色差物镜,有利于荧光的采集和成象的清晰。物镜组的转换,滤色片组的选取,载物台的移动调节,焦平面的记忆锁定都应由计算机自动控制。 1.2 扫描装置 LSCM使用的扫描装置在生物领域一般为镜扫描。由于转镜只需偏转很小角度就能涉及很大的扫描范围,图象采集速度大大提高,512×512画面每秒可达5帧以上,有利于那些寿命短的离子作荧光测定。扫描系统的工作程序由计算机自动控制。 1.3 激光光源 LSCM使用的激光光源有单激光和多激光系统。多激光器系统在可见光范围使用多谱线氩离子激光器,发射波长为457nm、488nm和514nm的蓝绿光,氦氖绿激光器提供发射波长为543nm的绿光,氦氖红激光器发射波长为633nm的红光。 1.4 检测系统 LSCM为多通道荧光采集系统,一般有三个荧光通道和一个透射光通道,能升级到四个荧光通道,可对物体进行多谱线激光激发,样品发射荧光的探测器为感光灵敏度高的光电倍增管PMT,配有高速12位A/D转换器,可以做光子计数。PMT前设置针孔,由计算机软件调节针孔大小,光路中设有能自动切换的滤色片组,满足不同测量的需要,也有通过光栅或棱镜分光后进行光谱扫描功能的设置。 二、激光共聚焦显微镜的特点以及在生物领域的应用 与传统光学显微镜相比,激光共聚焦显微镜具有更高的分辨率,实现多重荧光的同时观察并可形成清晰的三维图象等优点,在对生物样品的观察中,激光共聚焦显微镜有如下优越性: 1、对活细胞和组织或细胞切片进行连续扫描,可获得精细的细胞骨架、染色体、细胞器和细胞膜系统的三维图像。 2、可以得到比普通荧光显微镜更高对比度、高解析度图象、同时具有高灵敏度、杰出样品保护。 3、多维图象的获得,如7 维图象(XYZaλIt): xyt 、xzt 和xt 扫描,时间序列扫描旋转扫描、区域扫描、光谱扫描、同时方便进行图像处理。
Zeiss 激光扫描共聚焦显微镜 操作手册
Zeiss 激光扫描共聚焦显微镜操作手册 目录: 1 系统得组成 系统组成及光路示意图 实物照片说明 2 系统得使用 2、1 开机顺序 2、2 软件得快速使用说明 2、3 显微镜得触摸屏控制 2、4 关机顺序 3 系统得维护 1 系统得组成 激光扫描共聚焦显微镜系统主要由:电动荧光显微镜、扫描检测单元、激光器、电脑工作站及各相关附件组成。 系统组成及光路示意图: 电脑工作站 激光器 电动荧光显微镜扫描检测单元 实物照片说明: 电动荧光显微镜 扫描检测单元 CO2 培养系统控制器 激光器 电脑工作站 2 系统得使用 2、1 开机顺序 (1)打开稳压电源(绿色按钮) 等待2 分钟(电压稳定)后,再开其它开关 (2)主开关[ MAIN SWITCH ]“ON” 电脑系统[ SYSTEMS/PC ]“ON” 扫描硬件系统[ PONENTS ]“ON” (3)打开[ 电动显微镜开关] 打开[ 荧光灯开关] (注:具有5 档光强调节旋钮) (4)Ar 离子激光器主开关“ON” 顺时针旋转钥匙至“—” 预热等待约15分钟, 将激光器[ 扳钮] 由“Standby”扳至 “Laser run”状态,即可正常使用 (5)打开[ 电脑开关],进入操作系统
注:键盘上也具有[ 电脑开关] 2、2 软件得快速使用说明 (1)电脑开机进入操作系统界面后,双击桌面共聚焦软件ZEN 图标 (2)进入ZEN 界面,弹出对话框: “Start System”——初始化整个系统,用于激光扫描取图、 分析等。 “Image Processing”——不启动共聚焦扫描硬件,用于已 存图像数据得处理、分析。 (3)软件界面: 1 功能界面切换:扫描取图(Acquisition)、图像处理(Processing)、维护(Maintain) (注:Maintain仅供Zeiss专业工程师使用) 2 动作按钮; 3 工具组(多维扫描控制); 4 工具详细界面; 5 状态栏; 6 视窗切换按钮; 7 图像切换按钮;8 图像浏览/预扫描窗口;9 文档浏览/处理区域;10 视窗中图像处理模块 动作按钮: Single ——扫描单张图片、并在图像预览窗口显示。 Start ——开始扫描单张图片或一个实验流程(1组图片,如XYZ、XYT 等)。 Stop ——暂停/结束扫描。 New ——建立一个新图像扫描窗口/文档。 激光连接状况检查 眼睛观察/相机/共聚焦LSM 光路切换(ZEN软件界面右上角): Ocular ——通过观察筒用眼睛观察。(激光安全保护装置自动阻断激光、保护眼睛。) Camera ——光路切换至相机。 LSM ——共聚焦扫描成像光路。 显微镜设置: “Ocular”——> “Light Path”——> 点击物镜图标,选择物镜——> 样品聚焦。 透射光控制(Transmitted Light Control) 反射光光闸控制(Reflected Light Shutter) 荧光激发块选择(Reflector) 共聚焦LSM 扫描设置 点击“LSM”(ZEN软件界面右上角),系统切换至共聚焦扫描光路: 光路设置: Smart Setup ——自动预设光路 选取“荧光探针”、“颜色”、扫描方法, 应用“Apply”。 (注:Fastest 为最快速扫描,多条激光谱线同时扫 描。Best signal 为最佳信号扫描,多条激光谱线顺 序扫描。Best promise 为兼顾速度与信号得折
激光扫描共聚焦显微镜的原理和应用-17954讲解
激光扫描共聚焦显微镜的原理和应用 Tina(2007-10-23 09:40:17 一、激光扫描共聚焦显微镜的原理 传统的光学显微镜使用的是场光源,标本上每一点的图像都会受到邻近点的衍射或散射光的干扰;激光扫描共焦显微镜(Laser Scanning Confocal Microscope,LSCM采用点光源照射样本,在焦平面上形成一个轮廓分明的小的光点,该点被照射后发出的荧光被物镜搜集,并沿原照射光路回送到由双色镜构成的分光器。分光器将荧光直接送到探测器。光源和探测器前方都各有一个针孔,分别称为照明针孔和探测针孔。照明针孔与探测针孔相对于物镜焦平面是共轭的,焦平面上的点同时聚焦于照明针孔和发射针孔,焦平面以外的点被挡在探测针孔之外不能成像,这样得到的共聚焦图像是标本的光学切面,避免了非焦平面上杂散光线的干扰,克服了普通显微镜图像模糊的缺点,因此能得到整个焦平面上清晰的共聚焦图像。 原理图
二、激光扫描共聚焦显微镜组成特点 LSCM由显微镜光学系统,激光光源,扫描装置和检测系统构成,整套仪器由计算机控制,各部件之间的操作切换都可在计算机操作平台界面中方便灵活地进行。显微镜是LSCM的主要组件,它关系到系统的成像质量。通常有倒置和正置两种形式,前者在切片、活细胞检测等生物医学应用中使用更广泛。 三、激光扫描共聚焦显微镜的应用 一)细胞的三维重建
普通荧光显微镜分辨率低,显示的图像结构为多层面的图像叠加,结构不够清晰。LSCM 能以0.1μm的步距沿轴向对细胞进行分层扫描,得到一组光学切片,经A/D转换后作为二维数组贮存。这些数组通过计算机进行不同的三维重建算法,可作单色或双色图像处理,组合成细胞真实的三维结构。旋转不同角度可观察各侧面的表面形态,也可从不同的断面观察细胞内部结构,测量细胞的长宽高、体积和断层面积等形态学参数。通过模拟荧光处理算法,可以产生在不同照明角度形成的阴影效果,突出立体感。通过角度旋转和细胞位置变化可产生三维动画效果。LSCM 的三维重建广泛用于各类细胞骨架和形态学分析、染色体分析、细胞程序化死亡的观察、细胞内细胞质和细胞器的结构变化的分析和探测等方面。 二)静态结构检测:原位鉴定细胞或组织内生物大分子、观察细胞及亚细胞形态结构 1.细胞原位检测核酸 用于细胞核定位及其形态学观察、检测细胞内DNA的复制及断裂情况以及染色体定位观察。 2.原位检测蛋白质、抗体及其他分子 原位检测蛋白质、抗体及其他分子 免疫荧光标记技术 检测荧光蛋白 3.检测细胞凋亡
德国Zeiss激光扫描共聚焦显微镜快速操作手册
德国Zeiss 激光扫描共聚焦显微镜 快速操作手册 制作制作::Zeiss 光学仪器光学仪器((上海上海))国际贸易有限公司 孙 凯 2009年6月
目录目录:: 1 系统的组成 系统组成及光路示意图 实物照片实物照片说明说明 2 系统的使用 2.1 开机顺序 2.2 软件的软件的快速快速快速使用使用使用说明说明 2.3 显微镜显微镜的的触摸屏控制 2.4 关机顺序 3 系统的维护
1 系统的组成 激光扫描共聚焦显微镜系统主要由激光扫描共聚焦显微镜系统主要由::电动荧光显微镜电动荧光显微镜、、扫描检测单元扫描检测单元、、激光器激光器、、电脑工作站及各相关附件组成电脑工作站及各相关附件组成。。 系统系统组成及光路组成及光路组成及光路示意图示意图示意图:: 电脑工作站 激光器 扫描检测单元 电动荧光显微镜
实物照片说明实物照片说明:: 电动荧光显微镜 扫描检测单元 CO 2培养系统控制器 激光器 电脑工作站
2 系统的使用 2.1 开机顺序 (1)打开稳压电源打开稳压电源((绿色按钮绿色按钮)) 等待2分钟(电压稳定)后,再开其它开关 (2)主开关 [ MAIN SWITCH ]“ON ” 电脑系统 [ SYSTEMS/PC ]“ON ” 扫描硬件系统 [ COMPONENTS ]“ON ” (3)打开 [ 电动显微镜开关 ] 打开 [ 荧光灯开关 ] (注:具有5档光强调节旋钮) (4)Ar 离子激光器离子激光器主开关主开关 “ON ” 顺时针旋转钥匙 至 “—” 预热预热等待约等待约15分钟分钟,, 将激光器 [ 扳钮 ] 由“Standby ”扳至 “Laser run ”状态状态,,即可正常使用 (5)打开 [ 电脑开关 ],进入操作系统 注:键盘上也具有 [ 电脑开关 ]
激光共聚焦显微镜技术1讲解
激光共聚焦显微镜技术 The techniques and applications of Confocal Laser Scanning Microscopy 激光共聚焦显微镜(LSCM)的发展简史 1957年,Marvin Minsky提出了共聚焦显微镜技术的某些基本原理,获得了美国的专利。1978年,阿姆斯特丹大学的G.J.Brakenhoff首次展示了改善了分辨率的共焦显微镜。 1985年,Wijnaendtsvan Resandt推出了第一台对荧光标记的材料进行光切的共焦显微镜 激光共聚焦显微镜(LSCM)的发展简史 ?80年代末,各家公司都推出了商品化的共焦显微镜,英国的Bio-Rad公司的MRC系列,德国Leica公司的TCS系列,Zeiss公司的LSM系列等。 ?近二十年来,从滤片型到光谱型,人们对共焦高分辨率,采集图像快速,技术的改进及应用开发不断进行,出现了很多新的技术。如双光子,FCS,FLIM ,STED等。 共焦显微镜的优点 人眼分辨率:0.2mm 光学显微镜分辨率:0.25μm 电子显微镜分辨率:0.2nm 共焦显微镜分辨率:μm 共焦显微镜的优点 ?电子显微镜的缺陷: 1.只能观察固定样品 2.样品制备过程(固定、包埋、切片)造成的假象 ?荧光显微镜的缺陷: 1.可以观察活细胞或组织,但细胞或组织内结构高度重叠。 2.荧光具有强散射性,造成图像实际清晰度的大大下降。 3.荧光漂白很快,使荧光图像的拍照有困难。 4.如果荧光滤片选配不当,多荧光标记样品图像的采集很困难,且很难抑制光谱交叉。 共焦显微镜的优点 ?共焦显微镜与传统显微镜的区别 1.抑制图像的模糊,获得清晰的图像 激光扫描共焦显微镜技术 ?共焦显微镜与传统显微镜的区别
LeicaSP8激光扫描共聚焦显微镜快速操作手册2013-5-13
Leica激光扫描共聚焦显微镜 快速操作手册 制作:徕卡显微系统(上海)贸易有限公司 2013年3月
目录: 1 系统的组成 系统组成 (3) 光路示意图 (4) 2 系统的使用 2.1 开机顺序 (5) 2.2 软件界面简介 (7) 2.3 在显微镜下观察样品 (8) 2.4 采集共聚焦图像 (9) 2.5 XYZ三维扫描(Z-Stack) (11) 2.6 时间序列扫描(Timeseries or xyt Scan) (15) 2.7 波长扫描(xyλScan) (16) 2.8 HyD检测器 (17) 2.9 图像的保存及输出 (18) 2.10 关机 (20) 3 系统的维护 (21)
Leica SP8 系统组成图
1可见波长激光或白激光15UVIS, HIVIS或VISIR的光路镀膜 2声光调制器(AOTF)16扫描视场旋转镜(Abbe-Konig 旋转)* 3红外激光(IR)* 17在NND位置上的反射光检测器(RLD)* 4电光调制器18物镜(可提供各种选择)* 5紫外激光* 19在NND位置上的透射光检测器(TLD)* 6 AOTF或直接调制器(DMOD)20正方型针孔 7STED 激光* 21Fluorifier盘* 8Setlight监控二极管22X1出口接口* 9AOBS, 及其他选配件23外置检测器* 10用于FRAP的光束增强镜* 24色散棱镜 11红外激光耦合25分开的荧光光谱 12与CS2紫外光路耦合的紫外激光26最多5个光电倍增管或4个HyD检测器 13STED激光耦合*选配组件 14全视野扫描镜及串行高速扫描镜选件
激光共聚焦显微镜
激光共聚焦显微镜 1.激光器: 1.1系统激光器覆盖可见光及紫外光: 1.1.1蓝光固体激光器488nm20mW; 1.1.2绿光固体激光器552nm20mW; 1.1.3红光固体激光器638nm,20mW 1.1.4紫外固体激光器405nm50mW; 1.2激光器的开闭和电压调节完全由软件控制,无需另设单根激光器的开关。并具有激光寿命保护装置。 1.3具有激光强度回馈稳定电路设计,在动态记录中激光强度不会受环境的影响而改变。 2.共聚焦扫描系统: 2.1激光扫描系统直接与共聚焦机身连接 2.2检测器数量 ①三个荧光扫描检测器+一个透射光DIC(明场/相差/微分干涉)扫描检测器; ②扫描检测器包括2个光电倍增管(PMT)和一个磷砷化镓混合型检测器HyD。*③可以升级为五个以上独立连续光谱荧光检测器。 2.3连续分光设计系统(或其它光谱分离系统) *①三个通道,一个透射光DIC通道;二个荧光通道均为可做连续全光谱检测的荧光通道; ②光谱型荧光通道可自由更换荧光通道检测的波长范围,二个荧光通道和一个透射光DIC通道可同时进行快速扫描; ③多通道荧光图像即时叠加、荧光图像与透射光DIC图像即时叠加,精确对光谱进行分析; ④荧光通道具有高精度的共聚焦针孔,具有宽波谱范围内的色差校正功能,保证在多重荧光标记的同时检测过程中每个通道扫描光切平面和厚度的一致性和荧光精确定位。 2.4光谱扫描功能 ①高速多通道光谱分析和扫描,可获得透射光谱图像; ②光谱分辨率2nm,可连续以1nm波长调节; ③光谱扫描范围:400-800nm;光谱扫描步进:1nm; ④高速棱镜分光,线性光谱拆分,可区分光谱大量重叠的染料; ⑤光谱数据来源:用户指定/用户自建/厂家预设(可调节)。 2.5扫描速度及速度调节 *①扫描视野22mm下扫描速度7幅/秒(512×512pixels);70幅/秒(512×16pixels); ②双向扫描速度3600线/秒;扫描速度可精确调节。 2.6共聚焦针孔1个,全自动调节型,孔径50-300微米,调节步进0.5微米。
激光共聚焦显微镜原理
激光共聚焦显微镜原理 激光共聚焦扫描显微技术(Confocal laser scanning microscopy)是一种高分辨率的显微成像技术。普通的荧光光学显微镜在对较厚的标本(例如细胞)进行观察时,来自观察点邻近区域的荧光会对结构的分辨率形成较大的干扰。共聚焦显微技术的关键点在于,每次只对空间上的一个点(焦点)进行成像,再通过计算机控制的一点一点的扫描形成标本的二维或者三维图象。在此过程中,来自焦点以外的光信号不会对图像形成干扰,从而大大提高了显微图象的清晰度和细节分辨能力。 图1. 共聚焦显微镜简化原理图 图1是一般共聚焦显微镜的工作原理示意图。用于激发荧光的激光束(Laser)透过入射小孔(light source pinhole)被二向色镜(Dichroic mirror)反射,通过显微物镜(Objective lens)汇聚后入射于待观察的标本(specimen)内部焦点(focal point)处。激光照射所产生的荧光(fluorescence light)和少量反射激光一起,被物镜重新收集后送往二向色镜。其中携带图像信息的荧光由于波长比较长,直接通过二向色镜并透过出射小孔(Detection pinhole)到达光电探测器(Detector)(通常是光电倍增管(PMT)或是雪崩光电二极管(APD)),变成电信号后送入计算机。而由于二向色镜的分光作用,残余的激光则被二向色镜反射,不会被探测到。
图2. 探测针孔的作用示意图 图2解释了出射小孔所起到的作用:只有焦平面上的点所发出的光才能透过出射小孔;焦平面以外的点所发出的光线在出射小孔平面是离焦的,绝大部分无法通过中心的小孔。因此,焦平面上的观察目标点呈现亮色,而非观察点则作为背景呈现黑色,反差增加,图像清晰。在成像过程中,出射小孔的位置始终与显微物镜的焦点(focal point)是一一对应的关系(共轭conjugate),因而被称为共聚焦(con-focal)显微技术。共聚焦显微技术是由美国科学家马文?闵斯基(Marvin Minsky)发明的;他于1957年就为该技术申请了专利。但是直到八十年代后期,由于激光研究的长足进步,才使得激光共聚焦扫描显微技术(CLSM)成为了一种成熟的技术。 图3. 激光共聚焦显微镜原理框图 当今的激光共聚焦显微镜已经发展为一种结合了激光技术,显微光学,自动控制和图像处理等多种尖端科研成果的高技术工具。是现代微观研究领域不可缺少的利器之一。Nikon秉承“信赖与创造”的一贯企业理念,正在为业界提供世界领先水平的共聚焦显微镜系统产品。
激光共聚焦显微镜操作规程
激光共聚焦显微镜操作规程 一、准备工作 a)打开计算机。依次打开激光器电源、钥匙开关。多线氩离子(458 nm, 488 nm, 514 nm) ON、氦氖绿(543 nm) ON、 氦氖红(633 nm) ON。打开汞灯电源开关。 b)登陆Windows XP系统。双击快捷方式:FV10-ASW 1.1。User ID: Administrator ; Passeword: Administrator。注 意区分大小写。 二、显微镜镜下观察 1.微分干涉差观察 a)使用手控面板选择物镜。插入起偏镜。插入微分干涉滑块。 b)点击FV10-ASW软件中的图标。标本聚焦. 2.荧光观察: c)使用手控面板选择物镜。 d)打开汞灯的机械快门,拉出DIC滑块,点击FV10-ASW软件中的图标 e)使用手控面板选择荧光滤色片。标本聚焦。 3.获取单张荧光图像 a)点击FV10-ASW软件中的按钮。 b)关闭汞灯快门,点击按钮,关闭卤素灯快门。 c)点击染料选择按钮,在染料列表中,双击用于观察的荧光染料。点击Apply按钮。 d)点击XY Repeat按钮开始扫描。调节图像。点击Stop按钮停止扫描。 e)选择AutoHV,,并选择扫描速度。 f)点击XY按钮取得一幅图像。 g)点击SeriesDone按钮,“2D View-LiveImage(x)”2D界面就出现。 h)保存该幅图像:右图像管理器中显示的图像图标,选择另存为保存该幅图像。(保存为“xml”类型是击FV10-ASW 软件专用的图像格式。) 4.获得单张(荧光+微分干涉)图像 a)点击FV10-ASW软件中的按钮,关闭汞灯快门。点击按钮,关闭卤素灯快门。 b)点击染料选择按钮,在染料列表中,双击用于观察的荧光染料。点击Apply按钮。 c)选择TD1。 d)点击XY Repeat按钮开始扫描。调节绿色(FITC)图像和微分干涉差的图像。点击Stop按钮停止扫描。 e)选择AutoHV, 并选择扫描速度。 f)点击XY按钮取得一幅图像。 g)点击SeriesDone按钮, “2D View-LiveImage(x)”2D界面就出现。 h)保存该幅图像。 5.获取3D图像 例: 绿色荧光(FITC)和红色荧光(Rhodamine)双标(这里介绍线序列扫描取图的过程.)
激光共聚焦显微镜在材料领域应用的初探
激光共聚焦显微镜在材料领域应用初探 夏仲琦,周向群(2010-07-02 18:35:09) 一、前言 作为一种微观形态学工具,光学显微镜在工业测试方面的应用,目前主要大家比较熟悉的主要是以下方面: 首先,单独作为形态学工具,进行材料组织分析和外观缺陷检查,其典型的产品是金相显微镜和立体显微镜。 第二、光栅量测结合,进行部件的精密尺寸测量,其典型的产品是工具显微镜,测量显微镜。 近年来,随着计算机软件技术的发展,显微镜与图象处理系统的结合,产生了定量金相软件、工显测量软件、一般几何测量软件等等,使其不仅可以定性分析,更能在定量化上发挥重大作用。 但光学显微镜的局限在于,它是一种二维的形态学工具,其极限有效分辨率是0.35微米,该分辨率下的景深在1微米以下。因此如果要在高倍率下观察表面的三维形态,特别是纵向方向的形态,通常一定需要使用SEM而不是OM。SEM是这一方面非常成熟有效的标准工具,但有些样品使用SEM会碰到以下困难: 1、样品本身比较大,且不能做分割的器件组,虽然被观察的部分是微小的局部,但整个样品难 以放入SEM中。 2、非金属样品,且不适合做导电性处理。特别是一些对微小处理很敏感的样品。 3、无法测量多种尺寸数据,比如体积,面积,粗糙度等等。 针对这些问题,SEM厂家在不断推出更新的技术。同时,光学显微镜开发者也在探索如何使光学显微镜成为一种三维的微观形态学工具。 这方面目前比较有成效的技术,是激光扫描共焦显微镜(CF-LSM)。 共聚焦激光扫描显微镜的发展在国外,主要为日本。是从80年代末期开始的,目前在日本,共聚焦激光扫描显微镜已经是一种被广泛采用的技术,既用来观察样品表面亚微米程度(0.12微米)的三维形态和形貌,又可以测量多种微小的尺寸,诸如体积、面积、晶粒、膜厚、深度、长宽、线粗糙度、面粗糙度等等。 另外,它还有以下特点: 1、使用方便,与一般光学相似,且全部采用计算机直观控制。 2、基本无须制样,不损伤样品。不需要做导电处理,也容许大尺寸样品直接观察,完全不破坏样品。 3、几十秒到一两分钟即完成全部的扫描,成像,测量采样工作。该设备目前已经为吉林大学,哈 尔滨工业大学用于材料和机械加工方面的研究。
激光扫描共聚焦显微镜及其应用讲解
激光扫描共聚焦显微镜及其应用 激光扫描共聚焦显微镜(Laserscanningconfocalmicroscope,LSCM)是近代最先进的细胞生物医学分析仪器之一。它是在荧光显微镜成像的基础上加装激光扫描装置,使用紫外光或可见光激光荧光探针,利用计算机进行图像处理,不仅可观察固定的细胞、组织切片,还可对活细胞的结构、分子、离子进行实时动态地观察和检测。目前,激光扫描共聚焦显微技术已用于细胞形态定位、立体结构重组、动态变化过程等研究,并提供定量荧光测定、定量图像 激光扫描共聚焦显微镜(Laser scanning confocal microscope, LSCM)是近代最先进的细胞生物医学分析仪器之一。它是在荧光显微镜成像的基础上加装激光扫描装置,使用紫外光或可见光激光荧光探针,利用计算机进行图像处理,不仅可观察固定的细胞、组织切片,还可对活细胞的结构、分子、离子进行实时动态地观察和检测。目前,激光扫描共聚焦显微技术已用于细胞形态定位、立体结构重组、动态变化过程等研究,并提供定量荧光测定、定量图像分析等实用研究手段,结合其他相关生物技术,在形态学、生理学、免疫学、遗传学等分子细胞生物学领域得到广泛应用。 激光共聚焦显微镜的原理 激光扫描共聚焦显微镜是采用激光作为光源,在传统光学显微镜基础上采用共轭聚焦原理和装置,并利用计算机对所观察的对象进行数字图象处理的一套观察、分析和输出系统。 主要系统包括激光光源、自动显微镜、扫描模块(包括共聚焦光路通道和针孔、扫描镜、检测器)、数字信号处理器、计算机以及图象输出设备(显示器、彩色打印机)等。 通过激光扫描共聚焦显微镜,可以对观察样品进行断层扫描和成像。因此,可以无损伤的观察和分析细胞的三维空间结构。同时,通过激光扫描共聚焦显微镜也是活细胞的动态观察、多重免疫荧光标记和离子荧光标记观察的有力工具。 主要功能 1、图像处理功能 2、细胞生物学功能应用范围:(1)定量荧光测定;(2)定量共焦图像分析;(3)光学切片及三维重组;(4)动态观察;(5)荧光漂白恢复研究;(6)质膜流动性研究;(7)蛋白质相互作用研究;(8)激光显微外科及“光陷阱”研究;(9)光活化技术研究。 (编辑:文静)
共聚焦显微镜
共聚焦显微镜 从一个点光源发射的探测光通过透镜聚焦到被观测物体上,如果物体恰在焦点上,那么反射光通过原透镜应当汇聚回到光源,这就是所谓的共聚焦,简称共焦。共焦显微镜[confocallaserscanningmicroscope(clsm或lscm)]在反射光的光路上加上了一块半反半透镜(dichroicmirror),将已经通过透镜的反射光折向其它方向,在其焦点上有一个带有针孔(pinhole)的挡板,小孔就位于焦点处,挡板后面是一个光电倍增管 (photomultipliertube,pmt)。可以想像,探测光焦点前后的反射光通过这一套共焦系统,必不能聚焦到小孔上,会被挡板挡住。于是光度计测量的就是焦点处的反射光强度。其意义是:通过移动透镜系统可以对一个半透明的物体进行三维扫描。 激光扫描共聚焦显微镜是二十世纪80年代发展起来的一项具有
划时代的高科技产品,它是在荧光显微镜成像基础上加装了激光扫描装置,利用计算机进行图像处理,把光学成像的分辨率提高了 30%--40%,使用紫外或可见光激发荧光探针,从而得到细胞或组织内部微细结构的荧光图像,在亚细胞水平上观察诸如ca2+、ph值,膜电位等生理信号及细胞形态的变化,成为形态学,分子生物学,神经科学,药理学,遗传学等领域中新一代强有力的研究工具。激光共聚焦成像系统能够用于观察各种染色、非染色和荧光标记的组织和细胞等,观察研究组织切片,细胞活体的生长发育特征,研究测定细胞内物质运输和能量转换。能够进行活体细胞中离子和ph值变化研究(ratio),神经递质研究,微分干涉及荧光的断层扫描,多重荧光的断层扫描及重叠,荧光光谱分析荧光各项指标定量分析荧光样品的时间延迟扫描及动态构件组织与细胞的三维动态结构构件,荧光共振能量的转移的分析,荧光原位杂交研究(fish),细胞骨架研究,基因定位研究,原位实时pcr产物分析,荧光漂白恢复研究(frap),胞间通讯研究,蛋白质间研究,膜电位与膜流动性等研究,完成图像分
激光共聚焦显微镜FV中文说明书完整版
激光共聚焦显微镜F V 中文说明书 HEN system office room 【HEN16H-HENS2AHENS8Q8-HENH1688】
激光共聚焦显微镜 FV1000 (倒置显微镜IX81) 简易使用说明书 开启系统 1.打开计算机. 2.打开激光器.(打开钥匙开关.) 2-1.多线氩离子 (458 nm, 488 nm, 514 nm) ON 2-2氦氖绿 (543 nm) ON 2-3氦氖红 (633 nm) ON 3.打开汞灯电源开关. 4.登陆 Windows XP 系统. User ID: Administrator Password: fluoview 5.双击快捷方式: User ID: Administrator Password: Administrator * 系统软件的启动需要等待一定时间. 5 2 3 1
显微镜镜下观察 微分干涉差观察 1.使用手控面板选择物镜. (参照Memo.) 2.插入起偏镜. 3.插入微分干涉滑块. 4.点击FV10-ASW 软件中的图标. Note1:使用TD 滑块控制卤素灯 的光强; Note2:检查滤色片转盘的位置是否为“”,如果不是,用手柄按下DICT 图标 5.标本聚焦 显微镜镜下观察 荧光观察 *DIC 元件 1 2 4 手控面板 用此旋钮进行微分干 涉法对比度的调节 . Memo 按照 7-1 的操作转换物镜的倍率之后,对: ● 物镜 ● 各物镜对应的 D IC 元件 * 进行操作 .
1.使用手控面板选择物镜. 2.点击FV10-ASW 软件中的图标. 3.使用手控面板选择荧光滤色片.(参照 Memo.) 4.标本聚焦. 1 2 3 Hand switch Note 2 Notes 1 & 3 Memo 关于荧光滤色片 NIBA : 蓝色激发 / 绿色荧光 (例: FITC 、 EGFP 等) WIG : 绿色激发 / 红 色 荧光 (例: Rhodamine 、 DsRed 等)
共聚焦显微镜原理及其应用
共聚焦显微镜原理及其应用 传统的光学显微镜使用的是场光源,标本上每一点的图像都会受到邻近点的衍射或散射光的干扰;激光扫描共聚焦显微镜利用激光束经照明针孔形成点光源对标本内焦平面的每一点扫描,标本上的被照射点,在探测针孔处成像,由探测针孔后的光点倍增管(PMT)或冷电耦器件(cCCD)逐点或逐线接收,迅速在计算机监视器屏幕上形成荧光图像。照明针孔与探测针孔相对于物镜焦平面是共轭的,焦平面上的点同时聚焦于照明针孔和发射针孔,焦平面以外的点不会在探测针孔处成像,这样得到的共聚焦图像是标本的光学横断面,克服了普通显微镜图像模糊的缺点。它是在荧光显微镜成像基础上加装了激光扫描装置,利用计算机进行图像处理,把光学成像的分辨率提高了30%--40%,使用紫外或可见光激发荧光探针,从而得到细胞或组织内部微细结构的荧光图像,在亚细胞水平上观察诸如Ca2+ 、PH值,膜电位等生理信号及细胞形态的变化,成为形态学,分子生物学,神经科学,药理学,遗传学等领域中新一代强有力的研究工具。激光共聚焦成像系统能够用于观察各种染色、非染色和荧光标记的组织和细胞等,观察研究组织切片,细胞活体的生长发育特征,研究测定细胞内物质运输和能量转换。能够进行活体细胞中离子和PH值变化研究(RATIO),神经递质研究,微分干涉及荧光的断层扫描,多重荧光的断层扫描及重叠,荧光光谱分析荧光各项指标定量分析荧光样品的时间延迟扫描及动态构件组织与细胞的三维动态结构构件,荧光共振能量的转移的分析,荧光原位杂交研究(FISH),细胞骨架研究,基因定位研究,原位实时PCR产物分析,荧光漂白恢复研究(FRAP),胞间通讯研究,蛋白质间研究,膜电位与膜流动性等研究,完成图像分析和三维重建等分析。 共聚焦显微镜的应用。细胞形态学分析(观察细胞或组织内部微细结构,如:细胞内线粒体、内质网、高尔基体、微管、微丝、细胞桥、染色体等亚细胞结构的形态特征;半定量免疫荧光分析);荧光原位杂交研究;基因定位研究及三维重建分析。 1.细胞生物学:细胞结构、细胞骨架、细胞膜结构、流动性、受体、细胞器结构和分布变化 2.生物化学:酶、核酸、FISH(荧光原位杂交)、受体分析 3.药理学:药物对细胞的作用及其动力学 4.生理学:膜受体、离子通道、细胞内离子含量、分布、动态 5.神经生物学:神经细胞结构、神经递质的成分、运输和传递、递质受体、离子内外流、神经组织结构、细胞分布 6.微生物学和寄生虫学:细菌、寄生虫形态结构 7.病理学及临床应用:活检标本诊断、肿瘤诊断、自身免疫性疾病诊断、HIV等 8.遗传学和组胚学:细胞生长、分化、成熟变化、细胞的三维结构、染色体分析、基因表达、基因诊断 激光共聚焦显微镜在医学领域中的应用: A.在细胞及分子生物学中的应用 1. 细胞、组织的三维观察和定量测量 2. 活细胞生理信号的动态监测 3. 粘附细胞的分选 4. 细胞激光显微外科和光陷阱功能 5. 光漂白后的荧光恢复 6. 在细胞凋亡研究中的应用 B.在神经科学中的应用 1. 定量荧光测定 2. 细胞内离子的测定
激光扫描共聚焦显微镜在生命科学中的应用
激光扫描共聚焦显微镜在生命科学中的应用 实验目的与要求 1. 掌握激光扫描共聚焦显微镜的成像基本原理及其在生命科学中的应用。 一、激光扫描共聚焦显微镜的成像基本原理 1.普通荧光显微镜的不足 使用荧光物质标记细胞中的特定成分或结构,不仅图像与对比度增强,而且由于许多荧光显微镜的光源使用短波长的紫外光,大大提高了分辩率(δ=0.61 λ/ NA )。但当所观察的荧光标本稍厚时,普通荧光显微镜不仅接收焦平面上的光量,而且来自焦平面上方或下方的散射荧光也被物镜接收,这些来自焦平面以外的荧光使观察到的图像反差和分辨率大大降低(即焦平面以外的荧光结构模糊、发虚,原因是大多数生物学标本是层次区别的重叠结构)。 Laser Scanning Confocal Microscope 2. 共聚焦扫描显微镜的成像原理 采用点光源照射标本,在焦平面上形成一个轮廓分明的小的光点,该点被照射后发出的荧光被物镜收集,并沿原照射光路回送到由双向色镜构成的分光器。分光器将荧光直接送到探测器。光源和探测器前方都各有一个针孔,分别称为照明针孔和探测针孔。两者的几何尺寸一致,约100-200nm;相对于焦平面上的光点,两者是共轭的,即光点通过一系列的透镜,最终可同时聚焦于照明针孔和探测针孔。这样,来自焦平面的光,可以会聚在探测孔范围之内,而来自焦平面上方或下方的散射光都被挡在探测孔之外而不能成像。以激光逐点扫描样品,探测针孔后的光电倍增管也逐点获得对应光点的共聚焦图像,转为数字信号传输至计算机,最终在屏幕上聚合成清晰的整个焦平面的共聚焦图像。 Confocal Principle
每一幅焦平面图像实际上是标本的光学横切面,这个光学横短面总是有一定厚度的,又称为光学薄片。由于焦点处的光强远大于非焦点处的光强,而且非焦平面光被针孔滤去,因此共聚焦系统的景深近似为零,沿Z轴方向的扫描可以实现光学断层扫描,形成待观察样品聚焦光斑处二维的光学切片。把X-Y平面(焦平面)扫描与Z轴(光轴)扫描相结合,通过累加连续层次的二维图像,经过专门的计算机软件处理,可以获得样品的三维图像。 LSCM的基本特点 观察方式:以荧光为主 光源:激光(紫外、可见光、近红外) 照明方式:点照明、逐点扫描 成像方式:共聚焦、逐点成像 输出:实时观测,数字化图像,可以进行图像处理和定量分析多重染色样品的观察 3. 共聚焦扫描显微镜在生命科学研究中的应用 细胞结构、蛋白质(如受体、抗原、抗体、酶、细胞 骨架蛋白等基因表达产物)、DNA、RNA等 细胞膜流动性(荧光光漂白恢复技术) 细胞内氧自由基活性 细胞内钙离子浓度变化 膜电位
OlympusFV1200激光共聚焦显微镜系统操作手册
Olympus FV1200激光共聚焦显微镜系统操作手册 一、开关机步骤 1、开机步骤 1)打开计算机 2)打开汞灯电源开关 3)打开显微镜开关 4)打开载物台控制器开关 5)打开显微镜触屏面板开关 6)打开扫描头开关(先开开关键,然后将钥匙顺时针拧 到on位置) 7)打开激光器 ①405nm,633nm:打开开关键即可 ②559nm:先开开关键,绿色指示灯闪烁(约两分钟), 停止闪烁后将钥匙顺时针拧到on位置(红灯闪烁,停止 闪烁后即开启完成) ③多线氩离子(458nm,488nm,514nm):先开开关键, 然后将钥匙顺时针拧到on位置 8)双击电脑桌面上打开 FV10-ASW 4.0应用软件。 2、关机步骤 1)关闭FV10-ASW 4.0应用软件 2)关闭激光器(注意: 多线氩离子458nm,488nm,514nm 需先关钥匙,等风机散热20分钟后再关闭开关键)
3)关闭扫描头(先将钥匙拧到off位置,再关开关键) 4)关闭显微镜触屏面板 5)关闭载物台控制器 6)关显微镜开关 7)关汞灯,先关前面off按钮,倒计时30s,再关后方 开关键 8)关计算机 二、显微镜观察 1、用触屏面板选择物镜; 2、点击触屏面板EPI,选择需要的荧光滤片,如下图: 紫外激发/蓝色光 蓝色激发/绿色荧光 绿色激发/红色荧光) 打开,显微镜目镜下观察样品,推动载物台控制手柄可水平方向移动样品,转动调焦旋钮可调节焦距;
三、获图 XY多通道扫描 1、镜下调好之后,点击软件中的按钮,关闭汞灯快门。 2、首先进行软件设置: 在Acquisition Setting里将扫描速度设置为 8us/Pixel,像素数一般设置为1024*1024。 在Image Acquisition Control里点击Dye List按 钮,在染料列表中,双击用于观察的荧光染料(注:再次 双击已选项目可取消),然后点击Apply按钮。 3、将Image Acquisition Control面板中Filter Mode里 Kalman 打钩选中,设置线平均Line 2次,这样可以降低 图像的噪声。(见下图)
