基团贡献方法

基团贡献方法(UNIFAC)估算局部组成模型(NRTL\WILSON\UNIQUAC)的二元参数
结合海友的问题给出详细步骤:https://www.360docs.net/doc/274354295.html,/thread-581160-1-1.html
海友的问题:在模拟时,选用NRTL热力学方法时,二元交互作用参数中没有丙酮和2-甲基戊烷,但在文献中说二者能共沸,常压下组成为丙酮:44%,2-甲基戊烷:56%(质量分数),共沸温度为47摄氏度。
请教高手,如何在ASPEN中设置?
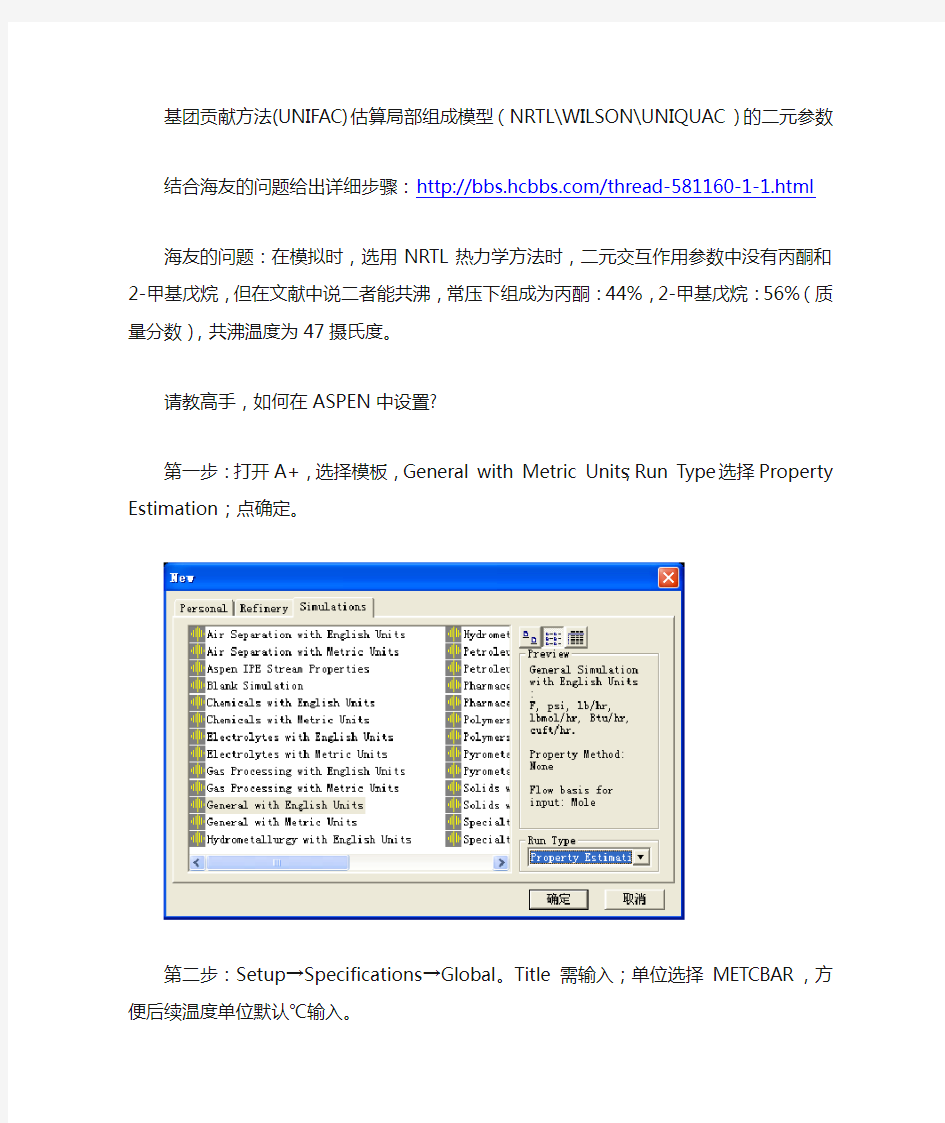
第一步:打开A+,选择模板,General with Metric Units;Run Type选择Property Estimation;点确定。
第二步:Setup→Specifications→Global。Title 需输入;单位选择METCBAR,方便后续温度单位默认℃输入。
第三步:Components→selection→Define components 输入丙酮、2-甲基戊烷。
第四步:Properties→Estimation→Input→Setup→Estimation options→Estimate only the selected parameters→只勾选Binary interaction parameters。
第五步:在Binary对话框中,点击New, Parameter选择NRTL, Method选择UNIF-DMD,
Component i 选择丙酮,Component j 选择2-甲基戊烷。在Temperature中输入多个温度点。温度范围最好包括两物质的沸点,这点很重要,影响二元参数的准确度。在这里输入25、30、35、40、45、50、55、60、65共9个温度点。
第六步:Run,查看Results。
运行后,NRTL参数自动保存在NRTL二元相互作用参数中。
第七步:利用该二元交互参数分析其共沸。首先,将Run Type 改回Flowsheet模式
第八步:Tools→Analysis→Properties→Binary,Analysis 选择Txy,Basis选择Mass fraction,点击Go。
第九步:查看Txy曲线,求得共沸点常压下组成为丙酮:44.4%,2-甲基戊烷:55.6%(质
量分数),共沸温度为46.5摄氏度。
小结:UNIF-DMD估算得到的二元参数对丙酮与2-甲基戊烷共沸求算与文献值较为吻合。在估算当中,估算温度的输入较为关键,当输入温度仅有1个的时候,共沸求算有差异。温度输入最好包括两者的沸点。也就是NRTL参数的TLOWER和TUPPER。
基团贡献方法UNIFAC估算局部组成模型NRTLWILSONUNIQUAC的二元参数
基团贡献方法(UNIFAC)估算局部组成模型(NRTL\WILSON\UNIQUAC)的二元参数 结合海友的问题给出详细步骤:https://www.360docs.net/doc/274354295.html,/thread-581160-1-1.html 海友的问题:在模拟时,选用NRTL热力学方法时,二元交互作用参数中没有丙酮和2-甲基戊烷,但在文献中说二者能共沸,常压下组成为丙酮:44%,2-甲基戊烷:56%(质量分数),共沸温度为47摄氏度。 请教高手,如何在ASPEN中设置?
问题: 1. 在第五步中的Method为什么选Unif-DMD,而没有选其他的方法,比如UNIF-LBY、UNIF-R4等,这些方法有什么本质上的区别吗 UNIFAC-DMD,LBY等没有本质区别,只是修正模型不同而已。你找我发的那个A+10说明书看下,有详细介绍是什么修正。 2. 如果我不想使用Aspen自带的unifac基团交互参数,而是用自己的unifac基团交互参数(基团参数rq仍旧采用软件自带的),来进行楼主帖子中这样的估算,如何操作? 另外,除了上面的问题外,还有一问,那就是如果我自己定义了Aspen中没有的新基团(有时候想把一个物质自己来进行拆分),而且通过别的途径得到了新基团的基团参数RQ以及所需要的相关基团交互参数,那么在这种情况下,在Aspen中怎么样来定义新基团,然后进行楼主帖子中的估算操作呢? 还请楼主解答。 今天研究了一下,你的这两个问题应该都可以解决: 1、当你选择UNIFAC方法的时候,A+默认使用数据库中参数,但也可以修改。你只需要在parameters→unifac group binary→GMUFB-1中输入参数即可。但这前提是你在components中有定义unifac groups,否则gmufb-1是灰色。 2、a+ components的UNIFAC group支持定义新的基团。号码可以自己定义。关键是你能定义官能团(方法有很多,bondi、unifac等等),这一步在分子结构中实现,并可以求的q、r的值。同样你可以在参数中输入。这个时候你不需要在进行回归了。 上面的关键是如何定义官能团(新或者旧)。
天津大学化工热力学试卷二
20 ~20 学年第 学期期末考试试卷 学院 化工学院 专业 化学工程与工艺 班 一、判断题:试判断对错,并写出原因或相应的公式(2分×5=10分) 1. 熵增原理的表达式为:0≥?S ( ) 2.二阶舍项维里方程可用于计算纯物质的逸度系数( ) 3. RK 方程中,常数b a ,的混合规则分别为 ∑∑==i i i M i i i M b y b a y a ( ) 4.无论以Henry 定律为基准,还是以Lewis-Randall 规则为基准定义活度,活度和逸度的值不变。( ) 5.烃类物系汽液平衡计算可以使用K 值法。 ( ) 二、简答题 (5分×7=35分) 1. 写出稳定流动系统热力学第一定律的一般形式,并对流体流经泵和流经换热器的系统进行适当的简化。 2. 写出水在一定温度下的饱和蒸气压的获得方法。 3.有人提出用下列方程组来表示恒温、恒压下简单二元体系的偏摩尔体积 22 22221111)()(bx x a b a V V bx x a b a V V --+=---+=- 式中:V 1和V 2是纯组分的摩尔体积,a 、 b 只是T 、P 的函数。试从热力学的角度分析这些方程是否合理 4. 写出局部组成的概念,并说明Wilson 方程和NRTL 方程的适用条件。 5. 请写出中低压下汽液相平衡的关系式。(其中:液相用活度系数表示,以 Lewis-Randall 规则为基准;汽相用逸 度系数表示)。 6. 说明基团贡献法的出发点、优点及局限性 7. 简述估算沸点下蒸发焓的方法 三、计算题(共55分) 1. (1)已知某饱和液体在273K 时,H m =0, S m =0,饱和蒸气压为1.27×105Pa ,若求478K ,68.9×105Pa 时该物质 蒸汽的H m 和S m ,请设计出计算路径,并画出图。 (2)请写出各步骤的焓和熵的计算公式。已知:该物质的饱和蒸气压方程为:T B A P s - =ln ,状态方程为:Cp RT pV m +=, 理想气体热容为:ET D C id m p +=,,式中各物理量均为国际单位制标准单位,A 、B 、C 、D 、 E 为常数。 2. 某二元溶液,Lewis-Randall 规则标准态的超额Gibbs 自由能可由下式给出:21/x x RT G E β= 式中:β为常数,两纯组元逸度分别为 *1f 和*2f ,单位为Pa, 1:-?mol J G E , T :K, 求: (1) 以Lewis-Randall 规则为标准态的活度系数1γ与2γ的表达式。 (2) 以Henry 定律为标准态的活度系数'1γ与' 2γ的表达式。 3.低压下丙酮(1)—乙腈(2)二元体系的汽液平衡中,汽液两相假定均可视为理想体系,查得丙酮、乙腈的饱和蒸气压方程如下: 15.4947 .29452874.16]502.7ln[93.3546 .29406513.16]502.7ln[21-- =-- =T p T p s s ,1s p s p 2 的单位为KPa , T 的单位为K 。试求: (1) 当p 为85KPa, t 为55?C ,该体系的汽液平衡组成y 1, x 1 (2) 溶液中总组成为z 1=0.8,当p 为85KPa, t 为55?C ,该体系的液相分率以及汽液相组成y 1, x 1 (3) 当t 为55?C ,汽相组成y 1=0.5时相平衡压力与液相组成x 1 (4) 当t 为55?C ,液相组成x 1=0.35时的相平衡压力与汽相组成y 1
北京化工大学高等化热大作业-基团贡献法
浅谈基团贡献法 引言 不久前,我前往导师XXX的办公室,与他沟通交流学业上的问题。谈话间,王老师提及的一种建立自由基聚合反应过程机理模型的方法──链节分析法[1],引起了我极大的兴趣。这一方法可以对复杂的聚合反应过程进行准确的动态模拟,解决了以往须同时求解无限多个微分方程才能模拟聚合过程的难题。通过这篇文献[1]我得知,对于高分子聚合物体系的热力学性质的处理,一直是建立聚合反应机理模型的难题之一。此法[1]不再把组成和链长不同的无穷多的聚合物大分子作为组分,而是将流程模拟系统的组分中出现的C、E、A·、R·等基本单元,参考其相应的单体物性,从而得到大分子聚合物的各种热力学性质。高分子的绝大部分热力学性质如密度ρ、比热容C p、焓H、摩尔体积V b、各种临界参数都能利用Joback基团贡献法,由基本单元的物性计算得到。联想到化热课堂上与基团贡献法有关的似乎只有UNIFAC模型,因此我想对物性估算法中的基团贡献法展开讨论,描述各种不同的方法并加以简单的评价。这便是本题目的来源。 第1章临界参数估算方法 不论是通过自己对化工热力学的学习,还是通过对文献的查阅,都不难得出这样的结论:对纯物质而言,临界参数是最重要的物性参数之一。其实,在所有的PVT 关系中,无论是对应状态法还是状态方程法都与临界数据有关。对应状态法已成为应用热力学的最基本法则[2],借助于对应状态法,物质的几乎所有的热力学参数和大量的传递参数可被预测,而对应状态法的使用又强烈地依赖于临界数据。此外,涉及到临界现象的高压操作,如超临界萃取和石油钻井[2],也与临界参数密切相关。总而言之,临界数据是化工设计和计算中不可缺少的重要数据。 临界参数如此重要,前人自然少不了花费巨大精力对其进行收集、整理和评定,但据我了解,所收集的临界数据大多局限于稳定物质的临界数据。虽然近几年对不稳定物质临界参数测定方法的研究在开展着,并且也测定了一些不稳定物质的临界参数,但大部分的不稳定物质仍由于测定难度大而缺乏实测的临界数据。因此,人们在致力
中南大学化工热力学试卷
中南大学考试试卷 2011——2012学年第1学期 化工热力学 课程 52学时 3.5 学分 考试形式:闭卷 专业年级:化工0901—0903 总分100分,占总评成绩70% 注:将答案写在答题纸上。 一、填空(每空1分,共30分)。 1. 化工热力学研究特点主要有四个方面:其研究体系状态为_________;获取数据的 方法为_______________;处理方法为_______________;应用领域为___________。 2. 纯物质PV 图临界等温线在临界点处的斜率和曲率都等于_______,数学上可以表示 为______________和_______________。 3. 理想气体微观上的三个特征是(1)_______________;(2)_____________;(3) ________________。 4. 在P 、V 、T 、U 、H 、S 、A 、G 这些热力学性质中,属于强度性质的有_______。 5. 逸度定义式为____________,活度系数的定义式为_______________。 6. 相平衡的判据是________________,汽液平衡数据的热力学一致性检验是指 ______________。 7. 用的组成主要有________、__________、___________、__________。 8. 等温、等压下的二元液体混合物的活度系数之间的关系为:___________+x 2dln ?2 =0。 9. 热力学一致性检验的原理主要是___________________,其方法分为两类,一类是 ________________,另一类是__________________。 10. 基团贡献法的原理是________________,有______和_______两种方法。 11. 反应进度是指______________________。 12. 反应体系相率表达式为______________。独立反应数可以通过_______和_______两 种方法确定。 二、单项选择题(每小题1分,共5分)。 1、 下列热力学性质中,属于过程函数的是______________。 A 、内能、 B 、热量、 C 、焓、 D 、自由焓、 2、下列热力学基本关系式与Maxwell 公式中,错误的是___________。 A 、dG = VdT – SdT B 、dH = TdS + VdP C 、 T V V S T P ??? ????-=??? ???? D 、V S S P V T ??? ????-=??? ???? 3、节流过程属于___________。 A 、等温过程、 B 、等压过程、 C 、等熵过程、 D 、等焓过程 4、下列表达式中,属于偏摩尔性质的是__________。 A 、 nj P S i n nV ,,)()(???? ???? B 、nj T V i n nG ,,)()(? ??? ???? C 、 nj T S i n nH ,,)()(???? ???? D 、nj P T i n nA ,,)()(???? ????
物性数据估算考查题2013
2013年《物性数据估算》选修课程考查题 姓名:吴景程学号:2010650621班级:2010级化学工程与工艺三班 (含4道问答题、1道计算题,共5道题。要求4道问答题总字数不低于2000字,可加页。每人独立作答,不得相互抄袭。) 1、化学物质的基本物性主要包括哪些,主要从哪些手册上可查阅到基本物性数据,物性数据的估算主要有哪些方法? 答:基本物性主要包括:密度,粘度,表面张力,溶解度,沸点和凝点,蒸气压,比热容,导热系数,汽化热、溶解热和熔融热,焓和熵,临界值,普朗特数,扩散系数,折射率和折射度,压缩因子,气-液平衡常数、挥发度和逸度,活度系数,偏心因子,P-V-T 数据等。 基本物性数据查阅手册:石油化工基础数据手册,化学试剂国内外标准手册 ,溶剂手册,化工工艺算图手册,物性手册查用基础,《危险货物品名表》速查手册,试剂手册,《化工计算手册》,水处理化学品手册 ,兰氏化学手册,《氯碱工业理化常数手册》,纯物质热化学数据手册 ,无机精细化学品手册,化学化工物性数据手,[美]B.E.波林《气液物性估算手册》,工业气体手册,气体数据手册等。 物性数据的估算方法:对应状态法(对比态法,两参数法,三参数法,极性参数法,沸点参数,量子参数法),基团贡献法,UNIFAC 法;状态方程法等。 两参数法 对比状态法从p -V -T 关系开始,van der Waals 方程: 提供了压缩因子Z 的估算方法(两参数压缩因子图) 发展为估算蒸气压、蒸发焓、焓差、熵差、热容差、逸度系数等一系列热力学性质的计算。 此法使用方便,但主要用于计算气相。 三参数法 加入第三参数可更好地反映物质的特性,因此在p -V -T 及其他各种热力学性质计算中更准确、更常用的三参数是偏心因子和临界压缩因子。 使用 和Zc 后,有关液相的计算更加准确了。 用作为第三参数时,作为标准的是球形流体(Ar 、Kr 、Xe ),后者的为零。 Lee -Kesler 是三参数法的一种改进,选择两种参考流体的方法更准确些。但复杂得多。 对比状态法和状态方程法比较 从计算方法比较,这两种方法有很大差异 但状态方程法中,所用参数都是从临界参数计算,即以Tc 、pc 、来表达的,在处理混合物时,需要用实验值回归交互作用参数,这样的计算成为估算方法。 对比态法在处理户混合物时也存在同样的问题。因此这两种方法也有一定的共同点。 2、介绍物质的偏心因子的概念,它的测定和估算方法是什么,利用物质的偏心因子可以有哪些应用? (),,0 r r r p T V φ=ωωω
化工热力学教学大纲
《化工热力学》教学大纲 一、课程基本信息 课程中文名称:化工热力学 课程英文名称:Chemical Engineering Thermodynamics 课程编号:06131050 课程类型:学科基础课 总学时:54 学分:3 适用专业:化学工程与工艺 先修课程:物理化学、化工原理 开课院系:化工与制药学院 二、课程的性质与任务 化工热力学是化学工程学的一个重要分支,是化工类专业必修的专业基础课程。它是化工过程研究、开发与设计的理论基础,是一门理论性与应用性均较强的课程。该门课系统地介绍了将热力学原理应用于化学工程技术领域的研究方法。它以热力学第一、第二定律为基础,研究化工过程中各种能量的相互转化及其有效利用,深刻阐述了各种物理和化学变化过程达到平衡的理论极限、条件和状态。 设置本课程,为了使考生能够掌握化工热力学的基本概念、理论和专业知识;能利用化工热力学的原理和模型对化工中涉及到的化学反应平衡原理、相平衡原理等进行分析和研究;能利用化工热力学的方法对化工中涉及的物系的热力学性质和其它化工物性进行关联和推算;并学会利用化工热力学的基本理论对化工中能量进行分析等。 三、课程教学基本要求 通过本课程学习,要求 1.正确理解化工热力学的有关基本概念和理论; 2.理解各个概念之间的联系和应用; 3.掌握化工热力学的基本计算方法; 4.能理论联系实际,灵活分析和解决实际化工生产和设计中的有关问题。 四、理论教学内容和基本要求
教学内容 第一章绪论 1.1 热力学发展简史 1.2 化工热力学的主要研究内容 1.3 化工热力学的研究方法及其发展1.4 化工热力学在化工中的重要性第二章流体的p-V-T关系 2.1 纯物质的p –V –T关系 2.2 气体的状态方程 2.2.1理想气体状态 2.2.2 维里方程 2.2.3 立方型状态方程 2.2.4 多参数状态方程 2.3 对应态原理及其应用 2.3.1 对比态原理 2.3.2 三参数对应态原理 2.3.3 普遍化状态方程 2.4 真实气体混合物的p-V-T关系2.4.1 混合规则 2.4.2气体混合物的虚拟临界性质2.4.2 气体混合的第二维里系数 2.4.3 混合物的状态方程 2.5液体的p –V -T关系 2.5.1 饱和液体体积 2.5.2 压缩液体(过冷液体)体积2.5.3 液体混合物的p –V -T关系 第三章纯流体的热力学性质 3.1 热力学性质间的关系 3.1.1 热力学基本方程 3.1.2 Maxwell关系式 3.2焓变与熵变的计算
四川大学化工热力学试卷
四川大学化工热力学期末考试试卷 一、判断题:试判断对错,并写出原因或相应的公式(2分×5=10分) 1. 熵增原理的表达式为:0≥?S ( ) 2.二阶舍项维里方程可用于计算纯物质的逸度系数( ) 3. RK 方程中,常数b a ,的混合规则分别为 ∑∑==i i i M i i i M b y b a y a ( ) 4.无论以Henry 定律为基准,还是以Lewis-Randall 规则为基准定义活度,活度和逸度的值不变。( ) 5.烃类物系汽液平衡计算可以使用K 值法。 ( ) 二、简答题 (5分×7=35分) 1. 写出稳定流动系统热力学第一定律的一般形式,并对流体流经泵和流经换热器的系统进行适当的简化。 2. 写出水在一定温度下的饱和蒸气压的获得方法。 3.有人提出用下列方程组来表示恒温、恒压下简单二元体系的偏摩尔体积 22 22221111)()(bx x a b a V V bx x a b a V V --+=---+=- 式中:V 1和V 2是纯组分的摩尔体积,a 、 b 只是T 、P 的函数。试从热力学的角度分析这些方程是否合理 4. 写出局部组成的概念,并说明Wilson 方程和NRTL 方程的适用条件。 5. 请写出中低压下汽液相平衡的关系式。(其中:液相用活度系数表示,以 Lewis-Randall 规则为基准;汽相用逸 度系数表示)。 6. 说明基团贡献法的出发点、优点及局限性 7. 简述估算沸点下蒸发焓的方法 三、计算题(共55分) 1. (1)已知某饱和液体在273K 时,H m =0, S m =0,饱和蒸气压为1.27×105Pa ,若求478K ,68.9×105Pa 时该物质 蒸汽的H m 和S m ,请设计出计算路径,并画出图。 (2)请写出各步骤的焓和熵的计算公式。已知:该物质的饱和蒸气压方程为:T B A P s - =ln ,状态方程为:Cp RT pV m +=, 理想气体热容为:ET D C id m p +=,,式中各物理量均为国际单位制标准单位,A 、B 、C 、D 、E 为常数。 2. 某二元溶液,Lewis-Randall 规则标准态的超额Gibbs 自由能可由下式给出:21/x x RT G E β= 式中:β为常数,两纯组元逸度分别为 *1f 和*2f ,单位为Pa, 1:-?mol J G E , T :K, 求: (1) 以Lewis-Randall 规则为标准态的活度系数1γ与2γ的表达式。 (2) 以Henry 定律为标准态的活度系数'1γ与' 2γ的表达式。 3.低压下丙酮(1)—乙腈(2)二元体系的汽液平衡中,汽液两相假定均可视为理想体系,查得丙酮、乙腈的饱和蒸气压方程如下: 15.4947 .29452874.16]502.7ln[93.3546 .29406513.16]502.7ln[21-- =-- =T p T p s s ,1s p s p 2 的单位为KPa , T 的单位为K 。试求: (1) 当p 为85KPa, t 为55?C ,该体系的汽液平衡组成y 1, x 1 (2) 溶液中总组成为z 1=0.8,当p 为85KPa, t 为55?C ,该体系的液相分率以及汽液相组成y 1, x 1 (3) 当t 为55?C ,汽相组成y 1=0.5时相平衡压力与液相组成x 1
化工热力学试卷二
本科生期末考试试卷统一格式(16开): 20 ~20 学年第 学期期末考试试卷 《化工热力学》(A 或B 卷 共 页) (考试时间: 年 月 日) 学院 化工学院 专业 化学工程与工艺 班 年级 学号 姓名 1.熵增原理的表达式为:0≥?S ( ) 2.二阶舍项维里方程可用于计算纯物质的逸度系数( ) 3.RK 方程中,常数b a ,的混合规则分别为 ∑∑==i i i M i i i M b y b a y a ( ) 4.无论以Henry 定律为基准,还是以Lewis-Randall 规则为基准定义活度,活度和逸度的值不变。( ) 5.烃类物系汽液平衡计算可以使用K 值法。 ( ) 二、 简答题 (5分×7=35分) 1.写出稳定流动系统热力学第一定律的一般形式,并对流体流经泵和流经换热器的系统进行适当的简化。 2.写出水在一定温度下的饱和蒸气压的获得方法。 3.有人提出用下列方程组来表示恒温、恒压下简单二元体系的偏摩尔体积 22 2222 1111)()(bx x a b a V V bx x a b a V V --+=---+=- 式中:V 1和V 2是纯组分的摩尔体积,a 、 b 只是T 、P 的函数。 试从热力学的角度分析这些方程是否合理?
4.写出局部组成的概念,并说明Wilson 方程和NRTL 方程的适用条件。 5.请写出中低压下汽液相平衡的关系式。(其中:液相用活度系数表示,以 Lewis-Randall 规则为基准;汽相用逸度系数表示)。 6.说明基团贡献法的出发点、优点及局限性 7.简述估算沸点下蒸发焓的方法 三、 计算题(共55分) 1.(1)已知某饱和液体在273K 时,H m =0, S m =0,饱和蒸气压为1.27×105Pa ,若求478K ,68.9×105Pa 时该物质蒸汽的H m 和S m ,请设计出计算路径,并画出图。 (2)请写出各步骤的焓和熵的计算公式。已知:该物质的饱和蒸气压方 程为:T B A P s -=ln ,状态方程为:Cp RT pV m +=, 理想 气体热容为:ET D C id m p +=,,式中各物理量均为国际单位制标准单位,A 、B 、C 、D 、E 为常数。 2.某二元溶液,Lewis-Randall 规则标准态的超额Gibbs 自由能可由下式给出: 21/x x RT G E β= 式中:β为常数,两纯组元逸度分别为*1f 和* 2f ,单位为Pa, 1:-?mol J G E , T :K, 求: (1) 以Lewis-Randall 规则为标准态的活度系数1γ与2γ的表达式。 (2) 以Henry 定律为标准态的活度系数'1γ与' 2γ的表达式。 3.低压下丙酮(1)—乙腈(2)二元体系的汽液平衡中,汽液两相假定均可视为理想体系,查得丙酮、乙腈的饱和蒸气压方程如下: 15.4947 .29452874.16]502.7ln[93.3546 .29406513.16]502.7ln[21-- =-- =T p T p s s ,1s p s p 2的单位为KPa , T 的单
化工热力学教学大纲
《化工热力学》教学大纲 一、课程简介 课程名称:化工热力学 课程编号:01C0263 开课院系:化学工程系 总学时:48 课程类型:学科基础课,必修 先修课程:基础化学、物理化学 课程简介: 化工热力学是化学工程学的一个重要分支,是化工类专业必修的专业基础课程。它是化工过程研究、开发与设计的理论基础,是一门理论性与应用性均较强的课程。该门课系统地介绍了将热力学原理应用于化学工程技术领域的研究方法。它以热力学第一、第二定律为基础,研究化工过程中各种能量的相互转化及其有效利用,深刻阐述了各种物理和化学变化过程达到平衡的理论极限、条件和状态。 设置本课程,为了使考生能够掌握化工热力学的基本概念、理论和专业知识;能利用化工热力学的原理和模型对化工中涉及到的化学反应平衡原理、相平衡原理等进行分析和研究;能利用化工热力学的方法对化工中涉及的物系的热力学性质和其它化工物性进行关联和推算;并学会利用化工热力学的基本理论对化工中能量进行分析等。 Name of Course:Chemical Engineering Thermodynamics Course Code: 01C0263 School: chemical engineering department Credit Hours: 48 Required of Elective: Required Prerequisite:Essential Chemistry、Physical Chemistry Introduction: Chemical thermodynamics is one important branch of chemical engineering, and it is preliminary course for chemical engineering. It is the basic theory of researching, developing and design of chemical engineering process. This course is high of theorie s and applications. This course systematically introduces the research method about a dopting the thermodynamic theory to chemical engineering area. Based on the first an
化工热力学
化工热力学知识点总结 1 化工热力学与高等化工热力学的关系,处理问题的方法及重要性。答:化工热力学的研究方法分为:经典热力学方法和分子热力学方法。经典热力学不研究物质结构,不考虑过程机理,只从状态的起点和终点,用宏观角度研究大量分子组成的系统达到平衡时所表现出的宏观性质。经典热力学只能以实验数据为基础,进行宏观性质的关联,又基于基本热力学关系,从某些宏观性质推算另一些性质。 分子热力学从微观角度应用统计的方法,研究大量粒子群的特性,将宏观性质看作是相应微观量的统计平均值,因此可以应用统热力学的方法通过理论模型预测宏观性质。 经典热力学和分子热力学没有绝对的分界线。 化工热力学是一门定性的科学,更是一门定量的科学。在定性方面,可以指导改进工艺参数,指引温度、压力宜高还是宜低,物料配比宜多还是宜少,反应或分离是否可能。 化工热力学是化学工程和化学工艺的基石之一,离开化工热力学就没有定量的化学工程和现代的化学工艺。化学工业的发展,要克服化学品对环境的制约,在解决此难题时,化工热力学也将起重大作用。 2 学习高等化工热力学的目的和应用以及重要性。
3 解释相关概念:热力学体系、系综、热力学过程; 8种常用状态函数的基本关系式; 哪些体系性质属于容量性质; 热函数、偏导、响应函数、配分函数、势能函数的概念及应用与估算; 热力学四大定律; 答:热力学四大定律:①第一定律:能量守恒定律 ②第二定律:熵增原理③第三定律:绝对熵定律(绝对零度不可能达到)④第四定律:热平衡定律 热力学体系包括孤立体系,封闭体系和敞开体系。 孤立体系:与外界既无能量的交换,有无粒子的交换(有确定的体积V固定的粒子数N)—微正则系综 封闭体系:有确定的体积V,确定的温度T以及固定粒子数N 的体系(与外界有能量交换,无粒子交换)—正则系综 敞开体系:有确定的体积V,确定的温度T及确定的化学势N (既有能量的交换,又有粒子的交换) 系综:极大量宏观状态相同的系统的集合,每个系统各处在它所经历的某个微观状态,这样的系统称之为标本系统,而所构成的标本系统的集合称之为系综。
高等化工热力学参考题及答案
1 化工热力学主要解决那些工程实际问题及其应用中的难点? 主要解决的三类实际问题 (1)相平衡和化学反应平衡问题。 (2)过程的可行性分析和能量的有效利用。 (3)测量、推算与关联热力学性质。 应用中的难点 1 简化普遍的热力学关系式以解决实际的复杂问题。 2 联系所需要的关系式和确定求解方案。 3 确定真实流体的内能、熵和逸度等热力学性质与温度、压力、比容和热容 等可测量参数间的关系。 4 判断计算结果的准确性。 2 经典热力学的研究对象及其特点? 经典热力学研究宏观量(温度、压力、密度等)间的关系。 特点 1 将大量分子组成的体系视为一个整体,研究平均变化。 2 采用大量宏观现象的直接观察与实验,总结具有普遍性的规律。 3 容易解决工程中的问题。 3 分子动力学模拟计算(Molecular dynamics simulation)和蒙特·卡罗模拟计算(Monte-Carlo simulation)各自的特点? 分子动力学模拟 分子动力学是在原子、分子水平上求解多体问题的重要的计算机模拟方法。 通过求解所有粒子的运动方程,分子动力学方法可以用于模拟与原子运动路径相关的基本过程。 在分子动力学中,粒子的运动行为是通过经典的Newton运动方程所描述。 蒙特·卡罗方法 蒙特卡罗是摩纳哥的一个著名城市,以赌博闻名于世。 蒙特卡罗方法也称统计试验方法或计算机随机模拟方法,它是计算数学中的一种计算方法。 蒙特卡罗方法是由Ulam和Von Neumann在20世纪40年代中为解决研制核武器中的计算问题而首先提出并加以运用的。 由于科学技术的不断发展,出现了越来越多的复杂而困难的问题,用通常的解析方法或数值方法都很难得到解决。蒙特卡罗方法作为一种可行 的而且是不可缺少的计算方法迅速发展起来的。 基本特点是以概率与统计中的理论与方法为基础,以是否适于在计算机上使用为重要标志。 因此,它虽属计算方法但又与一般计算方法有很大区别。 4 热力学四大定律? 第零定律 与第三个体系处于热力学平衡的两个体系彼此处于热力学平衡。 第一定律能量守恒定律 第二定律体系和环境的总熵变有增无减。即△S总≥0 1 热自发从高温流向低温 2 有序能(功)完全转变为无序能(热)的自发倾向不可逆转。 3 在循环过程中,不能从一个热能把热转变为功而不同时不一部分热传给冷 源。 第三定律 在T→0K的极限下,由一可逆过程联系起来的状态之间的熵差趋于零。 此定律与熵的基准态有关,在基准态时熵值为零。 5 统计热力学与经典热力学关系? 共同点 一以大量粒子的集合体为研究对象。 二研究体系的平衡行为。 不同点 经典热力学:以第一、二、三定律为基础,只描述的宏观行为,不考虑体系的物质结构,得出结论 有经验性。所用方法为宏观方法。 统计热力学:从粒子的微观结构着手,求出体系宏观性质与微观性质的关系,所得结论是大量粒子 的统计平均结果。所用方法为微观方法。 6 经典统计方法? 经典统计—经典力学为基础的统计方法 ①玻尔兹曼统计,适用于粒子间相互作用力可忽略的体系。 ②吉布斯统计,适用于粒子间相互作用力不可忽略的体系。 7 统计单位的两种分类方法及其特点? (1)按统计单位(粒子)是否可分辨分 定位体系(定域子体系或可辨粒子体系) 粒子可区分,粒子有固定的位置,粒子运动是定域化的,晶体。 非定位体系(离域子体系或等同粒子体系) 粒子不可区分,全部等同,处于混乱状态,没有固定的位置,运动是离域化的,如气体体系。 (2) 按体系中粒子间有无相互作用 独立粒子体系:粒子间相互作用力较小,可忽略。体系总能量等于各粒子能量之和。如理想气体体 系,U=∑ni εi 非独立粒子体系(相依粒子体系):粒子间相互作用较大,不可忽略。体系总能量除各粒子能量之和 外,还必须包括相互作用能。如实际气体体系、液体体系、固体体系,U = ∑niεi + Up
化工热力学答案(3章)
3-1. 物质的体积膨胀系数β和等温压缩系数k 的定义分别为: 1P V V T β???= ????,1T V k V P ???=- ????。试导出服从Vander Waals 状态方程的β和k 的表达式。 解:Van der waals 方程2 RT a P V b V =-- 由Z=f(x,y)的性质1y x z z x y x y z ???????????=- ? ? ??????????得 1 T P V P V T V T P ????? ??????=- ? ? ?????????? 又 () 2 3 2T P a RT V V V b ???=- ????- V P R T V b ???= ? ?-?? 所以 ()2321P a RT V V b V T R V b ???-??-??=-?? ????-???? ()() 3232P RV V b V T RTV a V b -???= ????-- 故 ()() 22 3 12P RV V b V V T RTV a V b β-???== ? ???-- ()() 2 223 12T V V b V k V P RTV a V b -???=-= ????-- 3-2. 某理想气体借活塞之助装于钢瓶中,压力为,温度为93℃,反抗一恒定的外压力 MPa 而等温膨胀,直到两倍于其初始容积为止,试计算此过程之U ?、H ?、S ?、A ?、G ?、TdS ?、pdV ?、Q 和W 。 解:理想气体等温过程,U ?=0、H ?=0 ∴ Q =-W = 2 1 1 1 2ln 2V V V V RT pdV pdV dV RT V ===??? = J/mol ∴ W = J/mol 又 P P dT V dS C dP T T ??? =- ? ??? 理想气体等温膨胀过程dT =0、P V R T P ???= ???? ∴ R dS dP P =- ∴ 2 2 2 1 1 1 ln ln ln2S P P P S P S dS R d P R P R ?==-=-=??=(mol·K) A U T S ?=?-?=-366×= J/(mol·K) G H T S A ?=?-?=?= J/(mol·K) TdS T S A =?=??= J/(mol·K)
2014-2015 第一学期 化工热力学 (6)
填空题(每空1分共30分) 1.当p→0或者V→∞时,任何真实气体状态方程都应该还原成 ____________方程。 答案:理想气体 2.______ _______ 答案:、Maxwell关系式 3.逸度的定义_______________________________。 答案:、两个都写才能得分。 4.对一个热力学过程分析的3种方法__________、__________、 ___________ 能量衡算法、熵分析法、火用分析法 5.纯物质的PV图临界等温线在临界点的斜率和曲率都等于 __________其数学表达式为______________和______________. 答案:0、、 6.实际气体节流膨胀的过程中Q___0、ΔH___0、Δp___0。(填“<”、“=”、“>”) 答案:=、=、< 7.透平机的进汽温度,朗肯循环热效率___________,透平机出口乏汽干度___________。(填“提高”、“不变”、“降低”) 答案:提高、提高 8.火用的主要组成有__________、__________、__________、__________。
答案:动能火用、位能火用、物理火用、化学火用 9.二元溶液,T、p一定时,Gibbs-Duhem方程为: + = 答案:、0 10.某高温高压气体(焓值为H1,熵值为S1)做功后其焓值变为H2,熵值变为S2,环境温度为T0,则该过程的理想功为;有效能变化为。 答案:=_ =_ 稳流过程理想功的计算式,按和的定义,稳流过程的物系状态变化过程所提供的理想功即为。 11.第二维里系数B只与有关。 答案:T/温度 12.可视为其他热力学的母函数。 答案:自由焓 13.用于计算低压和加压汽液平衡最普遍且严格的热力学方 程。 答案: 14.化学反应体系相率的基本方程。 答案:F=2-π+N-R 15.热力学一致性检验的原理是。 答案: /吉布斯-杜亥姆方程 16.完成相平衡体系求解过程框图。假设体系为部分理想系,已知总
高等化工热力学课后题整理(xc
化工热力学在化工中的地位、作用和意义? 化工热力学是将热力学原理应用于化学工程技术领域。它的主要任务是以热力学第一、第二定律为基础,研究化工过程中各种能量的相互转化及其有效利用,研究各种物理和化学变化过程达到平衡的理论极限、条件和状态。化工热力学是化学工程学的重要组成部分,是化工过程研究、开发与设计的理论基础。 热力学的重要性在于这些定律及其伴随的某些定义都给出了数学的表达式。从而导出一套相互关联的方程式,由这些方程式可以导出范围极广泛的实际结果和结论。物理学家、化学家和工程师都应用热力学这一事实说明,它是一种具有普遍适用性的科学。它的基本原理在任何情况下都是相同的,但应用则不同。化学工程师必须处理特别广泛的各种问题,最重要的是确定许多物理和化学过程中所需要的热和功,确定化学反应以及不同相间传递化学物质的平衡条件。 推导热力学基本方程和有用的关系式? 这四个基本方程可由热力学第一和第二定律导得。推导前需要一个有关状态或平衡态的基本假定:对于一个均相系统,如果不考虑除压力以外的其它广义力,为了确定平衡态,除了系统中每一种物质的数量外,还需确定两个独立的状态函数。如果有广义力存在,则每多一个广义力,还需再确定一个状态函数,通常就选相应的广义位移。根据这个基本假定,如有L 个广义力和K 个组分,我们可将内能U 表达为:),,,,,,,(11K L n n Y Y V S U U 为什么要研究流体的 PVT 关系,如何研究流体的 PVT 关系? 研究流体的 PVT 关系所以吸引着人们巨大的兴趣,是因为 PVT 关系具有特别优异的性能。这种性能在于如果知道PVT 关系以及C0p 运用热力学方法可以求得物质的所有重要的热力学性质,对传递(迁移)性质的关联也有很大帮助。如果不仅对气体,而且对液体的 PVT 关系也有足够的了解,我们还能预测一系列涉及气液相平衡关系的性质,如液体的逸度或饱和蒸气压PS 以及蒸发热△Hvap 等。按照相平衡时两相逸度相等的原理,我们甚至可以不必利用活度或过量函数,不必涉及标准态的选取,直接计算气液平衡或液液平衡。当然,由于液体的复杂性。这后一方面的发展还很不成熟。通常有两种研究 PVT 关系的途径(1)理论的方法 在分子间力理论的基础上 运用统计力学方法进行研究 在不太高的压力下使用的气体的维里方程就是它的重要成果 利用第四章介绍的各种位能函数模型可以由分子参数如兰纳 琼斯位能函数的 e 与 关联第二 第三维里系数 如果使用比较简单的萨日兰模型 我们将得到范德华方程 应用统计力学理论也建立了一些液体的状态方程 但它需要更细致的液体结构模型 这将在第六章介绍对应状态原理是另一个重要的成果 它表达了不同流体之间的内在联系 运用对比参数 将不同流体的性质统一关联起来 在实践中得到广泛的应用 (2)经验与半经验的方法 在目前的理论水平上 要建立一个适用范围广和准确度高的状态方程是有困难的 因而发展了大量的经验与半经验的力程 它们大致上可以分为两大类 一类通常被称为立方型方程 可以展开为体积的三次多项式 所以称为立方 它们大都是范德华方程的修正 包含 2-3 个与温度有关的特征参数 使用较为方便 另一类是更精细的方程 大都是在维里方程基础上的修正 包含大量的特征参数 这种方程精度高 但计算复杂 如何计算流体的体积 一个复杂的状态方程,如Lee-Kesler 方程等的长处是在于它的多功能性,即这种状态方程可以用于所有相态,即气相,液相和稠密相。然而,仅仅为了计算饱和液体的摩尔体积,则比较简单的方程往往更精确且更方便。液体摩尔体积的对比关联式在过去10年中已发表了很多,本节只选其中若干个,供读者参考使用。1.饱和液体状态方程(1)Rackett 方程 作者曾应用式(2-6.1)对16种不同性质的液体进行检验计算,其中包括一些极性物质,如氨、丙酮、氰化氢等,最大误差为7%,多数物质的计算误差均在2%以内。但本方程对缔合液体,如醇类、梭酸类和睛类不适用。此式也不适用于量子效应很强的流体,如氮、氢等。(2) Spencer-Danner 方程 其中Z RA 与Raekett 方程中采用的实验的Zc 有区别,对每种物质而言,它是从饱和液体数据拟合得到,一般来说,Z RA 与Zc 值有所不同,正是这两者之差别使得本方程计算精度有所提高。 (3)Yamada-Gunn 方程 该方程具有良好的计算精度,对许多饱和液体来说,误差在1%以内。(4)童景山方程 为了对本方程的通用性和精确性进行检验,作者从文献中收集了10类40余种物质的体积数据,其中包括酮、醇、梭酸、睛、胺等缔合物质的数据,用式(2-6.4)进行计算,并与实验值作比较,其总的平均误差为0.58%,最大误差为2.7%,而误差为2 .7%,最大误差为12.1。本方程不仅具有很高的精确度Rackett 方程的总平均,而且适用范围也很宽广。(5)Chueh-Prausnitz 方程 (6)Bhirud 方程 应用本方程对50多种物,其中包括烷烃、烯烃、芳烃、卤代烃以及一些无机化合物的饱和液体体积进行计算,其总的平均误差为1.95% 2、正常沸点下液体摩尔体积推算 本节只介绍一种加和法,即每个元素和九种键接均给定数值,以致正常沸点下摩尔体积可使用这些数值的加和来计算。Schroeder 法是推算正常沸点下液体体积的一种极为简单的方法。他的法则是求算碳、氢、氧和氮的原子数目,对每个双键加1,并对总和乘以7,给出的体积单位为cm3·mol-1,本法则一般能给出相当满意的结果,误差在3%-4%以内(除缔合液体外)。Schroeder 基团的贡献值原始规则现已被扩展到包括卤(素)、硫和三键。G . Le Bas 提出的加和体积是Schxoedex 法则的一种改进。按Le Bas 法的体积增量列在表2-13中。本方法经检验,其平均误差为4 %。本方法比Schroedex 法更通用。3.压缩液体状态方程 众所周知,液体的体积是随压力增大而减小的,但其改变量与气体相比要小得多。通常所谓压力对液体体积的影响,是指等温条件下液体的摩尔体积随压力变化的规律。 (1)Tait 方程Tait 方程是一个最好的描述高压液体行为的经验状态方程,如有足够的数据,确定出D,E 之后,即可计算沿等温线的V~P 数据。经验表明,Tait 方程能给出较精确的结果。 (2)Thomson-Brobst-Hankinson 方程 Thomson 等人对Tait 方程作了修正而提出如下形式的方程(3)Chueh-Prausnitz 方程 应用本方程对烃类液体进行了计算,总的平均偏差约为1% 探讨对已有的状态方程如何进行改进 (1)立方形状态方程 上面介绍的许多立方型方程,都是对范德华式的修正。我们的目的是要找到一个较好的两参数或三参数的方程,从上面介绍可知 改进基本上集中于两个方面 一是改进引力项(及斥力项)的形式 另一方面是将参数表达为依赖于温度的函数 这两方面的改进都应以是否与实验数据很好拟合为标准 下面分别讨论这两个方面(1)从临界等温线出发 探讨引力项及斥力项的形式(2)由饱和蒸汽压数据确定参数对温度的依赖关系。上面介绍的修正范德华方程的两个方面:一是将体积进行平移,以拟合临界等温线;二是将参数表达为依赖于温度的函数,以拟合饱和蒸气压。这种修正的方法具有普遍的意义。下面将看到,各种类型的立方型方程只是不同程度的平移,以及将参数表达为不同类型的温度函数的结果。(2)多参数方程 为了建立一个有较好精度,计算工作量又不至过分繁重的多参数状态方程,考虑作以下三项重要的修正:(i)进行体积平移,这样可以减少状态方程中的项数,例如,为拟合临界点以前的数据,可以用n=5代替n=7。(ii )维里方程中高幕次项的特点是当体积很小时贡献很大,它们在拟合高密度数据时起重要作用,现采用一些对小体积更敏感的函数如指数函数,这样可大大减少高幂次项的项数;(iii)参数对温度的依赖关系采用统一的形式。 对混合物如何计算其 PVT 性质 前面讨论了纯气体和液体的 PVT 关系 提出的关系可概括地用如下函数形式表示f(P,V ,T)=0把此关系式扩展应用于混合物时 必须引入组成的变量 即f(P,V ,T,x)=0当我们研究一定形式的 P -Y -y 关系时不论是对应状态原理 还是一个具体的状态方程 一般都是对纯物质来说的 这些一定形式的 PVT 关系中的参数 如立方型方程中的参数 a b c 等 大都根据纯物质的实验数据求得 原则上只能适用于纯物质 当我们希望将这些从纯物质研究得到的 PVT 关系推广应用到混合物时 通常采用的方法是将混合物看作一个虚拟的纯物质 它具有虚拟的特征参数 当将这些虚拟的参数代入一定形式的 PVT 关系电就能表达混合物的行为 对于这种混合物的虚拟参数 当然可以从混合物的实验 PVT 关系拟合求得 但是由于这种虚拟参数强烈依赖于混合物的组成 因而完全由实验解决将是一个浩繁的任务 所谓混合规则 就是指混合物的虚拟参数与纯物质的参数以及混合物组成的关系 这种关系如能被如实地描写出来将大大节省工作的时间 混合规则的建立有它的理论基础 我们可以利用统计力学中的径向分布函数方法 从理论上导得混合规则 但是从目前理论水平来看 还必须引入许多经验的修正 才能取得符合实际的效果 人们曾提出了许多代数式 它们基本上都是从一个总的表达式派生出来的 必须注意 本章提出的混合规则基本上都是经验性的 是通过计算混合物性质与实验数据反复比较试探才确定的。这些假临界常数与混合物的真实临界性质不同 它们是没有物理意义的 一般来说,混合规则是把混合参数Qm 用组成和纯组分参数按下列的公式来表示:Qm=∑∑yiyjQij 。RK 型状态方程混合规则,Virial 方程混合规则,BWR 方程混合规则,BWRSH 方程混合规则 ,MH 混合规则, LK 混合规则 分子作用力的种类,论述各种力的相对大小以及与物性的关系。 (1.带电粒子(离子)之间,以及固有偶极子、四极子和高阶多极子之间的静电力。设有两个点电荷,所带电量分别为e1和e2,在真空中相距为r ,则它们之间的作用力由库仑公式(有时称为平方反比定律)计算.离子间的静电力与距离的平方成反比,其它分子间力则取决于距离倒数的高次幂,因此前者的作用程比后者长得多。这种静电力对盐类晶体的位形能起主要作用,盐类具有高熔点的原因也在于此。此外,离子间力的这种长程特性,至少部分地导致了建立电解质浓溶液理论的困难。(2.固有偶极子(或四极子)与诱导偶极子之间的诱导力。象氩或甲烷这样的非极性分子设有固有偶极矩,但当这种分子受到电场作用时,分子中的电子离开通常位置,被诱导而产生偶极。在中等场强下,诱导偶极矩u 与场强成正比,即。式中比例因子a 是物质的基本性质,称为极化率表示分子中的电子在电场中发生离域的容易程度。极化率可由多种途径计算,最重要的是由电学性质和折射率数据。对于非对称性分子,极化率不是常数,它与分子相对于电场方向的取向有关。(3.非极性分子之间的吸引力(色散力)和排斥力。所谓非极性分子实际上只是当我们在一段时间内观察它时,才显出非极性。如果为它拍摄一张瞬时照片,则从照片就可以看出,在某一瞬间,电子绕核振荡,造成排列的畸变,产生瞬问偶极。这种瞬间偶极迅速变化着它的大小和方向,在短期内就使平均值为零。但是这种迅速变化的偶极也产生电场,使周围分子产生偶极。这种诱导作用的结果为吸引力,有时称为诱导偶极-诱导偶极作用力。非极性分子之间的位能与温度无关,且与分子间距的六次幂成反比。(4。导致形成缔合和络合,即形成弱化学健的特种力(化学力),氢键或许是最好的例子。物理力和化学力的主要区别在于是否饱和,化学力是饱和力而物理力不是。溶掖中的化学力,一般按缔合作用或溶剂化作用进行分类,前者指的是,一些分子形成聚合物的趋势:例如,醋酸主要由二聚体组成,这是存在氢键的缘故。后者指的是不同种类的分子形成络合物的趋势,例如三氧化硫的水溶液由于生成硫酸而显示强烈的溶剂化作用。分子如果含有和电负性原子相连的氢(如在酸、醇和胺中),它就显示出互相缔合以及和其它具有可接近的电负性原子的分子生成溶剂化物的强烈趋势。氢键和正常化学键之间的主要区别在于前者较弱。 简述对应状态的分子理论 建立对应状态的分子理论需要如下四个假定,这已由Pitzer 和Guggenheim 明确论定:配分函数可以按式(4.10-4)分解因子,其中Qint 与分子体积无关。2,Qtrans 可用经典近似式(4.10-5)表达。3,分子对位能只取决于分子间距,系统位能Tt 可表达为所有可能的分子对相互作用之和4,由特征能量对比化后的分子对位能可以表示为由特征长度对比化后的分子间距的普适函数式中F*为普适函数,它的特性只和式(4.10-8)中的位能函数Tij 的特性有关。表达了对应状态的分子(微观)理论。这个理论和式(4.10-12)表示的对应状态的宏现理论类似,不同之处在于对比参数。 写出讲过的各种过量自由焓模型和活度系数模型,叙述其原理或思想,比较各种模型的优缺点。 (1两尾标Margules 模型 对二元溶液最简单的gE 函数模型可表示为gE=Ax1x2,式中A 是需由实验确定的经验常数,具有和gE 相同的能量单位。A 和组份的种类及温度有关但和溶液的组成x 无关(x 用分子分数表示)。式中仅有一个可调整参数,因此属单参数方程。虽然严格说A 是温度的函数,但在较小的温度范围内常可近似当的常数。本节所讨论的单参数gE 模型形式非常简单,但只能应用于分子大小、形状和化学结构相近的简单二元溶液,对较复杂的溶液需在gE 模型中增加新的参数。(2Redlich-Kister 模型 Redlich-Kister 将描述二元溶液过剩自由能的(3-56)式扩充成以下展开级数的形式,其中B, C, b ,……为新增加的参数,其数值需由实验数据够定。各
