2016.9.22烃 化竞 有机

青岛58中高中化学竞赛辅导
19
第一讲 烷 烃
烷烃
开链烃(脂肪烃) 烯烃 烃 炔烃 环状烃(脂环烃) 脂环烃
芳香烃
一、烷烃命名
1、 伯、仲、叔、季碳原子
在烃分子中仅与一个碳相连的碳原子叫做伯碳原子(或一级碳原子,用1°表示) 与两个碳相连的碳原子叫做仲碳原子(或二级碳原子,用2°表示) 与三个碳相连的碳原子叫做叔碳原子(或三级碳原子,用3°表示) 与四个碳相连的碳原子叫做季碳原子(或四级碳原子,用4°表示)
如:
与伯、仲、叔碳原子相连的氢原子,分别称为伯、仲、叔氢原子。 2、 烷基 ( 烷烃分子中去掉一个氢原子而剩下的原子团称为烷基。)
CH 3- 甲基 CH 3CH 2- 乙基 CH 3CH 2CH 2- 丙基 CH 3CH- 异丙基 CH 3CH 2CH 2CH 2- 正丁基 CH 3CHCH 2- 异丁基
CH 3 CH 3 CH 3 CH 3CH 2CH- 仲丁基 CH 3 C 叔丁基
CH 3 CH 3
烷基的通式为C n H 2n+1 常用R 表示 , 此外 还有“亚”某基,“次”某基。 3、 系统命名法(IUPAC 命名法)
二、烷烃的构型
1. σ键 成键电子云沿键轴方向呈圆柱形对称重叠而形成的键叫做σ键。 σ键的特点:(1)电子云沿键轴呈圆柱形对称分布。
(2)可自由旋转而不影响电子云重叠的程度。 (3)结合的较牢固。( C-H 键能 415.3KJ/mol C-C 键能 345.6KJ/mol ) 2.其它烷烃的构型
1)碳原子都是以SP 3
杂化轨道与其他原子形成σ键,碳原子都为正四面体结构。
2)C-C 键长均为0.154nm, C-H 键长为0.109nm,,键角都接近于109°28,
。
3)碳链一般曲折排布在空间呈锯齿状,有多种曲折排列形式(由于σ键自由旋转)。 如:
CH 3CH 2CH 2
CH 2CH 3CH 3
CH 2CH 2
2
H 3C CH 3
CH 2
CH 22
CH 3
CH 3 C CH 2 CH CH 3
CH 3
31234CH 3
1°°°
°°
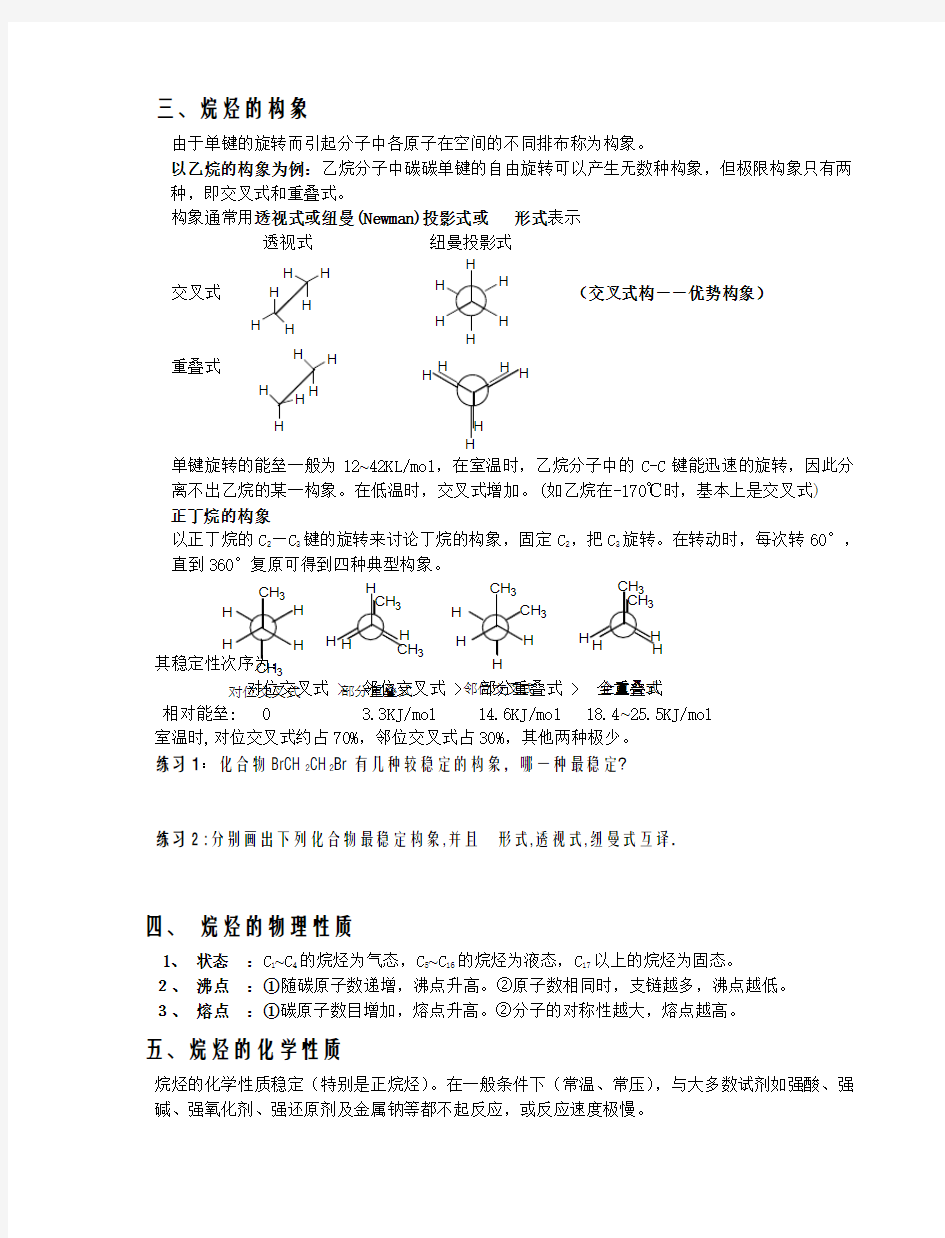
三、烷烃的构象
由于单键的旋转而引起分子中各原子在空间的不同排布称为构象。
以乙烷的构象为例:乙烷分子中碳碳单键的自由旋转可以产生无数种构象,但极限构象只有两种,即交叉式和重叠式。
构象通常用透视式或纽曼(Newman)投影式或形式表示
透视式纽曼投影式
交叉式(交叉式构――优势构象)
重叠式
单键旋转的能垒一般为12~42KL/mol,在室温时,乙烷分子中的C-C键能迅速的旋转,因此分离不出乙烷的某一构象。在低温时,交叉式增加。
(如乙烷在-170℃时,基本上是交叉式) 正丁烷的构象
以正丁烷的C2—C3键的旋转来讨论丁烷的构象,固定C2,把C3旋转。在转动时,每次转60°,直到360°复原可得到四种典型构象。
对位交叉式
> 邻位交叉式
> 部分重叠式 > 全重叠式
相对能垒: 0 3.3KJ/mol 14.6KJ/mol 18.4~25.5KJ/mol
室温时,对位交叉式约占70%,邻位交叉式占30%,其他两种极少。
练习1:化合物BrCH2CH2Br有几种较稳定的构象,哪一种最稳定?
练习2 :分别画出下列化合物最稳定构象,并且形式,透视式,纽曼式互译.
四、烷烃的物理性质
1、状态:C1~C4的烷烃为气态,C5~C16的烷烃为液态,C17以上的烷烃为固态。
2、沸点:①随碳原子数递增,沸点升高。②原子数相同时,支链越多,沸点越低。
3、熔点:①碳原子数目增加,熔点升高。②分子的对称性越大,熔点越高。
五、烷烃的化学性质
烷烃的化学性质稳定(特别是正烷烃)。在一般条件下(常温、常压),与大多数试剂如强酸、强碱、强氧化剂、强还原剂及金属钠等都不起反应,或反应速度极慢。
3
3
3
H
对位交叉式部分重叠式邻位交叉式全重叠式
青岛58中高中化学竞赛辅导
21
1、 氧化
氧化反应:燃烧生成CO 2和H 2O ,并放出大量的热能。
所以烷烃常用作内燃机的燃料。 2、 热裂反应
在高温及没有氧气的条件下使烷烃分子中的C-C 键和C-H 键发生断裂的反应。
3、 卤代反应
(重点)
1).甲烷的氯代反应
在光或高温下,甲烷易与氯、溴发生反应。
甲烷的卤代反应较难停留在一元阶段,氯甲烷还会继续发生氯化反应,生成二氯甲烷、三氯甲烷和四氯化碳。若控制一定的反应条件和原料的用量比,可得其中一种氯代烷为主要的产物。如 甲烷 :氯气 = 10 :1 (400~450℃时)CH 3Cl 占98%
= 1 :4 (400℃时)主要为CCl 4 2).其他烷烃的氯代反应
① 反应条件与甲烷的氯代相同(光照),但产物更为复杂,因氯可取代不同碳原子上的氢,得
到各种一氯代或多氯代产物。 ② 伯、仲、叔氢的相对反应活
分子中,有六个等价伯氢,两个等价仲氢,若氢的活性一样,则两种一氯代烃的产率,理论上为
6 :2 = 3 :1
但实际上为 43 :57 = 1 :1.33
这说明在时温氯代时,各类氢的反应活性是不一样的,
氢的相对活性 = 产物的数量÷被取代的等价氢的个数。这样可知:
即仲氢与伯氢的相对活性为4 :1。
练习3:异丁烷一氯代时的情况:
试求:可求得叔氢的相对反应活性:
C n H 2n+23n+12O 2燃烧nCO 2 + (n+1)H 2O + 热能(Q)C 6H 14 + 9 O 26CO 2 + 7H 2O + 4138KJ/mol 1
2
CH (1)CH 3-CH=CH 2 + H 2
CH 4 + CH 2=CH 2丙烯
乙烯
CH 4Cl 2CH 3HCl
Cl 漫射光CH
3
-CH 2
-CH 3
Cl 2
CH 3-CH 2-CH 2
CH 3-CH-CH 3
Cl 43%
57%
25℃光,伯氢的相对活性仲氢的相对活性
=57 / 243 / 6≈41CH 3-CH-CH 3CH 3Cl 2CH 3C CH 3
CH 3
Cl CH 3
CH 3
CH 2Cl 光
℃
25叔丁基氯异丁基氯36%
64%
小结:氯代,三种氢的相对活性为: 3°H :2°H :1°H = 5 :4 :1
溴代,三种氢的相对活性为: 3°H :2°H :1°H = 1600 :82 :1
例如: 故溴代反应的选择性好,在有机合成中比氯带更有用。 烷烃的卤代反应历程 氯代反应为自由基历程
从上可以看出,一旦有自由基生成,反应就能连续的进行下去,这样周而复始,反复不断的进行反应,故又称为链锁反应。
凡是自由基反应,都是经过链的引发、链的传递、链的终止三个阶段来完成的。
练习4:写出环己烷在光作用下溴代产生溴代环己烷的反应机理。
练习5:
写出可能反应机理。
卤素的反应活性
卤素的反应活性: 氟 > 氯 > 溴 > 碘。 烷烃卤代反应的相对活性与烷基自由基的稳定性
1. 烷烃卤代的相对活性: 3°C-H > 2°C-H > 1°C-H 2. 自由基的稳定性: 3°R · > 2°R · > 1°R · > CH 3·
CH 3-CH-CH 3CH 3CH 3-CH-CH 2CH 3CH 3-C-CH 3CH 3
Br 2
光℃127Br >99%
<1%Cl Cl υ 2 Cl CH 4Cl CH 3HCl Cl 2CH 3-Cl Cl CH 3-Cl Cl CH 2-Cl HCl CH 2-Cl Cl 2CH 2-Cl 2Cl ···.............................................................................................................................................链引发
链增长阶段Cl ·Cl ·Cl 2Cl CH 3-Cl CH 3-CH 3链终止阶段······CH 3·CH 3··CH 3···CH 3
青岛58中高中化学竞赛辅导
23
第二讲 单 烯 烃
一 、烯烃的结构-- --sp 2杂化,平面结构
1、双键结构
键能 610KJ / mol
C —
C
346KJ / mol
从键能看出碳碳双键键能不是单键两倍,说明碳碳双键不是由两个碳碳单键构成的。 其结构如图:
2、sp
2
杂化
3、乙烯分子的形成
其它烯烃的双键,也都是由一个σ键和一个π键组成的。
π键键能 = 双键键能 — 碳碳单键键能 = 610KJ / mol – 346 = 264.4KJ / mol
π键的特点: ① 不如σ键牢固(因p 轨道是侧面重叠的)。 ② 不能自由旋转(π键没有轨道轴的重叠)。
③ 电子云沿键轴上下分布,不集中,易极化,发生反应。
④ 不能独立存在。 二、烯烃的异构和命名 1、烯烃的同分异构
除碳干异构外,还有由双键的位置不同引起的位置异构和双键两侧的基团在空间的位置不同引起的顺反异构。
①造异构
CH 3-CH 2-CH=CH 2 1-丁烯
位置异构
H 0.108nm 0.133nm
117°121.7°一个sp 2
三个 的关系
sp 2
轨道与
轨道的关系p sp 2sp 2sp sp 2
2p
2s
2p
杂化
2激发态
π电子云形状
π键的形成
乙烯中的 σ键
CH 3-CH=CH-CH 3 2-丁烯 构造异构 CH 3-C=CH 2 2-甲基丙烯 碳干异构 CH
3
②顺反异构
由于双键不能自由旋转,而双键碳上所连接的四个原子或原子团是处在同一平面的,当双键的两个碳原子各
连接两个不同的原子或原子团时,就能产生顺反异构体。
产生顺反异构体的必要条件: 构成双键的任何一个碳原子上所连的两个基团要不同。
顺反异构体的物理性质不同,因而分离它们并不很难。
2、烯烃的命名
① 选择含碳碳双键的最长碳链为主链,称为某烯。 ② 从最靠近双键的一端开始,将主链碳原子依次编号。
③ 将双键的位置标明在烯烃名称的前面(只写出双键碳原子中位次较小的一个)。 ④ 其它同烷烃的命名。
几个重要的烯基
CH
2=CH- 乙烯基
CH 3CH=CH- 丙烯基(1-丙烯基)
CH 2=CH-CH 2- 烯丙基(2-丙烯基) IUPAC 允许沿用的俗名 CH 2= C – 异丙烯基
CH 3
(1)顺反命名法:在系统名称前加“顺”或“反”字。
顺反命名法有局限性,即在两个双键碳上所连接的两个基团彼此应有一个是相同的,彼此无相同基团时,
则无法命名其顺反。
如:
为解决此难题,IUPAC 规定,用Z 、E 命名法来标记顺反异构体的构型。
(2)Z 、E 命名法(次序规则法)
比较两个双键碳原子上的取代基团按“顺序规则”排出的先后顺序,如果两个双键碳上排列顺序在前的基团位于双键的同侧,则为Z 型,反之为E 型。
H CH 3H H 3C CH 3H
H H 3C 顺丁烯
反丁烯(立体异构体)
顺反异构体
构型异构
C = C
C = C
bp0.88℃bp 3.7℃C C C C C C a b a b b a a d d d a b
a a a
b 无顺反异构的类型
有顺反异构的类型C H C CH 2CH 3H CH 3CH 3CH 2C H C H
CH 2CH 3-2-反 甲基 己烯
-3--3-顺
戊烯C
Br Cl
CH 3H
C C
H CH 2CH 2CH 3
CH 3
CH 2CH 3C C
CH
CH 3CH 3CH 2
CH 2CH 2CH 3
CH 3CH 3
青岛58中高中化学竞赛辅导
25
Z 是德文 Zusammen 的字头,“同一侧” ; E 是德文 Entgegen 的字头,“相反”
次序规则:
① 比较与双键碳原子直接连接的原子的原子序数,按大的在前、小的在后排列。 如: I > Br > Cl > S > P > F > O > N > C > D > H
-Br > -OH > -NH 2 > -CH 3 > H
② 若与双键碳原子直接相连的基团第一个原子相同,则要依次比较第二、三顺序原子的原
子序数,来决定基团顺序。
如: CH 3CH 2- > CH 3- (因第一顺序原子均为C ,故必须比较与碳相连基团的大小)
CH 3- 中与碳相连的是 C(H 、H 、H)
CH 3CH 2- 中与碳相连的是 C(C 、H 、H) 所以CH 3CH 2-大。 同理:(CH 3)3C- > CH 3CH(CH 3)CH- > (CH 3)2CHCH 2- > CH 3CH 2CH 2CH 2-
③ 当取代基为不饱和基团时,则把双键、三键原子看成是它与多个某原子相连。
如: 相当于 相当于 练习1:
从例3可以说明,顺反命名和命名Z 、E 是不能一一对应的。应引起注意。
三、烯烃的物理性质 (略) 四、烯烃的化学性质
烯烃的化学性质很活泼,与很多试剂作用,主要发生在碳碳双键上,能起加成、氧化、聚合等反应。此外,由于双键的影响,与双键直接相连的碳原子(α-碳原子)上的氢(α-H )也可发生一些反应。 1、加成反应(重点) (1) 催化加氢 (2) 亲电加成 烯烃分子中,由于π电子流动性,易被极化,因而烯烃具有供电子性,易受到缺电子试剂(亲电试剂)的
进攻而发生反应,这种由亲电试剂的作用而引起的加成反应称为亲电加成反应。
与H-Nu 的加成 ( H + 是最简单的亲电试剂,能与烯烃起加成反应。其反应通式如下:)
CH 2=CH CH 2-CH C C=O C O
O C=C
Cl Br H CH 3C=C
CHCH 3CH 3CH 2CH 3C=C H
Br Cl Cl Cl > H Br > Cl
(Z)-1,2-二氯-1-溴乙烯RCH=CHR + H 2
RCH 2CH 2R
①与HX的加成:CH2=CH2 + HX CH3CH2-X
马氏规则:
不对称烯烃加成时,试剂中带正电荷的部分E+总是加到含氢较多的双键碳原子上,试剂中带负电荷的部分(Nu)总是加到含氢较少的双键碳原子上。
过氧化物效应
当有过氧化物(如 H2O2,
②与H2SO4的加成
不对称烯烃与硫酸(H2SO4)加成的反应取向符合马氏规则。
与X2加成
卤素的反应活性次序:F2> Cl2 > Br2 > I2 。(氟与烯烃的反应太剧烈,往往使碳链断裂;
碘与烯烃难于起反应。故烯烃的加卤素实际上是指加氯或加溴。)
烯烃也能与卤水等(混合物)起加成反应,有的在有机合成上很有用。
反应遵守马氏规则,因卤素与水作用成次卤酸(H-O-Cl),在次卤酸分子中氧原子的电负性较强,使之极化成,氯成为带正电荷的试剂。
2、氧化反应
C=C H-Nu
Nu = -X-OSO
3
H-OH-OCOCH3等
C C
H Nu
CH3CH=CH2 + HBr
CH3-C=CH2
CH3-CH=CH2 + HBr CH3-CH2-CH2-Br
过氧化物
反马氏产物
CH2=CH2CH3-CH2-OSO3H
硫酸氢乙酯
CH3CH2OH
98%H2SO4H
2
O
℃
90
CH3CH=CH2 + H2SO4CH3-CH-CH3
OSO2OH
硫酸氢异丙酯
约1MPa
CH2=CH2 + Br2 / CCl4CH2-CH2
Br Br
+ Br2 / CCl4
Br
Br
溴褪色(黄无)
实验室里,常用此
反应来检验烯烃
CH2=CH2 + HOCl CH2 CH2
OH Cl
(Cl2+H2O)
氯乙醇
是制取重要有机合成原料
环氧乙烷()的中间体
O
CH3CH=CH2 + HOCl CH3-CH-CH2
OH Cl
HO Clδ
δ
青岛58中高中化学竞赛辅导
27
(1)用KMnO 4或OsO 4氧化
① 用稀的碱性KMnO 4氧化,生成顺式邻二醇。
反应中KmnO 4褪色,且有MnO 2沉淀生成。故此反应可用来鉴定不饱合烃。
此反应生成的产物为顺式-1,2-二醇,可看成是特殊的顺式加成反应。
也可以用OsO 4代替KmnO 4进行反应。 ② 用酸性KMnO 4氧化
在酸性条件下氧化,反应更快,得到碳链断裂的氧化产物(低级酮或羧酸)。
反应的用途: 1° 鉴别烯烃,
2° 制备一定结构的有机酸和酮, 3° 推测原烯烃的结构。 (2).臭氧化反应
为了防止生成的过氧化物继续氧化醛、酮,通常臭氧化物的水解是在加入还原剂(如Zn / H 2O )或催化氢化下进行。
练习2:
小结
烯烃结构 CH 2= HCHO (甲醛) RCH= RCHO (醛) R 2C= R 2C=O (酮)
故可通过臭氧化物还原水解的产物来推测原烯烃的结构。 练习3: 臭氧化还原水解产物 ① CH 3COCH 3 OCHCH 2CHO HCHO,
② RCH=CH 22KMnO 44H 2O 3R-CH-CH 22MnO 2KOH
3OH OH
或中性R-CH=CH 2
KMnO H 2SO 4
R-COOH CO 2 + H 2O
C CHR''R R ′KMnO H 2SO 4C O R R
′R''-COOH 羧酸
酮
羧酸C=C H R''R R'O 3C C R''H R R'2C O R R''O R''H 2O 2H 2O
臭氧化物粘糊状,易爆炸,不必分离,可直接在溶液中水解。
CH 3-C=CHCH 3
31) O 32) Zn/H 2O
CH 322CHO O CH 3
(3)催化氧化
此类反应是特定反应,不能泛用。如要将其它烯烃氧化成环氧烷烃,则要用过氧酸来氧化。
3、α-H 反应
官能团的邻位统称为α位,α位上连接的氢原子称为α- H (又称为烯丙氢)。由于受C=C 的影响,α-H 键离解能减弱,故α- H 比其它类型的氢易起反应。
其活性顺序为: α- H (烯丙氢)> 3°H > 2°H > 1°H > 乙烯H 烯烃常温下与氯反应,则主要进行加成反应。 在高温下(500~600℃),则主要进行α- H 易取代。
卤代反应中α- H 的反应活性为:3°α- H > 2°α- H > 1°α- H
4、聚合反应
烯烃在少量引发剂或催化剂作用下,键断裂而互相加成,形成高分子化合物的反应 聚乙烯是一个电绝缘性能好,耐酸碱,抗腐蚀,用途广的高分子材料(塑料)。 TiCl 4-Al(C 2H 5)3 称为齐格勒(Ziegler 德国人)、纳塔(Natta 意大利人)催化剂。
五、马氏规则的解释和碳正离子的稳定性
1.用诱导效应和σ-π共轭效应来解释 (1)用诱导效应解释
CH 3CH=CH 2
CH 3C-O-O-H
O CH 3-CH CH 2
CH 3COOH
CH 3-CH=CH 2 + Cl 2
CH 2-CH=CH 2 + HCl Cl
>500℃
Cl 2
>500℃
+ HCl
Cl
32sp
sp CH 3 CH=CH 2
δ
因电负性 ,当甲基与 相连时,
使 双键 上的π电子云发生偏移,
上的电子 云密度增大, 上的电子云密度减小, 即双键上π
电子云发生了极化,(如左图所示)故加成时带正
电荷的基团优先加到
上得到马氏产物。sp 2 > sp 3
C 1C 2C 1C=C C=C 3
CH 3Br 2(1mol)
CH 3
C-CH=CH-CH 3CH 3CH 3
CH-CH=CH-CH 2
CH 3
CH 3
Br Br
主要产物
次要产物
10Mpa
[ CH-CH 2 ]n TiCl 4 Al(C 2H 5)3
50℃
nCH 3CH=CH 2
CH 3
聚丙烯
青岛58中高中化学竞赛辅导
29
(2)σ-π共轭效应来解释
当键直接与双键相连时,这样的体系中存在着电子的离域现象,其结果使极化。
2.用泼中间体碳正离子的稳定性来解释
正碳离子的杂化状态及结构如下所示: 定性的说,碳正离子的稳定性顺序为:
从电负性看,C sp2 > C sp3 故烷基上的电荷向C + 转移,分散了C + 的电荷,烷基越多,分散作用越大,碳正离子越稳定。
从σ-P 共轭效应看,参与σ-P 共轭键数越多,则正电荷越分散,碳正离子越稳定。
碳正离子的稳定性越大,越易生成,当有两种碳正离子可能生成时,则优先生成稳定的碳正离子,故主要得到马氏产物。例如:
2
H
C C 空
碳的杂化状态碳正离子的结构
平面构型
(碳原子外层只有六个电子)
CH 3
C CH 3H
CH 3C CH 3CH 3
CH 3
C H H
CH 3
>
>
>
叔仲伯(2°)(1°)
(3°
)2
9个C-H 参与σ-P 共轭
仅3个C-H 参与σ-P
共轭
CH 3-CH=CH 2
HBr
CH 3-CH-CH 3
CH 3-CH 22
°
21°( )异丙基碳正离子丙基碳正离子( )
Br
CH 3-CH-CH 3
Br
因碳正离子( )的稳定性CH 3-CH-CH 3>CH 3-CH 2-CH 2
(1)的产物为主要产物
第三讲 脂 环 烃
饱和脂环烃 环烷烃 不饱和脂环烃 环烯烃 如:( ) 环炔烃
环的大小: 小环(3~4元);普通环(5~7元);中环((8~12元)和 大环(十二碳以上)。
环的多少: 单环; 多环(桥环, 螺环) 一、命名 1.环烷烃 ○1根据分子中成环碳原子数目,称为环某烷。
○2把取代基的名称写在环烷烃的前面。
○3取代基位次按“最低系列”原则列出,基团顺序按“次序规则”小的优先列出。
:
2.环烯烃 ○1称为环某烯。②以双键的位次和取代基的位置最小为原则。
3
两个或多个碳原子。 ○1编号:从桥一端开始,沿最长桥链到桥另一端,再沿次长桥,最短的桥最后编号。 ○2命名:根据成环碳原子总数称环某烷,在环字后面方括号中标出除桥头碳原子外的桥碳原子数(大的数目排前,小的排后)。其它同环烷烃的命名。
Eg 、 上图命名为:
7,7-二甲基二环[2,2,1]庚烷
CH 3CH CH 3
CH 31,3-=甲基环戊烷异丙基环己烷
1-甲基-3-异丙基 环己烷1,4-=甲基-4-乙基 环己烷桥头碳
2CH 32-甲基-5-异丙基二环[3,1,0]己烷2-乙基-6-氯二环[3,2,1]辛烷
2
3
青岛58中高中化学竞赛辅导
31
(
①编号:从较小环中与螺原子相邻的一个碳原子开始,经小环到螺原子,再沿大环到所有环碳原子。 ○2命名:根据成环碳原子的总数称为环某烷,在方括号中标出各碳环中除螺碳原子以外的碳原子数目(小的数目排,大的排后),其它同烷烃的命名。
二、 异构现象
脂环烃的异构有构造异构和顺反异构。如C 5H 10的环烃的异构有:
三、 脂环烃的性质
(一)环烷烃----“小环是烯,大环是烷” 1.加成反应
----小环 (1) 加氢
(2)
加卤素
(3
) 加H X,、H 2SO 4
2、氧化反应
环丙烷对氧化剂稳定,不被高猛酸钾、臭氧等氧化剂氧化。例如:
1-溴-5-甲基螺[3,4]辛烷反式 bp29℃顺式 bp37
℃H 2N i CH 3CH 2CH 3H 2Ni CH
3CH 2CH 2CH 3
H 2
Pd >300℃CH 3CH 2CH 2CH 2CH 34CH 2-CH 2-CH 2Br Br
CH CH Br 2/CCl 4C-CH-CH 2
Br CH 3
Br CH 3
CH 3Br 2/CCl 4CH 2-CH 2-CH 2-CH 2
Br Br Br 2/CCl 4溴褪色可用于
鉴别环烷烃不起加成,而是取代反应
HBr H 2SO 4C
CH CH 3CH 3
CH 3Br
CH 3C CH CH 3CH 3CH 3OSO 3H CH 3C
CH CH 3CH 3
CH 3OH CH 3
故可用高猛酸钾溶液来区别烯烃与环丙烷衍生物。(二)环烯烃:具有烯烃的通性
环烃性质小结:
(1))小环烷烃(3,4元环)易加成,难氧化,似烷似烯。
4元环以上难加成,难氧化,似烷。
(2))环烯烃、共轭二烯烃,各自具有其相应烯烃的通性。
四、脂环烃的结构
从环烷烃的化学性质可以看出,环丙烷最不稳定,环丁烷次之,环戊烷比较稳定,环己烷以上的大环都稳定,这反映了环的稳定性与环的结构有着密切的联系。
环己烷的构象
在环己烷分子中,六个碳原子不在同一平面内,碳碳键角可以保持109.5°因此环很稳定。
1.两种极限构象——椅式和船式
椅式构象稳定的原因:
船式构象不稳定的原因:
H
H
相邻碳上的C-H键全部为交叉式
椅式船式
无角张力
无C-H键间的扭转张力
无张力环
常温下 99%
无角张力
有C-H键间的扭转张力
有张力环
1%
109.5°
CH3
CH3
Br2/CCl4
32
CH3-C-CH2CH2CH2CHO
O
1mol Cl2
CH3
Cl
Cl CH3
主次
CH=C
CH3
3
CH3
CH3
C=O
CH3
HCl
CH3
Cl
CH3
Cl
1,4-加成1,2-加成
(主)
青岛58中高中化学竞赛辅导
33
2.平伏键(e 键)与直立键(a 键)
在椅式构象中C-H 键分为两类。第一类六个C-H 键与分子的对称轴平行,叫做直立键或a 键(其中三个向环平面上方伸展,另外三个相换环平面下方伸展);第二类六个C-H 键与直立键形成接近109.5°的夹角,平伏着相环外伸展,叫做平伏键或e 键。
在室温时,环己烷的椅式构象可通过C-C 键 的转动(而不经过碳碳键的断裂),由一种椅
式构象变为另一种椅式构象,在互相转变中,
原来的a 键变成了e 键,而原来的e 键变成了 a 键。
当六个碳原子上连的都是氢时,两种构象是同一构象。连有不同基团时,则构象不同。 3.取代环己烷的构象
取代基可占据a 键,也可占据e 键,但占据e 键的构象更稳定。
原因:a 键取代基结构中的非键原子间斥力比e 键取代基的大(因非键原子间的距离小于正常原子键的距离所致)。从下图中原子在空间的距离数据可清楚看出。取代基越大e 键型构象为主的趋势越明显。
小结:1°环己烷有两种极限构象(椅式和船式),椅式为优势构象。 2°一元取代基主要以e 键和环相连。
3°多元取代环己烷最稳定的构象是e 键上取代基最多的构象。 4°环上有不同取代基时,大的取代基在e 键上构象最稳定。
环己烷的直立键和平伏键平伏键
直立键对称轴
键键键键两个椅式构象的互相转变3
93%内能比a 型少75.3KJ/mol
7%甲基环己烷原子间的距离C CH CH C 3
CH 3
CH 3<0.1%>99.9%
第三讲 炔烃和二烯烃
1.催化加氢 ①催化氢化常用的催化剂为 Pt , Pd , Ni ,但一般难控制在烯烃阶段。
②用林德拉(Lindlar )催化剂,可使炔烃只加一分子氢而停留在烯烃阶段。------顺式烯烃。
催化剂的几种表示方法:
○2在液氨中用钠或锂还原炔烃,主要得------反式烯烃。
2.亲电加成
○1 R-C ≡C-H 与HX 加成时,遵循马氏规则。 ○2 炔烃的亲电加成比烯烃困难。
A . CH 2=CH 2 + Br 2/CCl 4 溴褪色快 H-C ≡C-H + Br 2/CCl 4 溴褪色慢
B . 解释: 1° 炔碳原子是sp 杂化的,杂化轨道中S 的成分大,键长越短,键的离解能大。
2° 两个轨道分布与键的四周,重叠程度比乙烯中的要大,比双键难于极化。 3.水化反应
。
这种异构现象称为酮醇互变异构。这反应是库切洛夫在1881年发现的,故称为库切洛夫反应。
Br 2C=C R Br Br R'2R C C R Br Br ≡
R-C C-R'≡
R-C C-R'HX R-CH=C-R'X
HX
R C C R'X H CH 2=CH-CH 2-C CH Br 2/CCl 4CH 2-CH-CH 2-C CH ≡≡Br Br
HC CH ≡H 2O Hg 2+,H SO ~100℃[ ]H C CH 3-C O H C C
OH C C O 烯醇式(不稳定)酮式(稳定)
R-C C-R'≡
R-C C-R'H 2≡Lindlar C=C R R'H H
C C ≡H 2
C=C H H
顺二苯基依稀(87%)
1°
3°Pd BaSO Pd CaCO 3Lindlar Pd 喹啉2≡
-C C-Na, NH ( )C=C H H n-C 3H 7n-C 3H 7n-C 3H 7n-C 3H 7(E)-4-辛烯(97%)4-辛炔NaNH 2
青岛58中高中化学竞赛辅导
35
其他炔烃水化时,则变成酮:
4 氧化反应 (1) KMnO 4氧化
(2) O 3氧化
5.炔化物的生成
叁键碳上的氢原子具有微弱酸性,可被金属取代,生成炔化物。
生成炔银、炔铜的反应很灵敏,现象明显,
干燥的炔银或炔铜受热或震动时易发生爆炸生成金属和碳: Ag-C ≡C-Ag 2Ag + 2C 所以实验完毕,应立即加盐酸将炔化物分解,以免危险:Ag-C ≡C-Ag + 2HCl H-C ≡C-H + 2AgCl
乙炔和RC ≡C-H 在液态氨中与氨基钠作用生成炔化钠。
炔化钠是很有用的有机合成中间体,可用来合成炔烃的同系物。
CH 3CH 2C ≡
CNa + CH 3CH 2CH 2Br CH 3CH 2C ≡CCH 2CH 2CH 3 + NaBr R-X=1°RX 四、乙炔(自学)
要求: 掌握乙炔的制法,重要性质[氧化、加成、聚合(特别是二聚),及主要用途。 五、 炔烃的制备
1 邻二卤代烷脱卤化氢
2 由炔化外物制备
六 二烯烃的分类和命名
1 分类(根据两个双键的相对位置可把二烯烃分为三类)
累积二烯烃 -C=C=C-
二烯烃 共轭二烯烃 -C=CH-CH=CH-
孤立二烯烃 -C=CH(CH 2)n CH=C- n ≥ 1
CH 3C CH + H 2O 24
[CH 3-C=CH]CH 3-C-CH 3O
≡≡C CH + H 2O
H 2SO 4C CH 3
O 91%OH H-C C-H ≡2AgNO 3 + 2NH 4OH ≡
≡
2NH 4NO 3 + 2H 2O 2NH 4Cl + 2H 2O R-C C-H ≡R-C C-Ag ≡R-C C-Cu ≡
Ag(NH )+
乙炔银(白色)
乙炔亚铜(棕红色)2H-C C-H ≡
2NaNH 2H-C C-Na ≡NH 3R-C C-Na ≡
R-C C-H ≡NaNH 2NH 33液态氨R-CH-CH-R'R-CH=C-R'≡醇或KOH( )醇R-C C-R'≡R-C C-Na ≡R-C C-R'Na X ( Li )Li X
孤立二烯烃的性质和单烯烃相似,累积二烯烃的数量少且实际应用的也不多。共轭二烯烃有不同于共轭二烯烃的一些特性,在理论和实际应用上都很重要。下面我们主要讨论共轭二烯烃。
2 命名
○1和烯烃的命名一样称为某几烯
○2
多烯烃的顺反异构的标出(每一个双键的构型均应标出)。
七 二烯烃结构
1. 丙二烯烃(累积二烯烃)结构
2. 共轭二烯烃结构(以1,3-丁二烯为例)
丁二烯分子中碳原子都以杂化轨道相互重叠或与氢的轨道重叠,形成三个键和6个键,所有的原子都在同一平面上,键角都接近于120。此外,每个碳原子上未参与杂化的轨道均垂直于上述平面,四个轨道的对称轴互相平行侧面重叠,形成了包含四个碳原子的四电子共轭体系。
轨道中π电子云的分布不是局限在C 1-C 2, C 3-C 4之间,而是分布在包括在四个碳原子的轨道中,这种轨道称为离域轨道,这样形成的键称为离域键。可看出,C 1-C 2,C 3-C 4之间的键加强了,但C 2-C 3之间的键减弱,结果,所有的键虽然都具有π键的性质,但C 2-C 3键的π键的性质小些。所以,在丁二烯分子中,四个π电子是分布在包含四个碳原子的分子轨道中,而不是分布在两个定域的π轨道中。
八、 共轭二烯烃的反应
共轭二烯烃具有烯烃的通性,但由于是共轭体系,故又具有共轭二烯烃的特有性质。下面主要讨论共轭二烯烃的特性。
1. 1,4-加成反应
共轭二烯烃进行加成时,既可1,2加成,也可1,4加成,
即有1,2-加成,又有1,4-加成原因:
这是由反应历程决定的(其加成反应为亲电加成历程) 第一步:ⅠⅡ
CH 3CH=CH-C=CH 2CH 3甲基 戊二烯
2--1,3-C C
CH 3
H 3C
H C C CH 3
CH 2CH 3H (Z),(Z)-2,5-= -2,4-甲基庚二烯C C H H H H C H
119.8°°
483n m
37n m 0.108n m 1,3-丁二烯的结构π键所在平面与纸面垂直
σ键所在平面在纸面上CH 2CH 2-CH-CH=CH 2CH 2-CH-CH=CH 2CH 2-CH=CH-CH 2
CH 2-CH=CH-CH 2Br Br
Br H Br H ,2-加成产物1,4-加成产物
CH 2+
CH 2=CH-CH-CH 3CH 2=CH-CH 2-CH 2
烯丙基碳正离子伯碳正离子(Ⅰ)(Ⅱ)
-CH-CH 烯丙基碳正离子(Ⅰ)的结构为
3
H
P 空 π电子可离域到空P 轨道上,使正电荷得到分散,故较稳定
青岛58中高中化学竞赛辅导
37
因碳正离子的稳定性为 (Ⅰ) >(Ⅱ),故第一步主要生成碳正离子(Ⅰ)。 第二步:
在碳正离子(Ⅰ)中,正电荷不是集中在一个碳上,而是如下分布的。
所以Br 既可加到C 2上(1,2-加成产物),也可加到C 4上(1,4-加成产物) 。 从产物结构的稳定性看:
1,4-加成产物的稳定性大于1,2-加成产物。(可从σ-π共轭效应来理解)
2. 狄尔斯(Diels )—阿德尔(Alder )反应
共轭二烯烃和某些具有碳碳双键、三键的不饱和化合物进行1,4-加成,生成环状化合物的反应称为双烯合成反应。
要明确几点: ○1双烯体是以顺式构象进行反应的,反应条件为光照或加热。
○2双烯体(共轭二烯)可是连状,也可是环状。如环戊二烯,环己二烯等。
○3 亲双烯体的双键碳原子上连有吸电子基团时,反应易进行。
常见的亲双烯体有:CH 2=CH-CHO CH 2=CH-COOH CH 2=CH-COCH 3 CH 2=CH-CN CH 2=CH-COOCH 3 CH 2=CH-CH 2Cl
○4 D -A 反应的产量高,应用范围广是有机合成的重要方法之一,在理论上和生都占有重要的地位。
2伯碳正离子(Ⅱ)的结构为 π电子不能离域,碳正离子上的正电荷得不到分散,故不稳定。CH 2=CH CH-CH 3CH 3δ
CH CH-CH 3CH 2C CH=CH 2H Br H H C H H CH=CH CH H Br
1,2-加成产物
一个C-H σ键与π 共轭
1,4-加成产物五个C-H σ键与π 共轭CH 2CH 2
200℃CH CH
Δ
COOcH 33双烯体亲双烯体
CH 2Cl CH 2Cl H 3C H 3C CHO H 3C H 3C CHO Δ
C C COOCH 3
COOCH 3
CH CH C C O O O
O
O
[阅读材料]:共轭效应
一、共轭体系
1. 共轭体系的涵义 (共轭 平均分担之意,如牛之轭)
在分子结构中,含有三个或三个以上相邻且共平面的原子时,这些原子中相互平行的轨道之间相互交盖连在一起,从而形成离域键(大键)体系称为共轭体系。σπ
2.
a) π-π2) P-π共轭体系:
3) σ-π共轭体系: CH 3-CH=CH 2 见 P 68; 170 4) σ-P 共轭体系: 超共轭体系。 3. 共轭体系的特点:
a) 组成共轭体系的洋子原子具共平面性。 b) 键长趋于平均化。(因电子云离域而致)。
正常C-C 键
键长0.154nm 丁二烯中 C-C 键长0.147nm C=C 0.133nm
C=C 0.1337nm 苯分之中 C-C 键长均为0.1397nm
内能较低,分子趋于稳定(可从氢化热得知)。
二、共轭效应 1.共轭效应的含义
在共轭效应中,由于轨道之间的相互交盖,使共轭体系中电子云分布产生离域作用,键长趋于平均化,分子的内能降低,更稳定的现象称为共轭效应。
2. 共轭效应的传递: 沿着共轭链交替传递,不因链长而减弱(交替、远程传递)。例如:
3. 静态共轭效应的相对强度
1) 对P-π共轭效应有两种情况:
a 富电子时,P 电子朝着双键方向转移,呈供电子共轭效应(+C )。
对同族元素,P-π共轭效应的强度(+C )为:见P 95 对同周期元素,P-π共轭效应的强度(+C )为:见P 95
b 缺电子时,π电子云向P 轨道转移,呈吸电子共轭效应(- C )。其相对强度视体系结构而定。
2) π-π共轭的相对强度
双键与电负性大的不饱和基团共轭时,共轭体系的电子云向电负性大的元素偏移,呈现出吸电子的共轭效应(- C )。例如: CH 2=CH-CH=CH 2CH 2=CH-CH=CH-CH=CH 2
CH 2=CH-Cl CH 2=CH-CH 2CH 2=CH-CH 2CH 3C H 2
CH 3C H 2CH 3-CH-CH=CH-CH=CH 2
CH 32CH 3CH 2
X CH=CH 2C C
有机化学第四版第三章不饱和烃习题答案
不饱和烃第三章思考题其中含有六写出含有六个碳原子的烯烃和炔烃的构造异构体的构造式。习题3.1 (P69) 。个碳原子的烯烃,哪些有顺反异构?写出其顺反异构体的构型式(结构式)个 有顺反异构体:解:CH有13个构造异构体,其中4126 CHCHCH=CHCHCHCHCHCH=CHCHCHCHCHCHCH=CHCH3222233233222(Z,E)(Z,E)CH CH=CCHCHCHCH=CHCHCHCH=CHCHCHCH 3232232222CHCHCH333 CHCHCH=CCHCHCHCHCHCH=CHCHC=CHCH 332333322 CHCHCH333(Z,E)(Z,E) CHCHCH 33CHCH332C=CCHCH=CCHCHCH=CHCCHCH3233CHCH=CCH32322 CHCHCH333 有CH7个构造异构体:106CHCCHCHCCHCHCCHCHCCHCHCHCCHCHCH323232223232 CCHCHCHCCHCHCHCCHCHCHCCHCH)CC(CHCH 33332233CHCHCH333 (P74) 用衍生物命名法或系统命名法命名下列各化合物:习题3.2 )CHCH=CHCH(CH(CH)-3- or 2,5-(1) 己烯对称二异丙基乙烯二甲基233276453281CHCH=CHCHCH)(CHCHCH32232-4- 2,6-(2) 辛烯二甲基CH3132645or 3-(3)己炔二乙基乙炔CHCHCHCCCH322328 / 1 13245-1-(4)3,3-戊炔二甲基CHCCHCHC(CH)232343152-4-(5)1-炔戊烯 CHCCH=CHCH22CHCHCH322512634CH=CHHCCC=C(6) 3,4--1,3--5-炔二丙基己二烯2CHCHCH322CH32,3-(7) 二甲基环己烯CH3CH35,6--1,3-(8) 环己二烯二甲基CH3(P74) 习题3.3 用Z,E-命名法命名下列各化合物:HClC=C-1-Z)-1-(1) -1-丁烯↑ (溴↑氯BrCHCH32CHCl3C=C(2) -3-E)-2--2-↓氯↑(戊烯氟 FCHCH23CHHCHCH322C=C(3) E)-3--2-↑乙基(↓己烯 CHCHCH332CHCHCHCH3232C=C(4) E)-3--2-↓↑异丙基(己 烯)HCH(CH23(P83) 完成下列反应式:习题3.4 HH 催化剂lindlar C=CHCCCHC(1) 7733HHCC7337HHC NHLi , 液733HCCCHCC=C7733(2) CHH7328 / 2
大学有机化学期末考试试题A卷
大学有机化学期末考试试题A卷学院:专业:学号:姓名: 题号一二三四五六总分得分 1. 2. 3. 4. 5. 二、选择题
1、SP2杂化轨道的几何形状为() A.四面体B.平面形C.直线形D.球形2、甲苯在光照下溴化反应历程为() A.自由基取代反应B.亲电取代 C.亲核取代D.亲电加成 3、下列化合物中最容易发生硝化反应的是()
六、推断题(14分) 1、某烃A,分子式为C5H10,它与溴水不发生反应,在紫外光照射下与溴作用只得一种产物B(C5H9Br)。将化合物B与KOH的醇溶液作用得到C(C5H8),化合物C经臭氧化并在Zn 粉存在下水解得到戊二醛。写出化合物A的构造式及各步反应。 2、某化合物A的分子式是C9H10O2,能溶于NaOH溶液,易与溴水、羟胺、氨基脲反应,与托伦(Tollen)试剂不发生反应,经LiAlH4还原成化合物B(C9H12O2)。A及B均能起卤仿反应。A用锌-汞齐在浓盐酸中还原生成化合物C(C9H12O),C用NaOH处理再与CH3I煮沸得化合物D(C10H14O)。D用KMnO4溶液氧化最后得到对-甲氧基苯甲酸。推测A、B、C、D 的结构式。 -------------------附参考答案--------------- 一、命名(共10分) 1、Z –3-甲基-4-乙基-3-庚烯 2、7, 7-二甲基双环[2,2,1]-2-庚烯 3、Z-12-羟基-9-十八碳烯酸 4、N, N-二甲基甲酰胺 5、N-乙基-N-丙基苯胺 二、选择题(共20分)BACBD CBACB 三、完成下列反应,写出主要产物(每空2分,共20分)
人教版化学必修2烃类有机物专题练习及答案
有机物专题练习及答案 1. 衡量一个国家石油化工发展水平的标志是() A.石油产量 B.乙烯产量 C.天然气产量D.汽油产量 2. 下列气体中,只能用排水集气法收集,不能用排空气法收集的是() A.NO2B.NH3C.C2H4D.CH4 3. 制取较纯净的一氯乙烷最好采用的方法是() A.乙烷和氯气反应B.乙烯和氯气反应 C.乙烯和氯化氢反应D.乙烯和氢气、氯气的混合气体反应 4.某气态烷烃与烯烃的混合气9 g,其密度为相同状况下氢气密度的11.2倍,将混合气体通过足量的溴水,溴水增重4.2 g,则原混合气体的组成为() A.甲烷与乙烯B.乙烷与乙烯C.甲烷与丙烯D.甲烷与丁烯 5.若甲烷与氯气以物质的量之比1︰3混合,在光照下得到的产物: ①CH3Cl;②CH2Cl2;③CHCl3;④CCl4,其中正确的是() A.只有①B.只有② C.①②③的混合物D.①②③④的混合物 6.在下列反应中,光照对反应几乎没有影响的是() A.浓硝酸久置后变黄B.氯气与甲烷的反应 C.氧气与甲烷的反应D.次氯酸的分解 7.下列物质中,在一定条件下既能起加成反应,也能起取代反应,但不能使KMnO4酸性溶 液褪色的是( B ) A.乙烷B.苯C.乙烯D.乙醇 8. 下列有机物不.能通过乙烯的加成反应制取的是() A.CH3CH2Cl B.CH2Cl—CH2Cl C.CH3—CH2OH D.CH3—COOH 9. 现有分子式为C n H m O2的某有机物,1 mol该有机物在氧气中完全燃烧后,产生等物质的 量的CO2和H2O,并消耗78.4 L(标准状况)氧气,该有机物分子中碳原子数n是( ) A. 2 B. 3 C. 4 D. 5 10. 丙烯醇(CH2==CH—CH2OH)可发生的化学反应有() ①加成②氧化③燃烧④加聚⑤取代 A. 只有①②③ B. 只有①②③④ C. 只有①②③④⑤ D.只有①③④ 11. 茉莉醛具有浓郁的茉莉花香,其结构简式如下图所示: 关于茉莉醛的下列叙述错误的是:() A.在加热和催化剂作用下,能被氢气还原 B.能被高锰酸钾酸性溶液氧化 C.在一定条件下能与溴发生取代反应 D.不能与氢溴酸(HBr)发生加成反应 12. 由乙烯推测丙烯(CH2=CH—CH3)与溴水反应时,对反应产物的叙述正确的() A.CH2Br—CH2—CH2Br B.CH3—CBr2—CH3 C.CH3—CH2—CHBr2D.CH3—CHBr—CH2Br 13. 对尼古丁和苯并[a]芘的分子组成与结构描述正确的是() A.尼古丁为芳香族化合物 B.苯并[a]芘的分子式为C20H18 C.苯并[a]芘分子中含有苯环结构单元,是苯的同系物
高二有机化学综合测试题(附答案)
高二有机化学综合测试题_ 一、单选题 1.已知咖啡酸的结构如图所示。关于咖啡酸的描述正确的是( ) A .分子式为C 9H 5O 4 B .1mol 咖啡酸最多可与5mol 氢气发生加成反应 C .与溴水既能发生取代反应,又能发生加成反应 D .能与Na 2CO 3溶液反应,但不能与NaHCO 3溶液反应 2.某化妆品的组分Z 具有美白功效,原从杨树中提取,现可用如下反应制备:下列叙述错误的是( ) A.X 、Y 和Z 均能使溴水褪色 B.X 和Z 均能与3NaHCO 溶液反应放出2CO C.Y 既能发生取代反应,也能发生加成反应 D.Y 可作加聚反应单体,X 可作缩聚反应单体 3.下列说法不正确的是( ) A.油脂皂化反应得到高级脂肪酸盐与甘油 B.在一定条件下,苯分别与液溴、硝酸作用生成溴苯、硝基苯的反应都属于取代反应 C.己烷有4种同分异构体,它们的熔点、沸点各不相同 D.聚合物可由单体3CH CH 2CH 和2CH 2CH 加聚制得 4.下列关于有机化合物的说法正确的是( ) A.2-甲基丁烷也称为异丁烷 B.由乙烯生成乙醇属于加成反应 C.49C H Cl 有3种同分异构体 D.油脂和蛋白质都属于高分子化合物
5.将2.4g某有机物M置于密闭容器中燃烧,定性实验表明产物是 CO、CO和水蒸气。将燃烧产物 2 依次通过浓硫酸、碱石灰和灼热的氧化铜(试剂均足量,且充分反应),测得浓硫酸增重1.44g,碱石灰增重1.76g,氧化铜减轻0.64g。下列说法中不正确的是( ) A.M的实验式为 CH O 2 B.若要得到M的分子式,还需要测得M的相对分子质量或物质的量 C.若M的相对分子质量为60,则M一定为乙酸 D.通过红外光谱仪可分析M中的官能团 6.下列说法正确的是( ) A.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 B.按系统命名法,化合物的名称是2,3,5,5-四甲基-4,4-二乙基己烷 C.苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色 D.结构片段为的高聚物,其单体是甲醛和苯酚 7.用下列装置完成相关实验,不合理的是( ) A.用a趁热过滤提纯苯甲酸 B.用b制备并检验乙稀 C.用c除去溴苯中的苯 D.用d分离硝基苯与水 8.化合物a、b、c的分子式均为C8H8,其结构如下所示,下列说法正确的是( ) A.b的同分异构体可与苯互为同系物 B.c苯环上的二氯代物有10种 C.a能与溴水发生取代反应 D.c中所有原子可以处于同一平面
大学有机化学练习题-第三章不饱和烃
第三章不饱和烃 学习指导: 1.烯烃的异构和命名:构造异构和顺反异构(顺式、反式和Z、E表示法); 2. 烯烃的化学性质:双键的加成反应—催化加氢和亲电加成(亲电加成反应历程,不对称加成规则,诱 导效应,过氧化物效应、双键的氧化反应(高锰酸钾氧化,臭氧化,催化氧化)、—氢原子的反应(氯化); 3、炔烃的命名和异构; 4、炔烃的化学性质:亲电加成反应;氧化反应(高锰酸钾氧化,臭氧化);炔烃的 活泼氢反应(酸性,金属炔化物的生成) 5、烯烃的制备(醇脱水,氯代烷脱氯化氢);炔烃的制备(二卤代烷脱卤化氢,炔烃的烷基化)。 6. 二烯烃的分类和命名; 7. 共轭二烯烃的化学性质:加成反应(1、4—加成和1、2—加成)双烯合成(Diels-Alder反应) 习题 一、命名下列各物种或写出结构式。 1、写出的系统名称。 2、写出(Z)-3-甲基-4-异丙基-3-庚烯的构型式。 3、写出的系统名称。 写出的系统名称。 4、 二、完成下列各反应式(把正确答案填在题中括号内)。 1、 2、( ) 3、 4、
5、 6、 7、 三、理化性质比较题(根据题目要求解答下列各题)。 1、排列下列烯烃与HCl加成的活性次序: (A) (CH3)2C == CH2 (B) CH2 == CH2 (C) CH3CH == CH2 (D) CF3CH == CH2 2、将下列碳正离子按稳定性大小排序: 3、将下列碳正离子按稳定性大小排列: 4、排列与下列化合物进行双烯加成的活性次序: 5、比较下列化合物与1, 3-丁二烯进行Diels-Alder反应的活性大小: 6、由下列哪一组试剂经Diels-Alder反应生成产物?
烃类有机物性质总结
本章重难点专题突破 1 各类烃的结构与性质归纳解读 键含有加成反应 后者为铁粉。②苯不能使酸性高锰酸钾溶液褪色,但苯的同系物一般能被氧化而使酸性高锰酸钾溶液褪色。 溴水、溴的四氯化碳溶液、光照、催化剂等)对反应的影响。 2 烃类燃烧规律集锦 1.烃完全燃烧前后气体体积变化规律 烃完全燃烧的通式:C x H y +(x +y 4)O 2――→点燃x CO 2+y 2 H 2O (1)燃烧后温度高于100 ℃,即水为气态 ΔV =V 后-V 前=y 4 -1 ①y =4时,ΔV =0,体积不变②y >4时,ΔV >0,体积增大③y <4时,ΔV <0,体积减小 (2)燃烧后温度低于100 ℃时,即水为液态
ΔV=V前-V后=1+y 4,总体积减小 [特别提示]烃完全燃烧时,无论水是气态还是液态,燃烧前后气体体积变化都只与烃分子中的氢原子数有关,而与烃分子中碳原子数无关。 2.烃完全燃烧时耗氧量规律 (1)等物质的量的烃(C x H y)完全燃烧时,其耗氧量的大小取决于(x+y 4)的值,其值越大,耗氧 量越多。 (2)等质量的烃完全燃烧,其耗氧量大小取决于该烃分子中氢的质量分数,其值越大,耗氧量越多。相同碳原子数的烃类,碳的质量分数越大,耗氧量越多。 (3)最简式相同的烃,不论它们以何种比例混合,只要总质量一定,完全燃烧时所消耗的氧气为定值。 (4) 3 (1)2 (2)碳的质量分数相同的烃,只要总质量一定,以任意比混合,完全燃烧后,产生的CO2的量总是一个定值。 4.燃烧时火焰亮度与含碳量的关系比较规律 (1)含碳量越高,燃烧现象越明显,表现为火焰越明亮,黑烟越浓。如C2H2、苯、甲苯等燃烧时火焰明亮,并伴有大量浓烟;而含碳量越低,燃烧现象越不明显,无黑烟,如甲烷;对于C2H4及单烯烃的燃烧则是火焰较明亮,并伴有少量黑烟。 (2)含碳原子较少的各类烃,燃烧时的现象是不同的,烷烃无黑烟产生,烯烃有少量黑烟产生,炔烃及芳香烃有浓黑烟产生。应用燃烧来鉴别简单的烷烃、烯烃和炔烃是一种简单而有效的方法。 3、确定混合烃组成的四种方法 1.平均相对分子质量法 假设混合烃的平均相对分子质量为M,则必含相对分子质量比M小或相等(由同分异构体组成的混合气体)的烃。如M<26(烷、炔相混),则混合烃中一定有CH4,或M<28(烷、 烯相混),则混合烃中一定有CH4,等等。 2.平均分子组成法 假设混合烃的平均分子式为C x H y,根据其平均分子组成情况有以下规律:若1 一、选择题(每小题只有一个选项符合题意,每小题3分,共48分) 1.下列说法中不正确的是 ( ) A. 维勒用无机物合成了尿素,突破了无机物与有机物的界限 B. 开发核能、太阳能等新能源,推广乙醇汽油,使用无磷洗涤剂都可直接降低碳排放量 C. 红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析 D. 尼龙、棉花、天然橡胶、ABS 树脂都是由高分子化合物组成的物质 2.下列有机物的命名正确的是( ) A 、 3-甲基-2-乙基戊烷 B 、 (CH 3)3CCH 2CH( C 2H 5)CH 3 2,2-二甲基-4-乙基戊烷 C 、 邻甲基苯酚 D 、 2-甲基-3-戊炔 3、 下列叙述正确的是( ) A .OH 和OH 分子组成相差一个—CH 2—,因此是同系物关系 B .和 均是芳香烃,既是芳香烃又是芳香族化合物 C .分子式为C 4H 8的有机物可能存在4个C —C 单键 D .分子式为C 2H 6O 的红外光谱图上发现有C-H 键和C-O 键的振动吸收,由此可以初步推测有机物结构简式一定为C 2H 5-OH 4、有机物分子中基团间的相互影响会导致化学性质的不同。下列叙述不能说明上述观点的是( ) A 、甲苯与硝酸作用可得到2,4,6-三硝基甲苯,而苯与硝酸作用得到硝基苯 B 、甲苯可以是高锰酸钾溶液退色,而甲烷不能 C 、乙烯可发生加成反应,而乙烷不能 D 、苯酚能与NaOH 溶液反应,而乙醇不能 5、利用下图所示的有机物X 可生产S -诱抗素Y 。下列说法正确的是( )。 CH 3 CH 3-CH -CH -CH 3 CH 2 CH 3 2 CH 3 3 CH 3-CH -C C -CH 3 一.命名下列各化合物或写出结构式(每题1分,共10分) 1. C H C(CH3)3 (H3C)2HC H 2. 3-乙基-6-溴-2-己烯-1-醇 3. O CH3 4. CHO 5. 邻羟基苯甲醛 6. 苯乙酰胺 7. OH 8. 对氨基苯磺酸 9. COOH 10. 甲基叔丁基醚 二. 试填入主要原料,试剂或产物(必要时,指出立体结构),完成下列各反应式。(每空2分,共48分) 1. CH CH2Cl CHBr KCN/EtOH 2. 3. 4. +CO2CH3 5. 4 6. O O O O O 7. CH2Cl Cl 8. 3 +H2O- SN1历程 + 9. C2H5ONa O CH3 O + CH2=CH C CH3 O 10. +C12高温高压 、 CH = C H2HBr Mg CH3COC1 Br Br Zn EtOH 11. C O CH 3 + Cl 2 H + 12. Fe,HCl H 2SO 4 3CH 3 (CH 3CO) 2O Br NaOH 24 NaNO H PO (2) 三. 选择题。(每题2分,共14分) 1. 与NaOH 水溶液的反应活性最强的是( ) (A). CH 3CH 2COCH 2Br (B). CH 3CH 2CHCH 2Br (C). (CH 3)3CH 2Br (D). CH 3(CH 2)2CH 2Br 3 2. 对CH 3Br 进行亲核取代时,以下离子亲核性最强的是:( ) (A). CH 3COO - (B). CH 3CH 2O - (C). C 6H 5O - (D). OH - 3. 下列化合物中酸性最强的是( ) (A) CH 3CCH (B) H 2O (C) CH 3CH 2OH (D) p-O 2NC 6H 4OH (E) C 6H 5OH (F) p-CH 3 C 6H 4OH 4. 下列化合物具有旋光活性得是:( ) A, CH 3 CH 3B, C, (2R, 3S, 4S)-2,4-二氯-3-戊醇 5. 下列化合物不发生碘仿反应的是( ) A 、 C 6H 5COCH 3 B 、 C 2H 5OH C 、 CH 3CH 2COCH 2CH 3 D 、CH 3COCH 2CH 3 wo最新文件---------------- 仅供参考--------------------已改成-----------word文本--------------------- 方便更改 rd 有机物专题练习及答案 1. 衡量一个国家石油化工发展水平的标志是() A.石油产量B.乙烯产量C.天然气产量D.汽油产量 2. 下列气体中,只能用排水集气法收集,不能用排空气法收集的是() A.NO2B.NH3C.C2H4D.CH4 3. 制取较纯净的一氯乙烷最好采用的方法是() A.乙烷和氯气反应B.乙烯和氯气反应 C.乙烯和氯化氢反应D.乙烯和氢气、氯气的混合气体反应 4.某气态烷烃与烯烃的混合气9 g,其密度为相同状况下氢气密度的11.2倍,将混合气体 通过足量的溴水,溴水增重4.2 g,则原混合气体的组成为() A.甲烷与乙烯B.乙烷与乙烯C.甲烷与丙烯D.甲烷与丁烯 5.若甲烷与氯气以物质的量之比1︰3混合,在光照下得到的产物: ①CH3Cl;②CH2Cl2;③CHCl3;④CCl4,其中正确的是() A.只有①B.只有② C.①②③的混合物D.①②③④的混合物 6.在下列反应中,光照对反应几乎没有影响的是() A.浓硝酸久置后变黄B.氯气与甲烷的反应 C.氧气与甲烷的反应D.次氯酸的分解 7.下列物质中,在一定条件下既能起加成反应,也能起取代反应,但不能使KMnO4酸性溶 液褪色的是( B ) A.乙烷B.苯C.乙烯D.乙醇 8. 下列有机物不.能通过乙烯的加成反应制取的是() A.CH3CH2Cl B.CH2Cl—CH2Cl C.CH3—CH2OH D.CH3—COOH 9. 现有分子式为C n H m O2的某有机物,1 mol该有机物在氧气中完全燃烧后,产生等物质的 量的CO2和H2O,并消耗78.4 L(标准状况)氧气,该有机物分子中碳原子数n是( ) A. 2 B. 3 C. 4 D. 5 10. 丙烯醇(CH2==CH—CH2OH)可发生的化学反应有() ①加成②氧化③燃烧④加聚⑤取代 A. 只有①②③ B. 只有①②③④ C. 只有①②③④⑤ D.只有 ①③④ 11. 茉莉醛具有浓郁的茉莉花香,其结构简式如下图所示: 关于茉莉醛的下列叙述错误的是:() A.在加热和催化剂作用下,能被氢气还原 B.能被高锰酸钾酸性溶液氧化 C.在一定条件下能与溴发生取代反应 D.不能与氢溴酸(HBr)发生加成反应 12. 由乙烯推测丙烯(CH2=CH—CH3)与溴水反应时,对反应产物的叙述正确的() 必修二有机化学习题二 可能用到的相对原子质量:H-1 C-12 O-16 Cl-35.5 Br-80 Na-23 1、一次性餐具目前最有发展前景的是()。 A.瓷器餐具B.淀粉餐具C.塑料餐具D.纸木餐具 2、下列说法中错误的是 ①化学性质相似的有机物是同系物 ②分子组成相差一个或几个CH2原子团的有机物是同系物 ③若烃中碳、氢元素的质量分数相同,它们必定是同系物 ④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似 A.①②③④B.只有②③C.只有③④D.只有①②③ 3、能使酸性高锰酸钾溶液褪色,但不能跟溴水反应褪色的是: A、乙醛 B、乙烯 C、乙醇 D、裂化汽油 4、相同物质的量浓度的下列物质的稀溶液中,pH最小的是 A、乙醇 B、乙酸 C、氯化钠 D、碳酸 5、用分液漏斗可以分离的一组混合物是 A、溴苯和水 B、乙酸乙酯和乙酸 C、溴乙烷和乙醇 D、乙醇和水 6.下列物质属于纯净物的是()A.苯B.聚乙烯C.汽油D.煤 7.氯仿可用作全身麻醉剂,但在光照条件下,易被氧化成生成剧毒的光气(COCl2)?光2HCl+2COCl2为防止发生医疗事故,在使用前要先检查是否2CHCl3 +O2?→ 变质。下列那种试剂用于检验效果最好()A.烧碱溶液B溴水C.KI淀粉溶液D.AgNO3溶液 8.医院里检验糖尿病的方法是将病人尿液加入到CuSO4和NaOH的混合液中,加热后产生红色沉淀说明病人的尿中含有() A.脂肪B.乙酸C.蛋白质D.葡萄糖 9.炒菜时,又加料酒又加醋,可使菜变得香美可口,原因是()A.有盐类物质生成B.有酸类物质生成 C.有油脂类物质生成D.有酯类物质生成 10.丙烯酸的结构简式为CH2=CH—COOH,其对应的性质中不正确的是()A.与钠反应放出氢气 B.与新制的Cu(OH)2悬浊液反应 C.能与溴水发生取代反应 D.发生相互加成反应生成高分子化合物 11.白酒、食醋、蔗糖、淀粉等均为家庭厨房中常用的物质,利用这些物质能完成下列实验的是() ①检验自来水中是否含氯离子②鉴别食盐和小苏打③蛋壳能否溶于酸④白酒中是否 含甲醇 不饱和烃习题答案 习题1 2-乙基-1-戊烯;3-乙基环己烯;2,2-二甲基-3-庚炔;3-乙基-1,6-庚二烯;2,3-二甲基丁二烯;顺,反-2,4-己二烯;E-2-戊二烯;E-1-氯-2-甲基-1-丁烯;E-1-氯-1-溴-3,3--二甲基-1-丁烯;1,5-二甲基环戊二烯;1,4-环己二烯;1-异丙基环丁烯。 习题2 C H 3CH 3 H 3C H 3 C H 3CH 3 CH 3 Cl C H 2CH 2 H 3 CH 3 CH 3 CH 3 CH 3 C H 3 C H 3CH 3 C H 3C H 2CH C H 2CH C H 3CH 3 习题3,(1) C H 3O C H 33 SO 3H (2) CH 3 Br (3)CH 3 Br (4) C H 3H 3CH 3 O (5) C H 3CH 3 H CH 3Cl (6) CH 3 Br (7) C H 3CH 3 O (8)Br Br Br CH 3 Br (9)OH CH 3O H (10)HOOC O OH (11) O CH 3 O (12) Br 习题4,(1. C 3C H 33B ,C H 3C H 3OH (2)CH 2 Cl CH 3 (3) COOE t COOH (4) C H 3H 3Br (5) CH 3 C H 3(6)C H 3COOM e COOM e (7) O O C H 3O (8)COOH C H 3CH 3 (9) CH 3 O (10)CN C H 3C H 3CN 习题5,(4)最活泼,不对称二甲基推电子,(2)次之,一个甲基推电子,(1)又次之,乙基推电子(位阻比较大),(3)活泼性排最后,无推电子基。 习题6,(1) C H 3C H 3CH 3CH 3 CH 33 C H 3CH 23 KM nO 4 褪色 C H 3CH 23 C H 3C H 3CH 3CH 3 CH 33 Br Br 褪色 不褪色 CH 3CH 3C H 3H 3CH 3CH 3 (2) KM nO 4 褪色 不褪色 正己烷1-己炔 2-己炔 正己烷 1-己炔 2-己炔己炔 己炔 习题7,叔碳正离子稳定性最大,9个C-H 西格玛键超共轭; 仲碳正离子稳定性次之,6个C-H 西格玛键超共轭; 伯碳正离子稳定性又次之,3个C-H 西格玛键超共轭; 甲基碳正离子最不稳定无C-H 西格玛键超共轭。 习题8, (1) C H 3CH C H 3Cl Cl Zn C H 3CH 3 3 KM O C H 33 O C H 3COOH + A B 综合测试题(三) 一、命名下列化合物或写结构式: SO 3H CH 3 CH 3CHCH ≡CHCHCH 3 CH 2CH 3NHCOCH 3 HO 123 CH 3 5 6 4 O O O C C HOOCCH 2CH(OH)CH 2COOH 7.R-半胱氨酸 8. 顺-1,2-环己二醇的优势构象(用构象式表示) 9.N,N —二乙基苯胺 10.β-D-呋喃核糖(Haworth 式) 11.β-吡啶甲酰胺 12.间-硝基苯甲醚 二、选择题 (一) A 型题 13.能与酸性高锰酸钾溶液反应生成HOOC(CH 2)3COCH 3的是( ) CH 3 CH 3 (CH 3)2C CHCH 2CH 3 CH 2CHCH 2CH=C(CH 3)2 A B C D 14.下列化合物的溶液不能与溴水反应的是( ) A D-果糖 B D-核糖 C 胆固醇 D 甘油三油酸酯 15.下列化合物受热脱水产物为环酮的是( ) A CH 2CH 2COOH 2CH 2COOH CH 2CH 2COOH 2OH B C D COOH COOH COOH COOH 16.下列化合物中既能与NaHSO 3反应析出结晶,又能与FeCl 3显色的是( ) CH 3CCH 2CH 3 CH 3CCH 2CCH 3 A B C D OH COOH OH COCH 3 17.下列试剂能与糖类化合物发生显色反应的是( ) A FeCl 3溶液 B 水合茚三酮溶液 C α-萘酚/浓H 2SO 4 (Molisch 试剂) D 稀CuSO 4/OH -溶液 18.下列化合物中既能与HCN 加成,又能发生碘仿反应的是( ) A 苯乙酮 B 丙醛 C 丙酮酸 D 异丙醇 19.环丙二羧酸X 无旋光性,加热后脱羧得到环丙烷甲酸,则X 的结构为( ) COOH COOH CH 2COOH CH 2COOH COOH COOH HOOC HOOC D C B A 20.下列试剂中不能用来鉴别丙醛和丙酮的试剂是( ) A . Tollens 试剂 B . Fehling 试剂 C . NaOH + I 2溶液 D . HNO 2溶液 21.下列化合物受热生成交酯的是( ) A .1-羟基环戊基甲酸; B .γ-氨基己酸; C .β-环戊酮甲酸; D .己二酸 22.有关丙二烯分子叙述中正确的是( ) A .分子中存在π-π共轭效应; B .分子中所有原子共平面; C .分子中存在对称因素,故无光学异构体; D .分子中所有的碳原子都为sp 2杂化。 23.化合物A 的分子式为C 5H 8,可以吸收两分子溴,但不能与硝酸银的氨溶液反应。A 与KMnO 4 / H + 反应生成化合物B (C 3H 4O 3)和放出二氧化碳,由此可知A 是( ) A .2–甲基–1,3–丁二烯; B .环戊烯; C .2–戊炔; D .1,3–戊二烯; 24.下列化合物为消旋体的是( ) A C B D CHO Cl HOOC COOH CH 2=CHCHOHCH=CHCH 3 CH 2OH CH 2OH OH OH H H 25.下面描述的反应机制不属于自由基反应的是( ) A .环戊烷高温下与氯气的反应; B .甲苯在FeCl 3存在下与氯气的反应; C .环己烯在光照下与溴的反应; D .丙烯在过氧化物存在下与HBr 的反应; 26.下列碳正离子的稳定性顺序为( ) 上海理工大学 2012 ~2013学年第二学期《有机化学》期中试卷(A) 一、选择题(每小题2分,共50分)【得分:】 1.下列说法错误的是:( A ) A.有机化学发展至今已有100多年的历史了 B.魏勒第一个在实验室合成出尿素 C.有机化合物就是碳化合物 D.迪尔斯和阿尔德获得过诺贝尔化学奖 2.下列哪一种性质不是大多数有机化合物的共性:( B ) A.容易燃烧 B.在水中的溶解度比较大 C. 密度比水的密度小 D. 反应比较慢 3. 下列化合物中的碳为SP2杂化的是:( B )。 A:乙烷B:乙烯C:乙炔D:新戊烷 4.下列与共轭效应无关的是:( C ) A.电子离域 B.键长平均化 C.反应速度加快 D. 产生离域能 5.下列正碳离子的稳定性顺序是:( D) CH3CH3CH3 5-a5-b5-c A.a>b>c B. a>c>b C. c>b>a D. b>a>c 6.某烷烃的分子式为C5H12,其一元氯代物有三种,那么它的结构为:( A)。A:正戊烷B:异戊烷C:新戊烷D:不存在这种物质 7.甲基异丁基仲丁基甲烷的结构是:( B ) A B C D 8.化合物8-A的系统名称是:( C ) A. 3-甲基-2-庚烯-5-炔 H B. 5-甲基-5-庚烯-2-炔 C.(E)-3-甲基-2-庚烯-5-炔 D.(反)-3-甲基-2-庚炔-5-烯 8-A . . 9.(R)-1, 3-二溴戊烷的结构式是:( B ) 2 Br H H Br Et H CH33 13-A13-B13-C13-D A B C D 10.5-硝基-2-萘磺酸的结构是:( C ) 2 3 H 3 H 10-A 10-B 10-C 10-D 11.反-1-甲基-3-叔丁基环己烷的最稳定构象是:( D ) 11-A11-C11-D - t- 12.12-A的正确系统名称是:( C ) A. (E)-1-氯-2-丙基-1-丁烯 B. (Z)-1-氯-2-乙基-1-戊烯 C.(E)-1-氯-2-乙基-1-戊烯 D. 3-氯甲叉基己烷 12-A Cl H 13.13-A的正确系统名称是:( A ) A. 6-甲基-1-氯-1,4-环己二烯 B. 1-甲基-2-氯-2,5-环己二烯 C.3-甲基-2-氯-1,4-环己二烯 D.1-氯-2-甲基-3,6-环己二烯 14.14-A的正确系统命称是:( C ) A.3-磺酸基-4-甲基-1-溴苯 B.6-甲基-3-溴苯磺酸 C.2-甲基-5-溴苯磺酸 13-A Cl Me SO3H Br CH3 14-A 《烃》总结 一、烃的分类及结构和性质 要求掌握本章所涉及的化学方程式 三、专题总结 (一)烃类反应6种类型 1、取代反应——一上一下,取而代之 对象:饱和烃、苯和苯的同系物; 卤素要求是纯净的卤素单质 如:甲烷和氯气的取代反应(方程式、实验现象、产物的物性、取代的有关计算)苯和苯的同系物:卤化、硝化、磺化(方程式、实验设计、产物的物性、除杂)2、加成反应——断一拉二,只上不下 对象:不饱和烃(烯烃、炔烃和苯及苯的同系物) 烯与H2、X2、HX、H2O的加成。炔与H2、X2、HX 的加成; 苯与H2、Cl2的加成。马氏加成。 掌握单烯烃的单一加聚和混合加聚,掌握由加聚产物反推单体。 4、氧化反应 点燃:所有烃都可以燃烧。充分燃烧意即O2适量或过量。产物为CO2和H2O。 掌握所涉及的计算:差量法、极限法、平均值法、十字交叉法、守恒法 被酸性KMnO4溶液氧化:烯、炔、苯的同系物 5、还原反应——不饱和烃加氢 6、分解反应 甲烷分解成C和H2;烷烃的裂化 (二)常见经验规律 1、气态烃燃烧前后总物质的量的变化 C x H y+(x+y/4)O2——XCO2 + y/2 H2O(气) 当y=4时,反应前后气体总物质的量不变 当y>4时,n前<n后 当y<4时,n前>n后(只有C2H2) 如:125℃,1L某气态烃在9L氧气中充分燃烧后的混合气体体积为10L,则该烃可能是:CH4、C2H4、C3H4 2、·质量相同的不同烃,燃烧耗氧量由y/x决定或H%决定,比值越大,耗氧量越大。 生成CO2、H2O的量分别由C%、H%决定。 因此最简式相同的有机物(各元素百分比相同),不管以任何比例混合,只要混合物总的质量一定,各元素的质量就相同,完全燃烧后生成的CO2和H2O及消耗O2的总量就一定。 ·物质的量相同的不同烃,燃烧耗氧量由x+y/4决定,生成CO2、H2O的量分别由x、y决定。 如:C3H8、C3H6、C4H6、C7H8四种物质分析。 3、烃中含碳量的高低 烷烃<烯烃<炔烃、苯及其同系物 烷烃中碳数越多,碳的质量分数越大(<6/7);烯烃中碳的质量分数为一定值(6/7);炔烃、苯的同系物中碳数越多,碳的质量分数越小(>6/7)。 4、烃类物质熔沸点、密度规律:随分子量(碳原子个数)增大而升高。碳数相等的情况下,支链越多, 沸点越低。 5、“根”、“基”、“原子团”的区别 (三)区别一组概念: 同系物、同分异构体(书写、判断数目)、同位素、同素异形体 如:液氯、氯气、P4、P、D、T、CH4、C3H8、1—丁烯、2—甲基丁烯 属于同系物的是CH4、C3H8; 属于同分异构体的是1—丁烯、2—甲基丁烯; 属于同素异形体的是P4、P; 属于同位素的是D、T; 属于同一种物质的是液氯、氯气。 (四)命名: 烷烃、烯烃、炔烃类的命名。 云南大学200 -200学年下学期化学科学与工程学院 学科基础课《有机化学(2)》期末考试(闭卷)试卷(3) 满分:100分 考试时间:120分钟 任课教师: ________ 学院: _________ 专业: _______ 学号: ______ 姓名: _______ 题号 — 二 三 四 五 六 七 总分 得分 命名或写出结构(注意立体结构)(每题1分,共10分): 2、下列糖的衍生物中有还原性的是( Br 2. CH 3CHCH 2COOH 3. COOH o 6 厂十 CN(CH 3 )2 ?V 7. 己内酰胺 D ?丙氨酸 9. p-D-ntt 喃葡萄糖 10. O CH 2OC CH 3 o CHOC CH 3 o CH 2OC CH 3 二、 根据题意回答下列各题(每题2分,共20分) 1、下列竣酸衍生物进行氨解反应的活性由高到低的顺序是:( COOCH 3 CO b. | O CO 3、4、5、 7、8、 B. H CH2OH OH OH 0 OH 比较下列化合物的酸性最强的是( COOH B. Cl 比较下列化合物的碱性最强的是( CH3CH2CH2NH2 (CH3CH2CH2)2NH A. B. 'H列化合物屮可发生碘仿反应的有: H OH (CH3)2CHCOCH(CH3)2 (CH3)2CHCOCH3 OH NO2 C? ),最弱的是 OH CH2OH 0 H OH ),最弱的是 COOH D. ( CH3CH2CONH2 C. CH3CH2OH A- B. C? 下列化合物与CH3COOH进行酯化反应时,速率最快的是 CH3 A.OH B. CH2OH c. NO2 ) PhNH2 D. ) o D. ) ( CH3 OH 下列按基化合物与HCN反应活性最高的是( (CH3)2CHCH=O (CH3)2CH-CO-CH(CH3)2 (CH3)3C-CO-CH3 c. A. B. ),最低的是( Ph-CO-Ph D. 下列人名反应被称为: 浓NaOH < ?CHO ------------------------------- o A、Hofmann 重排 COO'Na+ B、Beckmann 重排 c、Wittig 5L应D、Cannizarro 反应 9、下列化合物称为油脂的是: CHsOCOCn H23 CH2OCOC11H23 CHOCOSH23 CH2OCOC11H23 CH2OCOC17H35 A. B.CH2OCOC2H5 CHOCOC2H5 CH2OCOC2H5 c. ) CH2OCOC17H35 CHOCOC17H35 CH2OCOC17H35 D. 10、下列化合物烯醇式含量的大小顺序是: 本章重难点专题突破 1 各类烃的结构与性质归纳解读 含有苯环含有键碳碳键结构特点 C 仅含C —键 含有键取代 反应 取代反应 加成反应 加成反应 主要化学反应 热分解反应 加成反应 氧化反应 氧化反应 氧化反应 氧化反应 CH CH===CH CH 代表物 62426对应的空间构型 正四面体形 平面形 直线形 平面形 一般随分子中碳原子数的增多,熔、沸点升高,简单的同系物常物理性质 密度增大。碳原子数为1~4的烃,常温下是气态,温下为液态,不溶不溶于水。液态烃的密度比水的小 于水,密度比水小 碳链异构 碳链异构 侧链大小及相对同分异构体 碳链异构 位置异构 位置异构 位置产生的异构 [特别提示] ①烷烃与苯和苯的同系物都能发生取代反应,但反应条件不同,前者为光照,后者为铁粉。②苯不能使酸性高锰酸钾溶液褪色,但苯的同系物一般能被氧化而使酸性高锰酸钾溶液褪色。 [特别提示]应用上述性质可以解决不同类型烃的鉴别问题,同时要特别注意条件(如液溴、溴水、溴的四氯化碳溶液、光照、催化剂等)对反应的影响。 2 烃类燃烧规律集锦 1.烃完全燃烧前后气体体积变化规律 yy点燃烃完全燃烧的通式:CH+(x+)O――→xCO+HO 22yx242(1)燃烧后温度高于100 ℃,即水为气态 yΔV=V-V=-1 ①y=4时,ΔV=0,体积不变②y>4时,ΔV>0,体积增大③y<4时,ΔV<0,体积减小 前后4 ℃时,即水为液态100 燃烧后温度低于(2). yΔV=V-V=1+,总体积减小后前4[特别提示]烃完全燃烧时,无论水是气态还是液态,燃烧前后气体体积变化都只与烃分子中的氢原子数有关,而与烃分子中碳原子数无关。 2.烃完全燃烧时耗氧量规律 y(1)等物质的量的烃(CH)完全燃烧时,其耗氧量的大小取决于(x+)的值,其值越大,耗氧yx4 量越多。 (2)等质量的烃完全燃烧,其耗氧量大小取决于该烃分子中氢的质量分数,其值越大,耗氧 量越多。相同碳原子数的烃类,碳的质量分数越大,耗氧量越多。 (3)最简式相同的烃,不论它们以何种比例混合,只要总质量一定,完全燃烧时所消耗的氧 气为定值。 (4)脂肪烃完全燃烧耗氧量比较 类别通式消耗氧气的量规律 烷烃CH (3n+1)/2 消耗氧气2nn2+CH 3n/2 烯烃、环烷烃的量成等nn2差数列炔烃、二烯烃CH (3n-1)/2 (1)质量相同的烃,碳的质量分数越大,完全燃烧生成的CO越多。2(2)碳的质量分数相同的烃,只要总质量一定,以任意比混合,完全燃烧后,产生的CO2的量总是一个定值。 4.燃烧时火焰亮度与含碳量的关系比较规律 (1)含碳量越高,燃烧现象越明显,表现为火焰越明亮,黑烟越浓。如CH、苯、甲苯等燃22烧时火焰明亮,并伴有大量浓烟;而含碳量越低,燃烧现象越不明显,无黑烟,如甲烷;对于CH及 **大学科学技术学院2007 /2008 学年第2 学期考核试卷课号:EK1G03A 课程名称:有机化学A 试卷编号:A 班级:学号:姓名: 阅卷教师:成绩: 一.命名下列各化合物或写出结构式(每题1分,共10分) 1. C C(CH3)3 (H3C)2HC H 2. COOH 3. O CH3 4. CHO 5. OH 6. 苯乙酰胺 7. 邻羟基苯甲醛 8. 对氨基苯磺酸 9. 3-乙基-6-溴-2-己烯-1-醇 10. 甲基叔丁基醚 二. 试填入主要原料,试剂或产物(必要时,指出立体结构),完成下列各反应式。(每空2分,共48分) 1. CH CH 2Cl CHBr KCN/EtOH 2. 3. 4. +C12高温高压、 CH = C H 2HBr Mg CH 3COC1 + CO 2CH 3 5. 4 6. CH 3OH OH 4 7. CH 2Cl Cl 8. 3 + H 2O -SN 1历程 + 9. C 2H 5ONa O CH 3 O + CH 2=CH C CH 3 O 10. Br Br Zn EtOH 11. OCH 3 CH 2CH 2OCH 3 + HI (过量) 12. Fe,HCl H 2SO 4 3CH 3 (CH 3CO) 2 O Br NaOH 24 NaNO H PO (2) 三. 选择题。(每题2分,共14分) 1. 下列物质发生S N1反应的相对速度最快的是( ) A B C (CH 3)2CHBr (CH 3)3CI (CH 3)3CBr 2. 对CH 3Br 进行亲核取代时,以下离子亲核性最强的是:( ) (A). CH 3COO - (B). CH 3CH 2O - (C). C 6H 5O - (D). OH - 3. 下列化合物中酸性最强的是( ) (A) CH 3CCH (B) H 2O (C) CH 3CH 2OH (D) p-O 2NC 6H 4OH (E) C 6H 5OH (F) p-CH 3C 6H 4OH 4. 指出下列化合物的相对关系( ) 3 2CH 3H 32CH 3 A ,相同, B ,对映异构, C ,非对映体, D ,没关系 5. 下列化合物不发生碘仿反应的是( ) A 、 C 6H 5COCH 3 B 、C 2H 3OH高二化学《有机化学基础》综合测试题及答案
大学有机化学期末考试题(含三套试卷和参考答案)
人教版化学必修2烃类有机物专题练习及答案 (优选.)
必修二有机化学测试题2
有机化学B教材第二版课后习题解析第三章 不饱和烃课后习题参考答案
大学有机化学综合测试题(三)
有机化学期中考试试题及参考答案
烃类知识点
有机化学2期末考试卷.docx
烃类有机物性质总结
有机化学期末考试试题及答案
