抗肿瘤抗体药物的研究进展_陈雪静

一直以来癌症的常规治疗手段均为手术、化疗和放疗,而肿瘤分子靶向治疗的出现使癌症的治疗策略发生了重大改变。目前肿瘤分子靶向药物主要有单克隆抗体和小分子抑制剂两类,抗体药物已经成为癌症治疗中最有效的方法之一。据Pharmaprojects V5数据库统计,目前上市与临床在研的约500种抗体药物中,大约50%用于肿瘤治疗。抗体药物从鼠源发展到嵌合型、人源化、全人源,免疫原性的问题已经基本解决。目前抗肿瘤抗体药物已不再局限于通过结合肿瘤特异性蛋白或生长因子而发挥靶向治疗的作用,基于抗体的一些新兴疗法已逐步形成,如抗体偶联药物(antibody -drug conjugate ,ADCs )是利用抗体作为靶向载体输送化疗药物,而免疫疗法是利用抗体激活抗癌免疫应答。1已上市的抗肿瘤抗体药物
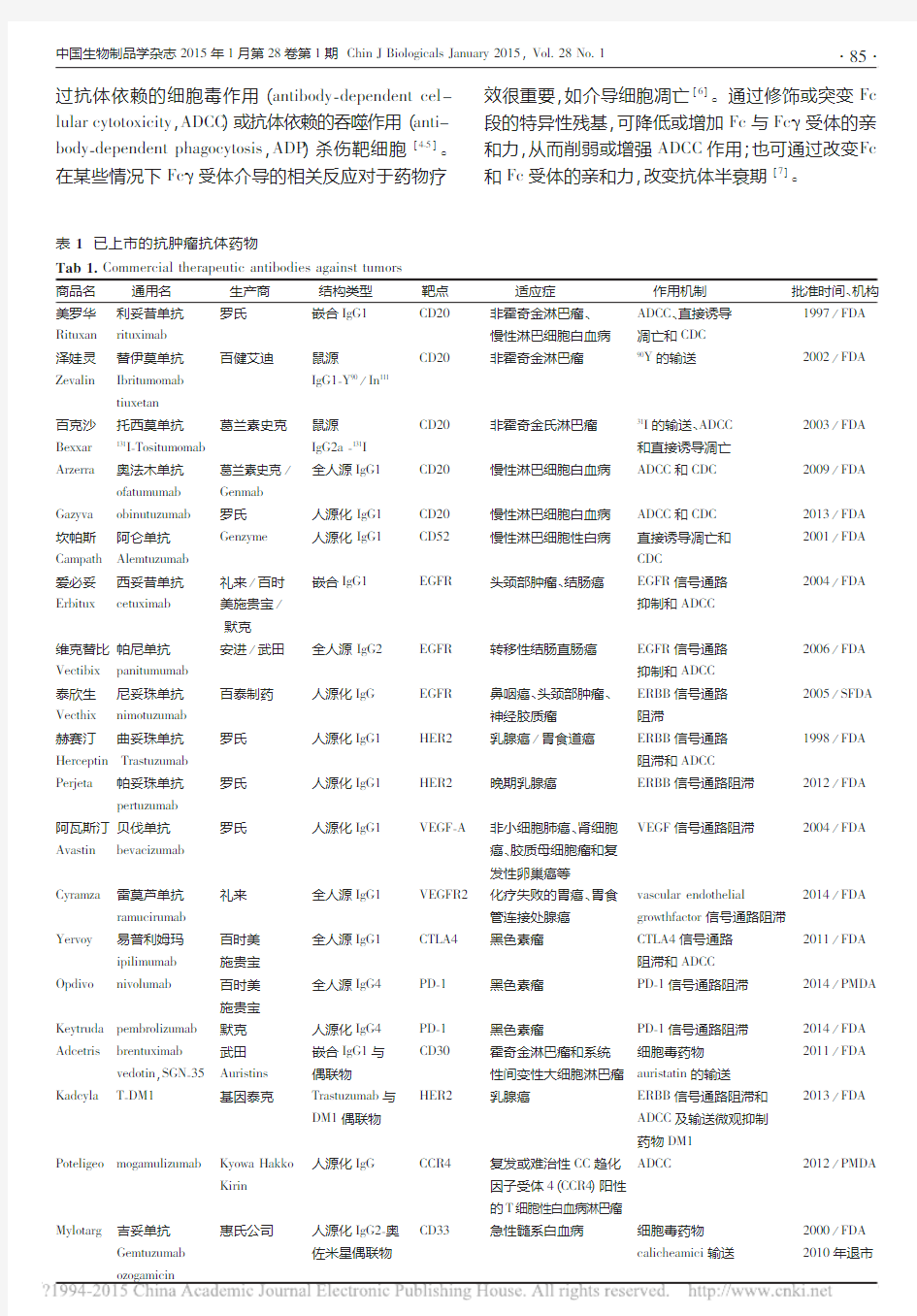
目前已上市的抗肿瘤抗体药物共20种(包括已
退市的Mylotarg ),其中美国FDA 批准17个,我国
SFDA 批准1个,日本PMDA 批准2个,见表1。在这些药物中,用于治疗血液癌症(如非霍奇金淋巴瘤、慢性淋巴细胞白血病)的抗体主要靶向B 细胞相关抗原CD20、CD52等,通过诱导细胞凋亡发挥抗肿瘤
作用[1]
。针对实体瘤的抗体主要靶向表皮生长因子受体(epithelial growth factor receptor ,EGFR )和表皮生长因子受体2(human epidermal growth factor receptor 2,HER2),通过阻滞肿瘤细胞信号通路等方式直接杀伤肿瘤细胞[2]。bevacizumab 靶向血管内皮生长因子(vascular endothelial growthfactor ,VEGF )-A ,通过抑制肿瘤血管生成及营养运输发挥抗肿瘤作用[3]。
ADCs 药物使靶向化疗成为可能,
T -DM1的上市使ADCs 成了抗肿瘤药物领域的研究热点。ipilimumab 的临床疗效引起了人们对癌症主动免疫治疗的关注,接下来引发了PD -1/PD -L1免疫治疗抗体的研发热潮。
由表1可见,上市抗体药物大多为IgG1亚型,其与自然杀伤细胞、巨噬细胞和中性粒细胞表面的Fc γ受体亲和力最强。抗体与Fc γ受体结合后,通
抗肿瘤抗体药物的研究进展
陈雪静
综述,常亮,高健审校
华北制药集团新药研究开发有限责任公司抗体药物研制国家重点实验室,河北石家庄050015
摘要:经过30多年的发展,抗肿瘤抗体药物已成为癌症治疗中最成功和最重要的策略之一。本文综述了已上市的抗肿瘤抗体药物,详细介绍了临床应用较成功的药物靶点,包括CD20、表皮生长因子受体(epithelial growth factor receptor ,EGFR )、表皮生长因子受体2(HER2)、血管内皮生长因子(vascular endothelial growthfactor ,VEGF ),并总结了抗体偶联药物及癌症免疫疗法等新兴疗法的研究进展。关键词:肿瘤;抗体药物;靶点;免疫治疗
中图分类号:R979.1+9文献标识码:A 文章编号:1004-5503(2015)-01-0084-07
Advances in research on therapeutic antibodies against tumors
CHEN Xue -jing ,CHANG Liang ,GAO Jian
New Drug Research and Development Company Limited ,North China Pharmacentical Corporation ,State Key Laboratory
of Antibody Drug Development ,Shijiazhuang 050015,Hebei Province ,China
Corresponding author:GAO Jian ,E -mail:gaojian3993@https://www.360docs.net/doc/2c8166355.html,
Abstract :As one of the most successful and the most important strategies ,therapeutic antibodies against tumors have been developed for more than 30years.This paper reviews the commercial therapeutic antibodies against tumors and their targets in clinic ,including cluster of differentiation 20(CD20),epithelial growth factor receptor (EGFR ),human epidermal growth factor receptor 2(HER2)and vascular endothelial growth factor (VEGF ),and summarizes the advances in research on novel therapy of tumors ,including antibody -drug conjugate and immunotherapy.
Key words :Tumor ;Antibody drug ;Target ;Immunotherapy
基金项目:国家高技术研究发展计划(863计划)项目(2012AA02A306).通讯作者:高健,E -mail :gaojian3993@https://www.360docs.net/doc/2c8166355.html,
·综述·
DOI:10.13200/https://www.360docs.net/doc/2c8166355.html,ki.cjb.000733
过抗体依赖的细胞毒作用(antibody-dependent cel-lular cytotoxicity,ADCC)或抗体依赖的吞噬作用(anti-body-dependent phagocytosis,ADP)杀伤靶细胞[4-5]。在某些情况下Fcγ受体介导的相关反应对于药物疗效很重要,如介导细胞凋亡[6]。通过修饰或突变Fc 段的特异性残基,可降低或增加Fc与Fcγ受体的亲和力,从而削弱或增强ADCC作用;也可通过改变Fc 和Fc受体的亲和力,改变抗体半衰期[7]。
表1已上市的抗肿瘤抗体药物
https://www.360docs.net/doc/2c8166355.html,mercial therapeutic antibodies against tumors
商品名通用名生产商结构类型靶点适应症作用机制批准时间、机构美罗华利妥昔单抗罗氏嵌合IgG1CD20非霍奇金淋巴瘤、ADCC、直接诱导1997/FDA Rituxan rituximab慢性淋巴细胞白血病凋亡和CDC
泽娃灵替伊莫单抗百健艾迪鼠源CD20非霍奇金淋巴瘤90Y的输送2002/FDA Zevalin Ibritumomab IgG1-Y90/In111
tiuxetan
百克沙托西莫单抗葛兰素史克鼠源CD20非霍奇金氏淋巴瘤31I的输送、ADCC2003/FDA Bexxar131I-Tositumomab IgG2a-131I和直接诱导凋亡
Arzerra奥法木单抗葛兰素史克/全人源IgG1CD20慢性淋巴细胞白血病ADCC和CDC2009/FDA ofatumumab Genmab
Gazyva obinutuzumab罗氏人源化IgG1CD20慢性淋巴细胞白血病ADCC和CDC2013/FDA 坎帕斯阿仑单抗Genzyme人源化IgG1CD52慢性淋巴细胞性白病直接诱导凋亡和2001/FDA Campath Alemtuzumab CDC
爱必妥西妥昔单抗礼来/百时嵌合IgG1EGFR头颈部肿瘤、结肠癌EGFR信号通路2004/FDA Erbitux cetuximab美施贵宝/抑制和ADCC
默克
维克替比帕尼单抗安进/武田全人源IgG2EGFR转移性结肠直肠癌EGFR信号通路2006/FDA Vectibix panitumumab抑制和ADCC
泰欣生尼妥珠单抗百泰制药人源化IgG EGFR鼻咽癌、头颈部肿瘤、ERBB信号通路2005/SFDA Vecthix nimotuzumab神经胶质瘤阻滞
赫赛汀曲妥珠单抗罗氏人源化IgG1HER2乳腺癌/胃食道癌ERBB信号通路1998/FDA Herceptin Trastuzumab阻滞和ADCC
Perjeta帕妥珠单抗罗氏人源化IgG1HER2晚期乳腺癌ERBB信号通路阻滞2012/FDA pertuzumab
阿瓦斯汀贝伐单抗罗氏人源化IgG1VEGF-A非小细胞肺癌、肾细胞VEGF信号通路阻滞2004/FDA Avastin bevacizumab癌、胶质母细胞瘤和复
发性卵巢癌等
Cyramza雷莫芦单抗礼来全人源IgG1VEGFR2化疗失败的胃癌、胃食vascular endothelial2014/FDA ramucirumab管连接处腺癌growthfactor信号通路阻滞
Yervoy易普利姆玛百时美全人源IgG1CTLA4黑色素瘤CTLA4信号通路2011/FDA ipilimumab施贵宝阻滞和ADCC
Opdivo nivolumab百时美全人源IgG4PD-1黑色素瘤PD-1信号通路阻滞2014/PMDA 施贵宝
Keytruda pembrolizumab默克人源化IgG4PD-1黑色素瘤PD-1信号通路阻滞2014/FDA Adcetris brentuximab武田嵌合IgG1与CD30霍奇金淋巴瘤和系统细胞毒药物2011/FDA vedotin,SGN-35Auristins偶联物性间变性大细胞淋巴瘤auristatin的输送
Kadcyla T-DM1基因泰克Trastuzumab与HER2乳腺癌ERBB信号通路阻滞和2013/FDA
DM1偶联物ADCC及输送微观抑制
药物DM1
Poteligeo mogamulizumab Kyowa Hakko人源化IgG CCR4复发或难治性CC趋化ADCC2012/PMDA Kirin因子受体4(CCR4)阳性
的T细胞性白血病淋巴瘤
Mylotarg吉妥单抗惠氏公司人源化IgG2-奥CD33急性髓系白血病细胞毒药物2000/FDA Gemtuzumab佐米星偶联物calicheamici输送2010年退市ozogamicin
2抗肿瘤抗体药物的主要靶点
目前临床在研的抗肿瘤抗体药物约200多种,针对70多个靶点,主要有造血分化抗原CD20、CD30、CD33、CD52等;生长及分化信号通路中的生长因子及受体ERBBs、HGFR、IGF-1R、EPHA3、TRAILR、RANKL 等;血管、细胞间质及外基质抗原VEGF、VEGFR、αVβ3、α5β1、FAP、tenascin等;实体瘤糖蛋白CEA、EPCAM、PSMA等;糖脂类GAN-GD2、GAN-GD3、GM2等[8]。近年来临床上应用较为成功的抗体药物主要以CD20、EGFR、HER2、VEGF为靶点。
2.1靶向CD20的抗肿瘤抗体药物CD20为B淋巴细胞表面特有的分化抗原,表达于90%以上的B 淋巴瘤细胞和正常B淋巴细胞;并且CD20分子不易脱落,与抗体结合后不内化,因此成为治疗B细胞淋巴瘤的理想作用靶点。抗CD20单克隆抗体是治疗B细胞淋巴瘤的重要靶向药物[9]。
以CD20为靶点已上市及临床在研的单抗药物约有30余种,其中60%为rituximab及其仿制药物(引自Pharmaprojects V5数据库)。rituximab是非霍奇金淋巴瘤的“金标准”治疗药物,并作为慢性淋巴细胞白血病的一线用药,2012年全球市场销售额达到67.32亿美元。在过去的十几年中,rituximab广泛应用于B细胞淋巴瘤患者,其安全性和有效性得到了证实,由于临床疗效好,副作用低,因此被大量仿制。但rituximab为嵌合抗体,人源化程度低,难免会产生免疫原性,且其有效性依赖于细胞表面CD20的表达水平,很多患者对其不应答或易产生耐药性,并且会产生严重的输液反应[10]。针对这些不足,人们通过开发CD20新表位、人源化改造和糖基化改造研制出多种新型抗体。ofatumumab是Ⅱ型全人源抗CD20单抗药物,较Ⅰ型嵌合rituximab具有较强的ADCC作用、较低的免疫原性、较好的耐受性,但被感染的风险较大[11]。obinutuzumab是糖基化修饰的Ⅱ型人源化抗CD20单抗药物,通过修饰Fc段而增强对Fcγ受体的亲和力,ADCC作用和直接细胞毒作用较rituximab更强,CDCC作用更弱,对非霍奇金淋巴瘤的总体响应率及耐受性均更强[12]。
除此之外,放射性标记的ibritumomab tiuxetan 与Tositumomab均已上市,ocrelizumab、ocaratuzumab、veltuzumab等均处于临床Ⅱ/Ⅲ期研发阶段(引自Pharmaprojects V5数据库)。经过多年的发展,ritux-imab已经在非霍奇金淋巴瘤和慢性淋巴细胞白血病治疗中占有很高的市场份额,该靶点其他药物的发展仍需要一些时间。我国对于抗CD20抗体药物的仿制主要是rituximab和ofatumumab,已有6家公司获得rituximab仿制药的临床批件,另有8个抗CD20药物申报临床。
2.2靶向EG FR家族的抗肿瘤抗体药物EGFR家族包括HER1(EGFR)、HER2、HER3及HER4四个成员,它们同属于跨膜酪氨酸激酶受体,在结构和功能上具有高度同源性。EGFR家族在多种实体瘤(如非小细胞肺癌、乳腺癌、宫颈癌、胃癌等)中存在过表达和(或)突变,导致肿瘤细胞生长失控和恶性程度增高,且与肿瘤的侵袭和转移等相关。EGFR家族通过与配体结合,产生二聚化和自身磷酸化,从而被活化,进一步激活下游信号通路[13]。EGFR和HER2与肿瘤的发生发展关系密切,多年的临床试验证明靶向EGFR 和HER2的抗体药物是癌症治疗史上的重大进步。
2.2.1靶向EGFR的抗肿瘤抗体药物以EGFR为靶点的单抗药物已上市的有Cetuximab和panitumumab,它们都用于治疗转移性结肠癌,通过阻断EGFR信号通路发挥作用,如图1C所示[14]。cetuximab与伊立替康联用治疗伊立替康化疗方案耐药的转移性直肠癌效果显著[15],与FOLFIRINOX方案联用治疗转移性结直肠癌,缓解率达到80.9%[16],联合放疗治疗局部晚期头颈部鳞状细胞癌,治疗组和单用放疗组的中位生存期分别为49.0个月和29.3个月,无进展生存期分别为17.1个月和12.4个月,5年生存率分别为45.6%和36.4%[17]。panitumumab是高亲和力全人源抗体药物,相对于嵌合型的cetuximab 免疫原性较低,由于是IgG2型抗体ADCC效应较弱。panitumumab联合FOLFOX4治疗转移性结直肠癌PFS比FOLFOX4单独治疗提高了1.6个月[18]。在cetuximab和panitumumab治疗中,最常见的不良反应是皮肤反应(如过性痤疮样皮疹)和低镁血症(EGFR 在肾髓袢中高表达),这可能是EGFR的靶点效应[19]。nimotuzumab是我国正式上市的第一个人源化单克隆抗体药物,在头颈部肿瘤和神经胶质瘤临床研究中发现nimotuzumab联合放疗可显著提高疗效。
目前以EGFR为靶点的临床在研抗体药物主要有necitumumab、LY-3016859和futuximab、ABT-806、GT-MAB5.2-GEX、RO-5083945等,其中necitumumab 在临床Ⅲ期试验中改善了患者的总生存期。我国对于EGFR抗体药物的研究主要是cetuximab仿制,中信国健已进入Ⅲ期临床。
2.2.2靶向HER-2的抗肿瘤抗体药物在HER2信号通路中,HER3通常很重要。HER3结合调蛋白等配体可以激活HER2激酶活性,HER2激酶将HER3胞内结构域磷酸化,从而启动下游信号通路[14]。
以HER-2为靶点的上市及临床在研单抗药物约有20个,其中70%是trastuzumab及其仿制药。trastuzumab是目前Her-2阳性可手术乳腺癌的标准治疗方案,2012年其全球市场销售额达62.72亿美元(引自Pharmaprojects V5数据库)。trastuzumab与HER2的胞外结构域Ⅳ结合阻断HER2相关信号通路,如图1A[14]所示。trastuzumab单药治疗有效率约25%,联合化疗药物有效率可达50%,可明显延长转移性乳腺癌患者的肿瘤进展时间及总生存期,另外耐药性好,副反应轻,因此被大量仿制[20]。pertuzumab 靶向HER2胞外结构域Ⅱ,阻断异二聚体的形成从而阻断HER2信号转导通路,如图1B[14]所示。per-tuzumab较trastuzumab有更好的安全性和耐受性,由于两株抗体作用的表位不同,联合用药表现出较好的协同性,治疗有效率显著提高,患者预后明显改善[21]。此类药物常见副反应有心脏毒性、心力衰竭,有时有严重过敏反应,输液反应和肺中毒等。从多年的临床应用来看,trastuzumab与多种化疗方案或与pertuzumab联用已经大大提高了病人的无进展生存期和总生存率[20]。
目前以HER2为靶点的临床在研抗体药物还有margetuximab、TrasGEX、ARGX-111等,我国已有7个HER2靶点人源化单抗仿制药获得临床批件,另有7个在审评中。
A:Trastuzumab;B:Pertuzumab;C:Cetuximab and panitumumab;D:T-DM1(ado-trastuzumab emtansine)。
注:星号代表细胞毒类药物,美登素衍生物1(DM1)。
图1靶向EGFR和HER2的治疗性抗体
Fig1.Therapeutic antibodies targeting EGFR and HER2
2.3靶向V EG F/V EG FR的抗肿瘤抗体药物血管生成是肿瘤发生发展的必要条件,抗血管生成是肿瘤治疗的一种策略。VEGF是很强的促血管生成因子,研究表明,VEGF与其特异性受体VEGFR结合,促进血管内皮细胞增殖、分化、成熟,促使新毛细血管生成及其功能成熟,在实体瘤的血管生成中起关键作用。抑制血管生成使得肿瘤生长及转移的可能性降低[22],因此VEGF及其受体VEGFR成为抗肿瘤药物研发的热门靶点。
以VEGF为靶点的抗肿瘤单抗药物主要是be-vacizumab及其仿制药(引自Pharmaprojects V5数据库)。bevacizumab是FDA批准上市的第一个抑制肿瘤血管生成的药,已被批准用于多种实体瘤,如转移性结直肠癌、非小细胞肺癌、转移性肾癌等,2012年其全球市场销售额为62.91亿美元(引自Pharmapro-jects V5数据库)。bevacizumab在转移性结直肠癌的一线和二线治疗中均显示出很好的疗效,在E3200临床试验[23]中,总体生存率提高33%,在NO16966研究[24]中,无进展生存期提高20%。作为转移性非小细胞肺癌的一线治疗药物,bevacizumab在ECOG4599试验[25]中将相对化疗的总生存期提高了25%。在关键的AVOREN试验[26]中将肾细胞癌患者的无进展生存期提高了67%,30%的病人出现了肿瘤萎缩现象。bevacizumab常见的不良反应是胃肠穿孔、手术伤口愈合并发症、高血压、蛋白尿和出血等,这些可能是由靶点本身或其人源化结构的缺陷所致。
作为VEGF的受体,VEGFR的数量有限且易被饱和,因此一些学者认为抑制VEGFR比阻断VEGF能更有效地抑制VEGF信号传导途径[27]。ramucirumab 是VEGFR2靶向抗体药物,2014年被FDA批准用于治疗晚期胃癌或食管胃交界腺癌,并授予孤儿药资格。目前临床在研的VEGF/VEGFR信号通路单抗阻断剂大都以VEGFR为靶点,主要有礼来的icru-cumab和诺华的ESBA-1008以及处于临床Ⅰ期的IMC-3C5、VGX-100、RG-7221、tanibirumab、sevacizumab 等。我国在研的此类药物均以VEGF为靶点,已有3个VEGF人源化单抗药物获得临床批件,另有10个药物在审评中。
3基于抗体的新兴疗法
3.1抗体偶联药物A DC s ADCs用于肿瘤治疗的研究始于20世纪80年代,将抗体与细胞毒药物偶联,通过抗体将药物直接输送到癌细胞,而不伤害正常组织细胞,靶向治疗的同时降低了不良反应,而且能很好的应对耐药性问题。但是,由于偶联技术、抗体药物靶向性和有效性等限制,ADCs
药物直到近年
才被成功应用。研究表明,ADCs单用对化疗不敏感的肿瘤患者有较高的客观反应率[28],因此,它将成为肿瘤治疗抗体药物的重要发展方向。
吉妥珠单抗-奥佐米星(Mylotarg)是第一个上市ADC药物,靶点为CD33,用于治疗急性髓系白血病。由于该药应用的化学裂解链接不稳定,在血液循环中提前断裂释放出小分子药物,造成较重不良反应,辉瑞公司于2010年自愿将其退市[29]。CD33在90%的急性髓系白血病细胞中表达,在正常造血干细胞中不表达,且未干扰肿瘤细胞主要的病理生理功能,因此CD33可能不适于抗体治疗,但可作为ADCs的理想靶点[30]。目前以CD33为靶点的ADCs主要有HUM195、AVE9633、SGN-CD33A等。
2011年,FDA批准了另一个ADC药物Adcetris (brentuximab vedotin,SGN-35)用于治疗难治性霍奇金淋巴瘤和系统性间变性大细胞淋巴瘤。该药由CD30特异性抗体brentuximab与微管聚合抑制剂(monomethyl auristatin E,MMAE)联接而成。CD30抗原在恶性肿瘤细胞上过表达,SGN-35被CD30阳性的淋巴瘤细胞内吞后,抗体特定部位被溶酶体组织蛋白酶B消化,释放MMAE而启动细胞凋亡[31]。SGN-35对于复发性霍奇金淋巴瘤的响应率为73%,完全响应率为32%,对于间变性大细胞淋巴瘤的响应率为86%,完全响应率为57%。该药不良反应可控,主要为Ⅰ~Ⅱ级周围神经病和粒细胞缺乏[32]。但是由于患者数量相对较少,该药的销售额不高。
2013年Kadcyla(ado-trastuzumab emtansine,T-DM1)上市后,ADCs便成为抗肿瘤药物领域的研究热点。T-DM1用于治疗HER-2阳性转移性乳腺癌,由曲妥珠单抗和美登素衍生物DM1偶联而成,曲妥珠单抗靶向HER2已成功用于乳腺癌的治疗,DM1能与微管蛋白结合防止微管形成,阻滞细胞周期引起细胞凋亡[33]。TDM4450g/BO21976Ⅱ期临床[34]研究显示,与曲妥珠单抗联合多西他赛的一线治疗方案相比,T-DM1具有较好的整体疗效和药代动力学特性,并且耐受良好。EMILIAⅢ期临床研究显示,T-DM1优于拉帕替尼联合卡培他滨的化疗标准方案,明显延长HER2阳性晚期乳腺癌患者的无进展生存期[35]。T-DM1的主要不良反应为疲劳(59.1%)和恶心(37.3%),严重不良反应为血小板减少症(5.5%)和背部疼痛(3.6%)[33]。
T-DM1和SGN-35的成功应用,促使针对各种实体瘤和血液癌症的ADCs药物得到了快速发展。目前进入临床研究的ADCs药物已超过30个,其中15%用于肿瘤治疗,主要靶向CD19、CD22、CD56、CD70、EGFR等靶点。随着新的靶点、新的毒性分子和连接器的不断开发,ADCs药物的疗效及安全性将进一步提高。
3.2癌症免疫肿瘤细胞通过多种机制逃避免疫系统的监控,免疫疗法旨在增强机体正常免疫系统对抗肿瘤的能力。细胞毒性T淋巴细胞抗原4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)是T细胞表面的负调控因子,通过与抗原呈递细胞表面的CD80/CD86复合物结合来启动免疫抑制信号[36]。抗CTLA4单抗ipilimumab能够阻断CTLA4介导的共抑制信号通路(如图2A[14]所示),上调T细胞的活化增殖,诱导细胞毒性T淋巴细胞识别,杀死癌细胞[37]。在MDX010-20临床研究[37]中,ipilimumab 显著提高了晚期黑色素瘤患者的总生存期。CA184-024临床研究[38]显示,ipilimumab和达卡巴嗪联用比达卡巴嗪单药的1、2、3年生存率均有显著提高,分别为47.3%与36.3%,28.5%与17.9%,20.8%与12.2%。但ipilimumab单药响应率只有10%左右,而且容易产生严重或致命的免疫系统不良反应[37]。
ipilimumab的成功不仅是黑色素瘤的治疗中的重大进步,而且证实了阻断免疫检验点的免疫疗法具有可行性。程序性死亡因子1(programmed death-1,PD-1)是另一个T细胞负调控因子,与CTLA-4不同的是PD-1直接与肿瘤细胞相互作用,其抑制剂作用更强,毒性更低。PD-1与肿瘤细胞表面的受体PD-L1联接后,T细胞就不能够发现肿瘤细胞,向免疫系统发出攻击肿瘤细胞的信号,而PD-1及PD-L的阻断性抗体可增强T细胞应答,如图2[14]所示。
目前已上市的抗PD1单抗有百时美的nivolumab 和默克的pembrolizumab,均用于黑色素瘤的治疗。Nivolumab在一项临床研究中,33/107的患者肿瘤萎缩30%以上,62%的患者存活期超过1年,43%的患者存活期超过2年[39],nivolumab和ipilimumab联用的1年总生存率达94%,2年总生存率达88%[40]。在NCT01295827[41]临床试验中,135名患者客观应答率为38%,完全应答率为10%,总体平均无进展生存在超过7个月。另外罗氏的MPDL3280A和阿斯利康的MEDI4736两个抗PDL1单抗也进入了Ⅲ期临床研究,用于治疗晚期恶性黑色素瘤及其他实体瘤。两者在早期临床研究中均已取得积极数据。
抗PD1单抗不单阻断了PD1与PD-L1的联接,还抑制了T细胞与抗原呈递细胞的PD-L2(尤其是肺部)的相互作用,所以抗-PD1单抗药物容易引起肺炎。Anti-PD1单抗nivolumab、pembrolizumab均报道了肺炎这一严重不良反应,anti-PDL1单抗MEDI4376、
MPDL3280A则没有。临床上的抗PD1抗体一般为人源IgG4亚型,相对抗PDL1抗体ADCC作用较弱,而抗PDL1抗体通过基因工程改造,完全消除了Fcγ受体结合,尚未引起严重的肺炎反应[42]。因此认为抗PDL1抗体优于抗PD1抗体。相对普通抗体治疗药物,利用抗体阻断免疫检验点的癌症免疫疗法耐受性较好。相信在未来相当长的一段时间里,基于该原理的抗体药物将成为研发的热点。
A:抗CTLA4抗体Ipilimumab阻断免疫检验点;B:抗PD1或抗PD-L1抗体阻断免疫检验点免疫抑制;C:靶向CD3的双特异性抗体向肿瘤细胞招募细胞毒T细胞。
图2抗体的癌症免疫疗法
Fig2.Immunotherapy of cancer with antibody
4结语
肿瘤的发生是多因素、多阶段、多基因相互作用的结果。抗体药物通常针对单靶点,耐受性较差,价格昂贵,使其应用得到了限制。随着癌症发病机制研究的不断深入,越来越多的分子机制得以阐明,新靶点和已有靶点新功能的发现以及多靶点之间相互作用的阐明,会使未来癌症治疗向以下方向发展:应用多靶点抗体药物,如抗CD19/CD3双抗blinatumomab,由识别T细胞受体的抗CD3臂和识别B淋巴瘤细胞表面抗原的抗CD19臂组成,招募T细胞到肿瘤细胞,进而有效杀死肿瘤细胞(图2C[14]);同靶点不同表位药物的联合应用,如nivolumab与ipilimumab、trastuzumab与pertuzumab的联合应用以及与化疗、放疗的联合应用。
参考文献
[1]Mathas S,Rickers A,Bommert K,et al.Anti-CD20-and B-cell receptor]mediated apoptosis:evidence for shared intracellular
signaling pathways[J].Cancer Res,2000,60(24):7170-7176.[2]Mendelsohn J,Baselga J.The EGF receptor family as targets for cancer therapy[J].Oncogene,2000,19(56):6550-6565.
[3]Ferrara N,Hillan KJ,Gerber HP,et al.Discovery and devel-opment of bevacizumab,an anti-VEGF antibody for treating
cancer[J].Nat Rev Drug Discov,2004,3(5):391-400.[4]Park S,Jiang Z,Mortenson ED,et al.The therapeutic effect of anti-HER2/neu antibody depends on both innate and adaptive
immunity[J].Cancer Cell,2010,18(2):160-170.
[5]Stagg J,Loi S,Divisekera U,et al.Anti-ErbB-2mAb therapy requires type I and II interferons and synergizes with anti-PD-1
or anti-CD137mAb therapy[J].Proc Natl Acad Sci USA,2011,
108(17):7142-7147.
[6]Wilson NS,Yang B,Yang A,et al.An Fcγreceptor-dependent mechanism drives antibody-mediated target-receptor signaling
in cancer cells[J].Cancer Cell,2011,19(1):101-113.[7]Olafsen T.Fc engineering:serum half-life modulation through FcRn binding[J].Methods Mol Biol,2012,907(7):537-556.[8]Scott AM,Wolchok JD,Old LJ.Antibody therapy of cancer [J].Nat Rev Cancer,2012,12(4):278-287.
[9]Maloney DG.Anti-CD20antibody therapy for B-cell lymphomas [J].N Engl J Med,2012,366(21):2008-2016.
[10]Chen J,Li J.Rituximab-induced rare adverse reactions[J].
Adv Drug React J,2010,12(5):321-324.(in Chinese)
陈净,李剑.利妥昔单抗的罕见不良反应[J].药物不良反应
杂志,2010,12(5):321-324.
[11]Barth MJ,Czuczman MS.Ofatumumab:a novel,fully human anti-CD20monoclonal antibody for the treatment of chronic
lymphocytic leukemia[J].Future Oncol,2013,9(12):1829-
1839.
[12]Dalle S,Reslan L,Besseyre de Horts T,et al.Preclinical studies on the mechanism of action and the anti-lymphoma
activity of the novel anti-CD20antibody GA101[J].Mol Cancer
Ther,2011,10(1):178-185.
[13]Mendelsohn J,Baselga J.Status of epidermal growth factor receptor antagonists in the biology and treatment of cancer[J].
J Clin Oncol,2003,21(14):2787-2799.
[14]Sliwkowski MX,Mellman I.Antibody therapeutics in cancer [J].Science,2013,341(6151):1192-1198.
[15]Garrett CR,Eng C.Cetuximab in the treatment of patients with colorectal cancer[J].Expert Opin Biol Ther,2011,11(7):
937-949.
[16]Assenat E,Desseigne F,Thezenas S,et al.Cetuximab plus FOLFIRINOX(ERBIRINOX)as first-line treatment for unresec
table metastatic colorectal cancer:a phase II trial[J].Oncologist,
2011,16(11):1557-1564.
[17]Bonner JA,Harari PM,Giralt J,et al.Radiotherapy plus cetuximab for locoregionally advanced head and neck cancer:
5-year survival data from a phase3randomised trial,and
relation between cetuximab-induced rash and survival[J].Lancet
Oncol,2010,11(1):21-
28.
[18]Douillard JY,Siena S,Cassidy J,et al.Randomized,phaseⅢtrial of panitumumab with infusional fluorouracil,leucovorin,
and oxaliplatin(FOLFOX4)versus FOLFOX4alone as first-line
treatment in patients with previously untreated metastatic
colorectal cancer:the PRIME study[J].J Clin Oncol,2010,28
(31):4697-4705.
[19]Schrag D,Chung KY,Flombaum C,et al.Cetuximab therapy and symptomatic hypomagnesemia[J].J Natl Cancer Inst,2005,
97(16):1221-1224.
[20]Cobleigh MA,Vogel CL,Tripathy D,et al.Multinational study of the efficacy and safety of humanized anti-HER2monoclonal
antibody in women who have HER2-overexpressing metastatic
breast cancer that has progreeed after chemotherapy for
metastatic disease[J].J Clin Oncol,1999,17(9):2639-2648.[21]McCormack PL.Pertuzumab:a review of its use for first-line combination treatment of HER2-positive metastatic breast
cancer[J].Drugs,2013,73(13):1491-1502.
[22]Wu YY,Li EX.Progression of VEGF in the malignant tumor [J].Mod Oncol,2005,13(5):S18-S21.(in Chinese)
吴胤瑛,李恩孝.VEGF在恶性肿瘤中的研究进展[J].现代
肿瘤医学,2005,13(5):附18-附21.
[23]Giantonio BJ,Catalano PJ,Meropol NJ,et al.Bevacizumab in combination with oxaliplatin,fluorouracil,and leucovorin
(FOLFOX4)for previously treated metastatic colorectal cancer:
results from the Eastern Cooperative Oncology Group Study
E3200[J].J Clin Oncol,2007,25(12):1539-1544.
[24]Saltz LB,Clarke S,Daz-Rubio E,et al.Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line
therapy in metastatic colorectal cancer:a randomized phase III
study[J].J Clin Oncol,2008,26(12):2013-2019.
[25]Sandler A,Gray R,Perry MC,et al.Paclitaxel-carboplatin alone or with bevacizumab for non-small-cell lung cancer[J].N
Engl J Med,2006,355(24):2542-2550.
[26]Escudier B,Pluzanska A,Koralewski P,et al.Bevacizumab plus interferon alfa-2a for treatment of metastatic renal cell
carcinoma:a randomised,double-blind phase III trial[J].
Lancet,2007,370(9605):2103-2111.
[27]Zhu Z,Witte L.Inhibition of tumor growth and metastasis by targeting tumor-associated angiogenesis with antagonists to the
receptors of vascular endothelial growth factor[J].Invest New
Drugs,1999,17(3):195-212.
[28]Adair JR,Howard PW,Hartley JA,et al.Antibody-drug conjugates-aperfect synergy[J].Expert Opin Biol Ther,2012,
12(9):1191-1206.
[29]Hollander I,Kunz A,Hamann PR,et al.Selection of reaction additives used in the preparation of monomeric antibody-
calicheamicin conjugates[J].Bioconjug Chem,2008,19(1):
358-361.[30]Robillard N,Wuillème S,LodéL,et al.CD33is expressed on plasma cells of a significant number of myeloma patients,and
may represent a therapeutic target[J].Leukemia,2005,19(11):
2021-2022.
[31]Okeley NM,Miyamoto JB,Zhang X,et al.Intracellular activation of SGN-35,a potent anti-CD30antibody-drug conjugate
[J].Clin Cancer Res,2010,16(3):888-897.
[32]Katz J,Janik JE,Younes A.Brentuximab Vedotin(SGN-35)[J].Clin Cancer Res,2011,17(20):6428-6436.
[33]Lewis Phillips GD,Li G,Dugger DL,et al.Targeting HER2-positive breast cancer with trastuzumab-DM1,an antibody-
cytotoxic drug conjugate[J].Cancer Res,2008,68(22):9280-
9290.
[34]Hurvitz SA,Dirix L,Kocsis J,et al.Phase II randomized study of trastuzumab emtansine versus trastuzumab plus
docetaxel in patients with human epidermal growth factor
receptor2-postive metastatic breast cancer[J].J Clin Oncol,
2013,31(9):1157-1163.
[35]Verma S,Miles D,Gianni L,et al.Trastuzumab emtansine for HER2-positive advanced breast cancer[J].N Engl J Med,2012,
367(19):1783-1791.
[36]Chambers CA,Kuhns MS,Egen JG,et al.CTLA-4-mediated inhibition in regulation of T cell responses:mechanisms and
manipulation in tumor immunotherapy[J].Annu Rev Immunol,
2001,19(4):565-594.
[37]Weber J.Overcoming immunologic tolerance to melanoma:targeting CTLA-4with ipilimumab(MDX-010)[J].Oncologist,
2008,13(Suppl4):16-25.
[38]Sherrill B,Wang J,Kotapati S,et al.Q-TWiST analysis comparing ipilimumab/dacarbazine vs placebo/dacarbazine for
patients with stage III/IVmelanoma[J].Br J Cancer,2013,
109(1):8-13.
[39]Topalian SL,Sznol M,McDermott DF,et al.Survival,durable tumor remission,and long-term safety in patients with advanced
melanoma receiving nivolumab[J].J Clin Oncol,2014,32(10):
1020-1030.
[40]Wolchok JD,Kluger H,Callahan MK,et al.Nivolumab plus ipilimumab in advanced melanoma[J].N Engl J Med,2013,
369(2):122-133.
[41]Hamid O,Robert C,Daud A,et al.Safety and tumor responses with lambrolizumab(anti-PD-1)in melanoma[J].N
Engl J Med,2013,369(2):134-144.
[42]Robert C,Soria JC,Eggermont AM,et al.Drug of the year:programmed death-1receptor/programmed death-1ligand-1
receptor monoclonal antibodies[J].Eur J Cancer,2013,49(14):
2968-2971.
收稿日期:2014-06-18编辑:王佳凤
靶向抗肿瘤药物的研究进展_0
---------------------------------------------------------------最新资料推荐------------------------------------------------------ 靶向抗肿瘤药物的研究进展 靶向抗肿瘤药物的研究进展近年来,随着肿瘤生物学及相关学科的飞速发展,人们逐渐认识到细胞癌变的本质是细胞信号转导通路的失调导致的细胞无限增生,随之而来的是抗肿瘤药物研发理念的重大转变。 研发焦点正从传统细胞毒药物向针对肿瘤发生发展过程中众多环节的新药方向发展,这些靶点新药针对正常细胞和肿瘤细胞之间的差异,可达到高选择性、低毒性的治疗效果,从而克服传统细胞毒药物的选择性差、毒副作用强、易产生耐药性等缺点,为此,肿瘤药物进入了一个崭新的研发阶段。 目前发现的药物靶点主要包括蛋白激酶、细胞周期和凋亡调节因子、法尼基转移酶(FTase) 等,现就针对这些靶点的研发药物做一综述。 1、蛋白激酶蛋白激酶是目前已知的最大的蛋白超家族。 蛋白激酶的过度表达可诱发多种肿瘤。 蛋白激酶主要包括丝氨酸/苏氨酸激酶和酪氨酸激酶,其中酪氨酸激酶主要与信号通路的转导有关,是细胞信号转导机制的中心。 蛋白激酶由于突变或重排,可引起信号转导过程障碍或出现异常,导致细胞生长、分化、代谢和生物学行为异常,引发肿瘤。 研究表明,近 80%的致癌基因都含有酪氨酸激酶编码。 1 / 22
抑制酪氨酸激酶受体可以有效控制下游信号的磷酸化,从而抑 制肿瘤细胞的生长。 酪氨酸激酶受体分为表皮生长因子受体(EGFR) 、血管内皮细胞 生长因子受体(VEGFR) 、血小板源生长因子受体(PDGFR) 等,针对各种受体的酪氨酸激酶抑制剂目前已开发上市的主要为表 皮生长因子受体酪氨酸激酶(EGFR-TK) 抑制剂、血管内皮 细胞生长因子受体酪氨酸激酶(VEGFR-TK) 抑制剂和血小板 源生长因子受体酪氨酸激酶(PDGFR-TK) 抑制剂等。 基于多靶点的酪氨酸激酶抑制剂目前已成为研究重点,具有广 阔的发展前景,其中,包括舒尼替尼和索拉芬尼在内的几个上市新 药均获得了良好的临床评价结果。 1. 1 EGFR-TK 抑制剂许多实质性肿瘤均高度表EGFR, EGFR-TK 抑制剂是目前抗肿瘤药研发的热点之一。 EGFR家族成员包括 EGFR、 ErbB2、 ErbB3、 ErbB4 等,其家 族受体酪氨酸激酶以单体形式存在,在结构上由胞外区、跨膜区、 胞内区 3 个部分组成,胞外区具有 2 个半胱氨酸丰富区,胞内区 有典型的 ATP 结合位点和酪氨酸激酶区,其酪氨酸激酶活性在调节 细胞增生及分化中起着至关重要的作用。 目前已有多个 EGFR-TK 抑制剂上市,且有不少品种处于研发后 期。 1. 1. 1 代表品种 1. 1. 1. 1 吉非替尼(易瑞沙) 本品是一种选择性 EGFR-TK 抑制剂,由阿斯利康公司开发。
常用化疗药分类
1.细胞周期非特异性药物(CCNSC)和细胞周期特异性药物(CCSC )的区别 CCSC是周期特异性药物,特异性地杀伤处于特定时相的肿瘤细胞,需等肿瘤细胞处于对应时相才有效,故应慢滴。 2.化疗药物给药剂量按体表面积计算(文生氏公式) 体表面积(m2)=0.0061×身高(cm)+0.128×体重(kg)-0.1529 工作中计算体表面积:以身高1.6m,体重60公斤,体表面积为1.6m2,做调整 3.肿瘤病人治疗后,无复发,生存率≥5年,算治愈 4.联合化疗方案药物成原则 a.两种以上作用机制不同的药物组成 b.周期非特异性药物和不同时相的周期特异性药物配合 c.各药的毒性不相重复 d.一般3~4个药物最好,临床上一般2-3个药合用,4个药合用一般用于复发的肿瘤患者或者难治性的血液病患者, 5.化疗药物的器官毒性 ADR(多柔比星,阿霉素):心脏毒性 BLM(博来霉素):肺纤维化 DDP(顺铂):肾毒性 L-OHP(奥沙利铂)、VCR(长春新碱)、PTX(紫杉醇):神经毒性 BCNU(卡莫司汀):肝毒性 6.化疗分为 a.诱导化疗:又称新辅助化疗,实施局部治疗方法(如手术或放疗)前所做的全身化疗,目的是使肿块缩小、及早杀灭看不见的转移细胞,以利于后续的手术、放疗等治疗。对于早期和晚期肿瘤患者不采用新辅助化疗的方法。 b.辅助化疗:手术治疗和放疗的后,杀灭手术无法清除的微小病灶,减少复发,提高生存率。
c.姑息化疗:对于手术后复发、转移或就诊时不能切除的肿瘤病人,目的并不是彻底地消灭肿瘤,而在于能够平稳地控制肿瘤的进展,缓解患者的痛苦,延长其生命。这时的化疗称作“姑息化疗”。 7.常用细胞周期特异性药物 S 期特异性药物: 抗叶酸类:甲氨蝶呤(MTX ,胸腺嘧啶、嘌呤)、培美曲塞(PEM ,胸腺 嘧啶、嘌呤,)、雷替曲塞(胸腺嘧啶)、六甲蜜胺(嘧啶) 抗嘧啶类:氟尿嘧啶(5-FU )、卡培他滨(CAPE ,希罗达,5-FU 前体药)、 替加氟(FT207,5-FU 衍生物)、替吉奥(替加氟+吉美嘧啶 +奥替拉西钾)、优福定(替加氟+尿嘧啶)、卡莫氟(HCFU , 5-FU 衍生物)、 阿糖胞苷(Ara-c )、吉西他滨(GEM ,作用机制同Ara-c)、 安西他滨(Ara-c 衍生物) 抗嘌呤类:6-巯嘌呤(6-MP )、硫唑嘌呤(体内转化6-巯嘌呤起作用)、 氟达拉滨(Ara-A ,阿糖腺苷类似物,抗病毒类)、硫鸟嘌呤 (6-TG )、喷他司丁(DCF ,新的抗代谢药,本品是从链霉素 菌中分离得的抗生素) 干扰嘌呤和嘧啶合成 :羟基脲(HU) 拓扑异构酶I :喜树碱类,羟喜树碱(HCPT ),伊立替康(CPT-11)、 拓扑替康 拓扑异构酶II :依托泊苷(VP-16)、替尼泊苷(VM-26) M 期特异性药物:长春碱类:长春碱(VLB )、长春新碱(VCR )、长春瑞滨(NVB )、 长春地辛(VDS ) 紫杉类:紫杉醇(PTX )、多西他赛(DOC ) G 1期特异性药物:L-ASP (L-门冬酰胺酶),肾上腺皮质类固醇 G 2期特异性药物:博来霉素(BLM ,国外)、平阳霉素 (PYM ,国内,与BLM 成 分相近) 影响蛋白质功能与合成的药 门冬酰胺酶、培门冬酶、高三尖杉酯碱 抗代谢类 拓扑异构酶抑制剂
多肽类抗肿瘤药物研究进展
多肽类抗肿瘤药物研究进展 【摘要】目前,恶性肿瘤已严重威胁人类的健康,传统的手术、化疗、放疗等治疗手段不仅选择性低,毒副作用大,且易产生耐药性。而多肽具有良好的靶向性,且分子量小、来源广泛,具有低毒性、易于穿透肿瘤细胞且不产生耐药性的优点。抗肿瘤活性肽可特异性结合并作用于肿瘤组织,与肿瘤生长转移相关的信号转导分子相互作用,从而抑制肿瘤生长或促进肿瘤细胞发生凋亡。本文将从抗肿瘤多肽药物的来源、作用机制及发展现状进行概述。【关键词】多肽来源抗肿瘤作用机制 恶性肿瘤是一类严重威胁人类健康和生命的疾病,仅次于心血管疾病,每年死于癌症的患者约占总死亡人数的1/4,且中国占相当庞大的病例数。药物治疗是当今治疗肿瘤的主要手段之一,但目前的抗肿瘤药物不良反应较大。对此,寻找新型高效低毒的抗肿瘤药物一直是国内外医药研发的热点。随着免疫和分子生物学的发展,以及生物技术与多肽合成技术的成熟,人们发现多肽类药物不仅毒性低、活性高、易于吸收,还可以通过提高机体免疫功能抑制肿瘤的生长和转移,增强抗肿瘤作用,而且其广泛存在于动物、植物、微生物体内,因此,越来越多的多肽药物被开发并应用于临床。 抗肿瘤多肽的来源 天然来源的抗肿瘤活性肽 天然活性多肽是存在于动物、植物和微生物等生物体内的一类生物活性肽,可经过特殊提取分离工艺直接得到。近年来,对某些多肽经修饰加工后发现其具有显著的抗肿瘤作用,它们可针对肿瘤细胞发生、发展的不同环节,特异性杀伤、抑制肿瘤细胞,显示出极好的应用前景。 1.1微生物源抗肿瘤多肽 微生物源抗肿瘤多肽主要是指广泛存在于生物体内的一种小分子多肤,它们是非核糖体合成的抗菌肽,如多黏菌素(polymyxin)、杆菌肽(bacitracin)、短杆菌肽(gramicidin)等,主要是由细菌产生,并经结构修饰而获得,这类微生物产生的抗菌多肽的研究近年来取得了较大的进展。 细菌抗菌肽又称细菌素,是最常见的一类抗菌肽,革兰氏阳性菌和革兰氏阴性菌均可分泌。细菌中已发现杆菌肽、短杆菌肽S、多黏菌素E和乳链菌肽(Nisin) 4种类型抗菌肽,能特异性杀死竞争菌,而对宿主自身无害。例如[1],枯草芽孢杆菌可以产生多种抗微生物物质,如表面活性素(surfactin),该物质具有抗病毒、抗肿瘤、抗支原体、抗真菌活性和一定程度的抗细菌活性。除此之外,人们还发现某些抗菌肽对部分病毒、真菌和癌细胞等有杀灭作用,甚至能提高免疫力、加速伤口愈合。 1.2动物源抗肿瘤多肽 动物源多肽主要是指从哺乳动物、两栖动物、昆虫中分离提取出来的抗肿瘤多肽。如,有些哺乳动物来源的抗肿瘤多肽对淋巴瘤细胞有较强的抗肿瘤活性且免疫原性低;此外,还有Berge [2]等通过体内实验验证来源于牛科动物乳铁蛋白Lfcin B的9肽LTX-302 ( WKKWDipKKWK )的抗肿瘤效果,结果表明其对淋巴瘤细胞A20具有抗肿瘤活性,IC50为16 μmol·L ̄1 。 多数研究表明,从天蚕中分离出的天蚕素Cecropins具有较强的抗肿瘤活性。Cecropin A和Cecropin B对膀胱癌细胞有选择性细胞毒作用,以剂量依赖的方式抑制膀胱癌细胞增殖,对所有膀胱癌细胞系的IC50为73.29~220.05 μmol·L ̄1,它们的作用机制可能是破坏靶细胞膜导致不可逆的细胞溶解和细胞破坏[3]。 1.3植物源抗肿瘤多肽
抗肿瘤药物分类
抗肿瘤药物的分类和临床应用 抗肿瘤药物的分类和临床应用 1.根据药物的化学结构和来源分:烷化剂、抗代谢药物、抗肿瘤抗生素、抗肿瘤植物药、激素和杂类。 2.根据抗肿瘤作用的生化机制分:干扰核酸生物合成的药物、直接影响DNA结构与功能的药物、干扰转录过程和阻止RNA合成的药物、干扰蛋白质合成与功能的芗、影响激素平衡的药物和其他。 3.根据药物作用的周期或时相特异性分:细胞周期非特异性药物和细胞周期(时相)特异性药物。 恶性肿瘤是危害人类健康的最危险的疾病之一,肿瘤的治疗强调综合治疗的原则,化疗是其中的一个重要手段。近年来抗肿瘤药物的研究取得了飞速发展,出现了一些新型的抗肿瘤药物,作用于肿瘤发生和转移的不同环节和新靶点。按照抗肿瘤药物的传统分类和研究进展,将抗肿瘤药物分为细胞毒药物;影响激素平衡的药物;其他抗肿瘤药物,包括生物反应调节剂和新型分子靶向药物等;抗肿瘤辅助用药。 一、细胞毒药物 1.破坏DNA结构和功能的药物 氮芥烷化剂类的代表药物,高度活泼,在中性或弱碱条件下迅速与多种有机物质的亲核基团结合,作用强但缺乏选择性。进入血中后水解或与细胞的某些成分结合,在血中停留的时间只有几分钟,作用短暂而迅速。G1期及M期细胞对氮芥的作用最敏感,大剂量时对各周期的细胞和非增殖细胞均有杀伤作用。主要用于恶性淋巴瘤及癌性胸膜、心包及腹腔积液。目前已很少用于其他肿瘤。不良反应包括消化道反应、骨髓抑制脱发、注射于血管外可引起溃疡。 环磷酰胺周期非特异性药,作用机制与氮芥相同。在体外无活性,主要通过肝p450酶水解成醛磷酰胺再形成磷酰胺氮芥发挥作用。抗瘤谱广,对白血病和实体瘤都有效。环磷酰胺口服后易被吸收,约1小时后血浆浓度达最高峰,在体内t1/2 4—6小时,约50%由肾脏排出,对泌尿道有毒性。大部分不能透过血脑屏障。环磷酰胺临床广泛应用,对恶性淋巴瘤、白血病、多发性骨髓瘤均有效,
靶向抗肿瘤药物的研究进展
【药学动态】 靶向抗肿瘤药物的研究进展 近年来,随着肿瘤生物学及相关学科的飞速发展,人们逐渐认识到细胞癌变的本质是细胞信号转导通路的失调导致的细胞无限增生,随之而来的是抗肿瘤药物研发理念的重大转变。研发焦点正从传统细胞毒药物向针对肿瘤发生发展过程中众多环节的新药方向发展,这些靶点新药针对正常细胞和肿瘤细胞之间的差异, 可达到高选择性、低毒性的治疗效果,从而克服传统细胞毒药物的选择性差、毒副作用强、易产生耐药性等缺点,为此,肿瘤药物进入了一个崭新的研发阶段。 目前发现的药物靶点主要包括蛋白激酶、细胞周期和凋亡调节因子、法尼基转移酶(FTase)等,现就针对这些靶点的研发药物做一综述。 1、蛋白激酶 蛋白激酶是目前已知的最大的蛋白超家族。蛋白激酶的过度表达可诱发多种肿瘤。蛋白激酶主要包括丝氨酸/苏氨酸激酶和酪氨酸激酶,其中酪氨酸激酶主要与信号通路的转导有关,是细胞信号转导机制的中心。蛋白激酶由于突变或重排,可引起信号转导过程障碍或出现异常,导致细胞生长、分化、代谢和生物学行为异常,引发肿瘤。 研究表明,近80%的致癌基因都含有酪氨酸激酶编码。抑制酪氨酸激酶受体可以有效控制下游信号的磷酸化,从而抑制肿瘤细胞的生长。酪氨酸激酶受体分为表皮生长因子受体(EGFR)、血管内皮细胞生长因子受体(VEGFR)、血小板源生长因子受体(PDGFR)等,针对各种受体的酪氨酸激酶抑制剂目前已开发上市的主要为表皮生长因子受体酪氨酸激酶(EGFR-TK)抑制剂、血管内皮细胞生长因子受体酪氨酸激酶(VEGFR-TK)抑制剂和血小板源生长因子受体酪氨酸激酶(PDGFR-TK)抑制剂等。基于多靶点的酪氨酸激酶抑制剂目前已成为研究重点,具有广阔的发展前景,其中,包括舒尼替尼和索拉芬尼在内的几个上市新药均获得了良好的临床评价结果。 1.1EGFR-TK抑制剂 许多实质性肿瘤均高度表EGFR,EGFR-TK抑制剂是目前抗肿瘤药研发的热点之一。EGFR 家族成员包括EGFR、ErbB2、ErbB3、ErbB4等,其家族受体酪氨酸激酶以单体形式存在,在结构上由胞外区、跨膜区、胞内区3个部分组成,胞外区具有2个半胱氨酸丰富区,胞内区有典型的ATP结合位点和酪氨酸激酶区,其酪氨酸激酶活性在调节细胞增生及分化中起着至关重要的作用。目前已有多个EGFR-TK抑制剂上市,且有不少品种处于研发后期。 1.1.1代表品种 1.1.1.1吉非替尼(易瑞沙) 本品是一种选择性EGFR-TK抑制剂,由阿斯利康公司开发。2002年7月在日本首次上市,用于治疗非小细胞肺癌(NSCLC)。本品也是首个获准上市的EGFR-TK抑制剂,属于苯胺喹钠唑啉化合物(anilinoquinazoline),为小分子靶向抗肿瘤药物。本品最常见不良反应是痤疮样皮疹和腹泻,最严重不良反应是间质性肺病,发生率为3%-5%。目前,本品用于前列腺癌、食管癌、肝细胞癌(HCC)、胰腺癌、膀胱癌、肾细胞癌(RCC)、卵巢癌、头颈部癌、恶性黑色素瘤等多种治疗适应证处于Ⅱ期临床研究阶段。 1.1.1.2厄洛替尼(特罗凯) 本品由OSI制药公司开发,2004年11月在美国首次上市,用于治疗NSCLC。本品为口服小分子EGFR-TK抑制剂,是目前世界上惟一已明确能提高NSCLC患者生存期的靶向药物。
抗肿瘤药物的研究进展与临床应用复习进程
抗肿瘤药物的研究进展与临床应用
吉林大学远程教育 专科生毕业论文(设 计) 中文题目抗肿瘤药物的研究进展 学生姓名何建梅专业药学 层次年级 1003高起专学号 201105982102 指导教师宋冬梅职称医师 学习中心山西公路系统奥鹏学习中心成绩 2013 年 3 月 9 日
摘要: 本文综述和分析了抗肿瘤药物近年来的临床应用现状和研究新进展。包括新的细胞毒性抗肿瘤药物、络铂类化合物、激素类药以及针对关键靶点的新型抗肿瘤药 ,如肿瘤新生血管 (TA) 抑制剂、拓扑异构酶 I 抑制剂、微管蛋白活性抑制剂以及最具研究热点的基因疗法,大量的临床实验及临床应用结果显示,这一系列新型抗肿瘤药物的研制成功,为人类最终战胜肿瘤开辟了新的途径,标志着人类对肿瘤治疗的研究已进入了一个新的阶段。 关键词: 肿瘤抗肿瘤药物研究进展临床应用
目录: 一细胞毒性药物 (3) 1 . 1 烷化剂 (3) 1 . 2 抗代谢药 (3) 1 . 3 有丝分裂抑制剂 (3) 1 . 4 抗肿瘤抗生素 (4) 二络铂类化合 物 (4) 三激素 类 (4) 四拓扑异构酶I 抑制剂 (5) 五微管蛋白活性抑制剂 (5) 六肿瘤新生血管生成( TA) 抑制剂 (5) 七抗癌中草药 (6) 八基因疗法 (6) 九小结 (7) 八参考文献 (8) 九致谢 (9)
引言:肿瘤仍是当今世界直接危及人类生命的一种最常见、最严重的疾病。据世界卫生组织报告:全世界现有肿瘤患者约7600 万,每年新增700 万,因癌症死亡的达600 万,占总死亡人数的12 % ; 在我国,肿瘤在前十名主要疾病排名中列第二位,死亡率为8 . 58/ 10 万,占死亡总人数的21 . 58 % 。近几年来,肿瘤化疗取得了一定的进展,肿瘤患者的生存时间明显延长,尤其是在对白血病、恶性淋巴瘤方面。但仍没有取得令人满意的疗效,尤其是在致命性最强的实体瘤方面。20 世纪初以来,随着人们利用动物模型实验开展对包括生物化学、免疫学、治疗学等领域在内的学科研究,以及对肿瘤基因水平的认识和在生物学领域与技术方面的新进展,药学家和肿瘤学家越来越深刻地意识到: 必须从肿瘤发生发展的机制入手,才能提高疗效,取得突破性进展。现将抗肿瘤药物目前的研究进展与临床应用综述如下。 一细胞毒性药物 1 . 1 烷化剂 这类药有一个或多个活跃的烷化基,能与机体细胞的核酸结合而使癌细胞受到抑制破坏。临床目前常用的仍以传统的烷化剂为主, 如盐酸氮芥、苯丁酸氮芥、环磷酰胺、左旋苯丙氨酸氮芥、噻替哌等。我国自行研制的烷化剂有N -甲酰溶肉瘤素、甲氧芬芥、抗瘤新芥等。这些药物在临床上分别对睾丸精原细胞癌、卵巢无性细胞瘤、多发性骨瘤、乳腺癌、肺癌、恶性淋巴瘤、原发性肝细胞癌、鼻咽癌等有较好的疗效,有效率分别达到41 %、52 %、48 %等。但这些传统烷化剂的缺点是:对实体瘤的疗效差,不良反应严重且易产生耐药性。因此目前正在开发更好的同系物,如开发直接用于缺氧细胞的选择性细胞杀伤剂、可生物降解的亚硝脲氮芥聚合物制剂。用于脑癌手术后在肿瘤附近滞留并持续发挥疗效的药物, 如: adozelesin和carze2lesin等。
新型铂类抗肿瘤药物综述
新型铂类抗肿瘤药物发展概况 作者:韩学亮201100260102 摘要 奈达铂、奥沙利铂等新型铂类抗肿瘤药物在临床上广泛应用,其具有抗癌谱广、活性强、不良反应低、与顺铂无交叉耐药性等特点。此外,尚处于临床研究中的亲脂性铂配合物、多核铂配合物等新型铂类化合物,也显示出提高疗效、降低不良反应的优势。该文对铂类抗肿瘤药物的发展历程、作用机制和一些具体药物进行了综述。 关键字 铂类抗肿瘤药物、卡铂、顺铂、奥沙利铂、作用机制 引言 铂族金属包括铂、铑、铱、锇、钌6个元素,它们具有许多独特和卓越的理化性质,一直在高新技术方面发挥着重要的作用。铂配合物,在肿瘤的治疗方面以其显著的疗效,被广泛应用于临床,并成为许多肿瘤联合用药方案中的重要组成部分。 铂类药物的研究最早兴起于40年前,1967年美国密执安州立大学教授Roserlberg和Camp首次发现顺铂具有抗癌症活性。这一发现迅速引起了肿瘤界的广泛兴趣,之后铂类抗肿瘤药物的研究成为热点,随着一个个有历史意义的试验结果的公布,肿瘤化疗疗效有了大幅的飞跃。1995年WHO对上百种抗肿瘤药物进行排名,顺铂在疗效及市场等方面的综合评价位于第二位。有统计数据表明,我国所有的化疗方案中的有70%~80%以铂为主或有铂类药物参加配伍。同时,铂类金属药物也是当前抗肿瘤药物最为活跃的研究开发领域之一,新的铂
类抗肿瘤药奥沙利铂、乐铂等已相继推出。铂类药物的抗肿瘤作用机制也有了进一步了解。目前第三代铂类抗肿瘤药沙铂和4-NDDP等已进入临床试验[1]。 自20世纪60年代发现顺铂具有抗肿瘤活性以来,铂类金属抗肿瘤药物的应用和研究得到了迅速的发展。迄今为止,人们大约已合成了数千种铂类化合物,但作为抗肿瘤药物投入临床的仅30种左右,其中20 多种因抗肿瘤活性弱或毒性过强而被淘汰[2]。 1 铂类抗肿瘤药物发展历程 在过去的30余年里,人们对几千个新的铂类化合物进行了筛选,其中有几十个化合物进入了临床研究,目前已上市的铂类抗肿瘤药物有4个品种,其发展大致经历了3个阶段。 1.1 第1代铂类抗肿瘤药物 顺铂是顺二氯二氨合铂(Ⅱ)的简称,缩写为DDP或CDDP(Ⅱ)。1979年首次在美国上市,是第一个上市的铂类抗肿瘤药物,目前已被收录入中、美、英等国的药典。顺铂对睾丸癌和卵巢癌的疗效明显,也可以用来治疗膀胱、颈部、头部、食管的肿瘤以及小细胞肺癌,还可与博来霉素、阿霉素及5-氟尿嘧啶配伍进行联合用药。顺铂抗癌谱广、作用强、活性高,易与其他抗肿瘤药配伍,因其交叉耐药性少而有利于联合用药,但其严重的毒副反应(包括肾毒性、胃肠道毒性、耳毒性及神经毒性)及低溶解性、耐药性限制了临床的大剂量和长期使用。 1995年WHO对上百种治癌药物进行排名,顺铂的综合评价(疗效、市场等)名列前茅,列第2位。另据统计,在我国以顺铂为主或有顺铂参与配伍的化疗方案占所有化疗方案的70%~80%。顺铂仍是目前应用最广泛的药物之一,含铂类化疗方案是晚期非小细胞肺癌的首选方案,亦是小细胞肺癌的主要组方之一。顺铂是头颈癌单药有效率最高的药物之一;顺铂加五氟尿嘧啶(5-FU)是头颈癌化疗的标准方案之一,联合紫杉醇、吉西他滨亦是非常有前景的头颈癌化疗方案。顺铂及卡铂一直是治疗睾丸癌(尤其是非精原细胞性)、卵巢癌的主要治疗药物。顺铂与其他化疗药物联合是侵袭性膀胱癌、骨肉瘤、食管癌、胃癌等的标准化疗方案。 早期的顺铂合成是以K2PtCl4为原料与氨水反应得到,但因重现性差且含有大量的杂质被放弃。目前顺铂合成(收率为80%)以K2PtCl4为起始原料,通过下面三个步骤来实现: (1)加入KI ,转化成K2 PtI4,与氨水反应,制备出相应cis-[Pt(II)I2(NH3)2]中间体。(2)中间体与AgNO3 (或Ag2SO4/Ag2O)反应,过滤分离AgI得到cis-[Pt(NH3)2(H2O)2 ]2 +母液。(3)母液与KCl反应,制得顺铂[3]。
抗肿瘤药物的研究进展
中山大学研究生学刊(自然科学、医学版) 第29卷第4期 JOURNAL OF T HE GRADUATES VOL129№4 2008 S UN Y AT2SE N UN I V ERSI TY(NAT URAL SC I E NCES、M E D I C I N E) 2008 抗肿瘤药物的研究进展3 郑晓克 (中山大学中山医学院,广州510080) 摘 要:综述分析了抗肿瘤药物近年来的新进展,包括细胞毒性抗肿瘤药物、 以细胞信号传导分子为靶点的抗肿瘤药物、新生血管生成抑制剂、分化诱导剂、细胞周期依赖性蛋白激酶抑制剂等。 关键词:抗肿瘤药物 癌症是严重威胁人类生命的常见病和多发病,其死亡率仅次于心血管病而位居第 二。随着分子肿瘤学的发展,人们发现细胞周期失控是癌变的重要原因。细胞内促增殖系统成分的过度表达与抑增殖系统成分的缺失均可引起细胞增殖失控而导致癌变。随着生命科学研究的飞速进展,恶性肿瘤细胞内的信号转导、细胞周期的调控、细胞凋亡的诱导、血管生成以及细胞与胞外基质的相互作用等各种基本过程正在被逐步阐明。以一 ,发现选择性作用于特定靶点的高效、低毒、特异性强的新型抗癌药物已成为当今抗肿瘤药物研究开发的重要方向。目前抗肿瘤药物研发的焦点正在从传统细胞毒类药物转移到针对肿瘤细胞内信号转导通路的新型抗肿瘤药物。导致这一转变的本质根源在于:传统细胞毒类药物由于主要作用于DNA、RNA和微管蛋白等与细胞生死攸关的共有组分,致使其选择性低、毒性大。相反,多种信号转导通路的关键组分在正常细胞与肿瘤细胞及不同类型肿瘤细胞之间存在巨大差异,这一差异的存在及阐明使高选择性、高效、低毒的新型抗肿瘤药物的研发面临历史性的重大机遇。正是上述差异使肿瘤细胞区别于正常细胞,不同肿瘤相互区别。靶向这些组分的抗肿瘤药物不但可望降低毒性,而且可实现个体化治疗,使治疗效益最大化。 3收稿日期:2008-10-08 作者简介:郑晓克,女,1982年生,汉族,河南人,中山大学中山医学院2008级药理学博士研究生,主要研究方向为肿瘤细胞的细胞骨架研究,电子邮箱ki2 ki118576@s ohu1com。
抗肿瘤药物研究进展
抗肿瘤药物研究进展 作者单位:276000 山东医学高等专科学校 通讯作者:尹华伟 标签:抗肿瘤药物;综述 随着人类生活环境、生活水平和生活方式的变化以及医学的进步,疾病谱发生了显著的变化,一般性传染病逐渐被控制,而恶性肿瘤则成为日益常见且严重威胁人类生命和生活质量的主要疾病之一。目前在中国乃至全世界,癌症已成了导致人类死亡的第二大原因。 近几年来,肿瘤化疗取得了相当大的进步,肿瘤患者生存时间明显延长,特别是对白血病、恶性淋巴瘤的治疗有了明显的突破,但对危害人类生命健康最严重的、占恶性肿瘤90%以上的实体瘤的治疗未能达到一定的效果。药学家和肿瘤学家越来越深刻地意识到要提高肿瘤的治疗效果,必须从肿瘤发生发展的机制入手,这样才能取得突破性进展。随着对肿瘤特性和本质的研究,抗肿瘤药物正从传统的细胞毒药物向针对机制的多环节作用的新型抗肿瘤药物发展。目前抗肿瘤药物的发展已进入了一个新的时代,从天然植物药物的开发(如紫杉醇),已发展到基因治疗、免疫治疗以及新的靶点药物,如以肿瘤细胞膜为靶点和以肿瘤血管生成为靶点的多项研究[1]。因此,在肿瘤的综合治疗中,各种药物的治疗手段已日益受到重视。 近年来,分子肿瘤学和分子药理学的发展不断地阐明肿瘤的本质,而且大规模快速筛选、组合化学、基因工程等先进技术的发明和应用更是加速了抗肿瘤药物的研究与开发进程。目前国内外关注的抗肿瘤作用的新靶点和相应的新型抗肿瘤剂型或手段有多种,本文仅就其中部分热点简述如下。 1 新生血管生成抑制剂 新生血管生成抑制剂是当今新型抗肿瘤药物研究最活跃的领域之一。1971年,Folkman最早提出肿瘤生长是血管依赖性的,并指出控制肿瘤生长的新途径-抗血管生成(angiogenesis)。已有研究表明,几乎所有实体肿瘤的生长和转移均依赖于肿瘤的血管生成。原发肿瘤的生长和转移是以新生血管的不断生成为前提的,肿瘤不但通过血管从宿主获取营养和氧气,而且通过肿瘤血管不断地向新的组织和器官输送癌细胞。实体瘤的生长通常分为无血管期和血管期,肿瘤直径达到1~2 mm时,肿瘤分泌若干因子刺激血管形成,获得血供的肿瘤继续增大乃至转移[2]。 体内肿瘤血管的生长是涉及多种激素和酶的多步骤过程,可分为“血管前期”和“血管期”两个阶段,两阶段的转化称为血管生成开关(angiogenicswitch)[3]。血管前期是指在肿瘤发生早期,局部几乎无新生血管的阶段,此时肿瘤半径<2
前体药物的研究进展
前体药物的研究进展 【摘要】前体药物的出现为新药研发开辟了新的途径,前药能够优化药物传输,提高靶向作用,增强治疗效果,因而日益受到重视。本文综述了近年来前药在心血管系统药物、透皮药物、神经系统药物、抗感染药物、抗肿瘤药物的研发与临床应用中所取得的进展。 【关键词】前体药物;研究进展 前体药物是指有生物活性的药物分子原型与前体基团所形成的衍生物在体内代谢转变为原型活性药物,故又称为生物可逆性药物。前体药物这一术语最先是由Albert提出来的[1]。早在19世纪,前药就已被用于临床,当时出现的乌洛托品及阿司匹林分别是甲醛和水杨酸的前药,也是前药应用的开端。近年来,应用前药原理在克服原药的缺点、降低不良反应、提高药效方面取得了一定的成功。本文结合近年来有关前药研制的文献报道,对前药研究进展进行综述。 1 神经系统药物 1.1 老年性痴呆是一种渐进性神经退化性失调。迄今为止治疗老年性痴呆药物的研究和开发主要着眼于维持退化的胆碱能神经元的功能,在脑内产生药理作用,因此,有必要将药物设计制成脑靶向给药系统。他克林(Tacrine)是第一个用于治疗老年性痴呆的药物[2],是一种可逆性乙酰胆碱酯酶(AchE)抑制剂。主要在脑内抑制乙酰胆碱酯酶而起到增加乙酰胆碱的作用。临床试验证明该药对老年性痴呆有改善作用,但其生物利用度及治疗指数低,而且具有较大的肝脏毒性。为增加药物在脑内的浓度以增强疗效,同时减小原药的全身毒副作用,需增加原药的脂溶性。Nl羧酰5氟尿嘧啶前体药物,则大大增加了药物在脑内的浓度,减小原药的全身毒副作用,增加了原药的脂溶性。 1.2 吗啡类镇痛药和拮抗剂。3羟基吗啡喃的低生物利用度可通过颊部或舌下给药得到改善,如小鼠口服纳洛酮、纳屈酮的生物利用度不到1%,而颊部用药可达70%。但由于这些药味很苦,不受病人欢迎。最近,Hussain等[3]研究认为,这类药物的苦味是由于其结构中的苯酚环与苦味受体作用所致。若将其3酚羟基酯化,得到无苦味前药,颊部用药生物利用度由5%提高到35%~50%。吗啡类药物结构中6酮基经化学修饰形成肟、烃基肟、酰腙、缩氯基睬等前药可优化药物性能,如纳洛酮的苯甲酰腙,动物实验表明它对吗啡的拮抗作用强度提高5倍,有效时间长达16 h以上,口服生物利用度可大大提高[4]。 2 透皮用药 皮肤是一个高活性的代谢器官,其中所含丰富的酶类可代谢各种天然和合成的生物活性分子,作为一个药物转连通道已日益引起人们的重视。但目前使用的大多数药物,由于达不到所要求的全身活性而不适于皮肤局部给药。应用前药形式是利用皮肤代谢能力,提高药物转运性能的一个行之有效的方法。
单抗类抗肿瘤药物概述
单抗类抗肿瘤药物概述 单抗类抗肿瘤药物单抗类抗肿瘤药物作用机制为当机 体受抗原刺激时,抗原分子上的许多决定簇分别激活各个具有不同基因的B 淋巴细胞。 被激活的B 细胞分裂增殖形成效应B 细胞(浆细胞)和记忆B 细胞,大量的浆细胞克隆合成和分泌大量的抗体分子分布到血液、体液中。如果能选出一个制造一种专一抗体的浆细胞进行培养,就可得到由单细胞经分裂增殖而形成细胞群,即单克隆。 单克隆细胞将合成针对一种抗原决定簇的抗体,称为单克隆抗体。单克隆抗体以其高特异性、有效性和低毒性,可以准确地攻击靶分子, 且毒副作用较低,已成为一类重要的抗肿 瘤药物。单克隆抗体抗肿瘤机制包括:免疫介导的效应功能,包括抗体依赖性细胞介导的细胞毒性反应(ADCC)和补体依 赖性细胞毒性反应(CDC)。单抗与肿瘤细胞靶抗原特异性结合后,其Fc段可以与NK细胞、巨噬细胞和中性粒细胞等 效应免疫细胞表面的Fc受体(FcR)结合,激活细胞内信号,发挥效应功能。NK细胞通过释放细胞毒性颗粒(穿孔素和颗粒酶)导致靶细胞的凋亡;释放细胞因子和趋化因子抑制细胞增殖及血管生成。 巨噬细胞可以吞噬肿瘤细胞,有释放蛋白酶、活性氧和细胞
因子等加强ADCC作用。此外,一些偶联抗体通过连接细胞毒化合物或放射性物质来杀伤肿瘤细胞,如TDM1(trastuzumab emtansine)、Zevalin等。1997-2013年FDA 和CFDA批准的抗肿瘤单抗类药物列表如图15。图15:1997-2013年FDA和CFDA批准的抗肿瘤单抗类药物(点开大图观看更清晰?)截至目前,全球上市的单克隆抗体共51个,其中鼠源单克隆4个、嵌合抗体7个、人源化单克隆抗体23个、全人单克隆抗体17个。单抗药物中,抗肿瘤药物占了一半左右。截至目前,中国上市的抗肿瘤单抗类药物共有7个,其中进口4个,国产3个,国内自主研发的第一个单克隆抗体类抗肿瘤药物为百泰药业治疗鼻咽癌的药物尼妥珠单抗(泰欣生)2008年4月被正式批准联合放疗治疗EGFR表达阳性的Ⅲ/Ⅳ期鼻咽癌(比埃克替尼早了3年),这是全球第一个以EGFR为靶点的人源化单抗药物。2015年,中国国内单抗药物销售额约为72亿元人民币,其中肿瘤药占了80%,约为57亿元,同比约占全球抗药市场的1.13%。对比小分子靶向药物,2014年国内22重点城市样本医院靶向小分子抗肿瘤药物市场为13.21亿元,根据2015年样本医院全年靶向小分子药物购入金额为14.92亿元,占全球市场的1.34%。 从全球市场上看,2015年靶向抗肿瘤药物TOP10中有6个是单抗,前3名全是单抗,且销售额差距明显,前3名2015
抗肿瘤药物的研究进展及临床应用
华西药学杂志 W C J P S 2008,23(3):364~366 蒙、抗原疫苗等[8] 。中国在从事口服胰岛素方面的研究己有些成果。全球己核准临床使用的近一万多种药物中,生物大分子药物不到 120种。作者实验室提出的“ATTE MPTS ”生物大分子药物 传送系统己证实可以将溶血栓的t -P A 酶类药物的功能限制于治疗心血管疾病,但不产生因药物而引起内出血的不良反应[9,10]。 212 生物大分子药物高效化需克服的困难 生物大分子药物的使用及高效化面临着数项困难。对作用物的靶向选择性低,导致严重的附带性不良反应;多种生物大分子药物(特别是蛋白质存在强免疫原性)可引发宿主免疫系统的过敏反应;大多数蛋白质或基因药物易被体内酶类所降解,需要频繁给药;生物大分子药物的形态学复杂,具有多晶型、多构象和多尺度,且不同尺度的晶体准晶的不同型态结构对药物的治疗效果及传送系统的实施有着极重要的影响;生物大分子的结构多依靠次级键维系,稳定性低,且易形成超分子组装的聚合体,可增加净化、分离与复制的困难。因此,从事生物大分子药物高效化的研究,除了致力于传送系统的设计与建立外,还需考虑其在传送系统制备过程中维持药物最佳结晶形态、最高结构稳定性和活性,以及在组织和器官上的分配特性。 3 展望 中国在蛋白质药物、纳米载体药物传送系统、创新口服剂型及透皮释药、抗体研究、药物结晶学和形态学以及给药系统的药代和药动研究的技术平台等方面均具有深厚的基础。基于此,期盼国家能将发展前沿性、创新性和具有自主知识产权的生物大分子药物高效化的尖端技术及传送系统的基础研究列入国家在药物方面的重点研究与突破的领域之一,使国内外专家对生物大分子药物高效化研究方向达成 共识,成功地组织一跨学科、跨专业的综合梯队,促进中国药剂的创新能力,大幅提升中国在国际药物市场的竞争力。参考文献: [1] 李婧.浅谈研究开发医药制剂的重要性[J ].中国药事, 2000,14(5):302-303. [2] 徐铮奎.畅销世界的十大医药制剂及今后几年新药开发动向 [J ].中国制药信息,2003,19(12):33-34. [3] L anger R ,Lund D ,Leong K,et a l .Controlled release ofm acromol 2 ecules :B i o l ogi cal studies[J ].J Cont r ol R eleas,1985,2:331-341. [4] 杜光,刘东.单克隆抗体治疗肿瘤的研究概况[J ].中国药 师,2007,10(6):547-649. [5] YR Duan ,WS Liu,ZR Zhang,et a l .A st udy on PELGE nanop arti 2 cl es as con tr o lleddrug deli very s yste m s for intravenous [J ].Key EngM at er,2005,288,163-166. [6] Xun Sun,You -Rong Duan,Zhi -R ong Zhang,et a l .PE L GE nanoparticles as ne w Carriers for the delivery of plas mid DNA [J ].Che m Phar m B ull,2005,53(6):599-603. [7] Hai -Tao SH I ,Tao GONG,Zhi -Rong Zhang,et al .A ds orp ti on and des orp ti on of insulin on Po r ous Hydroxya p atite M i cros p heres [J ].J Cera m ic Soci J apan,2005,1321(9):579-583. [8] Yang VC ,Park YJ ,S ong H ,et al .App licati on of t he ATTEMPTS for del i very of macr omolecular drugs [J ].J Con tr o ll R el eas e, 2004,101:35-45. [9] Yang VC,Park YJ,Nai k S,et a l .ATTEMPTS :A hepari n /p r o t a 2 m ine -bas ed triggered release syste m for the delivery of enzyme drugs without ass ociat ed side effects [J ].Adv Drug Delivery Rev,2003,55:251-265. [10] Yang VC ,Park YJ .B i oconjugates f o r effective d rug target i ng[J ]. Adv D rug Delivery Revi ews,2003,55:169-170. 收稿日期:2007-10 作者简介刘娱,女,从事医院临床工作。 抗肿瘤药物的研究进展及临床应用 刘 娱 (凉山州第一人民医院肿瘤科,四川西昌615000) 提要:综述抗肿瘤药物的研究进展及其应用关键词:肿瘤;药物;应用中图分类号:R979.1 文献标识码:B 文章编号:1006-0103(2008)03-0364-03 60年来,新的抗肿瘤药物不断涌现,且疗效确切、不良反应少、价格适中。文献[1] 统计了国内五省市肿瘤专科医院的 抗肿瘤药物中,植物类药、免疫调节剂、抗代谢类药分别居第 一、二、三位。 抗肿瘤药物的研发与临床应用 全球有组织的抗肿瘤药物研发始于世纪5年代中 期。1955年,美国国立肿瘤研究所(NCL )成立了全国肿瘤化疗服务中心,负责协调全国抗肿瘤药的研究工作;随后欧共体联合组成了欧洲肿瘤治疗协作组织(E OR T C );日本的抗肿瘤药研发始于1973年;而中国抗肿瘤药的研究于1958年就已启动。氟尿嘧啶、环磷酰胺的研制是世纪5~6年代抗肿瘤药研制的第一个里程碑(表)。细胞毒性类、激素类 :120020001
抗肿瘤药物的研究进展
抗肿瘤药物的研究进展 根据世界卫生组织WHO统计,全世界有3/5的人死于癌症、糖尿病、心血管疾病、慢 性呼吸系统疾病这4大类疾病,而癌症则是最主要的死因之一。2021年全球死于癌症的患者达760万人,占全球死亡人数的13%,其中超过70%的癌症死亡案例发生在中低收入国家,预测至2030年,全球将有超过110万人死于癌症。 而我国卫生部第三次全国死因调查结果显示,癌症仅次于心脑血管疾病成为我国第二 大死亡原因,占死亡总数的22.32%,并成为我国城市的首位死因,占我国城市死亡人数的1/4。我国的癌症死亡率与美国、英国、法国接近,但高于亚洲国家如:日本、印度和泰 国等。从不同肿瘤死因来看,肺癌、结直肠癌、胰腺癌、乳腺癌死亡率城市明显高于农村;而肝癌、胃癌、食管癌、宫颈癌农村较高。 目前,药物治疗已成为当今临床治疗肿瘤的重要手段之一,受癌症发病率与死亡率居 高不下的影响,抗肿瘤药物的销售额也逐年上升。 近50年的抗肿瘤药物研究开发工作使肿瘤化疗取得相当的进步,特别是使血液系统 恶性肿瘤患者生存时间明显延长,但严重威胁人类生命健康的占恶性肿瘤90%以上的实体 瘤的治疗尚未达到满意的疗效,仍有半数癌症患者对治疗无反应或耐药而最终导致治疗失败。因此,发现并开发新型抗肿瘤药物仍然是药学家所必须面对的十分艰巨而长期的使命 与挑战。随着分子肿瘤学、分子药理学的飞速发展使肿瘤本质得以逐步阐明和揭示;大规 模快速筛选、组合化学、基因工程等先进技术的发明和应用加速了药物开发的进程;抗肿 瘤药物的研究与开发已进入一个崭新的时代。当今抗肿瘤药物的发展战略有以下特点: 以占恶性肿瘤90%以上的实体瘤为主攻对象; 从天然产物中寻找活性成分; 针对肿瘤 发生发展的机制寻找新的分子作用靶点酶、受体、基因; 大规模快速筛选; 新技术的导入 和应用:组合化学、结构生物学、计算机辅助设计、基因工程、DNA芯片、药物基因组学等。抗肿瘤药物正从传统的非选择性单一的细胞毒性药物向针对机制的多环节作用的新 型抗肿瘤药物发展。 经过多年的发展,抗肿瘤药物的研发取得了许多重要进展。然而,面对威胁人类生命 健康最严重的、占恶性肿瘤90%以上的实体瘤至今仍然缺乏高效、特异性强的药物,这一 方面反映了抗肿瘤药物研发的艰难,另一方面也意味着抗肿瘤药物的研发还需要新理念、 新技术、新方法的运用。 抗肿瘤药物的进展,迎合了抗肿瘤药物研发的要求,为个体化治疗奠定了基础,昭示 着抗肿瘤药物研发的新时代:分子靶向药物提高了部分化疗耐药肿瘤的疗效,在耐受性方 面亦有一定优势,与化疗、放疗的联合,以及靶向药物之间的联合,有望进一步提高疗效。这一研究理念已经渗入到全球的抗肿瘤药物开发的各个领域,为提供高选择性、高效、低 毒药物奠定了基础。同时,生物标志物的研究日益得到重视,既有助于抗肿瘤药物的治疗
近十抗肿瘤药物进展研究
近十抗肿瘤药物进展研究 Jenny was compiled in January 2021
近十年抗肿瘤药物进展研究 摘要:癌症是严重危及人类生命健康的疾病。为了攻克这一世界性难题,世界各国都投入了大量的人力物力去研究。希望能早日掌握这种疾病,并找到治愈的方法,为癌症患者带来生的希望。本文主要介绍了肿瘤的简介及治疗方法,主要通过旧药改良、药物联用技术、治疗手段技术三个方面阐述了近十年来抗肿瘤药物的发展。 关键词:抗肿瘤进展改良新药合成靶向治疗 一、肿瘤及抗肿瘤药物的概念 [1]肿瘤是指机体在各种致瘤因子作用下,局部组织细胞增生所形成的新生物,因为这种新生物多呈占位性块状突起,也称赘生物。抗肿瘤药物是指抗恶性肿瘤的药物。肿瘤是威胁人类生命安全的疾病,发病前期具有隐蔽性,不易被人发现。因此错过了最佳治疗时机。发展到晚期的肿瘤比较难控制其生长,还会有癌细胞转移的致命危险。要解决这一世界性难题,需要广大科研工作者的共同努力。找出能治愈肿瘤的方法,为世界的人民带来福音。 进十年来抗肿瘤药物有一定的发展,特别是在抗肿瘤药物改良以及靶向治疗方面取得比较大的进展。 二、肿瘤的治疗方法 肿瘤的治疗方法主要有三种:手术治疗、放射治疗、药物治疗。三种治疗手段各有各的特点,互相补充。化学药物治疗是利用化学药物杀死肿瘤细胞、抑制肿瘤细胞的生长繁殖和促进肿瘤细胞生长分化的一种治疗手段。抗肿瘤药的两大障碍选择性不强,毒性大和耐药性,因此用化疗的方法无法根治。靶向药物治疗的方法可以直接对病灶进行用药,有目标的进行用药治疗,提高抗肿瘤药物的效率。降低要药物对其他正常细胞的毒副作用。三、进展
前药策略在抗肿瘤药物中的研究
前药策略在抗肿瘤药物中的研究 周晨希 生物制药1301 U201310004 前体药物,也称前药,药物前体,前驱药物等,是指经过生物体内转化后才具有药理作用的化合物。前体药物本身没有活性或活性很低,在体内经酶或化学作用释放有活性的原药。前药策略一般用于延长药物作用时间、靶向给药,或通过改善药物的脂溶性或水溶性提高药物的吸收度。 多数抗肿瘤药物存在选择性差的缺点,用药时造成正常组织细胞的损伤。为防止对正常组织的毒性,所用剂量也受到限制。若将一个无活性的前药靶向定位到肿瘤组织后再释放原药发挥作用,可减少药物对正常组织的毒性并提高其对肿瘤组织的药物活性。 一、抗肿瘤前药的设计方法 恶性肿瘤细胞与正常细胞有有许多不同之处 主要区别为:肿瘤细胞对生长因子的需要量降低,某些肿瘤细胞能释放血管生成因子,促进血管向肿瘤生长;代谢旺盛,肿瘤组织的DNA和RNA聚合酶活性均高于正常组织,核酸分解过程明显降低,DNA和RNA含量明显升高;蛋白质的合成及分解代谢都增强,但合成代谢超过分解代谢,甚至可以夺取正常组织的蛋白质分解产物;线粒体功能障碍,即使在氧供应充足的情况下也主要以糖酵解形式获取能量,细胞内环境呈酸性。 设计药物正是利用恶性肿瘤细胞与正常细胞的不同之处区分正常细胞与肿瘤细胞,实现药物的靶向性。 在前药设计中,母药分子与载体基团之间化学键的性质是前药设计需考虑的基本问题。经典的有对含羧基、羟基、氨基药物进行结构修饰制成酯、羧酸酯、氨基酸酯、酰胺、磷酸酯等类型前药。也有偶氮型前药、曼尼希碱型前药。一氧化氮型前药及开环、闭环等新型结构前药。 二、抗肿瘤前药的研究进展 1.脂质体前药 脂质体是有磷脂双层构成的具有水相内核的脂质微囊。将脂质吸附在水溶液载体制成脂质体,遇水时脂质溶胀,载体溶解形成多层脂质体,更适合包封脂溶性药物。脂质体前药系统具有可在血液中保留更长时间、降低药物的毒性、增加药物在靶点的聚集并提高药物的疗效的优点。脂质体的包封率一般与药物脂溶性成正比,因此脂质前药在脂质体中的包封率较高。 例如对5-氟尿嘧啶核苷(5-FUR)结构进行修饰,使其由水溶性转变为脂溶性,可制成包封率高达97%的5-FUR前药脂质体,从而达到既能使其抗肿瘤活性得以发挥,又降低其毒性的作用。 2.酶激活式抗肿瘤前体药物 根据激活前体药物的工具,前药可分为靶向酶前药和生物膜载体前药两类。靶向酶前药和相应的靶向细胞组成酶激活式的前药系统,其中的酶包括肿瘤细胞自身表达的和人工外源引入的两类。已发现的活性酶有对前列腺肿瘤特异性和高表达的抗原(PSA)、基质金属蛋白酶(MMP)及成纤维细胞活性激活蛋白(FAPα)等。这些在肿瘤细胞表面特异性表达或由肿瘤细胞特异性分泌的小分子抗原物质的共同特点是同时具备肿瘤定位和蛋白水解的两种特性。通常将具有细胞毒性的母体药物与多肽缩合成该类抗原的水解底物。 例如抗体导向-酶前药设计中,以单克隆抗体(McAb)作为载体,分别与药物、放射性
