第二组阳离子分析

第三节第二组阳离子的分析
(重点)
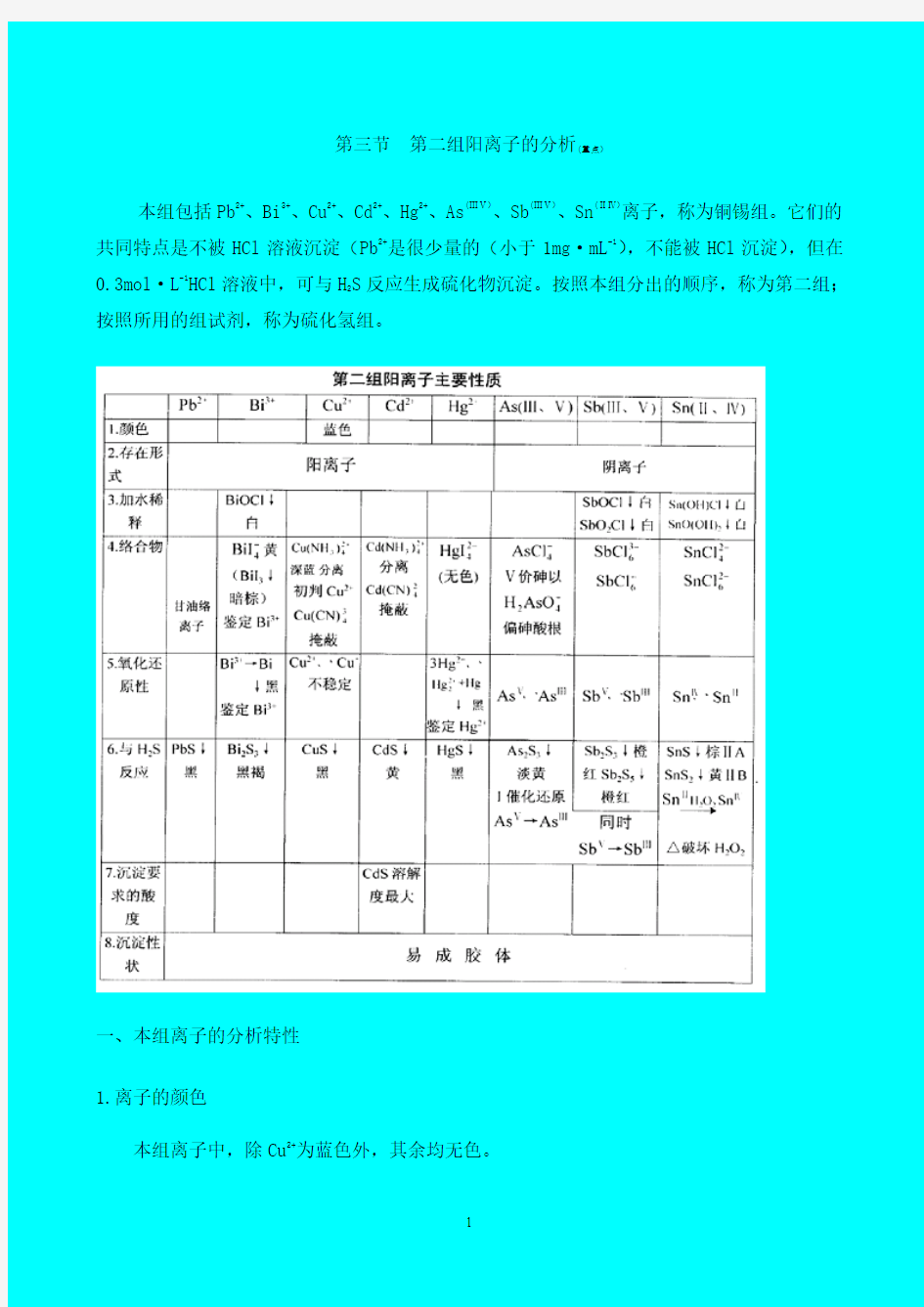
本组包括Pb2+、Bi3+、Cu2+、Cd2+、Hg2+、As(ⅢⅤ)、Sb(ⅢⅤ)、Sn(ⅡⅣ)离子,称为铜锡组。它们的共同特点是不被HCl溶液沉淀(Pb2+是很少量的(小于1mg·mL-1),不能被HCl沉淀),但在
S反应生成硫化物沉淀。按照本组分出的顺序,称为第二组;
0.3mol·L-1HCl溶液中,可与H
2
按照所用的组试剂,称为硫化氢组。
一、本组离子的分析特性
1.离子的颜色
本组离子中,除Cu2+为蓝色外,其余均无色。
2.离子的存在形式
铅、铋、铜、镉、汞具有显著的金属性质,在水溶液中主要以金属阳离子的形式存在;而砷、锑、锡三种元素则表现出不同程度的非金属性质,它们在溶液中的主要存在形式随酸碱环境而不同,主要以阴离子形式存在于溶液中。但由于存在下述平衡
AsO
33-+6H+=As3++3H
2
O
SbCl
6
3-= Sb3++ 6C1-
SnCl
4
2-=Sn2++4Cl-
溶液中也或多或少地存在着简单阳离子,并能生成相应的硫化物(如SnS
2、As
2
S
3
等),所
以这些元素还是作为阳离子来研究。
鉴定时并不严格区分它们的存在形式,只是泛指该元素,书写时只标出其氧化数,而不具体指明其存在形式。
3.加水稀释
Bi3+、Sb(ⅢⅤ)、Sn(ⅡⅣ)离子(见前表)
4.络合物
本组离子一般都能生成多种络合物。其中最常见的是氯络离子,因而大量Cl-存在时可影
响到各简单离子的浓度。另外,Cu2+、Cd2+等能生成氨或氰络离子:Cu(NH
3)
4
2+、Cd(NH
3
)
4
2+、
Cu(CN)
42+、Cd(CN)
4
2+,它们在Cu2+、Cd2+的分离和鉴定上有很多应用。Bi3+与I-生成黄色的BiI
4
-;
用于铋的鉴定。Cu2+、Pb2+和Bi3+能与甘油生成络离子;Hg2+与I-生成无色的HgI
4
2-,它与KOH
一起的溶液,可用于NH
4
+的鉴定,称为奈氏试剂。这些都具有一定的分析应用价值。
5.氧化还原性质
砷、锑、锡三元素的离子具有两种比较稳定的价态,它们在分析上都具有重要的意义。
例如,As(V)在冷而稀的HCl溶液中,与H
2S通过一系列的反应,最终得到的是As
2
S
3
↓,
但这个过程速率较慢,为了加速反应,先将As(V)还原为As(Ⅲ)。通常使用NH
4
I来还原。
另外,Sn(Ⅱ)还原性较强,很容易被氧化为Sn(Ⅳ)。而且SnS不溶于Na
2S,而SnS
2
能溶于Na
2
S,
这样在进一步分组时,把一种元素分在两个组中,将Sn(Ⅱ)归于ⅡA而Sn(Ⅳ)归于ⅡB组,
将使操作不便,故一般在进行沉淀之前加入H
2O
2
将Sn(Ⅱ)全部氧化成Sn(Ⅳ),并加热将剩余的H
2
O
2
除去。
锑的罗丹明B试法只对Sb(Ⅴ)有效,若溶液中的锑为三价则必须事先氧化。此外,将Bi3+还原为金属Bi是铋的重要鉴定反应之一。
6.与H
2
S的反应及本组硫化物性质
PbS Bi
2S
3
CuS CdS HgS As
2
S
3
Sb
2
S
3
SnS SnS
2
颜色黑黑褐黑黄黑黄桔红棕黄稀硝酸√√√√王水√√√√浓盐酸√√√√稀盐酸√
(△)
√
Na
2S HgS
2
2-AsS
3
3-SbS
3
3-SnS
3
2-
(NH
4)
2
S √√√
NaOH AsO
3
3-+
AsS
33-
√√
氨水√极微
溶
(NH
4)
2
CO
3
√沉淀的性状:易成胶体。
沉淀的溶解度:CdS最大。
二、组试剂与分离条件
本组与第三、四组离子分离的依据是其硫化物溶解度有显著的差异。事实上,除本组能
形成MS沉淀,第三组大多数离子也能沉淀为硫化物。如何使本组沉淀完全,又不使第三组离子混入?这就是要讨论的分离条件――组试剂的作用条件。
通过对溶解度进行比较可以得出,第二组中溶解度最大的硫化物沉淀是CdS(K
SP
=7.1×
10-28),第三组中溶解度最小的硫化物沉淀是ZnS(K
SP
=1.2×10-23),比第二组大了大约五个数量级,因此,按照沉淀规律,溶解度小的首先沉淀,溶解度大的不沉淀而留在溶液中,从而达到分离的目的。也就是说:当第二组中最难沉淀的CdS都沉淀完全时,第二组其它离子也就沉淀完全,第三组中最容易沉淀的ZnS没有开始沉淀,第三组其它离子也就没开始沉淀。
由此可见,分离第二组、第三组的关键是使CdS沉淀完全,ZnS不沉淀。从平衡关系来看,这点可通过调整酸度、控制S2-来实现。
为了将本组比较完全地同第三组分开,我们需要讨论以下几个问题。
(一)沉淀要求的酸度
1.适宜的酸度范围
要达到这个目的,根据溶度积关系:K
SP
=[M2+][S2-],在金属离子浓度一定的情况下,是否
发生沉淀反应,取决于溶液中[S2-],由于H
2
S是弱酸,[S2-]是随溶液酸度变化而变化,因此,可以通过调节酸度来控制溶液中S2-的浓度,从而达到分步沉淀的目的。
根据平衡:H
2S=H++HS2- K
1
=1.3×10-7
HS-=H++S2- K
2
=7.1×10-15
K 1K
2
=[H+]2[S2-]/[H
2
S]=9.2×10-22
室温下,饱和H
2S溶液中[H
2
S]≈0.1mol·L-1
所以,[H+]2[S2-]=9.2×10-23
[S2-]=9.2×10-23/[H+]2
结论:①稍改变H+,便可大幅度改变[S2-],如H+改变10倍,[S2-]将改变100倍。
②直接控制[S2-]难办到,但改变H+易办到。
③由[H+]2[S2-]=9.2×10-23和[M][S]=Ksp,可求出理论上的分离条件。
[H+]=
Ksp 10
9.2
[M]-23
?
?
关键1:使第二组的Cd2+沉淀完全,即要求[Cd2+]=10-5mol·L-1,溶液中应达到
[H+]= 2723
-5
10 810
9 10
--
??
?2.
=0.34mol/L
意味着只要酸度小于0.34mol·L-1,就能使第二组离子沉淀完全。若溶液的酸度过高,第二组中溶解度较大的CdS、SnS和PbS将沉淀不完全或者不沉淀而进入第三组中。
关键2:使第三组Zn2+不沉淀,第三组中最容易沉淀的是ZnS。在一般鉴定反应中,离子的浓度在0.1mol·L-1左右,所以设定[Zn2+]=0.1mol·L-1
[H+]= 2223
10 210
9
--
??
?2.
1.
=0.21mol/L
意味着只要酸度大于0.21mol·L-1,第三组离子就没有一个能沉淀。如果酸度太低
第三组溶解度最小的硫化物ZnS(K
SP
=1.2×10-23)则可能析出沉淀而进入第二组中。
结论:①综合起来考虑,理论上酸度应控制在0.21~0.34mol ·L -1。
事实上,沉淀本组硫化物的最适宜的酸度,是通过实验方法测得的,实验证明,分离第二组与第三组最适宜的酸度是0.3mol ·L -1HCl 。
②实验中必须认真查对酸度。
2.酸度对砷、锑和锡的硫化物的影响
酸度过低对形成砷、锑和锡的硫化物很不利。这是因为:
(1)它们只有在酸性环境中才能产生出生成硫化物所必需的简单阳离子。以砷为例: AsO 33-+6H +=As 3++3H 2O 锑盐和锡盐的情况与此类似。
(2)在中性或碱性溶液中,上述三种离子砷、锑和锡同S 2-生成硫代酸盐,而不是生成硫化物沉淀。
3.沉淀的后期处理
需要指出的是,在硫化物沉淀的过程中会不断有H +释放出来,例如 Cu 2++H 2S =CuS ↓+2H +
使得后期溶液的酸度有所增高。为了抵消这个变化,在通H 2S 的后期应将溶液适当地加以稀释,稀释的程度与沉淀量有关,一般稀释1倍即可。
(二) 五价砷的沉淀
在冷的稀HCl 溶液中,三价砷可以很快地同H 2S 生成As 2S 3沉淀, 2As 3++H 2S =As 2S 3↓
而五价砷却并不直接与H 2S 生成As 2S 5沉淀,而是通过下列三个步骤最后以As 2S 3的形式析出:
H 3AsO 4+H 2S =H 3AsO 3S+H 2O H 3AsO 3S =H 3AsO 3+S ↓ 2H 3AsO 3+3H 2S =As 2S 3+6H 2O
这个过程是很慢的。为了加速反应,可以把溶液加热或在溶液中加入I -,先使五价砷还原为三价砷:
AsO 43-+2I -+2H +=AsO 33-+I 2+H 2O
I-转变为I
2后,与H
2
S反应还可再生出来:
I
2+H
2
S=2I-+2H++S↓
可见,不需要加得太多。一般使用NH
4I,没有NH
4
I时也可以用碘酒来代替,后者可被H
2
S
还原为I-。
若改用TAA,就不必另NH
4
I,TAA可还原五价砷。
(三) 防止硫化物生成胶体(沉淀时的温度)
硫化物,特别是IIB组硫化物生成胶体的倾向较大,为了防止这一现象发生,第一,要保持溶液的适当酸度,以促进胶体的凝聚(这个目的在调节酸度时即已达到);第二,硫化物
沉淀要在热溶液中进行。其目的是促进胶体凝聚和加速五价砷的还原。但加热也会降低H
2
S 的溶解度从而使S2-浓度减小,不利于溶解度较大的PbS、CdS等沉淀生成,所以最后还要把
溶液冷却至室温,再通H
2
S。
(四) 二价锡的氧化
本组内部分离时,SnS不溶于Na
2S,SnⅡ属于IIA组;SnS
2
溶于Na
2
S,SnⅣ属于IIB组,同
一元素的不同价态分属两个组,组分析带来不便。为使SnⅡ全部转化SnⅣ,可在通人H
2
S之前
加H
2O
2
将SnⅡ氧化为SnⅣ然后将过剩的H
2
O
2
加热分解,以免以后与H
2
S发生作用。
综上所述,本组离子沉淀的详细步骤如下:
1.在酸性溶液中先加H
2
O
2
将SnⅡ→SnⅣ,然后,加热使过量H
2
O
2
分解;
2.用NH
3
·H
2
O(在系统分析中,由于分出第一组阳离子的氯化物沉淀后,溶液的酸性较
强,故需先用氨水中和,再用盐酸调至所需酸度)和HCl调节[H+]=0.3mol·L-1;
3.加入少许NH
4
I,还原AsⅤ、SbⅤ为AsⅢ、SbⅢ;
4.加热,通H
2
S,防止生成胶体;
5.冷却,将试液稀释一倍,然后通H
2
S至沉淀完全。 (使用硫代乙酰胺时,将试液稀释一倍后酸度应为0.2mol/L)。
(五) 硫代乙酰胺CH
3CSNH
2
由于H
2
S气体毒性较大,制备也不方便,故近年来已不再使用,而改用其替代品—硫代乙
酰胺CH
3CSNH
2
(通常简写为TAA)的水溶液代替H
2
S作沉淀剂。硫代乙酰胺在酸性溶液中水解产
生H
2
S。
硫代乙酰胺水溶液在常温下比较稳定,可长期存放,只有在加热时才能发生水解反应。 硫代乙酰胺水溶液在不同的介质中加热时发生不同的水解反应,可以分别代替H 2S 、(NH 4)2S 或Na 2S 。
在酸性溶液中水解产生H 2S ,可代替H 2S: CH 3CSNH 2+H ++2H 2O =CH 3COOH+NH 4++H 2S ↑
在氨性溶液中水解生成HS -,相当于(NH 4)2S 的作用:
-
+
++=-?+HS NH NH C CH NH CSNH CH 433232
NH 2
在碱性溶液中水解生成S 2-,可代替Na 2S 使用:
-
--+++?+2233233S O H NH COO CH OH CSNH CH
以硫代乙酰胺代替硫化氢作为组试剂具有以下特点:
(1)由于水解过程较慢,同时硫代乙酰胺的沉淀作用属于均相(匀)沉淀,故所得硫化物一般具有良好的晶形,易于分离和洗涤,共沉淀现象较少。
(2)硫代乙酰胺在90℃及酸性溶液中,可在沉淀时间内将As (V)还原为As (Ⅲ),此时Sb (Ⅴ)也同时被还原为Sb (Ⅲ),故不需另加NH 4I 。
(3)硫代乙酰胺在碱性溶液中加热时,除生成S 2-外,还生成一部分多硫化物。多硫化物具有氧化性,可将Sn (Ⅱ)氧化为Sn (Ⅳ)。因此,若以硫代乙酰胺代替Na 2S 作为ⅡA 组和ⅡB 组的分组试剂时,则事先可不加H 2O 2。
(4)由于在相同的条件下硫代乙酰胺所能提供的S 2-浓度较H 2S 提供的低,因此分离第二、三组阳离子时的适宜酸度为0.2mol ·L -1HCl 。但在此酸度下砷的沉淀反应不完全(AsO 33-+6H +=As 3++3H 2O 右向趋势很小),为了解决这一矛盾,可先将试液的酸度调至0.6mol ·L -1使砷完全沉淀,由于TAA 在酸性条件下水解时已消耗H +,使酸度降低,此时再将溶液稀释一倍,溶液的酸度正好在0.2mol ·L -1左右。
综上所述,以TAA 作为沉淀剂时,使本组离子沉淀的条件是:
先用氨水和盐酸调节试液的酸度为0.6mol ·L -1,(在系统分析中,由于分出第一组阳离子的氯化物沉淀后,溶液的酸性较强,故需先用氨水中和,再用盐酸调至所需酸度),加TAA 并在沸水浴上加热10min 。冷却后将试液稀释1倍,达到0.2mol ·L -1酸度,再加TAA 并加热10min ,直至本组离子沉淀完全。离心分离,沉淀经NH 4Cl 的稀溶液洗涤后作本组分析用;离心液在系统分析中留作第三、四组阳离子的定性分析。
[需要指出的是,定性分析中使用的试剂如(NH 4)2S 和氨水等都应是新配制的(不应在空气
中久置),否则因S 2-被氧化和氨水吸收了CO 2会导致某些离子(特别是第四组的阳离子)提前沉淀而“丢失”。]
第二组离子的沉淀中包括八种元素所形成的硫化物,种类比较多,在分析中相互间的干扰比较大,因此,为了定性分析的方便,还可以根据硫化物的酸碱性不同将它们进一步分成两个小组。
三、铜组与锡组的分离
本组包括由八种元素所形成的离子,为了定性分析的方便,还可以根据硫化物的酸碱性不同将它们分成两个小组。
铅、铋、铜、镉的硫化物属于碱性硫化物,它们不溶于NaOH 、Na 2S 和(NH 4)2S 等碱性试剂,这些离子属于铜组(ⅡA);砷、锑和锡(Ⅳ)的硫化物属于两性硫化物,而且其酸性更为明显,因而能溶于上述几种碱性试剂中,属于锡组(ⅡB)。汞的硫化物酸性较弱,只能溶解在含有高浓度S 2-的试剂Na 2S 中,本章采用Na 2S 溶液处理第二组阳离子硫化物的沉淀,因此HgS 亦属于ⅡB 组,也可用TAA (碱性溶液加热水解)或(NH 4)2S 来代替Na 2S 。用(NH 4)2S 处理时则属于IIA 组。
ⅡB 组硫化物与Na 2S 的溶解反应如下: Hg+S 2-=HgS 22-
-
-=+33
23223AsS S S As
Sb 2S 3+3S 2-=2SbS 33- SnS 2+S 2-=SnS 32-
离心分离,离心液留作锡组离子的分析鉴定,沉淀则用于铜组的分析。
使用Na 2S 的缺点是少量的Bi 2S 3和CuS 溶解,而汞的含量少时容易被IIA 组留住,溶解不完全。如改用(NH 4)2S ,则硫化锑和硫化锡溶解不完全,因而用得较少。(NH 4)2S x 优于(NH 4)2S ,但它的缺点是可使相当多的铜进入IIB 组,而锡量不大时,又容易把锡留在大量的硫化铜中。因此IIA 与IIB 的分离还缺乏一个理想的方案。
O H NO S Bi H NO S Bi O H NO S Pb H NO PbS 233322234232824233823+↑+↓+=+++↑+↓=++++-++-四、铜组的分析 1.铜组硫化物的溶解
在分出锡组后的沉淀中可能含有PbS 、Bi 2S 3、CuS 和CdS 。沉淀用含NH 4Cl 的蒸馏水洗涤干净后,加6mol ·L -1HNO 3并加热溶解:
+
CuS 与CdS 的溶解反应与PbS 的相似。 2.Cd 2+的分离和鉴定
在铜组离子的硝酸溶液中加入甘油(1:1)和过量的浓NaOH 溶液,这时,Pb 2+,Bi 3+,Cu 2+
与甘油生成甘油化合物留在溶液中,只有Cd 2+生成白色Cd(OH)2沉淀。离心分离,离心液留作铜、铅和铋的鉴定。Cd(OH)2沉淀经稀甘油-碱溶液洗涤后,溶于3mol ·L -1HCl 溶液中,用水稀释试液至酸度约为0.3mol ·L -1,通人H 2S 或加加TAA 并于沸水浴上加热,如有黄色沉淀(CdS)析出示有Cd 2+。
m=5μg, c=1:104
(100ppm)
值得注意的是,在Cd(OH)2沉淀中容易夹带有共沉淀的Bi(OH)3和Cu(OH)2因而溶解后通入H 2S 时所得沉淀不是纯黄色,甚至呈暗棕色。为此、可采取以下两项措施中的一项:
(1)防止上述现象发生的措施
将Cd(OH)2溶解后,重新加入沉淀剂(甘油—碱)使其重新沉出,然后再溶解,通H 2S ,进行鉴定。
(2)上述现象已经发生时的措施
将通H 2S 所得沉淀离心分离、洗净,加3mol/LHCl3滴、水6滴(相当于加1mol/LHCI ,降低酸度条件),加热,此时CdS 溶解,CuS 、Bi 2S 3不溶。离心沉降后,离心液以水稀释3倍(相当于酸度为0.3mol/L),通入H 2S ,Cd 2+存在时出现黄色CdS 沉淀。
3. 铜的鉴定(亚铁氰化钾法)
Cu 2+、Pb 2+、Bi 3+等能与甘油生成可溶性配位化合物。Cu 2+与甘油的反应的产物为甘油铜配位化合物,使溶液显蓝色。铅和铋的甘油化合物无色,其结构与甘油铜相似。取此溶液可分
别鉴定铜、铅、铋。
如溶液显蓝色,已证明有Cu 2+
存在。
如蓝色不明显或无色,则取少许溶液以HAc 酸化,加K 4[Fe(CN)6]鉴定,红棕色沉淀示有Cu 2+
2Cu 2++Fe(CN)62-=Cu 2Fe(CN)6↓
此沉淀不溶于稀酸,能溶于氨水生成深蓝色 [Cu(NH 3)4]2+ ,与强碱作用生成蓝色的Cu(OH)2
沉淀。
Fe 3+及大量Co 2+、Ni 2+对此鉴定反应有干扰。 m=3μg, c=1:1.7×104(61ppm)
4. 铅的鉴定(K 2CrO 4法)
取前面得到的甘油碱溶液,以6mol/LHAc 酸化,加K 2CrO 4溶液,黄色PbCrO 4沉淀,示有Pb 2+。如在第一组中已检出Pb 2+,则此处铅的鉴定可免。
m=12.5μg , c=1:4×103(250ppm)
5. 铋的鉴定(亚锡酸钠法)
取前述甘油碱溶液(保持原来的碱性)滴加在新配制的Na 2SnO 2溶液中、生成黑色的金属铋,示有Bi 3+:
2Bi 3++3SnO 22-+6OH -=2Bi ↓+2SnO 32-+3H 2O m=0.1μg, c=1:5×105(2ppm)
五、锡组的分析
主要是锡组沉淀,汞、砷与锑、锡分离及汞、砷分离。
1.锡组的沉淀
本组重新沉淀时,可选用HCl 、H 2SO 4或浓HAc ,
在用Na 2S 或碱性TAA 溶液溶出的ⅡB 组硫代酸盐溶液中,逐滴加入3mol ·L -1HCl 溶液(或浓HAc)至呈酸性,这时硫代酸盐被分解,析出相应的硫化物沉淀。
HgS 22-+2H +=HgS ↓+H 2S ↑ 2AsS 33-+6H +=As 2S 3↓+ 3H 2S ↑
3SbS 33-+6H +=Sb 2S 3↓+3H 2S ↑ SnS 32-+2H +
=SnS 2↓+ H 2S ↑
与此同时,通常还会析出一些硫黄。这是因为Na 2S 很容易部分地被空气氧化为多硫化物,当它遇到H +时:
Na 2S 2+2H +=2Na++ H 2S ↑+S ↓
析出的少量单质硫对锡组分析妨碍不大。
离心分离,锡组硫化物沉淀用NH 4Cl 稀溶液洗涤后留作以下分析用,一般情况下离心液可弃去。
2.汞、砷与锑、锡的分离
在上述硫化物沉淀上加8mol ·L -1HCl 溶液并加热,此时HgS 与A s2S 3不溶解,锑和锡的硫化物则因生成氯络离子而溶解。
3.砷与汞的分离和砷的鉴定
分出含有锑和锡的离心液后,在剩下的沉淀上加水数滴洗涤一次,然后加入过量的12%(NH 4)2CO 3,微热,此时HgS(及S)不溶,而A s2S 3溶解:
As 2S 3+3CO 32-=AsS 33-+AsO 33-+3CO 2
取一部分用(NH 4)2CO 3处理过的溶液,小心地加3mol/LHCl(防止大量气泡把溶液带出)至呈酸性,如有砷存在,生成黄色As 2S 3沉淀:
AsS 33-+AsO 33-+6H +=As 2S 3↓+3H 2O
现象不明显时,可用砷化氢法鉴定(P.37)
4. 汞的鉴定(SnCl 2-苯胺法)
经上述步骤分离后,如剩下黑色残渣,则初步说明有汞,但还需证实。将此残渣以王水(HNO 3:HCl=1:3)溶解:
3HgS+2NO 3-+12C1-+8H +=3HgC142- +3S ↓+2NO ↑+4H 2O 然后加热5-8分钟,破坏过量的王水,再以SnCl 2鉴定: SnCl 2+2C1-=SnCl 42-
2HgC142-+SnCl 42-=Hg 2C12↓+SnCl 62-+4C1- Hg 2C12+SnCl 42-=2Hg ↓+SnCl 62-
沉淀由白变灰黑,示有汞。如反应在滤纸上进行,则可得到黑色或棕色斑点。苯胺存在
时,反应的灵敏度增大。
亚汞盐和大量银盐干扰鉴定。
如果王水未除净,则SnCl
2
可被王水氧化,此处将不能得到明确结果。
m=1μg, c=1:5×104 (20ppm)
5. 锡的鉴定(氯化亚汞法)
取一部分分出汞、砷硫化物后的8mol/LHCl溶液,用无锈的铁丝(或铁、铝粉等)将Sn
Ⅳ
还原为Sn
Ⅱ
:
SnCl
62-+Fe=SnCl
4
2-+Fe2++2C1-
在所得溶液中加入HgCl
2
溶液,锡存在时可发生下列反应:
SnCl
42-+2HgCl
2
=Hg
2
Cl
2
↓+SnCl
6
2-
SnCl
42-+Hg
2
Cl
2
=2Hg ↓ +SnCl
6
2-
灰色的Hg
2Cl
2
+Hg或黑色的Hg沉淀,示有锡。
还原中应避免使用过多的粉状金属,它们过量存在时很容易进一步还原为Sn。遇到这种
情形,应加一些HCl使其溶解为Sn2+,然后加入HgCl
2,视Sn
Ⅱ
量小和大而得到白色、灰色或黑
色沉淀。
m=0.6μg, c=1:8×104(12ppm)
6. 锑的鉴定(金属锡还原法)
取一滴分出汞、砷后的8mol/LHCI溶液,放在一小块锡箔上,如生成黑色斑点,用水洗净,加l滴新配的NaBrO溶液。斑点不消失,示有锑。
2SbCl
63-+3Sn=2Sb↓+3SnCl
6
2-
当砷混入时,也能在锡箔上生成黑色斑点(As)。但洗净后加NaBrO则溶解。洗时要注意一定把HCl洗掉,否则在酸性条件下NaBrO也能使Sb的斑点消失。
m=20μg, c=1:2.5×103(400ppm)
示有锑
2017X射线衍射及物相分析实验报告写法
请将以下内容手写或打印在中原工学院实验报告纸上。 实验报告内容:文中红体字部分请删除后补上自己写的内容班级学号姓名 综合实验X射线衍射仪的使用及物相分析 实验时间,地点 一、实验目的 1.了解x射线衍射仪的构造及使用方法; 2.熟悉x射线衍射仪对样品制备的要求; 3.学会对x射线衍射仪的衍射结果进行简单物相分析。 二、实验原理 (X射线衍射及物相分析原理分别见《材料现代分析方法》第一、二、三、五章。)三、实验设备 Ultima IV型变温全自动组合粉末多晶X射线衍射仪。 (以下为参考内容) X衍射仪由X射线发生器、测角仪、记录仪等几部分组成。
图1 热电子密封式X射线管的示意图 图1是目前常用的热电子密封式X射线管的示意图。阴极由钨丝绕成螺线形,工作时通电至白热状态。由于阴阳极间有几十千伏的电压,故热电子以高速撞击阳极靶面。为防止灯丝氧化并保证电子流稳定,管内抽成1.33×10-9~1.33×10-11的高真空。为使电子束集中,在灯丝外设有聚焦罩。阳极靶由熔点高、导热性好的铜制成,靶面上被一层纯金属。常用的金属材料有Cr,Fe,Co,Ni,Cu,Mo,W等。当高速电子撞击阳极靶面时,便有部分动能转化为X射线,但其中约有99%将转变为热。为了保护阳极靶面,管子工作时需强制冷却。为了使用流水冷却和操作者的安全,应使X射线管的阳极接地,而阴极则由高压电缆加上负高压。x射线管有相当厚的金属管套,使X射线只能从窗口射出。窗口由吸收系数较低的Be片制成。结构分析用X射线管通常有四个对称的窗口,靶面上被电子袭击的范围称为焦点,它是发射X射线的源泉。用螺线形灯丝时,焦点的形状为长方形(面积常为1mm×10mm),此称为实际焦点。窗口位置的设计,使得射出的X射线与靶面成60角(图2),从长方形的短边上的窗口所看到的焦点为1mm2正方形,称点焦点,在长边方向看则得到线焦点。一般的照相多采用点焦点,而线焦点则多用在衍射仪上。 图2 在与靶面成60角的方向上接收X射线束的示意图 自动化衍射仪采用微计算机进行程序的自动控制。图3为日本生产的Ultima IV型变温全自动组合粉末多晶X射线衍射仪工作原理方框图。入射X射线经狭缝照射到多晶试样上,衍射线的单色化可借助于滤波片或单色器。衍射线被探测器所接收,电脉冲经放大后进人脉冲高度分析器。信号脉冲可送至计数率仪,并在记录仪上画出衍射图。脉冲亦可送至计数器(以往称为定标器),经徽处理机进行寻峰、计算峰积分强度或宽度、扣除背底等处理,并在屏幕上显示或通过打印机将所需的图形或数据输出。控制衍射仪的专用微机可通过带编码器的步进电机控制试样(θ)及探测器(2θ)进行连续扫描、阶梯扫描,连动或分别动作等等。目前,衍射仪都配备计算机数据处理系统,使衍射仪的功能进一步扩展,自动化水平更加提高。衍射仪目前已具有采集衍射资料,处理图形数据,查找管理文件以及自动进行物相定性分析等功能。 物相定性分析是X射线衍射分析中最常用的一项测试,衍射仪可自动完成这一过程。首先,仪器按所给定的条件进行衍射数据自动采集,接着进行寻峰处理并自动启动程序。
第一组阳离子分析
第三章阳离子分析 教学要求:1、常见阳离子有哪些?分析特性如何? 2、了解两酸两碱系统分析方案 3、掌握硫化氢系统分析方案(第一组是基础,第二组是重点) 第一节常见阳离子的分组 在湿法分析中,直接检出的是溶液中的离子。常见阳离子有23种元素、25种离子。它2+、Pb2+、Pb2+、Bi3+、Cu2+、Cd2+、Hg2+、As(Ⅲ、Ⅴ)、Sb(Ⅲ、Ⅴ)、Sn(Ⅱ、Ⅳ)、们是:Ag+、Hg 2 Al3+、Cr3+、Fe3+、Fe2+、Mn2+、Zn2+、Co2+、Ni2+、Ba2+、Sr2+、Ca2+、Mg2+、K+、Na+、和NH4+。 分组是按一定的顺序加入若干种试剂,将离子一组组沉淀出来。用于将各组离子分离开的试剂被称为组试剂。 (组试剂的条件与作用) 这些阳离子的盐酸盐、硫酸盐、硫酸盐、硫化物、氢氧化物的溶解性是不同;硫化物的酸碱性也不相同;氢氧化物两性也不相同;与氨的络合性也不相同;部分离子氧化性也不相同。这些相似与不同,为常见阳离子的分组和分离提供了基础。 对这些离子的分组,目前比较常见的有两种方案。 一、两酸两碱系统分组方案 分别利用盐酸、硫酸、氨水和氢氧化钠(故称为两酸两碱)为组试剂,将前述常见阳离子分为五组,如表所示。 表两酸两碱系统分组方案
4 条件不好掌握,易受污染等缺点。
二、硫化氢系统分组方案 硫化氢系统分组方案所依据的主要事实,就是各离子硫化物溶解度有明显的不同,以及根据离子的其它性质,将常见阳离子分成五组,现简化为四组(将钙、钠组合并)。 表2-1 简化的硫化氢系统分组方案 硫化氢系统的好处是分组均匀,合理。该方案从提出到现在已有二百多年的历史,经过不 断的改进,目前已成为最完善、应用最为广泛的一种分析方案,是阳离子定性分析中的首选方案,也是我们今后要学习的内容。但该方案也存在控制麻烦,毒性较大的缺点 。 Sr 2+ 碳酸盐不溶于水 碳酸盐溶于水 IV 组 碳酸铵组 V 组 钠组 NH 3+NH 4Cl (NH 4)2CO 3 组
第二组阳离子分析
第三节第二组阳离子的分析 (重点) 本组包括Pb2+、Bi3+、Cu2+、Cd2+、Hg2+、As(ⅢⅤ)、Sb(ⅢⅤ)、Sn(ⅡⅣ)离子,称为铜锡组。它们的共同特点是不被HCl溶液沉淀(Pb2+是很少量的(小于1mg·mL-1),不能被HCl沉淀),但在 S反应生成硫化物沉淀。按照本组分出的顺序,称为第二组; 0.3mol·L-1HCl溶液中,可与H 2 按照所用的组试剂,称为硫化氢组。 一、本组离子的分析特性 1.离子的颜色 本组离子中,除Cu2+为蓝色外,其余均无色。
2.离子的存在形式 铅、铋、铜、镉、汞具有显著的金属性质,在水溶液中主要以金属阳离子的形式存在;而砷、锑、锡三种元素则表现出不同程度的非金属性质,它们在溶液中的主要存在形式随酸碱环境而不同,主要以阴离子形式存在于溶液中。但由于存在下述平衡 AsO 33-+6H+=As3++3H 2 O SbCl 6 3-= Sb3++ 6C1- SnCl 4 2-=Sn2++4Cl- 溶液中也或多或少地存在着简单阳离子,并能生成相应的硫化物(如SnS 2、As 2 S 3 等),所 以这些元素还是作为阳离子来研究。 鉴定时并不严格区分它们的存在形式,只是泛指该元素,书写时只标出其氧化数,而不具体指明其存在形式。 3.加水稀释 Bi3+、Sb(ⅢⅤ)、Sn(ⅡⅣ)离子(见前表) 4.络合物 本组离子一般都能生成多种络合物。其中最常见的是氯络离子,因而大量Cl-存在时可影 响到各简单离子的浓度。另外,Cu2+、Cd2+等能生成氨或氰络离子:Cu(NH 3) 4 2+、Cd(NH 3 ) 4 2+、 Cu(CN) 42+、Cd(CN) 4 2+,它们在Cu2+、Cd2+的分离和鉴定上有很多应用。Bi3+与I-生成黄色的BiI 4 -; 用于铋的鉴定。Cu2+、Pb2+和Bi3+能与甘油生成络离子;Hg2+与I-生成无色的HgI 4 2-,它与KOH 一起的溶液,可用于NH 4 +的鉴定,称为奈氏试剂。这些都具有一定的分析应用价值。 5.氧化还原性质 砷、锑、锡三元素的离子具有两种比较稳定的价态,它们在分析上都具有重要的意义。 例如,As(V)在冷而稀的HCl溶液中,与H 2S通过一系列的反应,最终得到的是As 2 S 3 ↓, 但这个过程速率较慢,为了加速反应,先将As(V)还原为As(Ⅲ)。通常使用NH 4 I来还原。 另外,Sn(Ⅱ)还原性较强,很容易被氧化为Sn(Ⅳ)。而且SnS不溶于Na 2S,而SnS 2 能溶于Na 2 S, 这样在进一步分组时,把一种元素分在两个组中,将Sn(Ⅱ)归于ⅡA而Sn(Ⅳ)归于ⅡB组, 将使操作不便,故一般在进行沉淀之前加入H 2O 2 将Sn(Ⅱ)全部氧化成Sn(Ⅳ),并加热将剩余的H 2 O 2 除去。
XRD物相分析实验报告范本(完整版)
报告编号:YT-FS-1775-17 XRD物相分析实验报告范 本(完整版) After Completing The T ask According To The Original Plan, A Report Will Be Formed T o Reflect The Basic Situation Encountered, Reveal The Existing Problems And Put Forward Future Ideas. 互惠互利共同繁荣 Mutual Benefit And Common Prosperity
XRD物相分析实验报告范本(完整版) 备注:该报告书文本主要按照原定计划完成任务后形成报告,并反映遇到的基本情况、实际取得的成功和过程中取得的经验教训、揭露存在的问题以及提出今后设想。文档可根据实际情况进行修改和使用。 一、实验目的 1.掌握X 射线衍射仪的使用及进行定性相分析 的基本原理。 2.学会用PDF软件索引对多相物质进行相分析的 方法和步骤。 二、实验原理 布拉格方程:2dsinn X 射线衍射仪是按着晶体对X 射线衍射的几何 原理设计制造的衍射实验仪器。在测试过程,由X 射 线管发射出来的 X 射线照射到试样上产生衍射效应, 满足布拉格方程的2dsinn,和不消光条件的衍射光用 辐射探测器,经测量电路放大处理后,在显示或记录 装置上给出精确的衍射峰位置、强度和线形等衍射信
息,这些衍射信息可作为各种应用问题的原始数据。X 射线衍射仪的基本组成包括;X 射线发生器、衍射测角仪、辐射探测器、测量电路和控制操作、运行软件的电子计算机系统。在衍射测量时,试样绕测角仪中心轴转动,不断地改变入射线与试样表面的夹角,射测量时,试样绕测角仪中心轴转动,不断地改变入射线与试样表面的夹角,与此同时计数器沿测角仪圆运动,接收各衍射角所对应的衍射强度。任何一种结晶物质都具有特定的晶体结构。在一定波长的X 射线照射下,每种晶体物质都产生自己特有的衍射花样。每一种物质与它的衍射花样都是一一对应的,不可能有两种物质给出完全相同的衍射花样。如果试样中存在两种以上不同结构的物质时,每种物质所特有的衍射花样不变,多相试样的 衍射花样只是由它所含各物质的衍射花样机械叠加而成。在进行相分析时,只要和标准的PDF衍射图谱比较就可以确定所检测试样里面的所存在的相。 三、实验仪器,试样
阳离子的分离与鉴定
阳离子的分离与鉴定 一. 实验目的 1. 掌握用两酸三碱系统分析法对常见阳离子进行分组分离的原理和方法。 2. 掌握分离、鉴定的基本操作与实验技能。 二. 实验原理 阳离子的种类较多,常见的有二十多种,个别检出时,容易发生相互干扰,所以一般阳离子分析都是利用阳离子某些共同特性,先分成几组,然后再根据阳离子的个别特性加以检出。凡能使一组阳离子在适当的反应条件下生成沉淀而与其它组阳离子分离的试剂称为组试剂,利用不同的组试剂把阳离子逐组分离再进行检出的方法叫做阳离子的系统分析。在阳离子系统分离中利用不同的组试剂,有很多不同的分组方案。如硫化氢分组法,两酸、两碱系统分组法。下面介绍一种以氢氧化物酸碱性与形成配合物性质不同为基础,以HCl、H2SO4、NH3 H2O、NaOH、(NH4)2S为组试剂的两酸三碱分组方法。本方法将常见的二十多种阳离子分为六组。 第一组:盐酸组Ag+,Hg22+,Pb2+ 第二组:硫酸组Ba2+,Ca2+,Pb2+ 第三组:氨合物组Cu2+,Cd2+,Zn2+,Co2+,Ni2+ 第四组:易溶组Na+,NH4+,Mg2+,K+ 第五组:两性组Al3+,Cr3+,Sb III、V,Sn II、IV 第六组:氢氧化物组Fe2+,Fe3+, Bi3+,Mn2+,Hg2+ 用系统分析法分析阳离子时,要按照一定的顺序加入组试剂,将离子一组一组沉淀下来,具体分离方法如下表。 表阳离子分组步骤 试液(用个别检出法鉴定NH4+、Fe2+、Fe3+) ( Hg ) (两性组) (氢氧化物组) (第三组硫化物) (第四组易溶组)AlO2?、Cr O42?Fe(OH)3、 K+、Na+、Mg2+、NH4+SbO43?、SnO32?MnO(OH)2、 NaBiO3、HgNH2Cl
XRD物相分析实验报告
XRD物相分析 一、实验目的 1.掌握X 射线衍射仪的使用及进行定性相分析的基本原理。 2.学会用PDF软件索引对多相物质进行相分析的方法和步骤。 二、实验原理 布拉格方程:2dsinθ=nλ X 射线衍射仪是按着晶体对 X 射线衍射的几何原理设计制造的衍射实验仪器。在测试过程,由X 射线管发射出来的 X 射线照射到试样上产生衍射效应,满足布拉格方程的2dsinθ=nλ,和不消光条件的衍射光用辐射探测器,经测量电路放大处理后,在显示或记录装置上给出精确的衍射峰位置、强度和线形等衍射信息,这些衍射信息可作为各种应用问题的原始数据。X 射线衍射仪的基本组成包括;X 射线发生器、衍射测角仪、辐射探测器、测量电路和控制操作、运行软件的电子计算机系统。在衍射测量时,试样绕测角仪中心轴转动,不断地改变入射线与试样表面的夹角θ,射测量时,试样绕测角仪中心轴转动,不断地改变入射线与试样表面的夹角θ,与此同时计数器沿测角仪圆运动,接收各衍射角2θ所对应的衍射强度。任何一种结晶物质都具有特定的晶体结构。 在一定波长的X 射线照射下,每种晶体物质都产生自己特有的衍射花样。每一种物质与它的衍射花样都是一一对应的,不可能有两种物质给出完全相同的衍射花样。如果试样中存在两种以上不同结构的物质时,每种物质所特有的衍射花样不变,多相试样的
衍射花样只是由它所含各物质的衍射花样机械叠加而成。在进行相分析时,只要和标准的PDF衍射图谱比较就可以确定所检测试样里面的所存在的相。 三、实验仪器,试样 XRD仪器为:Philip X’Pert diffractometer with Cu-Ka radiation source (λ=1.54056?) at 40Kv。 实验试样:Ti98Co2基的合金 四、实验条件 2θ=20-80o step size:0.05o/S 五、实验步骤 1.开总电源 2.开电脑,开循环水 3.安装试样,设置参数,并运行Xray衍射仪。 4.Xray衍射在电脑上生成数据,保存数据。 5.利用orgin软件生成Xray衍射图谱。并依次找出峰值的2θ,并 与PDF中的标准图谱相比较,比对三强线的2θ,确定试样中存在的相。 六、实验结果及分析 含Ti98Co2基试样在2θ=20-80o,step size:0.05o/S实验条件下的Xray衍射图的标定如下图:
第二组阳离子分析
第三节第二组阳离子得分析 (重点) 本组包括Pb2+、Bi3+、Cu2+、Cd2+、Hg2+、As(ⅢⅤ)、Sb(ⅢⅤ)、Sn(ⅡⅣ)离子,称为铜锡组。它们得共同特点就是不被HCl溶液沉淀(Pb2+就是很少量得(小于1mg·mL-1),不能被HCl沉淀),但在0、 S反应生成硫化物沉淀。按照本组分出得顺序,称为第二组;按照3mol·L-1HCl溶液中,可与H 2 所用得组试剂,称为硫化氢组。 一、本组离子得分析特性 1、离子得颜色 本组离子中,除Cu2+为蓝色外,其余均无色。
2、离子得存在形式 铅、铋、铜、镉、汞具有显著得金属性质,在水溶液中主要以金属阳离子得形式存在;而砷、锑、锡三种元素则表现出不同程度得非金属性质,它们在溶液中得主要存在形式随酸碱环境而不同,主要以阴离子形式存在于溶液中。但由于存在下述平衡 AsO 33-+6H+=As3++3H 2 O SbCl 6 3-= Sb3++ 6C1- SnCl 4 2-=Sn2++4Cl- 溶液中也或多或少地存在着简单阳离子,并能生成相应得硫化物(如SnS 2、As 2 S 3 等),所以 这些元素还就是作为阳离子来研究。 鉴定时并不严格区分它们得存在形式,只就是泛指该元素,书写时只标出其氧化数,而不具体指明其存在形式。 3、加水稀释 Bi3+、Sb(ⅢⅤ)、Sn(ⅡⅣ)离子(见前表) 4、络合物 本组离子一般都能生成多种络合物。其中最常见得就是氯络离子,因而大量Cl-存在时可 影响到各简单离子得浓度。另外,Cu2+、Cd2+等能生成氨或氰络离子:Cu(NH 3) 4 2+、Cd(NH 3 ) 4 2+、 Cu(CN) 42+、Cd(CN) 4 2+,它们在Cu2+、Cd2+得分离与鉴定上有很多应用。Bi3+与I-生成黄色得BiI 4 -; 用于铋得鉴定。Cu2+、Pb2+与Bi3+能与甘油生成络离子;Hg2+与I-生成无色得HgI 4 2-,它与KOH一 起得溶液,可用于NH 4 +得鉴定,称为奈氏试剂。这些都具有一定得分析应用价值。 5、氧化还原性质 砷、锑、锡三元素得离子具有两种比较稳定得价态,它们在分析上都具有重要得意义。 例如,As(V)在冷而稀得HCl溶液中,与H 2S通过一系列得反应,最终得到得就是As 2 S 3 ↓,但 这个过程速率较慢,为了加速反应,先将As(V)还原为As(Ⅲ)。通常使用NH 4 I来还原。 另外,Sn(Ⅱ)还原性较强,很容易被氧化为Sn(Ⅳ)。而且SnS不溶于Na 2S,而SnS 2 能溶于Na 2 S, 这样在进一步分组时,把一种元素分在两个组中,将Sn(Ⅱ)归于ⅡA而Sn(Ⅳ)归于ⅡB组,将使 操作不便,故一般在进行沉淀之前加入H 2O 2 将Sn(Ⅱ)全部氧化成Sn(Ⅳ),并加热将剩余得H 2 O 2 除去。 锑得罗丹明B试法只对Sb(Ⅴ)有效,若溶液中得锑为三价则必须事先氧化。此外,将Bi3+还
常微分方程的求解与定性分析实验报告
常微分方程的求解与定 性分析实验报告 Company Document number:WTUT-WT88Y-W8BBGB-BWYTT-19998
常微分方程的求解与定性分析实验报告 一、实验综述 1、实验目的及要求 ●归纳和学习求解常微分方程(组)的基本原理和方法; ●掌握解析、数值解法,并学会用图形观察解的形态和进行解的定性分析; ●熟悉MATLAB软件关于微分方程求解的各种命令; ●通过范例学习建立微分方程方面的数学模型以及求解全过程; ●通过该实验的学习,使学生掌握微分方程(组)求解方法(解析法、欧拉法、 梯度法、改进欧拉法等),对常微分方程的数值解法有一个初步了解,同时学会使用MATLAB软件求解微分方程的基本命令,学会建立微分方程方面的数学模型。这对于学生深入理解微分、积分的数学概念,掌握数学的分析思维方法,熟悉处理大量的工程计算问题的方法是十分必要的。 2、实验仪器、设备或软件 电脑、 二、实验过程(实验步骤、记录、数据、分析) 实验内容: 根据实验内容和步骤,完成以下实验,要求写出实验报告(实验目的→问题→数学模型→算法与编程→计算结果→分析、检验和结论) 1.求微分方程的解析解,并画出它们的图形。 y '= y + 2 x, y (0) = 1, 0< x <1; m=dsolve('Dy=y+2*x','y(0)=1','x') ezplot(m,[0 1]) m = 3*exp(x) - 2*x – 2
1.求微分方程?? ???====-+]100[0)0(;0)0(01.03t u u u u u 的数值解,要求编写求解程序。 function dy=vdp1000(t,y) dy=zeros(2,1); dy(1)=y(2); dy(2)=-y(1)+*y(1)^3; [T,Y]=ode15s('vdp1000',[0 10],[0 0]); plot(T,Y(:,1),'-') 3.Rossler 微分方程组: 当固定参数b =2,c =4时,试讨论随参数a 由小到大变化(如 a ∈(0,)而方程解的变化情况,并且画出空间曲线图形,观察空间曲线是否形成混沌状 function r=rossler(t,x) global a; global b; global c; r=[-x(2)-x(3);x(1)+a*x(2);b+x(3)*(x(1)-c)]; global a; global b; global c; b=2; c=4; t0=[0,200]; for a=0:: [t,x]=ode45('rossler',t0,[0,0,0]); subplot(1,2,1); plot(t,x(:,1),'r',t,x(:,2),'g',t,x(:,3),'b'); title('x(红色),y(绿色),z(蓝色)随t 的变化情况');xlabel('t'); subplot(1,2,2); plot3(x(:,1),x(:,2),x(:,3)) title('相图');xlabel('x');ylabel('y');zlabel('z'); pause end 结果显示: a=0: a=: a=: a=: a=:
常微分方程的求解与定性分析实验报告
常微分方程的求解与定性分析实验报告 一、实验综述 1、实验目的及要求 ●归纳和学习求解常微分方程(组)的基本原理和方法; ●掌握解析、数值解法,并学会用图形观察解的形态和进行解的定性分析; ●熟悉MATLAB软件关于微分方程求解的各种命令; ●通过范例学习建立微分方程方面的数学模型以及求解全过程; ●通过该实验的学习,使学生掌握微分方程(组)求解方法(解析法、欧拉法、 梯度法、改进欧拉法等),对常微分方程的数值解法有一个初步了解,同时学会使用MATLAB软件求解微分方程的基本命令,学会建立微分方程方面的数学模型。这对于学生深入理解微分、积分的数学概念,掌握数学的分析思维方法,熟悉处理大量的工程计算问题的方法是十分必要的。 2、实验仪器、设备或软件 电脑、matlab7.0 二、实验过程(实验步骤、记录、数据、分析) 实验内容: 根据实验内容和步骤,完成以下实验,要求写出实验报告(实验目的→问题→数学模型→算法与编程→计算结果→分析、检验和结论) 1.求微分方程的解析解,并画出它们的图形。 y '= y + 2 x, y (0) = 1, 0< x <1; m=dsolve('Dy=y+2*x','y(0)=1','x') ezplot(m,[0 1]) m = 3*exp(x) - 2*x – 2
0.1 0.2 0.3 0.4 0.50.6 0.7 0.8 0.9 1 11.522.533.5 4x 3 exp(x) - 2 x - 2 1.求微分方程?? ? ??====-+]100[0)0(;0)0(01.03t u u u u u 的数值解,要求编写求解程序。 function dy=vdp1000(t,y) dy=zeros(2,1); dy(1)=y(2); dy(2)=-y(1)+0.1*y(1)^3; [T,Y]=ode15s('vdp1000',[0 10],[0 0]); plot(T,Y(:,1),'-')
分析化学实验课后部分习题标准答案(第四版)
实验一阳离子第一组(银组)的分析思考题: 1.沉淀第一组阳离子为什么要在酸性溶液中进行?若在碱性条件下进行,将会发生什么后果? 答:在系统分析中,为了防止易水解离子的水解生成沉淀而进入第一组,所以沉淀第一组阳离子时要在酸性溶液中进行。若在碱性条件下进行,第一组以后的大部分阳离子将生成沉淀,这样就不到分离的目的。 2.向未知溶液中加入第一组组试剂HCl时,未生成沉淀,是否表示第一组阳离子都不存在? 答:向未知试液中加入第一组组试剂时,未生成沉淀,只能说明Ag+,Hg22+不存在,而不能说明Pb2+不存在,因为当试液中Pb2+的浓度小于1mg?ml-1,或温度较高时,Pb2+将不在第一组沉淀,而进入第二组。 3.如果以KI代替HCl作为第一组组试剂,将产生哪些后果? 答:如果以KI代替HCl作为第一组组试剂时,酸度太小,第二组易水解的阳离子将水解进入第一组,达不到分离的目的。另外具有氧化性阳离子将与I-发生氧化还原反应,使这些离子的浓度
降低不能鉴出。 实验二阳离子第二组(铜锡组)的分析思考题: 1.沉淀本组硫化物时,在调节酸度上发 生了偏高或偏低现象,将会引起哪些 后果? 答:沉淀本组硫化物,若酸度偏低时,第三组阳离子Zn2+将生成ZnS 沉淀进入第二组。若酸度偏高时,本组的Cd 2+不生成硫化物沉淀而进入第三组。 2.在本实验中为沉淀硫化物而调节酸度时,为什么先调至0.6mol·L-1HCl酸度,然后再稀释一倍,使最后的酸度为0.2 mol·L-1? 答:因As(III)的硫化物完全沉淀需在0.6mol·L-1HCl酸度下,Cd2+的硫化物完全沉淀需在0.2 mol·L-1HCl酸度下。因此为了使本组离子完全生成硫化物沉淀而与第三组阳离子分离,所以在调节酸度时,先调至0.6 mol·L-1HCl酸度,然后再稀释一倍,使最后的酸度为0.2mol·L-1。 3.以TAA代替H2S作为第二组组试剂时,为什么可以不加H2O2和NH4I? 答:以TAA代替H2S作为第二组组试剂时,因TAA在90℃及酸性溶液中,可在沉淀时间内将As(V)还原为As(II
GC定性分析实验报告
气相色谱法对蔬菜中农药残留的定性分析 专业(班级): 姓名: 学号: 指导教师: 实验日期:2016 年 4 月 20 日
气相色谱法对蔬菜中农药残留的定性分析 一、实验目的 1. 了解气相色谱仪的基本结构、工作原理和操作技术。 2. 了解程序升温技术在气相色谱分析中的应用。 3. 了解毛细管气相色谱分析中的应用。 4. 学习利用保留值进行色谱对照的定性方法。 二、实验原理 气相色谱仪 (Gac Chromatography, GC) 是采用气体 (载气) 作为流动相的一种色谱法。当流动相携带欲分离的混合物流经固定相时,由于混合物中各组分的性质不同,与固定相作用的程度也有所不同,因而组分在两相间具有不同的分配系数,经过相当多次的分配之后,各组分在固定相中的滞留时间有长有短,从而使各组分依次流出色谱柱而得到分离。 三、实验仪器与试剂 天美G7900气相色谱仪、电子天平(METTLER AE200) 、离心机 (菲恰尔 80-2B)、KS康氏振荡器 丙酮 (分析纯)、乙酸乙酯 (分析纯)、超纯水、对硫磷标准品、甲基对硫磷标准品、三唑磷标准品、无水硫酸钠 (分析纯)、50 mL PP 离心管、10 mL PP 离心管
四、实验内容 样品处理 1. 将蔬菜切碎 (要充分粉碎),称取2 g于20 mL离心管中。 2. 加入10 mL丙酮 : 乙酸乙酯 (1 : 1) 混合液,旋紧瓶塞,振荡 2 min后,离心4 min (1500 r/min)。 3. 加入无水硫酸钠1 g,超纯水5 mL,振荡2min后,继续离心4 min (1500 r/min)。 4. 取上清液至10 mL离心管,贴好标签。 5. 上机测定前保存于4 ℃冰箱。 色谱条件 进样口温度:240 ℃ 检测器温度:250 ℃ 柱温程序:140 ℃(1 min),然后以10 ℃/min升温至200 ℃(4 min),再以15℃/min升温至280℃ (2 min) 载气 (N2) 流量:35 mL/min 进样量:1uL 五、注意事项 1. 蔬菜一定要充分切碎,越细越好。 2. 离心前一定要振荡,使其充分混匀。 3. 上清液不用完全取完,不要将下层的水层吸取上来。
第三组阳离子的分析
第四节第三组阳离子的分析 一、本组离子的分析特性 本组包括由7种元素形成的8种离子:Al3+、Cr3+、Fe3+、Fe2+、Mn2+、Zn2+、Co2+、Ni2+,称为铁组,它们的氯化物溶于水,在·L-1HCl溶液中不形成硫化物沉淀,只能在NH3-NH4Cl(pH≈9)溶液中与(NH4)2S或硫代乙酰胺反应生成硫化物或氢氧化物沉淀,按分组顺序称为第三组,按所用试剂称为硫化铵组。 1.离子的颜色——预测某些有色离子是否存在 常见阳离子中带有颜色的,除Cu2+以外,其余都集中到本组,而本组中只有Al3+和Zn2+无色。 作用:此性质可用作未知离子的预测。
应注意的问题: (1)当含量少时,即使溶液无色,也不能排除有少量有色离子的存在。 (2)当不同的颜色发生互补现象时,溶液虽然无色也不能排除有色离子的存在。 如Co2+:Ni2+=1:3 互补规律:(对角线互补为无色) 2.离子的价态 本组除Al3+与Zn2+外,都有两种以上的价态,如Fe(2,3),Mn(2,3,4,5,6,7),Cr(2,3,6),Co(2,3),Ni(2,3)等。可应用于分离和鉴定反应之中。正因为这样,本组许多离子的分析反应都与其价态的变化有关,有的还有重要的分析意义。
氧化还原反应在分析中的应用 (1)分离离子:掩蔽或沉淀 以NaOH沉淀Co(OH)2时,因它的溶解度较大,且容易被过量的NaOH部分溶解为HCoO2-,所以沉淀不完全。为使沉淀完全,一般都将Co(OH)2氧化为Co(OH)3。Co(OH)2很容易被氧化,甚至放置在空气中都可逐渐转变为Co(OH)3。在实验条件下,通常是加Na2O2作为氧化剂: 2Co(OH)2+Na2O2+2H2O=2Co(OH)3↓+2Na++2OH- (2)鉴定离子 Mn2+在稀溶液中接近无色,而MnO4-却有鲜明的紫红色。利用这一性质,可将Mn2+氧化为MnO4-而加以鉴定,灵敏度很高(m=1μg,c=16ppm)。 又如,Cr3+的鉴定方法之一,是先在碱性溶液中将它氧化为黄色的CrO42-(不够灵敏、受有色离子的干扰),然后再在酸性溶液中进一步氧化为蓝色的过氧化铬CrO5。这是铬比较特效的方法。
定性分析课标
《定性分析》课程标准 【课程名称】 定性分析 【适用专业】 中等职业学校工业分析与检验专业 1.课程性质 本课程是工业分析与检验专业的一门专业(技能)方向课程。主要内容包括:理论基础知识(定性分析基础知识、试样的制备);操作技能训练(阳离子试液的制备、 25种阳离子的定性分析、混合阳离子试液定性分析、阴离子试液的制备、15种阴离子的定性分析方)。 2.课程目标 使学生具备工业分析与检验人才所必需的定性分析的基本知识和基本应用能力,初步形成解决实际问题的能力,为学习专业知识和从事分析检验工作打下基础。了解常用定性分析方法的基本原理、方法特点和应用范围。掌握定性分析常用分析仪器的使用方法,定性分析常用技术。掌握阳离子试液和阴离子试液的制备方法。掌握常用25种阳离子和15种阴离子的定性分析法。能针对不同的试样进行试液的制备。能较准确进行25种阳离子和15种阴离子的个别定性分析。 3.课程内容和要求
4.实施建议 4. 1 教材 根据课程标准要求编写定性分析校本教材。 4. 2 教学建议 (1)突出重点,贯彻“必须、够用”的原则,做到理论为实践服务,为操作技能和生产现场服务。 (2)教学中要紧密联系生产实际,以讲授基本概念和定性分析为主、计算为辅,注意用实验演示密切配合理论教学。 (3)教学中以实践需要为目的,讲解相关的知识点,保持理论与实践的紧密结合。 (4)本课程主要在理实一体化的实训场所进行,主要采用分任务实训的教学方法,同时结合教师演示讲解、学生训练、学生讨论等形式,充分利用多媒体
课件、设备等现代化的教学手段。 4. 3 教学评价 (1)根据实训项目的完成情况及理论考核情况进行评分,采用过程性评价和结果性评价相结合的评价体系。 (2)操作考核从操作步骤、结果准确度和安全卫生等三方面进行评分。4. 4 课程资源的开发与利用 (1)充分利用网络资源,让学生接触更多、更新的知识,帮助学生对知识和技能的理解和掌握,培养学生的综合职业能力。 (2)加强校企结合,让学生进入企业化验室顶岗实习,体验角色转换,缩短就业适应期。 5.教材与参考资料 5. 1教材 采用学校自编的《定性分析》校本教材 5. 2参考书 《分析化学》
定性分析实验报告
定性分析综合实验报告 一.实验目的 1)掌握化学分析法的基本操作技能和初步运用的能力; 2)掌握常见离子的个性、共性、反应条件和鉴定方法; 3)通过综合实验分析混合试液 的各阳离子及其性质。 二.实验仪器和试剂 仪器:离心管若干、玻璃棒、离心机、量筒、滴管、电炉、烧杯、石棉网、试管架、试 管夹、黑白点滴板、ph试纸、药匙、表面皿、滤纸、红色石蕊试纸、坩埚 试剂: 6mol/lhcl、3mol/lhcl、1mol/lhcl、0.6mol/lhcl、6mol/lhac、3mol/l hac、 k2cro4溶液、3mol/lh2so4、6mol/lnaoh、6mol/l氨水、蒸馏水、6mol/lhno3、 3mol/lhno3、 0. 6mol/lhcl、稀氨水、taa、nh4cl、kclo3、甘油溶液(1:1)、 naac、k4fe(cn)6、浓 hac、sncl2、浓hcl、(nh4)2co3、浓hno3、铝片、锡粒、新配制的nabro、k3fe(cn)6、 (nh4)2hg(scn)4、 nh4scn、0.1mol/lhcl、nabio3、h2o2、戊醇、浓(nh4)2hpo4、丁二酮肟、氨气、 cocl2、(nh4)2c2o4、四苯硼化钠、醋酸铀酰锌、乙醇、浓naoh、镁试剂、nh4no3 三.实验步骤 1. 被测溶液的ph值大于7,显碱性,初步判定试液中可能有nh 4+ 4+ 2. nh的鉴定水浴 被测试液1滴(下表面皿)+湿润的红色石蕊试纸(上表面皿)+浓naoh 红色石蕊试 纸变蓝示有nh4+ 3.阳离子第一组(银组)的分析 (1)本组的沉淀 在试液中加2滴6mol/lhcl,充分搅拌,约2min,离心沉降,吸出离心液,留作第二组 测定,沉淀以3滴1mol/lhcl洗涤2次,然后按(2)研究 (2)向所得氯化物沉淀上加水1ml,然后在水浴中加热近沸,搅拌,约1-2min后,趁 热离心沉淀,并迅速吸出离心液于另一只离心管中 ①铅的鉴定 离心液+6mol/lhac+3滴k2 cro pbcro4(黄) 示有pb2+②hg2+的鉴定 在(2)残渣+6mol/l 氨水无现象没有hg2+③ag+的鉴定 离心液++agcl ,hg2cl2 ,pbcl2 ii-iv组 1 pb,cl agcl,hg2cl 2 6mol/lhac 6mol/l 氨水 4黄) 无现象示有pb2+ 4.阳离子第二组(铜锡组)的分析 向上述溶液中加6mol/l氨水,使其呈碱性,再加3mol/lhcl(沉淀溶解,溶液蓝色透明) 至酸度为ph=0.6.在该溶液中加taa,加热(褐色沉淀产生),离心沉降,保留沉淀,离心液 继续处理。 稀释离心液一倍,使其酸度降低,沉淀完全,并将两次处理的沉淀合并,用以含nh4cl 的水洗涤,继续研究。离心液按第三组阳离子研究,在离心管上表明“第三组阳离子研究” 字样,避免混乱。
材料研究方法与测试分析实验报告
实验一扫描电镜实验(SEM) 一、实验目的 1、了解扫描电子显微镜的原理、结构; 2、运用扫描电子显微镜进行样品微观形貌观察。 二、实验原理 扫描电镜(SEM)是用聚焦电子束在试样表面逐点扫描成像。试样为块状或粉末颗粒,成像信号可以是二次电子、背散射电子或吸收电子。其中二次电子是最主要的成像信号。由电子枪发射的电子,以其交叉斑作为电子源,经二级聚光镜及物镜的缩小形成具有一定能量、一定束流强度和束斑直径的微细电子束,在扫描线圈驱动下,于试样表面按一定时间、空间顺序作栅网式扫描。聚焦电子束与试样相互作用,产生二次电子发射以及背散射电子等物理信号,二次电子发射量随试样表面形貌而变化。二次电子信号被探测器收集转换成电讯号,经视频放大后输入到显像管栅极,调制与入射电子束同步扫描的显像管亮度,得到反映试样表面形貌的二次电子像。扫描电镜由下列五部分组成,如图1(a)所示。各部分主要作用简介如下:
1.电子光学系统 它由电子枪、电磁透镜、光阑、样品室等部件组成,如图1(b)所示。为了获得较高的信号强度和扫描像,由电子枪发射的扫描电子束应具有较高的亮度和尽可能小的束斑直径。常用的电子枪有三种形式:普通热阴极三极电子枪、六硼化镧阴极电子枪和场发射电子枪, 其性能如表1所示。前两种属于热发射电子枪,后一种则属于冷发射电子枪,也叫场发射电子枪。由表可以看出场发射电子枪的亮度最高、电子源直径最小,是高分辨本领扫描电镜的理想电子源。 电磁透镜的功能是把电子枪的束斑逐级聚焦缩小,因照射到样品上的电子束斑越小,其分辨率就越高。扫描电镜通常有三个磁透镜,前两个是强透镜,缩小束斑,第三个透镜是弱透镜,焦距长,便于在样品室和聚光镜之间装入各种信号探测器。为了降低电子束的发散程度,每级磁透镜都装有光阑;为了消除像散,装有消像散器。样品室中有样品台和信号探测器,样品台还能使样品做平移运动。 2、扫描系统 扫描系统的作用是提供入射电子束在样品表面上以及阴极射线管电子束在荧光屏上的同步扫描信号。 3、信号检测、放大系统 样品在入射电子作用下会产生各种物理信号、有二次电子、背散射电子、特征X射线、阴极荧光和透射电子。不同的物理信号要用不同类型的检测系统。它大致可分为三大类,即电子检测器、阴极荧光检测器和X射线检测器。 4、真空系统 镜筒和样品室处于高真空下,一般不得高于1×10-2 Pa,它由机械泵和
分析化学实验思考题答案
实验一阳离子第一组(银组)的分析 思考题: 1.沉淀第一组阳离子为什么要在酸性溶液中进行?若在碱性条件下进行,将会发生什么后果? 答:在系统分析中,沉淀第一组阳离子在酸性溶液中进行是为了防止后面几组阳离子中易水解离子的水解生成沉淀而进入第一组。若在碱性条件下进行,第一组以后的大部分阳离子将生成沉淀,达不到分离的目的。 2.向未知溶液中加入第一组组试剂HCl时,未生成沉淀,是否表示第一组阳离子都不存在? 答:不能。向未知试液中加入第一组组试剂时,未生成沉淀,只能说明Ag+,Hg22+不存在,但不能说明Pb2+不存在,因为当试液中Pb2+的浓度小于1mg?ml-1,或温度较高时,Pb2+将不在第一组沉淀,而进入第二组。Cl-离子浓度太大,Ag+,Hg22+离子浓度太低,也难以生成沉淀。 3.如果以KI代替HCl作为第一组组试剂,将产生哪些后果? 答:如果以KI代替HCl作为第一组组试剂时:(1)、酸度太小,第二组易水解的阳离子将水解进入第一组,同时后面几组较多离子与I-反应生成沉淀进入第一组,达不到分离的目的。(2)、具有氧化性阳离子将与I-发生氧化还原反应,使这些离子的浓度降低不能鉴出。 (3)、I-比Cl-更容易使与金属离子形成络合物,而得不到沉淀。(4)、引入了K+,对K+的鉴定结果难以下确定结论。 实验二阳离子第二组(铜锡组)的分析 思考题: 1.沉淀本组硫化物时,在调节酸度上发生了偏高或偏低现象,将会引起哪些后果? 答:沉淀本组硫化物时: (1)、若酸度偏高时,本组溶解度较大的CdS、SnS(包括第一组的Pb2+进入第二组后)不生成硫化物沉淀而进入第三组。 (2)、若酸度偏低时,第三组阳离子Zn2+将生成ZnS(溶解度较大)沉淀进入第二组。 (3)、酸度偏低不利于As、Sb、Sn生成硫化物沉淀。 2.在本实验中为沉淀硫化物而调节酸度时,为什么先调至0.6mol·L-1HCl酸度,然后再稀释一倍,使最后的酸度为0.2 mol·L-1? 答:先调至0.6mol·L-1HCl酸度,因As(III)的硫化物完全沉淀需在0.6 mol·L-1HCl酸度下进行,然后再稀释一倍(并且本组离子沉淀时酸度要增高),使最后的酸度为0.2 mol·L-1,因Cd2+(包括第一组未沉淀的Pb2+)的硫化物完全沉淀需在0.2 mol·L-1HCl酸度下。因此为了使本组离子完全生成硫化物沉淀而与第三组阳离子分离,所以在调节酸度时,先调至0.6 mol·L-1HCl酸度,然后再稀释一倍,使最后的酸度为0.2 mol·L-1。
气相色谱定性与定量分析报告实验
气相色谱的定性与定量分析 一、 实验目的: 1、 学习计算色谱峰的分享度 2、 掌握根据纯物质的保留值进行定性分析 3、 掌握用归一化法定量测定混合物各组分的含量 4、 学习气相色谱信的使用方法 二、 方法原理 1、 柱效能的测定:色谱柱的分享效能,主要由柱效和分离度来衡量。柱效率是以样品中验 证分离组分的保留值用峰宽来计算的理论塔板数或塔板高度表示的。 2 2 2 1 1654.5??? ? ??=???? ? ??=b R R W t W t n 理论塔板数: n L H = 理论塔板高度: 式中R t 为保留值(S 或mm ):2 1 W 为半峰宽(S 或mm ):b W 为峰底宽(S 或mm ):L 为 柱长(cm )。 理论塔板数越大或塔板高度越小,说明柱效率越好。但柱效率只反应了色谱对某一组分的柱效能,不能反映相邻组分的分离度,因此,还需计算最难分离物质对的分离度。 分离度是指色谱柱对样品中相邻两组分的分离程度,对一个混合试样成功的分离,是气相色谱法完成定性及定量分析的前提和基础。分离度R 的计算方法是: ) ()(2211211 2W W t t R R R +-= 或 2112)(2B b R R W W t t R +-= 分离度数值越大,两组分分开程度越大,当R 值达到1.5时,可以认为两组分完全分开。 2、 样品的定性: 用纯物质的保留值对照定性。在一个确定的色谱条件下,每一个物质都有一个确定的保留值,所以在相同条件下,未知物的保留值和已知物的保留值相同时,就可以认为未知物即是用于对照的已知纯物质。但是,有不少物质在同一条件下可能有非常相近的而不容易察觉差异的保留值,所以,当样品组分未知时,仅用纯物质的保留值与样品的组分的保留值对照定性是困难的。这种情况,需用两根不同的极性的柱子或两种以上不同极性固定液配成的柱子,对于一些组成基本上可以估计的样品,那么准备这样一些纯物质,在同样的色谱条件下,以纯物质的保留时间对照,用来判断其色谱峰属于什么组分是一种简单而行方便的定性方法。 用标准加入法来定性。首先用未知的混合样品在一定的色谱条件下采集混合物样品的色谱峰,然后取一定量的混合物样品中加入怀疑有的物质的纯物质,在相同的色谱条件下采集加入某纯物质的色谱峰,用两个色谱图进行比较,就会发现两个色谱图上某一个峰的保留值相同,但加了某纯物质的色谱图上的色谱峰的峰高增加、峰面积增大,那么此峰即为某纯物质。 3、 样品的定量
第四组阳离子分析预习要求
实验三、第四组阳离子混合液分析 一、实验目的 1.掌握第四组阳离子分组的依据和反应条件。 2.掌握本组阳离子的鉴定方法,熟记本组离子鉴定反应及其特征。 3.熟练掌握定性分析基本操作。 1.仪器配置 Ba2+练习试液Sr2+练习试液Ca2+练习试液 K+练习试液Na+练习试液NH4+练习试液Mg2+练习试液 HCl(,1 mol·L-1 , 6 mol·L-1,) HAc (6 mol·L-1) HNO3 (6mol·L-1 ,3mol·L-1 ) NH3·H2O (6 mol·L-1) NaOH (6mol·L-1) TAA(5%) 3mol·L-1NaAc 0.25mol·L-1K4Fe(CN)6 0.25mol·L-1K3Fe(CN)61mol·L-1NH4Cl 饱和NH4Cl H2O230g·L-1 1mol·L-1K2CrO4 0.5mol·L-1(NH4)2C2O4 1 mol·L-1 NH4)2CO3 饱和(NH4)2CO30.01 mol·L-1KMnO4 Na2CO3(S) Na3Co(NO2)6(S) 玫瑰红酸钠95% 乙醇1% 四苯硼化钠 醋酸铀酰锌镁试剂(I) 材料:铂丝、蒸馏水、广泛pH试纸、红色石蕊试纸、滤纸
第四组阳离子分析预习要求 一、课前练习: 1.用系统分析法分析第四组阳离子,其沉淀条件中除需加NH3·H2O以防止(NH4)2CO3水解外,还需加热至60~70℃,其目的是:() A防止沉淀胶溶; B.赶去有害气体; C.使氨基甲酸铵转化为(NH4)2CO3; D.防止沉淀水解; E.加快反应速度。 2.要将BaSO4、SrSO4溶解,制备成Ba2+、Sr2+的溶液,可采用何种方法:() A.加HNO3,加热; B.加王水; C.加浓NH3·H2O,加热; D.加浓NaOH; E.用Na2CO3浓溶液使之转化成碳酸盐,再使之溶于酸。 3.若NH4+、K+同时存在,则NH4+将干扰K+的鉴定,可用下述何种方法除去NH4+的干扰? ()A.离子交换分离; B.萃取分离; C.灼烧试液,使NH4+挥发除去; D.加入掩蔽剂; E.加入四苯硼化钠 4.对Ba2+、Ca2+的混合液,可采用下列何种试剂分离并鉴定Ba2+: () A.(NH4)2C2O4; B.K2CrO4; C.Na2CO3; D.NH4Ac; E.(NH4)2CO3。 5.以K2CrO4鉴定Ba2+离子时,如溶液的酸性太强,要加入NH4Ac或NaAc,这是为了: ()A.防止Pb2+的干扰; B.破坏胶体; C.易获得粗大晶体; D.降低溶液的酸度,使之生成BaCrO4沉淀; E.起盐效应作用。 二、课前思考: 1.第四组离子的分析中,鉴定K+、Na+、Mg2+之前为什么必须除尽NH4+? 2.在硫化氢系统分析中,沉淀Ba2+、Sr2+、Ca2+的组试剂能否用Na2CO3,为什么? 3.分析第四组离子中的Mg2+,是否可以用镁试剂直接从原
