康为世纪- BCA蛋白定量试剂盒

BCA Protein Assay Kit
BCA蛋白定量试剂盒
Version 21092010‐2.2
I 产品规格
Catalog no. CW0014
Number of preps. 500
试剂A 100 ml
试剂B 3 ml
BSA标准品 (2mg/ml) 2 ml
II 保存条件
试剂A、B室温放置,BSA标准品4℃储存。
III 产品简介
BCA蛋白定量法是目前广泛使用的蛋白定量方法之一。本产品是基于BCA(Bicinchoninic Acid)法研制而成,实现了对蛋白质进行快速、稳定、灵敏的浓度测定。其原理是在碱性环境下蛋白质分子中的肽链结构能与Cu2+络合生成络合物,同时将Cu2+还原成Cu+。BCA试剂可敏感特异地与Cu+结合,形成稳定的有颜色的复合物。在562nm处有高的光吸收值,颜色的深浅与蛋白质浓度成正比,可根据吸收值的大小来测定蛋白质的含量。本试剂盒含有牛血清白蛋白(BSA)溶液作为蛋白质标准品溶液,测定范围为20~2000 ug/ml。
IV注意事项
1.如待测样品中含较多的干扰物质(具体见附表1),可采用Bradford蛋白浓度测定试剂盒或其他蛋白定量试剂盒测定。
2.采用37℃孵育30 分钟或室温放置2小时进行反应,结果无差异。
3.BSA标准品的稀释液需与待测样品的稀释液一致。为简便起见,也可用1XPBS或0.9%生理盐水进行稀释。
4.为了您的安全和健康,请穿实验服并戴一次性手套操作。
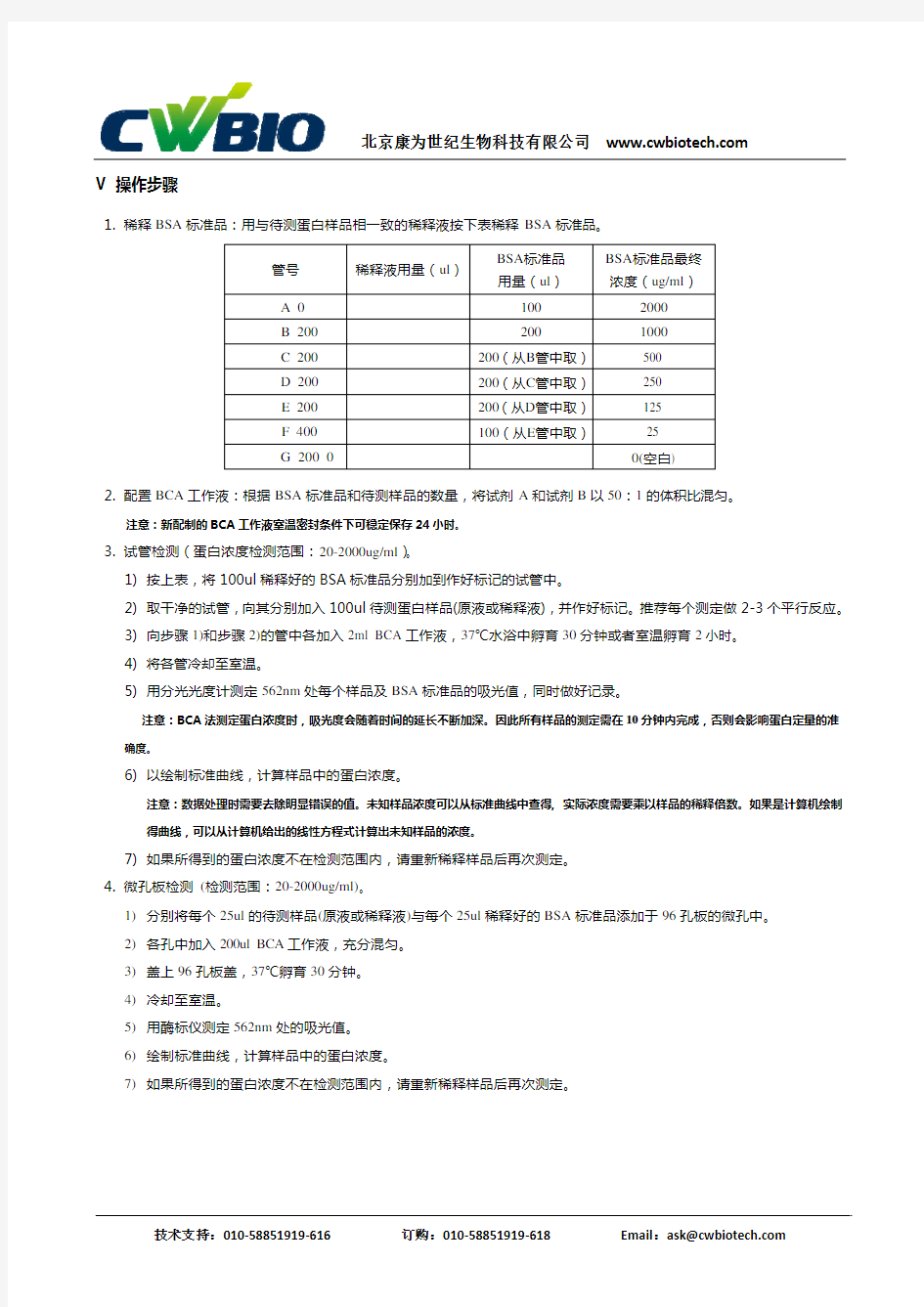
V 操作步骤
1.稀释BSA标准品:用与待测蛋白样品相一致的稀释液按下表稀释BSA标准品。
管号稀释液用量(ul)BSA标准品
用量(ul)
BSA标准品最终
浓度(ug/ml)
A 0 100
2000
B 200 200 1000
C 200
200(从B管中取)500
D 200
200(从C管中取)250
E 200
200(从D管中取)125
F 400
100(从E管中取)25
G 200 0 0(空白)
2.配置BCA工作液:根据BSA标准品和待测样品的数量,将试剂A和试剂B以50:1的体积比混匀。
注意:新配制的BCA工作液室温密封条件下可稳定保存24小时。
3.试管检测(蛋白浓度检测范围:20-2000ug/ml)。
1)按上表,将100ul稀释好的BSA标准品分别加到作好标记的试管中。
2)取干净的试管,向其分别加入100ul待测蛋白样品(原液或稀释液),并作好标记。推荐每个测定做2-3个平行反应。
3)向步骤1)和步骤2)的管中各加入2ml BCA工作液,37℃水浴中孵育30分钟或者室温孵育2小时。
4)将各管冷却至室温。
5)用分光光度计测定562nm处每个样品及BSA标准品的吸光值,同时做好记录。
注意:BCA法测定蛋白浓度时,吸光度会随着时间的延长不断加深。因此所有样品的测定需在10分钟内完成,否则会影响蛋白定量的准确度。
6)以绘制标准曲线,计算样品中的蛋白浓度。
注意:数据处理时需要去除明显错误的值。未知样品浓度可以从标准曲线中查得, 实际浓度需要乘以样品的稀释倍数。如果是计算机绘制得曲线,可以从计算机给出的线性方程式计算出未知样品的浓度。
7)如果所得到的蛋白浓度不在检测范围内,请重新稀释样品后再次测定。
4.微孔板检测(检测范围:20-2000ug/ml)。
1)分别将每个25ul的待测样品(原液或稀释液)与每个25ul稀释好的BSA标准品添加于96孔板的微孔中。
2)各孔中加入200ul BCA工作液,充分混匀。
3)盖上96孔板盖,37℃孵育30分钟。
4)冷却至室温。
5)用酶标仪测定562nm处的吸光值。
6)绘制标准曲线,计算样品中的蛋白浓度。
7)如果所得到的蛋白浓度不在检测范围内,请重新稀释样品后再次测定。
附表
附表1. 干扰物质表
化合物耐受浓度化合物耐受浓度
缓冲液去垢剂和变性剂
乙酸盐 0.2M Brij35 1%
甘氨酸 1M CHAPS 1%
HEPES 0.1M 盐酸胍 4M
MES 50mM NP-40 1%
MOPS 50mM 辛葡糖 1%
Na+-柠檬酸<1mM SDS 1%
X-100 1%
PIPES 50mM
Triton
磷酸钠 0.1M 糖类
乙酸钠0.2M pH 5.5 葡萄糖 10mM
TES 50mM 蔗糖 1M
Tris 0.1M 螯合剂
10mM
盐类 EDTA
硫酸铵干扰还原剂
β-巯基乙醇 50μM
NaCl 1M
尿素 3M DTT 1mM
极性化合物其他
DMSO 5% 脂类干扰
0.1M
HCl/NaOH
甘油 10%
BCA蛋白浓度测定试剂盒
BCA蛋白浓度测定试剂盒 产品编号产品名称包装价格 P0012 BCA蛋白浓度测定试剂盒500次258.00 元 O 碧云天生产的BCA蛋白浓度测定试剂盒是根据目前世界上最常用的两种蛋白浓度检测方法之一BCA法研制而成,实现了蛋白浓度测 定的简单,高稳定性,高灵敏度和高兼容性。 O 灵敏度高,检测浓度下限达到25微克/毫升,最小检测蛋白量达到0.5微克,待测样品体积为1-20微升。 O 在50-2000微克/毫升浓度范围内有较好的线性关系。 O BCA法测定蛋白浓度不受绝大部分样品中的化学物质的影响,可以兼容样品中高达5%的SDS,5%的Triton X-100,5%的Tween 20, 60, 80。但受螯合剂和略高浓度的还原剂的影响,需确保EDTA低于10mM,无EGTA,二硫苏糖醇低于1mM,β-巯基乙醇低 于1mM。不适用BCA法时建议使用碧云天Bradford蛋白浓度测定试剂盒。 O BCA蛋白浓度测定试剂盒对样品中各种物质详细的兼容性表,参见BCA蛋白浓度测定兼容性表。 O 每个试剂盒可以检测500个样品。 包装清单: BCA试剂A 100 ml BCA试剂B 3 ml 蛋白标准(5mg/ml BSA) 1 ml 说明书 1 份 保存条件: BCA试剂A和B室温保存,蛋白标准请-20℃冻存。本试剂盒自订购之日起一年注意事项: O 需酶标仪一台,测定波长为540-595nm之间,562nm最佳。需96孔板。如果没有酶标仪,也可以使用普通的分光光度计测定,但 是测定蛋白浓度时,需根据测定吸光度的杯子的体积,按比例调整A液,B液和样品的体积。使用分光光度计测定蛋白浓度时,每 个试剂盒可以测定的样品数量可能会显著减少。 O 如发现样品稀释液或裂解液本身就有较高背景,请试用Bradford蛋白浓度测定试剂盒。 O 为了加快BCA法测定蛋白浓度的速度可以适当用微波炉加热,但是切勿过热。 O EDTA浓度必需小于10mM,不兼容EGTA。不适用BCA法时,请试用Bradford蛋白浓度测定试剂盒。 使用说明: 1. 根据样品数量,按50体积BCA试剂A加1体积BCA试剂B(50:1)配制适量BCA工作液,充分混匀。BCA工作液室温24小时内稳定。 2. 完全溶解蛋白标准品,取10微升稀释至100微升,使终浓度为0.5mg/ml。蛋白样品在什么溶液中,标准品也宜用什么溶液稀 释。但是为了简便起见,也可以用0.9%NaCl或PBS稀释标准品。 3. 将标准品按0, 1, 2, 4, 8, 12, 16, 20微升加到96孔板的标准品孔中,加标准品稀释液补足到20微升。 4. 加适当体积样品到96孔板的样品空中,加标准品稀释液到20微升。 5. 各孔加入200微升BCA工作液,37℃放置30分钟,或室温放置2小时,或60℃放置30分
白蛋白试剂盒产品技术审评规范2017版
附件2 白蛋白测定试剂(盒)产品技术审评规范(2017版) 本规范旨在指导注册申请人对白蛋白测定试剂(盒)注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。 本规范是对白蛋白测定试剂(盒)的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据产品特性确定其中的具体内容是否适用。 本规范是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料。应在遵循相关法规的前提下使用本规范。 本规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本规范相关内容也将进行适时调整。 一、适用范围 白蛋白测定试剂(盒)用于体外定量测定人血清或血浆中白蛋白的浓度。 从方法学考虑,本规范主要指基于分光光度法原理,利用全自动、半自动生化分析仪或分光光度计,在医学实验室采用溴甲酚绿法、溴甲酚紫法进行白蛋白定量检验所使用的临床化学体外诊断试剂。本文不适用于干式或免疫比浊法的白蛋白测定试剂,但适用处可参照执行。 依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号,以下简称《办法》)、《食品药品监管总局关于印发体外诊断试剂
分类子目录的通知》(食药监械管[2013]242号)白蛋白测定试剂(盒)管理类别为Ⅱ类,分类代号为6840。 二、注册申报资料要求 (一)综述资料 综述资料主要包括产品预期用途、临床意义、产品描述、有关生物安全性方面说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《体外诊断试剂注册管理办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局〔2014〕第44号公告)相关要求。下面着重介绍与白蛋白测定试剂(盒)预期用途有关的临床背景情况。 白蛋白为含580个氨基酸残基的单链单纯蛋白质,分子量66.3kD,分子中含17个二硫键,在Ph7.4体液中为每分子可以带有200个以上负电荷的负离子。白蛋白由肝实质细胞合成分泌,是血浆中含量最多的蛋白质,约占血浆总蛋白的57%-68%,血浆半衰期约15-19天。白蛋白为体内重要营养蛋白,并参与维持血浆胶体渗透压、酸碱平衡等内环境稳定,也是血浆中多种物质的主要转运蛋白。白蛋白增高主要见于血液浓缩而致相对性增高,如严重脱水和休克、严重烧伤、急性出血、慢性肾上腺皮质功能减低症。白蛋白降低常见于肝硬化合并腹水及其他肝功能严重损害(如急性肝坏死、中毒性肝炎等)营养不良、慢性消耗性疾病、糖尿病、严重出血肾病综合征等。 注:若注册申报产品声称临床意义超出此内容范围,应提供相关文献或临床研究依据。 (二)主要原材料研究资料(如需提供) 主要原材料的选择、制备、质量标准及实验验证研究资料;质控品、校准品的原料选择、制备、定值过程及试验资料;校准品的溯源性文件,包括具体溯源链、实验方法、数据及统计分析等详细资料。
(整理)6种方法测定蛋白质含量.
6种方法测定蛋白质含量 一、微量凯氏(kjeldahl)定氮法 样品与浓硫酸共热。含氮有机物即分解产生氨(消化),氨又与硫酸作用,变成硫酸氨。经强碱碱化使之分解放出氨,借蒸汽将氨蒸至酸液中,根据此酸液被中和的程度可计算得样品之氮含量。若以甘氨酸为例,其反应式如下: NH2CH2COOH+3H2SO4――2CO2+3SO2+4H2O+NH3(1) 2NH3+H2SO4――(NH4)2 SO4(2) (NH4)2 SO4+2NaOH――2H2O+Na2SO4+2NH3(3) 反应(1)、(2)在凯氏瓶内完成,反应(3)在凯氏蒸馏装置中进行。 为了加速消化,可以加入CuSO4作催化剂,K2SO4以提高溶液的沸点。收集氨可用硼酸溶液,滴定则用强酸。实验和计算方法这里从略。 计算所得结果为样品总氮量,如欲求得样品中蛋白含量,应将总氮量减去非蛋白 氮即得。如欲进一步求得样品中蛋白质的含量,即用样品中蛋白氮乘以6.25即得。 二、双缩脲法(biuret法) (一)实验原理 双缩脲(NH3CONHCONH3)是两个分子脲经180℃左右加热,放出一个分子氨后得到的产物。在强碱性溶液中,双缩脲与CuSO4形成紫色络合物,称为双缩脲反应。凡具有两个酰胺基或两个直接连接的肽键,或能过一个中间碳原子相连的肽键,这类化合物都有双缩脲反应。
紫色络合物颜色的深浅与蛋白质浓度成正比,而与蛋白质分子量及氨基酸成分无关,故可用来测定蛋白质含量。测定范围为1-10mg蛋白质。干扰这一测定的物质主要有:硫酸铵、tris缓冲液和某些氨基酸等。 此法的优点是较快速,不同的蛋白质产生颜色的深浅相近,以及干扰物质少。主要的缺点是灵敏度差。因此双缩脲法常用于需要快速,但并不需要十分精确的蛋白质测定。 (二)试剂与器材 1.试剂: (1)标准蛋白质溶液:用标准的结晶牛血清清蛋白(bsa)或标准酪蛋白,配制成10mg/ml的标准蛋白溶液,可用bsa浓度1mg/ml的a280为0.66来校正其纯度。如有需要,标准蛋白质还可预先用微量凯氏定氮法测定蛋白氮含量,计算出其纯度,再根据其纯度,称量配制成标准蛋白质溶液。牛血清清蛋白用H2O 或0.9%NaCl配制,酪蛋白用0.05NaOH配制。 (2)双缩脲试剂:称以1.50克硫酸铜(CuSO4?5H2O)和6.0克酒石酸钾钠(KNaC4H4O6?4H2O),用500毫升水溶解,在搅拌下加入300毫升10% NaOH溶液,用水稀释到1升,贮存于塑料瓶中(或内壁涂以石蜡的瓶中)。此试剂可长期保存。若贮存瓶中有黑色沉淀出现,则需要重新配制。 2.器材: 可见光分光光度计、大试管15支、旋涡混合器等。 (三)操作方法 1.标准曲线的测定:取12支试管分两组,分别加入0,0.2,0.4,0.6,0.8,1.0毫升的标准蛋白质溶液,用水补足到1毫升,然后加入4毫升双缩脲试剂。充分摇匀后,在室温(20~25℃)下放置30分
血清淀粉样蛋白A C-反应蛋白测定试剂盒(胶体金免疫层析法)产品技术要求yuepu
血清淀粉样蛋白A/C-反应蛋白测定试剂盒(胶体金免疫层析法) 适用范围:该产品用于体外定量测定人血清、血浆、全血(静脉血和指尖血)中血清淀粉样蛋白A和C-反应蛋白的含量。 1.1规 格 1人份/袋、10人份/盒、20人份/盒、50人份/盒 1.2组成 产品包含1/10/20/50人份血清淀粉样蛋白A/C-反应蛋白检测卡、1/10/20/50 支样品缓冲液(300μL/支)、1份二维码(内含校准信息),每人份试剂独立铝箔袋包装内含1支检测卡和1包干燥剂。 检测卡由标记垫(喷涂有胶体金标记的鼠抗人血清淀粉样蛋白A和鼠抗人C-反应蛋白单克隆抗体混合物)、样品垫、硝酸纤维素膜(T1线包被鼠抗人血清淀粉样蛋白A;T2线包被鼠抗人C-反应蛋白单克隆抗体;C线包被羊抗鼠多抗体)、吸水纸、塑料载板组成。 样品缓冲液由0.1%的表面活性剂和0.1mol/L的Tris溶液(pH7.0)组成。 2.1物理性状 2.1.1外观 检测卡应整洁完整、无毛刺、无破损、无污染;材料附着牢固;标签字迹清晰,无破损。样品缓冲液应清澈透明、无杂质、无絮状物。 2.1.2液体移行速度 液体移行速度应不低于10 mm/min。 2.1.3 膜条宽度 检测卡的膜条宽度≥2.5mm。 2.1.4样品缓冲液装量 样品缓冲液体积应在标识体积的±5%以内。 2.2空白限 血清淀粉样蛋白A的空白限应不高于10μg/mL,C-反应蛋白的空白限应不高于0.5μg/mL。
2.3重复性 分别用高、中、低3个浓度的样本,各重复检测10次,CV(%)应不高于15.0%。 2.4批间差 用3个批号的试剂卡,分别检测2个浓度的样本,相对极差R应不高于15.0%。 2.5线性 血清淀粉样蛋白A在[10,150] μg/mL的范围内,线性相关系数应不低于0.990。C-反应蛋白在[0.5,100] μg/mL的范围内,线性相关系数应不低于0.990。 2.6准确度 检测血清淀粉样蛋白A国际标准品(92/680)、C-反应蛋白国际标准品(ERM DA-474/IFCC),相对偏差在±15%以内。 2.7 校准信息溯源性 应根据GB/T21415-2008提供校准信息的来源、赋值过程,血清淀粉样蛋白A溯源至国际校准品(92/680),C-反应蛋白溯源至国际校准品(ERM DA-474/IFCC)2.8稳定性 将试剂盒在4℃~30℃环境中放置至有效期18个月后,过有效期后3个月内,分别检测,结果应符合2.1、2.2、2.3、2.5、2.6的要求。
测量蛋白质三种方法测定原理
测定蛋白质含量的三种方法原理 院系:xxx 专业:xxx 姓名:xxx 学号:xxx
测量蛋白质三种方法测定原理 【摘要】了解测量蛋白质三种测定方法的基本原理和优缺点。三种方法为考马斯亮蓝法(Bradford法),Folin-酚试剂法(Lowry法)和紫外吸收法。 【关键词】蛋白质含量测定考马斯亮蓝法 Folin-酚试剂法紫外吸收法 蛋白质含量测定法,是生物化学研究中最常用、最基本的分析方法之一目前常用的有两种古老的经典方法,即Folin-酚试剂法(Lowry法)和紫外吸收法。另外还有一种近十年才普遍使用起来的新的测定法,即考马斯亮蓝法(Bradford 法)。其中Bradford法和Lowry法灵敏度最高,比紫外吸收法灵敏10~20倍。。每种测定法都不是完美无缺的,都有其优缺点。在选择方法时应考虑:①实验对测定所要求的灵敏度和精确度;②蛋白质的性质;③溶液中存在的干扰物质;④测定所要花费的时间。简单列表为: 考马斯亮蓝法 双缩脲法(Biuret法)和Folin—酚试剂法(Lowry法)的明显缺点和许多限制,促使科学家们去寻找更好的蛋白质溶液测定的方法。 1976年由Bradford建立的考马斯亮兰法(Bradford法),是根据蛋白质与染料相结合的原理设计的。这种蛋白质测定法具有超过其他几种方法的突出优点,因而正在得到广泛的应用。这一方法是目前灵敏度最高的蛋白质测定法。它是一种蛋白定量法 (一)实验原理 考马斯亮蓝G-250(Coomassie G-250)是一种甲基取代的三苯基甲烷,分子中磺酸基的蓝色染料,在465nm处有最大吸收值。考马斯亮蓝G-250能与蛋白质通过范得华相互作用形成蛋白质—考马斯亮蓝复合物蓝色溶液,引起该染料的最大吸收λmax的位置发生红移,在595nm处有最大吸收值。由于蛋白质—考马斯亮蓝复合物在595nm处的光吸收远高于考马斯亮蓝在465nm处的光吸收,因此,可大大地提高蛋白质的测定灵敏度。蛋白质—考马斯亮蓝复合物溶液颜色的深浅与蛋白质的浓度成正比。利用溶液颜色的差异进行比色测定,适合于蛋白质类的定量分析,尤其适合于稀有蛋白质的微量分析。 (二)Bradford法的突出优点是: (1)灵敏度高,据估计比Lowry法约高四倍,其最低蛋白质检测量可达1mg。这
高铁血红素白蛋白检测试剂盒(Schumm法)
高铁血红素白蛋白检测试剂盒(Schumm 法) 简介: 出现严重血管内溶血,产生的游离血红蛋白量超过结合珠蛋白所能结合的量,血液中结合珠蛋白几乎被耗尽,游离血红蛋白分解成珠蛋白和血红素,有一部分会被氧化成高铁血红素,高铁血红素和血浆白蛋白结合生成高铁血红素白蛋白(Methemalbumin ,MHA),MHA 分子较大,不能由肾脏排出,而是经肝脏清除。 Leagene 高铁血红素白蛋白检测试剂盒(Schumm 法)(Methemalbumin Assay Kit)采用Schumm 法,其检测原理是严重血管内溶血时,结合珠蛋白与血红素结合蛋白均被耗尽,高铁血红素与白蛋白结合成MHA ,经氧化作用后用分光镜或分光光度计检测,若在处出现强的吸收峰,表示存在高铁血红素白蛋白。该试剂盒主要用于定性检测血清或血浆样本,亦可用于定性检测细胞或组织的裂解液或匀浆液等中的高铁血红素白蛋白,血清中出现高铁血红素白蛋白是溶血严重的指标。该试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。 组成: 自备材料: 1、 生理盐水 2、 比色杯 3、 分光光度计或分光镜 操作步骤(仅供参考): 1、 准备样品:按照常规方法制备溶血标本血清或血浆,检测前再次高速离心,除尽红细胞,-80℃冻存。如果样品中的MHA 含量过高,可以用生理盐水适当稀释后再进行测定。 2、 加样:轻轻向待测样品加入Schumm Reagent A ,使Schumm Reagent A 完全覆盖样品表面,然后加入样品Schumm Reagent B ,轻轻混合。 4、 检测:取或恰当容量的比色杯,分别加入上述混合液,以生理盐水作为空白对照,用分光光度计或分光镜检测,若在处出现强的吸收峰,表示存在高铁血红素白蛋白,一般应数小时内检测完毕。 编号 名称 TC0211 50T Storage 试剂(A): Schumm Reagent A 15ml RT 避光 试剂(B): Schumm Reagent B 5ml ×2 RT 避光 使用说明书 1份
几种测蛋白含量方法的比较
蛋白质含量测定方法的比较及肽含量的测定 (一)蛋白质测定方法的比较(原理、优缺点)蛋白质含量测定法,目前包括定氮法、双缩脲法、福林酚法(Lowry 法)和紫 外吸收法、考马斯亮蓝法。其中考马斯亮蓝和福林酚法灵敏度最高,比紫外吸收法灵敏10~20 倍,比双缩脲法灵敏100倍以上。定氮法较复杂,但准确,往往以定氮法测定的蛋白质作为其他方法的标准蛋白质。在选择方法时应该考虑:(1)实验测定要求的灵敏度和精确度;(2)蛋白质的性质;(3)溶液中存在的干扰物质;(4)测定花费时间。蛋白质含量测定法,目前包括定氮法、双缩脲法、福林酚法(Lowry 法)和紫外吸收法、考马斯亮蓝法。其中考马斯亮蓝和福林酚法灵敏度最高,比紫外吸收法灵敏10~20 倍,比双缩脲法灵敏100倍以上。定氮法较复杂,但准确,往往以定氮法测定的蛋白质作为其他方法的标准蛋白质。在选择方法时应该考虑:(1)实验测定要求的灵敏度和精确度;(2)蛋白质的性质;(3)溶液中存在的干扰物质;(4)测定花费时间。 1 微量凯氏定氮法(GB 5009.5-2010) 1.1原理样品与浓硫酸共热。含氮有机物即分解产生氨(消化),氨又与硫酸作用,变成硫酸氨。经强碱碱化使之分解放出氨,借蒸汽将氨蒸至酸液中,根据此酸液被中和的程度可计算得样品之氮含量。 1.2操作方法样品经前处理、炭化、消化、蒸馏、滴定等主要步骤 1.3特点准确度较高,适用于0.2~ I.Omg氮,误差为土2%;操作复杂费时,整个过程需要耗时8~10h,试剂消耗量大。,测得结果为总氮含量,包括蛋白氮和非蛋白氮含 量;适用范围广,几乎所有样品均可用此方法。 2双缩脲比色法
三种定量蛋白质组方法比较
A comparative study on the three quantitative methods frequently used in proteomics, 2D DIGE (difference gel electrophoresis), cICAT (cleavable isotope-coded affinity tags) and iTRAQ (isobaric tags for relative and absolute quantification), was carried out. DIGE and cICAT are familiar techniques used in gel- and LC-based quantitative proteomics, respectively. iTRAQ is a new LC-based technique which is gradually gaining in popularity. A systematic comparison among these quantitative methods has not been reported. In this study, we conducted well-designed comparisons using a six-protein mixture, a reconstituted protein mixture (BSA spiked into human plasma devoid of(缺乏)six abundant proteins), and complex HCT-116 cell lysates as the samples. All three techniques yielded quantitative results with reasonable accuracy when the six-protein or the reconstituted protein mixture was used. In DIGE, accurate quantification was sometimes compromised due to comigration or partial comigration of proteins. The iTRAQ method is more susceptible to errors in precursor ion isolation, which could be manifested with increasing sample complexity. The quantification sensitivity of each method was estimated by the number of peptides detected for each protein. In this regard, the global-tagging iTRAQ technique was more sensitive than the cysteine-specific cICAT method, which in turn was as sensitive as, if not more sensitive than, the DIGE technique. Protein profiling on HCT-116 and HCT-116 p53 ?/? cell lysates displayed limited overlapping among proteins identified by the three methods, suggesting the complementary nature of these methods. Keywords: protein quantification ? DIGE ? cICAT ? iTRAQ ? 2D gel ? LC-MALDI TOF/TOF DIGE:荧光差异凝胶电泳 CICAT:同位素亲和标记 iTRAQ:同位素标记相对和绝对定量
BCA蛋白定量试剂盒
BCA 蛋白定量试剂盒 简介: 目前世界上最常用的蛋白浓度检测方法是:BCA 蛋白定量试剂盒(BCA Protein Assay Kit)和Bradford 蛋白定量试剂盒(Bradford Protein Assay Kit)。BCA 法与传统方法相比,更简单、更稳定、更灵敏度。BCA 法测定蛋白浓度兼容性亦很好,不受大部分样本中其他成分的影响,对于5%以内的SDS 、Triton X-100、Tween 20、 Tween 80具有很好的兼容性。BCA 法测定蛋白浓度易受螯合剂、高浓度的还原剂影响。在BCA 法测定蛋白浓度前,应尽量使EDTA 浓度≤m10M; DTT 浓度≤1mM ,2-ME ≤0.01%。 Leagene BCA Protein Assay Kit 在50~1000μg/ml 浓度范围内有较好的线性关系, 其最小检出量为25μg/ml 。 组成: 自备材料: 1、 酶标仪或分光光度计 2、 96孔板或离心管 3、 恒温箱 操作步骤(仅供参考): 1、 取蛋白标准配制液加入到蛋白标准(BSA)(20mg)中,充分溶解后配制成蛋白标准溶液,配制后可立即使用,溶解后的蛋白标准溶液应-20℃保存。 2、 取适量蛋白标准,稀释至终浓度为500μg/ml 或所需浓度。如取25μl 20mg/ml 蛋白标准,加入975μl 稀释液,充分混匀,即配制500μg/ml 蛋白标准。特别提示:待测蛋白溶解于什么样的稀释液中,蛋白标准也宜溶解于什么样的稀释液中。例如待测蛋白溶解于蔗糖中,亦取20mg/ml 蛋白标准溶解于蔗糖中。一般也可以用0.9%NaCl 或PBS 作为溶解BSA 稀释液。稀释后的500μg/ml 蛋白标准也应-20℃长期保存。 3、 根据样品数量,试剂(A):试剂(B 配制BCA 工作液,即取BCA 试剂A 和BCA 试剂B , 充分混匀,即获得BCA 工作液。例如取BCA 试剂A 和BCA 试剂B ,配制成BCA 工作液。 编号 名称 PT0001 250T PT0001 500T Storage 试剂(A): BCA 试剂A 50ml 100ml RT 避光 试剂(B): BCA 试剂B 1.5ml 3ml RT 避光 试剂(C): 蛋白标准(BSA) 20mg 20mg RT 试剂(D): 蛋白标准配制液 5ml 10ml RT 使用说明书 1份
糖化白蛋白测定试剂盒(过氧化物酶法)产品技术要求baiding
糖化白蛋白测定试剂盒(过氧化物酶法) 适用范围:用于体外定量测定人血清中糖化白蛋白和白蛋白测量浓度的比值(%)。 1.1 规格 GA校准品(选配):1×1mL,ALB校准品(选配):1×1mL; 质控品(选配):水平1:1×1mL,水平2:1×1mL。 1.2 组成:
签。 2.1 外观 2.1.1 GA试剂1:淡黄色液体。 2.1.2 GA试剂2:淡黄色至淡红色液体。 2.1.3 ALB试剂:黄绿色液体。 2.1.4 GA校准品:冻干粉,复溶后为无色至淡黄色液体,无可见不溶物。 2.1.5 ALB校准品:无色至淡黄色液体。 2.1.6质控品:冻干粉,复溶后为无色至淡黄色液体,无可见不溶物。2.1.7包装外观应整洁,标签字迹清晰,不易脱落。 2.2 净含量 液体试剂的净含量不低于标示体积。 2.3 试剂空白吸光度
2.3.1糖化白蛋白试剂空白吸光度≤0.3。 2.3.2白蛋白试剂空白吸光度≤0.5。 2.4 分析灵敏度 2.4.1糖化白蛋白样本浓度为1.4g/dL时,吸光度差值应≥0.01。 2.4.2白蛋白样本浓度为4.0g/dL时,吸光度差值应≥0.02。 2.5 线性区间 在[10.0,69.0] %的范围内,线性相关系数r≥0.990。测试浓度在[10.0,30.0] %时,绝对偏差应不超过±3%;测试浓度在[30.0,69.0]%时,相对偏差应不超过±10%。 2.6 精密度 2.6.1重复性 用高、低2个浓度的样本测试试剂盒,各重复测试10次,其变异系数(CV)应不大于10%。 2.6.2批间差 用样本分别测试3个不同批次的试剂盒,每个批次测试3次,其相对极差(R)应不大于10%。 2.7 准确度 与已上市产品进行对比试验,在[10.0,69.0] %的范围内,线性相关系数r≥0.975。测试浓度在[10.0,30.0] %时,绝对偏差应不超过±3%;测试浓度在[30.0,69.0]%时,相对偏差应不超过±10%。 2.8 质控品赋值有效性 测试结果在质控范围内。 2.9 校准品/质控品瓶内重复性 校准品/质控品瓶内重复性(CV)应不大于10%。 2.10 校准品/质控品批内瓶间差 校准品/质控品批内瓶间差(CV)应不大于10%。 2.11 溯源性 根据GB/T21415及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,校准品溯源至JCCRM611-1M。
蛋白质定量的五种方法
蛋白质定量的五种方法 令狐采学 方法一双缩脲法测定蛋白质浓度 [目的]掌握双缩脲法测定蛋白质浓度的原理和标准曲线的绘制。 [原理] 双缩脲(NH2CONHCONH2)在碱性溶液中与硫酸铜反应生成紫红色化合物,称为双缩脲反应,蛋白质分子中含有许多肽键(-CONH-)在碱性溶液中也能与Cu2+反应产生紫红色化合物。在一定范围内,其颜色的深浅与蛋白质浓度成正比。因此,可以利用比色法测定蛋白质浓度。 双缩脲法是测定蛋白质浓度的常用方法之一。操作简便、迅速、受蛋白质种类性质的影响较小,但灵敏度较差,而且特异性不高。除-CONH-有此反应外,-CONH2、-CH2NH2、-CS-NH2等基团也有此反应。 [操作] 取中试管7支,按下表操作。
各管混匀、放置37℃水浴中保温20分钟。用540nm比色,以空白管调零点,读取各管光密度值。 [计算] (一)在座标纸上以光密度为纵座标,以蛋白质浓度为横座标绘制标准曲线。 (二)从标准曲线中查出待测血清样本的蛋白质浓度(g/L),并求出人血清样本的蛋白质 浓度。 (三)再从标准管中选择一管与测定管光密度相接近者,求出人血清样本的蛋白质浓度(g/L)。 [器材] 中试管7支,l毫升刻度吸管3支,10毫升刻度吸管1支,水浴箱,721型分光光度计、坐标纸。 [试剂] (—)6N NaOH:称取240g氢氧化钠溶于1000ml水中。 (二)双缩脲试剂:称取CuS04·5H2O 3.0克,酒石酸钾9.0 克和碘化钾5.0克,分别溶解后混匀,加6N NaOH l00ml,最后加
水至1000ml,贮于棕色瓶中,避光,可长期保存。如有暗红色沉淀出现,即不能使用。 (三)0.9%NaCl。 (四)蛋白质标准液(10mg/m1),称取干燥的牛血清蛋白100.0mg,以少量生理盐水溶解后倒入l0ml容量瓶中,淋洗称量瓶数次,一并倒入容量瓶中,最后加生理盐水至刻度线,或用凯氏定氮法测定血清蛋白质含量,然后稀释成l0mg/m1作为蛋白质标准液。 (五)待测血清样本:将人血清或动物血清用生理盐水稀释10倍后再测定。 方案二Folin-酚试剂法(Lowry法)测定蛋白质浓度 [目的]掌握Lowry法测定蛋白质浓度的原理。 [原理] 蛋白质在碱性溶液中其肽键与Cu2+螯合,形成蛋白质一铜复合物,此复合物使酚试剂的磷钼酸还原,产生蓝色化合物,在一定条件下,利用蓝色深浅与蛋白质浓度的线性关系作标准曲线并测定样品中蛋白质的浓度。 [操作] 取试管7支、编号、按下表操作:
BCA蛋白浓度测定试剂盒完整
BCA蛋白浓度测定试剂盒 说明 23225蛋白质化验试剂盒:为500试管或5000微孔板的检测提供充足的试剂 23227蛋白质化验试剂盒:为250试管或2500微孔板的检测提供充足的试剂试剂盒组分: BCA 试剂 A, 1000 mL (No. 23225 产品中)或 500mL ( No. 23227 产品中),碳酸钠, 碳酸氢钠,二座咻甲酸,酒石酸钠溶于0.1 21氢氧化钠中。 BCA试剂B , 25 mL.包括4%硫酸铜 一次性标准白蛋白,2mg/ mL. 10 x 1 mL安甑,包含2 mg/mL牛血淸白蛋白(BSA)存在于0.9%盐和0.05%叠氮化钠中。 储存:以上试剂保持在室温下储存和装运 注意:如果试剂A或试剂B在低温下运输或长期储存时岀现沉淀现象,可以通过缓慢加温或轻轻搅拌溶液使沉淀物溶解。当试剂变色或确定微生物污染时请丢球试剂盒。 目录 介绍 (1) 准备标准试剂和工作试剂 (2) 准备试管 (3) 准备微型版 (3) 故障检修 (4) 有关美国热电其他产品 (5) 附加信息 (5) 参考文献 (6) 介绍 美国热电(Thermo)公司的BCA蛋白浓度测左试剂盒是基于二嚨咻甲酸(BCA)通过比色检测和赵疑测定总蛋白的洗涤剂兼容配方。该方法通过碱性介质中的一种蛋白结合了 Cu2使其显著减少转变为Cui (缩二腺反应)。用一种含二奎琳甲酸的试剂选择性的比色法高敏感的比色杯中的Cui.这种测左方法的紫色色反应产物是通过BCA的两个分子和亚铜离子螯合作用形成的。这种水溶性复合物在562nm处有强吸收>1金。在大的活性范囤内(20-2000感/mL)几乎同蛋白浓度增加呈线性关系。BCA法不是真正的终点的方法:也就是说,最终颜色继续发展。孵化之后,继续的颜色发展速度是足够慢以允许一起进行测泄大虽:样本。 大分子结构的蛋白质,肽键的数量和存在的四个特定氨基酸(半胱氨酸,胱氨酸,色氨酸和酪氨酸)拯说是与BCA形成颜色产物的原因。因此,蛋白浓度的测量通常要参照标准的一个常见的蛋白质如牛血淸白蛋白。一系列已知浓度的蛋白质稀释液是为与之相近的未知蛋白质浓度测定准备的。因为每一个未知浓度的测左都需要基于标准曲线。如果需要将一个未知蛋白精确定量,选择一个与未知蛋白特性相似的标准蛋白是可取的。例如,当测左免疫球蛋白时牛血淸丙种球蛋白可以被当做标准蛋白。以下给出了两种检测过程: 其中,试管程序需要一个较大的体积(0.1 升)的蛋白质样品。然而,因为它使用了一个样品比例为1:20的工作试剂(v/v),所以将干扰物质的影响降到最小。在酶处理程序提供了一样品处理酶,需要体积较小(10-25pL)的蛋白质样品。然而,由于使用了样品比例为1:8的工作试剂(v/v),所以在克服干扰物质浓度时灵活性降低,从而获得的检测水平较低。
定量蛋白质组学的方法有哪些 (2).doc
定量蛋白质组学的方法有哪些? 1背景和意义 从生命活动的直接执行者——蛋白质的角度研究生命现象和规律(特别是疾病防治和病 理研究)已成为研究生命科学的主要手段。而这些研究往往离不开对细胞、组织或器官中含有蛋白质种类和表达量的研究。对处不同时期、不同条件下蛋白质表达水平变化的研究,识别功能模块和路径,监控疾病的生物标志物,这些研究都需要对蛋白质进行鉴定和定量。生物质谱技术的出现和不断成熟为蛋白质差异表达分析提供了更可靠、动态范围更广的研究手段。基于质谱技术,科学家们不断开发出新的定量蛋白质组学方法,来了解细胞、组织或生物体的整体蛋白质动力学。 2方法学介绍 目前较主流的定量蛋白质组学方法有 5 种,分别是Label-free 、 iTRAQ 、 SILAC 、 MRM(MRM HR) 、和 SWATH 。简述如下: 2.1Label-free Label-free 定量,即非标记的定量蛋白质组学,不需要对比较样本做特定标记处理,只 需要比较特定肽段 /蛋白在不同样品间的色谱质谱响应信号便可得到样品间蛋白表达量的变 化,通常用于分析大规模蛋白鉴定和定量时所产生的质谱数据。 Label-free 操作简单,可以做任意样本的总蛋白质差异定量,但对实验操作的稳定性、 重复性要求较高,准确性也较标记定量差。因此,Label-free 技术适合于大样本量的定量比较,以及对无法用标记定量实现的实验设计。 2.2 iTRAQ iTRAQ 定量是目前定量蛋白质组学应用很广泛的技术,该技术的核心原理是多肽标记 和定量,将多肽的含量转化为 114、115、116 和 117 同位素的含量 (或 113、114、115、116、117、118、119 和121 的 8 标记 ),从而简化了定量的复杂性,最终通过多肽定量值回归到蛋 白的定量值,从而最终测定出不同样本之间蛋白质的差异。 iTRAQ定量不依赖样本,可检测出较低丰度蛋白,胞浆蛋白、膜蛋白、核蛋白、胞外 蛋白等,且定量准确,可同时对8 个样本进行分析,并可同时得出鉴定和定量的结果,特别 适用于采用多种处理方式或来自多个处理时间的样本的差异蛋白分析。金开瑞质谱平台应用 iTRAQ 定量技术,可鉴定多达 6000 种蛋白(以人 HepG2 为例),重复样品间的蛋白表达量 相关性可达到0.95 以上。 2.3SILAC SILAC 定量的基本原理是分别用天然同位素(轻型 )或稳定同位素(中性或重型 )标记的必 需氨基酸取代细胞培养基中相应氨基酸,细胞经 5-6 个倍增周期后,稳定同位素标记的氨基 酸完全掺入到细胞新合成的蛋白质中替代了原有氨基酸。不同标记细胞的裂解蛋白按细胞数或蛋 白量等比例混合,经分离、纯化后进行质谱鉴定,根据一级质谱图中两个同位素型肽段的面积 比较进行相对定量,属于体内代谢标记法。 SILAC 属于体内标记技术,更接近样品真实状态,标记效率高达100% ,且标记效果稳 1
蛋白质定量检测方法
Bradford法蛋白定量(Bradford Protein Assay ) Bradford Assay is a rapid and accurate method commonly used to determine the total protein concentration of a sample. The assay is based on the observation that the absorbance maximum for an acidic solution of Coomassie Brilliant Blue G-250 shifts from 465 nm to 595 nm when binding to protein occurs. Both hydrophobic and ionic interactions stabilize the anionic form of the dye, causing a visible color change. Within the linear range of the assay (~5-25 mcg/mL), the more protein present, the more Coomassie binds. Reference Bradford, M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. (1976) 72, 248-254. 考马斯亮蓝染色法(Bradford法)测定蛋白质含量 原理 1976年Bradford建立了用考马斯亮蓝G250与蛋白质结合的原理,迅速、敏感的定量测定蛋白质的方法。染料与蛋白质结合后引起染料最大吸收的改变,从465nm变为595nm,光吸收增加。蛋白质-染料复合物具有高的消光系数,因此大大提高了蛋白质测定的灵敏度,最低检出量为1μg蛋白。染料与蛋白质的结合是很迅速的过程,大约需2min,结合物的颜色在1h内是稳定的。一些阳离子,如K+,Na+,Mg2+,(NH4)2SO4,乙醇等物质不干扰测定,而大量的去污剂如TritonX100,SDS等严重干扰测定,少量的去污剂可通过用适当的对照而消除。由于染色法简单迅速,干扰物质少,灵敏度高,现已广泛应用于蛋白质含量的测定。 操作 一、标准方法 取含10~100μg蛋白质溶液于小试管中,用双蒸水或缓冲液调体积到0.1mL,然后加入5mL蛋白试剂,充分振荡混合,2min后于595nm测定光吸收值。以0.1mL 双蒸水或缓冲液及5mL蛋白试剂作为空白对照。 二、微量蛋白分析法 取含1~10μg蛋白质溶液,用双蒸水调体积到0.8mL,加0.2mL蛋白试剂,充分振荡混合,2min后于595nm测定光吸收值,以0.8mL双蒸水及0.2mL蛋白试剂作为空白对照。用不同浓度的蛋白质溶液作标准曲线,以蛋白质浓度为横坐
C-反应蛋白测定试剂盒(免疫比浊法)产品技术要求zhongshengbeikong
C-反应蛋白测定试剂盒(免疫比浊法) 适用范围:本试剂盒与ABBOTT ARCHITECT c4000/c8000/c16000全自动生化分析仪配套使用,用于体外定量测定人血清中C-反应蛋白的含量。 1.1包装规格 液体双剂型 试剂1(R1):60mL×1,试剂2(R2):15mL×1; 试剂1(R1):80mL×2,试剂2(R2):20mL×2。 1.2主要组成成分 1.2.1 试剂1(R1)(液体) 三(羟甲基)氨基甲烷10mmol/L 1.2.2 试剂2(R2)(液体) 羊抗人C-反应蛋白抗体浓度根据效价而定 2.1 外观 试剂盒中各组件的外观应满足: 2.1.1 试剂 1(R1)应为无色透明溶液,无杂质、无絮状物,外包装完整无破损; 2.1.2 试剂2(R2)应为淡黄色至淡粉色溶液,无杂质、无絮状物,外包装完整无破损。 2.2 净含量 液体试剂净含量应不少于标示值。 2.3试剂空白吸光度 在波长340nm处(光径1cm),试剂空白吸光度(A)应≤0.100。 2.4 准确度
测定ERM-DA474,相对偏差应不超过±10%。 2.5分析灵敏度 对应于浓度为9mg/L的CRP所引起的吸光度差值(△A)的绝对值在 0.006~0.030的范围内。 2.6重复性 重复测定高、低浓度样本,变异系数(CV)应≤ 5%。 2.7批间差 测定同一样本,批间差(R)应≤ 5%。 2.8线性范围 在[1,250]mg/L范围内,线性相关系数(r)应≥0.990; 在(5,250]mg/L范围内,线性相对偏差应不超过±10%, 在[1,5]mg/L范围内,线性绝对偏差应不超过±0.5mg/L。 2.9试剂稳定性 2.9.1效期稳定性 原包装的试剂盒在2℃~8℃避光贮存,有效期为12个月。试剂有效期满后3个月以内,试剂性能应符合2.1、2.3、2.4、2.5、2.6、2.8的要求。2.9.2开盖稳定性 开盖后,在2℃~8℃避光保存,可稳定30天;开盖稳定期满后1天内,试剂性能应符合2.1、2.3、2.4、2.5、2.6、2.8的要求。
尿液蛋白质定量测定方法及临床意义
尿液蛋白质定量测定方法及临床意义 【摘要】正常人尿液中含有微量的蛋白质,每天排出量在150mg 以下,其中以白蛋白占多数,随不同病种有一定量的球蛋白和其它蛋白。随着肾病科研工作的开展,以观察患者每天排出蛋白质的量以示病情的变化,因此尿液蛋白质定量在临床上有实际应用价值,已成为医院化验室常规的检验项目。 【关键词】尿液蛋白质检测 1丽春红-S法 尿液标本中的蛋白质与丽春红-S染料混匀后一起被三氯醋酸沉淀,将沉淀物溶解于碱性溶液中,此时溶液呈紫色,显色深度与蛋白质浓度成正比。 1.1试剂 三氯乙酸-丽春红-S试剂原液:称取丽春红-S1.0g,加入到1000ml300g/L三氯乙酸中溶解。 三氯乙酸-丽春红-S试剂应用液:将原液用蒸馏水按1:10稀释,放置室温稳定数月。 蛋白定性试剂。0.2mol/L氢氧化钠溶液。 蛋白标准曲线:把定值蛋白稀释成不同的浓度,按操作测定其吸光度,以吸光度为横坐标,以稀释后的蛋白浓度为纵坐标绘制标准曲线。 1.2操作先做尿蛋白定性试验,以适当稀释标本。在试管中加入100μl标本,再加入1ml三氯乙酸一丽春红-S应用液,混匀后以3000r
/min离心15分钟,吸去上清液,倒置于洁净滤纸上。在沉淀中加入0.2mol/L氢氧化钠溶液lml,用560nm波长测定其吸光度,查标准曲线的蛋白含量。 1.3参考值46.5±18.1mg/L 1.4注意事项:尿液如被稀释应乘以稀释倍数。尿中血红蛋白含量>5mg/L时影响结果。离心后上清必须全部弃去,若沉淀中夹带有丽春红-S影响比色结果。 2双缩脲比色法 以磷钨酸乙醇溶液沉淀尿中的蛋白质,在碱性介质中蛋白质与铜离子形成紫红色络合物,与标准液比色即可得出尿中蛋白质的含量。 2.1试剂 蛋白沉淀液:称取磷钨酸7.5g,加入30ml蒸馏水、95%乙醇385ml、浓盐酸25ml。 双缩脲液:(1)称取枸橼酸钠34.6g,无水碳酸钠20g,加入120ml 蒸馏水使其溶解;(2)称取硫酸铜3.46g,加入20ml蒸馏水使其溶解。将(1)、(2)混合,加入蒸馏水至200ml,备用。0.75mol/L氢氧化钠溶液。蛋白标准液(1.5g/L):称取150mg结晶型冻干人血清白蛋白,加入100ml的3g/L苯甲酸溶液溶解。 2.2操作取5ml24小时混合尿液,2500~3000r/min离心5分钟,取上清备检。混匀放入56℃水浴15分钟,取出后离心,倾上清留沉淀。0.75mol/1 NaOH1.51.51.5
Bradford法蛋白定量试剂盒
Bradford法蛋白定量试剂盒 产品简介: 目前世界上最常用的蛋白浓度检测方法是:BCA蛋白浓度测定试剂盒(BCA Protein Assay Kit)和Bradford法蛋白定量试剂盒(Bradford Protein Assay Kit) 。Bradford 法与传统方法相比,更简单、更稳定、兼容性更好。 Bradford法测定蛋白浓度不受绝大部分样品中的化学物质的影响。样品中β-巯基乙醇的浓度可高达1M,DTT的浓度可高达5mM。但受高浓度的去垢剂的影响, 故在用Bradford Protein Assay Kit进行蛋白定量的时候,需确保SDS低于0.01%,Triton X-100低于0.05%,Tween 20, 60, 80低于0.015%。含高浓度去污剂的蛋白定量,建议采用Leagene BCA Protein Assay Kit。 Leagene Bradford Protein Assay Kit检测速度很快,少量样品一般只需10min即可完成检测。检测浓度下限达到25μg/ml,最小检测蛋白量达到0.5μg,待测样品体积为1~20μl。在50~1000μg/ml浓度范围内有较好的线性关系。 产品组成: 主要成分: 试剂(A): 主要由G250、缓冲液等组成。 试剂(B): 主要由牛血清白蛋白(BSA)、防腐剂等组成。 自备材料: 1、酶标仪或分光光度计 2、微量移液器 3、双蒸水 4、96孔板 操作步骤(仅供参考): 1、完全溶解蛋白标准(BSA 5mg/ml),按蛋白标准:稀释液=1:9进行稀释,如取蛋白标准
10μl稀释溶解于稀释液90μl,使终浓度为0.5mg/ml。注意,蛋白样品在什么溶液中,蛋白标准也宜用什么溶液稀释。也可以用0.9%NaCl或PBS稀释蛋白标准(BSA 5mg/ml)。 2、将标准品按0, 1, 2, 4, 8, 12, 16, 20μl加到96孔板的蛋白标准孔中,加蛋白标准稀释 液补足到20μl。 3、加适当体积样品到96孔板的样品孔中,补加标准品稀释液到20μl。 4、各孔加入200μl G250染色液,室温放置3~5min。 5、用酶标仪测定A595,或560~610nm之间的其它波长的吸光度。 6、根据标准曲线计算出样品中的蛋白浓度。 注意事项: 1、G250染色液使用前充分混匀。 2、G250染色液回复至室温再使用,有利于提高检测的灵敏度。 3、蛋白标准在全部溶解后先混匀,再稀释成一系列不同浓度的蛋白标准。 4、待测蛋白溶解于什么样的稀释液中,蛋白标准也宜溶解于什么样的稀释液中,否者待测蛋白与蛋白标准中所含非蛋白成分不一致,有可能导致测定不准确。 5、需可检测560~610nm之间波长的酶标仪一台,最佳检测波长为595nm,并需96孔板。 6、建议每次测定时都做标准曲线。因为测定时颜色会随着时间的延长不断加深,并且显色反应的速度和温度有关,所以除非精确控制显色反应的时间和温度,否则如需精确测定宜每次都做标准曲线。 7、如果没有酶标仪,也可以使用普通的分光光度计测定,但测定时,考虑根据比色皿的最小检测体积。应按比例适当加大BCA工作液的用量使总体积不小于最小检测体积,样品和标准品的用量亦相应按比例放大。使用分光光度计测定蛋白浓度时,每个试剂盒可以测定的样品数量可能会显著减少。 8、为了您的安全和健康,请穿实验服并戴一次性手套操作。 有效期:12个月有效。 相关产品: 产品编号 产品名称 PE0025SDS-PAGE蛋白加样缓冲液(5×) PE0081Tris-HCl缓冲液(1.5mol/L,pH8.8) PE0092Tris-甘氨酸电泳缓冲液(5×SDS-PAGE) PE0103丙烯酰胺:亚甲基双丙烯酰胺溶液(30%Acr-Bis,29:1)
