元素周期表(Periodic Table)-multiple version
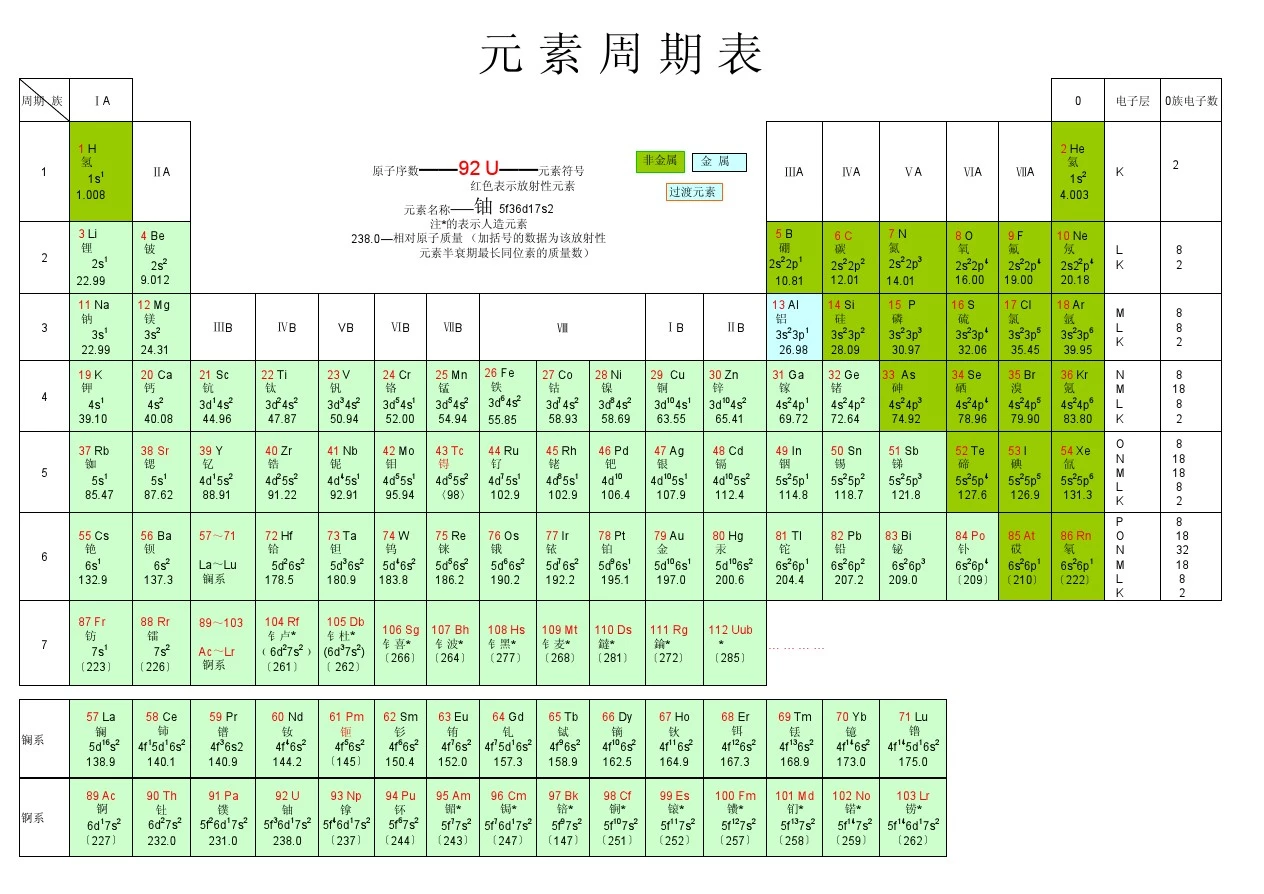
镧系57 La
镧
5d16s2
138.9
58 Ce
铈
4f15d16s2
140.1
59 Pr
镨
4f36s2
140.9
60 Nd
钕
4f46s2
144.2
61 Pm
钷
4f56s2
〔145〕
62 Sm
钐
4f66s2
150.4
63 Eu
铕
4f76s2
152.0
64 Gd
钆
4f75d16s2
157.3
65 Tb
铽
4f96s2
158.9
66 Dy
镝
4f106s2
162.5
67 Ho
钬
4f116s2
164.9
68 Er
铒
4f126s2
167.3
69 Tm
铥
4f136s2
168.9
70 Yb
镱
4f146s2
173.0
71 Lu
镥
4f145d16s2
175.0
锕系
89 Ac
锕
6d17s2
〔227〕
90 Th
钍
6d27s2
232.0
91 Pa
镤
5f26d17s2
231.0
92 U
铀
5f36d17s2
238.0
93 Np
镎
5f46d17s2
〔237〕
94 Pu
钚
5f67s2
〔244〕
95 Am
镅*
5f77s2
〔243〕
96 Cm
锔*
5f76d17s2
〔247〕
97 Bk
锫*
5f97s2
〔147〕
98 Cf
锎*
5f107s2
〔251〕
99 Es
锿*
5f117s2
〔252〕
100 Fm
镄*
5f127s2
〔257〕
101 Md
钔*
5f137s2
〔258〕
102 No
锘*
5f147s2
〔259〕
103 Lr
铹*
5f146d17s2
〔262〕
/'silv ?(r)//'l?θ?naid//'haidr ?d ??n/氢
/'li θi ?m/锂
/b ?'rili ?m/铍/'b ??r ?n/硼/'k ɑ?b ?n/碳/'naitr ?d ??n/氮/'?ksid ??n/氧/'hi ?li ?m/
氦/'ni ??n/
氖/'fl ??ri ?n/氟/?lj ?'mini ?m/铝/'silik ?n/硅 /'f ?sf ?r ?s/磷/‘s ?lf ?(r)/硫/'kl ??ri ?n/氯/’ɑ?g ?n/
氩 /‘g?li ?m/镓/d ???'meini ?m/锗 /'ɑ?snik/砷/s ?'li ?ni ?m/硒/'br ??mi ?n/ 溴/'kript ?n/
氪/'indi ?m/铟/tin/锡/'?ntim ?ni/锑 /'telj ??ri ?m/碲 /'ai ?di ?n/碘/'zen ?n/氙/'θ?li ?m/铊/li ?d/铅/'bizm ?θ/铋/'p ?l ??ni ?m/钋/'?st ?ti ?n/砹/'reid ?n/
氡/'s ??di ?m/钠
/m?g'ni ?zi ?m/镁/p ?‘t?si ?m/钾
/'k?lsi ?m/钙/'sk?ndi ?m/钪/ti'teini ?m/钛/v ?'neidi ?m/钒/'kr ??mi ?m/铬/'m??g ?ni ?z/锰/ai ?n/铁/'k ??b ??lt/钴/'nikl/镍/'k ?p ?(r)/铜 /zi ?k/锌/r ?'bidi ?m/铷
/'str ?nti ?m/锶/'itri ?m/钇/z ??'k ??ni ?m/钇/nai'??bi ?m/铌/m ?'libd ?n ?m/钼/tek'ni ????m/锝/ru ?'θi ?ni ?m/
钌/'r ??di ?m/铑/p ?'leidi ?m/钯/'k?dmi ?m/镉/'m ??kj ?ri/汞/g ??ld/金/'pl?tin ?m/铂/I'ridi ?m/铱/'?zmi ?m/锇/'ri ?ni ?m/铼/'t ??st ?n/钨/'t?nt ?l ?m/钽/'h?fni ?m/铪 /'silv ?(r)/银 /'l?n θ?naid/镧/'be ?ri ?m/钡/'si ?zi ?m/铯
/'fr?nsi ?m/钫
/'reidi ?m/镭/?k'tini ?m/
锕/'l?n θ?n ?m/镧/'si ?ri ?m/铈/preizi ??dimi ?m/镨/ni ???'dimi ?m/钕/pr ?'mi ?θi ?m/钜/s ?'me ?ri ?m/钐/j ??r'??pi ?m/铕/g?d ?'lini ?m/钆/'t ??bi ?m/铽/dis'pr ??zi ?m/镝/dis'pr ??zi ?m/镝 /'??bi ?m/铒 /'θu ?li ?m/铥/i't ??bi ?m/镱/lu ?'ti ??i ?m/
镏/?k'tini ?m/锕
/'θ??ri ?m/钍/pr ??t?k'tini ?m/镤/ju'reini ?m/
铀/'?lk ?lai/ 碱金属
/'?lk ?lain/ 碱土金属
金属
/'metl ??d/类金属
非金属/'h?l ?d ??n/ 卤素
/'n ??bl/ 稀有气体
/'l?n θ?naid/ or /?k'tinaid/ 稀土元素
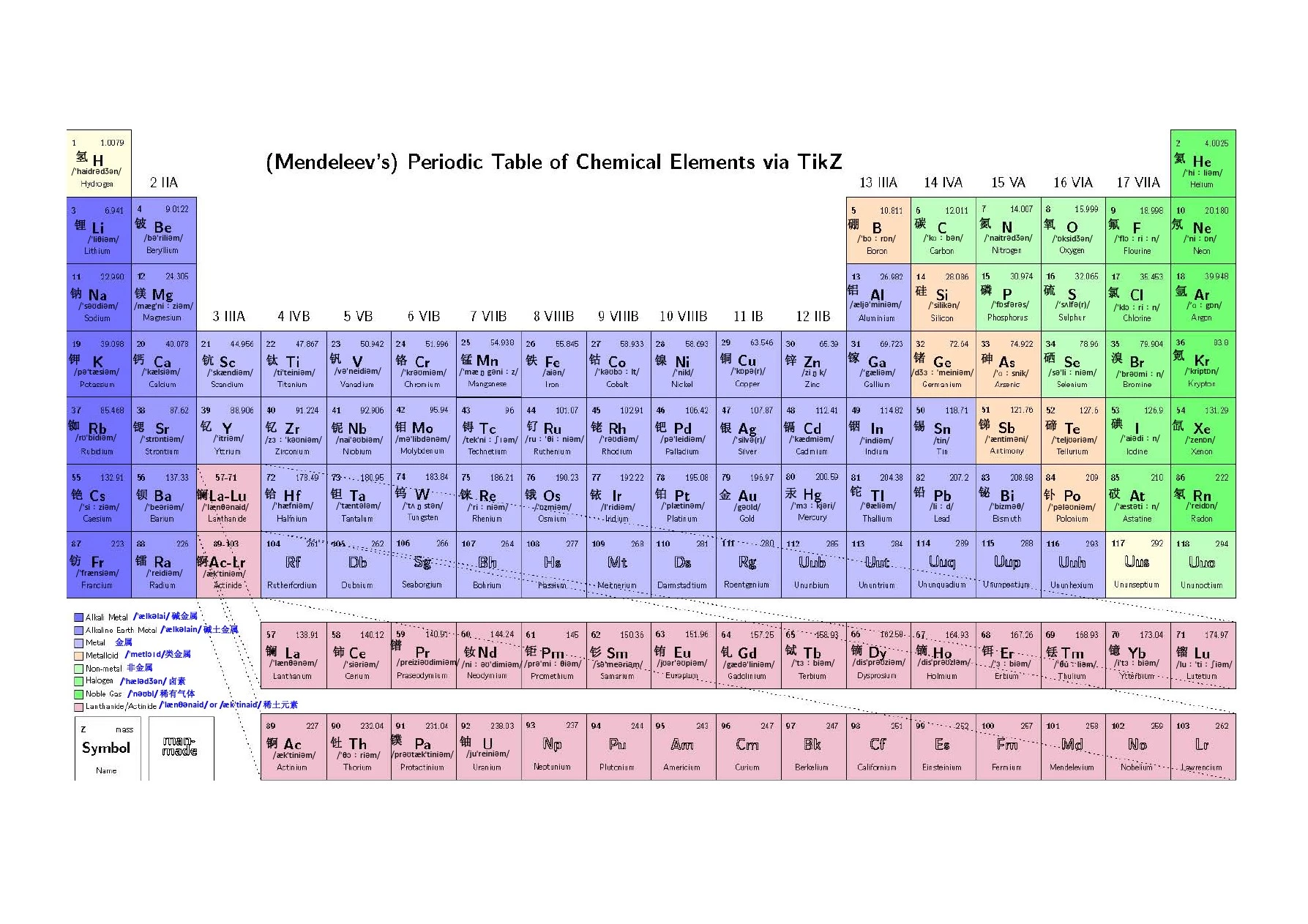
NOBLE GASES
1H 1.008
Hydrogen
1s
1Oxidation States Electroneg.
1
2.2Atomic Radius Ionic Radius 37
–Electron Affinity 1st Ion. Pot.0.7513.603Li 6.94Lithium 1s 22s 1Oxidation States Electroneg.10.98Atomic Radius Ionic Radius 152(+1)76Electron Affinity 1st Ion. Pot.0.62 5.394Be 9.01Beryllium
1s 2
2s 2Oxidation States Electroneg.2 1.57Atomic Radius Ionic Radius 111(+2)45Electron Affinity 1st Ion. Pot.Unstable Anion 9.3212Mg 24.31Magnesium [Ne]3s 2Oxidation States Electroneg.2 1.31Atomic Radius Ionic Radius 160(+2)72Electron Affinity
1st Ion. Pot.Unstable Anion 7.6521Sc 44.96Scandium [Ar]3d 14s 2Oxidation States Electroneg.3 1.36Atomic Radius Ionic Radius 161(+3)75Electron Affinity 1st Ion. Pot.0.19 6.5639Y 88.91Yttrium [Kr]4d 15s 2Oxidation States Electroneg.3 1.22Atomic Radius Ionic Radius 178(+3)102Electron Affinity 1st Ion. Pot.0.31 6.2257La 138.9Lanthanum [Xe]5d 16s 2Oxidation States Electroneg.3 1.10Atomic Radius Ionic Radius 187(+3)116Electron Affinity 1st Ion. Pot.0.5 5.7789Ac 227Actinium [Rn]6d 17s 2Oxidation States Electroneg.
3 1.1Atomic Radius Ionic Radius 188(+3) -Electron Affinity 1st Ion. Pot.
– 5.17104Rf 261Rutherfordium [Rn]5f 146d 27s 2disc.1964105Db 262Dubnium [Rn]5f 146d 37s 2disc.196758Ce 140.1Cerium [Xe]4f 15d 16s 2Oxidation States Electroneg.3,4 1.12Atomic Radius Ionic Radius 183(+3)114Electron Affinity 1st Ion. Pot.– 5.5459Pr 140.9Praseodymium [Xe]4f 36s 2Oxidation States Electroneg.3,4 1.13Atomic Radius Ionic Radius 182(+3)113Electron Affinity 1st Ion. Pot.– 5.4660Nd 144.2Neodymium [Xe]4f 46s 2Oxidation States Electroneg.3 1.14Atomic Radius Ionic Radius 181(+3)114Electron Affinity 1st Ion. Pot.– 5.5361Pm 145Promethium [Xe]4f 56s 2Oxidation States Electroneg.3–Atomic Radius Ionic Radius 181(+3)109Electron Affinity 1st Ion. Pot.– 5.5562Sm 150.4Samarium [Xe]4f 66s 2Oxidation States Electroneg.3,2 1.17Atomic Radius Ionic Radius 180(+3)108Electron Affinity 1st Ion. Pot.– 5.6463Eu 152.0Europium [Xe]4f 76s 2Oxidation States Electroneg.3,2–Atomic Radius Ionic Radius 199(+3)107Electron Affinity 1st Ion. Pot.– 5.6764Gd 157.3Gadolinium [Xe]4f 75d 16s 2Oxidation States Electroneg.3 1.20Atomic Radius Ionic Radius 179(+3)105Electron Affinity 1st Ion. Pot.– 6.1565Tb 158.9Terbium [Xe]4f 96s 2Oxidation States Electroneg.3,4–Atomic Radius Ionic Radius 176(+3)118Electron Affinity 1st Ion. Pot.– 5.8666Dy 162.5Dysprosium [Xe]4f 106s 2Oxidation States Electroneg.3 1.22Atomic Radius Ionic Radius 175(+3)103Electron Affinity 1st Ion. Pot.– 5.9467Ho 164.9Holmium [Xe]4f 116s 2Oxidation States Electroneg.3 1.23Atomic Radius Ionic Radius 174–Electron Affinity 1st Ion. Pot.– 6.0268Er 167.3Erbium [Xe]4f 126s 2Oxidation States Electroneg.3 1.24Atomic Radius Ionic Radius 173(+3)100Electron Affinity 1st Ion. Pot.– 6.1169Tm 168.9Thulium [Xe]4f 136s 2Oxidation States Electroneg.3,2 1.25Atomic Radius Ionic Radius 173(+3)109Electron Affinity 1st Ion. Pot.– 6.1870Yb 173.0Ytterbium [Xe]4f 146s 2Oxidation States Electroneg.3,2–Atomic Radius Ionic Radius 194(+3)99Electron Affinity 1st Ion. Pot.– 6.2571Lu 175.0Lutetium [Xe]4f 145d 16s 2Oxidation States Electroneg.3 1.0Atomic Radius Ionic Radius 172(+3)98Electron Affinity 1st Ion. Pot.– 5.43
90Th 232.0Thorium [Rn]6d 27s 2Oxidation States Electroneg.4 1.3Atomic Radius Ionic Radius 180(+4)94Electron Affinity 1st Ion. Pot.– 6.0891Pa 231.0Protactinium [Rn]5f 26d 17s 2Oxidation States Electroneg.5,4 1.5Atomic Radius Ionic Radius 161(+5)78Electron Affinity 1st Ion. Pot.– 5.8992U 238.0Uranium [Rn]5f 36d 17s 2Oxidation States Electroneg.6,5,4,3 1.7Atomic Radius Ionic Radius 139(+6)73Electron Affinity 1st Ion. Pot.– 6.1993Np 237Neptunium [Rn]5f 46d 17s 2Oxidation States Electroneg.6,5,4,3 1.3Atomic Radius Ionic Radius –(+5)75Electron Affinity 1st Ion. Pot.– 6.2794Pu 244Plutonium [Rn]5f 67s 2Oxidation States Electroneg.6,5,4,3 1.3Atomic Radius Ionic Radius 151(+4)86Electron Affinity 1st Ion. Pot.– 6.0695Am 243Americium [Rn]5f 77s 2Oxidation States Electroneg.6,5,4,3–Atomic Radius Ionic Radius 131(+3)98Electron Affinity 1st Ion. Pot.– 5.9996Cm 247Curium [Rn]5f 76d 17s 2Oxidation States Electroneg.3–Atomic Radius Ionic Radius –(+3)97Electron Affinity 1st Ion. Pot.– 6.0297Bk 247Berkelium [Rn]5f 97s 2Oxidation States Electroneg.4,3–Atomic Radius Ionic Radius –(+3)96Electron Affinity 1st Ion. Pot.– 6.2398Cf 251Californium [Rn]5f 107s 2Oxidation States Electroneg.3–Atomic Radius Ionic Radius –(+3)95Electron Affinity 1st Ion. Pot.– 6.3099Es 252Einsteinium [Rn]5f 117s 2Oxidation States Electroneg.3–Atomic Radius Ionic Radius ––Electron Affinity 1st Ion. Pot.– 6.42100Fm 257Fermium [Rn]5f 127s 2Oxidation States Electroneg.3–Atomic Radius Ionic Radius ––Electron Affinity 1st Ion. Pot.– 6.50101Md 258Mendelevium [Rn]5f 137s 2Oxidation States Electroneg.3,2–Atomic Radius Ionic Radius ––Electron Affinity 1st Ion. Pot.– 6.58102No 259Nobelium [Rn]5f 147s 2Oxidation States Electroneg.3,2–Atomic Radius Ionic Radius ––Electron Affinity 1st Ion. Pot.– 6.65103Lr 262Lawrencium [Rn]5f 146d 17s 2Oxidation States Electroneg.3–Atomic Radius Ionic Radius ––Electron Affinity 1st Ion. Pot.
––
106Sg 266Seaborgium [Rn]5f 146d 47s 2disc.1974107Bh 264Bohrium [Rn]5f 146d 57s 2disc.1981108Hs 269Hassium [Rn]5f 146d 67s 2disc.1984109Mt 268Meitnerium [Rn]5f 146d 77s 2disc.1982110Ds 281Darmstadtium [Rn]5f 146d 97s 1Darmstats, Germany
111Uuu 272Unununium disc.1994Darmstats, Germany 112Uub 277Ununbium disc.1996Darmstats, Germany 113Uut 284Ununtrium disc.2004Dubna, Russia 114Uuq 289Ununquadium disc.1999Dubna, Russia 115Uup 288Ununpentium disc.2004Dubna, Russia 116?
?Notdiscovered - -117??Notdiscovered --118??Notdiscovered - -72Hf 178.5Hafnium [Xe]4f 145d 26s 2Oxidation States Electroneg.4 1.3Atomic Radius Ionic Radius 156(+4)83Electron Affinity 1st Ion. Pot.~0 6.8373Ta 180.9Tantalum [Xe]4f 145d 36s 2Oxidation States Electroneg.5 1.5Atomic Radius Ionic Radius 143(+5)64Electron Affinity 1st Ion. Pot.0.327.8974W 183.8Tungsten [Xe]4f 145d 46s 2Oxidation States Electroneg.6,5,4,3,2 1.7Atomic Radius Ionic Radius 137(+6)60Electron Affinity 1st Ion. Pot.0.867.9875Re 186.2Rhenium [Xe]4f 145d 56s 2Oxidation States Electroneg.7,6,4,2,-1 1.9Atomic Radius Ionic Radius 137(+7)53Electron Affinity 1st Ion. Pot.0.157.8876Os 190.2Osmium [Xe]4f 145d 66s 2Oxidation States Electroneg.2,3,4,6,8 2.2Atomic Radius Ionic Radius 134(+4)63Electron Affinity 1st Ion. Pot.1.108.777Ir 192.2Iridium [Xe]4f 145d 76s 2Oxidation States Electroneg.2,3,4,6 2.2Atomic Radius Ionic Radius 136(+4)63Electron Affinity 1st Ion. Pot.1.579.178Pt 195.1Platinum [Xe]4f 145d 96s 1Oxidation States Electroneg.2,4 2.2Atomic Radius Ionic Radius 139(+4)63Electron Affinity 1st Ion. Pot.2.139.079Au 197.0Gold [Xe]4f 145d 106s 1Oxidation States Electroneg.3,1 2.4Atomic Radius Ionic Radius 144(+3)85Electron Affinity 1st Ion. Pot.2.319.2380Hg 200.6Mercury [Xe]4f 145d 106s 2Oxidation States Electroneg.2,1
1.9Atomic Radius Ionic Radius 150(+2)102Electron Affinity
1st Ion. Pot.Unstable Anion 10.4481Tl 204.4Thallium [Xe]4f 145d 106s 2p 1Oxidation States Electroneg.3,1 1.8Atomic Radius Ionic Radius 170(+1)159Electron Affinity 1st Ion. Pot.0.2 6.1182Pb 207.2Lead [Xe]4f 145d 106s 2p 2Oxidation States Electroneg.4,2 1.8Atomic Radius Ionic Radius 175(+2)119Electron Affinity 1st Ion. Pot.0.367.4283Bi 209.0Bismuth [Xe]4f 145d 106s 2p 3Oxidation States Electroneg.3,5 1.9Atomic Radius Ionic Radius 155(+3)103Electron Affinity 1st Ion. Pot.0.957.2984Po 209Polonium [Xe]4f 145d 106s 2p 4Oxidation States Electroneg.4,2 2.0Atomic Radius Ionic Radius 118(+4)–Electron Affinity 1st Ion. Pot.1.98.4240Zr 91.22Zirconium [Kr]4d 25s 2Oxidation States Electroneg.4 1.33Atomic Radius Ionic Radius 159(+4)84Electron Affinity 1st Ion. Pot.0.43 6.6341Nb 92.91Niobium [Kr]4d 45s 1Oxidation States Electroneg.5,3 1.60Atomic Radius Ionic Radius 143(+5)64Electron Affinity 1st Ion. Pot.0.90 6.7642Mo 95.94Molybdenum [Kr]4d 55s 1Oxidation States Electroneg.6,5,4,3,2 2.16Atomic Radius Ionic Radius 136(+6)59Electron Affinity 1st Ion. Pot.0.757.0943Tc 98Technetium [Kr]4d 55s 2Oxidation States Electroneg.7 2.10Atomic Radius Ionic Radius 135–Electron Affinity 1st Ion. Pot.0.557.2844Ru 101.1Ruthenium [Kr]4d 75s 1Oxidation States Electroneg.2,3,4,6,8 2.20Atomic Radius Ionic Radius 133(+3)68Electron Affinity 1st Ion. Pot.1.057.3645Rh 102.9Rhodium [Kr]4d 85s 1Oxidation States Electroneg.2,3,4 2.28Atomic Radius Ionic Radius 135(+3)67Electron Affinity 1st Ion. Pot.1.147.4646Pd 106.4Palladium [Kr]4d 10Oxidation States Electroneg.2,4 2.20Atomic Radius Ionic Radius 138(+2)64Electron Affinity 1st Ion. Pot.0.568.3447Ag 107.9Silver [Kr]4d 105s 1Oxidation States Electroneg.1 1.93Atomic Radius Ionic Radius 145(+1)115Electron Affinity 1st Ion. Pot.1.307.5848Cd 112.4Cadmium [Kr]4d 105s 2Oxidation States Electroneg.2 1.69Atomic Radius Ionic Radius 149(+2)95Electron Affinity
1st Ion. Pot.Unstable Anion 8.9949In 114.8Indium [Kr]4d 105s 2p 1Oxidation States Electroneg.3 1.78Atomic Radius Ionic Radius 163(+3)80Electron Affinity 1st Ion. Pot.0.30 5.7950Sn 118.7Tin [Kr]4d 105s 2p 2Oxidation States Electroneg.
4,2 1.96Atomic Radius Ionic Radius 141(+4)45Electron Affinity 1st Ion. Pot.1.117.3422Ti 47.87Titanium [Ar]3d 24s 2Oxidation States Electroneg.4 1.54Atomic Radius Ionic Radius 145(+4)61Electron Affinity 1st Ion. Pot.0.08 6.8323V 50.94Vanadium [Ar]3d 34s 2Oxidation States Electroneg.5.3 1.63Atomic Radius Ionic Radius 131(+5)54Electron Affinity 1st Ion. Pot.0.53 6.7524Cr 52.00Chromium [Ar]3d 54s 1Oxidation States Electroneg.6,3,2 1.66Atomic Radius Ionic Radius 125(+3)62Electron Affinity 1st Ion. Pot.0.67 6.7725Mn 54.94Manganese [Ar]3d 54s 2Oxidation States Electroneg.7,6,4,2,3 1.55Atomic Radius Ionic Radius 137(+2)67Electron Affinity
1st Ion. Pot.Unstable Anion 7.4326Fe 55.85Iron [Ar]3d 64s 2Oxidation States Electroneg.2,3 1.83Atomic Radius Ionic Radius 124(+3)55Electron Affinity 1st Ion. Pot.0.1517.9027Co 58.93Cobalt [Ar]3d 74s 2Oxidation States Electroneg.2,3 1.88Atomic Radius Ionic Radius 125(+2)65Electron Affinity 1st Ion. Pot.0.667.8828Ni 58.69Nickel [Ar]3d 84s 2Oxidation States Electroneg.2,3 1.91Atomic Radius Ionic Radius 125(+2)69Electron Affinity 1st Ion. Pot.1.167.6429Cu 63.55Copper [Ar]3d 104s 1Oxidation States Electroneg.2,1 1.90Atomic Radius Ionic Radius 128(+2)73Electron Affinity 1st Ion. Pot.1.247.7330Zn 65.39Zinc [Ar]3d 104s 2Oxidation States Electroneg.2 1.65Atomic Radius Ionic Radius 133(+2)74Electron Affinity 1st Ion. Pot.Unstable Anion 9.3931Ga 69.72Gallium [Ar]3d 104s 2p 1Oxidation States Electroneg.3 1.81Atomic Radius Ionic Radius 122(+3)62Electron Affinity 1st Ion. Pot.0.3 5.1013Al 26.98Aluminum [Ne]3s 2p 1Oxidation States Electroneg.3 1.61Atomic Radius Ionic Radius 143(+3)54Electron Affinity 1st Ion. Pot.0.44 5.995B 10.81Boron 1s 22s 2p 1Oxidation States Electroneg.3 2.04Atomic Radius Ionic Radius 80–Electron Affinity 1st Ion. Pot.0.288.306C 12.01Carbon 1s 22s 2p 2Oxidation States Electroneg.4,2 2.55Atomic Radius Ionic Radius 77(+4)16Electron Affinity 1st Ion. Pot.1.2611.267N 14.01Nitrogen 1s 22s 2p 3Oxidation States Electroneg.3,5,4,2 3.04Atomic Radius Ionic Radius 74(+3)16Electron Affinity 1st Ion. Pot.Unstable Anion 14.538O 16.00Oxygen 1s 22s 2p 4Oxidation States Electroneg.-2 3.44Atomic Radius Ionic Radius 74(-2)140Electron Affinity 1st Ion. Pot.1.4613.629F 19.00Fluorine 1s 22s 2p 5Oxidation States Electroneg.-1 3.98Atomic Radius Ionic Radius 71(-1)133Electron Affinity 1st Ion. Pot.3.4017.4210Ne 20.18Neon 1s 22s 2p 6Oxidation States Electroneg.––Atomic Radius Ionic Radius ––Electron Affinity 1st Ion. Pot.Unstable Anion 21.572He 4.003Helium 1s 2Oxidation States Electroneg.––Atomic Radius Ionic Radius ––Electron Affinity 1st Ion. Pot.Unstable Anion 24.5914Si 28.09Silicon [Ne]3s 2p 2Oxidation States Electroneg.4 1.90Atomic Radius Ionic Radius 118(+4)40Electron Affinity 1st Ion. Pot.1.398.1515P 30.97Phosphorus [Ne]3s 2p 3Oxidation States Electroneg.3,5,4
2.19Atomic Radius
Ionic Radius 110(+5)17Electron Affinity 1st Ion. Pot.0.7510.4933As 74.92Arsenic [Ar]3d 104s 2p 3Oxidation States Electroneg.3,5 2.18Atomic Radius Ionic Radius 125(+3)58Electron Affinity 1st Ion. Pot.0.819.8152Te 127.6Tellurium [Kr]4d 105s 2p 4Oxidation States Electroneg.2,4,6
2.10Atomic Radius
Ionic Radius 143(-2)221Electron Affinity 1st Ion. Pot.1.979.0185At 210Astatine [Xe]4f 145d 106s 2p 5Oxidation States Electroneg.1,3,5,7
2.2Atomic Radius
Ionic Radius ––Electron Affinity 1st Ion. Pot.2.8-20Ca 40.08Calcium [Ar]4s 2Oxidation States Electroneg.2 1.00Atomic Radius Ionic Radius 197(+2)100Electron Affinity 1st Ion. Pot.0.04 6.1138Sr 87.62Strontium [Kr]5s 2Oxidation States Electroneg.20.95Atomic Radius Ionic Radius 215(+2)126Electron Affinity 1st Ion. Pot.0.11 5.7056Ba 137.3Barium [Xe]6s 2Oxidation States Electroneg.20.89Atomic Radius Ionic Radius 217(+2)142Electron Affinity 1st Ion. Pot.0.15 5.2188Ra 226Radium [Rn]7s 2Oxidation States Electroneg.20.9Atomic Radius Ionic Radius –(+2)162Electron Affinity 1st Ion. Pot.– 5.2811Na 22.99Sodium [Ne]3s 1Oxidation States Electroneg.1
0.93Atomic Radius Ionic Radius 186(+1)102Electron Affinity 1st Ion. Pot.0.55 5.1419K 39.10Potassium
[Ar]4s
1Oxidation States Electroneg.1
0.82Atomic Radius Ionic Radius 227(+1)151Electron Affinity 1st Ion. Pot.0.50 4.3437Rb 85.47Rubidium
[Kr]5s
1Oxidation States Electroneg.1
0.82Atomic Radius Ionic Radius 248(+1)161Electron Affinity 1st Ion. Pot.0.49 4.1855Cs 132.9Cesium
[Xe]6s
1Oxidation States Electroneg.10.79Atomic Radius Ionic Radius 265(+1)174Electron Affinity 1st Ion. Pot.0.47 3.8987Fr 223Francium
[Rn]7s
1Oxidation States Electroneg.1
0.7Atomic Radius Ionic Radius –
–Electron Affinity 1st Ion. Pot.0.46–+–34Se 78.96Selenium [Ar]3d 104s 2p 4Oxidation States Electroneg.2,4,6
2.55Atomic Radius
Ionic Radius 116(-2)198Electron Affinity 1st Ion. Pot.2.029.75+–35Br 79.90Bromine [Ar]3d 104s 2p 5Oxidation States Electroneg.1,5 2.96Atomic Radius Ionic Radius 114(-1)196Electron Affinity 1st Ion. Pot.3.3611.81+–36Kr 83.80Krypton [Ar]3d 104s 2p 6Oxidation States Electroneg.––Atomic Radius Ionic Radius ––Electron Affinity 1st Ion. Pot.Unstable Anion 14.00
+–+–16S 32.07Sulfur [Ne]3s 2p 4Oxidation States Electroneg.2,4,6
2.58Atomic Radius Ionic Radius 103(-2)184Electron Affinity 1st Ion. Pot.2.0810.36+–17Cl 35.45Chlorine [Ne]3s 2p 5Oxidation States Electroneg.1,3,5,7
3.16Atomic Radius Ionic Radius 99(-1)181Electron Affinity 1st Ion. Pot.3.6112.97+–18Ar 39.95Argon [Ne]3s 2p 6Oxidation States Electroneg.––Atomic Radius Ionic Radius ––Electron Affinity 1st Ion. Pot.Unstable Anion 15.76+–53I 126.9Iodine [Kr]4d 105s 2p 5Oxidation States Electroneg.1,5,7
2.66Atomic Radius Ionic Radius 133(-1)220Electron Affinity 1st Ion. Pot.
3.0610.45+–54Xe 131.3Xenon [Kr]4d 105s 2p 6Oxidation States Electroneg.– 2.60Atomic Radius Ionic Radius ––Electron Affinity 1st Ion. Pot.Unstable Anion 12.13
+–86Rn 222Radon [Xe]4f 145d 106s 2p 6
Oxidation States Electroneg.––Atomic Radius Ionic Radius ––Electron Affinity 1st Ion. Pot.Unstable Anion 10.75
51Sb 121.8Antimony [Kr]4d 105s 2p 3Oxidation States Electroneg.3,5 2.05Atomic Radius Ionic Radius 145(+3)76Electron Affinity 1st Ion. Pot.1.078.64+–32Ge 72.61Germanium [Ar]3d 104s 2p 2Oxidation States Electroneg.
4 2.01Atomic Radius Ionic Radius 123(+4)53Electron Affinity 1st Ion. Pot.1.237.90ALKALI
METALS A C T I N I D E
S E R I E S L A N T H A N I D E S E R I E S Atomic Number:number of protons Atomic Weight:weighted average of atomic masses of natural isotopes - mass number of the most stable isotope for each radioactive element 2
34567891112
10131415161718ALKALINE EARTH
METALS
HALOGENS Electronegativity:Pauling scale; measures ability of atom to attract electrons in a chemical bond Atomic Radius:
given in “pm”; 1 pm = 1x10-12m
Ionic Radius:
given in “pm”; 1 pm = 1x10-12m
Electron Affinity:
energy released in the formation of an
anion: given in “eV”
1st Ionization Potential:
energy required to remove one electron,
forming a cation; given in “eV” $4.95 U.S. / $7.50 CAN REFERENCE: CRC Handbook of Chemistry and Physics ? 81st edition, 2000-2001CONTENT ADVISOR: Mark Jackson, PhD Chemistry Professor - Florida Atlantic University
DESIGN / LAYOUT: John Ford, CEO -
Customer Hotline # 1.800.230.9522
March 2005ISBN 142320003-9visit us at https://www.360docs.net/doc/3a108854.html, All rights reserved.No part of this publica-tion may be reproduced or transmitted in any
form, or by any means, electronic or mechan-
ical, including photocopy , recording, or any
information storage and retrieval sy stem,
without written permission from the publisher.
?2002, 2005 BarCharts, Inc.
1.00791 4.0026220.1801014.007739.948
1835.4531718.998915.999883.8036131.2954(222)
8612.0116C 10.811B 526.982Al 1328.086Si 1430.9741532.065S 166.941Li 39.0122Be 422.9901124.305Mg
1239.0981940.078Ca 2044.956Sc 2147.867Ti 2250.942V 2351.996Cr 2454.938Mn 2555.845Fe 2658.933Co 2758.693Ni 2863.546Cu 2965.39Zn 3069.7233172.64Ge 3274.922As 3378.96Se 3479.9043585.4683787.62Sr 3888.906Y 3991.224Zr 4092.906Nb 4195.94Mo 42132.9155137.33Ba 56138.91La La-Lu 57-7157178.49Hf 72180.95Ta 73183.84W 74(223)87(226)Ra 88(227)Ac
Ac-Lr 89-10389(98)Tc
43126.90I 53101.07Ru 44102.91Rh 45106.42Pd 46107.87Ag 47112.41Cd 48186.21Re 75190.23Os 76192.22Ir 77195.08Pt 78196.97Au 79200.59P Na K Ga Rb
Cs
Fr
Hg 80204.38Tl 81207.2Pb 82208.98Bi 83(209)Po 84(210)At 85114.82In 49118.71Sn 50121.76Sb 51127.60Te 52H He Ne N Ar Cl F O Kr Xe Rn Br IA IIA IIIB IVB VB VIB VIIB IB IIB IVA VA VIA VIIA VIIIB VIIIA 1
54231314151617186789101112IIIA 174.97Lu 71140.12Ce 58232.04Th 90231.04Pa 91238.03U 92140.91Pr 59144.24Nd 60(262)
Lr 103(145)Pm 61(237)Np 93(244)Pu 94(243)Am 95(247)Cm 96(247)Bk 97(251)Cf 98(252)Es 99(257)Fm 100(258)Md 101(259)No 102150.36Sm 62151.96Eu 63157.25Gd 64158.93Tb 65162.50Dy 66164.93Ho 67167.26Er 68168.93Tm 69173.04Yb 70(264)Bh 107(261)Rf 104(262)Db 105(266)Sg 106(277)Hs 108(268)Mt 109Copyright EniG. (eni@ktf-split.hr)? 1998-200310.811B 513(281)Uun 110(272)Uuu 111(285)Uub 112(289)
Uuq 114Ne Ga Fe Tc 1
2
34
5671
1621718HYDROGEN HELIUM NEON NITROGEN ARGON CHLORINE FLUORINE OXYGEN KRYPTON XENON RADON CARBON BORON ALUMINIUM SILICON PHOSPHORUS SULPHUR LITHIUM BERYLLIUM SODIUM MAGNESIUM POTASSIUM CALCIUM SCANDIUM TITANIUM VANADIUM CHROMIUM MANGANESE COBALT NICKEL COPPER ZINC GALLIUM GERMANIUM ARSENIC SELENIUM BROMINE RUBIDIUM STRONTIUM YTTRIUM ZIRCONIUM NIOBIUM MOLYBDENUM CAESIUM BARIUM LANTHANUM HAFNIUM TANTALUM TUNGSTEN FRANCIUM RADIUM ACTINIUM TECHNETIUM IODINE RUTHENIUM RHODIUM PALLADIUM SILVER CADMIUM RHENIUM OSMIUM IRIDIUM PLATINUM GOLD THALLIUM LEAD BISMUTH POLONIUM ASTATINE INDIUM TIN ANTIMONY TELLURIUM P E R I O D GROUP
IRON MERCURY LANTHANIDE
ACTINIDE LUTETIUM CERIUM THORIUM PROTACTINIUM URANIUM PRASEODYMIUM NEODYMIUM LAWRENCIUM
PROMETHIUM NEPTUNIUM PLUTONIUM AMERICIUM CURIUM BERKELIUM CALIFORNIUM EINSTEINIUM FERMIUM MENDELEVIUM NOBELIUM SAMARIUM EUROPIUM GADOLINIUM TERBIUM DYSPROSIUM HOLMIUM ERBIUM THULIUM YTTERBIUM BOHRIUM RUTHERFORDIUM DUBNIUM SEABORGIUM HASSIUM MEITNERIUM http://www.ktf-split.hr/periodni/en/Lanthanide Actinide PERIODIC TABLE OF THE ELEMENTS BORON ATOMIC NUMBER
ELEMENT NAME SYMBOL (1) Pure Appl. Chem.,, No. 4, 667-683 (2001)
73Editor:Aditya Vardhan (adivar@https://www.360docs.net/doc/3a108854.html,)Relative atomic mass is shown with five
significant figures.For elements have no stable
nuclides,the value enclosed in brackets
indicates the mass number of the longest-lived
isotope of the element.
However three such elements (Th,Pa,and U)
do have a characteristic terrestrial isotopic
composition,and for these an atomic weight is
tabulated.Metal Alkali metal Alkaline earth metal Transition metals Lanthanide
Actinide Chalcogens element Halogens element
Noble gas Semimetal Nonmetal - gas - liquid - solid - synthetic
STANDARD STATE (100 °C; 101 kPa)UNUNNILIUM UNUNUNIUM UNUNQUADIUM
UNUNBIUM RELATIVE ATOMIC MASS (1)
GROUP CAS GROUP IUPAC
Notes
- I UPAC 2011 Standard atomic weights abridged to four significant digits (Table 4 published in Pure Appl. Chem. 85, 1047-1078 (2013); https://www.360docs.net/doc/3a108854.html,/10.1351/PAC-REP-13-03-02. The uncertainty in the last digit of the standard atomic weight value is listed in parentheses following the value. In the absence of parentheses, the uncertainty is one in that last digit. An interval in square brackets provides the lower and upper bounds of the standard atomic weight for that element. No values are listed for elements which lack isotopes with a characteristic isotopic abundance in natural
terrestrial samples. See PAC for more details. - “Aluminum” and “cesium” are commonly used alternative spellings for “aluminium” and “caesium.”- Claims for the discovery of all the remaining elements in the last row of the Table, namely elements with atomic numbers 113, 115, 117 and 118, and for which no assignments have yet been made, are being considered by a IUPAC and IUPAP Joint Working Party.
For updates to this table, see https://www.360docs.net/doc/3a108854.html,/reports/periodic_table/. This version is dated 1 May 2013.
Copyright ? 2013 IUPAC, the International Union of Pure and Applied Chemistry.InternatIonal UnIon of PUre and aPPlIed ChemIstry
1H
hydrogen
[1.007; 1.009]1
18
3Li lithium
[6.938; 6.997]4Be beryllium 9.01211Na
sodium
22.9912Mg magnesium 24.3119K
potassium
39.1020Ca calcium 40.0837Rb
rubidium
85.4738Sr strontium 87.6255Cs
caesium
132.956Ba barium 137.387Fr
francium 88Ra radium 5
B boron [10.80; 10.83]13Al aluminium 26.9831Ga gallium 69.7249In indium 114.881Tl thallium [204.3; 204.4]6
C carbon [12.00; 12.02]14Si silicon [28.08; 28.09]32Ge germanium 72.6350Sn tin 118.782Pb lead 207.27N nitrogen [14.00; 14.01]15P phosphorus 30.9733As arsenic 74.9251Sb antimony 121.883Bi bismuth 209.08O oxygen [15.99; 16.00]16S sulfur [32.05; 32.08]34Se selenium 78.96(3)52Te tellurium 127.684Po polonium 9F fluorine 19.0017Cl chlorine [35.44; 35.46]35Br bromine 79.9053I iodine 126.985At astatine 10Ne neon 20.18
2He helium 4.00318Ar argon 39.9536
Kr krypton 83.8054Xe xenon 131.386Rn radon
22Ti titanium 47.8740Zr zirconium 91.2272Hf hafnium 178.5104Rf rutherfordium
23V vanadium 50.9441Nb niobium 92.9173Ta tantalum 180.9105Db dubnium 24Cr chromium 52.0042Mo molybdenum 95.96(2)74W tungsten 183.8106Sg seaborgium 25Mn manganese 54.9443Tc technetium 75Re rhenium 186.2107Bh bohrium 26Fe iron 55.8544Ru ruthenium 101.176Os osmium 190.2108Hs hassium 27Co cobalt 58.9345Rh rhodium 102.977Ir iridium 192.2109Mt meitnerium 28Ni nickel 58.6946Pd palladium 106.478Pt platinum 195.1110Ds darmstadtium 29Cu copper 63.5547Ag silver 107.979Au gold 197.030Zn zinc 65.38(2)48Cd cadmium 112.480Hg mercury 200.6111Rg roentgenium 112Cn copernicium
57La
lanthanum
138.989Ac
actinium 58Ce cerium 140.190Th thorium
232.059Pr praseodymium 140.991Pa protactinium 231.060Nd neodymium 144.292U uranium 238.061Pm promethium 93Np neptunium 62Sm samarium 150.494Pu plutonium 63Eu europium 152.095Am americium 64Gd gadolinium 157.396Cm curium 65Tb terbium 158.997Bk berkelium 66Dy dysprosium 162.598Cf californium 67Ho holmium 164.999Es einsteinium 68Er erbium 167.3100Fm fermium 69Tm thulium 168.9101Md mendelevium 70Yb ytterbium 173.1102No nobelium 71
Lu lutetium 175.0
103
Lr lawrencium
21Sc scandium 44.9639Y yttrium 88.9157-71
lanthanoids 89-103
actinoids atomic number
Symbol standard atomic weight 2
13 14 15 16 17 Key: 3
4 5 6 7 8 9 10 11 12 name For updates to this table, see https://www.360docs.net/doc/3a108854.html,/reports/periodic_table/. This version is dated 21 January 2011.
Copyright ? 2011 IUPAC, the International Union of Pure and Applied Chemistry.
Notes
- IUPAC 2009 Standard atomic weights abridged to four significant digits (Table 4 published in Pure Appl. Chem. 83, 359-396 (2011);
doi:10.1351/PAC-REP-10-09-14). The uncertainty in the last digit of the standard atomic weight value is listed in parentheses following the value.
In the absence of parentheses, the uncertainty is one in that last digit. An interval in square brackets provides the lower and upper bounds of the
standard atomic weight for that element. No values are listed for elements with no stable isotopes. See PAC for more details.
- “Aluminum” and “cesium” are commonly used alternative spellings for “aluminium” and “caesium.”
IUPAC Periodic Table of the Elements
镧系La镧 Ce铈Pr镨Nd钕Pm钷Sm钐Eu铕Gd钆Tb铽Dy镝Ho钬Er铒Tm铥Yb镱Lu镥lán shìpǔnǚpǒshān yǒu gátèdīhuǒěr diūyìlǔlanthanun cerium praseodymium neodymium promethium samarium europium gadolinium terbium dysprosium holmium erbium thulium ytterbium lutetium 57138.958140.159140.960144.261[145]62150.46315264157.365158.966162.567164.968167.369168.97017371175
锕系Ac锕Th钍Pa镤U铀Np镎Pu钚Am镅*Cm锔*Bk锫*Cf锎*Es锿*Fm镄*Md钔*No锘*Lr铹*ātǔpúyóu nábùméi jūpéi kāiāi fèi mén nuòláo actinium thorium protactinium uranium neptunium plutonium americium curium berkelium californium einsteinium fermium mendelevium nobelium lawrencium 89[227]90232912319223893[237]94[244]95[243]96[247]97[247]98[251]99[252]100[257]101[258]102[259]103[262]
门捷列夫与元素周期表的小故事
门捷列夫与元素周期表不得不说的故事宇宙万物是由什么组成的?古希腊人以为是水、土、火、气四种元素,古代中国则相信金、木、水、火、土五种元素之说。到了近代,人们才渐渐明白:元素多种多样,决不止于四五种。18世纪,科学家已探知的元素有30多种,如金、银、铁、氧、磷、硫等,到19世纪,已发现的元素已达54种。 人们自然会问,没有发现的元素还有多少种?元素之间是孤零零地存在,还是彼此间有着某种联系呢? 门捷列夫发现元素周期律,揭开了这个奥秘。 原来,元素不是一群乌合之众,而是像一支训练有素的军队,按照严格的命令井然有序地排列着,怎么排列的呢?门捷列夫发现:元素的原子量相等或相近的,性质相似相近;而且,元素的性质和它们的原子量呈周期性的变化。 门捷列夫激动不已。他把当时已发现的60多种元素按其原子量和性质排列成一张表,结果发现,从任何一种元素算起,每数到8个就和第一个元素的性质相近,他把这个规律称为“八音律”。 门捷列夫是怎样发现元素周期律的呢? 1834年2月7日,伊万诺维奇·门捷列夫诞生于西伯利亚的托波尔斯克,父亲是中学校长。16岁时,进入圣彼得堡师范学院自然科学教育系学习。毕业后,门捷列夫去德国深造,集中精力研究物理化学。1861年回国,任圣彼得堡大学教授。 在编写无机化学讲义时,门捷列夫发现这门学科的俄语教材都已陈旧,外文教科书也无法适应新的教学要求,因而迫切需要有一本新的、能够反映当代化学发展水平的无机化学教科书。 这种想法激励着年轻的门捷列夫。当门捷列夫编写有关化学元素及其化合物性质的
章节时,他遇到了难题。按照什么次序排列它们的位置呢?当时化学界发现的化学元索已达63种。为了寻找元素的科学分类方法,他不得不研究有关元素之间的内在联系。研究某一学科的历史,是把握该学科发展进程的最好方法。门捷列夫深刻地了解这一点,他迈进了圣彼得堡大学的图书馆,在数不尽的卷帙中逐一整理以往人们研究化学元素分类的原始资料…… 门捷列夫抓住了化学家研究元素分类的历史脉络,夜以继日地分析思考,简直着了迷。夜深人静,圣彼得堡大学主楼左侧的的门捷列夫的居室仍然亮着灯光,仆人为了安全起见,推开了门捷列夫书房的门。 “安东!”门捷列夫站起来对仆人说:“到实验室去找几张厚纸,把筐也一起拿来。” 安东是门捷列夫教授家的忠实仆人。他走出房门,莫名其妙地耸耸肩膀,很快就拿来一卷厚纸。“帮我把它剪开。” 门捷列夫一边吩咐仆人,一边动手在厚纸上画出格子。 “所有的卡片都要像这个格于一样大小。开始剪吧,我要在上面写字。” 门捷列大不知疲倦地工作着。他在每一张卡片上都写上了元素名称、原于量、化合物的化学式和主要性质。筐里逐渐装满了卡片。门捷列夫把它们分成几类,然后摆放在一个宽大的实验台上。接下来的日子,门捷列夫把元素卡片进行系统地整理。门捷列夫的家人看到一向珍惜时间的教授突然热衷于“纸牌”感到奇怪。门捷列夫旁若无人,每天手拿元素卡片像玩纸牌那样,收起、摆开,再收起、再摆开,皱着眉头地玩“牌”…… 冬去春来。门捷列夫没有在杂乱无章的元素卡片中找到内在的规律。有一天,他又坐到桌前摆弄起“纸牌”来了,摆着,摆着,门捷列夫像触电似的站了起来,在他面前出现了完全没有料到的现象,每一行元素的性质都是按照原子量的增大而从上到下地逐渐变化着。门捷列夫激动得双手不断颤抖着。“这就是说,元素的性质与它们的原子量呈周期性
物质结构及元素周期表
物质结构及元素周期表 为您服务的教育网络 主题一材料结构和元素周期表 一、审查考试地点 1.考试网站网络建设 (1)元素“位-结构-单位”之间的关系 (2)。推断元素的名称或位置是本节中常见的问题之一。其方法可以大致概括如下: 2.检查现场解释: 测试地点1:同一时期、同一主体群体性质变化的逻辑衍生关系1。相同周期和相同主族元素性质变化规律性质原子半径电子层结构电子损失能力获得电子能力金属非金属主价最高价氧化物酸相应水合物碱性非金属气态氢化物形成困难稳定性相同周期(从左到右)具有相同数量电子层的最外层电子的数量逐渐减少,最外层电子的数量逐渐减少,最外层电子的数量逐渐增加,最外层电子的数量逐渐减少,最外层电子的数量逐渐减少,最外层电子的数量逐渐增加,最外层电子的数量逐渐增加,最大正价(+1→+7)非金属负价=-(8族序数)酸度逐渐增加,最外层电子的数量XK碱度 随着主族(自上而下)电子层数的逐渐增加,最外层电子的数量也在逐渐增加,逐渐减少,逐渐增加,逐渐减少,逐渐减少,逐渐减少,最高正价=族序数(除O,F外)非金属负价=-(8-族序数)酸度逐渐减少,碱度逐渐增加,形成从难到易的稳定性逐渐增加,形成从易到难的稳
定性逐渐减少2。元素周期表中的“三角形”变化规律 如果元素a、b和c位于元素周期表中图5-1所示的位置,所有相关的性质都可以顺利释放。 1 为您服务的教育网络 订单(但D不能参与安排)。(1)原子半径:碳>氮>硼;(2)金属度:碳>碳>硼;(3)非金属:硼>碳>碳3。元素周期表(1)中的相似性规则与主族元素的性质相似(因为最外面的电子是相同的);⑵元素周期表中对角线位置(如2中的A、D位置)的元素具有相似的性质,如锂和镁、铍和铝、硼和硅等。 (3)相邻元素的性质差别不大。 测试点2元素周期定律的普通次定律 1.最外层电子数大于或等于3且小于8的元素必须是主族元素;最外层电子数为1或2的元素可以是主族、次族或0族(he)元素;最外层电子数为8的元素是稀有气体元素(氦除外)。 2.在元素周期表中,IIA族和IIA族元素的原子数有三种不同:①1-3周期(短周期)1元素的原子数不同;(2)第4和第5周期之间的差异为11;③第6和第7周期的差异为25。 3.在每个周期中排列的元素类型满足以下规则:如果n是周期序数,那么在奇数周期中它是(n?1)222(n?2)物种,物种处于偶数周期。2 4.在元素周期表中,除了第八族元素外,具有奇数(或偶数)原子序数的元素,元素所在的族的序数和主价也是奇数(或偶数)。
门捷列夫的化学元素周期表与卡片分析法
中国职工科技报/2007年/4月/20日/第004版 科普家园 门捷列夫的化学元素周期表与卡片分析法 王振宇 卡片时于研究文学艺术和社会科学很重要,对于研究自然科学特别是发明创造也同样重要。运用卡片分析法取得重大成果的最著名的事例。就是俄国化学家门捷列夫发现化学元素周期率。1869年,为了研究已发现的60多种元素之间的关系,研究元素的质量和化学性质的关系,门捷列夫将搜集来的各种元素的名称写在纸上,并记下它们的原子量和基本性质,把相似的元素和相近的原子量排列在一起:他又从最小的原子量开始选取元素,并把它们按原子量的顺序排列,经过分析研究,终于发现了元素的性质存在着周期性,从而发现了化学元素周期律,并根据周期率编制了第一张化学元素周期表。 从以上事例可以看出,卡片分析法的基础是要有卡片。卡片大小自便,扑克牌大小也可,稍大也可,能在上面记录信息即可。卡片上面都记录什么呢?以下方面可供参考:突然涌现的想法:由谈话、读书、观察等产生的设想或注意到的问题;图书、杂志、人名、地址、电话号码;被记述或证实的信息;从智力激励法等创造性开发会议中产生的新设想:有关行动计划。的基本设想:使数据系统化的各种形式:发现数据存在的场所、收集的来源以及技法;数据的种类:意想不到的偶然事件;从大脑中一闪即过的有创意的新设想,等等。 卡片分析法是一种发挥综合思维作用的方法,通过将所得到的记录有有关信息或设想的卡片。进行分析,进行整理排列,以寻找各部分之间的有机联系,从整体上把握事物,最后形成比较系统的新设想。该法作为分析整理资料获得启发的有效途径,可用于解决问题的各个阶段中。在分析中要把对象的各个部分、各个方面和种种因素联系起来考虑。综合不是主观地、任意地把对象的各部分捏合在一起,也不是各个部分的机械相加,不是各种因素的简单堆砌,而是按照对象各部分间的有机联系,从总体上把握事物的一种方法。它不是抽象地、从外部现象的联结上来认识事物,而是抓住事物的本质,即抓住事物在总体上相互联结而又矛盾的特殊性,研究这一矛盾怎样制约着事物丰富多彩的属性,怎样在事物的运动中展现出整体的特征。 卡片分析法具有以下一些特点:首先,这是一种在比较分类的基础上,由综合进行创新的方法比较和分类是运用此法时要做的基本工作,然而,真正有创意的工作在于时各类资料的综合:其次,运用这种方法时,不只是对卡片的理性分析和综合,还需要综合地发挥运用者的各种心理因素,如感受、感情、直观、意志等,因为对卡片的分析整理直接受到这些圆素的影响:第三,此法借助于卡片分析事理发现其内在联系,具有直观、方便、灵活的特点。既可单人应用,也可集体进行,应用范围广,几乎适用于各领域的创造性活动。 卡片分析法在各种研究和发明创造过程中,有着特殊的作用。将待处理的信息卡片化,具有克服人脑思维限度的功能,从而成为整理分析资料获得启发的有效方法。人的思维能力虽然是无限的,但一个人在思维中同时操作的思维元素数是很有限的,实验证明,一般人当同时思维操作的信息元素超过10个时,要在脑内同时操作加工这些信息显得很困难。而通过卡片,把各种信息或设想转移到脑外,变成能稳定地呈现在眼前的外存信息,这样既可把在头脑中借助记忆进行的思维操作转为脑外自理卡片,来减轻思维负担,又可使注意力集中,从而提高了思维效率。 (四十五) 第1页共1页
高考化学一模试题分类汇编——原子结构与元素周期表综合及答案解析
高考化学一模试题分类汇编——原子结构与元素周期表综合及答案 解析 一、原子结构与元素周期表练习题(含详细答案解析) 1.南京理工教授制出了一种新的全氮阴离子盐—AgN5,目前已经合成出钠、锰、铁、钴、镍、镁等几种金属的全氮阴离子盐。 (1)基态Mn2+的价电子排布式为____;银与铜位于同一族,银元素位于元素周期表的___区。 (2)[Mg(H2O)6]2+[(N5)2(H2O)4]2-的晶体的部分结构如图1所示: N、O、Mg元素的前3级电离能如下表所示: 元素I1/kJ?mol-1I2/kJ?mol-1I3/kJ?mol-1 X737.71450.77732.7 Y1313.93388.35300.5 Z1402.32856.04578.1 ①X、Y、Z中为N元素的是____,判断理由是__________。 ②从作用力类型看,Mg2+与H2O之间是________、N5与H2O之间是________。 ③N5-为平面正五边形,N原子的杂化类型是_______。科学家预测将来还会制出含N4-、N6- 表示,其中m代表等平面环状结构离子的盐,这一类离子中都存在大π键,可用符号πn m 参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π66),则N4-中的大π键应表示为_________。 (3)AgN5的立方晶胞结构如图2所示,Ag+周围距离最近的Ag+有_______个。若晶体中紧邻的N5-与Ag+的平均距离为a nm,N A表示阿伏加德罗常数的值,则AgN5的密度可表示为 _____g?cm-3(用含a、N A的代数式表示)。 【答案】3d5 ds Z X最外层为2个电子,X为镁;N的2p轨道处于半充满的稳定状态,
元素周期表结构新题18-教师用卷答案修改
微专题--元素周期表结构新题答案 一、单选题 1、【答案】C 【解析】本题考查原子结构和元素周期律关系,侧重考查原子结构、元素周期表结构、元素化合物性质,正确推断Y元素是解本题的关键,题目难度中等。 【解答】W、X、Y、Z为同一短周期元素,根据图知,X能形成4个共价键、Z能形成1个共价键,则X位于第IVA族、Z位于第VIIA族,且Z核外最外层电子数是X核外电子数的一半,Z最外层7个电子,则X原子核外有14个电子,为Si,Z为Cl,该阴离子中Cl显?1价、X显+4价,根据阴离子中化合价的代数和为?1价,知Y为?3价,所以Y为P,根据阳离子所带电荷知,W为Na,通过以上分析知,W、X、Y、Z分别是Na、Si、P、Cl元素。 A.WZ为NaCl,NaCl的水溶液呈中性,故A错误; B.同一周期元素非金属性随着原子序数增大而增强,则非金属性Cl>P>Si,所以非金属性Z>Y>X,故B错误; C.Y为P,Y的最高价氧化物的水化物H3PO4为中强酸,故C正确; D.Y为P,其最外层有5个电子,P原子形成2个共价键且该阴离子得到W原子一个电子,所以P原子达到8电子结构,即Y原子达到8电子稳定结构,故D错误; 2、【答案】C 【解析】本题考查常见元素推断、同周期元素性质的递变规律、化学键类型的判断等,题目难度中等,熟练掌握元素周期表和元素周期律的知识是解题的关键。 【解答】由有机物分子结构式知,Y原子形成3个共价键,X能形成4个共价键,Z原子形成2个共价键,R形成一个共价键,再结合原子序数排序,R为氢或锂元素,Y为氮或磷元素,X为碳元素,Z为氧或硫元素。又因为R、Y的简单阴离子相差一个电子层,X、Y、Z位于同周期,所以R为氢元素,Y 为氮元素,Z为氧元素。 A.同周期从左到右原子半径逐渐减小,H原子半径最小,所以原子半径:C>N>O>H,故A错误; B.C同周期从左到右非金属性逐渐增强,C、N、O的非金属性依次增强,故B错误; C.H和O组成的简单化合物为H2O,只含极性共价键,故C正确; D.N的含氧酸中HNO2是弱酸,故D错误。 3、【答案】A 【解析】本题考查了离子键、共价键、离子化合物、共价化合物的判断,难度不大,注意离子化合物中可能含有共价键,但共价化合物中一定不含离子键。 【解答】A.根据电子式知,该物质中含有阴阳离子,所以是离子化合物,故A正确; B.根据电子式知,该物质中含有阴阳离子,所以是离子化合物不是共价化合物,故B错误; C.氢离子和铵根离子间存在离子键,铵根离子中氮原子和氢原子间存在共价键,故C错误; D.氢离子和铵根离子间存在离子键,铵根离子中氮原子和氢原子间存在共价键,故D错误。 4、【答案】A 【解析】本题考查原子结构与元素周期律,把握元素的性质、原子结构来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识及元素化合物知识的应用。 【解答】根据W、X、Y、Z为短周期原子序数依次增大的主族元素,W与X、Y、Z都能形成共价化合物,W应该为氢元素;Y、W形成的化合物溶于水显碱性,Y为N,Y、W形成的常见化合物为NH3;Z、W形成的化合物溶于水显酸性,Z可能为F、S、Cl,根据四种元素形成化合物的结构式为 可知,Z不可能为S;根据其原子序数之和为30,且W、X、Y、Z原子序数依次增大判 定Z不可能为F元素,故Z为Cl元素,则X为B元素。A.X为硼元素,选项A错误; B.Y为N,不属于第ⅣA族元素,选项B正确; C.Y、Z分别与W形成的常见化合物为NH3和HCl,它们能反应生成NH4Cl,属于盐,选项C正确; D.Z、Y最高价氧化物对应的水化物分别为HClO4、HNO3,酸性HClO4>HNO3,选项D正确。 5、【答案】A【解析】略 6、【答案】D 【解析】本题考查了原子结构与元素周期律的知识,侧重考查学生元素推断和知识迁移能力,难度中等。根据甲的结构与性质推断其原子结构是解答本题的关键。 【解答】根据题给信息可知,W、X、Y、Z位于三个不同的周期,且原子序数依次增大,X与Z的核外电子数之和是Y的核外电子数的2倍,W与Y同主族,则W为H,Y为Na。结合化合物甲结构可知,Z最外层有4个电子,则Z为Si,W为H,X为O,Y为Na。 A项,钠离子和氧离子的电子层数相同,且钠的原子序数大于氧的原子序数,相同电子层数时原子序数越大,离子半径越小,则离子半径:r(O2?)>r(Na+),故A错误; B项,同周期从左到右元素非金属性逐渐增大,同主族从上到下元素非金属性逐渐减小,则非金属性:O>S>Si,所以非金属性:O>Si,故B错误; C项,化合物甲为Si(OH)4,H原子最外层不满足8电子稳定结构,故C错误; D项,由W、X、Y三种元素形成的化合物为NaOH,NaOH溶液能与硅单质反应,故D正确; 7、【答案】C 【解析】本题考查结构性质位置关系,根据元素周期律进行分析,难度中等. 【解答】由题意推知,Y原子的最外层电子数为次外层电子数的2倍,则Y为C,根据R的结构式,知道这些元素的成键个数,Y(C)成4键,W成双键且和Y处于同一周期则W为O,X成1键且周期数小于Y(C),则X为H,Z处于Y(C)和W(O)之间,则Z为N,所以X、Y、Z、W分别为H、C、N、O; A.同周期元素从左到右原子半径逐渐减小,则原子半径:C>N>O,A项正确; B.同周期元素从左到右非金属性依次增强,非金属性越强,最高价氧化物对应水化物的酸性越强;非金属性:N>C,酸性:HNO3>H2CO3,B项正确; C.氮的氧化物不具有两性,C项错误; D.化合物R为氨基乙酸,其中的羧基具有酸性,能与NaOH溶液反应,D项正确; 8、【答案】C 【解析】本题考查位置、结构和性质的关系,为高频考点,题目难度不大,正确判断元素是解本题关键,试题侧重考查学生的分析能力及逻辑推理能力。 【解答】根据结构可知,X共用4对电子,W共用6对电子,Y共用2对电子,Z共用1对电子,因为Y和W同主族,所以为ⅥA族,根据原子序数大小关系,Y为O元素,W为S元素;因为原子半径 r(X)>r(Y)>r(Z),则X、Y、Z同周期,X为C元素,Z为F元素。 A.X为C元素,C的氢化物可以是甲烷、乙烷、丙烷等,有极性键,也可能含有非极性键,A错误; B.该物质为LiSO3CF3,O元素的化合价为?2价,B错误; C.Z为F元素,Y为O元素,2F2+2H2O=4HF+O2,C正确: D.Y为O元素,W为S元素,S2?的还原性大于O2?,D错误。
阅读材料:门捷列夫与元素周期表
门捷列夫与元素周期表 在化学教科书中,都附有一张“元素周期表”。这张表揭示了物质世界的秘密,把一些看来似乎互不相关的元素统一起来,组成了一个完整的自然体系。它的发明,是近代化学史上的一个创举,对于促进化学的发展,起了巨大的作用。看到这张表,人们便会想到它的最早发明者——门捷列夫。 门捷列夫生平简介 德米特里·伊万诺维奇·门捷列夫生于一八三四年二月七日俄国西伯利亚的托波尔斯克市。这个时代,正是欧洲资本主义迅速发展时期。生产的飞速发展,不断地对科学技术提出新的要求。化学也同其它科学一样,取得了惊人的进展。门捷列夫正是在这样一个时代,诞生到人间。门捷列夫从小就热爱劳动,热爱学习。他认为只有劳动,才能使人们得到快乐、美满的生活;只有学习,才能使人变得聪明。 门捷列夫在学校读书的时候,一位很有名的化学教师,经常给他们讲课。热情地向他们介绍当时由英国科学家道尔顿始创的新原子论。由于道尔顿新原于学说的问世,促进了化学的发展速度,一个一个的新元素被发现了。化学这一门科学正激动着人们的心。这位教师的讲授,使门捷列夫的思想更加开阔了,决心为化学这门科学献出一生。 门捷列夫在大学学习期间,表现出了坚韧、忘我的超人精神。疾病折磨着门捷列夫,由于丧失了无数血液,他一天一天的消瘦和苍白了。可是,在他贫血的手里总是握着一本化学教科书。那里面当时有很多没有弄明白的问题,缠绕着他
的头脑,似乎在召呼他快去探索。他在用生命的代价,在科学的道路上攀登着。他说,我这样做“不是为了自己的光荣,而是为了俄国名字的光荣。”——过了一段时间以后,门捷列夫并没有死去,反而一天天好起来了。最后,才知道是医生诊断的错误,而他得的不过是气管出血症罢了。 由于门捷列夫学习刻苦和在学习期间进行了一些创造性的研究工作,一八五五年,他以优异成绩从学院毕业。毕业后,他先后到过辛菲罗波尔、敖德萨担任中学教师。这期间,他一边教书,一边在极其简陋的条件下进行研究,写出了《论比容》的论文。文中指出了根据比容进行化合物的自然分组的途径。一八五七年一月,他被批准为彼得堡大学化学教研室副教授,当时年仅二十三岁。 攀登科学高峰的路,是一条艰苦而又曲折的路。门捷列夫在这条路上,也是吃尽了苦头。当他担任化学副教授以后,负责讲授《化学基础》课。在理论化学里应该指出自然界到底有多少元素?元素之间有什么异同和存在什么内部联系?新的元素应该怎样去发现?这些问题,当时的化学界正处在探索阶段。近五十多年来,各国的化学家们,为了打开这秘密的大门,进行了顽强的努力。虽然有些化学家如德贝莱纳和纽兰兹在一定深度和不同角度客观地叙述了元素间的某些联系,但由于他们没有把所有元素作为整体来概括,所以没有找到元素的正确分类原则。年轻的学者门捷列夫也毫无畏惧地冲进了这个领域,开始了艰难的探索工作。 他不分昼夜地研究着,探求元素的化学特性和它们的一般的原子特性,然后将每个元素记在一张小纸卡上。他企图在元素全部的复杂的特性里,捕捉元素的共同性。但他的研究,一次又一次地失败了。可他不屈服,不灰心,坚持干下去。 为了彻底解决这个问题,他又走出实验室,开始出外考察和整理收集资料。一八五九年,他去德国海德尔堡进行科学深造。两年中,他集中精力研究了物理化学,使他探索元素间内在联系的基础更扎实了。一八六二年,他对巴库油田进行了考察,对液体进行了深入研究,重测了一些元素的原子量,使他对元素的特性有了深刻的了解。一八六七年,他借应邀参加在法国举行的世界工业展览俄罗斯陈列馆工作的机会,参观和考察了法国、德国、比利时的许多化工厂、实验室,大开眼界,丰富了知识。这些实践活动,不仅增长了他认识自然的才干,而且对他发现元素周期律,奠定了雄厚的基础。
物质结构 元素周期表
第一章物质结构元素周期表1、元素周期表、元素周期律 原子结构?元素周期表?元素性质(元素周期律) 几个等式: 核电荷数=核内质子数=原子序数=核外电子数 周期序数=电子层数主族序数=最外电子层数=元素最高正化合价数主族元素最低负化合价=8-主族序数 表1: 2、元素的金属性和非金属强弱比较 3、化学键和用电子式表示化学键的形成 离子键: 化学键非极性键: 共价键极性键:例题1:.某主族元素R的最高正价与最低负化合价的代数和为4,由此可以判断( ) A.R一定是第四周期元素 B.R一定是ⅣA族元素 C.R的气态氢化物比同周期其他元素气态氢化物稳定 D.R气态氢化物化学式为H 2 R 例题 2:下列关于物质性质变化的比较, 不正确的是: A. 酸性强弱: H 2 SiO 4 <H 2 CO 3 <H 3 PO 4 B. 原子半径大小: Na > S > O C. 碱性强弱: KOH > NaOH > LiOH D. 还原性强弱: F- > Cl- > I- 例题3:下列叙述中不正确的是 A.共价化合物中,一定含非金属元素 B.共价化合物中,一定没有离子键 C.离子化合物中可能含有共价键 D.离子化合物中一定含有金属元素和非金属元素 练习4: 下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是( ) 练习5:某元素X原子核外电子数等于核内中子数,取该元素单质2.8 g与氧气充分作用,可得 6 g化合物XO2。该元素在周期表中的位置是( ) A.第三周期 B.第二周期 C.第ⅣA族 D.第ⅤA族 练习 6:元素X和元素Y在周期表中位于相邻的两个周期,X和Y两原子核外电子总数之和为19,Y原子核内质子数比X多3个,下列叙述正确的是( ) A.X和Y都是性质活泼的元素,在自然界中只能以化合态存在 B.X和Y形成的化合物的化学式为Y2X C.X的化合物种类比Y的化合物种类多 D.Y能置换酸中氢,放出氢气,但不能置换出盐中的金属 练习7:下列物质溶于水中,化学键发生改变的是 A.氧气 B.氯化氢 C.氯化钠 D.氢氧化钠
专题23 位构性之元素周期表相关推断(教师版)
1.(2019·浙江高考真题)2019年是门捷列夫提出元素周期表150周年。根据元素周期律和元素周期表, 下列推断不合理 ...的是 A.第35号元素的单质在常温常压下是液体 B.位于第四周期第ⅤA族的元素为非金属元素 C.第84号元素的最高化合价是+7 D.第七周期0族元素的原子序数为118 【答案】C 【解析】A.35号元素是溴元素,单质Br2在常温常压下是红棕色的液体,合理;B.位于第四周期第ⅤA 族的元素是砷元素(As),为非金属元素,合理;C.第84号元素位于第六周期ⅥA族,为钋元素(Po),由于最高正价等于主族序数,所以该元素最高化合价是+6,不合理;D.第七周期0族元素是第七周期最后一个元素,原子序数为118,合理。故答案选C。 2.(2015·浙江高考真题)右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是() A.X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增 B.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增C.YX2晶体熔化、液态WX3气化均需克服分子间作用力 D.根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性 【答案】D 【解析】从表中位置关系可看出,X为第2周期元素,Y为第3周期元素,又因为X、W同主族且W元素的核电荷数为X的2倍,所以X为氧元素、W为硫酸元素;再根据元素在周期表中的位置关系可 专题23 位构性之 元素周期表相关推断
推知:Y为硅元素、Z为磷元素、T为砷元素。A、O、S、P的原子半径大小关系为:P>S>O,三种元素的气态氢化物的热稳定性为:H2O>H2S>PH3,A不正确;B、在火山口附近或地壳的岩层里,常常存在游离态的硫,B不正确;C、SiO2晶体为原子晶体,熔化时需克服的微粒间的作用力为共价键,C不正确;D、砷在元素周期表中位于金属元素与非金属的交界线附近,具有半导体的特性,As2O3中砷为+3价,处于中间价态,所以具有氧化性和还原性,D正确。答案选D。3.(2019·全国高考真题)今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是 A.原子半径:W
门捷列夫与元素周期表
门捷列夫与元素周期表 在十九世纪初期,人们已经发现了不少元素。在这些元素的状态和性质方面,有些极为相似,有些则完全不同,有些元素在某些性质方面很相似,但 在另一些方面却又差别很大。化学家们很自然地产生了一种寻求 元素相之间内在联系从而把元素作一科学分类的要求。科学家们 在这方面作了不少的工作,曾发表了部分元素间相互联系的论 述。 1829年德国段柏莱纳根据元素性质的相似性,提出“三素 组”的分类法,并指出每组中间元素的原子量大约等于两端的元 素原子量的平均值。但他当时只排了五个三素组,还有许多元素 没找到其间相互联系的规律。 1864年德国迈耶按元素的原子量顺序把元素分成六组,使化学性质相似的元素排在同一纵行里。但也没有指出原子量跟所有元素之间究竟有什么联系。 1865年英国纽兰兹把当时所知道的元素按原子量增加的顺序排列,发现每个元素它的位置前后的第七个元素有相似的性质。他称这个规律叫“八音律”。他的缺点在于机械地看待原子量,把一些元素(Mn、Fe等)放在不适当的位置上而把表排满,没有考虑发现新元素的可能性。 直到1868年,迈耶发表了著名的原子体积周期性图解。都末找出元素间最根本的内在联系,但却一步步地向真理逼近,为发现元素周期律开辟了道路。 与迈耶尔相似,以先行者提供的借鉴为基础,门捷列夫通过自己顽强的努力,于1869年2月编成了他的第一张元素周期表。1869年3月18日,俄国化学会举行学术报告会,门捷列夫因病未能出席,他委托他的同事、彼得堡大学化学教授门许特金代他宣读他的论文《元素性质和原子量的关系》。在论文中,他指出: (1)按照原子量大小排列起来的元素,在性质上呈现明显的周期性变化。 (2)化学性质相似的元素,或者是原子量相近(如Pt,Ir,Os),或者是依次递增相同的数量(如K,Rb,Cs)。 (3)各族元素的原子价(化合价)一致。 (4)分布在自然界的元素都具有数值不大的原子量值,具有这样的原子量值的一切元素都表现出特有的性质,因此可以称它们是典型的元素。 (5)原子量的大小决定元素的特征。 (6)应该预料到许多未知元素将被发现,例如排在铝和硅后面的、性质类似铝和硅的、原子量位于65~75之间的两种元素。 (7)当我们知道了某些元素的同类元素的原子量后,有时可借此修正该元素的原子量。 (8)一些类似的元素能根据其原子量的大小被发现出来。 正如门捷列夫所指出的,周期律的全部规律性都表述在这些原理中。其中最主要的是元素的物理和化学性质随着原子量的递增而做着周期性的变化。他的卓见没有立即被接受。他的老师、俄国化学家齐宁甚至训诫他是不务正业。在这种压力下,门捷列夫没有象纽兰兹那样伤心地放弃对新理论的研究,他不顾名家的指责和嘲笑,继续为周期律的揭示而奋斗。经过两年的努力,1871年他发表了关于周期律的新论文。文中他果断地修正了前一个元素周期表。例如在前一表中,性质类似的各族是横排,周期是竖排;而在新表中,族是竖排,周期是横排,这样各族元素化学性质的周期性变化就更为清晰。同时他象迈耶尔那样,将那些当时性质尚不够明确的元素集中在表格的右边,形成了各族元素的副族。在前表中为尚未发现的元素留下的4个空格,在新表中则变成了6个。 门捷列夫深信他所发现的周期律是正确的。他以周期律为依据,大胆指出某些元素的原子量是不准确的,应重新测定。例如当时公认金的原子量为169.2,按此,在周期表中,金应排在锇、铱、铂(当时认为它们的原子量分别是198.6,196.7,196.7)的前面。而门捷列夫根据金的性质认为金在周期表中应排在这些元素的后面,所以它们的原子量应重新测定。重新测定的结果是:锇为190.9,铱为193.1,铂为195.2,金为197.2。实验证明了门捷列夫的意见是对的。又例如,当时铀公认的原子量是116,是三价元素。门捷列夫则根据铀的氧化物与铬、钼、钨的氧化物性质相似,认为它们应属于一族,因此铀应为六
元素周期表习题及答案
一、选择题(每小题3分,共42分,每小题有1-2个正确选项) 1.下列有关现在的长式元素周期表的判断中正确的是( ) A.从左向右数第七纵行是ⅦA族 B.从左向右数第十一纵行是ⅠB族 C.ⅠA族全部是金属元素 D.ⅦA族的全部元素只能表现非金属元素的性质 解析:A.它应是ⅦB族。C.氢元素在ⅠA族中。D.砹(At)是既能表现非金属性又能表现金属性的元素的典型之一。 答案:B 2.主族元素在周期表中的位置,取决于元素原子的( ) A.相对原子质量和核电荷数 B.电子层数和中子数 C.电子层数和最外层电子数 D.金属性和非金属性的强弱 解析:原子的电子层数决定其所在的周期;原子的最外层电子数决定它所在的族。 答案:C 3.下列关于现在的长式元素周期表的判断中不正确的是( ) A.所含元素种数最少的周期是第一周期所含元素种数最多的周期是第六周期C.所含元素种数最多的族是Ⅷ族 D.所含元素种数最多的族是ⅢB族 答案:C 4.下列原子序数所代表的元素中,全属于主族元素的一组是( ) A.22,26,11 B.13,15,38 C.29,31,16 D.18,21,14 答案:B 5.据国外有关资料报道,在独居石(一种共生矿,化学成分为Ce、La、Nd、……的磷酸盐)中,查明有尚未命名的116、124、126号元素。判断其中116号元素应位于周期表中的( ) A.第6周期ⅣA族B.第7周期ⅥA族 C.第7周期Ⅷ族D.第8周期ⅥA族 答案:B 6.(2011·天津卷)以下有关原子结构及元素周期律的叙述正确的是( ) A.第ⅠA族元素铯的两种同位素137Cs比133Cs多4个质子
B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小 C.第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 D.同主族元素从上到下,单质的熔点逐渐降低 解析:137Cs与133Cs是铯的两种同位素,二者质子数相等,中子数相差4,A项错误;同周期元素(除0族外)从左到右,核电荷数逐渐增大,原子半径逐渐减小,B项正确;同主族元素从上到下,非金属性逐渐减弱,其对应氢化物的稳定性逐渐减弱,C项错误;碱金属元素的单质,从上到下熔点逐渐降低,而卤族元素的单质,从上到下熔点逐渐升高,D项错误。 答案:B 7.国际无机化学命名委员会在1989年做出决定,把长式元素周期表原先的主副族及族号取消,由左至右改为18列。如碱金属元素为第1列,稀有气体元素为第18列。按此规定,下列说法错误的是( ) A.第9列元素中没有非金属元素 B.只有第2列元素原子最外层有2个电子 C.第1列和第17列元素的单质熔沸点变化趋势相反 D.在整个18列元素中,第3列的元素种类最多 解析:根据元素周期表的结构,第9列即原第Ⅷ族中的1个纵行,无非金属元素。而第18列的He元素最外层也有2个电子,所以B项错误。第1列为碱金属元素,第17列为卤素,两者熔沸点的变化趋势确实相反。由于第3列即第ⅢB族,包括镧系和锕系元素,镧系和锕系各包括15种元素,种类最多。 答案:B 点评:了解元素周期表的结构,利用信息进行知识的迁移考查了自学能力。 8.A、B两元素为某周期第ⅡA族和第ⅢA族元素,若A元素的原子序数为x,则B元素的原子序数可能为( ) ①x+1 ②x+8 ③x+11 ④x+18 ⑤x+25 ⑥x+32 A.①③ B.②④ C.①③⑤ D.②④⑥ 解析:在同一周期的前提下,若A、B为第二或第三周期元素,其原子序数之差为1,即B的原子序数为x+1。若A、B为第四或第五周期元素,其原子序数之差要加上10种过渡元素,B的原子序数为x+11。若A、B为第六或第七周期元素,其原子序数之差还包括15种镧系或锕系元素,即有24种过渡元素,B的原子序数为x+25。故答案为C。 答案:C 9.关于卤素(用X表示)的下列叙述正确的是( ) A.卤素单质与水反应均可用X2+H2O=HXO+HX表示 B.HX都极易溶于水,它们的热稳定性随核电荷数增大而增强
高考化学二轮复习基础题练习物质结构与元素周期表
基础题练习(五) 物质结构与元素周期表 (建议用时:25分钟) (第162页) 1.(2019·武汉模拟)短周期主族元素X、Y、Z、W的原子序数依次增大,其中Y、Z位于同一主族。X的气态氢化物常用作制冷剂。ZYW2能与水剧烈反应,可观察到液面上有雾生成,并有刺激性气味的气体逸出,该气体可使品红溶液褪色。下列说法正确的是( ) A.最简单氢化物的沸点:Z>Y B.原子半径:W>Z>Y>X C.把ZY2通入石蕊试液中先变红后褪色 D.向ZYW2与水反应后的溶液中滴加AgNO3溶液有白色沉淀生成 D[X的气态氢化物常用作制冷剂,所以X是N Y和Z位于同一主族, ZYW2能与水剧烈反应,可观察到液面上有雾生成,并有刺激性气味的气体逸出,该气体可使品红溶液褪色,即有SO2产生,所以Y是O,Z是S,W是Cl ZYW2是SOCl2,据此回答。] 2.(2019·恩施州模拟)短周期主族元素R、X、Y、Z的原子序数依次增大,化合物M、N 均由这四种元素组成,且M的相对分子质量比N小16。分别向M和N中加入烧碱溶液并加热,二者均可产生能使湿润的红色石蕊试纸变蓝的气体。将M溶液和N溶液混合后产生的气体通入品红溶液中,溶液变无色,加热该无色溶液,无色溶液又恢复红色。下列说法错误的是( ) A.简单气态氢化物的稳定性:Y>X B.简单离子的半径:Z>Y C.X和Z的氧化物对应的水化物都是强酸 D.X和Z的简单气态氢化物能反应生成两种盐 C[依题意可知,M是NH4HSO3,N是NH4HSO4,故元素R、X、Y、Z依次为H、N、O、S,据此分析。] 3.(2019·江西名校模拟)短周期W、X、Y、Z、Q五种元素的原子序数依次递增,W和Z 位于同一主族。已知W的氢化物可与Q单质在光照条件下反应生成多种化合物,且Y、Q形成一种共价化合物,X的最高价氧化物对应的水化物可与Z单质反应产生常见的还原性气体单质E。下列说法不正确的是( ) A.X、Z的最高价氧化物相互化合,生成的产物可用作防火剂 B.Y、Q形成的化合物是强电解质 C.电解X、Q元素组成的化合物的饱和溶液常被用于实验室制备E单质 D.W、X、Q三种元素都能形成多种氧化物 C[短周期W、X、Y、Z、Q五种元素的原子序数依次递增,已知W的氢化物可与Q单质在光照条件下反应生成多种化合物,则W是C元素,Q是Cl元素;W和Z位于同一主族,则Z 是Si元素;Y、Q形成一种共价化合物,Y的原子序数比Si小。则Y只能是Al元素;X的最
人教版高一第一册第四章物质结构元素周期律第一节原子结构与元素周期表
人教版(2019)高一必修第一册第四章物质结构元素周期律 第一节原子结构与元素周期表 学校:___________姓名:___________班级:___________考号:___________ 一、单选题 1.铝的原子结构示意图为( ) A . B . C . D . 2.已知某元素的原子核外最外层电子数=最内层电子数=电子层数,则该元素是( ) A .氦 B .锂 C .铍 D .镁 3.高铁动车车厢禁止吸烟。高铁装有的离子式烟雾传感器具有稳定性好、灵敏度高的特点,其主体是一个放有镅( 24195Am )放射源的电离室。下列关于224195Am 的说法中, 不正确的是( ) A .质子数为95 B .质量数为241 C .核外电子数为146 D .中子数为146 4.氯、溴、碘单质的化学性质相似,原因是 A .均为有色单质 B .均为双原子分子 C .原子最外层电子数均为7 D .均可从海洋中提取 5.下列有关碱金属元素和卤素的说法中,错误的是() A .溴单质与H 2的反应比碘单质与H 2的反应更剧烈 B .碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的能力最强 C .钾与水的反应比钠与水的反应更剧烈 D .随核电荷数的增加,碱金属元素和卤素的熔沸点都逐渐降低 6.下列说法正确的是( ) A .氧气和臭氧互为同素异形体,它们的互相转化属于物理变化 B .1H 、2H 、3H 与16O 、18O 可组成6种不同的水分子 C .2H 、2 D 和2D 2T 互为同素异形体
D.35Cl和37Cl互为同位素 7.镭(Ra)位于元素周期表中第7 周期第ⅡA 族,下列关于镭元素单质及其化合物的性质推测错误的是 A.镭的原子半径比钙的大B.氯化镭的化学式为RaCl2 C.单质镭不能与水反应产生氢气D.氢氧化镭的碱性比氢氧化钙强 8.下列说法中不正确的是 ①质子数相同的粒子一定属于同一种元素 ②同位素的性质几乎完全相同 ③质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子 ④电子数相同的粒子不一定是同一种元素的原子 ⑤一种元素不可以形成不同的单质 ⑥某种元素的相对原子质量取整数,就是其质量数 A.①②⑤⑥B.①②④⑤C.②③⑤⑥D.③④⑤⑥9.下图所表示的微粒中,氧化性最强的是 A.B.C.D. 10.为纪念门捷列夫发表第一张元素周期表(部分如下)150周年,联合国宣布2021年为“国际化学元素周期表年”。关于下表的说法正确的是 A.表中数字代表元素的原子序数 B.表中元素的排列依据是元素的原子结构 C.推测表中“?=70”指代的元素的最高化合价为+4 D.每一纵行(列)都对应现在常用的元素周期表中的一族 11.第117号元素X核外有7个电子层,且最外层有7个电子。下列叙述正确的是()A.元素X的简单气态氢化物的化学式为HX,在常温下很稳定
高考化学 原子结构与元素周期表综合试题及答案解析
高考化学原子结构与元素周期表综合试题及答案解析 一、原子结构与元素周期表练习题(含详细答案解析) 1.南京理工教授制出了一种新的全氮阴离子盐—AgN5,目前已经合成出钠、锰、铁、钴、镍、镁等几种金属的全氮阴离子盐。 (1)基态Mn2+的价电子排布式为____;银与铜位于同一族,银元素位于元素周期表的___区。 (2)[Mg(H2O)6]2+[(N5)2(H2O)4]2-的晶体的部分结构如图1所示: N、O、Mg元素的前3级电离能如下表所示: 元素I1/kJ?mol-1I2/kJ?mol-1I3/kJ?mol-1 X737.71450.77732.7 Y1313.93388.35300.5 Z1402.32856.04578.1 ①X、Y、Z中为N元素的是____,判断理由是__________。 ②从作用力类型看,Mg2+与H2O之间是________、N5与H2O之间是________。 ③N5-为平面正五边形,N原子的杂化类型是_______。科学家预测将来还会制出含N4-、N6-等平面环状结构离子的盐,这一类离子中都存在大π键,可用符号πn m 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π66),则N4-中的大π键应表示为_________。 (3)AgN5的立方晶胞结构如图2所示,Ag+周围距离最近的Ag+有_______个。若晶体中紧邻的N5-与Ag+的平均距离为a nm,N A表示阿伏加德罗常数的值,则AgN5的密度可表示为 _____g?cm-3(用含a、N A的代数式表示)。 【答案】3d5 ds Z X最外层为2个电子,X为镁;N的2p轨道处于半充满的稳定状态, 其失去第一个电子较难,I1较大,则Z为氮元素配位键氢键 sp254π 12 22 3 A 8.910 N a ? ?
高中化学元素周期表和元素题型归纳
元素周期律和元素周期表习题 知识网络 中子N 原子核 质子Z 原子结构 : 电子数(Z 个)核外电子 排布规律 → 电子层数 周期序数及原子半径 表示方法 → 原子(离子)的电子式、原子结构示意图 随着原子序数(核电荷数)的递增:元素的性质呈现周期性变化 ①、原子最外层电子的周期性变化(元素周期律的本质) 元素周期律 ②、原子半径的周期性变化 ③、元素主要化合价的周期性变化 ④、元素的金属性与非金属性的周期性变化 ①、按原子序数递增的顺序从左到右排列; 元素周期律和 排列原则 ②、将电子层数相同的元素排成一个横行; 元素周期表 ③、把最外层电子数相同的元素(个别除外)排成一个纵行。 ①、短周期(一、二、三周期) 周期(7个横行) ②、长周期(四、五、六周期) 周期表结构 ①、主族(ⅠA ~ⅦA 共7个) 族(18个纵行) ②、副族(ⅠB ~ⅦB 共7个) ③、Ⅷ族(8、9、10纵行) ④、零族(稀有气体) 同周期同主族元素性质的递变规律 ①、核外电子排布 ②、原子半径 性质递变 ③、主要化合价 ④、金属性与非金属性 ⑤、气态氢化物的稳定性 ⑥、最高价氧化物的水化物酸碱性 电子层数 相同条件下,电子层越多,半径越大。 判断的依据 核电荷数 相同条件下,核电荷数越多,半径越小。 最外层电子数 相同条件下,最外层电子数越多,半径越大。 微粒半径的比较 1、同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外) 如:Na>Mg>Al>Si>P>S>Cl. 2、同主族元素的原子半径随核电荷数的增大而增大。如:Li
