香料化学复习题

一、名词解释。(2分×5=10分)
1.名词诠释
香料:香料是能够被嗅觉嗅出香气或味觉尝出香味的化学物质。
香精:有两种或两种以上的香料按一定的比例混合而调配出来的混合物称为香精。
精油:利用水蒸气蒸馏或压榨的方法从天然植物得到的芳香物质的油状混合物。
浸膏:用挥发性的有机溶剂浸泡芳香植物,芳香植物中的可溶性有机物溶解在有机溶剂中,再将溶剂挥发掉,得到的膏状物。
酊剂:用乙醇做溶剂,提取芳香植物或动物的分泌物,得到的液体冷却后过滤掉不溶物而得到的产品,称为酊剂。
净油:用乙醇浸提浸膏,除去浸膏中所含的植物蜡色素等杂质,再将乙醇蒸出,得到的残余物称为净油。
阈值:能够被辨别出香气种类的香料化合物的最低浓度称为阈值。
2.按香精的形态或用途的不同,香精各可以分为哪几类?
?(1). 按香精形态不同可以分为四类:
?水溶性香精; 油溶性香精; 乳化香精; 粉末香精
?(2). 按香精用途不同可以分为三类:
?食用香精;日用香精;其他类香精
3. 组成香精的各种香料在香精中所起的作用是不同的,据此可以将香精分为主香剂,和香剂,修饰剂和定香剂,它们在香精中的作用各是什么?
?主香剂构成了香精的主体香气.
?和香剂协调各种香料的香气,使主香剂的香气更加突出.
?修饰剂的作用是使香精的香气富于变化,避免单调.
?定香剂使香精中的各种香料成分均匀挥发,使香精香气更加持久.
4. 植物性天然香料的生产方法有哪些?
?水蒸气蒸馏法; 浸提法; 压榨法; 吸收法
5.单离香料的生产方法:
物理:分馏、冷冻结晶
化学:亚硫酸氢钠法、硼酸酯法、酚钠盐法
二、选择题:3分×10=30或填空题:1分×30=30分。
三、写出香料的结构式(英文名)、香气特征、应用建议:4分(3分)×5=20分(15分
苧烯、石竹烯、结晶玫瑰
叶醇、苯乙醇、肉桂醇、香叶醇、香茅醇
丁香酚
大茴香醛、香兰素、肉桂醛、ACA、HCA萜醛:柠檬醛、香茅醛、甜橙醛
丁二酮、覆盆子酮、香芹酮、薄荷酮
正丁酸
乙酸异戊酯、乙酸叶醇酯、乙酸苄酯、凤梨醛、辛炔羧酸甲酯、环己基丙酸烯丙酯、乙酸薄荷酯
芳香族羧酸酯:柳酸甲酯、苯甲酸苄酯
香豆素、椰子
酮麝香、麝香酮
MA
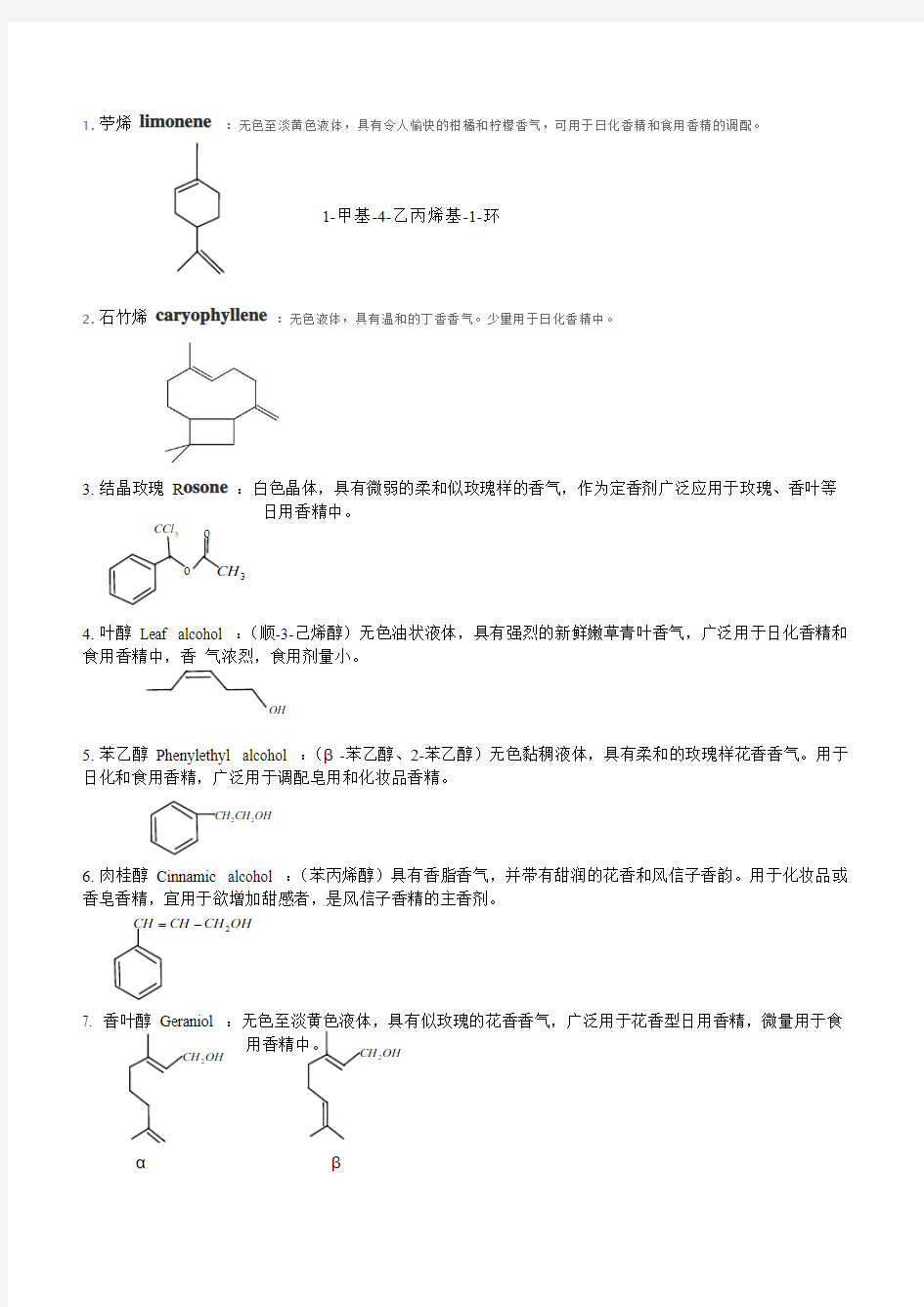
1. 苧烯
limonene :无色至淡黄色液体,具有令人愉快的柑橘和柠檬香气,可用于日化香精和食用香精的调配。
2. 石竹烯 caryophyllene :无色液体,具有温和的丁香香气。少量用于日化香精中。
3. 结晶玫瑰 R osone :白色晶体,具有微弱的柔和似玫瑰样的香气,作为定香剂广泛应用于玫瑰、香叶等 日用香精中。
4. 叶醇 Leaf alcohol :(顺-3-己烯醇)无色油状液体,具有强烈的新鲜嫩草青叶香气,广泛用于日化香精和食用香精中,香 气浓烈,食用剂量小。
5. 苯乙醇 Phenylethyl alcohol :(β-苯乙醇、2-苯乙醇)无色黏稠液体,具有柔和的玫瑰样花香香气。用于日化和食用香精,广泛用于调配皂用和化妆品香精。
6. 肉桂醇 Cinnamic alcohol :(苯丙烯醇)具有香脂香气,并带有甜润的花香和风信子香韵。用于化妆品或香皂香精,宜用于欲增加甜感者,是风信子香精的主香剂。
OH CH CH CH 2-=
7. 香叶醇 Geraniol :无色至淡黄色液体,具有似玫瑰的花香香气,广泛用于花香型日用香精,微量用于食 用香精中。
o 3CCl o 3CH OH CH CH 22 1-甲基-4-乙丙烯基-1-环OH
OH CH 2 OH CH 2 α β
8. 香茅醇 Citronellol :无色液体,具有清新的玫瑰和香叶似的香气。是玫瑰香型香精的主香剂,适用于皂用香精,也是调配食用香精的原料。
9. 丁香酚 Eugenol :又称1-羟基-2-甲氧基-4-烯丙基苯,无色至淡黄色液体,具有强烈的丁香和辛香香气,合成香兰素的重要香料,是配制丁香香精的主香剂,是配制木香型和东方型香精的定香济和修饰剂。
10. 大茴香醛 Anisaldehyde 无色至淡黄色液体,具有山楂花香香气,是调配山楂花花型的主体香料,食用配方中作甜味剂。
11. 香兰素 Vanillin :白色值微黄色针状晶体,具有强烈又独特的香荚兰豆香气。是食品工业中食用最多的食品赋香剂之一,是配制香草香精的主体原料。
12. 肉桂醛 Cinnamaldehyde :黄色液体,具有强烈的桂皮香气和辛香香气。在使用香精中主要用于辛香、可乐型。
13. ACA α-Amyl cinnamaldehyde :淡黄色油状液体,具有茉莉花似的香气,是配制茉莉香精的重要原料。
14. HCA α-Hexyl cinnamaldehyde :淡黄色液体,具有持久的茉莉花香,略有栀子花和药草香气,是配制树β-香茅醇
3,7-二甲基-6-辛烯醇(β-香茅醇) 3,7-二甲基-7-辛烯醇(α-香茅醇)
OH
OCH 3CH 2CH=CH 2丁香酚OH OCH 3CH=CHCH 3异丁香酚OH 3OCH CHO 4-羟基-3-甲氧基苯甲醛 CH=CHCHO 3-苯基丙烯醛 CHO 3OCH 对甲氧基苯甲醛 115H C
CH=C —CHO α-戊基桂醛
兰花油的很好原料,少量用于食用香精中。
15. 柠檬醛 Citral :黄色液体,具有强烈的柠檬香气,也似生姜的辛香。可用于需要柠檬香气的日用和食用香精中,酒用香精中也有使用,可作为掩盖工业生产中不良气息的香料,还是一种扩普的抗菌剂。
16. 香茅醛 Citronella :无色至淡黄色液体,青涩及粗草香,具有柠檬、玫瑰、浓的姜草香气。主要用于配制香皂和化妆品香精,微量用于食用香精。
17. 甜橙醛 Sinensal :淡黄色液体,具有浓郁,新鲜的甜橙香味。主要用于调配柑橘型食用香精。 α-甜橙醛又称2,6,10-三甲基-2,6,9,11-十二碳四烯醛
Β-甜橙醛又称2,6-二甲基-10-亚甲基-2,6,11-十二碳三烯醛
18. 丁二酮 2,3-Butanedione :黄色至浅绿色液体,具有强烈的尖刺的香气,奶油香气。用于食品香精,是奶香型香精的主香成分。
19. 覆盆子酮 Raspberry ketone :白色针状结晶,具有甜润的覆盆子似的果香香气。常用于花香型香精中作为修饰剂,在食用香精中应用广泛。
CHO 3,7-二甲基-2,6-辛二烯醛 CHO
3,7-二甲基-6-辛烯醛 CHO
CHO α-甜橙醛 β-甜橙醛
O O 33CH C C CH --- 322CH C CH CH -- OH O
对羟基苯丁酮 13
6H C CH=C —CHO α-己基桂醛
20. 香芹酮 Carvone :无色至淡黄色液体,d-香芹酮具有葛楼子、莳萝子的果香香气。常用于花香型香精中作为修饰剂,在食用香精中应用很广。
21. 薄荷酮 Menthone :无色油状液体,具有清新的薄荷香气,略带有木香香韵。是配制人造香叶油的原料,在日用香精中起调花香作用,用于清凉型的食用香精中。
22. 正丁酸 n-Butyric acid : 无色液体,具有持久刺鼻的酸败奶油气息,稀释到一定程度后具有奶香,干酪香、果香。主要用于调配奶油香精。
23. 乙酸异戊酯 Isoamyl acetate : 无色透明液体,具有强烈的水果香气,稀释时有香蕉、苹果、梨等果香香韵。在桂花日用香精中起修饰剂作用,也是最常用的果香型香精之一。
24. 乙酸叶醇酯 Leaf acetate :无色至淡黄色液体,具有强烈新刈草清香香气。用于高档香水和化妆品香精调配,用于多种蔬菜香精。
25 乙酸苄酯 Benzyl acetate :无色油状液体,强烈的茉莉花,铃兰花香并略带果香香气,在茉莉、白兰中起主香剂,在香蕉、葡萄、草莓、苹果等中也经常使用。
26. 凤梨醛 Allyl hexanoate :无色液体,并带有朗姆酒似的风味,具有强烈的菠萝似的果香。经常用于调配苹果、草莓、菠萝等食用香精,以及白酒、朗姆酒等酒用香精。
己酸烯丙酯
27. 辛炔羧酸甲酯 Methyl octine carbonate :无色至淡黄色油状液体,具有强烈的新鲜紫罗兰叶的香气,并有青香和鲜桃样香气。少量用于香水香精,微量用于荔枝、香蕉、桃子等食用香精。
28. 环己基丙酸烯丙酯 Allyl cyclohexyl propionate :无色液体,具有强烈而又甜润的菠萝似的水果香气。可由于日化香精,也可用于食用和酒用香精。
29. 乙酸薄荷酯 Menthyl acetate :无色液体,具有清新的薄荷、水果、草香,并略有清凉气息。主要用于调O 1-甲基-4-乙丙烯基-6-环己烯-2-酮 O 2-异丙基-5-甲基环己酮 O 3
CH 3
223CHCH CH OCH C CH --
O C CH CH -523)( 3OCH C C -- O O
配薄荷、留兰香、水果桃子、覆盆子、浆果等食用香精。
30. 柳酸甲酯 Methyl salicylate :无色液体,具有特有的冬青油香气。用于依兰、晚香玉等日用香精,用于牙膏、口腔清洁剂中,用于草莓、葡萄、香子兰等食用香精。
31. 苯甲酸苄酯 Benzyl benzoate :无色黏稠液体,具有微弱的香脂似的香气,茉莉、依兰、晚香玉等日用香精的定香剂,矫香剂,用于菠萝、草莓、樱桃等食用香精。
32. 乳酸乙酯 Ethyl lactate :无色液体,具有柔和的醚样油性气息。用于苹果、菠萝、椰子、牛奶、奶油等食用香精和酒用香精中。
33. 草莓醛 Strawberry aldehyde :无色至淡黄色液体,强烈的草莓气味,在茉莉、橙花、素心兰等日用香精中,在苹果、草莓、樱桃、桃子等食用香精。
34. 二氢茉莉酮酸甲酯 Methyl dihydrojasmonate :无色至淡黄色的油状液体,具有清雅的茉莉花样气息,柠檬苹果样果香香韵。广泛用于香水香精。化妆品香精,皂用香精中,也适用于草莓、柠檬、水果、圆柚等食用香精中。
35. 香豆素 Coumarin :白色晶体,强烈又甜韵的草香和辛香香气,稀释时有干草和烟草香韵,用于调配烟用香精和日用香精。
52H CHCOOC C --3CH O O O
3
OCH C --
OH - O
----2CH O C
O
OH 523H OC C CH CH --- O O
O 3COOCH 2-戊基环戊酮-3-乙酸甲酯 O O
36. 椰子醛 γ-Nonalactone :无色至淡黄色液体,奶油和椰子香气。常用于花香型和幻想型日化香精中,在食用香精中作为椰子香精主香剂。
37. 酮麝香 Musk ketone :淡黄色晶体,具有优雅而又浓郁的麝香香气。用于化妆品香精和皂用香精中,调配粉末型香精。
38. 麝香酮 Muskone :无色黏稠液体,具有强烈的、甜韵而又柔和的麝香香气。用于高档香水、香粉日用香精中,微量用于水果,生梨等食用香精中。
39. MA Methyl anthranilate :无色液体或晶体。具有愉快的花香和果香香气,稀释时具有橙花和葡萄样香气,广泛用于橙花、茉莉日用香精中,也可用于食用香精和烟用香精中。
四.纯合成题。
月桂烯
正己醇
月桂醛
樟脑
423)(CH CH O O O N O 2 2NO O
2NH O O
2-氨基苯甲酸甲酯、人造橙花油
1.月桂烯Myrcene :无色或淡黄色液体,具有清淡的香脂香气和柑橘、热带水果味道。
2.
正己醇n-Hexyl alcohol :无色液体,具有水果、青香、醇香、醚香香气。
3.月桂醛Lauric aldehyde :无色至淡黄色液体,具有强烈的草香和松叶香气,稀释后有紫罗兰样的香气。
4.樟脑Camphor :无色至白色半透明晶体或粉末,存在旋光异构体。右旋体具有独特的樟脑气息,并
略带薄荷香气,同时还带有强烈的芳香味,味苦并有凉感。
O
H
Cl
NH
2
4
-
MgX
H
C
9
4
OH
CH
CH
CH-
2
4
2
3
)
(
2
H
Ni
COOH
CH
CH -
4
2
3
)
(
O
樟脑
α-月桂烯β-月桂烯
ɑ为2-甲基-6-亚甲基-1,7-辛二烯
β为2-甲基-6-亚甲基-2,7-辛二烯
TMEDA
H
C
i
HN
Na/
)
(
/
2
7
3
-
O
Et
MgO
2
/
Br Br
+
OH
CH
CH
CH-
2
4
2
3
)
(
O
2
2
CH
CH-
OH
CH
CH
CH-
2
4
2
3
)
(
CHO
CH
CH
10
2
3
)
(又称正十二醛
HCOOH
COOH
CH
CH
10
2
3
)
(
TiO2
260℃
+ CHO
CH
CH
10
2
3
)
(又称正十二醛
O
H
CHO
CH
CH
2
10
2
3
2
)
(
2+
2
2
10
2
3
)
(
2O
OH
CH
CH
CH+PtO2
60℃
五.英文、感官、结构、应用、合成。
1. 芳樟醇 Linalool :无色液体,浓清香带甜的木青气息。可用于水果型、木香型使用香精。以β-芳樟
醇为主。
2. 薄荷醇 Menthol :无色针状晶体或粒状,具有凉爽的薄荷香气。在日化工业中主要用于牙膏、漱口水、牙粉等香精中。也大量用于糖果、清凉饮料等食用香精中。
3. 茴香脑 Anethole :反式为白色结晶固体,顺式为无色液体,具有独特的甜润的茴香和辛香。用于皂类、洗涤剂香精与茴香、薄荷等调味品食用香精。
OH OH H 2
Ni OH 间甲酚 百里香酚
OH 2-异丙基-5甲基环己醇
O 2 Cu 皂化 KOH O
3CH C O --O OH OH 芳樟醇β-芳香醇又称3,7-二甲基-1,6-辛二烯-3-醇 异戊二烯 氯化异戊烯 6-甲基-5-烯-庚酮 脱氢芳香醇 芳香醇 CH 三HC 33CH C CH -- HCl +Cl O O +H 2
OH OH O CH 3 丙烯基茴香醚
4. 铃兰醛 Lilial :无色至淡黄色液体,铃兰百合、兔耳草、菩提花似的花香香气。广泛用于百合、丁香、玉兰、插花以及素心兰东方型香精中。
5. 桃醛 γ-Undecalactone :淡黄色至黄色黏稠液体,强烈的果香,桃子和杏仁样香韵,主要用于桃子、樱桃食用香精。
+H 2H
O CO CH CH 223)( 3OCH O 3OCH HO 3OCH 3OCH 苯甲醚(茴香醚) 对甲氧基苯丙酮
3CH
CHO CH CH --2
2-甲基-3叔丁基苯-丙醛 H 2 Ni NaOH -H 2O 3CH CHO CH CH -= 3CH CHO CH CH --2 CHO CHO CH CH 23+O O
623)(CH CH 内酯化 H 2SO 4 异构化 H 2SO 4 O O 623)(CH CH COOH CH CH CH --=822)( COOH CHCH CH CH CH -=2623)( 322623)(COOCH CH CH OH CH CH CH -=+- O O
623)(CH CH 正辛醇 丙烯酸甲酯
配位化学考试复习资料
分裂能: 中心离子的d轨道的简并能级因配位场的影响而分裂成不同组能级之间的能量差。晶体场稳定化能:在配体静电场的作用下, 中心金属离子的d轨道能级发生分裂, 其上的电子一部分进入分裂后的低能级轨道, 一部分进入高能级轨道。进入低能级轨道使体系能量下降, 进入高能级轨道使体系能量上升。根据能量最低原理, 体系中的电子优先进入低能级。如果下降的能量多于上升的能量, 则体系的总能量将下降。这样获得的能量称为晶体场稳定化能。光谱项:配位场光谱是指配合物中心离子的电子光谱。这种光谱是由d电子在d电子组态衍生出来的能级间跃迁产生的, 所以又称为d-d跃迁光谱或电子光谱。求某一电子组态的能级, 就是推导其光谱项, 实质上就是推算该电子组态的不同L和S的组合。空穴规则:在多于半满的壳层中, 根据静电观点, “空穴”可理解成正电子, 正电子也象电子那样会产生相互排斥作用。 二、命名结构式 1、[Co(NH3)6]Cl3 2、顺-二氯·二氨合铂(II) 反-二氯·二氨合铂(II) 顺-四氯·二氨合铂(Ⅳ) 反-四氯·二氨合铂(Ⅳ) 面-三氯·三氨合钴(III ) 经-三氯·三氨合钴(III ) 3、二(μ- 氯) ·四氯合二铁(III) 二(μ- 氯) ·二(二氯合铁(III)) 4、[(CO)5Mn-Mn(CO)5] 二(五羰基合锰) 5、二茂铁
三、简答 1.异构体异构现象是配合物的重要性质之一。所谓配合物的异构现象是指分子式(或实验式)相同,而原子的连接方式或空间排列方式不同的情况。化学结构异构(构造异构)结构异构是因为配合物分子中原子与原子间成键的顺序不同而造成的, 常见的结构异构包括电离异构, 键合异构, 配位体异构和聚合异构电离异构:在溶液中产生不同离子的异构体。[Co(NH3)5Br]SO4紫红色和[Co(NH3)5SO4]Br(红色), 它们在溶液中分别能产生SO42-和Br-。键合异构有些单齿配体可通过不同的配位原子与金属结合, 得到不同键合方式的异构体, 这种现象称为键合异构。配位异构在阳离子和阴离子都是配离子的化合物中, 配体的分布是可以变化的, 这种异构现象叫配位异构。配位体异构这是由于配位体本身存在异构体, 导致配合单元互为异构。立体异构实验式相同,成键原子的联结方式也相同,但其空间排列不同,由此而引起的异构称为立体异构体一般分为非对映异构体(或几何异构)和对映异构体(或旋光异构)两类 2.配合物稳定性、软硬酸碱理论、举例说明、应用配合物在溶液中的稳定性是指配离子或分子在溶液中解离为水合金属离子和配体达到平衡时,其解离程度的大小。稳定性是配合物在溶液中的一个重要性质,通常用相应的稳定常数来衡量。软酸或软碱是其价电子容易被极化或容易失去的酸或碱,而硬酸或硬碱则是其价电子与原子核结合紧密且不容易被极化或不容易失去的酸或碱。或者说,软酸、软碱之所以称为软,是形象地表明他们较易变形,硬酸、硬碱之所以称为硬,是形象地表明他们不易变形。举例:硬酸中接受电子的原子较小、正电荷高,其价电子轨道不易变形(用一句话说就是硬酸是受体原子对外层电子的吸引力强的酸)。像Al3+离子以及BF3之类的化合物都是硬酸的例子。软酸中接受电子的原子较大、正电荷数目低或者为0, 以易变形的价电子轨道去接受电子(也用一句话说就是软酸是受体原子对外层电子的吸引力弱的酸)。金属原子、Hg2+离子及InCl3之类化合物即是典型的软酸。硬碱中的价电子结合紧密(半径小),软碱中的价电子容易被极化(半径大)。典型的硬碱是一些较小的阴离子如F-离子,对称的含氧酸阴离子, 如ClO4-, 以及具有小的给予体原子的分子如NH3等。典型的软碱是一些较大的阴离子如I-、H-,或者含有较大的给予体原子的分子。应用:软硬酸碱原则在无机化学中有许多定性的应用:①由于一种元素的硬度通常随着其氧化态的增大而增大,氧化态越高硬度越大。因此,为了使一种处于高氧化态的元素稳定,就必须使之与硬碱如O2-、OH-或F-配位:如Fe(VI)和Pt(VI)这样的高价态能够分别在化合物 K2FeO4和PtF6中得到。相反,为了使一种元素处于低氧化态,则必须用软碱如CO或PR3与元素配位。如Na[Co-1(CO)4]和Pt0[P(CH3)3]4这样的化合物中可以见到Co(-1)和Pt(0)。 ②软硬酸碱原理还用来判断离子性盐在水中的溶解度。 3.价键理论、配位场理论、分子轨道理论优缺点价键理论提出配位共价模型,考虑了中心原子和配体的结构,能较好地说明许多配合物的配位数、几何构型、磁性质和一些反应活性等问题。但这个价键理论只能说明配合物在基态时的性质,而不能说明与激发态有关的性质(如配合物的各种颜色和光谱),也不能说明同一过渡金属系列中不同配合物的相对稳定性等。配位场理论人们在晶体场理论的基础上, 吸收了价键理论的若干成果, 既适当考虑中心原子与配体化学键的共价性, 又仍然采用晶体场理论的计算方法, 发展成为一种改进了的晶体场理论, 特称为配体场理论。分子轨道理论用于说明双原子分子和芳香烃的结构。1935年Van Vleck首先用分子轨道理论方法来处理配合物的化学键问题,遵循成键三原则:能量近似、最大重叠和对称性匹配原则。在理论上比晶体场理论等方法更为严谨,所得的结果常用来补充晶体场理论的不足。晶体场理论晶体场理论是一种静电理论, 它把配合物中中心原子与配体之间的相互作用, 看作类似于离子晶体中正负离子间的相互作用。但配体的加入, 使得中心原子五重简并的 d 轨道(见图)失去了简并性。在一定对称性的配体静电场作用下, 五重简并的d轨道将解除简并, 分裂为两组或更多的能级组, 这种分裂将对配合物的性质产生重。
初三化学金属和金属材料练习题2.doc
周周清一(金属和金属材料练习) 1.下列化学方程式书写正确的是() A.2Fe+6HCl==2FeCl3+3H2 B. Fe+H2SO4==FeSO4+H2 t C. Fe+ CuSO4==FeSO4+Cu D. 4Fe+3O2==2Fe2O3 2.将适量的铁粉投入到盐酸屮,下列现象不会出现的是() A.溶液变成浅绿色 B.有无色气体产生 C.铁粉不断减少 D.有棕色沉淀生成 3.国外目前掀起购买“屮国铁锅热”,这主要是因为铁锅() A.传热快 B.价格便宜 C.不易腐蚀 D.被加工的食品屮含有铁元素 4.收藏家收藏清末铝制品,至今保存丁分完好,该艺术品不易锈蚀的主要原因是() A.铝不易发生化学反应 B.铝不易发生化学反应 C.铝易氧化,其表面的氧化膜具有保护内部作用 D.铝很难与酸发生反应 5.在LI常生活屮的金属炊具和医院屮的金属医疗器械的主要成份是() A.白铜合金 B.武徳合金 C.不锈钢 D.青铜 6.下列关于生铁和钢的描述屮,正确的是() A.生铁和钢都是混合物,其主要成份都是碳 B.生铁硬而有韧性,既可以铸又可锻 C.生铁与钢的性能由很大的并别,主要是由于生铁和钢屮的含碳最不同 D.钢是用铁矿石和焦炭作原料炼制而成的 7.垃圾时放错了位置的资源,该分类|叫收,生活屮废弃的铁锅,铝制易拉罐、铜导线等可以归为一类加以冋收,它们属于() A.氧化物 B.化合物 C.金属或合金 D.非金属 8.将铁放入下列溶液屮,溶液的质量会减少的是() A.盐酸溶液 B.硫酸溶液 C.硫酸亚铁溶液 D.硫酸铜溶液 9.新买的铝锅、铝壶用来烧开水,凡是水浸到的地方都会变黑,这现彖说明该水中含有() A.钾元素 B.钠元素 C.钙元索 D.铁元索 10.下列关于“合金”的叙述①合金屮至少含有两种金属;②合金屮元素以化合态的形式存在; ③合金屮一定含有金属;④合金一定为混合物;⑤合金依然具有金属特性,其屮正确的是() A.④ B.①②③ C.③④ D.③④⑤ 11?为适应火车提速,沪宁线上原有的短轨全部连接成超常轨,在连接过稈屮,工程技术人员点燃铝热剂(铝粉和氧化镁的混合物)能释放出大量的热量,生成熔融状态的铁可用来连接铁轨,反应的化学方程式为:Fe2O3+2Allf AI2O34-2Fe其屮还原剂是()
配位化学试题
配位化学试题 1. 利用Pt (Ⅱ)配合物中的反位效应,试说明如何以 K 2PtCl 为原料制备 :(1) [ PtPyNH 3Cl ] 所有可能的异构体,(2)下列配合物: Pt Cl NH 3H 3N Py Pt Cl Py H 3N H 3N Pt Cl NH 3C 2H 4Cl 2. 下列各组中,哪种配位体与同一中心离子形成的配合物稳定性高,为什么? C l -,F -和AL 3+;I -,Br --和Hg 2+;2CH 3NH 2,en 和Cu 2+ 3. 从常数手册上查出 [Cu (gly )2 ] 的lgk 1=9.76,lgk 2=2.47。测定条件是: T=25℃,[ NaClO 4 ]=1.0 mol/L ,此常数代表什么意义?具有什么性质?如测定 的方法是pH 法,叙述此方法的原理以及测定过程(gly :甘氨酸)。 4. 解释下列各胺与 Cu (Ⅱ)形成配离子稳定性的差别: 配体 lgk 1(25℃,I=0.1) 乙二胺 1055 1,2—二氨基丙烷 10.65 1,3—二氨基丙烷 9.98 1,2,3—三氨基丙烷 11.1 5. 下列二组试剂与同一金属离子形成螯合物时,估计lgk 大小次序: M(en)3M(Pn)3M(dien)2(1), ,,(2)N OH Cl N OH N OH CH 3N OH CH(CH 3)2 6、试为制备下列各化合物写出适合的配平方程式,并给出大致的反应条件。 (1)以 [Ir(NH 3)5H 2O]3+ 为原料,制备 [Ir(NH 3)5ONO]2+ (2)以 K 2PtCl 4 为原料,制备 [Pt(NH 3)4Cl 2] (3)以 CoBr 2·6H 2O 为原料,制备 [Co(NH 3)5Br]Br 2 (4)以 [Co(NH 3)5Cl]Cl 2 为原料,制备 [Co(en) 3]Cl 3 (5)以 [Pt(NH 3)4SO 4 为原料,制备 trans-[Pt(NH 3)4(OH)2]SO 4 7、何谓配位场谱项?它是如何产生的? 8、为什么Mn(NO 3)2的水溶液是很淡的粉红色?请解释。
(完整版)九年级化学金属的化学性质同步练习题
金属的化学性质 一、选择题 1.下列各金属可以跟盐酸反应的是() ①Zn ②Fe ③Ag ④Cu ⑤Al A.①②③ B.①②⑤ C.①③④ D.①③⑤ 2.铁丝放入硫酸铜溶液中,下列描述中不正确的是( ) A.铁丝表面有红色金属铜生成 B.溶液颜色有蓝色逐渐变为浅绿色 C.溶液质量增加 D.铁丝中铁的质量逐渐减少 3.除去铜粉中少量铁粉,不可采用的方法是( ) A.用磁铁吸引 B.加入足量稀盐酸再过滤 C.加适量CuSO4溶液 D.在空气中灼热 4.下列化学方程式正确的是() A.2Fe+6HCl====2FeCl3+3H2↑ B.CO2+Ca(OH)2====CaCO3↓+H2O C.CaCO3+HCl====CaCl+CO2↑+H2O D.Mg+O2点燃 MgO 5.铝是生活中最为常见的金属之一。关于铝的“自我保护”能力极强的原因,这一问题引起了同学们的极兴 趣,纷纷提出自己的看法:①铝的化学性质本来不活泼,难被腐蚀;②市场上的铝材料通常是铝合金,合金是不发生化学反应的;③铝性质活泼,表面能产生一层结构致密的氧化膜。你所认同的是() A.① B.② C.③ D.①②③ 6.有A、B、C、D四种金属,分别把它们加入到稀盐酸中,A、B、D反应后有气体放出,C无明显现象,再把A,D加入B盐溶液中,D表面有B析出,而A没有,则四种金属的活动性顺序是( ) A.A>B>D>C B.B>D>A>C C.D>A>B>C D.D>B>A>C 7.将过量的铁粉投入硫酸和硫酸铜的混合溶液中,充分反应后过滤,滤出剩余的铁和生成的铜,在滤液里 含有的物质是( ) A.FeSO4 B.CuSO4 C.Fe2(SO4)3 D.H2SO4 8.下列金属中,常温下最易和氧气反应的是( ) A.铝B.铂C.铁D.铜 9.用铁和铝分别跟足量的稀硫酸反应。若要制得相同质量的氢气,则需要用去铁和铝的质量比是()A.28:27 B.28:9 C.56:27 D.112:81 10.Fe、Cu、Ag三种金属的活动性由强到弱的顺序是Fe>Cu>Ag。则下列各组物质间能发生反应的是()A.Fe和CuSO4溶液B.Ag和FeSO4溶液C.Cu(NO3)2和Ag溶液D.Cu和FeSO4溶液11.在硝酸银和硝酸铜的混合溶液中加入一定量的铁粉,充分反应后发现有少量金属析出。则析出的少量金属是() A.Cu和Fe B.Ag C.Cu D.无法确定 12.将下列各组药品进行实验,能判断出铁比铜活泼的一组() A.Fe、Cu、稀H2SO4 B.Fe、Cu、ZnSO4溶液 C.Fe、Cu、AgNO3溶液 D.Fe,Cu、FeSO4溶液 13.我国古代的“药金”外观和黄金相似,经常被误认为金子其冶炼方法为(ZnCO3)、赤铜(Cu2O)和木炭混合的物质加热至800℃左右,即得到金光闪闪的“药金”。试推断“药金”组成()
配合物 习题及答案
配合物习题及答案 一、判断题: 1.含有配离子的配合物,其带异号电荷离子的内界和外界之间以离子键结合,在水中几乎完全解离成内界和外界。 .... () 2.在1.0 L 6.0 mol·L-1氨水溶液中溶解0.10 mol CuSO4固体,假定Cu2+ 全部生成[ Cu (NH3 )4 ]2+,则平衡时NH3的浓度至少为 5.6 mol·L-1 。.........................() 3.在M2+溶液中,加入含有X-和Y-的溶液,可生成MX2沉淀和[MY4]2-配离子。如果K( MX2 )和K([ MY4]2- ) 越大,越有利于生成[MY4]2-。() 4.金属离子A3+、B2+可分别形成[ A(NH3 )6 ]3+和[ B(NH3 )6 ]2+,它们的稳定常数依次为 4 ?105 和 2 ?1010,则相同浓度的[ A(NH3 )6 ]3+和[ B(NH3 )6 ]2+溶液中,A3+和B2+ 的浓度关系是c ( A3+ ) > c ( B2+ ) 。() 5.在多数配位化合物中,内界的中心原子与配体之间的结合力总是比内界与外界之间的结合力强。因此配合物溶于水时较容易解离为内界和外界,而较难解离为中心离子(或原子)和配体。.........................................................................................................................() 6. 已知K2 [ Ni (CN)4 ] 与Ni (CO)4均呈反磁性,所以这两种配合物的空间构型均为平面正方形。.....................................................................................() 7.某配离子的逐级稳定常数分别为K、K、K、K,则该配离子的不稳定常数K= K·K·K·K。.......................................................... () 8.HgS 溶解在王水中是由于氧化还原反应和配合反应共同作用的结果。............ () 9.在多数配位化合物中,内界的中心原子与配体之间的结合力总是比内界与外界之间的结合力强。因此配合物溶于水时较容易解离为内界和外界,而较难解离为中心离子(或原子)和配体。.........................................................................................................................() 二、选择题: 1.下列配离子在水溶液中稳定性大小关系中正确的是 . ()。 (A) [ Zn (OH)4 ]2- ( lg K= 17.66 ) > [Al (OH)4 ]- ( lg K= 33.03 ); (B) [ HgI4 ]2- ( lg K= 29.83 ) > [ PbI4 ]2- ( lg K= 4.47 ); (C) [ Cu (en)2 ]+ ( lg K= 10.8 ) > [ Cu (en)2 ]2+ ( lg K= 20.0 ); (D) [ Co (NH3 )6 ]2+ ( lg K= 5.14 ) > [ CoY ]2- ( lg K= 16.31) 。 2.下列配合物中,属于内轨型配合物的是.............................................()。 (A) [ V(H2O)6 ]3+,μ = 2.8 B. M.;(B) [ Mn (CN)6 ]4-,μ = 1.8 B. M.; (C) [Zn (OH)4]2-,μ= 0 B. M.;(D) [ Co(NH3)6 ]2+,μ = 4.2 B. M.。 3.在一定温度下,某配离子ML4的逐级稳定常数为K(1)、K(2)、K(3)、K(4),逐级不稳定常数为K(1)、K(2)、K(3)、K(4)。则下列关系式中错误的是.................................................................................. ()。 (A) K(1)·K(2)·K(3)·K(4) = [ K(1)·K(2)·K(3)·K(4) ]-1; (B) K(1) = [K(1) ]-1; (C) K(4) = [K(1) ]-1; (D)K(2) = [K(3) ]-1。 4.下列叙述中错误的是............................................................................... ()。 (A) 配合物必定是含有配离子的化合物; (B) 配位键由配体提供孤对电子,形成体接受孤对电子而形成; (C) 配合物的内界常比外界更不易解离; (D) 配位键与共价键没有本质区别。
复习题 -配位化学2014
复习题 1.配体的能力的强弱次序? 2.历史上记录的第一种人工合成的配位化合物? 3.原子轨道线性组合的原则是? 4.内轨型配离子[Cu(CN)4]2-的磁距等于 2.0B.M.判断其空间构型和中心离子的 杂化轨道是? https://www.360docs.net/doc/3d2128842.html,-和CO作配体时较之以F-和H2O作配体时形成的配合物多为内轨型,其 原因是? 6.[Co(NO2)6]3-显黄色(吸收紫光),而[Co(NH3)6]3-显橙色(吸收蓝光),根据它 们颜色(或所吸收光的波长)判断出Co3+在这两种配离子中分裂能(△)的大小? 7.K4[Fe(CN))6]为低自旋配合物,[Fe(H2O)6]Cl3是高自旋配合物,据晶体场理论, t2g和e g轨道上的电子排布? 8.按晶体场理论,[Co(NO2)6]4- 和[Co(H2O)6]2+ 两种配离子中,d电子排布式分 别为? 9.Fe3+和X-配合物的稳定性随X-离子半径的增加而如何变化? 10.何谓分裂能?分裂能的大小有何规律? 11.Werner型配合物结晶合成的方法有? 12.产生吸收光谱的原因是什么 13.命名常见配合物和配离子 14.试以K2PtCl4为主要原料合成某些配合物,并用图表示反应的可能途径 15.用非直接测定结构的实验方法区别同分异构体(特征反应,光谱特性) 16.四面体配合物中的d-d 跃迁吸收带比相应的八面体配合物吸收强弱比较 17.Td 场的分裂能比Oh 场比较 18.配合物有无几何异构的判定 19.实验测得Co(CN)63-和CoF63-均有正八面体的结构且磁矩分别为0和4.9 B.M. 请分别指出中心离子的杂化轨道的类型及为配合物的类型。 20.原子轨道线性组合的原则是什么 21.配位化合物的稳定性的影响因素(会应用)
初中化学金属试题及答案
金属的化学性质习题精选(一) 1.下列叙述中,属于金属化学性质的是() A.纯铁是银白色固体B.铝在空气中易与氧气反应生成致密的氧化膜 C.铜容易传热、导电D.钨有很高的熔点 2.镁条在空气中燃烧时,可观察到的现象是() A.发出蓝色火焰B.发出耀眼白光 C.发出黄色火焰D.剧烈燃烧,火星四射 3.下列关于金属的说法正确的是() A.各种金属在常温下都不能与氧气反应B.各种金属在高温下都能与氧气反应 C.根据金属与氧气反应的难易程度可以初步比较金属的活动性 D.各种金属都能与盐酸发生置换反应 4.下列方程式中错误的是() A.Fe + CuCl2 = FeCl3 + Cu B.Fe + 2HCl = FeCl2 + H2↑ C.Cu + ZnSO4 = Zn + CuSO4D.2Cu + O2 2CuO 5.下列叙述中不正确的是() A.氯化亚铁溶液和硫酸亚铁溶液都是浅绿色的B.氧化铝和氧化铜都是黑色固体 C.硫酸铜溶液是蓝色溶液D.硫酸铝溶液是无色溶液 6.为适应火车提速,我国一些铁路线上原有的短轨已全部连接为超长轨。工程技术人员常用如下反应来焊接钢轨间的缝隙:2Al + Fe2O3Al2O3 + 2Fe。有关此反应的下列说法中正确的是()A.该反应属于化合反应B.该反应属于分解反应 C.该反应属于置换反应D.该反应中铁元素的化合价降低 7.小兰家中收藏一件清末的铝制佛像,至今仍保存十分完好。该佛像未锈蚀的主要原因是()A.铝不易发生化学反应B.铝的氧化物容易发生化学反应 C.铝不易被氧化D.铝易被氧化,但氧化铝具有保护内部铝的作用。 8.镁、铁在日常生活中有较为广泛的用途。如: (1)镁在空气中燃烧时,发出耀眼的白光,可用来制造镁闪光灯,其反应化学方程式为:。 (2)市场上出售的补血麦片中常含有微量颗粒细小的还原性铁粉,铁粉与人体胃液中的盐酸反应转化成氯化亚铁,起到补血作用,写出这个反应方程式:。 9.我国是现代湿法冶金的先驱,早在西汉时期,刘安在《淮南万毕术》中写到“曾青得铁则化铜”,这里的“曾青”就是铜的化合物(如硫酸铜)。在宋朝利用这个反应冶铜的生产具有一定的规模。该反应的化学方程式为:,该反应的基本反应类型是。 10.(1)实验室的废酸液不能直接倒入下水道是因为。 (2)工人师傅在切割钢板时常用硫酸铜划线是因为(用化学方程式表示)
(完整版)配位化学练习题
配位化学练习题 一.是非题 1.配合物的配位体都是带负电荷的离子,可以抵消中心离子的正电荷。 2.[Cu(NH 3)3]2+ 的积累稳定常数β3是反应[Cu(NH 3)2]2+ +NH 3?[Cu(NH 3)3]2+的平衡常数。 3.配位数是中心离子(或原子)接受配位体的数目。 4.配离子的电荷数等于中心离子的电荷数。 5.配合物中由于存在配位键,所以配合物都是弱电解质。 6.根据稳定常数的大小,即可比较不同配合物的稳定性,即K f 愈大,该配合物愈稳定。 7.外轨型配离子磁矩大,内轨型配合物磁矩小。 8.Fe(Ⅲ)形成配位数为6的外轨型配合物中,Fe 3+离子接受孤对电子的空轨道 是sp 3d 2。 9.中心离子的未成对电子数越多,配合物的磁矩越大。 10.配离子的配位键越稳定,其稳定常数越大。 二.选择题 1.下列叙述正确的是 A.配合物由正负离子组成 B.配合物由中心离子(或原子)与配位体以配位键结合而成 C.配合物由内界与外界组成 D.配合物中的配位体是含有未成键的离子 2.下面关于螯合物的叙述正确的是( )。 A 、有两个以上配位原子的配体均生成螯合物 B 、螯合物和具有相同配位原子的非螯合物稳定性相差不大 C 、螯合物的稳定性与环的大小有关,与环的多少无关 D 、起螯合作用的配体为多齿配体,称为螯合剂 3.已知()lg 232Ag NH θβ+?????? =7.05, ()lg 22Ag CN θβ-?????? =21.7, ()lg 22Ag SCN θβ-?????? =7.57, () 3lg 2232Ag S O θβ-???? ?? =13.46;当配位剂的浓度相同时,AgCl 在哪种溶液中的溶解度
初中化学第八单元《金属和金属材料》测试题
初中化学第八单元《金属和金属材料》测试题 相对原子质量:Zn:65 Fe:56 H:1 第Ⅰ卷(选择题共40分) 一、选择题(本题包括20个小题,共40分) 1.某物质为金属材料,则该物质() A、一定是单质 B、一定是化合物 C、一定是混合物 D、可能是单质或混合物 2.金属钛有银白色金属光泽,密度为4.5g/cm3,熔点为1725℃,具有良好的延展性和耐腐蚀性。下列物品不能用钛制作的是() A、保险丝 B、医疗器械 C、潜艇外壳 D、眼镜架 3.灯泡里的灯丝用钨制而不用锡制,主要是因为() A、钨的导电性好 B、钨的熔点高 C、钨的硬度大 D、钨的密度大 4.生铁和钢的主要区别是() A、是否为纯净物 B、含碳量不同 C、机械强度不同 D、铸造性不同 5.在常温下,将下列物质投入足量地稀盐酸中,能产生气体且有金属不溶物残留的是 ( ) A.铁 B.黄铜 C.碳酸钙 D.生石灰 6.公元二世纪我国炼丹专家魏殃著有《周易参同契》是世界上现在的最早的一部炼丹专著,书中描写道“金入于猛火色不夺精光”。这句话是指黄金的性质在强热条件下()A.很稳定 B.很活泼 C.易氧化 D.易还原 7.将一枚洁净的铁钉浸入稀硫酸中,下列叙述:①铁钉表面产生气泡;②液体由无色逐渐变为浅绿色;③铁钉的质量减轻;④液体的质量减轻,其中正确的是() A.②③ B.①②④ C.①②③ D.①②③④ 8.下列物质在氧气中燃烧,能生成黑色固体的一组是() ①镁②硫③铁④磷⑤铜 A、①③ B、③ C、③④⑤ D、③⑤ 9.下列不能由金属和酸直接反应得到的物质是() A、氯化镁 B、硫酸锌 C、氯化亚铁 D、硫酸铜 10.下列反应类型中,一定有单质参加的反应是() A、化合反应 B、分解反应 C、置换反应 D、氧化反应 11.化学反应往往需要在一定的条件下进行。通过控制或改变反应条件可以加快、减缓甚至阻止反应的进行。下列所反映的措施中,能加快其化学反应速率的是() A.铁门表面喷漆 B.冰箱保存食物 C.用扇子扇煤炉火,火会更旺 D.将木头电线杆埋入地下的部分用火微微烧焦12.下列各种情况下,埋在地下的铸铁管道被锈蚀的速率最慢的是() A.在潮湿、疏松、透气的土壤中 B. 在含铁元素较多的酸性土壤中 C. 在潮湿、致密、不透气的土壤中 D. 在干燥、致密、不透气的土壤中 13、在车船表面刷油漆的目的是()
配位化学习题
配位化合物(01) 1.历史上记录的第一种人工合成的配位化合物是( D ) A.硫酸六氨合钴(II) B.普鲁士蓝 C.硫酸四氨合铜(II) D.氯化二氨合银(I) 2.配位化学的奠基人是( D) A.阿仑尼乌斯 B.路易斯 C.鲍林 D.维尔纳 3.下列说法中错误的是( C) A 配合物的形成体通常是过渡金属元素 B 配键是稳定的化学键 C 配键的强度可以和氢键相比较 D 四面体配合物中,不存在顺反几何异构现象 4.下列说法中正确的是(D ) A 配位原子的孤电子对越多,其配位能力就越强 B 电负性大的元素充当配位原子,其配位能力也强 C CH3-C-OH配体是双齿配体 D 在[Cu(en)2]2+中,Cu2+的配位数是4 12.下列说法中错误的是(D ) A.对于Ni2+来说,当配位数为6时,无论是强场或弱场配体本位,只能采用SP3d2杂化 B.对Ni2+来说,当本位数为4时,随配体的不同可采取dsp2或SP3杂化 C.无论中心离子杂化轨道是d2sp2或SP3d2,其构型均为八面体形 D.配合物中,由于存在配键,所以配合物都是弱电解质 13.下列配体的本位能力的强弱次序为(B ) https://www.360docs.net/doc/3d2128842.html,->NH3>NCS->H2O>X- https://www.360docs.net/doc/3d2128842.html,->NH3>NCS->H2O>X- C.X->H2O>CH->NH3>NCS- D.X->CN->H2O>NH3>NCS- 14.在配位分子3KNO2.Co(NO3)2中,配位数为(D ) A 3 B 4 C 5 D 6 27.1 共价键和配位共价键的区别是什么?在NH4+离子中分别有多少 个共价键和配位共价键?如何对其进行区分? 解配位共价键是指一对电子由两个原子共享,且此电子是由其中的一 个原子提供的;共价键是指一对共用电子对,一旦形成这两种键就没有区别。在NH4+离子中有四个共价键,其中有一个是配位共价键。 27.4 求下列配位化合物的中心原子的配位数分别是多少? (a) [Mo(CN)8]4-中的钼(b)Cu(en)22+中的铜(en为乙二胺) 解(a) 8 (b) 4
2010级《配位化学》期末考试试题(A卷)
泰山学院课程考试专用 泰山学院化学化工学院2010级化学专业本科 2012~2013学年第一学期 《配位化学》试卷A (试卷共6页,答题时间120分钟) 一、选择题(每小题 2 分,共 20 分。请将答案填在下面的表格内) 1、关于影响配位数的主要因素的叙述,正确的是( ) A. 不论何种配体,中心离子的电荷越高、半径越小,配位数越大 ; B. 不论何种中心原子,配体的体积都是对配位数影响最大的因素 ; C. 讨论配位数的大小要从外部条件、中心离子、配体等方面考虑 ; D. 中心离子的电荷与半径,决定了形成配合物的配位数高低 ; 2、下面关于中心离子的描述,正确的是( ) A. Nb(V)、La(III)、Co(III) 为外层具有9-17电子结构的过渡金属离子; B. Cu(I)、Sn(II)、Hg(II) 为外层具有18 电子结构的离子 ; C. Ge(II)、Sn(II)、Pb(II) 为外层具有18+2电子结构的离子 ; D. Al(III)、Si(IV)、Ti(III) 为外层具有8电子结构的离子; 3、说明Zn 2+,Cd 2+,Hg 2+形成配合物的稳定性顺序,错误的是( ) A. [ZnI 4]2- > [HgI 4]2- ; B. [ZnCl 4]2- < [CdCl 4]2- ;
C. [CdF4]2-< [HgF4]2-; D. [CdF4]2-< [ZnF4]2-; 4、下列光谱化学序列中配体强弱顺序排列,正确的是( ) A. en > NO2-; B. F-< C2O42-; C. NH3> en ; D. OH-> CN-; 5、下列有关配合物的立体结构与配位数的描述,不正确的是( ) A. 配位数为3的配合物,有平面三角形和三角锥型两种构型; B. 一维无限链式结构的Cs[CuCl3]n的配位数为4 ; C. 具有角锥形结构的[SnCl3]-配位数为3 ; D. 配合物[(Ph3P)3Cu2Cl2]中铜(I)的配位数有3、4两种模式; 6、下列有关配位数与配合物的结构描述,不正确的是( ) A. 配离子[PdCl4]2-和[AuCl4]-都具有平面四方形结构; B. 配合物[VO(acac)2] 和[Cu(NH3)4]SO4·H2O都具有四方锥结构; C. 配离子[Ni(CN)5]3-和[CdCl5]3-都具有三角双锥构型; D. 配离子Cd(CN)4]2-和[Cu(CN)4]2-都具有四面体结构; 7、下列关于配合物几何异构体的叙述,正确的是( ) A. 配合物[Co(NO2)3(NH3)3] ,有2种几何异构体; B. 配离子[Co(en)2Cl2]+,有5种几何异构体; C. 配离子[Co(NH3)2(H2O)2(Py)2]3+,共有6种几何异构体; D. 配合物[Cr(gly)3] ,有4种几何异构体; 8、外文期刊Angew.Chem.Int.Ed可从哪个数据库网址中查得?() A. https://www.360docs.net/doc/3d2128842.html, ; B. https://www.360docs.net/doc/3d2128842.html, ; C. https://www.360docs.net/doc/3d2128842.html, ;
初中化学金属及其化合物练习题
初中化学金属及其化合物练习题 【巩固练习】 一、选择题 1.(2016 甘肃省嘉峪关六中期末考)某病人被诊断患有缺铁性贫血,这里的“铁”指()。 A.铁元素B.铁粉C.四氧化三铁D.三氧化二铁 2.在烧杯中加水和苯(密度:0.88 g/cm3)各50 mL。将一小粒金属钠(密度:0.97 g/cm3)投入烧杯中,观察到的现象可能是()。 A.钠在水层中反应并四处游动 B.钠停留在苯层中不发生反应 C.钠在苯的液面上反应并四处游动 D.钠在苯与水的界面处反应并可能上、下跳动 3.下列反应中,调节反应条件以后,反应产物不会改变的是()。 A.钠与氧气B.NaOH溶液和Al2(SO4)3溶液 C.盐酸与铁粉D.二氧化碳与氢氧化钠溶液 4.小王喜欢做实验,一次他将一把没有擦干的小刀放在火上烤了一下,发现表面变蓝,他又将一把干燥的光亮小刀放在火上烤了一下,发现也有同样的现象发生,他分析后认为可能是火烤的过程中小刀表面生成了某种物质造成的。你认为此物质最有可能是()。 A.Fe3O4B.Fe(OH)3C.Fe2O3D.Fe(OH)2 5.下列反应,其产物的颜色按红、红褐、淡黄、蓝色顺序排列的是()。 ①金属钠在纯氧中燃烧②向FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间③向FeCl3溶液中滴入KSCN溶液④将无水硫酸铜放入75%的酒精中 A.②③①④B.③②①④C.③①②④D.①②③④ 6.甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种。若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失。将丁溶液滴入甲溶液中时,无明显现象,据此可推断丙物质是()。 A.Al2(SO4)3B.FeSO4C.NaOH D.BaCl2 7.纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体,下列区分这两种物质的方法中正确的是()。 A.分别用砂锅加热两种样品,全部分解挥发没有残留物的是小苏打 B.用洁净的铁丝蘸取两种样品在煤气灯火焰上灼烧,使火焰颜色发生明显变化的是小苏打 C.用两只小玻璃杯,分别加入少量的两种样品,再加入等量的食醋,产生气泡快的是纯碱 D.先将少量两种样品配成溶液,分别加入氯化钙溶液,无白色沉淀生成的是小苏打 8.(2016 安徽省太和八中期末考)制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu==2FeCl2+ CuCl2,向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,在烧杯中下列结果不可能出现的是()。 A.有铜无铁B.有铁无铜C.铁、铜都有D.铁、铜都无 9.(2015 广东深圳市宝安区期末考)向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液.下列图象中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)()。
级《配位化学》期末考试试题(A卷)
级《配位化学》期末考试试题(A 卷)
————————————————————————————————作者:————————————————————————————————日期: 2
泰山学院化学与环境科学系2007级化学系各专业本科 2009~2010学年第二学期 《配位化学》试卷 A (试卷共6页,答题时间120分钟) 题号 一 二 三 四 五 总分 统分人 复核人 得分 一、选择题(每小题 2 分,共 20 分。请将答案填在下面的表格内) 1、中心原子具有18+2电子结构的是( ) A. Al(III); B. Zn(II); C. Pb(II); D. Fe(III); 2、下列关于配合物几何异构体数目的叙述,正确的是( ) A.[Co(NO 2)3(NH 3)3]配合物有3种几何异构体; B.平面四边形配合物[M(abcd)]型配合物,只有1种几何异构体 ; C. [M(a 2b 2b 2]型的八面体配合物存在5种几何异构体; D.八面体[M(ab)3]配合物,不存在几何异构体; 3、配合物晶体场稳定化能的计算结果,错误的是( ) A. [Fe(H 2O)6]2+ 的CFSE=-0.4Δo B. [Mn(H 2O)6]2+ 的CFSE=-2.0Δo 得分 阅卷人 题号 1 2 3 4 5 6 7 8 9 10 答案
C. [Ni(H2O)6]2+的CFSE=-1.2Δo D. [Cu(H2O)6]2+的CFSE=-0.6Δo 4、指出下列配体的光谱化学序列中错误的排列顺序( ) A. en < NO2-; B. SCN- > CN-; C. NH3 < en ; D. H2O > C2O42-; 5、配合物荷移跃迁能排列顺序存在错误的是:() A. [OsCl6]2- > [OsBr6]2- > [OsI6]2- B. [Ru III Cl6]3- > [Ru IV Cl6]2- C. VO43 > CrO42- > MnO4- D. HgCl42- < HgBr42- < HgI42- 6、期刊https://www.360docs.net/doc/3d2128842.html,mun.主要收录在哪个数据库网址中?() A. https://www.360docs.net/doc/3d2128842.html, ; B. https://www.360docs.net/doc/3d2128842.html, ; C. https://www.360docs.net/doc/3d2128842.html, ; D. https://www.360docs.net/doc/3d2128842.html, ; 7、找出有关d n组态自由离子基谱项,错误的是:( ) A. d1组态的自由离子基谱项是2D ; B. d2组态的自由离子基谱项是1P; C. d3组态的自由离子基谱项是4F; D. d4组态的自由离子基谱项是5D; 8、配合物的立体结构与配位数的描述,错误的是( ) A. [Ag(NH3)2]+的配位数为2; B. 配位数为4的配合物,主要有四面体和平面四边形两种构型; C. 配位数为3的配合物只有平面三角形结构; 2 / 8
考配位化学复习题
配位化学复习题 1.试用图形表示下列配合物所有可能的异构体并指明它们各属哪一类异构体。 (2)[Co(NH3)3(H2O)ClBr]+(3)Rh(en)2Br2] (1)[Co(en)2(H2O)Cl] 2 (4)Pt(en)2Cl2Br2(5)Pt(Gly)3(6)[Cr(en)3][Cr(CN)6] 2.配合物[Pt(py)(NH3)(NO2)ClBrI]共有多少个几何异构体? 3.试举出一种非直接测定结构的实验方法区别以下各对同分异构体: (1)[Cr(H2O)6]Cl3和[Cr(H2O)5Cl]Cl2·H2O (2)[Co(NH3)5Br](C2O4)和[Co(NH3)5(C2O4)]Br (3)[Co(NH3)5(ONO)]Cl2和[Co(NH3)5(NO2)]Cl2 4.解释下列事实: (1)[ZnCl4]2-为四面体构型而[PdCl4]2-却为平面正方形? (2)Ni(II)的四配位化合物既可以有四面体构型也可以有平面正方形构型,但Pd(II)和Pt(II)却没有已知的四面体配合物? (3)根据[Fe(CN)6]4水溶液的13C-NMR只显示一个峰的事实,讨论它的结构。(4)主族元素和过渡元素四配位化合物的几何构型有何异同?为什么?(5)形成高配位化合物一般需要具备什么条件?哪些金属离子和配体可以满足这些条件?试举出配位数为八、九、十的配合物各一例,并说明其几何构型和所属点群。 5.阐述晶体场?分裂能的大小有何规律?分裂能与周期数有什么关系? 6. 为什么T d场的分裂能比O h场小? 如何理解四面体配合物大多数是高自旋的? 7.d n离子哪些无高低自旋的可能?哪些有高低自旋之分?确定高低自旋的实验方法是什么?用什么参数可以判断高低自旋? 8.根据LFT绘出d轨道在O h场和T d场中的能级分裂图。标出分裂后d轨道的符号 9.什么叫光化学顺序?如何理解电子云伸展效应?
初三化学-金属单元试题及答案资料
初三化学-金属单元试 题及答案
1.下列物品的主要材质当时不是通过化学变化获取的是 A.马踏飞燕(青铜器) B.龙泉剑(铁器) C.金缕衣 D.塑料器具 2.金属材料在人类活动中已得到越来越广泛的应用。下列性质属于金属共性的是 A.硬度很大、熔点很高 B.有良好的导电性、传热性 C.银白色的固体 D.易与酸反应产生氢气3.下列金属中,只能与硝酸银溶液反应,不能与稀硫酸反应的是() A.镁 B.银 C.铜 D.铝 4、在氯化铜和氯化镁的混合溶液中,加入过量的铁粉,充分反应后过滤,留在滤纸上的物质是() A、Fe和Cu; B、Cu; C、Fe; D、Mg和Cu 6.将M、N两种金属片分别放入硫酸铜溶液中,M表面析出铜,N没有明显现象。据此判断,三种金属的金属活动性顺序是 A. N>Cu>M B. M>Cu>N C. Cu> M > N D. M > N> Cu 7.有甲、乙、丙、丁四种金属。只有甲在自然界主要以游离态存在。丁盐的水溶液不能用乙制的容器盛放,但可以用丙制的容器盛放。这四种金属的活动性由强到弱的顺序是A.甲>乙>丁>丙 B.丙>丁>乙>甲 C.丙>乙>丁>甲 D.乙>丁>丙>甲8.某学生为了验证铁、锌、铜三种金属的活动性顺序,设计了四种方案:①将Zn、Cu分别加入到FeSO4溶液中;②将Zn、Cu分别加入到ZnSO4溶液中;③将Zn分别加入到FeSO4、CuSO4溶液中;④将Fe 分别加入到ZnSO4、CuSO4溶液中。其中可行的是 A.①④ B.①② C.②③ D.③④ 9.向含有AgNO3、Cu(NO3)2的混合溶液中加入一定量的锌粉,充分反应后过滤。向滤出的固体中滴加稀盐酸,没有气体生成。下列结论正确的是 A.滤出的固体中一定含有Ag B.滤出的固体一定是Ag和Cu的混合物 C.滤液中一定有Zn(N O3)2和C u(N O3)2 D.滤液中一定没有AgNO3和C u(N O3)2 14、下列除去杂质的方法中,错误的是()
考!!配位化学复习题 (1)知识分享
考!!配位化学复习题 (1)
配位化学复习题 1.试用图形表示下列配合物所有可能的异构体并指明它们各属哪一类异构体。 (2)[Co(NH3)3(H2O)ClBr]+(3)Rh(en)2Br2] (1)[Co(en)2(H2O)Cl] 2 (4)Pt(en)2Cl2Br2(5)Pt(Gly)3(6)[Cr(en)3][Cr(CN)6] 2.配合物[Pt(py)(NH3)(NO2)ClBrI]共有多少个几何异构体? 3.试举出一种非直接测定结构的实验方法区别以下各对同分异构体: (1)[Cr(H2O)6]Cl3和[Cr(H2O)5Cl]Cl2·H2O (2)[Co(NH3)5Br](C2O4)和[Co(NH3)5(C2O4)]Br (3)[Co(NH3)5(ONO)]Cl2和[Co(NH3)5(NO2)]Cl2 4.解释下列事实: (1)[ZnCl4]2-为四面体构型而[PdCl4]2-却为平面正方形? (2)Ni(II)的四配位化合物既可以有四面体构型也可以有平面正方形构型,但Pd(II)和Pt(II)却没有已知的四面体配合物? (3)根据[Fe(CN)6]4水溶液的13C-NMR只显示一个峰的事实,讨论它的结构。 (4)主族元素和过渡元素四配位化合物的几何构型有何异同?为什么?(5)形成高配位化合物一般需要具备什么条件?哪些金属离子和配体可以满足这些条件?试举出配位数为八、九、十的配合物各一例,并说明其几何构型和所属点群。
5.阐述晶体场?分裂能的大小有何规律?分裂能与周期数有什么关系? 6. 为什么T d 场的分裂能比O h 场小? 如何理解四面体配合物大多数是高自旋的? 7.d n 离子哪些无高低自旋的可能?哪些有高低自旋之分?确定高低自旋的实验方法是什么?用什么参数可以判断高低自旋? 8.根据LFT 绘出d 轨道在O h 场和T d 场中的能级分裂图。标出分裂后d 轨道的符号 9.什么叫光化学顺序?如何理解电子云伸展效应? 10.指出下列配离子哪些是高自旋的?哪些是低自旋的?并说明理由。 (1) FeF 36- (2) CoF 36- (3) Co(H 2O)36+ (4) Fe(CN)36- (5) Mn(CN)46- (6) Cr(CN)36- (7) Co(NO 2)26- (8) Co(NH 3)36+ 11.LFSE 的意义是什么在ML 6 配合物中LSFE 随d 电子数的变化有何特征? 12.什么叫Jahn-Tel1cr 效应?d 轨道哪些构型易发生畸变,哪些不易畸变,为什么?指出下列离子中易发生畸变者(ML 6为O h ML 4为Td 或D 4h )。 (1) Co(H 2O)36+ (2) Ti(H 2O)36+ (3) Fe(CN)46- (4) CoCl 24- (5)Pt(CN)24- (6) ZnCl 24- (7) Co(en)23 + (8) FeCl 4- (9) Mn(H 2O)26+ 13.试从Jahn-Teller 效应解释Cu 2+化合物的构型常常是四条、短键二条长键即近似为平面正方形四配位的结构。 14.已知第一过渡系M 2+离子半径如下表,写出他们在O h 弱场中的d 电子构型解释离子半径变化的规律。
