白三叶叶蛋白提取及纯化工艺_吕宗友

2052-205611/2011
草 业 科 学
PRATACULTURAL SCIENCE
28卷11期
Vol.28,No.11白三叶叶蛋白提取及纯化工艺
吕宗友,赵国琦,苏衍菁,邬彩霞,陆银,王小山
(扬州大学动物科学与技术学院,江苏扬州225009)
摘要:以白三叶(Trifolium repens)为材料探讨了叶蛋白的提取工艺和纯化方法。对白三叶叶蛋白提取中加热时间、温度、pH值、料液比、酸的种类等单因素以及纯化试剂甲醇、乙醇、丙酮、四氯化碳、水等进行了研究。结果表明,各单因素最佳参数为加热时间9min,温度90℃,pH值4.0,料液比1∶2,沉淀的酸为硝酸。对加热时间、加热温度、pH值和料液比进行4因素3水平正交试验,发现影响叶蛋白提取因素为pH值>温度>时间>料液比,最佳提取工艺为加热时间9min,温度80℃,pH值4.0,料液比1∶2。对叶蛋白纯化结果表明,纯化剂对叶蛋白纯度的影响依次为甲醇>乙醇>丙酮>四氯化碳>水,但各种纯化剂之间差异不显著(P>0.05)。
关键词:白三叶;叶蛋白;提取;纯化
中图分类号:S816.4;S541+.2 文献标识码:A 文章编号:1001-0629(2011)11-2052-05
蛋白质缺乏是世界性的[1]。高等植物的叶片被认为是最有前途的蛋白质资源。植物蛋白因其廉价、资源丰富并能满足人类和家畜对蛋白质的需求,引起了人们极大的关注[2-3]。开发植物蛋白质资源成为食品业和饲料业一个亟待解决的问题。
叶蛋白又称绿色蛋白浓缩物(leaf protein con-centration,LPC),是以新鲜牧草或其他青绿植物的生长组织(茎、叶)为原料,经打浆压榨后利用蛋白质等电点原理从其汁液中提取的高蛋白浓缩物[4]。白三叶(Trifolium repens)是一种豆科牧草,其青饲利用期长、粗蛋白质含量高、管理粗放、柔软细嫩,是重要的种植牧草和观赏草坪草[5-7]。目前,牧草中的苜蓿(Medicago sativa)[8]、聚合草(Symphytumperegrinum)[9]、串叶松香草(Silpnium perfolia-tum)[10]、酸模(Rumex acetosa)[11]、黑麦草(Loliumperenne)[12]的叶蛋白开发均有报道,而白三叶叶蛋白的研究较少。本试验通过对白三叶叶蛋白提取和纯化条件的探讨,为其开发利用提供参考。
1 材料与方法
1.1材料 白三叶于2010年4月中旬采自扬州大学动物科技学院草业科学牧草标本区。
1.2仪器 SGL-300食品料理机(天津达康电器公司);101型电热鼓风干燥箱(上海市实验仪器总厂);凯式定氮仪(天津玻璃仪器厂),用于粗蛋白质的测定,按照张丽英[13]提供的方法进行;HSS-I(B)恒温浴槽(成都仪器厂);Sartorius酸度计[赛多利斯科学仪器(北京)有限公司];SHB循环水式多用
真空泵(郑州长城科工贸有限公司)。
1.3试验步骤
1.3.1叶蛋白的提取步骤 均匀称取鲜样50g,剪成1cm左右的小段,按试验要求加入规定量的水,打浆4min,用3层滤布压滤浆液,弃草渣,将滤液调节到规定的pH值后于水浴中快速加热至规定的温度,恒温不同的时间,得絮凝物,过滤得叶蛋白膏,65℃烘干得叶蛋白浓缩物成品(图1)
。
图1 叶蛋白的提取步骤[1]
1.3.2叶蛋白提取单因素设计 分别以加热时间、加热温度、pH值、料液比和酸的种类(表1)作为影响白三叶叶蛋白提取率及沉淀率的因素,每个处理重复3次。
1.3.3叶蛋白提取的正交设计 在单因素试验的基础上,选4因素3水平作正交试验设计(表2)。由于料液比1∶5太浪费水,所以舍弃该比例。1.4计算及分析 叶蛋白提取率及蛋白提取率计算,采用张垚等[4]的研究方法。采用SPSS 16.0和
*
收稿日期:2011-01-06 接受日期:2011-05-04
作者简介:吕宗友(1983-),男,四川德阳人,在读硕士生,研究
方向为牧草次生代谢产物及其生物利用。
E-mail:2zongyou@163.com
通信作者:赵国琦 E-mail:jszhaoguoqi@sohu.com
11/2011草 业 科 学(第28卷11期)
表1 单因素设计
单因素料液比 pH值温度(℃)加热时间(min
)酸
酸
1∶2 4.0 90
9HCl、H2SO4、
HNO3、C2H6O2
加热时间(min)1∶2 4.0
90
5、7、9、11、15
温度(℃)1∶2 4.0
60、70、80、90、100
9pH值1∶2
3.0、4.0、5.0、6.5、8.0
90 9料液比
1∶1、1∶2、1∶3、
1∶4、1∶54.0
90
9
表2 正交试验设计
水平A(时间)B(温度)C(p
H值)D(料液比)1 9 80 3 1∶22 11 90 4 1∶33
13
100
5
1∶4
Excel分析处理数据。
1.5叶蛋白的纯化 分别使用四氯化碳、甲醇、无水乙醇、蒸馏水、丙酮5种试剂以料液比为1∶3浸洗新鲜提取的叶蛋白粗提物3h,3 000r/min离心10min,沉淀烘干后测定其纯化蛋白质含量。每个设计重复3次。
2 结果
2.1加热时间对提取率的影响 提取率随加热
时间的延长而提高,但各处理间差异不显著(P>0.05)。当加热时间为9min时,叶蛋白和蛋白提取率的增长均达到了最大,随着提取时间的延长,两项指标均下降然后保持恒定(图2
)
。图2 加热时间对叶蛋白纯化和提取率的影响
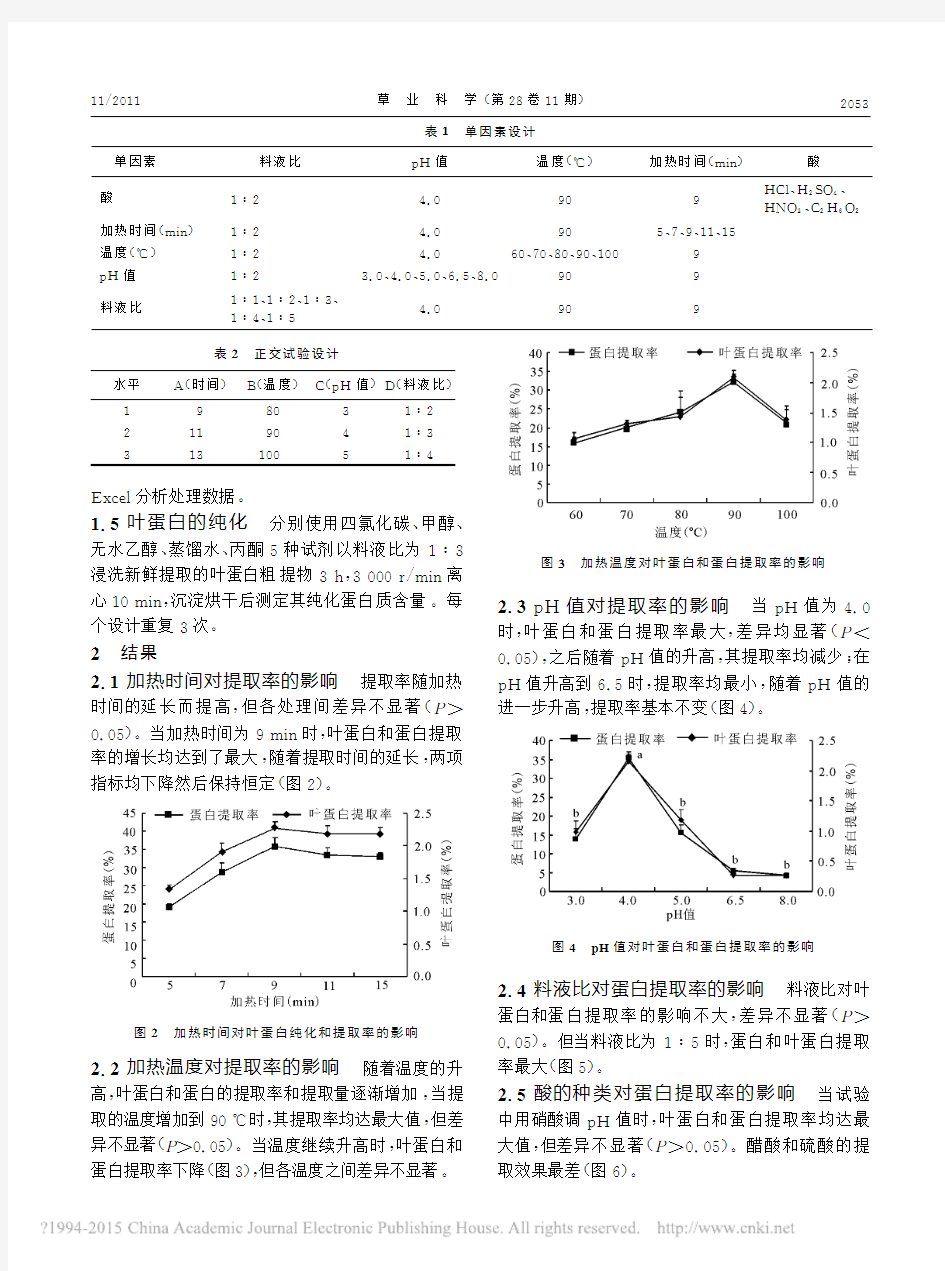
2.2加热温度对提取率的影响 随着温度的升
高,叶蛋白和蛋白的提取率和提取量逐渐增加,当提取的温度增加到90℃时,其提取率均达最大值,但差异不显著(P>0.05)。当温度继续升高时,叶蛋白和蛋白提取率下降(图3),但各温度之间差异不显著
。
图3 加热温度对叶蛋白和蛋白提取率的影响
2.3 p
H值对提取率的影响 当pH值为4.0时,叶蛋白和蛋白提取率最大,差异均显著(P<0.05),之后随着pH值的升高,
其提取率均减少;在p
H值升高到6.5时,提取率均最小,随着pH值的进一步升高,
提取率基本不变(图4)
。图4 pH值对叶蛋白和蛋白提取率的影响
2.4料液比对蛋白提取率的影响 料液比对叶
蛋白和蛋白提取率的影响不大,差异不显著(P>0.05
)。但当料液比为1∶5时,蛋白和叶蛋白提取率最大(图5
)。2.5酸的种类对蛋白提取率的影响 当试验
中用硝酸调pH值时,叶蛋白和蛋白提取率均达最大值,但差异不显著(P>0.05)。醋酸和硫酸的提取效果最差(图6
)。3
502
PRATACULTURAL SCIENCE(Vol.28,No.11)11/201
1
图5
料液比对叶蛋白和蛋白提取率的影响
图6 酸对叶蛋白和蛋白提取率的影响
2.6正交设计试验 通过正交试验和极差分析
可知:对于叶蛋白提取率来说,按照极差R的大小可
得出影响主次因素为C>B>A>D,即pH值>温
度>时间>料液比;对叶蛋白沉淀率来说,影响主次因素为C>A>B>D,即pH值>时间>温度>料液比(表3)。表中得出的最优结果是加热时间9min,温度80℃,pH值4.0,料液比1∶2。经试验验证,当按照最优结果进行提取时,叶蛋白提取率可达2.44%,叶蛋白沉淀率可达38.94%,正交设计所得出的为最优工艺。
2.7不同纯化剂对叶蛋白纯化的影响 未使
用纯化剂时,叶蛋白的纯度在50%左右。使用纯化剂时,叶蛋白纯度达到了70%左右。其中,纯化剂对叶蛋白纯度的影响依次为甲醇>乙醇>丙酮>四氯化碳>水,但各种纯化剂之间差异不显著(P>0.05
)(图7)
。图7 不同纯化剂对叶蛋白纯化的影响
表3 正交试验设计结果
试验时间温度pH值料液比叶蛋白提取率(%)蛋白提取率(%)1
1
1
1
1∶2
1.10±0.03
16.58±0.48
2 1 2 2 1∶3 2.42±0.03 38.85±0.463 1 3 3 1∶4 2.22±0.11 34.64±1.754 2 1 2 1∶4 2.23±0.01 35.16±0.225 2 2 3 1∶2 1.34±0.13 19.75±1.876 2 3 1 1∶3 0.10±0.01 1.58±0.187 3 1 3 1∶3 2.01±0.08 30.17±1.248 3 2 1 1∶4 0.11±0.02 1.63±0.279 3 3 2 1∶2 2.24±0.03
37.42±0.54
K1 5.74 5.34 1.31 4.68K2 3.67 3.87 6.89 4.53K3 4.36 4.56 5.80 4.56k1 1.91 1.78 0.44 1.56k2 1.22 1.29 2.30 1.51叶蛋白提取率
k3 1.45 1.52 1.93 1.52影响主次因素R 1.38 1.47 5.58 0.15C>B>A>D
K1 90.07 81.91 19.79 71.95K2 56.49 60.23 111.43 70.60K3 69.22 73.64 84.56 71.43k1 30.02 27.30 6.60 23.98k2 18.83 20.08 37.14 23.53叶蛋白沉淀率k3 23.07 24.55 28.19 23.81影响主次因素R
33.58
21.68
91.64
1.35
C>A>B>D
注:
ki值为同一水平下的平均值,Ki值为同一水平下的分值之和,R为不同水平间均值的极差。4
502
11/2011草 业 科 学(第28卷11期)
3 讨论
3.1单因素对白三叶叶蛋白提取率的影响 叶蛋白的提取方法有水溶液提取法、加热法、酸碱法、纯蛋白质沉淀法、盐析法、凝聚剂沉淀法、超滤法、电浓缩法、反胶团相转移法、有机溶剂沉淀法、发酵酸法等等。其中,直接加热法和酸化加热法是最常用的方法,两种方法的蛋白提取率均较高,成本均较低,适合大剂量叶蛋白的提取[14-15]。有研究[16]表明,酸化加热法能终止脱镁叶绿素的形成而避免动物食用后产生过敏反应,但该方法提取的叶蛋白絮凝物结构疏松,不易过滤分离,同时还加速不饱和脂肪酸的氧化,使胡萝卜素的损失增多。本试验在酸化加热时发现,低pH值适合蛋白质在等电点沉淀及加热钝化了蛋白酶活性,从而使叶蛋白的提取率最高。叶蛋白的提取率与酸的种类有关,盐酸沉淀的叶蛋白的量较硫酸,硝酸,醋酸大[17];高莉[14]的研究也表明,盐酸絮凝的情况下,马齿苋(Portulacaoleracea)的叶蛋白提取率及沉淀率均增大,这与本试验中硝酸能提高叶蛋白的提取率的结果不一致,可能与植物种类不同有关。
加热时间的长短影响叶蛋白的提取。试验中当加热时间小于9min时,由于加热时间过短,蛋白质沉淀不完全,当加热时间大于9min时,叶蛋白的沉淀不再增加,反而有减少的趋势,这与王桓[16]的研究结果一致。因为蛋白质的絮凝是一个需要能量的反应,随着加热时间的延长,沉淀所需的能量才能达到峰值,但当达到所需能量的峰值之后,对反应会造成负影响,使絮凝速度和絮凝的积累量都减少[4]。由于试验各种处理中得到的未纯化叶蛋白蛋白质含量基本一致,所以纯化蛋白提取率的趋势和叶蛋白也基本一致[4]。
温度的高低影响蛋白质的沉淀。本试验中当温度为90℃时,叶蛋白的提取率达到最大,当温度继续升高时,叶蛋白的提取率反而下降,这可能是温度升高杂质沉淀量增加而导致叶蛋白的提取率下降[12]。
蛋白质分子的电荷和溶解度可随环境的pH值的变化而变化。pH值较低时,碱性氨基酸的支链功能基及酸性氨基酸的羧基质子化,蛋白质带正电荷;pH值较高时,碱性与酸性功能基中的质子被移除,蛋白质带负电荷;在某一特定pH值时,蛋白质为电中性[8]。试验中当pH值为4.0时,叶蛋白提取量达最大值,此时叶蛋白的溶解度最小;当pH值
接近中性时,大量的叶蛋白溶解,这与Dalev等[2]的研究结果一致。当pH值继续增加时,更大量的叶蛋白溶解[14]。
影响叶蛋白提取率的最主要原因是其叶蛋白能否提取完全。理论上,当料液比越大时,叶蛋白提取越完全,而适中的料液比能以最少的提取液获得最大的叶蛋白。本试验中当料液比小于1∶2时,叶蛋白未完全溶解,叶蛋白的提取率低;当料液比为1∶3时,叶蛋白提取率较高;之后随着料液比的增加,叶蛋白提取率不再增加。
3.2正交设计对叶蛋白提取的优化 本试验中正交设计影响的主次因素为C>B>A>D,即pH值>温度>时间>料液比。pH值在试验中占主要因素,这与吴峰华等[18]的研究结果一致。pH值在4.0时,叶蛋白质处在等电点,蛋白质分子以双极离子存在,总净电荷为零,颗粒无电荷间的排斥作用,易凝集成大颗粒,因而最不稳定,溶解度最小,易沉淀析出。当温度为80℃时,能迅速使最适温度分别为55℃及45℃的血红蛋白水解酶和羧肽酶钝化,降低了蛋白质的降解;当温度低于80℃时,由于温度太低,部分巯基蛋白酶的活性仍很高,导致蛋白质降解损失升高;当温度高于80℃时,蛋白质又被溶解,导致溶解损失。但张垚等[4]的研究结果表明,温度的影响较pH值的大,可能是因为植物种类不同,其组成蛋白质的氨基酸的酸碱性不同,受pH值的影响不同。
3.3叶蛋白的纯化 叶蛋白中含脂化合物、叶绿素以及类胡萝卜素等植物色素和导致叶蛋白有不良风味和颜色的多酚类物质,烘干后发黑,影响了其利用。有机溶剂可除去这些化合物[19],且纯化剂的使用能提高叶蛋白的纯度近20%,粗制得到的叶蛋白呈墨绿色,经过不同纯化剂的纯化后,产品色泽变浅,青草味消失,叶蛋白的蛋白质含量明显提高[20]。本试验的纯化剂为醇类物质时纯化效果最好。黄威[21]也认为醇类的浓度越高,蛋白质的含量也越高,醇提法可除掉类脂化合物、叶绿素以及类胡萝卜等植物色素和多酚化合物。水的效果最差,是因为叶绿素类物质不溶于水。
4 结论
白三叶叶蛋白单因素提取的最佳参数为加热时间9min,温度90℃,pH值4.0,料液比1∶2,沉淀的酸为硝酸。通过正交试验设计可知叶蛋白提取的
5
5
0
2
PRATACULTURAL SCIENCE(Vol.28,No.11)11/2011
最佳工艺为加热时间为9min,温度为80℃,pH值为4.0,料液比为1∶2。纯化叶蛋白的最佳试剂是甲醇,以料液比1∶3纯化叶蛋白粗提取物最有效。参考文献
[1] Ghaly
A E,Alkoaik F N.Extraction of protein fromcommon plant leaves for use as human food[J].Ameri-can Journal of Applied Sciences,2010,7(3):323-334.[2] Dalev P,Ljubomirova A,Ivanov I.Enzy
me extraction,functional properties and application of leaf proteinfractions of nettle[J].Biotechnology Letters,1996,18(1):107-
110.[3] Yust M M,Pedroche J,Megías C,et al.Imp
rovement ofprotein extraction from sunflower meal by
hydrolysis withalcalase[J].Grasasy aceites,2003,54(4):419-423.[4] 张垚,
白志明,董宽虎,等.苜蓿鲜草提取叶蛋白最适条件的研究[J].中国草地学报,2007,29(6):69-72.[5] 梁哲,
姜三杰,未丽,等.三叶草基因工程研究进展[J].草业学报,2009,18(2):205-
211.[6] 张婧源,
彭燕,罗燕,等.不同产地白三叶种质遗传多样性的SRAP分析[J].草业学报,2010,19(5):130-138.[7] 王友生,
王瑛,李阳春.三叶草愈伤组织诱导及分化的研究[J].草业学报,2009,18(2):212-
215.[8] 韩鲁佳,
阎巧娟,李道娥,等.苜蓿叶蛋白提取工艺条件对蛋白质含量的影响[J].中国农业大学学报,1997,2(6):92-
95.[9] 李凤玲,
何金环.聚合草鲜草叶蛋白提取条件研究[J].中国草地学报,2009,31(2):76-
80.[10] 姚爱兴,
崔慰贤,王玲.串叶松香草和紫花苜蓿叶蛋白提取技术研究[J].中国饲料,2000(3):33.
[11] 韩丽琴,
刘建华,董顺福.鲁梅克斯叶蛋白提取的研究[J].吉林医药学院学报,2007,28(1):20-
21.[12] 杨超英,
刘艳,薛正莲,等.黑麦草叶蛋白提取工艺研究[J].中国农学通报,2007,23(5):14-
17.[13] 张丽英.
饲料分析及饲料质量检测技术[M].北京:中国农业大学出版社,2002:52-
53.[14] 高莉,
刘捷,张平,等.从马齿苋中提取叶蛋白工艺的研究[J].食品与机械,2007,23(1):90-
92.[15] 杨林.
新疆紫花苜蓿叶蛋白的提取及应用研究[D].乌鲁木齐:新疆大学,2008:16-
18.[16] 王桓.
四翅滨藜叶蛋白的提取及物性学研究[D].乌鲁木齐:新疆大学,2009:34-
35.[17] Fernández S S,Padilla A P,Mucciarelli S.Protein ex-
traction fromAtriplex lampaleaves:potential use asforage for animals used for human diets[J].PlantFoods for Human Nutrition(Formerly Qualitas Plan-tarum),1999,54(3):251-
259.[18] 吴峰华,
杨虎清,何志平.豆腐柴叶蛋白提取工艺研究[J].食品工业科技,2010(2):240-
241.[19] 杨春波.
苜蓿叶蛋白的提取与应用研究[D].无锡:江南大学,2007:14-
17.[20] 田丽萍,
李宪刚,张静,等.乙醇纯化苜蓿叶蛋白效果初探[J].安徽农学通报,2007,13(5):38-
39.[21] 黄威.
南瓜叶蛋白加工方法及其制品的安全性评价研究[D].重庆:西南大学,2010:17-
21.A study
on leaf protein extraction and purification of white cloverLV Zong-you,ZHAO Guo-qi,SU Yan-jing
,WU Cai-xia,LU Yin,WANG Xiao-shan(College of Animal Science and Technology,Yangzhou University,Jiangsu Yang
zhou 225009,China)Abstract:The leaf protein(LPC)of white clover(Trifolium repens)were extracted and purified by
singlefactor experiment.Heat time,temperature,pH value,the sort of acid and the ration of fresh leaf to wateras extracting factors were studied in extracting
leaf protein.Methanol,ethanol,acetone,carbon tetrachlo-ride,water as extracting solutions were studied in purifying leaf protein.The results showed that the opti-mum time,temperature,p
H value,acids and the ration of fresh leaf to water were 9minutes,90℃,4.0,nitric acid,1∶2,respectively.The result of orthogonal experiment showed that the sequence of the fac-tors in affecting
extraction ratio of the LPC was pH value,temperature,heat time and the ratio of freshleaf to water.The optimum combination condition was pH value 4.0,temperature 90℃,heat time 9minand the fresh leaf to water 1∶2.The result of the purification method showed that the sequence of the p
u-rifiers in affecting protein purification was methanol,ethanol,acetone,carbon tetrachloride,water;andthere were not significant differences(P>0.05)among
the factors.Key
words:white clover;leaf protein;extraction;purification6
502
银杏叶提取黄酮及分离纯化
银杏叶提取黄酮及分离纯化 组员:李佳辉、黄埔、赵超武 一、实验目的 1.掌握传统的溶剂提取法并对银杏中的黄酮进行提取 2.掌握紫外分光光度计的应用,以及相关溶液的配置 3.学会自主设计实验,培养团队合作精神 二、实验原理 ⑴关于黄酮:银杏中最具药用价值的成分,有提高人体免疫力的作用;并且抗衰老、调节内分泌,还具有抗炎、抗真菌的作用; ⑵实验需设置空白参比液,由文献资料可知芦丁标准液的最大波长大概为510nm; ⑶本实验采用硝酸铝(氯化铝)法测定银杏叶总黄酮的质量浓度,因 为黄酮类化合物可以与铝盐发生络合显色反应。 其主要原理为:在中性或弱碱性及亚硝酸钠存在的条件下,黄酮类化合物与铝盐发生螯合反应,加入氢氧化钠溶液后,溶液显橙红色,在510nm(左右)处有吸收峰,且符合定量分析的朗伯—比尔定律(即A=kbc)一般与芦丁标准溶液比较定量。先用亚硝酸钠还原黄酮类化
合物,再加铝盐络合,最后加氢氧化钠溶液使黄酮类化合物开环,生成2-羟基查尔酮而显色。显色原理发生在黄酮醇类邻位无取代的邻二酚羟基部位,不具有邻位无取代的邻二酚羟基的黄酮类成分加入上述试剂时是不显色的。(如二氢黄酮类化合物就不发生该显色反应)
目前银杏叶黄酮的提取方法主要有:溶剂提取法、超临界流体萃取法(SFE法)、高速逆流色谱技术提取法(HSCCC)微波提取法、超色波提取法、酶提取法、分子烙印技术。因溶剂提取法操作简单,所需试剂廉价易得,故通常使用此法来进行大规模生产。 其工艺流程如下: 银杏叶—→粉碎—→NaOH-60%乙醇回流提取—→离心—→过滤—→滤液收集—→二次醇提—→合并两次滤液—→树脂吸附—→脱吸—→浓缩—→干燥—→提取物 由于银杏叶黄酮中的类黄酮主要为芦丁,故用芦丁为对照物绘制标准曲线,并采用分光光度法进行测定。 三.实验材料及器材 1.材料 酸银杏叶、芦丁、亚硝酸钠、硝酸铝、氢氧化钠、95%乙醇、磷酸氢二钠、磷二氢钠、D101大孔吸附树脂、盐酸
蛋白质的纯化方法
蛋白质纯化的方法 蛋白质的分离纯化方法很多,主要有: (一)根据蛋白质溶解度不同的分离方法 1、蛋白质的盐析 中性盐对蛋白质的溶解度有显著影响,一般在低盐浓度下随着盐浓度升高,蛋白质的溶解度增加,此称盐溶;当盐浓度继续升高时,蛋白质的溶解度不同程度下降并先后析出,这种现象称盐析,将大量盐加到蛋白质溶液中,高浓度的盐离子(如硫酸铵的SO4和NH4)有很强的水化力,可夺取蛋白质分子的水化层,使之“失水”,于是蛋白质胶粒凝结并沉淀析出。盐析时若溶液pH在蛋白质等电点则效果更好。由于各种蛋白质分子颗粒大小、亲水程度不同,故盐析所需的盐浓度也不一样,因此调节混合蛋白质溶液中的中性盐浓度可使各种蛋白质分段沉淀。 影响盐析的因素有:(1)温度:除对温度敏感的蛋白质在低温(4度)操作外,一般可在室温中进行。一般温度低蛋白质溶介度降低。但有的蛋白质(如血红蛋白、肌红蛋白、清蛋白)在较高的温度(25度)比0度时溶解度低,更容易盐析。(2)pH值:大多数蛋白质在等电点时在浓盐溶液中的溶介度最低。(3)蛋白质浓度:蛋白质浓度高时,欲分离的蛋白质常常夹杂着其他蛋白质地一起沉淀出来(共沉现象)。因此在盐析前血清要加等量生理盐水稀释,使蛋白质含量在2.5-3.0%。 蛋白质盐析常用的中性盐,主要有硫酸铵、硫酸镁、硫酸钠、氯化钠、磷酸钠等。其中应用最多的硫酸铵,它的优点是温度系数小而溶解度大(25度时饱和溶液为4.1M,即767克/升;0度时饱和溶解度为3.9M,即676克/升),在这一溶解度范围内,许多蛋白质和酶都可以盐析出来;另外硫酸铵分段盐析效果也比其他盐好,不易引起蛋白质变性。硫酸铵溶液的pH常在4.5-5.5之间,当用其他pH值进行盐析时,需用硫酸或氨水调节。 蛋白质在用盐析沉淀分离后,需要将蛋白质中的盐除去,常用的办法是透析,即把蛋白质溶液装入秀析袋内(常用的是玻璃纸),用缓冲液进行透析,并不断的更换缓冲液,因透析所需时间较长,所以最好在低温中进行。此外也可用葡萄糖凝胶G-25或G-50过柱的办法除盐,所用的时间就比较短。
银杏叶黄酮提取及含量测定
银杏叶黄酮提取及含量测定 一、实验目的 1、掌握银杏叶中黄酮的提取方法 2、了解银杏叶中黄酮的含量测定 二、实验原理 近几年来,随着对黄酮类化合物研究的日益深入与重视,黄酮类化合物提取技术的发展也得到了促进。目前提取黄酮类化合物的方法主要包括有机溶剂浸提法、超声波提取法、超临界流体萃取法、微波提取法和酶提取法等。 1.1有机溶剂浸提法 目前国内外使用最广泛的银杏叶中黄酮的提取方法就是有机溶剂提取法,一般可用乙酸乙酯、丙酮、乙醇、甲醇或某些极性较大的混合溶剂,如甲醇-水(1+1)溶液。由于甲醇的毒性、挥发性较大,因此一般采用乙醇作为提取剂。银杏叶干燥粉碎后用有机溶剂浸泡、提取、过滤,滤液中的溶剂经减压蒸馏除去后得银杏叶浸膏粗提物。徐桂花等[1]提取银杏叶中黄酮类化合物时,采用乙醇(70+30)溶液为提取剂,提取温度为70℃,料液质量浓度比为1g比40mL,提取时间为4h。由于乙醇提取工艺在安全性、溶剂成本、效率及杂质酚酸去除等方面都不能应对日益严酷的市场竞争,张林涛等[1]提出了以硼砂- 氢氧化钙碱水为溶剂提取银杏叶黄酮,其黄酮提取率与文献值相近,但提取工艺时间缩短为1h。 1.2超声波提取法 超声波提取法是利用搅拌作用、强烈的振动和空间效应、高的加速度等使药物有效成分进入溶剂,从而提高提取率,缩短提取时间,并能消除高温对提取成分影响的一种提取法。刘晶芝等[2]运用了超声波技术与水浸提取相结合的方法得出超声波提取的最佳工艺条件为:超声频率40kHz,超声处理时间55min,料液质量比1比100,提取温度35℃,静置3h,提取率为81.9%。郭国瑞等[3]以水为介质,超声波提取银杏叶中黄酮苷,与常规水浸提法比较,超声波提取效率大大提高,确定超声波提取的最佳工艺为:超声处理时间55min,料液质量比1比30,提取温度50℃,提取率为82.3%。 1.3超临界流体萃取法 超临界流体萃取法是一种以超临界流体代替常规有机溶剂对有效成分进行萃取和分离的新技术。可作为超临界流体的物质很多,其中二氧化碳临界温度(TC=31.3℃)接近室温,且具有无色、无毒、无味、不易燃、化学惰性、价廉、易制成高纯气体等优点而被广泛应用,特别在中药材及其制剂中更显示出其独特、简便、快速、具有较高的选择性、提取杂质少、可直接进样分析的优点。邓启焕等[4]探讨了超临界萃取银杏叶有效成分的影响因素,最佳条件为萃取压力20MPa、时间90min、粒度3.9mm、温度40℃,经测定银杏叶黄酮的质量分数为28%,高于国际公认标准。 1.4微波提取法 微波提取法是利用分子或离子在微波场中的导电效应直接对物质进行加热从而提取植物细胞内耐热物质的新工艺。曾里等[5]的研究表明以乙醇溶液作溶剂比以水作溶剂的效果好,最佳条件为以乙醇 (60+40)溶液为提取剂,解冻处理20min。张鹏等[6]对微波法提取银杏叶中黄酮类物质进行了研究,最佳提取条件为以乙醇(50+50)溶液
蛋白质分离纯化的步骤
蛋白质分离纯化的一般程序可分为以下几个步骤: (一)材料的预处理及细胞破碎 分离提纯某一种蛋白质时,首先要把蛋白质从组织或细胞中释放出来并保持原来的天然状态,不丧失活性。所以要采用适当的方法将组织和细胞破碎。常用的破碎组织细胞的方法有: 1. 机械破碎法 这种方法是利用机械力的剪切作用,使细胞破碎。常用设备有,高速组织捣碎机、匀浆器、研钵等。 2. 渗透破碎法 这种方法是在低渗条件使细胞溶胀而破碎。 3. 反复冻融法 生物组织经冻结后,细胞内液结冰膨胀而使细胞胀破。这种方法简单方便,但要注意那些对温度变化敏感的蛋白质不宜采用此法。 4. 超声波法 使用超声波震荡器使细胞膜上所受张力不均而使细胞破碎。 5. 酶法 如用溶菌酶破坏微生物细胞等。 (二)蛋白质的抽提 通常选择适当的缓冲液溶剂把蛋白质提取出来。抽提所用缓冲液的pH、离子强度、组成成分等条件的选择应根据欲制备的蛋白质的性质而定。如膜蛋白的抽提,抽提缓冲液中一般要加入表面活性剂(十二烷基磺酸钠、tritonX-100 等),使膜结构破坏,利于蛋白质与膜分离。在抽提过程中,应注意温度,避免剧烈搅拌等,以防止蛋白质的变性。(三)蛋白质粗制品的获得选用适当的方法将所要的蛋白质与其它杂蛋白分离开来。比较方便的有效方法是根据蛋白质溶解度的差异进行的分离。常用的有下列几种方法: 1.等电点沉淀法不同蛋白质的等电点不同,可用等电点沉淀法使它们相互分离。 2.盐析法 不同蛋白质盐析所需要的盐饱和度不同,所以可通过调节盐浓度将目的蛋白沉淀析出。被盐析沉淀下来的蛋白质仍保持其天然性质,并能再度溶解而不变性。 3.有机溶剂沉淀法 中性有机溶剂如乙醇、丙酮,它们的介电常数比水低。能使大多数球状蛋白质在水溶液中的溶解度降低,进而从溶液中沉淀出来,因此可用来沉淀蛋白质。此外,有机溶剂会破坏蛋白质表面的水化层,促使蛋白质分子变得不稳定而析出。由于有机溶剂会使蛋白质变性,使用该法时,要注意在低温下操作,选择合适的有机溶剂浓度。 (四)样品的进一步分离纯化
银杏叶中黄酮的提取原理及方法
银杏叶中黄酮提取及含量测定 一、实验目的 提取银杏叶中的总黄酮并测定其含量。 二、实验原理 银杏系银杏科银杏属落叶乔木,银杏叶中含有多种生理活性成分,其中黄酮类化合物是重要的生理活性物质,具有保肝护肝、预防治疗心血管疾病、抗氧化、抗衰老等作用。因此,将银杏叶作为高营养、保健功能价值的资源加以开发利用,这对于提高银杏叶综合利用率有重要意义。银杏叶黄酮类化合物的提取方法目前研究的有水浸取法,成本低但浸取率低;有机溶剂浸取法中,乙醇浸取的效率高且无毒,是目前采用较多的方法;韩玉谦等采用超临界流体萃取法,在70%乙醇溶液中加热回流法和CO2 超临界流体萃取法提取银杏叶中的活性成分,银杏黄酮回收率为84 . 4 % ,是常规萃取法回收率的2倍多;乙醇超声波浸取法, 黄酮提取率可达到8 6 . 7 %。银杏黄酮含量的测定常用分光光度法和高效液相色谱法。分光光度法自20世纪9 0年代以来一直是用来测定银杏黄酮的一种重要方法, 由于其成本低、便于操作等特点, 是一种快捷有效的方法[1]。本实验采用乙醇作溶剂进行索氏提取,建立了用Al(NO3)3显色法对芦丁标准品和银杏叶提取液进行光谱扫描测定银杏叶总黄酮含量的方法[2]。 三、实验仪器和试剂 材料:银杏叶粉末50g 试剂:标准芦丁样品,无水乙醇(600ml),50mlAl(NO3)3(0.1mol/L),乙醚,5%NaNO2溶液,10%AL(NO3)3,4%NaOH溶液。
仪器:紫外分光光度计、电子分析天平、水浴锅、烘箱、烧杯、容量瓶(100ml1个、50ml1个、10ml6个)、索氏提取器、减压蒸馏装置、锥形瓶、沸石等。 四、实验步骤 1.1提取银杏叶中总黄酮 (1)将银杏叶洗净, 在103℃下烘干至恒重,用研钵捣碎制得银杏叶粉(2)准确称取10.0g,置于索氏提取器中,按下列条件加热回流提取:乙醇浓度80%,料液比1:20(g/ml),回流温度85℃,回流时间2 h,平行进行1~3次实验。 (3)将圆底烧瓶中提取液倒入烧杯,加入一倍蒸馏水,再加入相同量的乙醚,混合均匀,倒入分液漏斗中,静置20min,分层后,收集下层液体。 (4)减压蒸馏,回收乙醇,得到淡黄色黏液,干燥得到银杏叶中总黄酮提取物。 1.2银杏叶中总黄酮含量测定 (1)芦丁标准溶液的配置:称取0.0100g芦丁标准品,放入烧杯中,加入80%的乙醇溶液使其溶解,置于100ml的容量瓶中,制成0.1g/L的芦丁标准溶液。定容,摇匀备用。 (2)绘制芦丁标准曲线:分别移取0,0.4 ,0.8,1.2,1.6,2.0 ml 芦丁对照品溶液,于6个10ml 容量瓶中,标记1~6,分别加入2.0、1.6、1.2、0.8、0.4、0ml的80%乙醇溶液,加入5%NaNO2溶液0.5ml,摇匀,放置6min,加入0.5ml10%AL(NO3)3,摇匀,放置6min,加入4%NaOH 溶液4.0ml,加入80%乙醇定容,摇匀,放置20min。在波长510nm处分
蛋白质提取及纯化
蛋白质提取及纯化 提取蛋白质的当天早晨去后把高速离心机和超高速离心机都打开冷却 1、前一天晚上用Resuspension Buffer重悬4L菌体,然后离心于4C保存,第 二天使用。 2、用少量预冷的Resuspension Buffer重悬细菌,1 protease inhibitor tablets(EDTA Free),1mM PMSF, 然后用玻璃Homogenizer做均一化处理,将总体积调至80ml; 3、High Pressure Homogenizer破壁,特别注意样品一定要在不加压力的情况 下运行一个循环(2min);然后1200bar,6min三个循环,整个过程冰水冷却; 4、DNaseI处理:加入2.5mg DNaseI,10mM MgCl2, 室温处理30min; 5、 11.000rpm,4℃,15min; then 11.000rpm,4℃,15min; 6、 1mM PMSF, 45.000rpm,4℃,90min; 7、用Resuspension Buffer洗两次以除去可溶性的蛋白质,然后预热分光光度 计; 8、用3-4ml Binding Buffer重悬Membrane pellets,动作一定要轻缓,重悬 后的总体积不超过8ml,取出300ul测定OD800和OD850(以OD850为准),测定时候是逐步稀释,每次吸光值小于1; 9、调整OD850≤30-50,在缓慢搅拌(速度一定要慢)的情况下逐滴加入30%的 LDAO使其终浓度达到0.5%,1mM PMSF,26℃黑暗条件下重悬1h,期间注意观察颜色变化; 10、45.000rpm, 4℃, 30min,注意观察颜色的变化以及沉淀是否发生明显的变化。 Charge and Equilibrate Resin (1)用蒸馏水冲洗柱子以除去20%酒精,注意不要用buffer,1ml/min,至紫外 吸收和电导稳定; (2)用0.1M NiSO4 Charge Resin,1ml/min,10倍柱体积,尽量使得紫外吸收 和电导稳定; (3)用蒸馏水冲洗,1ml/min,至紫外吸收和电导稳定;
银杏叶提取工艺
银杏叶提取工艺 一.实验仪器及试剂 1.实验器材:电子分析天平,烘箱,粉碎机,分样筛(60目),恒温水浴锅,分光光度 计,真空干燥机 2.玻璃仪器:棕色广口瓶,烧杯(1L),容量瓶(25mL)玻璃棒,温度计,普通漏斗, 分液漏斗,布氏漏斗,具塞刻度比色管(10mL),移液枪,比色杯 3.试剂:60%乙醇溶液(取640mL95%乙醇,360mL纯净水配成60%乙醇溶液),石油醚, 30 %乙醇溶液,5%亚硝酸钠溶液,10%硝酸铝溶液,1mol/L氢氧化钠溶液,芦丁粉 4.装置:蒸馏装置,抽滤装置,萃取装置 5.其他材料:纱布,银杏叶 二.实验步骤 1.预备取新鲜银杏叶,洗净,晾干,于70℃烘箱中烘9h(时间视样品水分含量定, 可以8~12h),取出置于干燥箱内冷却,用粉碎机粉碎过60目筛,粉末置于棕色广 口瓶中存储。 2.浸提配制60%乙醇溶液(取640mL95%乙醇,360mL纯净水配成60%乙醇溶液)。取 100g银杏叶粉于700mL60%乙醇中,在水浴锅内加热到60℃~70℃,浸提2h,每10min 搅拌一次,用纱布过滤,残渣中加入60%乙醇700mL,60℃~70℃继续浸提2h,每10min 搅拌一次,纱布过滤,合并浸提液。同时做平行实验。 3.除脂类和叶绿素将滤液盛于分液漏斗中,用石油醚萃取1~2次,每次石油醚用量 约为滤液体积的1/25,直到水层不含叶绿素为止。 4.抽滤先用纱布粗滤,去除大颗粒沉淀,以提高抽滤速度。安装抽滤仪器,往布氏漏斗 中加入少量浸提液进行抽滤,由于银杏叶中含有胶状沉淀物,滤纸易造成堵塞,导致抽 滤速度下降,故应经常更换滤纸。抽滤结束后,取滤液弃滤渣。 5.蒸馏、浓缩安装蒸馏、浓缩仪器,抽滤液中含大量乙醇溶液,用蒸馏装置进行乙醇 浓缩。一定量的乙醇也具有杀菌作用,在测定提取物抑菌作用时,应尽量排除乙醇溶 剂的干扰,使乙醇完全挥发干净。为了不破坏提取物中有效成分,水浴温度控制在 60℃~70℃,而95%乙醇的沸点在75℃左右,故蒸馏速度慢,时间长。可采取简单的方 法,直接水浴加热,在空气中挥发乙醇,此法缺点:不能回收乙醇。最终得到的提取物为 一部分沉淀浸膏,颜色为深棕色粘稠物。 6.干燥由于浓缩的浸提液中仍含有部分乙醇和水分,采用真空干燥法,温度控制在 60℃~70℃之间,利用增大真空度来降低沸点,去除最后的乙醇和残留的部分水分。 如果条件允许还可以采用冰冻干燥法干燥。此时的提取物中除含有黄酮类和内酯外, 还含有一定量的杂质。
蛋白质的分离纯化--有机溶剂分离纯化法
蛋白质的分离纯化--有机溶剂分离纯化法 文章出处:朱敏 蛋白质的分离纯化--有机溶剂分离纯化法 有机溶剂能降低溶液的介电常数,从而增加蛋白质分子上不同电荷的引力,导致溶解度降低。有机溶剂与水作用能破坏蛋白质的水化膜,使蛋白质在一定浓度的有机溶剂中沉淀析出。常用的有机溶剂是乙醇和丙酮,由于有机溶剂的加入易引起变性失活,尤其乙醇和水混合释放热量,操作一般宜在低温下进行,且在加入有机溶剂时注意搅拌均匀以免局部浓度过大。用此法所析出的沉淀一般比盐析法易过滤或离心沉降。分离后的蛋白质沉淀应立即用水或缓冲液溶解,以降低有机溶剂的浓度。操作时的pH值大多数控制在待沉淀蛋白质等电点附近。有机溶剂在中性盐存在时能增加蛋白质的溶解度,减少变性和提高分离的效果。一般在有机溶剂沉淀时添加中性盐的浓度在0.05mol左右,过多不仅耗费有机溶剂,而且可能导致沉淀不好.沉淀的条件一经确定,就必须严格控制,才能得到重复性结果.有机溶剂浓度通常以有机溶剂和水容积比或用百分浓度素示.故操作条件比盐析法严格。 许多有机溶剂,如碳链较长的醇,它溶于水,但有限度。其量大到一定程度后则分成两相,一相以水为主,一相以有机溶剂为主。某些第3组分的存在可以改变两相的比例和组成。有许多蛋白质在两相中均能溶解,形成分配。在同一个两相的溶剂系统中,不同的蛋白质有不同的分配系数。根据这一原理,操作全部机械化的有逆流分溶。因要求实验室温度恒定且操作也繁杂,虽一直有人在用但很不普遍。分配层析也是应用这一原理,但在分离纯化蛋白质工作中用得不多,主要是因为多数蛋白质在有机溶剂中,特别是在易与水分相的溶剂中溶解度小且易变性。 疏水层析是近年发展的新方法。它利用蛋白质表面有一部分疏水性,与带有疏水性的载体在高盐浓度时结合。洗脱时将盐浓度逐渐降低,蛋白质因疏水性不同而逐个地先后被洗脱而纯化。此法能分离其它一些方法不易纯化的蛋白质。 利用分子形状和大小不同的分离方法 蛋白质形状有细长的如纤维,有密实的如圆球,形状很不相同。蛋白质的分子量从6000左右开始,有各种大小,大的可以大到几百万。利用这些差别,有几种方法可用来分离蛋白质。 凝胶层析 属最常用的蛋白质分离方法。系混合物随流动相流经装有凝胶作为固定相的层析柱时,混合物中各物质因分子大小不同而被分离的技术。所指凝胶从广义上说是一类具有三维空间多孔网状结构的物质,如天然物质中的马铃薯淀粉及琼脂糖凝胶,人工合成品的葡聚糖凝胶及带离子交换基团的葡聚糖凝胶等。把适当的凝胶颗粒装填到玻璃管中制成层析柱,于柱内加入欲分离的混合物,然后用大量蒸镏水或其它稀溶液洗柱,由于混合物中各物质的分子大小和形状不同,在洗柱过程中,分子量最大的物质不能进入凝胶网孔而沿凝胶颗粒间的空隙最先流出柱外。分子量最小的物质因能进入凝胶网孔而受阻滞,流速缓慢,致使最后流出柱外。整个过程和过滤相似,故又名凝胶过滤、凝胶渗透过滤、分子筛过滤等。由于物质在分离过程中的阻滞减速现象,有人也称之为阻滞扩散层析、排阻层析等。
银杏叶中黄酮类化合物的提取工艺研究
2006年第13卷第6期 化工生产与技术ChemicalProductionandTechnology !!!!!!" !" !!!!!!" !" 研究与开发 收稿日期:2006-10-10 以银杏叶提取物(GBE)为原料制成的药物具有清除自由基,防止脑缺血和脑水肿,改善脑功能等多种作用。银杏叶制剂还可用于保健食品和化妆品等[1,2]。银杏叶中黄酮类化合物的提取直接决定着银杏叶的药用价值,因而成为国内外的研究热点。 提取方法最早用水浸提法,此方法具有设备简单、成本低且对环境和人类无毒害的特点,但提取率偏低、杂质含量较高,后处理难度大。有机溶剂法尤其酮、醇提取法是相当经典的方法,比如用丙酮作为提取剂的方法有:(1)丙酮提取-四氯化碳萃取法;(2)丙酮提取-氢氧化铅沉淀法;(3)丙酮提取-氨水沉淀法;(4)丙酮提取-硅藻土过滤法。(1)法工艺产品黄酮含量太低,达不到标准,(2)~(4)法工艺虽然能较好地从银杏叶中提取出有效成分含量较高的提取物,但它们存在着很多缺点。例如,使用了丁酮、四氯化碳等有毒害溶剂等,产品中无法避免这些物质的残留;操作复杂和步骤多,导致GBE收率低且最终精制品的质量不够稳定。 随着超临界流体提取技术的迅速发展,应用该技术提取植物中活性成分已越来越广泛,与有机溶剂提取法相比,超临界流体萃取方法具有产品收率高、质量好、有效成分破坏少、无溶剂残留、操作方便等优点。但是超临界流体萃取法设备规模较大、技术要求高、投资大,安全操作要求高,难以用于较大规模的生产。乙醇和丙酮对活性成分提取率相近,但考虑到溶剂的成本和操作的安全性,使用乙醇水溶液比丙酮水溶液更合适。因此采用乙醇-水 为提取剂,对影响浸取的主要因素进行了研究。 1 实验部分 1.1 主要材料、试剂及仪器 银杏叶:产于连云港花果山,自采;氢氧化钠、无 水乙醇、硝酸铝、芦丁、亚硝酸钠、二氯甲烷和甲醇,均为分析纯。 723可见分光光度计,DF-1型集热式磁力搅拌 器,RE-5285A型旋转蒸发器,恒温水浴锅,电热鼓风干燥箱,SHZ-CD型循环水式真空泵,等。1.2工艺流程 采用有机溶剂提取法,因为甲醇和丙酮具有毒性,所以采用乙醇-水作为提取剂比较合适[3]。 GBE的提取工艺流程如下: 干燥银杏叶→粉碎→浸取→过滤→减压蒸馏→银杏浸膏粗提物→二氯甲烷萃取→减压除去溶剂→干燥→产物。 1.3银杏叶中总黄酮含量的测定 将银杏叶洗净,在低温下烘干至恒重,准确称取 2g,置于索氏提取器中用甲醇回流提取至提取液无色;提取液经浓缩,并转入50mL容量瓶中,用甲醇定容至刻度,摇匀,取1mL按照标准曲线的作法测定吸光度[4],水浴温度控制在75℃左右。 银杏叶中总黄酮的质量分数=50×ρ1/m1,ρ1为银杏叶中总黄酮的质量浓度,mg/mL;m1为银杏叶质 量,mg。 本实验中银杏叶中总黄酮的质量分数=50×0.7/ 银杏叶中黄酮类化合物的提取工艺研究 朱平华 (淮海工学院化工系,江苏连云港222005) 摘要 对银杏叶中黄酮类化合物的提取工艺进行了研究,通过单因素试验和L9(33)正交试 验,研究了浸取温度、乙醇含量和固液质量比对黄酮类化合物提取率的影响。结果显示温度是影响提取率的主要因素,最佳工艺为浸取温度80℃,乙醇的体积分数为70%和固液质量比1:7,银杏叶中黄酮类化合物的浸出率可达到92.3%。关键词 银杏叶;黄酮类化合物;乙醇;提取 中图分类号TQ234.2+1,TQ460.6+1文献标识码A文章编号1006-6829(2006)06-0025-03 ?25 ?
蛋白质纯化的方法选择
蛋白质纯化的方法选择 随着分子生物学的发展,越来越多的科研人员熟练掌握了分子生物学的各种试验技术,并研制成套试剂盒,使基因克隆表达变得越来越容易。但分子生物学的上游工作往往并非是最终目的,分子克隆与表达的关键是要拿到纯的表达产物,以研究其生物学作用,或者大量生产出可用于疾病治疗的生物制品。相对与上游工作来说,分子克隆的下游工作显得更难,蛋白纯化工作非常复杂,除了要保证纯度外,蛋白产品还必须保持其生物学活性。纯化工艺必须能够每次都能产生相同数量和质量的蛋白,重复性良好。这就要求应用适应性非常强的方法而不是用能得到纯蛋白的最好方法去纯化蛋白。在实验室条件下的好方法却可能在大规模生产应用中失败,因为后者要求规模化,且在每日的应用中要有很好的重复性。本文综述了蛋白质纯化的基本原则和各种蛋白纯化技术的原理、优点及局限性,以期对蛋白纯化的方法选择及整体方案的制定提供一定的指导。 1、蛋白纯化的一般原则 蛋白纯化要利用不同蛋白间内在的相似性与差异,利用各种蛋白间的相似性来除去非蛋白物质的污染,而利用各蛋白质的差异将目的蛋白从其他蛋白中纯化出来。每种蛋白间的大小、形状、电荷、疏水性、溶解度和生物学活性都会有差异,利用这些差异可将蛋白从混合物如大肠杆菌裂解物中提取出来得到重组蛋白。蛋白的纯化大致分为粗分离阶段和精细纯化阶段二个阶段。粗分离阶段主要将目的蛋白和其他细胞成分如DNA、RNA等分开,由于此时样本体积大、成分杂,要求所用的树脂高容量、高流速,颗粒大、粒径分布宽.并可以迅速将蛋白与污染物分开,防止目的蛋白被降解。精细纯化阶段则需要更高的分辨率,此阶段是要把目的蛋白与那些大小及理化性质接近的蛋白区分开来,要用更小的树脂颗粒以提高分辨率,常用离子交换柱和疏水柱,应用时要综合考虑树脂的选择性和柱效两个因素。选择性树脂与目的蛋白结合的特异性,柱效则是指各蛋白成分逐个从树脂上集中洗脱的能力,洗脱峰越窄,柱效越好。仅有好的选择性,洗脱峰太宽,蛋白照样不能有效分离。 2、各种蛋白纯化方法及其优、缺点 2.1 蛋白沉淀蛋白能溶于水是因为其表面有亲水性氨基酸,在蛋白质的等电点处若溶液的离子强度特别高或者特别低,蛋白则倾向于从溶液中析出。硫酸铵是沉淀蛋白最常用的盐,因为它在冷的缓冲液中溶解性好,冷的缓冲液有利于保持目的蛋白的活性。硫酸铵分馏常用作试验室蛋白纯化的第一步,它可以初步粗提蛋白质,去除非蛋白成分。蛋白质在硫酸铵沉淀中较稳定,可以短期在这种状态下保存中间产物,当前蛋白质纯化多采用这种办法进行粗分离翻。在规模化生产上硫酸铵沉淀方法仍存在一些问题,硫酸铵对不锈钢器具的腐蚀性很强。其他的盐如硫酸钠不存在这种问题,但其纯化效果不如硫酸铵。除了盐析外蛋白还可以用多聚物如PEG和防冻剂沉淀出来,PEG是一种惰性物质,同硫酸铵一样对蛋白有稳定效果,在缓慢搅拌下逐渐提高冷的蛋白溶液中的PEG浓度,蛋白沉淀可通过离心或过滤获得,蛋白可在这种状态下长期保存而不损坏。蛋白沉淀对蛋白纯化来说并不是多么好的方法,因为它只能达到几倍的纯化效果,而我们在达到目的前需要上千倍的纯化。其好处是可以把蛋白从混杂有蛋白酶和其他有害杂质的培养基及细胞裂解物中解脱出来。 2.2 缓冲液的更换虽然更换缓冲液不能提高蛋白纯度,但它却在蛋白纯化方案中起着极其重要的作用。不同的蛋白纯化方法需要不同pH及不同离子强度的缓冲液。假如你用硫酸铵将蛋白沉淀出来,毫无疑问蛋白是处在高盐环境中,需要想办法脱盐,可用的方法有利用半透膜透析,通过勤换透析液体去除盐分,此法尚可,但需几个小时,通常要过夜,也难以用于大规模纯化中。新型的设备将透析膜夹在两个板中间,板的一侧加缓冲液,另一侧加需脱盐的蛋白溶液,并在蛋白溶液一侧通过泵加压,可以使两侧溶液在数小时内达到平衡,若增加对蛋白溶液的压力,还可迫使水分和盐更多通过透析膜进入透析液达到对蛋白浓缩的目的。也有出售的脱盐柱,柱内的填料是小孔径的颗粒,蛋白分子不能进入孔内,先于高浓度盐离子从柱中流出,从而使二者分离。蛋白纯化的每一步都会造成目的蛋白的丢失,缓冲液平衡的步骤尤甚。蛋白会结合在任何它能接触的表面上,剪切力、起泡沫和离子强度的快速变化很容易让蛋白失活。 2.3 离子交换色谱这是在所有的蛋白纯化与浓缩方法中最有效方法。基于蛋白与离子交换树脂间的相互电荷作用,通过选择不同的缓冲液,同一种蛋白既可以和阴离子交换树脂(能结合带负电荷的分子)结合,也可以和阳离子交换树脂结合。树脂所用的带电基团有四种:二乙基氨基乙基用于弱的阴离子交换树脂;羧甲基用于弱的阳离子交换树脂;季铵用于强阴离子交换树脂;甲基磺酸酯用于强阳离子交换树脂。蛋白质由氨基酸组成,氨基酸在不同的pH环境中所带总电荷不同。大多数蛋白在生理pH(pH6~8)下带负电荷,需用阴离子交换柱纯化,极端的pH下蛋白会变性失活.应尽量避免。由于在某个特定的pH下不同的蛋白所带电荷数不同,与树脂的结合力也不同,随着缓冲液中盐浓度的增加或pH的变化,蛋白按结合力的强弱被依次洗脱。在工业化生产中更多地是改变盐浓度而不是去改变pH值,因为前者更容易控制。在实验室中几乎总是用盐浓度梯度去洗脱离子交换柱,利用泵的辅助可以使流入柱的缓冲液中盐浓度平稳地上升,当离子强度能够中和蛋白的电荷时,蛋白就被从柱上洗脱下来。但在工业生产中盐浓度很难精确控制,所以常用分步洗脱而不足连续升高的盐梯度。与排阻层析相比,离子交换特异性更好,有更多的参数可以调整以获得最优的纯化效果,树脂也比较便宜。值得一提的是,即便是用最精确控制的条件,仅用离子交换单一的方法也得不到纯的蛋白,还需要其他的纯化步骤。
蛋白质的分离纯化方法(参考资料)
蛋白质的分离纯化方法 2.1根据分子大小不同进行分离纯化 蛋白质是一种大分子物质,并且不同蛋白质的分子大小不同,因此可以利用一些较简单的方法使蛋白 质和小分子物质分开,并使蛋白质混合物也得到分离。根据蛋白质分子大小不同进行分离的方法主要有透析、超滤、离心和凝胶过滤等。透析和超滤是分离蛋白质时常用的方法。透析是将待分离的混合物放入半透膜制成的透析袋中,再浸入透析液进行分离。超滤是利用离心力或压力强行使水和其它小分子通过半透膜,而蛋白质被截留在半透膜上的过程。这两种方法都可以将蛋白质大分子与以无机盐为主的小分子分开。它们经常和盐析、盐溶方法联合使用,在进行盐析或盐溶后可以利用这两种方法除去引入的无机盐。由于超滤过程中,滤膜表面容易被吸附的蛋白质堵塞,以致超滤速度减慢,截流物质的分子量也越来越小。所以在使用超滤方法时要选择合适的滤膜,也可以选择切向流过滤得到更理想的效果离心也是经常和其它方法联合使用的一种分离蛋白质的方法。当蛋白质和杂质的溶解度不同时可以利用离心的方法将它们分开。例如,在从大米渣中提取蛋白质的实验中,加入纤维素酶和α-淀粉酶进行预处理后,再用离心的方法将有用物质与分解掉的杂质进行初步分离[3]。使蛋白质在具有密度梯度的介质中离心的方法称为密度梯度(区带)离心。常用的密度梯度有蔗糖梯度、聚蔗糖梯度和其它合成材料的密度梯度。可以根据所需密度和渗透压的范围选择合适的密度梯度。密度梯度离心曾用于纯化苏云金芽孢杆菌伴孢晶体蛋白,得到的产品纯度高但产量偏低。蒋辰等[6]通过比较不同密度梯度介质的分离效果,利用溴化钠密度梯度得到了高纯度的苏云金芽孢杆菌伴孢晶体蛋白。凝胶过滤也称凝胶渗透层析,是根据蛋白质分子大小不同分离蛋白质最有效的方法之一。凝胶过滤的原理是当不同蛋白质流经凝胶层析柱时,比凝胶珠孔径大的分子不能进入珠内网状结构,而被排阻在凝胶珠之外,随着溶剂在凝胶珠之间的空隙向下运动并最先流出柱外;反之,比凝胶珠孔径小的分子后流出柱外。目前常用的凝胶有交联葡聚糖凝胶、聚丙烯酰胺凝胶和琼脂糖凝胶等。在甘露糖蛋白提纯的过程中使用凝胶过滤方法可以得到很好的效果,纯度鉴定证明产品为分子量约为32 kDa、成分是多糖∶蛋白质(88∶12)、多糖为甘露糖的单一均匀糖蛋白[1]。凝胶过滤在抗凝血蛋白的提取过程中也被用来除去大多数杂蛋白及小分子的杂质[7]。 2.2 根据溶解度不同进行分离纯化 影响蛋白质溶解度的外部条件有很多,比如溶液的pH值、离子强度、介电常数和温度等。但在同一条件下,不同的蛋白质因其分子结构的不同而有不同的溶解度,根据蛋白质分子结构的特点,适当地改变外部条件,就可以选择性地控制蛋白质混合物中某一成分的溶解度,达到分离纯化蛋白质的目的。常用的方法有等电点沉淀和pH值调节、蛋白质的盐溶和盐析、有机溶剂法、双水相萃取法、反胶团萃取法等。 等电点沉淀和pH值调节是最常用的方法。每种蛋白质都有自己的等电点,而且在等电点时溶解度最
银杏叶提取物生产工艺规程
目录 1、产品简介 2、处方和依据 3、生产工艺流程图和生产环境洁净区域划分 4、制备方法 5、生产操作过程及工艺条件及操作要点 6、工艺卫生管理 7、本产品工艺过程中所需的标准操作规程名称及要求 8、原辅材料、中间产品和成品的质量标准、检验方法、技术参数及贮存注意事项 9、工艺用水的制备、质量标准及质量控制 10、需要进行验证的关键工序及其工艺验证的具体要求 11、原辅材料消耗定额、技术经济指标、产品收率以及各项指标的计算方法 12、设备一览表、主要设备生产能力 13、技术安全、工艺卫生及劳动保护 14、劳动组织、岗位定员与产品周期 15、综合利用与三废处理 16、附页
1、产品简介 【中文名】银杏叶提取物 【汉语拼音】Yinxingye Tiquwu 【性状】本品为浅棕黄色至棕褐色的粉末;味微苦。 【有效期】12个月。 【制剂】银杏叶片 【贮藏】密封,避光。 2. 标准依据 2.1 标准依据 《中国药典》2005年版一部281页。 2.2 原材料质量标准 应符合《中国药典》2005年版一部220页“银杏叶”项下有关各项规定。 2.3 生产批量处方
4、制备方法 取银杏叶,粉碎,用稀乙醇加热回流提取,合并提取液,回收乙醇并浓缩至适量,加于已处理好的大孔吸附树脂柱上,依次用水及不同浓度的乙醇洗脱,收集相应的洗脱液,回收乙醇,喷雾干燥,即得。 5、生产操作过程、工艺技术条件及操作要点 5.1 中药材的前处理 5.1.1 生产指令 由生产技术部下达批生产指令一式四份,质量管理部部长审核、签字,生产厂长批准后执行。批生产指令生产技术部留存一份,其余三份分发至质量管理部一份,作为质量监控与检验依据;物料部一份,作为物料发放依据;生产车间一份,作为生产和物料领取依据。 5.1.2 称量配料 生产车间核算员按照批生产指令,填写领料单,交仓库保管员备料,并同领料员、车间质检员一起到仓库,按“称量配料岗位生产标准操作规程SC/SOP/QC/001-01”进行称量配料、领料,并及时填写生产记录,产品与下一生产工序净制进行交接。 要点:重点核对物料名称、批号、数量、物料放行审核单、称量核对。 5.1.3 前处理依据:《中国药典》2005年版一部(炮制通则)及药材项下的规定、《药材炮制规范》(修订本)。 5.1.4中药材前处理的方法和要求 5.1.4.1净制 按“净制岗位生产标准操作规程SC/SOP/QC/002-01”进行操作。在挑选工作台上手工净制生产,净制完毕及时填写生产记录,并检查中药材收率范围与规定的物料消耗定额核对,填写“物料周转单SC/R/TY/021-01”,产品与下一个生产工序切制进行交接。 要点:(1)除杂、除尘; (2)标志管理:生产状态标志、清洁状态标志、设备状态标志、清场合格证等。 规定收率:≥99%。 5.1.4.2银杏叶前处理要求:净制; 5.1.4.3前处理药材规定的分步收率及总收率参考下表:
蛋白质的提取与纯化
蛋白质的提取与纯化 一,蛋白质的提取 大部分蛋白质都可溶于水、稀盐、稀酸或碱溶液,少数与脂类结合的蛋白质则溶于乙醇、丙酮、丁醇等有机溶剂中,因些,可采用不同溶剂提取分离和纯化蛋白质及酶。 (一)水溶液提取法 稀盐和缓冲系统的水溶液对蛋白质稳定性好、溶解度大、是提取蛋白质最常用的溶剂,通常用量是原材料体积的1-5倍,提取时需要均匀的搅拌,以利于蛋白质的溶解。提取的温度要视有效成份性质而定。一方面,多数蛋白质的溶解度随着温度的升高而增大,因此,温度高利于溶解,缩短提取时间。但另一方面,温度升高会使蛋白质变性失活,因此,基于这一点考虑提取蛋白质和酶时一般采用低温(5度以下)操作。为了避免蛋白质提以过程中的降解,可加入蛋白水解酶抑制剂(如二异丙基氟磷酸,碘乙酸等)。 下面着重讨论提取液的pH值和盐浓度的选择。 1、pH值 蛋白质,酶是具有等电点的两性电解质,提取液的pH值应选择在偏离等电点两侧的pH 范围内。用稀酸或稀碱提取时,应防止过酸或过碱而引起蛋白质可解离基团发生变化,从而导致蛋白质构象的不可逆变化,一般来说,碱性蛋白质用偏酸性的提取液提取,而酸性蛋白质用偏碱性的提取液。 2、盐浓度 稀浓度可促进蛋白质的溶,称为盐溶作用。同时稀盐溶液因盐离子与蛋白质部分结合,具有保护蛋白质不易变性的优点,因此在提取液中加入少量NaCl等
中性盐,一般以0.15摩尔。升浓度为宜。缓冲液常采用0.02-0.05M磷酸盐和碳酸盐等渗盐溶液。 (二)有机溶剂提取法 一些和脂质结合比较牢固或分子中非极性侧链较多的蛋白质和酶,不溶于水、稀盐溶液、稀酸或稀碱中,可用乙醇、丙酮和丁醇等有机溶剂,它们具的一定的亲水性,还有较强的亲脂性、是理想的提脂蛋白的提取液。但必须在低温下操作。丁醇提取法对提取一些与脂质结合紧密的蛋白质和酶特别优越,一是因为丁醇亲脂性强,特别是溶解磷脂的能力强;二是丁醇兼具亲水性,在溶解度范围内(度为10%,40度为6.6%)不会引起酶的变性失活。另外,丁醇提取法的pH及温度选择范围较广,也适用于动植物及微生物材料。 二、蛋白质的分离纯化 蛋白质的分离纯化方法很多,主要有: (一)根据蛋白质溶解度不同的分离方法 1、蛋白质的盐析 中性盐对蛋白质的溶解度有显著影响,一般在低盐浓度下随着盐浓度升高,蛋白质的溶解度增加,此称盐溶;当盐浓度继续升高时,蛋白质的溶解度不同程度下降并先后析出,这种现象称盐析,将大量盐加到蛋白质溶液中,高浓度的盐离子(如硫酸铵的SO4和NH4)有很强的水化力,可夺取蛋白质分子的水化层,使之“失水”,于是蛋白质胶粒凝结并沉淀析出。盐析时若溶液pH在蛋白质等电点则效果更好。由于各种蛋白质分子颗粒大小、亲水程度不同,故盐析所需的盐浓度也不一样,因此调节混合蛋白质溶液中的中性盐浓度可使各种蛋白质分段沉淀。
银杏叶中黄酮提取方法
银杏叶黄酮的提取 一、溶剂提取法:国内外使用最广泛的方法,步骤多、周期长、产率低、产品中有机溶剂易残留。溶剂系统主要有乙醇,水溶液、丙酮-水溶液、NaOH-水溶液、NaOH-乙醇等。精提物常在粗提物制备基础上精制,常用液-液提取法、沉淀法和吸附.洗脱法。 以60%丙酮为起始溶剂粗提取,再脱脂、去银杏酚酸等15道工艺制成提取物。NaOH-水溶液提取效果最好,NaOH-乙醇溶液次之,正丁醇萃取水溶液中银杏黄酮苷,获得最佳萃取条件为萃取5 min温度60℃4次,萃取物中黄酮苷含量为57%。V水:V正丙醇=1:25最佳。银杏叶精提物树脂吸附纯化法以石油醚回流提取,再以80%乙醇回流提取,减压浓缩,新型澄清剂沉降,树脂分级吸附,pH值为3—4酸水和酸性25%乙醇洗涤,75%乙醇洗脱,喷雾干燥 将银杏叶洗净,于60℃烘干至恒重,粉碎,过50目筛。称取粉末25 g,置于索氏提取器中恒重,粉碎,过50目筛。称取粉末25 g,置于索氏提取器中加入60%乙醇至250.0 ml,80℃下回流提取3.0 h,蒸馏回收乙醇,并用活性炭脱色,得银杏叶黄酮提取物。乙醇浓度为50%一70%时,提取率随浓度增加提高,当浓度70%时提取率达最大。随水浴温度升高总黄酮提取率快速增加。当温度80℃时提取率达最大。提取时间为三小时为佳。 二、超临界流体萃取法(SFE法):利用临界或超临界状态的流体及被萃取的物质在不同蒸汽压力下所具有的不同化学亲和力和溶解能力进行分离纯化的操作。最佳萃取实验工艺条件为萃取压力15 MPa、乙醇浓度90%、萃取温度55℃,此时,黄酮类化合物萃取得率较理想. 三、高速逆流色谱技术提取法:是一种不用任何固定载体的液一液分配色谱技术W=70%的乙醇连续循环喷淋逆流6级萃取,m乙醇:m银杏叶=5:1,总萃取时间240min,萃取温度50~55度,萃取率99%以上。 四、微波提取法:微波提取法能对萃取体系中的不同组分进行选择性加热,受溶剂亲和力的限制较小,可供选择的溶剂较多及热效率较高,升温快速均匀,大大缩短了提取时间,提高了萃取效率。以水为介质的条件下,对银杏叶进行微波处理。 工艺流程银杏叶一干燥一粉碎一加入适量氢氧化钙溶液一微波预处理一加入适量碱水一调节pH和硼砂含量→恒温水浴浸提—过滤一定容 通过对提取温度、提取时间、液料比、微波功率、微波时间、解析剂比6个因素进行正交实验,优选得到最佳的萃取工艺条件为:提取温度80℃,提取时间60min,液料比.50:1,微波功率700W,微波时问180s,解析剂比7:l。 五、超声提取法:超声技术应用于天然活性产物的提取,具有速度快、提取率高、节省溶剂、节约能耗、不破坏有效成分的特点。最佳操作条件为超声波频率40kHz处理时间10min、静置时间12 h。以水为介质,在较低温度下 六、酶提取法: 加入淀粉部分水解产物及对葡糖基有转移作用的葡糖苷酶或转糖苷酶,使油溶性或难溶于水或不溶于水的有效成分转移到水溶性苷糖中,既提高了有效成分的提取率,又促进难溶于水或不溶于水的有效成分在体内的吸收. 在常规的醇一水浸提之前用纤维素酶对原料进行酶预处理(酶解时间为2h) 七、分子烙印技术:在极性溶剂中,以丙烯酞胺作功能单体,以强极性化合物槲皮素为模板,
分离纯化蛋白质的方法及原理
(二)利用溶解度差别 影响蛋白质溶解度的外部因素有:1、溶液的pH;2、离子强度;3、介电常数;4、温度。但在同一的特定外部条件下,不同蛋白质具有不同的溶解度。 1、等电点沉淀:原理:蛋白质处于等电点时,其净电荷为零,由于相邻蛋白质分子之间没有静电斥力而趋于聚集沉淀。因此在其他条件相同时,他的溶解度达到最低点。在等电点之上或者之下时,蛋白质分子携带同种符号的净电荷而互相排斥,阻止了单个分子聚集成沉淀,因此溶解度较大。不同蛋白质具有不同的等电点,利用蛋白质在等电点时的溶解度最低的原理,可以把蛋白质混合物分开。当pH被调到蛋白质混合物中其中一种蛋白质的等电点时,这种蛋白质大部分和全部被沉淀下来,那些等电点高于或低于该pH的蛋白质则仍留在溶液中。这样沉淀出来的蛋白质保持着天然的构象,能重新溶解于适当的pH和一定浓度的盐溶液中。 5、盐析与盐溶:原理:低浓度时,中性盐可以增加蛋白质溶解度这种现象称为盐溶.盐溶作用主要是由于蛋白质分子吸附某种盐类离子后,带电层使蛋白质分子彼此排斥,而蛋白质与水分子之间的相互作用却加强,因而溶解度增高。球蛋白溶液在透析过程中往往沉淀析出,这就是因为透析除去了盐类离子,使蛋白质分子之间的相互吸引增加,引起蛋白质分子的凝集并沉淀。当溶液的离子强度增加到一定程度时,蛋白质溶解程度开始下降。当离子强度增加到足够高时,例如饱和或半饱和程度,很多蛋白质可以从水中沉淀出来,这种现象称为盐析。盐析作用主要是由于大量中性盐的加入使水的活度降低,原来溶液中的大部分甚至全部的自由水转变为盐离子的水化水。此时那些被迫与蛋白质表面的疏水集团接触并掩盖他们的水分子成为下一步最自由的可利用的水分子,因此被移去以溶剂化盐离子,留下暴露出来的疏水基团。蛋白质疏水表面进一步暴露,由于疏水作用蛋白质聚集而沉淀。 盐析沉淀的蛋白质保持着他的天然构象,能再溶解。盐析的中性盐以硫酸铵为最佳,在水中的溶解度很高,而溶解度的温度系数较低。 3、有机溶剂分级分离法:与水互溶的有机溶剂(甲醇、乙醇和丙酮等)能使蛋白质在水中的溶解度显著降低。在室温下有机溶剂会引起蛋白质变性,如果预先将有机溶剂冷却到-40°C以下,然后在不断搅拌下逐滴加入有机溶剂,以防局部浓度过高,那么变性可以得到很大程度缓解。蛋白质在有机溶剂中的溶解度也随温度、pH和离子强度而变化。在一定温度、pH和离子强度条件下,引起蛋白质沉淀的有机溶剂的浓度不同,因此控制有机溶剂浓度也可以分
