5 二组分金属相图的绘制

实验五二组分金属相图的绘制
【目的要求】
1. 学会用热分析法测绘Sn-Bi二组分金属相图。
2. 了解纯物质和混合物步冷曲线的形状有何不同,其相变点的温度应如何确定。
3. 学会金属相图实验数据的采集,步冷曲线的绘制、相图曲线的绘制。
【实验原理】
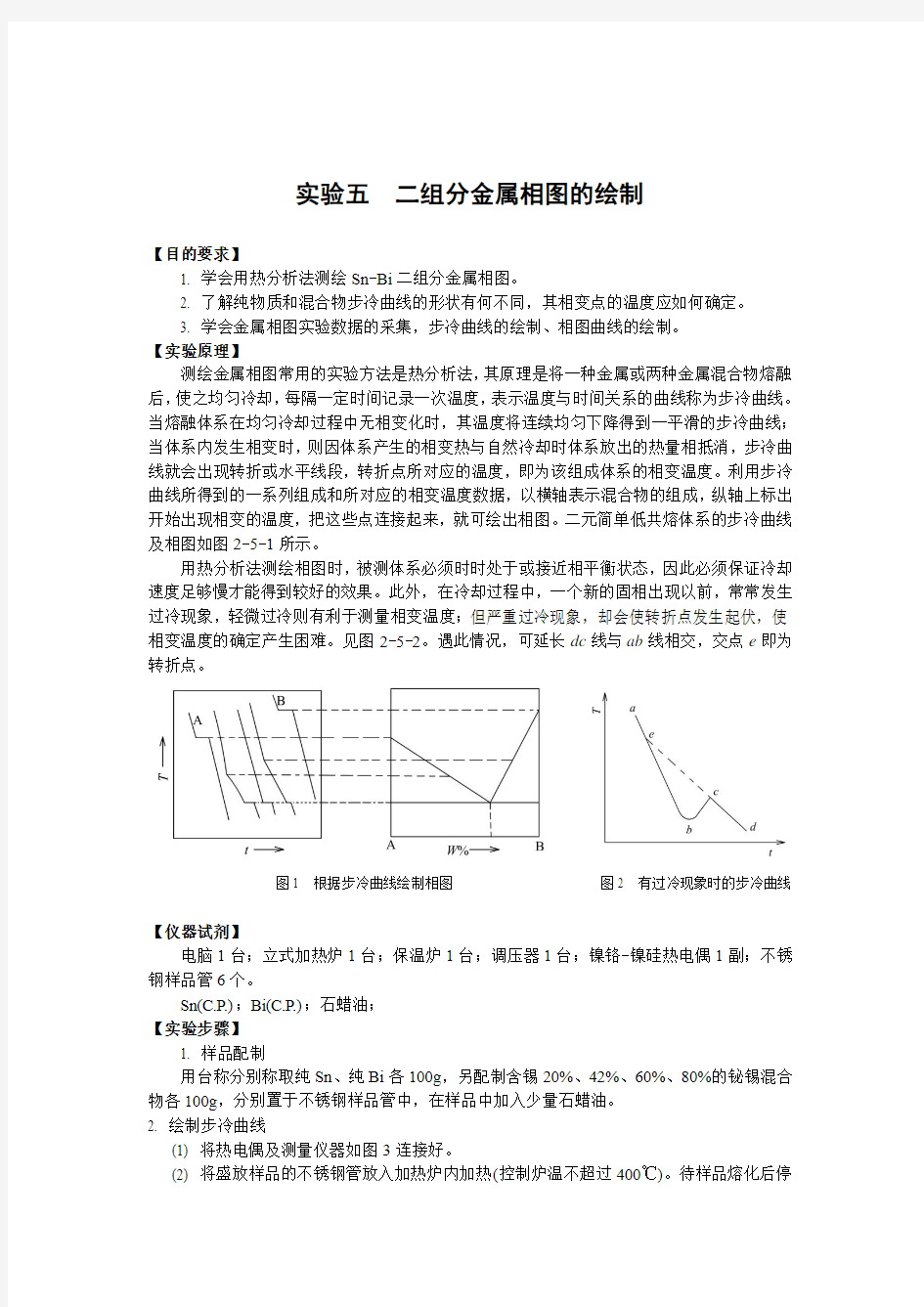
测绘金属相图常用的实验方法是热分析法,其原理是将一种金属或两种金属混合物熔融后,使之均匀冷却,每隔一定时间记录一次温度,表示温度与时间关系的曲线称为步冷曲线。当熔融体系在均匀冷却过程中无相变化时,其温度将连续均匀下降得到一平滑的步冷曲线;当体系内发生相变时,则因体系产生的相变热与自然冷却时体系放出的热量相抵消,步冷曲线就会出现转折或水平线段,转折点所对应的温度,即为该组成体系的相变温度。利用步冷曲线所得到的一系列组成和所对应的相变温度数据,以横轴表示混合物的组成,纵轴上标出开始出现相变的温度,把这些点连接起来,就可绘出相图。二元简单低共熔体系的步冷曲线及相图如图2-5-1所示。
用热分析法测绘相图时,被测体系必须时时处于或接近相平衡状态,因此必须保证冷却速度足够慢才能得到较好的效果。此外,在冷却过程中,一个新的固相出现以前,常常发生过冷现象,轻微过冷则有利于测量相变温度;但严重过冷现象,却会使转折点发生起伏,使相变温度的确定产生困难。见图2-5-2。遇此情况,可延长dc线与ab线相交,交点e即为转折点。
图1 根据步冷曲线绘制相图图2 有过冷现象时的步冷曲线
【仪器试剂】
电脑1台;立式加热炉1台;保温炉1台;调压器1台;镍铬-镍硅热电偶1副;不锈钢样品管6个。
Sn(C.P.);Bi(C.P.);石蜡油;
【实验步骤】
1. 样品配制
用台称分别称取纯Sn、纯Bi各100g,另配制含锡20%、42%、60%、80%的铋锡混合物各100g,分别置于不锈钢样品管中,在样品中加入少量石蜡油。
2. 绘制步冷曲线
(1) 将热电偶及测量仪器如图3连接好。
(2) 将盛放样品的不锈钢管放入加热炉内加热(控制炉温不超过400℃)。待样品熔化后停
止加热。
1-加热炉;2-不锈钢样品管;3-套管;4-热电偶
图3
进行实验前,将仪器开启两分钟。设置好仪器的各种参数,具体的参数设置方法,请参照仪器的使用说明书。
按“打开串口”按纽,根据串口连接方式,选择适当的串口。如果选择正确,将会在软件左上方的文本框内显示仪器所测得当前的温度值。按下“坐标设定”按钮,设置图形框内所显示的温度的最小值,最大值、及时间长度。按下“开始实验”按钮,输入本次实验数据保存的文件名,而后开始进行记录实验数据。实验数据将以波形的形式显示在程序界面上。实验结束后,按下“实验结束”按钮,保存好本次的实验数据。本次试验的数据可通过“步冷曲线”按钮再次调入程序进行观看。
(3) 步冷曲线的绘制
进行多次实验后,便可以绘制步冷曲线。绘制曲线前,可按下“坐标设定”按钮设置好步冷曲线的温度范围及时间长度。按下“步冷曲线”按钮,根据实验要求将实验结果添加至图形上。多次重复这一过程,可将多条曲线添加至图形上。
3. 绘制相图曲线
从步冷曲线上读出拐点温度及水平温度。按下“相图绘制”按钮,分别输入“拐点温度”、“样品成分”,输入顺序请按照其中一种物质的百分比。为了保证相图的正确性,必须保证实验结果覆盖相图曲线的两段直线。
4. 程序按钮的含义说明
(1)“坐标设定”:
X轴表示时间坐标,Y轴表示温度坐标,单位为度;设定X的宽度,坐标为分钟;程序默认值分别为50分钟;温度为0到400度。实验开始前可以设定坐标范围。
(2)“开始实验”
在实验前,初步估计实验所需时间,实验所需最高温度,点击开始按键,程序弹出菜单,请输入实验结果的保存文件名;做实验时,可将温度及时间坐标范围选宽一点,以完整记录实验过程,如需具体观察某一段温度曲线,可在实验结束后,用以下方法实现:首先用“坐标设定”按钮设定图形的参数,用“添加数据文件”按钮将实验结果显示出来。
提示:如果实验时温度超过所设定的最高温度,实验数据仍然保存在结果文件中。(3)“实验结束”
观察到所需实验现象后,可点击实验结束按键,计算机自动保存实验结果,实验结果为一个“*.dat”的文件,其中的数据的数值为实际温度值乘以10。
(4)“退出实验”
点击退出实验,退出实验
5.“串口选择”
根据计算机和仪器连接所用的串口,选择串口1或2或3或4,当所选无效时,系统将给出如下提示:
6.点击画图区,则在左边的“位置温度”文字下面的内可出现鼠标所点击位置处的温度坐
标。
7. 图象放大
点击可将图象逐渐放大,便于观看曲线。
8. 图象缩小
点击可将图象逐渐缩小,直到将曲线恢复到默认大小。
9. 图象清空
点击可将所绘图形清空。
【注意事项】
开始实验前及绘制步冷曲线时可按下“坐标设定”键,进行图形参数设定。
用电炉加热样品时,温度要适当,温度过高样品易氧化变质;温度过低或加热时间不够则样品没有完全熔化,步冷曲线转折点测不出。
热电偶热端应插到样品中心部位,在套管内注入少量的石蜡油,将热电偶浸入油中,以改善其导热情况。搅拌时要注意勿使热端离开样品。
混合物的体系有两个转折点,必须待第二个转折点测完后方可停止实验,否则须重新测定。
【数据处理】
1. 用已知纯Bi、纯Sn的熔点及水的沸点作横坐标,以纯物质步冷曲线中的平台温度为
纵坐标作图,画出热电偶的工作曲线。
2. 找出各步冷曲线中转折点和水平线段所对应的温度值。
3. 从热电偶的工作曲线上查出各转折点温度和水平线段所对应的温度,以温度为纵坐
标,以物质组成为横坐标,绘出Sn-Bi金属相图。
【思考题】
1. 对于不同成分的混合物的步冷曲线,其水平段有什么不同?为什么?
2. 作相图还有哪些方法?
【讨论】
1. 本实验成败的关键是步冷曲线上转折点和水平线段是否明显。步冷曲线上温度变化的速率取决于体系与环境间的温差、体系的热容量、体系的热传导率等因素,若体系析出固体放出的热量抵消散失热量的大部分,转折变化明显,否则转折就不明显。故控制好样品的降温速度很重要,一般控制在6~8℃/min,在冬季室温较低时,就需要给体系降温过程加以一定的电压(约20V左右)来减缓降温速率。
2. 本实验所用体系一般为Sn-Bi、Cd-Bi、Pb-Zn等低熔点金属体系,但它们的蒸气对人体健康有危害,因而要在样品上方覆盖石墨粉或石蜡油,防止样品的挥发和氧化。石蜡油的沸点较低(大约为300℃),故电炉加热样品时注意不宜升温过高,特别是样品近熔化时所加电压不宜过大,以防止石蜡油的挥发和炭化。
3. 固液系统的相图类型很多,二组分间可形成固溶体、化合物等,其相图可能会比较复杂。一个完整相图的绘制,除热分析法外,还需借用化学分析、金相显微镜、X射线衍射等方法共同解决。
二组分简单共熔体系相图的绘制
二组分简单共熔体系相图的绘制
————————————————————————————————作者: ————————————————————————————————日期:
实验七二组分简单共熔体系相图的绘制 ------Cd~Bi二组分金属相图的绘制1实验目的及要求: 1)应用步冷曲线的方法绘制Cd~Bi二组分体系的相图。 2)了解纯物质和混合物步冷曲线的形状有何不同,其相变点的温度应如何确定。 2 实验原理:… 用几何图形来表示多相平衡体系中有哪些相、各相的成分如何,不同相的相对量是多少,以及它们随浓度、温度、压力等变量变化的关系图,叫相图。 绘制相图的方法很多,其中之一叫热分析法。在定压下把体系从高温逐渐冷却,作温度对时间变化曲线,即步冷曲线。体系若有相变,必然伴随有热效应,即在其步冷曲线中会出现转折点。从步冷曲线有无转折点就可以知道有无相变。测定一系列组成不同样品的步冷曲线,从步冷曲线上找出各相应体系发生相变的温度,就可绘制出被测体系的相图,如图Ⅱ一6一l所示。 纯物质的步冷曲线如①⑤所示,从高温冷却,开始降温很快,口6线的斜率决定于体系的散热程度。冷到A的熔点时,固体A开始析出,体系出现两相平衡(溶液和固体A),此时温度维持不变,步冷曲线出现bc的水平段,直到其中液相全部消失,温度才下降。 混合物步冷曲线(如②、④)与纯物质的步冷曲线(如①、⑤)不同。如②起始温度下降很快(如a′b′段),冷却到b′点的温度时,开始有固体析出,这时体系呈两相,因为液相的成分不断改变,所以其平衡温度也不断改变。由于凝固热的不断放出,其温度下降较慢,曲线的斜率较小(b′c′段)。到了低共熔点温度后,体系出现三相,温度不再改变,步冷曲线又出现水平段c′d′,直到液相完全凝固后,温度又迅速下降。 曲线⑧表示其组成恰为最低共熔混合物的步冷曲线,其图形与纯物相似,但它的水平段是三相平衡。 用步冷曲线绘制相图是以横轴表示混合物的成分,在对应的纵轴标出开始出现相变(即步冷曲线上的转折点)的温度,把这些点连接起来即得相图。 3仪器与药品: 加热电炉1只,热电偶(铜一康铜)1根,不锈纲试管8只,控温测定装置1台,计算机1台,镉(化学纯),铋(化学纯)。 4 实验步骤: 1)配制不同质量百分数的铋、镉混合物各100g(含量分别为0%,15%,25%,40%,55%,75%,90%,100%),分别放在8个不锈纲试管中。 2)用控温测定装置装置,依次测纯镉、纯铋和含镉质量百分数为90%,75%,55%,40%,25%,15%样品的步冷曲线。将样品管放在加热电炉中加热,让样品熔化,同时将热电偶的热端(连玻璃套管)插入样品管中,待样品熔化后,停止加热。用热电偶玻璃套管轻轻搅
金属相图
实验 金属相图 [实验目的] 1.学会用热分析法测绘Pb - Sn 二组分金属相图。 2.掌握热分析法的测量技术与有关测量温度的方法。 [基本原理] 热分析法是先将体系加热熔融成一均匀液相,然后让体系缓慢冷却,并每隔一定时间读体系温度一次,将所得温度值对时间作图,所得曲线即为步冷曲线(如下图1)。每一种组成的Pb - Sn 体系均可根据其步冷曲线找出相应的转折点和水平台温度,然后在温度-成分坐标上确定相应成分的转折温度和水平台的温度,最后将转折点和恒温点分别连接起来,即为相图(如下图2)。 图1 步冷曲线 图2 步冷曲线与相图 [仪器结构] 图1 加热装置 图2 测量装置 仪器参数设置法: 最高温度:C 350℃ 加热功率:P1 400W 保温功率:P2 40W 报警时间:E1 30s 报警声音:n 0 按设置键:显示温度时就是退出了设置状态,可以进行实验。
[实验步骤] 1.配制样品。配制含锡量分别为20%,40%,61.9%,80%的铅-锡混合物各100g,装入4个样品管中,然后在样品管内插入玻璃套管(管中应有硅油,增加热传导系数),并在样品上方盖一层石墨粉; 2.将需加热的样品管放入一炉子中,将加热选择旋钮指向该加热炉(加热炉和选择旋钮上均有数字标号),并将测温传感器置于需加热的样品管中; 3.设定具体需加热的温度,加热功率和保温功率,本实验中这些参数依次设定为350o C,400W, 40W,参数设定完成后, 按下“加热”键,即进入加热状态; 4.当测量装置上的温度示值接近于330 O C时,可停止加热。待样品熔化后,用玻璃套管小心搅拌样品; 5.待温度降到需要记录的温度值时(比如305 C),可点击测量软件中的“开始实验”按钮,降温过程中,若降温速度太慢,可打开风扇;若降温速度太快,则可按“保温”键,适当增加加热量。当温度降到平台以下,停止记录。 按照上述步骤,测定不同组成金属混合物的温度—时间曲线。 [数据处理] 1.依实验数据绘制T-t步冷曲线,6根曲线绘制在同一张图上; 2.依样品的组成和步冷曲线中转折点和平台的温度绘制出Pb-Sn的T-w金属相图; 3.你所测得的Pb, Sn的熔点与教材(东北师大第90面)上的值的相对误差分别为: %, %. [问答题] 金属相图的用途有哪些? ---------------------------------------------------------------------------------------------------------------- 班级: 姓名: 学号: 实验日期: 分数: 教师:
实验六 二组分金属相图的绘制
实验六二组分金属相图的绘制 一、实验目的 1.学会用热分析法测绘Sn—Bi二组分金属相图。 2.了解热电偶测量温度和进行热电偶校正的方法。 二、预习要求 1.了解纯物质的步冷曲线和混合物的步冷曲线的形状有何不同,其相变点的温度应如何确定。 2.掌握热电偶测量温度的原理及校正方法。 三、实验原理 测绘金属相图常用的实验方法是热分析法,其原理是将一种金属或合金熔融后,使之均匀冷却,每隔一定时间记录一次温度,表示温度与时间关系的曲线叫步冷曲线。当熔融体系在均匀冷却过程中无相变化时,其温度将连续均匀下降得到一光滑的冷却曲线;当体系内发生相变时,则因体系产生之相变热与自然冷却时体系放出的热量相抵偿,冷却曲线就会出现转折或水平线段,转折点所对应的温度,即为该组成合金的相变温度。利用冷却曲线所得到的一系列组成和所对应的相变温度数据,以横轴表示混合物的组成,纵轴上标出开始出现相变的温度,把这些点连接起来,就可绘出相图。 二元简单低共熔体系的冷却曲线具有图1所示的形状。
图1根据步冷曲线绘制相图 图2有过冷现象时的步冷曲线 用热分析法测绘相图时,被测体系必须时时处于或接近相平衡状态,因此必须保证冷却速度足够慢才能得到较好的效果。此外,在冷却过程中,一个新的固相出现以前,常常发生过冷现象,轻微过冷则有利于测量相变温度;但严重过冷现象,却会使折点发生起伏,使相变温度的确定产生困难。见图2。遇此情况,可延长dc线与ab线相交,交点e即为转折点。 四、仪器药品 1.仪器 立式加热炉1台;冷却保温炉1台;长图自动平衡记录仪1台;调压器1台;镍铬-镍硅热电偶1副;样品坩埚6个;玻璃套管6只;烧杯(250mL)2个;玻璃棒1只。
二组分金属相图的绘制
二组分金属相图的绘制 一.实验目的 1.用热分析法(冷却曲线法)测绘Bi —Sn 二组分金属相图。 2.了解固液相图的特点,进一步学习和巩固相律等有关知识。 二.实验原理 表示多相平衡体系组成、温度、压力等变量之间关系的图形称为相图。 较为简单的二组分金属相图主要有三种:一种是液相完全互溶,凝固后,固相也能完全互溶成固熔体的系统,最典型的为Cu —Ni 系统;另一种是液相完全互溶而固相完全不互溶的系统,最典型的是Bi —Cd 系统;还有一种是液相完全互溶,而固相是部分互溶的系统,如本实验研究的Bi —Sn 系统。在低共熔温度下,Bi 在固相Sn 中最大溶解度为21%(质量百分数)。 图1冷却曲线 图2由冷却曲线绘制相图 热分析法(冷却曲线法)是绘制相图的基本方法之一。它是利用金属及合金在加热和冷却过程中发生相变时,潜热的释出或吸收及热容的突变,来得到金属或合金中相转变温度的方法。通常的做法是先将一定已知组成的金属或合金全部熔化,然后让其在一定的环境中自行冷却,画出冷却温度随时间变化的冷却曲线(见图 1)。当金属混合物加热熔化后再冷却时,开始阶段由于无相变发生,体系的温度随时间变化较大,冷却较快(ab 段)。若冷却过程中发生放热凝固,产生固相,将减小温度随时间的变化,使体系的冷却速度减慢(bc 段)。当融熔液继续冷却到某一点时,如c 点,由于此时液相的组成为低共熔物的组成。在最低共熔混 合物完全凝固以前体系温度保持不变,冷却曲线出现平台,(如图cd 段)。当融熔液完全凝固形成两种固态金属后,体系温度又继续下降(de 段)。 由此可知,对组成一定的二组分低共熔混合物系统,可以根据它的冷却曲线得出有固体析出的温度和低共熔点温度。根据一系列组成不同系统的冷却曲线的各转折点,即可画出二组分系统的相图(T - x 或T - w B 图)。不同组成熔液的冷却曲线对应的相图如图2所示。 图3可控升降温电炉前面板 1.电源开关 2.加热量调节旋钮 3、4.电压表 5.实验坩埚摆放区 6.控温传感器插孔 7.控温区电炉8.测试区电炉 9.冷风量调节
实验3 金属相图实验报告dyl
物理化学实验备课材料 实验3 热电偶温度计的校正及金属相图 一、基本介绍 一个多相体系的状态可用热力学函数来表达,也可用几何图形来描述。表示相平衡体系状态与影响相平衡强度因素关系的几何图形叫平衡状态图,简称相固,也叫状态图。由于常见的影响相平衡的强度因素是温度、压力和浓度,所以也可以说,相图是描述多相体系的状态与温度、压力和组成关系的几何图形。 相平衡的研究对生产和科学研究具有重大意义。钢铁和合金冶炼生产条件的控制、硅酸盐(水泥、耐火材料等)生产的配料比、盐湖中无机盐的提取等,都需要相干衡的知识。又如对物质进行提纯(如制备半导体材料)、配制各种不同低熔点的金屑台金等,都要考虑到有关相干衡问题。化工生产中产品的分离和提纯是非常重要的,其中溶解和结晶、冷凝和熔融、气化和升华等都属相交过程。 总之.由于相变过程和相干衡问题到处存在,研究和革捏相变过程的规体,用以解释有关的自然现象和指导生产甚为重要。 二、实验目的 1、用热电偶—电位差计测定Bi—Sn体系的步冷曲线,绘制相图; 2、掌握热电势法测定金属相图的方法; 3、掌握热电偶温度计的使用,学习双元相图的绘制。。 三、实验原理 绘制固液二相平衡曲线的方法,常用的有溶解度法和热分析法。溶解度法是指在确定的温度下,直接测定固液二相平衡时溶液的浓度,然后依据澜得的温度和相应的溶解度数据绘制成相固。此法适用于常温下易澜定组成的体系,如水盐体系等。热分析法是指在常温下不便直接澜定固液乎衡时溶液组成的体系(如合金和有机化合物的体系).通常利用相变时的热效应来测定组成已确定之体系的温度,然后依据选定的一系列不同组成的二组分体系所测定的温度,绘制相图。此法简单易行,应用顾广。 用热分析法测绘相图时,被测体系必须时时处于或接近相平衡状态。因此.体系的冷却速度必须足够慢.才能得到较好的结果。体系温度的测量,可用水银温度计,也可选用合适的热电偶。由于水银温度计的测量范围有限,而且其易破损,所以目前大都采用热电偶来进行测温。用热电偶测温其优点是灵敏度高、重现性好、量度宽。而且由于它是将非电信号转换为电信号,故将它与电子电热差计配合使用,可自动记录温度—时间曲线。原则上也可用升温过程中的实验数据作温度-时间关系曲线,但由于升温过程中温度很难控制,不易做到均匀加热,由此产生的误差大于冷却过程,所以通常都绘制冷却曲线。 本实验用热电偶作为感温元件,自动平衡电位差计测量各样晶冷却过程中的热电势,作出电位—时间曲线(步冷曲线),再由热电偶的工作曲线找出相变温度,从而作出Bi-Sn体系的相图.
金属相图实验步骤(学生)
实验八金属相图 一、实验目的 1、学会用热分析法测绘铅-锡二组分金属相图; 2、掌握热分析法的测量技术; 3、熟悉ZR-HX金属相图控温仪、ZR-08金属相图升温电炉等仪器。 二、基本原理 相图是用以研究体系的状态随浓度、温度、压力等变量的改变而发生变化的图形,它可以表示在指定条件下存在的相数和各相的组成,对蒸汽压较小的二组分凝聚体系,常以温度-组成图来描述。 热分析法是绘制相图常用的基本方法之一。这种方法是通过观察体系在冷却时温度随时间的变化关系,来判断有无相变的发生。通常的做法是先将体系全部融化,然后让其在一定环境中自行冷却,并每隔一定时间记录一次温度,以温度(T)为纵坐标,时间(t)为横坐标,画出步冷曲线。当体系均匀冷却时,如果体系不发生相变,则体系的温度随时间的变化将是均匀的,冷却也较快(如图8-1中ab线段)。若在冷却过程中发生了相变,由于在相变过程中伴随着热效应,所以体系温度的降温速度随时间的变化将发生改变,体系的冷却速度减慢,步冷曲线就出现转折(如图8-1中bc 线段)。当熔液继续冷却到某一点时,由于此时熔液的组成已达到最低共熔混合物的组成,故有最低共熔混合物析出,在最低共熔混合物完全凝固以前,体系温度保持不变,因此步冷曲线出现平台(如图中cd线段)。当熔液完全凝固后,温度才迅速下降(见图中de线段)。 由此可知,对组成一定的二组分低共熔混合物体系来说,可以根据它的步冷曲线,判断有固体析出时的温度和最低共熔点的温度。如果作出一系列组成不同的体系的步冷曲线,从中找出各转折点,即能画出二组分体系最简单的相图(温度-组成图)。不同组成熔液的步冷曲线与对应相图的关系可以从8-2中看出。 图8-2 图8-1 用热分析法测绘相图时,被测体系必须时时处于或接近相平衡状态。因此,体系的冷却速度必须足够慢,才能得到较好的结果。
二组分金属相图的绘制.
实验六二组分金属相图的绘制 【实验目的】 1. 学会用热分析法测绘Sn—Bi二组分金属相图。 2. 了解纯物质的步冷曲线和混合物的步冷曲线的形状有何不同,其相变点的温度应如何确定。 3. 了解热电偶测量温度和进行热电偶校正的方法。 【基本要求】 (1)学会用热分析法测绘Sn-Bi二组分金属相图。 (2)掌握步冷曲线的绘制和利用。 【实验原理】 测绘金属相图常用的实验方法是热分析法,其原理是将一种金属或两种金属混合物熔融后,使之均匀冷却,每隔一定时间记录一次温度,表示温度与时间关系的曲线称为步冷曲线。当熔融体系在均匀冷却过程中无相变化时,其温度将连续均匀下降得到一平滑的步冷曲线;当体系内发生相变时,则因体系产生的相变热与自然冷却时体系放出的热量相抵消,步冷曲线就会出现转折或水平线段,转折点所对应的温度,即为该组成体系的相变温度。利用步冷曲线所得到的一系列组成和所对应的相变温度数据,以横轴表示混合物的组成,纵轴上标出开始出现相变的温度,把这些点连接起来,就可绘出相图。二元简单低共熔体系的冷却曲线具有图2-5-1所示的形状。 用热分析法测绘相图时,被测体系必须时时处于或接近相平衡状态,因此必须保证冷却速度足够慢才能得到较好的效果。此外,在冷却过程中,一个新的固相出现以前,常常发生过冷现象,轻微过冷则有利于测量相变温度;但严重过冷现象,却会使折点发生起伏,使相变温度的确定产生困难。见图2-5-2。遇此情况,可延长dc线与ab线相交,交点e即为转折点。
图6-1 根据步冷曲线绘制相图 图6-2 有过冷现象时的步冷曲线 【仪器试剂】 立式加热炉1台;保温炉1台;镍铬-镍硅热电偶1副;不锈钢样品管4个;250mL烧杯1个。 Sn(化学纯);Bi(化学纯);石腊油;石墨粉。 【实验步骤】 1. 样品配制 用感量0.1g的台称分别称取纯Sn、纯Bi各50g,另配制含锡20%、40%、60%、80%的铋锡混合物各50g,分别置于坩埚中,在样品上方各覆盖一层石墨粉。 2. 绘制步冷曲线 (1) 将热电偶及测量仪器如图2-5-3连接好。 (2) 将盛放样品的坩埚放入加热炉内加热(控制炉温不超过400℃)。待样品熔化后停止加热,用玻璃棒将样品搅拌均匀,并在样品表面撒一层石墨粉,以防止样品氧化。 图6-3 步冷曲线测量装置 1.加热炉; 2.不锈钢管; 3.套管; 4.热电偶 (3) 将坩埚移至保温炉中冷却,此时热电偶的尖端应置于样品中央,以便反映
二元合金相图的测定实验
实验报告 实验名称:金属的塑性变形 组别第6组 学号、姓名:2012034036 谈鑫学号、姓名:2012034035 何韦唯学号、姓名:2012034034 周卫东学号、姓名:2012034037 安望学号、姓名:2012034038 罗伟学号、姓名:2012034039 陈科宇 2014年 5月 28日
一、实验目的 1.用热分析法测熔融体步冷曲线,再绘制Pb-Sn二元金属相图。 2.了解热分析法的实验技术热电偶测量温度的方法。 二、实验仪器 SWKY型数字控温仪一台;KWL-08型可控升降温电炉一台; 三、实验原理 相图是多相(二相或二相相以上)体系处于相平衡状态时体系的某物理性质(如温度)对体系的某一自变量(如组成)作图所得的图形,图中能反映出相平衡情况(相的数目及性质等),故称为相图。二元或多元体系的相图常以组成为自变量,其物理性质则大多取温度。由于相图能反映出多相平衡体系在不同自变量条什下的相平衡情况,因此,研究多相体系的性质,以及多相体系相平衡情况的演变(例如冶金工业冶炼钢铁或其他合金的过程,石油工业分离产品的过程等),都要用到相图。 图4.1是一种类型的二元简单低共熔物相图。图中A、B表示二个组分的名称,纵轴是物理量温度T,横轴是组分B的百分含量B%。在acb线的上方,体系只有一个相(液相)存在;在ecf线以下,体系有两个相(两个固相——晶体A、晶体B)存在; 在ace所包为的面积中,一个固相(晶体A)和一个液相(A在B中的饱和熔化物)共存; 在bcf所包围的面积中,也是一个固相(晶体B)和一个液相(B在A中的饱和熔化物)共存;图中c点是ace与bef两个相区的交点,有三相(晶体A、晶体B、饱和熔化物)共存。测绘相图就是要将相图中这些分隔相区的线画出来。常用的实验方法是热分析法。 热分析法所观察的物理性质是被研究体系的温度。将体系加热熔融成一均匀液相,然后让体系缓慢冷却,并每隔一定时间(例如半分钟或一分钟)读体系温度一次,以所得历次温度值对时间作图,得一曲线,通常称为步冷曲线或冷却曲线,图4.2是二元金属体系的一种常见类型的步冷曲线。冷却过程中,若体系发生相变,就伴随着一定热效应,团此步冷曲线的斜率将发生变化而出现转折点,所以这些转折点温度就相当于被测体系在相图中分隔线上的点。若图4.2是图4.1中组成为P的体系的步冷曲线,则点2、3就分别相当于相图中的点G、H。因此,取一系列组成不同的体系,作出它们的步冷曲线,找出各转折点,即能画出二元体系的最简单的相图(对复杂的相图,
二组分固液相图
5.4二组分系统的固~液平衡 5.4.1形成低共熔物的固相不互溶系统 当所考虑平衡不涉及气相而仅涉及固相和液相时,则体系常称为"凝聚相体系"或"固液体系"。固体和液体的可压缩性甚小,一般除在高压下以外,压力对平衡性质的影响可忽略不计,故可将压力视为恒量。由相律: 因体系最少相数为Φ=1,故在恒压下二组分体系的最多自由度数f*=2,仅需用两个独立变量就足以完整地描述体系的状态。由于常用变量为温度和组成,故在二组分固液体系中最常遇到的是T~x(温度~摩尔分数)或T~ω(温度~质量分数)图。 二组分固~液体系涉及范围相当广泛,最常遇到的是合金体系、水盐体系、双盐体系和双有机物体系等。在本节中仅考虑液相中可以完全互溶的特殊情况。这类体系在液相中可以互溶,而在固相中溶解度可以有差别。故以其差异分为三类:(1)固相完全不互溶体系;(2)固相部分互溶体系和(3)固相完全互溶体系。进一步分类可归纳如下: 研究固液体系最常用实验方法为“热分析”法及“溶解度”法。本节先在“形成低共熔物的固相不互溶体系”中介绍这两种实验方法,然后再对各种类型相图作一简介。 (一)水盐体系相图与溶解度法
1.相图剖析 图5-27为根据硫酸铵在不同温度下于水中的溶解度实验数据 绘制的水盐体系相图,这类构成相图的方法称为"溶解度法"。 纵坐标为温度t(℃),横坐标为硫酸铵质量分数(以ω表 示)。图中FE线是冰与盐溶液平衡共存的曲线,它表示水 的凝固点随盐的加入而下降的规律,故又称为水的凝固点降 低曲线。ME线是硫酸铵与其饱和溶液平衡共存的曲线,它 表示出硫酸铵的溶解度随温度变化的规律(在此例中盐溶解 度随温度升高而增大),故称为硫酸铵的溶解度曲线。一般 盐的熔点甚高,大大超过其饱和溶液的沸点,所以ME不可 向上任意延伸。FE线和ME线上都满足Φ =2,f *=1,这意 味温度和溶液浓度两者之中只有一个可以自由变动。 FE线与ME线交于E点,在此点上必然出现冰、盐和盐溶液三相共存。当Φ=3 时,f*=0 ,表明体系的状态处于E点时,体系的温度和各相的组成均有固定不变的数值;在此例中,温度为 -18.3℃,相应的硫酸铵浓度为 39.8%。换句话说,不管原先盐水溶液的组成如何,温度一旦降至 -18.3℃,体系就出现有冰(Q 点表示)、盐(I点表示)和盐溶液(E点表示)的三相平衡共存,连接同处此温度的三个相点构成水平线QEI,因同时析出冰、盐共晶体,故也称共晶线。此线上各物系点(除两端点Q和I外)均保持三相共存,体系的温度及三个相的组成固定不变。倘若从此类体系中取走热量,则会结晶出更多的冰和盐,而相点为E的溶液的量将逐渐减少直到消失。溶液消失后体系中仅剩下冰和盐两固相,Φ=2,f*=1,温度可继续下降即体系将落入只存在冰和盐两个固相共存的双相区。若从上向下看E点的温度是代表冰和盐一起自溶液中析出的温度,可称为"共析点"。反之,若由上往下看E点温度是代表冰和盐能够共同熔化的最低温度,可称为"最低共熔点"。溶液E凝成的共晶机械混合物,称为"共晶体"或"简单低共熔物"。不同的水盐体系,其低共熔物的总组成以及最低共熔点各不相同,表5-7列举几种常见的水盐体系的有关数据。 表5-7 某些盐和水的最低共熔点及其组成
试验五金属相图
实验五 金属相图 一 实验目的 1. 了解热分析的测量技术 2. 掌握热分析法绘制Pb - Sn 合金相图的方法 二 实验原理 物质在不同的温度、压力和组成下,可以处于不同的状态。研究多相平衡体系的状态如何随温度、压力、浓度而变化,并用几何图形表示出来,这种图形称为相图。二组分体系的相图分为气-液体系和固-液体系两大类。本实验为后者也称凝聚体系,它受压力影响很小,其相图常用温度-组成的平面图表示。 热分析法(步冷曲线法)是绘制相图的常用方法之一。这种方法是通过观察体系在冷却(或加热)时温度随时间的变化关系,来判断有无相变的发生。通常的做法是先将体系全部熔化,然后让其在一定环境中自行冷却;并每隔一定的时间(例如半分钟或一分钟)记录一次温度。以温度(T )为纵坐标,时间(t )为横坐标,画出步冷曲线T -t 图。图5-1是二组分金属体系的一种常见类型的步冷曲线。 当体系均匀冷却时,如果体系不发生相变, 则体系的温度随时间的变化将是均匀的, 冷却也较快(如图中ab 线段)。若在冷却 过程中发生了相变,由于在相变过程中伴 随着热效应,所以体系温度随时间的变化 速度将发生改变,体系的冷却速度减慢, 步冷曲线就出现转折即拐点(如图中b 点 所示)。当熔液继续冷却到某一点时(例如 图中c 点),由于此时熔液的组成已达到最 低共熔混合物的组成,故有最低共熔混合物 析出,在最低共熔混合物完全凝固以前,体 系温度保持不变,因此步冷曲线出现水平线 段即平台(如图中cd 段)。当熔液完全凝固 后,温度才迅速下降(见图中de 线段)。 (a) 步冷曲线 图 5-1 步冷曲线 (b) A -B 体系相图 图 5-2 步冷曲线与相图
二组分简单共熔系统相图的绘制
实验报告 课程名称: 大学化学实验(P ) 指导老师: 成绩:_______________ 实验名称: 二组分简单共熔系统相图的绘制 实验类型: 物性测试 同组学生姓名: 【实验目的】 1. 用热分析法测绘Zn-Sn 相图。 2. 熟悉热分析法的测量原理 3. 掌握热电偶的制作、标定和测温技术 【实验原理】 本实验采用热分析法中的步冷曲线方法绘制Zn-Sn 系统的固-液平衡相图。将系统加热熔融成一均匀液相,然后使其缓慢冷却,每隔一定时间记录一次温度,表示温度与时间的关系曲线,称为冷却曲线或步冷曲线。当熔融系统在均匀冷却过程中无相变化时,其温度将连续下降,得到一条光滑的冷却曲线,如在冷却过程中发生相变,则因放出相变热,使热损失有所抵偿,冷却曲线就会出现转折点或水平线段。转折点或水平线段对应的温度,即为该组成合金的相变温度。对于简单共熔合金系统,具有下列形状的冷却曲线[图a(a)],由这些冷却曲线,即可绘出合金相图[图a(b)]。 在冷却过程中,常出现过冷现象,步冷曲线在转折处出现起伏[图a(c)]。遇此情况可延长FE 交曲线BD 于点,G 点即为正常的转折点。 用热分析法测绘相图时,被测系统必须时时处于或接近相平衡状态,因此,系统的冷却速度必须足够慢,才能得到较好的结果。 图a 步冷曲线(a )、对应相图(b )及有过冷现象出现的步冷曲线(c ) 【试剂与仪器】 仪器 镍铬-镍硅热电偶1支;UJ-36电位差计1台;小保温瓶1只;盛合金的硬质玻璃管7只;高 温管式电炉2只(加热炉、冷却炉);调压器(2KW )1只; 坩埚钳1把;二元合金相图计算机测试系统1套。 试剂 锡、锌、铋(均为AR );石墨粉。 【实验步骤】 1. 热电偶的制作:取一段长约0.6m 的镍铬丝,用小瓷管穿好,再取两段各长0.5m 的镍硅丝,制作热 电偶(此步骤一般已事先做好)。 2. 配置样品:在7只硬质玻璃管中配制各种不同质量分数的金属混合物:100%Bi ;100%Sn ;100%Zn ; 45%Sn+55%Zn ;75%Sn+25%Zn ;91.2%Sn+8.8%Zn ;95%Sn+5%Zn 。为了防止金属高温氧化,表面放置石墨粉(此步骤由实验室完成)。 3. 安装:安装仪器并接好线路。 4. 加热溶化样品,制作步冷曲线:依次测100%Zn ,100%Bi ,100%Sn ,45%Sn+55%Zn ,
Bi-Sn 二元金属相图的绘制(热电势法)实验报告
Sn—Bi二元金属相图的绘制(热电势法) 一、实验目的 1、用热电偶—电位差计测定Bi—Sn体系的步冷曲线,绘制相图; 2、掌握热电势法测定金属相图的方法; 3、掌握热电偶温度计的使用,学习双元相图的绘制; 二、实验原理 研究多相体系的状态随浓度、温度、压力等变量的改变而发生变化的规律,并用图形来表示体系状态的变化,这种图形就称为相图或称为状态图。用热分析法可绘制相图,测绘一系列不同组成的金属混合物的步冷线,然后把各步冷曲线上物态变化的温度绘在温度--组成图上,即把图中各步冷曲线的转折点和水平段所对应的温度用。表示在温度--组成图中,即得到该体系的相图。液相完全互溶的二组分体系,在凝固时有的能完全互溶成为固溶体,有的仅部分互溶,如本实验的Bi--Sn体系。 本实验用热电偶作为感温元件,自动平衡电位差计测量各样品冷却过程中的热电势,作出电位—时间曲线(步冷曲线),再由热电偶的工作曲线找出相变温度,从而作出Bi-Sn体系的相图。 三、实验仪器和试剂 坩埚电炉(含控温仪);自动平衡电位差计;冷却保温装置;样品管;杜瓦瓶;镍铬---镍铝(或含其他材料);热电偶. 锡(AR)232;铋(AR)271 四、实验步骤 1、准备工作 在杜瓦瓶中装入室温水,按图连接路线并检查线路。热电偶调零:在测温热电偶为室温温度时开启记录仪开关,调量程为10mV,走纸温度为0,调节零旋纽使记录笔位于记录纸左边零线处。这时位置所指温度热电势为0,代表温度为室温。 2、测量 (1)加热试样: 置纯Sn样品坩埚于管式电炉中,置电热偶温度计于坩埚中细玻璃管内,并插入底部.调调压器使加热电压为150mV,加热至坩埚中细玻璃管能动则说明试样已 熔化,停止加热。 (2)测量步冷曲线 当发现记录笔开始向左移动(降温)时,放下记录笔,调走纸速度为4mm/min,开始测量。当平台出现后一会抬起记录笔并调节走纸速度为0。 同上步骤,依次测量含Bi 30%,58% 的混合物。 五、实验数据记录及处理 1.测纯Sn的各样品电势变化
物理化学实验报告二组分简单共熔合金相图绘制
一、实验目的 1.掌握步冷曲线法测绘二组分金属的固液平衡相图的原理和方法。 2、了解固液平衡相图的特点,进一步学习和巩固相律等有关知识。 二、主要实验器材和药品 1、仪器:KWL-II金属相图(步冷曲线)实验装置、微电脑控制器、不锈钢套管、硬质玻璃样品管、托盘天平、坩埚钳 2、试剂:纯锡(AR)、纯铋(AR)、石墨粉、液体石蜡 三、实验原理 压力对凝聚系统影响很小,因此通常讨论其相平衡时不考虑压力的影响,故根据相律,二组分凝聚系统最多有温度和组成两个独立变量,其相图为温度组成图。 较为简单的组分金属相图主要有三种:一种是液相完全互溶,凝固后固相也能完全瓦溶成固体混合物的系统最典型的为Cu- Ni系统;另一种是液相完全互溶,而固相完全不互溶的系统,最典型的是Bi- Cd 系统;还有一种是液相完全互溶,而固相是部分互溶的系统,如Pb- Sn或Bi- Sn系统。 研究凝聚系统相平衡,绘制其相图常采用溶解度法和热分析法。溶解度法是指在确定的温度下,直接测定固液两相平衡时溶液的浓度,然后依据测得的温度和溶解度数据绘制成相图。此法适用于常温F易测定组成的系统,如水盐系统。 热分析法(步冷曲线法)则是观察被研究系统温度变化与相变化的关系,这是绘制金属相图最常用和最基本的实验方法。它是利用金属及合金在加热和冷却过程中发生相变时,潜热的释出或吸收及热容的突变,来得到金属或合金中相转变温度的方法。其原理是将系统加热熔融,然后使其缓慢而均匀地冷却,每隔定时间记录一次温度,物系在冷却过程中温度随时间的变化关系曲线称为步冷曲线(又称为冷却曲线)。根据步冷曲线可以判断体系有无相变的发生。当体系内没有相变时,步冷曲线是连续变化的;当体系内有相变发生时,步冷曲线上将会出现转折点或水平部分。这是因为相变时的热效应使温度随时间的变化率发生了变化。因此,由步冷曲线的斜率变化可以确定体系的相变点温度。测定不同组分的步冷曲线,找出对应的相变温度,即可绘制相图。 图3- 15(b)是具有简单低共熔点的A- B二元系相图,左右图中对应成分点a.b.c、d.e 的步冷曲线。下面对步冷曲线作简单分析。 在固定压力不变的条件下,相律为: f=c-φ+1 (3-6-1) 式中:c为独立组分数;为相数。 对于纯组分熔融体系,c=1,q=1。在冷却过程中若无相变化发生,其温度随时间变化关系曲线为平滑曲线。到凝固点时,固液两相平衡,=2,自由度为0,温度不变,出现水平线段。等体系全部凝固后,其冷却情况同纯熔融体系一样,呈一平滑曲线。图3- 15(a)中曲线ave 属于这种情况。 曲线C是低共培体冷却曲线,情况与a.c相似.水平线段的出现是因为当冷却到头能点温度r。时,A和B同时标出,且固相中的比例与溶液中相同,因此溶液浓度不变,从街具备
金属共晶相图
5.3.2 二元共晶相图 ①共晶相图: 当两组元在液态能无限互溶,在固态只能有限互溶,并具有共晶转 变,这样的二元合金系所构成的相图称为二元共晶相图。 如Pb-Sn ,Pb-Sb ,Cu-Ag ,Al-Si 等合金的相图都属于共晶相图。Pb-Sn 合金相 图是典型的二元共晶相图,见图5.26, 下面以它为例进行讲解。首先分析相图中 的点,线和相区。 图5.26 铅锡相图 一、相图分析 1、点: t A ,t B 点分别是纯组元铅与锡的熔点,为327.5o C 和231.9o C 。 M 点:为锡在铅中的最大溶解度点。N 点:为铅在锡中的最大溶解度点。 E 点:为共晶点,具有该点成分的合金在恆温183℃时发生共晶转变L E →αM +β N 共晶转变:是具有一定成分的液相在恆温下同时转变为两个具有一定成分和结构的固相的过程。 F 点:为室温时锡在铅中的溶解度。G 点:为室温时铅在锡中的溶解度。 2、t A Et B 线:为液相线,其中t A E 线:为冷却时L →α的开始温度线,Et B 线:为 冷 却时L →β的开始温度线。 t A MENt B 线:为固相线,其中t A M 线:为冷却时L →α的终止温度线,t B N 线: 为冷却时L →β的终止温度线。 MEN 线:为共晶线,成分在M~N 之间的合金在恒温183℃时均发生共晶转 变L E →(αM +βN )形成两个固溶体所组成的机械混合物,通常称为共晶体 或共晶组织。 MF 线:是锡在铅中的溶解度曲线。NG 线:是铅在锡中的溶解度曲线。
3、相区 (1)单相区:在t A Et B 液相线以上,为单相的液相区用L表示,它是铅与锡组成的合金溶液。 t A MF线以左为单相α固溶体区,α相是Sn在Pb中的固溶体。 t B NG线以右为单相β固溶体区,β相是Pb在Sn中的固溶体。 (2)两相区:在t A EMt A 区为L+α相区,在t B ENt B 区为L+β相区。在FMENGF区为α+β相区。 (3)三相线:MEN线为L+α+β三相共存线。由相律可知三相平衡 共存时,f=2-3+1=0,只能在恒温下实现。 具有共晶相图的二元系合金,通常可以根据它们在相图中的位置不同,分为以下几类:①成分对应于共晶点(E)的合金称为共晶合金,如Pb-Sn相图中含Sn61.9%的合金。②成分位于共晶点(E)以左,M点以右的合金称为亚共晶合金,如含Sn19%~61.9%的合金都是亚共晶合金。③成分位于共晶点(E)以右,N点以左的合金称为过共晶合金。如含Sn61.9%~97.5%的合金都是过共晶合金。④成分位于M点以左,N点以右的合金称为端部固溶体合金。如含Sn小于19%和大于97.5%的合金都是端部固溶体合金。 二.共晶系典型合金的平衡凝固过程分析 1.端部固溶体合金(10%Sn-Pb合金) 由图5.26可以看出,合金①冷却到t 1 温度时开始发生匀晶转变从L→α。随着 温度的降低α量不断增加,L量不断减少,并且α相的成分沿固相线t A M变,L 相的成分沿液相线t A E变。当冷却到t 2 温度时L全部转变成α相,继续降低温度 α相自然冷却不发生成分和相的变化。当冷却到t3温度时,Sn在α固溶体中达到饱和状态,因此随着温度的降低,它处于过饱和状态,多余的Sn以β固溶体的形式从α固溶体中析出,这时α固溶体的平衡成分沿MF线变化,相对量逐渐减少,而析出的β固溶体的平衡成分沿NG线变化,相对量逐渐增加。通常将固溶体中析出另一种固相的过程称为脱溶转变,脱溶转变的产物一般称为次生相或二次相。次生相β固溶体用β Ⅱ 表示,以区别从液相中直接凝固出的β固溶体。由于次生相是从固相中析出的,而原子在固相中的扩散速度慢,所以次生相一般都较细小,并分布在晶界上或固溶体的晶粒内部。由上述分析可知该合金在室温 时的组织为α+β Ⅱ,见图5.27。图中黑色基体为α相,白色颗粒为β Ⅱ 相。图5.28为该合金的平衡凝固过程示意图。
合金相图实验报告
一.实验目的 1.用热分析法测绘Sn-Bi二元低共熔体系的相图 2.学习步冷曲线绘制相图的方法 二.实验原理 相图是多相体(二相或二相以上)处于相平衡状态时体系的某种物理性质对体系的某一自变量作图所得的图形(体系的其它自变量维持不变),二元和多元体系的相图常以组成为自变量,其物理性质则大多取温度。由于相图能反映出多相平衡体系在不同条件下的相平衡情况,因此研究相体系的性质,以及多相平衡情况的变化要用相图的知识。 AB表示两个组分的名称,纵坐标是温度T,横坐标 是B的百分含量abc线上,体系只有液相存在,ace 所围的面积中有固相A及液相存在,bcf所围的中 有B晶体和个液相共存,c点有三相(AB晶体和饱 和熔化物)。 测绘相图就是要将图中这些分离相区的线画出来, 常用的实验方法是热分析法。所观察的物理性质是 被研究体系的温度。将体系加热熔融成均匀液体,然后冷却,每隔一定时间记录温度一次,一温度对时间作图,得到步冷曲线。 当一定组成的熔化物冷却时,最初温度随时间逐渐下降达到相变温度时,一种组分开始析出,随着固体的析出而放出凝固潜热,使体系冷却速度变慢,步冷曲线的斜率发生变化而出现转折点,转折点的温度即是相变温度。继续冷却的过程中,某组分析出的量逐渐增多而残留溶液中的量则逐渐减少,直到低共熔温度时,液相达到低共熔组成,两种组分同时互相饱和,两种组分的晶体同时析出,这时继续冷却温度将保持不变,步冷曲线出现一水平部分,直到全部溶液变为固体后温度才开始降低,水平停顿温度为最低共熔点温度。 如果体系是纯组分,冷却过程中仅在其熔点出现温度停顿,步冷曲线的水平部分是纯物质的熔点,图中b是图1中组成为P体系的步冷曲线,点2,3分别相当于图1中的G,H。因此取一系列不同组成的体系,做出它们的步冷曲线求出其转折点,就能画出相图。但是在实验过程中有时会出现过冷现象,这时必须外推求得真正的转折点。
二组分金属相图的绘制思考题汇总
二组分金属相图的绘制思考题汇总 1.有一失去标签的Pb-Sn合金样品,用什么方法可以确定其组成? 答: 将其熔融、冷却的同时记录温度,作出步冷曲线,根据步冷曲线上拐点或平台的温度,与温度组成图加以对照,可以粗略确定其组成。 2.总质量相同但组成不同的Pb-Sn混合物的步冷曲线,其水平段的长度有什么不同?为什么? 答: (1)混合物中含Sn越多,其步冷曲线水平段长度越长,反之,亦然。 (2)因为Pb 和Sn的熔化热分别为23.0和59.4jg-1,熔化热越大放热越多,随时间增长温度降低的越迟缓,故熔化热越大,样品的步冷曲线水平段长度越长。 3.有一失去标签的Pb-Sn合金样品,用什么方法可以确定其组成? 4.总质量相同但组成不同的Pb-Sn混合物的步冷曲线,其水平段的长度有什么不同?为什么? (查表: Pb 熔点327℃,熔化热23.0jg-1,Sn熔点232℃,熔化热59.4jg-1) 5、何谓热分析法?用热分析法绘制相图时应注意些什么? 热分析法是相图绘制工作中的一种常用的实验方法,按一定比例配制均匀的液相体系,让他们缓慢冷却,以体系温度对时间作图,则为步冷曲线。曲线的转折点表征了某一温度下发生的相变的信息。 6、为什么要控制冷却速度,不能使其迅速冷却? 答:
使温度变化均匀,接近平衡态,必须缓慢降低温度,一般每分钟降低5度。 7、如何防止样品发生氧化变质? 答: 温度不可过高,空气不能过多和样品接触。 8、用相律分析在各条步冷曲线上出现平台的原因。 答: 因为金属熔融系统冷却时,由于金属凝固放热对体系散热发生一个补偿,因而造成冷却曲线上 的斜率发生改变,出现折点。当温度达到了两种金属的最低共熔点,会出现平台。 9、为什么在不同组成融熔液的步冷曲线上,最低共熔点的水平线段长度不同?答: 不同组成,各组成的熔点差值不同,凝固放热对体系散热的补偿时间也不同。 10.样品融熔后为什么要保温一段时间再冷却? 答: 使混合液充分混融,减小测定误差。 11.对于不同成分混合物的步冷曲线,其水平段有什么不同? 答: 纯物质的步冷曲线在其熔点处出现水平段,混合物在共熔温度时出现水平段。而平台长短也不同。 12.作相图还有哪些方法?
物理化学实验报告讲义二组分金属相图的测定
实验30 二组分金属相图的测定 预习要求 1.理解热分析法。 2.理解步冷曲线上的转折点及停歇线表示的含义。 3.本实验所测定的Zn-Sn二组分,在液相及固相的相互溶解情况。 4.使用热电偶测量温度时的注意事项。(参阅附录1.2.3) 实验目的 1.用热分析法(步冷曲线法)绘制Zn-Sn二组分金属相图。 2.掌握热电偶测量温度的基本原理和自动平衡记录仪的使用方法。 实验原理 简单的二组分金属相图主要有三种:①液相完全互溶,凝固后固相也能完全互溶成固溶体的系统,如Cu-Ni,溴苯-氯苯;②液相完全互溶,固相完全不互溶的系统,如Bi-Cd; ③液相完全互溶,固相部分互溶的系统,如Pb-Sn。本实验研究的Zn-Sn系统属于第二种。在低共熔温度下,Zn在固相Sn中的最大溶解度为w Zn=0.09。 热分析法是绘制金属相图的基本方法之 一,即利用金属或合金在加热或冷却过程中发 生相变时,相变热的吸收或释放引起热容的突 变,来得到金属或合金中相转变温度的方法。 通常的做法是将金属或合金加热至全部熔 化,然后让其在一定的环境中自行冷却,每隔 一定时间记录一次温度,表示温度与时间关系 的曲线,即为步冷曲线(见图3-13)。 当熔融的系统均匀冷却时,如果不发生相 图3-13步冷曲线 变,则系统温度随时间的变化是均匀的,冷却 速度较快(如图中ab线段);若在冷却过程中 发生相变,由于在相变过程中伴随着放热,所以系统的冷却速率减慢,步冷曲线上出现转折(如图中b点);当系统继续冷却到某一温度时(如图中c点),系统中有低共熔混合物析出,步冷曲线出现温度的“停顿”;在低共熔混合物全部凝固以前,系统温度保持不变,因此步冷曲线上出现水平线段(如图中cd线段);当系统完全凝固后,温度又开 始下降(如图中de线段)。 图3-14 固相完全不互溶的A-B二组分金属相图及其步冷曲线
金属共晶相图
5.3.2 二元共晶相图 ①共晶相图:当两组元在液态能无限互溶,在固态只能有限互溶,并具有共晶转 变,这样的二元合金系所构成的相图称为二元共晶相图。 如Pb-Sn,Pb-Sb,Cu-Ag,Al-Si等合金的相图都属于共晶相图。Pb-Sn合金相图是典型的二元共晶相图,见图, 下面以它为例进行讲解。首先分析相图中的点, 线和相区。 图铅锡相图 一、相图分析 1、点:t A,t B点分别是纯组元铅与锡的熔点,为和。 M点:为锡在铅中的最大溶解度点。N点:为铅在锡中的最大溶解度点。 E点:为共晶点,具有该点成分的合金在恆温183℃时发生共晶转变L E→αM+ βN 共晶转变:是具有一定成分的液相在恆温下同时转变为两个具有一定成分和结构的固相的过程。 F点:为室温时锡在铅中的溶解度。G点:为室温时铅在锡中的溶解度。 2、t A Et B线:为液相线,其中t A E线:为冷却时L→α的开始温度线,Et B线:为冷 却时L→β的开始温度线。 t A MENt B线:为固相线,其中t A M线:为冷却时L→α的终止温度线,t B N线: 为冷却时L→β的终止温度线。
MEN线:为共晶线,成分在M~N之间的合金在恒温183℃时均发生共晶 转变L E→(αM+βN)形成两个固溶体所组成的机械混合物,通常称为共晶 体或共晶组织。 MF线:是锡在铅中的溶解度曲线。NG线:是铅在锡中的溶解度曲线。 3、相区 (1)单相区:在t A Et B液相线以上,为单相的液相区用L表示,它是 铅与锡组成的合金溶液。 t A MF线以左为单相α固溶体区,α相是Sn在Pb中的固溶体。 t B NG线以右为单相β固溶体区,β相是Pb在Sn中的固溶体。 (2)两相区:在t A EMt A区为L+α相区,在t B ENt B区为L+β相区。 在FMENGF区为α+β相区。 (3)三相线:MEN线为L+α+β三相共存线。由相律可知三相平衡 共存时,f=2-3+1=0,只能在恒温下实现。 具有共晶相图的二元系合金,通常可以根据它们在相图中的位置不同,分为以下几类:①成分对应于共晶点(E)的合金称为共晶合金,如Pb-Sn相图中含%的合金。 ②成分位于共晶点(E)以左,M点以右的合金称为亚共晶合金,如含Sn19%~%的合金都是亚共晶合金。③成分位于共晶点(E)以右,N点以左的合金称为过共晶合金。如含%~%的合金都是过共晶合金。④成分位于M点以左,N点以右的合金称为端部固溶体合金。如含Sn 小于19%和大于%的合金都是端部固溶体合金。 二.共晶系典型合金的平衡凝固过程分析 1.端部固溶体合金(10%Sn-Pb合金) 由图可以看出,合金①冷却到t1温度时开始发生匀晶转变从L→α。随着温度的 降低α量不断增加,L量不断减少,并且α相的成分沿固相线t A M变,L相的成 分沿液相线t A E变。当冷却到t2温度时L全部转变成α相,继续降低温度α相自 然冷却不发生成分和相的变化。当冷却到t3温度时,Sn在α固溶体中达到饱和
