SILAC-IP

SILAC-IP技术原理与应用
一、SILAC研究蛋白质相互作用概述
用SILAC (Stable isotope labeling with amino acids in cell culture,SILAC) 结合免疫共沉淀(Co-Immunoprecipitation,CoIP)寻找相互作用蛋白是SILAC在定量蛋白质组学研究基础上的进一步应用,称之为SILAC-IP技术。其基本原理是通过质谱鉴定和分析蛋白质相对量来判断是否是特异性结合诱饵蛋白,当实验组与对照组中某个蛋白质量含量达到统计学的差异时,就判定这个蛋白质与诱饵蛋白质具有相互作用。
二、与传统的免疫共沉淀(CoIP)或Pull down相比,SILAC技术研究蛋白质相互作用具有以下优势
1、特异性强,假阳性极低;
2、高通量,液相与质谱连用,能最大限度的寻找到相互作用的蛋白质;
3、灵敏度高;
4、能直接检测出与bait蛋白互作的其它蛋白的相对含量。
三、SILAC研究蛋白质相互作用技术服务流程
实验流程:
实验方案:
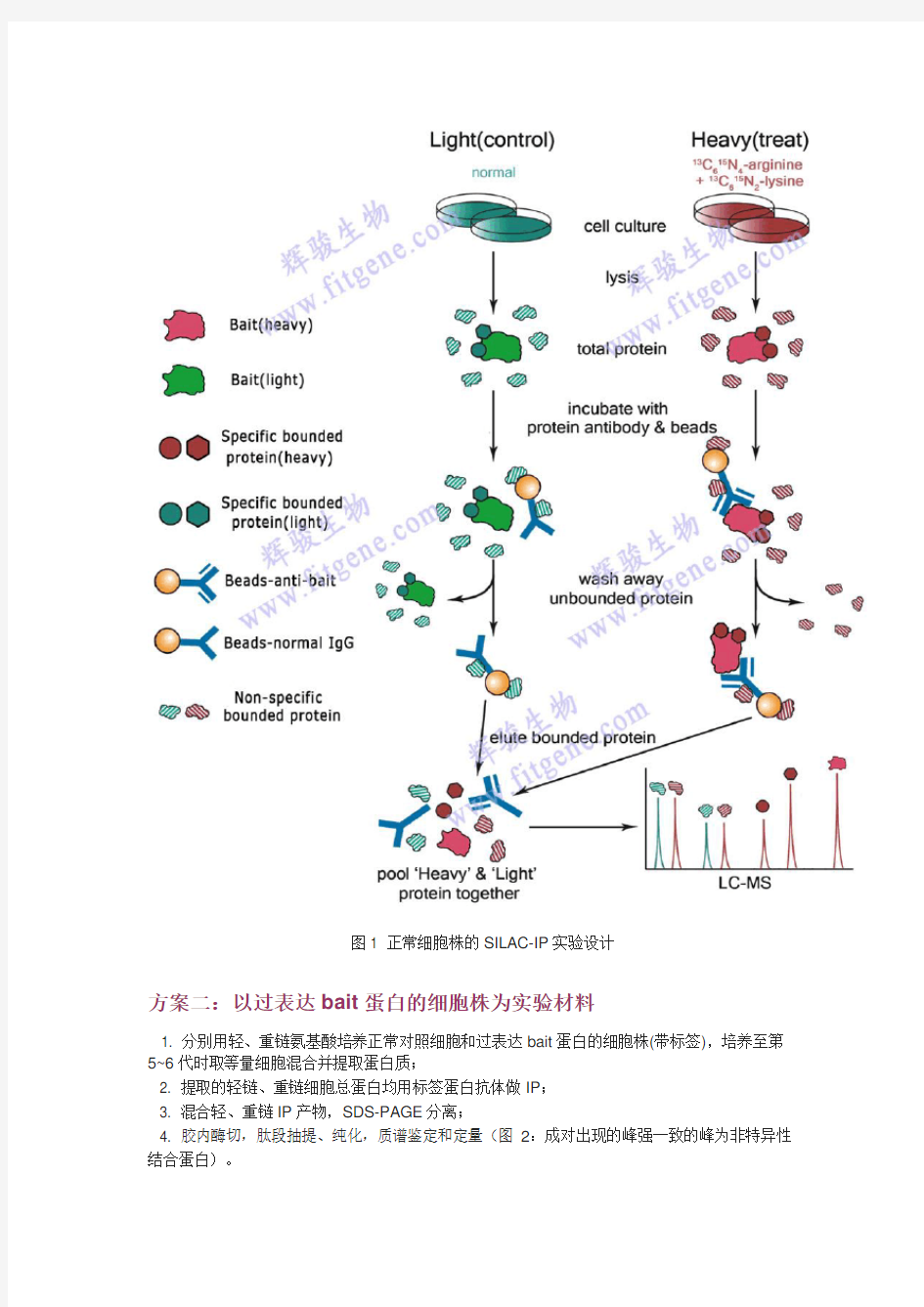
方案一:以正常细胞株为实验材料
1. 分别用轻、重链氨基酸培养细胞,培养至第5~6代时取等量细胞混合并提取蛋白质;
2. 提取的轻链、重链细胞总蛋白分别用Normal IgG和抗bait蛋白的特异抗体做免疫沉淀(IP);
3. 混合轻、重链IP产物,SDS-PAGE分离;
4. 胶内酶切,肽段抽提、纯化、鉴定和定量(图1:成对出现的峰为非特异性结合蛋白)。
图1 正常细胞株的SILAC-IP实验设计
方案二:以过表达bait蛋白的细胞株为实验材料
1. 分别用轻、重链氨基酸培养正常对照细胞和过表达bait蛋白的细胞株(带标签),培养至第5~6代时取等量细胞混合并提取蛋白质;
2. 提取的轻链、重链细胞总蛋白均用标签蛋白抗体做IP;
3. 混合轻、重链IP产物,SDS-PAGE分离;
4. 胶内酶切,肽段抽提、纯化,质谱鉴定和定量(图2:成对出现的峰强一致的峰为非特异性
结合蛋白)。
图2 过表达细胞株的SILAC-IP实验设计
方案三:以RNAi bait基因的细胞株为实验材料
1. 分别用轻链、重链氨基酸培养RNAi bait基因的细胞株和正常对照细胞株,培养至第5~6代时取等量细胞混合并提取蛋白质;
2. 提取的轻链、重链细胞总蛋白均用抗bait蛋白的特异抗体做IP;
3. 混合轻、重链IP产物,SDS-PAGE分离;
4. 胶内酶切,肽段抽提、纯化,质谱鉴定和定量(图3:成对出现且峰强一致的为非特异性结合蛋白;由于RNAi组的细胞株内bait蛋白含量下降,因而与其相互作用的蛋白的丰度也相对较
低,表现为峰强的减弱)。
图3 RNAi细胞株的SILAC-IP实验设计
四、SILAC研究蛋白质相互作用结果简要说明
图4:SILAC分析蛋白质相互作用的质谱峰图及被鉴定蛋白的生物信息分析
五、文献
Quantitative Proteomics Reveals a Novel Role of Karyopherin Alpha2 in Cell Migration through the Regulation of Vimentin?pErk ProteinComplex Levels in Lung Cancer.(2015)
High-throughput screening of a CRISPR/Cas9library for functional genomics in human cells. (2014).
Interplay of Acetyltransferase EP300and the Proteasome System in RegulatingHeat Shock Transcription Factor 1. (2014)
