二元体系沸点-组成图

二元体系沸点--组成图测绘
1 实验目的及要求
(1)在大气压下,测定环己烷-乙醇体系气、液平衡相图(沸点-组成图)。
(2)掌握阿贝折光仪的测量原理和使用方法。
2 原理
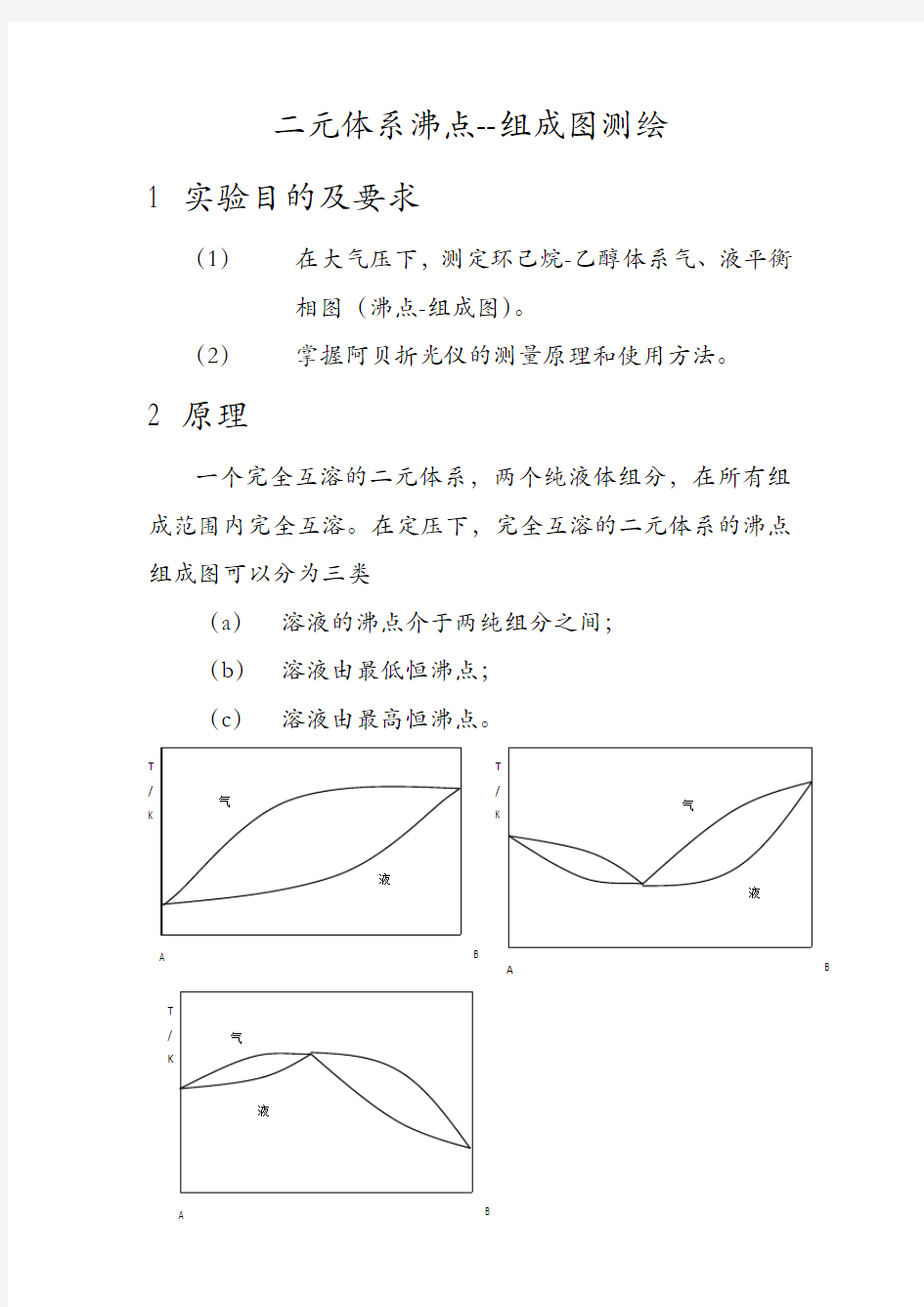
一个完全互溶的二元体系,两个纯液体组分,在所有组成范围内完全互溶。在定压下,完全互溶的二元体系的沸点组成图可以分为三类
(a)溶液的沸点介于两纯组分之间;
(b)溶液由最低恒沸点;
(c)溶液由最高恒沸点。
(b)(c)两类溶液在最高候着最低恒沸点时气、液两相组成相同,加热蒸发只能使气相总量增加,气、液相组成及溶液沸点保持不变,此温度称为恒沸点,相应组成称为恒沸组成。
绘制沸点组成图的原理:加热总组成为x1的溶液,体系的温度上升,达到液相线上的1点时溶液开始沸腾,组成为x2的气相开始生成,但是气相量很少,x1x2二点代表达到平衡时液、气两相组成。继续加热,气相量逐渐增加,沸点继续上升,气、液二相组成分别在气相线与液相线上变化,当达到某温度时并维持温度不变时,则x3x4为该温度下液、气两相组成,气相、液相的量按照杠杆原理确定。从相律f=c-p+2得:当外压恒定时,在气、液两相共存区域自由度为1;当温度一定是,则,气、液两相的组成也就确定,总组成一定,由杠杆规则可知两相的量之比也确定。因此,在一定的实验装置中,全回流的加热溶液,在总组成、总量不变时,当气相量与液相量之比也不变时,则体系的温度也就恒定。分别取出气、液两相的样品,分析其组成,得到该温度下气、液两相平衡时各相的组成。改变溶液总组成,得到另一温度下,气、液两相平衡时各相的组成。测得溶液若干总组成下的气液平衡温度及气、液相组成,分别将气相点用
连线相连即为气相线,讲液相线相连,即为液相线,得到沸点—组成图。
3 仪器与试剂
恒温槽恒沸点仪折光仪镜头纸加热电源电热丝导线橡皮塞温度计放大镜量筒(30ml)洗耳球吸管环己烷(A.R.)无水乙醇(A.R.)
4 实验步骤
(1)调节恒温槽至20.0℃。熟悉各个实验装置的使用方
法。
(2)在10个干燥洁净的沸点仪中,分别加入30ml液体,
每个沸点仪中液体的组成各不相同,组成如表所示,
在其中一个沸点仪中安装好温度计及电热丝,使电
热丝全部浸没在液体中,温度计水银球约1/2~2/3
浸入液体中。
(3)确认冷却水已经通入沸点仪冷凝管中。
(4)将加热电源的输出线与电热丝断开,打开加热电源
的电源开关,将输出电压调至0 。
(5)沸点仪冷凝管上端口不能加塞,烧瓶上端口和取样
直管口要塞紧塞子防止漏气。
(6)将加热电源的输出线与电热丝联通,调高加热电源
的输出电压或者输出电流,通过电热丝直接加热使
液体升高至沸腾。注意:调高电压的同时观察电热
丝在液体中的加热情况,避免加热电流过大引燃液
体;加热电压不要超过20v;沸点仪冷凝水要充足,
不能让蒸汽溢出。
(7)注意观察温度变化及液体沸腾前后情况。当冷凝管
下端凹槽内馏液充满溢出后,且温度稳定数分钟不
变时,记下温度,即为沸点。停止加热。用一只比
较长的吸管从冷凝管上端伸入凹槽中取液,另一支
吸管从烧瓶中取母液样品。立即在20℃下分别进行
这关率的测定。
(8)将温度计和电热丝取出,装入另一沸点仪中。参照
上面的步骤进行操作,测定馏液与母液的折光率。
加入另一沸点仪中,温度计和加热丝上的残留的液
体不需要进行吹干处理。
(9)用同样的方法,测定其他沸点仪中溶液沸点、馏液
和母液的折光率。
5 数据记录与处理
有图像得到恒沸点为64度,组成为0.56,即环己烷的摩
尔数。
6 思考题
(1)本实验中,如何判断气、液相是否已达平衡?
温度恒定,没有大范围的变化。
(2)本实验体系中,恒沸组成的蒸汽压比拉乌尔定律所预测的蒸汽压大还是小?
拉乌尔定律指出,在一定温度下,气液相平衡时,溶
液上方气相中任意组分所具有的分压,等于该组分在
相同温度下的饱和蒸汽乘以该组分在液相中的分子
分数。所以实验所得的恒沸蒸汽压应该是比预测的要
小。
(3)收集气相冷凝液的凹槽的大小对实验结果有无影响?
基本没有影响,只要蒸馏出足够多的气相冷凝液,能
够进行折光率的分析即可。
(4)蒸馏是一次分离环己烷~乙醇的有效方法么?
为什么?
不是,环己烷沸点81度,乙醇沸点78度,相差太小,
不符合蒸馏的条件(沸点相差30度)
二组分溶液沸点-组成图
实验4.5 二组分溶液沸点-组成图的绘制 一、目的要求 1.掌握阿贝折光仪及超级恒温槽的使用方法 2.掌握沸点-组成图的绘制方法 3.掌握用折光率确定二元液体组成的方法 二、实验原理 二组分完全互溶液体系统蒸馏曲线可分为三类: (1)系统中两组分对拉乌尔定律的偏差都不大,在T-x图上溶液的沸点总是介于A、B两纯液体的沸点之间,(如图) (2)两组分对拉乌尔定律都产生较大的负偏差,在p-x图上出现最小值时,在T-x图上将出现最高点,(如图) (3)两组分对拉乌尔定律都产生较大的正偏差,在p-x图上出现最大值时,在T-x图上将出现最低点,(如图) 最高点和最低点分别称为最高恒沸点和最低恒沸点,对应的组成称为恒沸组成,其相应的混合物称为恒沸混合物。
系统中两组分对拉乌尔定律的偏差都不大两组分对拉乌尔定律都产生较大的负偏差 两组分对拉乌尔定律都产生较大的正偏差
本实验是在某恒定压力下则定乙醇—正己烷二组分系统的沸点与组成平衡数据,并绘制该液体混合物的蒸馏曲线,其类型是系统中两组分对拉乌尔定律的偏差都较大的类型。 三、仪器试剂 超级恒温槽、阿贝折光仪、蒸馏瓶、恒流源、精密数字温度计、量筒、移液管、滴管、 环己烷、无水乙醇、丙酮、重蒸馏水、80%、60%、40%、20%环己烷—-乙醇标准混合液; 各种组成的环己烷—乙醇混合液。 四、实验步骤 1.测定沸点与组成的关系:使用折光率仪测量上述混合溶液相应的折光率。以折射率对浓度作图,即可绘制工作曲线。 2. 一定组成环己烷——乙醇混合液沸点及气液两相折射率的测定。按图装好装置后,加入药品,环己烷/乙醇: 26.21ml/0.45ml、25.44ml/1.23ml、23.41ml/3.25ml、 19.46ml/7.21ml、17.15ml/9.52、11.61ml/15.85ml、 6.4ml/20.23ml、1.41ml/25.26ml,加热回流。 3.待温度读数稳定后,将蒸馏瓶稍稍倾斜,使小槽中的冷凝回流蒸气瓶,发福倾倒三次,待小槽收集满后,记下沸点温度,
二组分溶液沸点—组成图的绘制
学号:21 成绩: 基础物理化学实验报告 实验名称:二组分溶液沸点—组成图 的绘制 应用化学二班级3 组号 实验人姓名:xx 同组人姓名:xx 指导老师:周崇松 实验日期:2013.9 湘南学院化学与生命科学系
一.实验目的 1.测定常压下环己烷-乙醇二元系统的气液平衡数据,绘制沸点-组成相图。 2.掌握双组分沸点的测定方法,通过实验进一步理解分馏原理。 3.掌握阿贝折射仪的使用方法。 二.实验原理 在一定的外压下,纯液体的沸点是恒定的,但对于完全互溶双液系,沸点 不仅与外压有关,而且还与其组成有关,并且在沸点时,平衡的气-液两相组成往往不同。根据相律:F=C-P+2,一个气液共存的二组分体系,其自由度为2,只需再任意确定一个变量,其自由度就减为1,整个体系的存在状态就可以用二维图来描述。本实验中采用在一定压力下,作出体系的温度T 和组分x 的关系图,即T-x 图。 完全互溶体系的T-x 图可分为三类:①液体与Raoult 定律的偏差不大,在T-x 图上,溶液的沸点介于两种纯液体的沸点之间(图1.a ),如苯-甲苯系统;②由于两组分的相互作用,溶液与Raoult 定律有较大的负偏差,在T-x 图上存在最高沸点(图1.c ),如卤化氢-水系统;③ 溶液与Raoult 定律有较大的正偏差,在T-x 图上存在最低沸点(图1.b ),如乙醇-水系统。②和③类溶液,在最高或最低沸点时的气-液两相组成相同,这些点称为恒沸点,此浓度的溶液称为恒沸点混合物,相应的温度称为恒沸温度,相应的组成称为恒沸组成。 本实验所要测绘的环己烷-乙醇体系即属于第二类溶液。对于一个组成恒定的封闭系统,当系统达到气液平衡温度时,气液两相的组成和温度恒定不变,以此便能得到该温度下的平衡气-液两相组成的一对坐标。依次改变系统的组成就能得到一系列的平衡气-液两相组成坐标点,用光滑曲线连接即成相图。 实验所用的沸点仪结构如图2,冷凝管底部的小球用以收集冷凝下来的 气相样品。电热丝直接浸入溶液中加热可避免暴沸现象,温度计外的小玻璃罩有利于降低周围环境可能造成的温度计读数波动。平衡时气-液两相组成的分析用的是折射率法,因为溶液的折射率与其组成有关。若在一定温度下,测得一系列已知浓度溶液的折射率,作出该温度下溶液的折射率-组成工作曲线,就可通过测量同温度下的未知浓度溶液的折射率得到此溶液的浓度。因折射率是温度的函数,测定时必须严格控制阿贝折光仪的测量温度。 t/℃ t/℃ t/℃ A A A B B B x B (a) x B (b) 气 气 气 液 液 液 x B (c)
物理化学实验报告 - 二元体系沸点-组成图测绘
C7二元体系沸点-组成图测绘 ——实验日期:2014年4月日姓名:马玉仁学号:1120122488 班级:10011202 一、实验目的 (一)在大气压下,测定环己烷-乙醇体系气、液平衡相图(沸点-组成图)。(二)掌握阿贝折光仪的测量原理和使用方法。 二、原理及实验公式 一个完全互溶的二元体系,两个纯液体组分,在所有组成范围内完全互溶。在定压下,完全互溶的二元体系的沸点—组成图可分为三类,如图C7.1所示。 a.溶液的沸点介于两纯组分沸点之间,如苯一甲苯体系; b.溶液有最低恒沸点,如环己烷-乙醇体系; c.溶液有最高恒沸点,如丙酮—氯仿体系。 b、c两类溶液在最高或最低恒沸点时气、液两相组成相同,加热蒸发只能使气相总量增加,气、液相组成及溶液沸点保持不变,此温度称恒沸点,相应组成称恒沸组成。 图C7.1 二元体系T-x图 下面以a为例,简单说明绘制沸点-组成图的原理。加热总组成为x1的溶液,体系的温度上升,达液相线上1点时溶液开始沸腾,组成为x2的气相开始生成,但气相量很少(趋于0),x1、x2二点代表达到平衡时液、气两相组成。继续加热,气相量逐渐增多,沸点继续上升,气、液二相组成分别在气相线和液相线上变化,当达某温度(如2点),并维持温度不变时,则x3、x4为该温度下液、气两相组成,气相、液相的量之比按杠杆规则确定。从相律f = c - p +2可知,当外压恒定时,在气、液两相共存区域自由度等于1,当温度一定时,则气、液两相的组成也就确定,总组成一定,由杠杆规则可知两相的量之比也已确定。因此,在一定的实验装置中,全回流的加热溶液,在总组成、总量不变时,当气相的量与液相的量之比也不变时(达气-液平衡),则体系的温度也就恒定。分别取出气、液两相的样品,分析其组成,得到该温度下,气、液两相平衡时各相的组成。改变溶
二元液系相图(实验数据分析)
实验名称:二元液系相图 学院:XXXXXXXXXX 班级:XXXXXXXXX 姓名(学号):XXX(XXXXXXXX) 指导教师:XXX 实验时间:XXXXXXXXXXXXXX
二元液系相图 一、实验目的 1.测定环己烷-乙醇系统的沸点组成图(T-X图)。 2.掌握阿贝(Abbe)折光仪的使用方法。 二、实验原理 两种液态物质以任何比例混合都形成均相溶液的系统称这完全 互中溶双液系。在恒定压力下溶液沸点与平衡的气液相组成的关系,可用沸点-组成图(t-x图)表示。 完全互溶双液系的沸点-组成图可分为两三种: 一种为最简单的情况,溶液沸点介于两个纯组分沸点之间,如图6-1所示。纵坐标表示温度,横坐标表示组分B的摩尔分数(x B,y B)。下面一条曲线表示气液平衡时温度(即溶液沸点)与液想组成的关系,称液相线(T-x线)。上面的线表示平衡温度与气相组成的关系,称气相线(T-y线)。若总组成为Z B的系统在压力p及温度t时达到气液两相平衡,其液相组成为x B气相组成为y B(见图6-1)。 另两种类型为具有恒沸点的完全互溶双液系统气液平衡相图,如图6-2所示。其中(a)为具有低恒沸点相图,(b)为具有高恒沸点相图。这两类相图中气相线与液相线在某处相切。相切点对应的温度称为恒沸温度,对应组成的混合物称恒沸混合物。恒沸混合物在恒沸点达气液平衡,平衡的气、液组成相同。同一双液系在不同压力下,恒沸点及恒沸混合物是不同的。
本实验绘制环己烷-乙醇二元液系的T-X图。其方法为将不同组成的溶液于蒸馏仪中进行蒸馏,沸腾平衡后记下温度,依次吸取少量的蒸馏液和蒸出液。分别用阿贝折光计测定其折射率,然后由环己烷-乙醇的折射率-组成标准曲线或其数据表确定相应组成,从而绘制环己烷-乙醇二元液系相图。 三、仪器和试剂 沸点测定仪;取样管;阿贝折光仪。 环己烷(分析纯);无水乙醇(分析纯);环己烷摩尔分数分别为0.2、0.4、0.6、0.8的乙醇溶液。 四、实验步骤 1.纯液体折光率的测定 分别测定乙醇和环己烷的折光率。 2.标准曲线的绘制 测定环己烷摩尔分数分别为0.2、0.4、0.6、0.8的乙醇溶液的折光率,绘制标准曲线。 3.测定沸点-组成数据 1)安装沸点测定仪。 2)溶液配制。 粗略配制环己烷质量百分数分别为0.05、0.1、0.2、0.45、0.55、0.6、0.7、0.8、0.9等组成的环己烷-乙醇溶液约50ml。
二元体系沸点-组成图测绘.
二元体系沸点-组成图测绘 1 实验目的及要求 1)在大气压下,测定环己烷-乙醇体系气、液平衡相图(沸点-组成图)。 2)掌握阿贝折光仪的测量原理和使用方法。 2 原理 一个完全互溶的二元体系,两个纯液体组分,在所有组成范围内完全互溶。在定压下,完全互溶的二元体系的沸点—组成图可分为三类,如图C7.1所示。 a.溶液的沸点介于两纯组分沸点之间,如苯一甲苯体系; b.溶液有最低恒沸点,如环己烷-乙醇体系; c.溶液有最高恒沸点,如丙酮—氯仿体系。 b、c两类溶液在最高或最低恒沸点时气、液两相组成相同,加热蒸发只能使气相总量增加,气、液 图C7.1 二元体系T-x图 下面以a为例,简单说明绘制沸点-组成图的原理。加热总组成为x1的溶液,体系的温度上升,达液相线上1点时溶液开始沸腾,组成为x2的气相开始生成,但气相量很少(趋于0),x1、x2二点代表达到平衡时液、气两相组成。继续加热,气相量逐渐增多,沸点继续上升,气、液二相组成分别在气相线和液相线上变化,当达某温度(如2点),并维持温度不变时,则x3、x4为该温度下液、气两相组成,气相、液相的量之比按杠杆规则确定。从相律f = c - p +2可知,当外压恒定时,在气、液两相共存区域自由度等于1,当温度一定时,则气、液两相的组成也就确定,总组成一定,由杠杆规则可知两相的量之比也已确定。因此,在一定的实验装置中,全回流的加热溶液,在总组成、总量不变时,当气相的量与液相的量之比也不变时(达气-液平衡),则体系的温度也就恒定。分别取出气、液两相的样品,分析其组成,得到该温度下,气、液两相平衡时各相的组成。改变溶液总组成,得到另一温度下,气、液两相平衡时各相的组成。测得溶液若干总组成下的气液平衡温度及气、液相组成,分别将气相点用线连接即为气相线,将液相点用线连接即为液相线,得到沸点-组成图。 气相、液相的成份分析采用折光率法:先绘出折光率~组成(n~x)的等温线,方法是在定温下测定已知各种组成(x)的折光率(n),绘出n~x等温线。对于未知组成的样品,取出各相样品后,迅速测出该温度下的折光率(n),便可以从n~x线查出其相应组成。 3 仪器与试剂 恒温槽 恒沸点仪 折光仪 镜头纸 加热电源 电热丝 导线(带夹子) 橡皮塞 温度计(0.1,50~100℃)放大镜 量筒(30ml)洗耳球 吸管 环己烷(A.R.)无水乙醇(A.R.)
实验 环己烷-乙醇双液系沸点相图..
实验四环己烷-乙醇双液系相图 一.实验目的 1.绘制在p下环已烷-乙醇双液系的气----液平衡图,了解相图和相率的基本概念。 2.掌握测定双组分液系的沸点的方法,找出恒沸点混合物的组成和最低恒沸点。 3.掌握用折光率确定二元液体组成的方法。 4.掌握阿贝折射仪的测量原理及使用方法。 二.实验原理 液体的沸点是指液体的饱和蒸汽压和外压相等时的温度。在一定外压下,纯液体的沸点有确定的值。但对于完全互溶的双液系,沸点不仅与外压有关,而且还与双液系的组成有关。 常温下,两种液态物质以任意比例相互溶解所组成的体系称为完全互溶双液系。在恒定压力下,表示溶液沸点与组成关系的相图称为沸点—组成图,即为T-x相图。完全互溶双液系的T-x图可分为三类: (1)理想双液系,溶液沸点介于两纯物质沸点之间如图(a); (2)各组分对拉乌尔定律发生正偏差,溶液具有最低恒沸点(图中最低点)如图(b); (3)各组分对拉乌尔定律发生负偏差,溶液具有最高恒沸点(图中最高点)如图(c);
绘制双液系的T-x图时,需要同时测定气液平衡时溶液的沸点及气相组成、液相组成数据。例如图(a)中,与沸点t 1 对应的气相组成 是气相线上g 1点对应的,液相组成是液相线上lgBx 1 点对应的。实验测 定整个浓度范围内不同组成溶液的气液相平衡组成和沸点后,即可绘出T-x图。 本实验采用回流冷凝的方法绘制环己烷-乙醇体系的T-x图。其方法是用Abbe折射仪测定不同组分的体系在沸点时气液两相的折光率。在折光率-组成图(标准曲线)找出未知浓度溶液的折光率,就可从曲线上查出相对应的组成 三.仪器试剂 沸点仪1套;超级恒温水浴1台;阿贝折光仪1台;移液管2支;滴管2支 环己烷(A.R.);无水乙醇(A.R.) 沸点仪
二组分溶液沸点一组成图的绘制
二组分溶液沸点一组成图的绘制 一内容提要 本实验采用回流冷凝法测定不同浓度的环己烷-乙醇溶液的沸点和气液两相的平衡浓度,绘制沸点—组成图,并从图上确定体系的最低恒沸物及其相应的组成。 二目的要求 1.掌握沸点一组成图的绘制方法。 2.掌握阿贝折光仪及超级恒温槽的使用方法。 三实验关键 1.在测定工作曲线步骤中,配制液体时要求使用移液管准确移液,从而保证绘制工作曲线的准确性。每种浓度样品其沸腾状态应尽量一致,即以气泡“连续”、“均匀”冒出为好,不要过于激烈也不要过于缓慢。 2.由于液体的折射率受温度影响很大,折射仪采和用温槽恒温,恒温水在回路中要保持循环畅通。用阿贝折光仪测液体折射率时,用滴管滴数滴液体于棱镜上,待整个镜面浸润后再进行观察。 3.蒸馏瓶中电热丝一定要被溶液浸没后方能通电加热,否则电热丝易烧断或燃烧着火。四预备知识 1.杠杆原则.当组成以物质的量分数(x)表示时,两相的物质的量反比于系统点的两个相点线段的长度。 2.在恒定压力下,实验测定一系列不同组成液体的沸腾温度及平衡时气液两相的组成,即可绘出该压力下的温度-组成图。最大正偏差系统的温度-组成图上出现最低点,在此点气相线和液相线相切,由于对应于此点组成的液相在指定压力下沸腾时产生气相与液相组成相同,故沸腾时温度恒定,且这一温度又是液态混合物的最低温度,故称之为最低恒沸点,与此类似,最大负偏差系统的温度—组成图上出现最高点,即为最高恒沸点。恒沸混合的组成取决于压力,压力一定,恒沸混合物的组成一定;压力改变,恒沸混合物的组成改变,甚至恒沸点可以消失,这证明恒沸混合物不是一种化合物。 五实验原理 在恒压下完全互溶的二组分溶液体系的沸点一组成图可分三类: 1.理想的二组分溶液,其沸点介于两组分沸点之间,如苯-甲醇体系。 2.对拉乌尔定律发生负偏差的溶液,其溶液有最高恒沸点,如丙酮—氯仿、硝酸—水体系。 3.对拉乌尔定律发生正偏差的溶液,其溶液有最低恒沸点,如苯—乙醇、乙醇—水体系。 了解二组分溶液的沸点—组成图,对两组分的分离——精馏有指导意义。 本实验采用回流冷凝法测定不同浓度的环已烷——乙醇溶液的沸点和气、液两相的组成,从而绘制T-x图。 它们表明了沸点和气、液两相组成的关系,当体系总组成x的溶液开始沸腾时,气相组成为y,继续蒸馏,则气相量增加,液相量相应减少(体系总量不变),溶液温度上升,由于回流的作用,控制了两相的量为一定,其沸点也为一定,此时气相组成为y′,与其平衡的液相组成为x′,系统的平衡沸点为t 沸,此时气液两相的量服从杠杆原理。 压力一定时,对两相共存区进行相律分析:组分K=2,相数 =2,所以自由度F=K+1-=2+1-2=1,就是说,若系统温度一定,气、液两相成分就已确定,当总量一定时由杠杆原理可知,两相的量也一定:反过来,在一定实验装置中,利用回流的方法,控制气液两相的相对量一定,使系统的温度一定,则气、液组成一定。 用精密温度计可以测出平衡温度(即沸点),取出该温度下的气液两相样品,用折射率测定可以求出其组成。因为折射率与组成有一一对应的函数关系。这可以通过测定一系列已知组成的样品的折射率,绘出工作曲线即折射率-组成图表示出来。这样,只要测定出未知样品的折射率就可以从图上找到未知样品的组成。 折射率是用阿贝折光仪测得,仪器的原理、构造及使用方法见附录“阿贝折光仪”。 本实验的工作就是测出溶液的沸点和气液相的折射率。
二组分系统气液平衡相图的绘制(含数据)
二组分系统气液平衡相图的绘制 一实验目的 1.确定不同组成的环己烷——乙醇溶液的沸点及气、液两相的平衡浓度,由此绘制其沸点组成图。 2.掌握阿贝折射仪的原理及使用方法。 二实验原理 本实验用回流冷凝法测定不同浓度的环己烷——乙醇溶液的沸点和气、液两相的组成,从而绘制T----x图。 下图为环己烷——乙醇的沸点组成图的大致形状,ADC和BEC为气相线,AD′C和BE′C 为液相线。体系总组成为x的溶液开始沸腾时,气象组成为y ,继续蒸馏,气相量增加,液相量减少(总量不变),溶液温度上升,回流作用,控制了两相的量一定,沸点一定。此时,气相组成为y′,与其平衡的液相组成为x′,体系的平衡沸点为t沸,此时气液两相服从杠杆原理。 当压力一定时,对两相共存区进行相律分析:独立组分K=2,相数P=2,则自由度f=K-P+1=2-2+1=1 即有,体系温度一定,则气液两相成分确定。总量一定时,亮相的量也一定。在一实验装置中,控制气液两相的相对量一定,使体系温度一定, 则气液组成一定。 用精密温度计可以测出平衡温度,取出气液两相样品 测定其折射率可以求出其组成。折射率和组成有一一对应 关系,可以通过测定仪系列已知组成的样品折射率,绘出 工作曲线。测出样品就可以从工作曲线上找到未知样品的 组成。 三仪器与药品 仪器:阿贝折射仪、超级恒温槽、蒸馏瓶、调压 变压器、1/10℃刻度温度计、25ml移液管一支、5ml、 10ml移液管各两支、锥形瓶四个、滴管若干支 药品:环己烷、乙醇、丙酮 四实验步骤 1.工作曲线的测定 把超级恒温槽调至25℃,连接好恒温槽与阿贝折 射仪,使恒温水流经折射仪。 准确配制下列溶液,测定纯环己烷,乙醇和下列 溶液的折射率,并测定溶液温度。 环己烷 1 2 3 4ml 乙醇 4 3 2 1ml 2.测定环己烷的沸点 按图装好仪器,调压变压器调至最小,将25ml苯加入蒸馏瓶,打开冷凝水,接通电源,
双液系沸点组成图的绘制
实验报告纸 x乙醇0 0.1 0.2 0.3 0.4 0.5 折射率n 1.4232 1.4147 1.4085 1.402 1.3952 1.3882 x乙醇0.5 0.6 0.7 0.8 0.9 1 折射率n 1.3882 1.3850 1.3791 1.3700 1.3624 1.3585 表4-1 实验数据记录表 室温:23.8℃气压:汞柱759.4mm=103278.4Pa 在20ml乙醇中加入环己烷 气相液相沸点(℃) 折射率n x乙醇折射率n x乙醇T沸点ΔT T正常 0.5 1.3606 0.9558 1.3600 0.9640 76.89 -0.1482 76.74 1 1.3750 0.7308 1.3619 0.9358 74.89 -0.1444 74.75 2 1.3860 0.5574 1.3660 0.8779 71.16 -0.1372 71.02 3 1.3927 0.4538 1.3711 0.7919 68.05 -0.1312 67.92 4 1.3940 0.4347 1.3770 0.6964 66.29 -0.1278 66.16 5 1.3940 0.4317 1.3830 0.6009 65.33 -0.1259 65.20 注:乙醇的沸点77.83℃ 表4-2 实验数据记录表 室温:23.8℃气压:汞柱759.4mm=103278.4Pa 在20ml环己烷中加入乙醇 气相液相沸点(℃) 折射率n x乙醇折射率n x乙醇T沸点ΔT T正常 0.5 1.4092 0.1956 1.4209 0.0125 71.61 -0.1380 71.47 1 1.4038 0.2801 1.4174 0.0673 65.83 -0.1269 65.70 2 1.4020 0.308 3 1.4099 0.1847 64.67 -0.1246 64.55 3 1.4011 0.322 4 1.4036 0.2833 64.59 -0.124 5 64.47 4 1.3996 0.3459 1.3956 0.408 5 64.65 -0.124 6 64.53 5 1.3982 0.3678 1.3888 0.5149 64.88 -0.1251 64.75 注:环己烷的沸点80.25℃ΔT=T沸(101325-P)/(101325*10);T正常=T沸+ΔT
二元体系沸点-组成图
二元体系沸点--组成图测绘 1 实验目的及要求 (1)在大气压下,测定环己烷-乙醇体系气、液平衡相图(沸点-组成图)。 (2)掌握阿贝折光仪的测量原理和使用方法。 2 原理 一个完全互溶的二元体系,两个纯液体组分,在所有组成范围内完全互溶。在定压下,完全互溶的二元体系的沸点组成图可以分为三类 (a)溶液的沸点介于两纯组分之间; (b)溶液由最低恒沸点; (c)溶液由最高恒沸点。
(b)(c)两类溶液在最高候着最低恒沸点时气、液两相组成相同,加热蒸发只能使气相总量增加,气、液相组成及溶液沸点保持不变,此温度称为恒沸点,相应组成称为恒沸组成。 绘制沸点组成图的原理:加热总组成为x1的溶液,体系的温度上升,达到液相线上的1点时溶液开始沸腾,组成为x2的气相开始生成,但是气相量很少,x1x2二点代表达到平衡时液、气两相组成。继续加热,气相量逐渐增加,沸点继续上升,气、液二相组成分别在气相线与液相线上变化,当达到某温度时并维持温度不变时,则x3x4为该温度下液、气两相组成,气相、液相的量按照杠杆原理确定。从相律f=c-p+2得:当外压恒定时,在气、液两相共存区域自由度为1;当温度一定是,则,气、液两相的组成也就确定,总组成一定,由杠杆规则可知两相的量之比也确定。因此,在一定的实验装置中,全回流的加热溶液,在总组成、总量不变时,当气相量与液相量之比也不变时,则体系的温度也就恒定。分别取出气、液两相的样品,分析其组成,得到该温度下气、液两相平衡时各相的组成。改变溶液总组成,得到另一温度下,气、液两相平衡时各相的组成。测得溶液若干总组成下的气液平衡温度及气、液相组成,分别将气相点用
二组分气液平衡相图的绘制
双液系气-液平衡相图的绘制 一、实验目的、要求 1. 测定常压下环己烷-乙醇二元系统的汽液平衡数据,绘制101325Pa下的沸点-组成的相图。 2. 掌握阿贝折射仪的原理和使用方法。 二、实验原理 液体混合物中各组分在同一温度下具有不同的挥发能力。因而,经过汽液见相变达到平衡后,各组分在汽、液两相中的浓度是不相同的。根据这个特点,使二元混合物在精馏塔中进行反复蒸馏,就可分离得到各纯组分。为了得到预期的分离效果,设计精馏装置必须掌握精确的汽液平衡数据,也就是平衡时的汽、液两相的组成与温度、压力见的依赖关系。大量工业上重要的系统的平衡数据,很难由理论计算,必须由实验直接测定,即在恒压(或恒温)下测定平衡的蒸汽与液体的各组分。其中,恒压数据应用更广,测定方法也较简便。 本实验测定的恒压下环己烷-乙醇二元汽液平衡相图。图中横坐标表示二元系的组成(以B的摩尔分数表示),纵坐标为温度。用不同组成的溶液进行测定,可得一系列数据,据此画出一张由液相线与汽相线组成的完整相图。 分析汽液两相组成的方法很多,有化学方法和物理方法。本实验用阿贝折射仪测定溶液的折射率以确定其组成。预先测定一定温度下一系列已知组成的溶液的折射率,得到折射率-组成对照表。以后即可根据待测溶液的折射率,由此表确定其组成。 三、使用仪器、材料 沸点仪1套,阿贝折射仪,移液管,环己烷,无水乙醇 四、实验步骤 1、测定折射率与组成的关系,绘制工作曲线 将9支小试管编号,依次移入0.1 ml, 0.2 ml, …, 0.9 ml的环己烷,然后依次移入0.9 ml, 0.8 ml,…, 0.1 ml的无水乙醇,配成9份已知浓度的溶液,用阿贝折射仪测定每份溶液的折射率及纯环己烷和纯无水乙醇的折射率,以折射率对浓度作图。 2、测定环己烷-乙醇体系的沸点与组成的关系 (1) 右半部沸点-组成关系的测定取20 ml无水乙醇加入沸点仪中,然后依次加入环己烷0.5, 1.0, 1.5, 2.0, 4.0, 14.0 ml,测定溶液沸点,及气、液组分折射率n。完成后,将溶液倒入回收瓶。 (2) 左半部沸点-组成关系的测定取25 ml环己烷加入沸点仪中,然后依次加入无水乙醇0.1, 0.2, 0.3, 0.4, 1.0, 5.0 ml,测定溶液沸点,及气、液组分折射率n。完成后,将溶液倒入回收瓶。 五、实验过程原始记录(数据、图表、计算等) 标准曲线 V环己烷(ml) V乙醇(ml) xEtOH x环己烷折射率 0 1 1 0 1.3631 0.1 0.9 0.9437 0.0563 1.3710 0.2 0.8 0.8817 0.1183 1.3735 0.3 0.7 0.813 0.187 1.3814 0.4 0.6 0.7365 0.2635 1.3849
物化实验——双液系沸点-组成图的绘制
实验五双液系沸点-组成图的绘制 一、实验目的 1. 测定100 kPa下乙醇一乙酸乙酯体系的气液平衡相图。 2. 使用数字阿贝折射仪测定液体、气体的组成。 一、基本原理 从完全互溶双液系的t-x图中可清楚地看到系统在达到沸腾时的温度,以及达到气液平衡时气、液两相的组成。t-x图对于了解系统的行为,系统的分馏过程很有实用价值。 理想的双液系在全部组成范围内符合拉乌尔定律,有少数系统能近似符合理想溶液的行为,但大多数系统在p-x图中有正或负的偏差。本实验采用的系统是对拉乌尔定律产生正偏差的系统。 在一定压力下完全互溶双液系的沸点与组成的关系有三种情况: 1. 溶液沸点介于二纯组分的沸点之间,如正丙醇一乙醇、苯一甲苯。 2. 溶液具有最高恒沸点如氯化氢一水、硝酸一水。 3. 溶液具有最低恒沸点如苯一乙醇、乙醇一水、乙醇一乙酸乙酯。 上述情况的t-x图如图5-1所示。 从相律分析,对于双液系,当压力恒定时,在气液相平衡共存区域内,自由度等于1(F = C–P + 1 = 2–2 + 1 = 1),当温度一定,气液二相的组成也一定。反之,溶液的组成一定,气液平衡时系统温度恒定。将某组成的双液系置于沸点仪中,加热至沸腾,在气液两相达平衡,测定其沸点为t1,同时测定达到平衡时的气相组成和液相组成分别为y1和x1(如图5-1左)。若换一种x B稍小的物系,加热蒸馏达到新的平衡,沸点t2对应气相组成和液相组成为y1’、x1’。 待二相平衡以后,取出二相样品,用物理方法或化学的方法分析二相的组成,在t-x图中画出该温度下二相平衡时各相组成的坐标点(可用·表示气相点,用×表示液相点)。不断改变系统的组成,再按上法测出一对对坐标点。分别将气相点和液相点连成气相线和液相线,就得到完全互溶双液系的t-x相图。 仪器装置如图5-2所示;整个装置分为加热部分与冷凝部分,加热部分由电热丝和电源组成(220 V电压变至0 V~15 V,视需要而定)。蒸汽在支管B中冷凝。冷凝液一部分回流入沸点仪,一部分存于小槽D室中,温度计由热电偶构成浸入液面。液体样品自A处吸出,气相冷凝液自B管底部小D室中吸出。
二组分气液平衡相图
实验三二组份气液平衡相图 一、目的 1、用沸点仪测定和绘制乙醇和环己烷的二组份气液平衡相图; 2、用阿贝折射仪测定液体的组成,了解液体折射率的测量原理及方法。 二、基本原理 两种液态物质混合而成的二组份系统称为双液系。二液体若能按任意比例互相溶解,称完全互溶双液系;若只能在一定比例范围内互相溶解,则称部分互溶双液系。例如水-乙醇双液系、苯-甲苯双液系都是完全互溶双液系,苯-水双液系则是部分互溶双液系。 液体的沸点是指液体的蒸汽压和外压相等时的温度。在一定的外压下,纯液体的沸点有确定的值,但对于双液系,沸点不仅与外压有关,而且还与双液系的组成有关,即和双液系中两种液体的相对含量有关。通常用几何作图的方法将双液系的沸点对其气相、液相的组成作图,即得二组份气液平衡相图,它表明溶液在各种沸点的液相组成和与之成平衡的气相组成的关系。 在恒压下,二组份完全互溶双液系的沸点组成图可分为三类: (1)溶液的沸点介于两纯组份沸点之间,如苯和甲苯、水和甲醇等。
(2)溶液有最高沸点,如氯化氢与水、硝酸和水、丙酮与氯仿等。 (3)溶液有最低沸点,如水和乙醇、苯和乙醇、乙醇和环已烷等。 这三种类型的相图如下图所示 图4-1 二组份气液平衡相图的三种类型 图中、T 分别表示纯A 纯B 的沸点。图中两曲线包围的区域为气-液两相平衡共存区。它的上方G 代表气相区,下方L 为液相区。C 和C'分别表示最高和最低恒沸物的沸点和组成。 T A *B * 测绘这类相图时,要求同时测定溶液的沸点及气液平衡时两相的组成。本实验用回流冷凝法测定环己烷-乙醇溶液在不同组成时的沸点。所用沸点仪如图4-2所示,是一只带有回流冷凝管的长颈园底烧瓶,冷凝管底部有一球形小室D ,用以收集冷凝下来的气相样品,液相样品则通过烧瓶上的支管L 抽取,图中E
二组分溶液沸点—组成图的绘制实验报告
实验名称: 二组分溶液沸点——组成图的绘制 班级:09级应化一班 学号:200914120120 报告人:裴哲民 同组人:匡江梅,李琪瑶,潘齐常,陈斌,梁细莲 实验时间:2011年9月16日 辅导老师:李传华 一.实验目的 1.测定常压下环己烷-乙醇二元系统的气液平衡数据,绘制沸点-组成相图。 2.掌握双组分沸点的测定方法,通过实验进一步理解分馏原理。 3.掌握阿贝折射仪的使用方法。 二. 基本原理 在一定的外压下,纯液体的沸点是恒定的,但对于完全互溶双液系,沸点不仅与外压有关,而且还与其组成有关,并且在沸点时,平衡的气-液两相组成往往不同。根据相律:F=C-P+2,一个气液共存的二组分体系,其自由度为2,只需再任意确定一个变量,其自由度就减为1,整个体系的存在状态就可以用二维图来描述。本实验中采用在一定压力下,作出体系的温度T 和组分x 的关系图,即T-x 图。 完全互溶体系的T-x 图可分为三类:①液体与Raoult 定律的偏差不大,在T-x 图上,溶液的沸点介于两种纯液体的沸点之间(图 1.a ),如苯-甲苯系统;②由于两组分的相互作用,溶液与Raoult 定律有较大的负偏差,在T-x 图上存在最高沸点(图1.c ),如卤化氢-水系统;③ 溶液与Raoult 定律有较大的正偏差,在T-x 图上存在最低沸点(图1.b ),如乙醇-水系统。②和③类溶液,在最高或最低沸点时的气-液两相组成相同,这些点称为恒沸点,此浓度的溶液称为恒沸点混合物,相应的温度称为恒沸温度,相应的组成称为恒沸组成。 本实验所要测绘的环己烷-乙醇体系即属于第二类溶液。对于一个组成恒定的封闭系 t/℃ t/℃ t/℃ A A A B B B x B (a) x B (b) 气 气 气 液 液 液 x B (c)
二组分系统相图
宁波工程学院 物理化学实验报告 专业班级姓名实验日期 同组姓名指导老师序号 实验名称二组分系统气液平衡温度—组成图的绘制 一、实验目的 1、测定在常压下环己烷-乙醇系统的气液平衡数据,绘制系统的沸点-组成图; 2、确定系统的恒沸温度及恒沸混合物组成; 3、了解阿贝折射仪的测量原理,掌握阿贝折射仪的使用方法。 二、实验原理 实验采用沸点仪装置,用沸点仪直接测定一系列不同组成液态混合物的气液平衡温度,并收集少量馏出物和馏出液,分别用阿贝折光仪测定折射率。利用环己烷(B)-乙醇(A)二组分系统的折光率-组分工作曲线,查出对应于样品折射率的组成。 图一、具有最低恒沸点的T-x图 三、实验仪器、试剂 仪器:沸点仪一套,NTY-2A型数字温度计一套,YP-2B精密稳流电源一套,阿贝折射仪一套,HK-1D型恒温火槽一套。 试剂:无水乙醇(A.R)、环己烷(A.R)、不同组成环己烷-乙醇混合物。
实验装置图如下: 四、实验步骤 1、开启恒温水槽,设定水温为30℃,供阿贝折射仪使用; 2、加入试剂,盖好加料口塞子,使电热丝及温度传感器浸入液体中; 3、开冷凝水,温度传感器连接NTY-2A型数字式温度计,加热丝连接YP-2B精密稳 流电源。调节稳流电源电流,加热至沸腾。液体沸腾后,蒸气逸出,经冷凝后流入球形小室。最初在冷凝管下端球形小室的液体不能代表平衡时气相组成,为加速达到平衡可将球形小室内最初冷凝的液体倾回沸点仪内,反复2-3次,待温度读数恒定后记下沸点并停止加热; 4、同法完成1、2、3、4、 5、 6、 7、8,乙醇以及纯环己烷实验。 5、实验结束,关闭电源及水源。 五、数据记录与处理 室温:℃大气压:KPa
二组分完全互溶系统的气液平衡相图
二组分完全互溶系统的气——液平衡相图 周韬 摘要:测定了乙醇--环己烷完全互溶系统的气--液平衡相图。在相图上,以环己烷占互溶系统的摩尔含量作为横坐标,以混合物的沸点为纵坐标,分别从分析纯的乙醇出发和分析纯的环己烷出发,制作出完整的混合溶液相图。实验中通过控制压力相等的条件测定相图需要的各项数据,混合物溶液各组分的含量利用折光率不同来确定。实验结果与理论值能够很好的符合。 关键词:相律;折射率;沸点。 1 前言 许新华,王晓岗,刘梅川等人的“双液系气液平衡相图实验的新方法研究” ① 中讨论了自制工作曲线和引用文献数据的优良,由于实验环境等因素的影响,文献值之间也会有差别,所以文献数据并不能很好地反映真实情况,而自制工作曲线由于溶液配制时会挥发,准确浓度的溶液配制又有难度。 另一方面气相测折光率确定组分是,由于气相冷凝液非常少,难以进行平行测定,偶然误差比较大。他们在文献中提到的解决办法是,用气相色谱法是进行微量样品分析。借鉴气相色谱实验定量配制混合样品的方法,比较精确地配制出乙醇-环己烷标准组成溶液。对最后得出的实验数据用Origin 处理得到如下的工作曲线(图1): 进行实验时,由于器材和时间的限制,我们采用直接引用文献数据和测定折光率的方式。最后的数据进行温度校正之后作图,得到的工作曲线依然可以很好地和文献相吻合。 2实验部分 2.1原理 两种液态物质若能以任意比例混合,则称为二组分完全互溶混合物系统。当其蒸气压与外压相当时,溶液就会沸腾,此时的温度称为沸点,沸腾的溶液也产 图1文献的工作曲线
生了气相和液相两种相数。 在一定压力下,二组分完全互溶混合物系统的沸点可能有三种情况:①混合物的沸点介于两种纯液体的沸点之间,这种混合物,气液两项的组成不同,可以通过精馏使系统的两个组分完全分离开;②混合物有沸点极大值;③混合物有沸点极小值。②、③两种由于实际系统严重偏离了拉乌尔定律,②项负偏差很大,在相图上有沸点极大值,③项的正偏差很大,会产生沸点极小值,后面两种混合物情况,难以用精馏的方式将两种液体分离开②。 相律,是研究相平衡的基本规律,表示平衡物系中的自由度数,相数及独立组分数之间的关系。其最普遍的表达式为f=N?R?R’?P+2=C?P+2。N、P分别表示描述体系的物种数和相数。f 为自由度数, 即保持体系相数及相态不变的情况下, 体系可以独立改变的强度变量数。C 为组分数, 即可以表达平衡体系所有相的最小物种个数③~④。 相图是用来表示材料相的状态和温度及成分关系的综合图形,其所表示的相的状态是平衡状态。为了确定二组分完全互溶混合物系统的相图,根据上面相律所述,控制溶液的压力,测定在一定要下的沸点和组成,作T(温度)—x(组成)图像。在确定相图之后,对于确定该两种液体的混合物,通过测定沸点可以查看其组成,也可测定其组成了解其在一定温度下的相态。 本实验中,在常压下测定物质的沸点,通过折光率来确定混合物气相和液相的组成,即可以作出完整相图。 折光率定义:n =c1/c2,其中c表示在不同介质里的光速。物质的折光率因温度或光线波长的不同而改变,透光物质的温度升高,折光率变小;光线的波长越短,折光率越大。作为液体物质纯度的标准,折光率比沸点更为可靠。在蒸馏两种或两种以上的液体混合物且当各组分的沸点彼此接近时,那么就可利用折光率来确定馏分的组成。因为当组分的结构相似和极性,混合物的折光率和物质的量组成之间常呈线性关。 2.2实验方法 2.2.1主要仪器及药品 仪器沸点仪;WAY-2S数字阿贝折光仪;超级恒温槽;调压变压器;温度计(50~100℃,1/10℃)1支;普通温度计(0~100℃)1支;250mL烧杯1只;10mL
实验十一_二组分沸点组成相图的制作
实 验 报 告 一、 数据记录和处理 1.数据记录表 T 室温= 23.4℃ 表1 室温时正丙醇-乙醇溶液的组成与折射率的对应关系数据记录表 始P = 102.7kpa 末P = 102.7kpa 表2 正丙醇-乙醇溶液沸点-组成相图各数据记录表 2. 室温时绘制正丙醇—乙醇溶液组成与其折射率标准曲线 表3 室温时正丙醇-乙醇溶液的组成与折射率的对应关系表
表3数据的计算示例: 查附表9-8表计算得到: ρ0.8013 = 正丙醇 ρ0.7865 = 乙醇 再求正丙醇-乙醇溶液中正丙醇的物质的量分数浓度X正丙醇。 由表3数据绘制标准曲线: . . 图1 正丙醇物质的量分数与折射率的标准曲线
3. 常压下正丙醇-乙醇体系的沸点-组成相图的测绘 表4 正丙醇-乙醇溶液沸点-组成相图各数据处理表 由表4数据绘制相图: 图2 正丙醇-乙醇体系的沸点-组成相图
二、回答问题 1.本实验如何判断气、液两相达到平衡?用相律加以说明。如果取样口或空气口 塞子漏气,会有什么现象?为什么? 2.折射率-组成标准曲线的测定误差可能来自哪些方面?应采取哪些措施来减小误 差? 3.实验中超级恒温槽的作用?能否换成普通恒温槽? 4.气液平衡后,气相和液相在平衡仪内的温度不同,某同学认为这样测量出的气、 液相折射率会存在误差,这种说法是否正确?为什么? 5.本实验中气液平衡仪及毛细管为什么必须干燥?本实验测得的沸点-组成相图的 误差主要来源是那些操作? 6.本实验中Ⅰ-Ⅹ号溶液的浓度应如何选择?若某一号溶液的浓度发生不大的变化, 对实验测得的相图有无影响? 7.影响纯物质沸点的因素有哪些?影响混合液沸点的因素有哪些?加入平衡仪 内液体的量的多少对沸点有影响吗?
双液系的气—液平衡相图预习思考题
实验五双液系的气—液平衡相图预习思考题 一、思考题: 1.作乙醇—正丙醇标准液的折光率—组成曲线的目的是什么? 答:求平衡体系的两相组成,组分与沸点之间的关系。 2.如何判断已达气液平衡? 答:温度计读数不再变化。 3.测定一定沸点下的气液相折光率时为什么要将待测液冷却? 答:因为折射率与被测物的温度有关。阿贝折光仪测折光率时,温度是恒定在30°C,故冷却待测液。 4.本实验加入沸石的目的是什么? 答:避免局部过热,防止爆沸。 5.乙醇—正丙醇的折光率—组成工作曲线为一直线,两点即可定一线,本实验为何还要进 行多点测定? 答:进行多点测定可减少偶然误差。 6.简述本实验是如何测定双液系的气—液平衡相图的? 答:先测出其标准溶液的折光率-组分曲线,再根据折光率计算出组分,便能得出气液平衡相图。 7.本实验在测定双液系的沸点和组成时,每次加入沸点仪中的两种液体是否应按记录表规 定精确计量?为什么? 答:否。因为双液系的沸点和组分成曲线关系的,不因组分的改变而改变,可以根据折射率得到其组分。 8.我们测得的沸点和标准大气压下的沸点是否一致?为什么? 答:不一致。因为通常外界压力并不恰好等于标准压力。 9.简述用阿贝折光仪测定液体折光率的步骤。 答:P37. 10.双液系的沸点—组成图分为哪几类?本实验属于哪一类? 答:(1)混合液的沸点介于A,B二纯组分沸点之间;(2)有最低恒沸点体系;(3)有最高恒沸点体系。属于第一类
二、操作题: 1. 如何进行打开冷凝水至适当位置操作?为什么? 答: 2. 如何进行沸点仪在开始加热和温度接近沸点时的操作? 3. 如何进行测定沸点后蒸馏瓶水浴冷却操作? 答:用塑料盆盛自来水,冷却至温度计读数与超级恒温槽接近为止。 4. 如何进行沸点仪气、液相取样操作? 答:气相取样:打开气态冷凝液磨口塞,用弯钩滴管吸出气相收集小液体球;液相取样:用直的滴管吸取部分液相样品。 5. 折光仪在加样时应注意什么?如何操作? 答: 6. 如何进行折光仪加样后的调节操作? 答: 7. 如何进行折光仪读数操作? 答:左目镜读数。 8. 如何进行折光仪测定前上下棱镜的乙醇清洗操作?为何要清洗? 答:用待测液察洗上下棱镜,水平滴加让待测液平辅在棱镜上。 9. 为何要进行温度露颈校正?如何校正? 答:根据其控制温度的差异,调节调节器,顺时针调高,逆时针调低,反复进行,直至温度为希望温度值,固定螺丝。 10. 如何设定超级恒温槽温度为30℃(实控温度)? 答:调节调节器使指示温度比30°C低2-3°C,如槽中温度不低于30°C,则根据差值调节调节器,使槽中温度显示为30°C。 11.本实验中超级恒温槽的作用是什么? 答:保证折光仪测光率时被测物温度恒定。 如有侵权请联系告知删除,感谢你们的配合!
实验六双液系沸点-组成图的绘制预习及实验报告书写要点
董 超 编 写 实验六 双液系沸点-组成图的绘制 【重要提示】 环己烷-异丙醇溶液的浓度调整为: 序号 1 2 3 4 5 6 %V 异丙醇 10% 20% 35% 50% 70% 85% 一、实验原理部分书写要点 1.二组分气-液平衡相图的概况及其特征(简单概括....); 2.本实验所涉及双液系的特点; 3.本实验绘制相图所使用的实验方法。 【注】:实验原理部分如果较长,可附页书写; 物理化学实验教材另需预习内容:(1) Excel 常用函数 ④ round P 13 (2) 金属电阻温度计 P 131 物理化学理论课相关内容:① §6.1 相律 P 228 ② §6.4 二组分真实液态混合物的气-液平衡相图 2.温度-组成图 P 244 二、实验原始数据记录 室温:______________ 大气压:______________ 气相折光率g D n 及其测定温度T ∕℃ 液相折光率l D n 及其测定温度T ∕℃ 1 2 3 1 2 3 溶液 序号 T b ∕℃ g D n T g D n T g D n T l D n T l D n T l D n T 1 2 ... ... ... ... ... ... ... ... ... ... ... ... ... (6)
董 超 三、实验数据处理要求 1.计算气、液相折光率测定值的平均值,并根据环己烷-异丙醇双液系的温度系数 41410D dn dt ??=?×℃进行温度校正; 2.用Excel 软件对教材P 48的环己烷-异丙醇双液系的D x n ?异丙醇数据进行二次多项式拟合,建立()D x f n =异丙醇的拟合方程; 3.由()D x f n =异丙醇的拟合方程根据经过温度校正的折光率计算气、液相的平衡组成; 4.绘制环己烷-异丙醇双液系的沸点组成图; 5.根据相图确定恒沸点的相关数据:,b T 恒、x 异丙醇, 恒 ,并作误差分析。 四、实验数据处理部分书写参考格式 1.环己烷-异丙醇双液系的()D x f n =异丙醇拟合方程为:______(填入拟合方程表达式)_____ 2.折光率温度校正及气、液相平衡组成计算 环己烷-异丙醇双液系的温度系数 41410D dn dt ??=?×℃
