碳青霉烯类与其他抗菌药物联合对鲍曼不动杆菌的协同效应

International Journal of Antimicrobial Agents36 (2010) 243–246
Contents lists available at ScienceDirect
International Journal of Antimicrobial Agents
j o u r n a l h o m e p a g e:h t t p://w w w.e l s e v i e r.c o m/l o c a t e/i j a n t i m i c a g
Short communication
Synergistic activities between carbapenems and other antimicrobial agents against Acinetobacter baumannii including multidrug-resistant and extensively drug-resistant isolates
Pattarachai Kiratisin a,?,Anucha Apisarnthanarak b,Srirumpa Kaewdaeng a
a Department of Microbiology,Faculty of Medicine Siriraj Hospital,Mahidol University,2Prannok Road,Bangkok-Noi,Bangkok10700,Thailand
b Division of Infectious Diseases,Faculty of Medicine,Thammasat University Hospital,Pratumthani12120,Thailand
a r t i c l e i n f o
Article history:
Received19February2010
Accepted29April2010
Keywords:
Carbapenems
Combination therapy
Synergy
Acinetobacter baumannii
a b s t r a c t
Treatment options for multidrug-resistant(MDR)and extensively drug-resistant(XDR)Acinetobacter bau-
mannii have been seriously limited and may require combination antimicrobial therapy.In this study,
we searched for synergistic activity between carbapenems(doripenem,imipenem and meropenem)and
various non-traditional agents(cefoperazone/sulbactam,doxycycline,rifampicin,netilmicin and moxi-
?oxacin)against40A.baumannii clinical isolates,including MDR and XDR isolates.The results showed
that combination of each carbapenem with cefoperazone/sulbactam,based on the Etest method,demon-
strated synergy more frequently(17.5–32.5%)than the other tested agents,which may suggest a role in
combination therapy against highly resistant A.baumannii.
? 2010 Elsevier B.V. and the International Society of Chemotherapy. All rights reserved.
1.Introduction
Multidrug-resistant(MDR)and extensively drug-resistant
(XDR)Acinetobacter baumannii have become a serious widespread
threat for nosocomial infections,which often result in higher mor-
tality[1].The prevalence of MDR and XDR A.baumannii,including
carbapenem-resistant A.baumannii,has been increasing in several
regions including Asia-Paci?c[2].Empirical combination therapy
is a common practice in areas where highly resistant A.bauman-
nii is endemic in order to achieve a possible synergistic effect
or at least to reduce selective pressure for the emergence of a
resistant phenotype[3].Although colistin,a polymyxin E,has
been shown to be effective against this resistant bacterium,its
toxicity is recognisable whilst little is known regarding its phar-
macokinetics/pharmacodynamics to achieve the optimal dosage.
As an alternative to colistin therapy,a few in vitro studies demon-
strated that carbapenems could be candidates for combination
therapy,such as imipenem plus tigecycline[4],meropenem plus
cipro?oxacin[5],and meropenem plus sulbactam[6].However,
there are very little data regarding doripenem,a newer car-
bapenem,with respect to its use alone or in combination against
A.baumannii.In this study,we evaluated the role of carbapen-
ems,including doripenem,imipenem and meropenem,when used
in combination with an antimicrobial agent of different classes
?Corresponding author.Tel.:+6624197058;fax:+6624113106.
E-mail address:sipkr@mahidol.ac.th(P.Kiratisin).
(cefoperazone/sulbactam,doxycycline,rifampicin,netilmicin and
moxi?oxacin)against A.baumannii,including MDR and XDR iso-
lates,recovered from patients in Thailand.These agents were
selected based on their potential use,including in combination
therapy,for the treatment of infection due to A.baumannii[7–9].
Synergistic activity was determined based on the Etest,a less
laborious and time-consuming method used practically in clinical
laboratories[10].
2.Materials and methods
Forty non-duplicate A.baumannii isolates recovered from vari-
ous clinical specimens at Siriraj Hospital,a2400-bed tertiary-care
university hospital in Bangkok(Thailand),during January and
June2009were randomly selected for this study.All isolates
were cultivated and identi?ed according to standard microbio-
logical procedures.MDR and XDR phenotypes were de?ned as
isolates resistant to at least three different antimicrobial classes or
resistant to all but one or two antimicrobial agents,respectively
[11].Susceptibility testing was performed by the disk diffusion
method according to Clinical and Laboratory Standards Institute
(CLSI)recommendations[12].Minimal inhibitory concentrations
(MICs)of each agent used in the combination study(doripenem,
imipenem,meropenem,cefoperazone/sulbactam,doxycycline,
rifampicin,netilmicin and moxi?oxacin)were determined by Etest
(AB BIODISK,Solna,Sweden)and were interpreted based on CLSI
breakpoints.No CLSI breakpoint was available for doripenem,thus
a breakpoint of1mg/L was adopted according to the US Food and
0924-8579/$–see front matter? 2010 Elsevier B.V. and the International Society of Chemotherapy. All rights reserved.
doi:10.1016/j.ijantimicag.2010.04.011
244P.Kiratisin et al./International Journal of Antimicrobial Agents36 (2010) 243–246
Table1
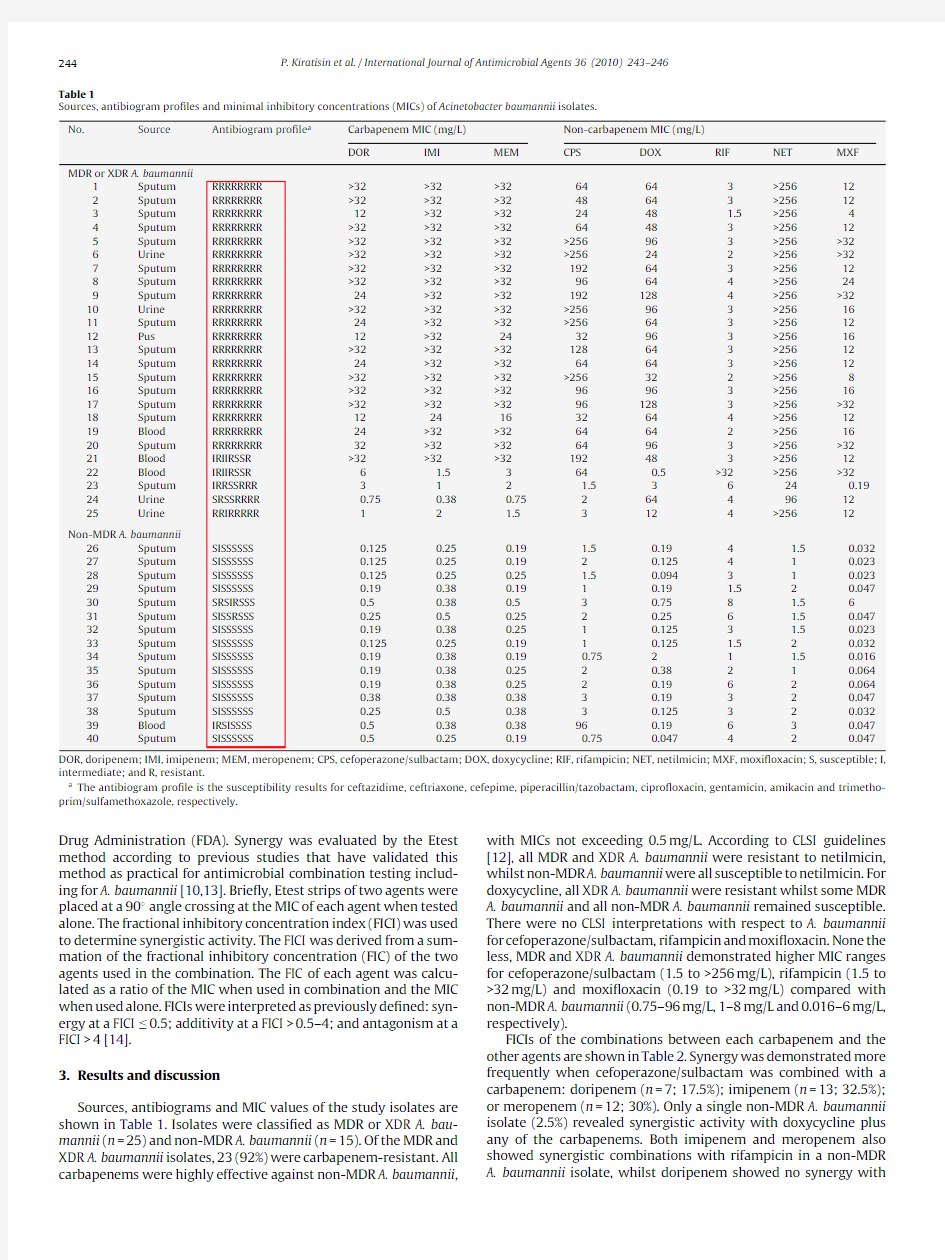
Sources,antibiogram pro?les and minimal inhibitory concentrations(MICs)of Acinetobacter baumannii isolates.
No.Source Antibiogram pro?le a Carbapenem MIC(mg/L)Non-carbapenem MIC(mg/L)
DOR IMI MEM CPS DOX RIF NET MXF
MDR or XDR A.baumannii
1Sputum RRRRRRRR>32>32>3264643>25612 2Sputum RRRRRRRR>32>32>3248643>25612 3Sputum RRRRRRRR12>32>322448 1.5>2564 4Sputum RRRRRRRR>32>32>3264483>25612 5Sputum RRRRRRRR>32>32>32>256963>256>32 6Urine RRRRRRRR>32>32>32>256242>256>32 7Sputum RRRRRRRR>32>32>32192643>25612 8Sputum RRRRRRRR>32>32>3296644>25624 9Sputum RRRRRRRR24>32>321921284>256>32 10Urine RRRRRRRR>32>32>32>256963>25616 11Sputum RRRRRRRR24>32>32>256643>25612 12Pus RRRRRRRR12>322432963>25616 13Sputum RRRRRRRR>32>32>32128643>25612 14Sputum RRRRRRRR24>32>3264643>25612 15Sputum RRRRRRRR>32>32>32>256322>2568 16Sputum RRRRRRRR>32>32>3296963>25616 17Sputum RRRRRRRR>32>32>32961283>256>32 18Sputum RRRRRRRR12241632644>25612 19Blood RRRRRRRR24>32>3264642>25616 20Sputum RRRRRRRR32>32>3264963>256>32 21Blood IRIIRSSR>32>32>32192483>25612 22Blood IRIIRSSR6 1.53640.5>32>256>32 23Sputum IRRSSRRR312 1.536240.19 24Urine SRSSRRRR0.750.380.7526449612 25Urine RRIRRRRR12 1.53124>25612
Non-MDR A.baumannii
26Sputum SISSSSSS0.1250.250.19 1.50.194 1.50.032 27Sputum SISSSSSS0.1250.250.1920.125410.023 28Sputum SISSSSSS0.1250.250.25 1.50.094310.023 29Sputum SISSSSSS0.190.380.1910.19 1.520.047 30Sputum SRSIRSSS0.50.380.530.758 1.56 31Sputum SISSRSSS0.250.50.2520.256 1.50.047 32Sputum SISSSSSS0.190.380.2510.1253 1.50.023 33Sputum SISSSSSS0.1250.250.1910.125 1.520.032 34Sputum SISSSSSS0.190.380.190.7521 1.50.016 35Sputum SISSSSSS0.190.380.2520.38210.064 36Sputum SISSSSSS0.190.380.2520.19620.064 37Sputum SISSSSSS0.380.380.3830.19320.047 38Sputum SISSSSSS0.250.50.3830.125320.032 39Blood IRSISSSS0.50.380.38960.19630.047 40Sputum SISSSSSS0.50.250.190.750.047420.047
DOR,doripenem;IMI,imipenem;MEM,meropenem;CPS,cefoperazone/sulbactam;DOX,doxycycline;RIF,rifampicin;NET,netilmicin;MXF,moxi?oxacin;S,susceptible;I, intermediate;and R,resistant.
a The antibiogram pro?le is the susceptibility results for ceftazidime,ceftriaxone,cefepime,piperacillin/tazobactam,cipro?oxacin,gentamicin,amikacin and trimetho-prim/sulfamethoxazole,respectively.
Drug Administration(FDA).Synergy was evaluated by the Etest method according to previous studies that have validated this method as practical for antimicrobial combination testing includ-ing for A.baumannii[10,13].Brie?y,Etest strips of two agents were placed at a90?angle crossing at the MIC of each agent when tested alone.The fractional inhibitory concentration index(FICI)was used to determine synergistic activity.The FICI was derived from a sum-mation of the fractional inhibitory concentration(FIC)of the two agents used in the combination.The FIC of each agent was calcu-lated as a ratio of the MIC when used in combination and the MIC when used alone.FICIs were interpreted as previously de?ned:syn-ergy at a FICI≤0.5;additivity at a FICI>0.5–4;and antagonism at a FICI>4[14].
3.Results and discussion
Sources,antibiograms and MIC values of the study isolates are shown in Table1.Isolates were classi?ed as MDR or XDR A.bau-mannii(n=25)and non-MDR A.baumannii(n=15).Of the MDR and XDR A.baumannii isolates,23(92%)were carbapenem-resistant.All carbapenems were highly effective against non-MDR A.baumannii,with MICs not exceeding0.5mg/L.According to CLSI guidelines [12],all MDR and XDR A.baumannii were resistant to netilmicin, whilst non-MDR A.baumannii were all susceptible to netilmicin.For doxycycline,all XDR A.baumannii were resistant whilst some MDR A.baumannii and all non-MDR A.baumannii remained susceptible. There were no CLSI interpretations with respect to A.baumannii for cefoperazone/sulbactam,rifampicin and moxi?oxacin.None the less,MDR and XDR A.baumannii demonstrated higher MIC ranges for cefoperazone/sulbactam(1.5to>256mg/L),rifampicin(1.5to >32mg/L)and moxi?oxacin(0.19to>32mg/L)compared with non-MDR A.baumannii(0.75–96mg/L,1–8mg/L and0.016–6mg/L, respectively).
FICIs of the combinations between each carbapenem and the other agents are shown in Table2.Synergy was demonstrated more frequently when cefoperazone/sulbactam was combined with a carbapenem:doripenem(n=7;17.5%);imipenem(n=13;32.5%); or meropenem(n=12;30%).Only a single non-MDR A.baumannii isolate(2.5%)revealed synergistic activity with doxycycline plus any of the carbapenems.Both imipenem and meropenem also showed synergistic combinations with rifampicin in a non-MDR A.baumannii isolate,whilst doripenem showed no synergy with
P.Kiratisin et al./International Journal of Antimicrobial Agents36 (2010) 243–246245
Table2
Fractional inhibitory concentration indices(FICIs)of various carbapenem combinations a.
No.DOR combination with:IMI combination with:MEM combination with:
CPS DOX RIF NET MXF CPS DOX RIF NET MXF CPS DOX RIF NET MXF
MDR or XDR Acinetobacter baumannii
10.690.94 1.04 1.00 1.380.75 1.50 1.50 1.00 1.500.75 1.38 1.50 1.00 1.50
20.92 1.00 1.500.88 1.500.75 1.50 1.50 1.00 1.500.75 1.13 1.50 1.00 1.50
3 1.33 1.0
4 2.00 1.50 2.00 1.04 1.13 1.50 1.00 1.500.7
5 1.00 1.50 1.00 1.50
4 1.13 1.50 1.500.88 1.50 1.13 1.50 1.50 1.00 1.50 1.13 1.50 1.50 1.00 1.50
50.63 1.50 1.500.69 1.000.63 1.50 1.50 1.00 1.000.38 1.50 1.50 1.000.63
60.310.88 1.13 1.00 1.000.19 1.04 1.130.750.750.25 1.25 1.130.750.75
70.710.88 1.50 1.00 1.500.75 1.50 1.50 1.00 1.500.44 1.50 1.50 1.00 1.50
80.850.88 1.00 1.00 1.50 1.04 1.50 1.13 1.00 1.500.880.88 1.50 1.00 1.17
90.40 1.50 1.42 1.50 1.500.44 1.13 1.13 1.00 1.000.44 1.50 1.13 1.00 1.00 100.63 1.04 1.50 1.00 1.500.50 1.50 1.50 1.00 1.500.50 1.50 1.50 1.00 1.50 110.63 1.50 2.00 1.50 2.000.38 1.13 1.50 1.00 1.500.38 1.00 1.040.75 1.25 12 1.42 2.00 2.00 1.50 2.000.440.75 1.040.75 1.250.71 1.00 1.670.88 1.42 130.75 1.00 1.50 1.00 1.500.440.88 1.170.75 1.500.44 1.00 1.500.75 1.50 140.50 1.75 1.75 1.00 1.750.75 1.13 1.50 1.00 1.500.75 1.00 1.170.75 1.50 150.44 1.00 1.50 1.00 1.500.22 1.13 1.50 1.00 1.500.310.75 1.25 1.00 1.13 160.88 1.500.88 1.00 1.500.42 1.50 1.04 1.00 1.500.44 1.04 1.040.75 1.50
17 1.38 1.00 1.50 1.000.630.75 1.50 1.50 1.00 1.000.75 1.00 1.04 1.00 1.00
18 1.25 1.17 1.17 1.50 1.670.71 2.00 1.42 1.50 2.00 1.00 1.50 1.50 1.50 2.00
19 1.17 1.42 2.00 1.50 2.00 1.13 1.50 1.50 1.00 1.250.75 1.13 1.50 1.00 1.50
20 1.25 1.75 1.42 1.50 1.500.690.88 1.50 1.000.420.69 1.04 1.50 1.00 1.00 210.69 1.38 1.04 1.00 1.500.44 1.50 1.25 1.00 1.500.38 1.38 1.04 1.00 1.50 220.25 1.430.880.75 1.040.22 1.76 1.04 1.38 1.500.22 1.170.75 1.04 1.04 23 1.000.830.830.500.670.88 1.00 1.25 1.25 1.410.88 1.00 1.420.71 1.41 240.88 1.42 1.420.42 1.01 1.00 1.16 1.160.45 1.67 1.42 2.00 1.750.76 1.33 25 1.00 2.00 1.50 1.50 2.000.880.83 1.50 1.50 2.00 1.00 2.00 1.75 1.50 2.00
Non-MDR A.baumannii
260.88 1.660.890.85 1.720.71 1.250.63 1.09 1.260.67 1.150.990.99 1.38 270.88 2.00 1.25 2.00 1.750.88 1.51 1.26 2.00 2.000.99 2.000.99 2.00 2.00 28 1.01 1.43 1.01 1.13 1.45 1.43 1.44 1.00 2.00 2.00 1.26 1.44 1.26 1.26 2.00 290.84 2.000.670.710.68 1.00 1.320.66 1.16 1.340.72 1.660.99 1.16 1.15 300.42 1.270.630.830.820.66 1.160.69 1.67 1.670.88 1.430.75 1.26 1.76 310.75 1.52 1.00 1.000.840.440.880.710.830.990.63 1.520.83 1.26 1.44
32 1.41 2.00 1.16 1.32 1.70 1.00 1.750.99 1.16 1.35 1.51 2.00 1.26 1.26 1.46
33 2.00 1.50 1.09 1.25 1.500.88 1.27 1.43 1.76 2.000.84 2.00 1.32 1.75 2.00
34 2.000.460.870.83 1.660.660.390.88 1.16 1.16 1.000.340.990.99 1.41 350.71 1.32 1.16 1.04 1.390.70 1.16 1.03 1.04 1.000.88 1.66 1.51 1.14 1.26 36 1.24 2.000.99 1.75 2.000.88 1.15 1.00 1.16 1.50 1.00 2.000.83 1.51 1.73 270.83 1.32 1.16 1.03 1.15 1.00 1.150.99 1.75 1.15 1.00 1.32 1.16 1.16 1.15 38 1.00 2.00 1.26 1.51 1.480.42 1.010.830.88 1.26 1.00 1.75 1.16 1.00 1.16 390.140.840.71 1.00 1.250.19 1.150.41 1.00 1.150.250.990.50 1.000.99 400.69 1.380.880.880.39 1.17 2.00 1.14 1.51 1.68 1.00 2.00 1.50 1.41 1.68
a FICI interpretation:≤0.5,synergy(underlined);>0.5–4,additivity;>4,antagonism[14].
rifampicin.Two XDR A.baumannii isolates(5%)demonstrated syn-ergy between doripenem and netilmicin,one of which was the only isolate that showed synergy between imipenem and netilmicin. One of each XDR A.baumannii and non-MDR A.baumannii showed synergy of imipenem+moxi?oxacin and doripenem+moxi?oxacin combinations,respectively.No synergy was observed for combinations of meropenem+netilmicin and meropenem +moxi?oxacin.In addition,none of the combinations demon-strated antagonism.
In critically ill patients,infection due to MDR or XDR A.bau-mannii is a signi?cant predictor of mortality and requires high-cost https://www.360docs.net/doc/473860064.html,bination antimicrobial therapy may be consid-ered to improve the chance of survival.However,limited data are available on effective combinations against A.baumannii.We looked for combination activity between various carbapenems plus other non-traditional agents.Synergy was observed more often between cefoperazone/sulbactam and a carbapenem.MICs of doripenem,imipenem and meropenem were reduced3.18-, 3.78-and3.65-fold,respectively,when combined with cefopera-zone/sulbactam(data not shown).Synergy of a carbapenem and sulbactam against A.baumannii has also been shown in a few studies[3,6].For other agents(doxycycline,rifampicin,netilmicin and moxi?oxacin),synergistic activity with a carbapenem was less effective.Generally,doripenem and imipenem demonstrated comparable potential for synergy with other agents and were slightly better than meropenem with respect to synergistic activ-ities.It is noteworthy that antagonism was not detectable in any combination.Most FICIs were also<2.00,suggesting that MICs of the combined agents were decreased,albeit with no synergism. Particularly for patients with serious infections due to highly resis-tant A.baumannii,this study has demonstrated the potential clinical value of combination treatment between a carbapenem and other non-traditional agents.The activity of carbapenems,at least,may be enhanced when used in combination with some of these agents. However,in vitro synergistic activity could be dependent on strains and methods and thus results should be used with extreme caution in empirical therapy.Although time-kill and checkerboard methods are considered to be standard testing for antimicrobial combina-tion studies,they are time consuming and labour intensive.The Etest method is more feasible for testing in general clinical lab-oratories.It was determined that results of combination activity based on the Etest method were ca.63–75%in agreement with the time-kill method compared with44–88%for the checkerboard method[10].Therefore,the Etest technique may be used as an alternative and convenient method for synergy testing although further evaluation is warranted.It should also be mentioned that,
246P.Kiratisin et al./International Journal of Antimicrobial Agents36 (2010) 243–246
as a limitation,antagonism may be less detected by the Etest combination study because the inhibition zone may be con?ned under the crossed strips[10].For isolates with very high MIC levels, it is unlikely to achieve clinical plasma concentrations of the indi-vidual drug.Therefore,time-kill study using the steady-state con-centration according to the pharmacokinetic/pharmacodynamic model of each antibiotic as well as additional clinical trials based on in vitro data should be carried out to validate the value of these combination regimens.Furthermore,advances in knowledge of underlying resistance mechanisms among these strains would be important to provide a better understanding of how combination therapy could bene?t clinical outcomes.
Acknowledgments
The authors thank the Department of Microbiology,Faculty of Medicine Siriraj Hospital(Bangkok,Thailand)for providing iso-lates used in this study.They also thank Janssen(Thailand),MSD (Thailand)and Astra Zeneca(Thailand)for their support of study reagents.
Funding:PK was a recipient of the Siriraj Research Development Fund during this study.
Competing interests:None declared.
Ethical approval:Not required.
References
[1]Abbo A,Carmeli Y,Navon-Venezia S,Siegman-Igra Y,Schwaber MJ.Impact of
multi-drug-resistant Acinetobacter baumannii on clinical outcomes.Eur J Clin Microbiol Infect Dis2007;26:793–800.
[2]Mendes RE,Bell JM,Turnidge JD,Castanheira M,Jones RN.Emergence and
widespread dissemination of OXA-23,-24/40and-58carbapenemases among Acinetobacter spp.in Asia-Paci?c nations:report from the SENTRY surveillance program.J Antimicrob Chemother2009;63:55–9.
[3]Lee NY,Wang CL,Chuang YC,Yu WL,Lee HC,Chang CM,et https://www.360docs.net/doc/473860064.html,bination
carbapenem–sulbactam therapy for critically ill patients with multidrug-resistant Acinetobacter baumannii bacteremia:four case reports and an in vitro combination synergy study.Pharmacotherapy2007;27:1506–11.
[4]Principe L,D’Arezzo S,Capone A,Petrosillo N,Visca P.In vitro activity of tige-
cycline in combination with various antimicrobials against multidrug resistant Acinetobacter baumannii.Ann Clin Microbiol Antimicrob2009;8:18.
[5]Pankuch GA,Lin G,Seifert H,Appelbaum PC.Activity of meropenem with and
without cipro?oxacin and colistin against Pseudomonas aeruginosa and Acine-tobacter baumannii.Antimicrob Agents Chemother2008;52:333–6.
[6]Kiffer CR,Sampaio JL,Sinto S,Oplustil CP,Koga PC,Arruda AC,et al.In vitro syn-
ergy test of meropenem and sulbactam against clinical isolates of Acinetobacter baumannii.Diagn Microbiol Infect Dis2005;52:317–22.
[7]Appleman MD,Belzberg H,Citron DM,Heseltine PN,Yellin AE,Murray J,et al.In
vitro activities of nontraditional antimicrobials against multiresistant Acineto-bacter baumannii strains isolated in an intensive care unit outbreak.Antimicrob Agents Chemother2000;44:1035–40.
[8]Jung R,Husain M,Choi MK,Fish DN.Synergistic activities of moxi?oxacin com-
bined with piperacillin–tazobactam or cefepime against Klebsiella pneumoniae, Enterobacter cloacae,and Acinetobacter baumannii clinical isolates.Antimicrob Agents Chemother2004;48:1055–7.
[9]Timurkaynak F,Can F,Azap OK,Demirbilek M,Arslan H,Karaman SO.In
vitro activities of non-traditional antimicrobials alone or in combination against multidrug-resistant strains of Pseudomonas aeruginosa and Acineto-bacter baumannii isolated from intensive care units.Int J Antimicrob Agents 2006;27:224–8.
[10]White RL,Burgess DS,Manduru M,Bosso https://www.360docs.net/doc/473860064.html,parison of three different
in vitro methods of detecting synergy:time-kill,checkerboard,and E test.
Antimicrob Agents Chemother1996;40:1914–8.
[11]Falagas ME,Karageorgopoulos DE.Pandrug resistance(PDR),extensive drug
resistance(XDR),and multidrug resistance(MDR)among Gram-negative bacilli:need for international harmonization in terminology.Clin Infect Dis 2008;46:1121–2.
[12]Clinical and Laboratory Standards Institute.Performance standards for antimi-
crobial susceptibility testing.Nineteenth informational supplement.Document M100-S19.Wayne,PA:CLSI;2009.
[13]Bonapace CR,White RL,Friedrich LV,Bosso JA.Evaluation of antibiotic syn-
ergy against Acinetobacter baumannii:a comparison with Etest,time-kill,and checkerboard methods.Diagn Microbiol Infect Dis2000;38:43–50.
[14]Eliopoulos GM,Moellering RC.Antimicrobial combinations.In:Lorian V,editor.
Antibiotics in laboratory medicine.4th ed.Baltimore,MD:Williams&Wilkins;
1996.
碳青霉烯类抗菌药物临床应用专家共识
附件1 碳青霉烯类抗菌药物临床应用专家共识 近年来,我国碳青霉烯类抗菌药物在临床应用中出现了一些不合理现象,部分细菌对其耐药性呈明显上升趋势。经相关领域专家多次研究论证,对碳青霉烯类抗菌药物的临床应用达成以下共识。 一、碳青霉烯类抗菌药物在治疗感染性疾病中发挥着重要作用 碳青霉烯类抗菌药物的抗菌谱广、抗菌活性强,对需氧、厌氧菌均具有抗菌作用,特别就是对多重耐药革兰阴性杆菌,如产超广谱β—内酰胺酶(ESBL)肠杆菌科细菌具很强抗菌活性。该类药物的临床适应证广,在多重耐药菌感染、需氧菌与厌氧菌混合感染、重症感染及免疫缺陷患者感染等的抗菌治疗中发挥着重要作用。 目前我国上市的碳青霉烯类抗菌药物有5个品种:亚胺培南、美罗培南、帕尼培南、比阿培南与厄她培南。厄她培南抗菌谱相对较窄,对铜绿假单胞菌、不动杆菌等非发酵糖细菌抗菌作用差;其她4个品种的药效学特性相仿。亚胺培南、帕尼培南分别与西司她丁及倍她米隆组成合剂,后二者分别为肾脱氢肽酶抑制剂及近端肾小管有机阴离子输送系统抑制剂,并不起到抗菌作用。 二、碳青霉烯类抗菌药物临床应用存在的问题
(一)碳青霉烯类抗菌药物临床使用量逐年上升。全国抗菌药物临床应用监测网数据显示,自2011年我国开展抗菌药物临床应用专项整治以来,我国住院患者抗菌药物使用率由2011年的59、4%降至2017年的36、8%,抗菌药物使用强度同期由85、1 DDDs/100人·天降至49、7 DDDs/100人·天。多数类别抗菌药物包括第三代头孢菌素、喹诺酮类的使用强度均呈下降趋势,而同期该监测网中心成员单位的碳青霉烯类抗菌药物使用强度由1、83 DDDs/100人·天上升至3、28 DDDs/100人·天。在部分地区存在个别品种应用过多或上升过快的现象。 碳青霉烯类抗菌药物使用量增加的主要原因:1、多重耐药菌感染患者增多。近年来,全球范围内临床分离细菌对抗菌药物的耐药性总体呈上升趋势,因而选择该类药物的几率增加。2、免疫缺陷/免疫抑制治疗患者增多。3、部分医务人员临床应用不合理。 (二)革兰阴性杆菌对碳青霉烯类抗菌药物耐药呈上升趋势。全国细菌耐药监测网显示,2017年全国碳青霉烯类耐药肺炎克雷伯菌的检出率平均为9、0%,较2014年上升了2、6个百分点,个别省份检出率最高达到26、9%。老年、儿童与成人患者碳青霉烯类耐药肺炎克雷伯菌的检出率依次为10、2%、9、1%与7、8%。碳青霉烯耐药鲍曼不动杆菌(CRAB)的检出率持续较高,2017年全国平均检出率为56、1%,个别省份检出率最高达到 80、4%。 三、碳青霉烯类抗菌药物临床应用的专家建议 (一)严格掌握药物临床应用适应证。《抗菌药物临床应用指
2017 WHO指南:医疗卫生机构中耐碳青霉烯类肠杆菌,鲍曼不动杆菌和铜绿假单胞菌的预防和控制--推荐五
2017 WHO指南:医疗卫生机构中耐碳青霉烯类肠杆菌,鲍曼不动杆菌和铜绿假单胞菌的预防和控制--推荐五 5 患者隔离 专家组推荐: 定植或感染CRE-CRAB-CRPsA的患者应该与非定植或非感染的患者施行物理隔离,采用: a 单间,或 b 同种耐药菌的患者集中分类收治 (强烈推荐,极低至低质量证据) 推荐理由 ?在11项CRE研究中,9项将患者隔离作为评估干预的一部分。这9项中有8项报告了干预后CRE显著减少。 ?在5项CRAB研究中,3项将患者隔离作为评估干预的一部分。3项均报告了干预后CRAB显著减少。 ?在3项CRPsA研究中,1项将患者隔离作为评估干预的一部分,并报告了干预后CRPsA显著减少。 ?尽管可用证据有限,且质量级别为非常低至低。GDG一致认为这一推荐级别应列为强烈推荐。这一决定基于: o由于定植/感染CRE-CRAB-CRPsA的患者增加了接触传播的风险,对此类患者进行隔离是接触预防的基本内容。 o专家组关注到已证实的CRE-CRAB-CRPsA传播性,同时注意到实施患者隔离/集中分类收治在减少其他相似多重耐药菌传播方面的有效证据。 o证据和关于CRE-CRAB-CRPsA定植/感染的负担和影响的国际关注。(特别是1.1章节流行病学数据和1.2章节形成这些推荐意见的具体原因) 评论: ?值得注意的是,“隔离”及“集中分类收治”在一些医疗机构中存在术语使用不一致性。为了本指南的目的,使用下述标准定义:
o隔离:有条件的话,应将患者安排在单间(最好有独立卫生间)。 若单间供给不足,患者应集中分类收治。 o集中分类收治:将定植/感染同种微生物的患者归为一组,在一个划定的地点提供照护,防止与其他患者接触。 ?隔离的目的是将定植/感染患者与非定植/非感染患者分隔开。 ?GDG指出,尽管在CRE定植/感染的患者中,隔离的有效性有最强的证据支持,但专家组认为本推荐对预防CRAB或CRPsA定植/感染患者的交叉传播很有可能同样有效。 ?GDG指出,患者隔离有可能与一些潜在伤害和意想不到的负面结果有关(例如:社会孤立和抑郁、焦虑等心理影响)。上述问题与伦理审查小组讨论,讨论结果和相关缓解措施在“价值观和偏好”部分描述,还有一些该领域的重要参考资料。总而言之,GDG认为使用恰当的管理方法能够使负面结果最小化,相对于以上关注点,隔离患者给预防CRE-CRAB-CRPsA 的交叉传播所带来的益处更有价值。 ?如果有可能,应优先安排定植/感染患者在单间。在单间不足,或对定植/感染相同病原菌的患者进行集中分类收治更能有效利用医院病房和资源的情况下,集中分类收治是备选。GDG认为在感染暴发时应该总是执行患者隔离。在病原体流行的情况下,可能难以实现单间隔离,尤其在资源和设备有限的低收入医疗机构。 ?GDG指出,有证据和临床经验支持,应安排专门的医务人员对隔离/集中分类收治的患者进行管理,尽管专家组认为可能在可行性方面还存在一些问题(见资源影响和可行性)。 背景 患者隔离是接触预防的重要组成部分,通过单间病房或集中分类收治的方式将患者实施物理分隔,来预防患者之间的感染传播。支持患者隔离作为有效的感染防控干预来预防医疗保健相关感染以及病原体交叉传播的一般证据,早前在《WHO关于国家和急症医疗机构层面的感染预防和控制核心措施的指南》中有所概述。 证据摘要 在本节中,我们研究了患者隔离或集中分类收治作为干预措施的一部分,对预防和控制CRE-CRAB-CRPsA患者结局的影响的相关证据。 评估患者隔离的研究为间断性序列(ITS)设计,来自国家分属:美洲(11项CRE研究中有4项,5项CRAB中有2项,3项CRPsA研究中有1项)、
碳青霉烯类抗菌药物临床应用专家共识
碳青霉烯类抗菌药物临床应用专家共识近年来,我国碳青霉烯类抗菌药物在临床应用中出现了一些不合理现象,部分细菌对其耐药性呈明显上升趋势。经相关领域专家多次研究论证,对碳青霉烯类抗菌药物的临床应用达成以下共识。 一、碳青霉烯类抗菌药物在治疗感染性疾病中发挥着重要作用 碳青霉烯类抗菌药物的抗菌谱广、抗菌活性强,对需氧、厌氧菌均具有抗菌作用,特别是对多重耐药革兰阴性杆菌,如产超广谱β-内酰胺酶(ESBL)肠杆菌科细菌具很强抗菌活性。该类药物的临床适应证广,在多重耐药菌感染、需氧菌与厌氧菌混合感染、重症感染及免疫缺陷患者感染等的抗菌治疗中发挥着重要作用。 目前我国上市的碳青霉烯类抗菌药物有5个品种:亚胺培南、美罗培南、帕尼培南、比阿培南和厄他培南。厄他培南抗菌谱相对较窄,对铜绿假单胞菌、不动杆菌等非发酵糖细菌抗菌作用差;其他4个品种的药效学特性相仿。亚胺培南、帕尼培南分别与西司他丁及倍他米隆组成合剂,后二者分别为肾脱氢肽酶抑制剂及近端肾小管有机阴离子输送系统抑制剂,并不起到抗菌作用。 二、碳青霉烯类抗菌药物临床应用存在的问题 (一)碳青霉烯类抗菌药物临床使用量逐年上升。全国抗菌药物临床应用监测网数据显示,自2011年我国开展抗菌药物临床应用专项整治以来,我国住院患者抗菌药物使用率由2011年的59.4%降至2017年的36.8%,抗菌药物使用强度同期由85.1 DDDs/100人·天降至49.7 DDDs/100人·天。多数类别抗菌药物包括第三代头孢菌素、喹诺酮类的使用强度均呈下降趋势,而同
期该监测网中心成员单位的碳青霉烯类抗菌药物使用强度由 1.83 DDDs/100人·天上升至3.28 DDDs/100人·天。在部分地区存在个别品种应用过多或上升过快的现象。 碳青霉烯类抗菌药物使用量增加的主要原因:1.多重耐药菌感染患者增多。近年来,全球范围内临床分离细菌对抗菌药物的耐药性总体呈上升趋势,因而选择该类药物的几率增加。2.免疫缺陷/免疫抑制治疗患者增多。3.部分医务人员临床应用不合理。 (二)革兰阴性杆菌对碳青霉烯类抗菌药物耐药呈上升趋势。全国细菌耐药监测网显示,2017年全国碳青霉烯类耐药肺炎克雷伯菌的检出率平均为9.0%,较2014年上升了2.6个百分点,个别省份检出率最高达到26.9%。老年、儿童和成人患者碳青霉烯类耐药肺炎克雷伯菌的检出率依次为10.2%、9.1%和7.8%。碳青霉烯耐药鲍曼不动杆菌(CRAB)的检出率持续较高,2017年全国平均检出率为56.1%,个别省份检出率最高达到80.4%。 三、碳青霉烯类抗菌药物临床应用的专家建议 (一)严格掌握药物临床应用适应证。《抗菌药物临床应用指导原则(2015年版)》明确碳青霉烯类抗菌药物临床应用适应证:多重耐药但对本类药物敏感的需氧革兰阴性杆菌所致严重感染;脆弱拟杆菌等厌氧菌与需氧菌混合感染的重症患者;病原菌尚未查明的严重免疫缺陷患者感染的经验治疗。对照这3个适应证,临床合理应用的重点有: 1.“重症感染”是指因感染导致患者出现低血压、低氧血症、脏器功能损害等临床表现的患者。而对于“重症患者”,则需要认真鉴别是否存在感染后,再决定是否需要使用抗菌药物,特别是碳青霉烯类药物。
碳青霉烯类抗菌药物临床应用
碳青霉烯类抗菌药物临床应用 专家共识 近年来,我国碳青霉烯类抗菌药物在临床应用中出现了一些不合理现象,部分细菌对其耐药性呈明显上升趋势。经相关领域专家多次研究论证,对碳青霉烯类抗菌药物的临床应用达成以下共识。 一、碳青霉烯类抗菌药物在治疗感染性疾病中发挥着重要作用 碳青霉烯类抗菌药物的抗菌谱广、抗菌活性强,对需氧、厌氧菌均具有抗菌作用,特别是对多重耐药革兰阴性杆菌,如产超广谱β—内酰胺酶(ESBL)肠杆菌科细菌具很强抗菌活性。该类药物的临床适应证广,在多重耐药菌感染、需氧菌与厌氧菌混合感染、重症感染及免疫缺陷患者感染等的抗菌治疗中发挥着重要作用。 目前我国上市的碳青霉烯类抗菌药物有5个品种:亚胺培南、美罗培南、帕尼培南、比阿培南和厄他培南。厄他培南抗菌谱相对较窄,对铜绿假单胞菌、不动杆菌等非发酵糖细菌抗菌作用差;其他4个品种的药效学特性相仿。亚胺培南、帕尼培南分别与西司他丁及倍他米隆组成合剂,后二者分别为肾脱氢肽酶抑制剂及近端肾小管有机阴离子输送系统抑制剂,并不起到抗菌作用。 二、碳青霉烯类抗菌药物临床应用存在的问题
(一)碳青霉烯类抗菌药物临床使用量逐年上升。全国抗菌药物临床应用监测网数据显示,自2011年我国开展抗菌药物临床应用专项整治以来,我国住院患者抗菌药物使用率由2011年的59.4%降至2017年的36.8%,抗菌药物使用强度同期由85.1 DDDs/100人·天降至49.7 DDDs/100人·天。多数类别抗菌药物包括第三代头孢菌素、喹诺酮类的使用强度均呈下降趋势,而同期该监测网中心成员单位的碳青霉烯类抗菌药物使用强度由1.83 DDDs/100人·天上升至3.28 DDDs/100人·天。在部分地区存在个别品种应用过多或上升过快的现象。 碳青霉烯类抗菌药物使用量增加的主要原因:1.多重耐药菌感染患者增多。近年来,全球范围内临床分离细菌对抗菌药物的耐药性总体呈上升趋势,因而选择该类药物的几率增加。2.免疫缺陷/免疫抑制治疗患者增多。3.部分医务人员临床应用不合理。 (二)革兰阴性杆菌对碳青霉烯类抗菌药物耐药呈上升趋势。全国细菌耐药监测网显示,2017年全国碳青霉烯类耐药肺炎克雷伯菌的检出率平均为9.0%,较2014年上升了2.6个百分点,个别省份检出率最高达到26.9%。老年、儿童和成人患者碳青霉烯类耐药肺炎克雷伯菌的检出率依次为10.2%、9.1%和7.8%。碳青霉烯耐药鲍曼不动杆菌(CRAB)的检出率持续较高,2017年全国平均检出率为56.1%,个别省份检出率最高达到 80.4%。 三、碳青霉烯类抗菌药物临床应用的专家建议
碳青霉烯类抗菌药物介绍 试题答案
项目名称:2019年兵团《抗菌药物临床应用与管理》、《医疗纠纷预防和处理条例》全员培训 碳青霉烯类抗菌药物介绍试题答案 1、下列关于碳青霉烯类药物的特点说法错误的是(c ) A、对绝大多数G+与G-、需氧菌与厌氧菌均具有良好的抗菌作用 B、产ESBL 菌株所致严重感染的首选药 C、甲氧西林敏感的葡萄球菌、肺炎球菌、链球菌属、粪肠球菌的作用优于头孢他啶 D、对于沙雷菌属、不动杆菌、绿脓杆菌、产碱杆菌等的抗菌作用大多优于头孢他啶 E、各种厌氧菌包括脆弱类杆菌的作用优于甲硝唑、克林霉素和氯霉素 1、下列关于药物的构效关系描述错误的是(b ) A、亚胺培南——肾毒性大,易代谢,需与酶抑制剂联用;R位碱性强,易导致神经毒性 B、美罗培南——肾毒性低,酶稳定;R位碱性降低,抗G-菌的活性增高、神经毒性降低 C、厄他培南——肾毒性低,酶稳定; R位提高蛋白结合率,半衰期延长;神经毒性降低 D、厄他培南——肾毒性低,酶稳定;R位碱性降低,抗G-菌的活性增高、神经毒性降低 E、比阿培南——肾毒性低,酶稳定;几乎无神经毒性 关于碳青霉烯类的不良反应的描述错误的是(b ) A、超剂量应用时此类药物易诱发神经毒性,其中亚胺培南发生率较高,而美罗培南、厄他培南和比阿培南发生率较低,故亚胺培南不适用于中枢神经系统的感染 B、超剂量应用时此类药物易诱发神经毒性,发生率约为10 %-30% C、较严重的不良反应是神经系统毒性,如头痛、惊厥、癫痫、肌阵挛、意识障碍等 D、可导致皮疹、瘙痒、发热、休克等过敏反应,因此过敏体质者应慎用 E、主要为恶心、呕吐、腹痛、腹泻等胃肠道反应以及血液学方面的嗜酸性细胞增多、白细胞减少、中性粒细胞减少、血小板减少或增多、血红蛋白减少等,并可致抗人球蛋白试验阳性,转氨酶升高,血胆红素或碱性磷酸酶升高,但一般能为患者所耐受 窗体底端
关于我院ICU3例耐碳青霉烯类鲍曼不动杆菌感染病例的调查
关于我院ICU 3例耐碳青霉烯类鲍曼不动杆菌(CR-AB)病例的调查2018年7月6日,院感科到检验科抄录多重耐药菌信息时发现短时间内ICU送检痰标本连续检出3例耐碳青霉烯鲍曼不动杆菌(CR-AB),我科专职人员立即到ICU进行调查。主要调查内容为:1、讨论患者临床表现、实验室检查,判断是否为医院感染;2、判断医院感染聚集性病例/医院感染暴发;3、对其可能的感染因素进行调查分析;4、整改措施干预等。现报告具体情况如下: 一、患者基本情况,是否为医院感染。 1、患者王岳,男,25岁,住院号2018009376,于2018年6月10日入院,入院诊断“1、双肺挫伤; 2、急性呼吸衰竭; 3、肋骨骨折; 4、创伤性血气胸; 5、全身多处皮肤挫伤; 6、右侧肘关节内脱位骨折”。患者于6月10日入住ICU,行气管插管接呼吸机辅助呼吸。6月21日送痰培养检出CR-AB,已按药敏使用抗生素。再根据临床症状、病原微生物检查结果,定义为医院感染。 2、患者曾禾珍,女,77岁,住院号2018009003,于2018年6月2日入院,入院诊断“1、肺部感染;2、淋巴瘤性甲状腺瘤术后; 3、大气道狭窄; 4、气管切开术后拔管困难; 5、冠状动脉粥样硬化性心脏病伴心功能不全; 6、高血压Ⅲ”。患者于6月2日入住ICU,行气管切开接呼吸机辅助呼吸。6月29日送痰培养检出CR-AB,已按药敏使用抗生素。根据临床症状、病原微生物检查结果,定义为医院感染。 3、患者张树生,男,71岁,住院号2018007626,于2018年6月27日入院,入院诊断“1、鼻骨骨折;2、吸入性肺炎;3、糖尿病; 4、高血压; 5、脑梗死后遗症; 6、帕金森氏病; 7、消化道出血”。患者于6月27日入住耳鼻喉科后当日即转入ICU,行气管插管接呼吸机辅助呼吸。7月3日送痰培养检出CR-AB,已按药敏使用抗生素。根据临床症状、病原微生物检查结果,定义为污染。 二、判断性质 聚集:相对不常见事件或疾病在空间或时间上的数量集合超过概率造成的期望值。 聚集性病例:医疗机构或科室的患者中,短时间内出现2例或2例以上临床症候群相似,怀疑有共同感染源的感染病例。 医院感染暴发:在医疗机构或其他科室的患者中,短时间内局出现三例以上同种同源病例的感染。 本次3例CR-AB,均在ICU接受治疗,且均住在A组,痰培养均检出CR-AB,由于耐药
碳青霉烯类抗菌药物和替加环素使用管理规定
碳青霉烯类抗菌药物和替加环素使用管理规定根据《抗菌药物临床应用管理办法》、《抗菌药物临床应用指导原则(2015 年版)》和《2017年抗菌药物临床合理应用督导工作表》的要求,制定本管理流程。 一、严格控制碳青霉烯类抗菌药物和替加环素的使用 碳青霉烯类抗菌药物和替加环素使用条件和程序包括:碳青霉烯类抗菌药物和替加环素选用应从严控制,患者病情需要应用碳青霉烯类抗菌药物和替加环素,应具备严格临床用药指征或确凿依据。 1.有药敏支持; 2.经科室讨论和有关专家会诊同意; 3.处方需经具有副高级以上专业技术职务任职资格医师开具。 临床应用碳青霉烯类抗菌药物和替加环素应当严格掌握用药指征,经抗菌药物管理工作组指定的专业技术人员会诊同意后,由具有相应处方权医师开具处方。 碳青霉烯类抗菌药物和替加环素会诊人员由具有抗菌药物临床应用经验的感染性疾病科、呼吸科、重症医学科、微生物检验科、药学部门等具有高级专业技术职务任职资格的医师、药师或具有高级专业技术职务任职资格的抗菌药物专业临床药师担任。 碳青霉烯类抗菌药物和替加环素不得在门诊使用。 二、临床科室使用碳青霉烯类抗菌药物和替加环素相关规定 1.住院患者确需使用碳青霉烯类抗菌药物和替加环素的,由临床科室提出会诊申请,由指定的具有高级技术职务任职资格的专家进行会诊,确定是否使用,包括碳青霉烯类抗菌药物和替加环素品种、使用剂量、疗程及预后等。 2.经会诊确需使用的,临床科室须填写《特殊使用级抗菌药物申请表》,由会诊专家签名、具有高级专业技术任职资格的医师开具处方方可使用。 3.使用过程中,严密观察患者用药反应,对于出现严重不良反应的,立即停药,并积极救治。 4.紧急情况下未经会诊同意或需越级使用的,处方量不得超过1日用量,并做好相关病历记录。 5.按月填写《医疗机构碳青霉烯类抗菌药物及替加环素使用情况信息表》,报临
耐碳青霉烯 鲍曼
中南大学学报(医学版) J Cent South Univ (Med Sci)2012, 37(5) https://www.360docs.net/doc/473860064.html,; https://www.360docs.net/doc/473860064.html,521长沙地区临床分离碳青霉烯类耐药鲍曼不动杆菌的 分子流行病学特征 梁伟1,2,邹明祥1,邬靖敏1 , 邬国军3,李军1,豆清娅1 ,刘文恩1 (1. 中南大学湘雅医院检验科,长沙 410008;2. 长沙市第三人民医院检验科,长沙 410015; 3. 中南大学基础医学院微生物学系,长沙 410078) [摘要]目的:了解长沙地区临床分离鲍曼不动杆菌的耐药性,探讨碳青霉烯类抗生素耐药菌株的分子流行病学特征。方法:收集长沙地区10所综合性医院2010年3月至2010年12月间临床分离的非重复鲍曼不动杆菌株205株;采用K-B法检测药物敏感性,改良双纸片协同试验检测金属β-内酰胺酶(金属酶),改良Hodge试验筛查碳青霉烯酶;PCR扩增OXA-23,OXA-24,OXA-51,OXA-58及IMP-1和VIM-2型碳青霉烯酶基因,并进行测序分析。应用肠杆菌科基因间一致重复序列聚合酶链反应(enterobacterial repetitive intergenic consensus PCR,ERIC-PCR)对菌株进行DNA 分型及同源性分析。结果:在监测的18种药物中,耐药率超过50%的达14种。其中哌拉西林耐药率最高(80.5%),头孢哌酮/舒巴坦耐药率最低(2.5%)。共筛选出耐碳青霉烯类药物鲍曼不动杆菌115 株,其金属酶表型及基因检测均为阴性;改良Hodge试验阳性71株,其中64株OXA-23基因扩增阳性。115株菌株OXA-51均阳性,未检出OXA-24,OXA-58基因。115株菌株共分为7个ERIC基因型。其中A型19株,B型72株,为主要的流行克隆。结论:长沙地区临床分离鲍曼不动杆菌多重耐药十分严重;产OXA-23 和OXA-51型碳青霉烯酶是鲍曼不动杆菌对碳青霉烯类药物耐药的重要机制,且碳青霉烯类耐药菌株存在克隆流行。 [关键词]鲍曼不动杆菌;碳青霉烯酶;肠杆菌基因间一致重复序列聚合酶链反应;分子流行病学特征 DOI:10.3969/j.issn.1672-7347.2012.05.018 Molecular epidemiological characteristics of clinically isolated carbapenem-resistant Acinetobacter baumannii in Changsha LIANG Wei1,2, ZOU Mingxiang1, WU Jingmin1, WU Guojun3, LI Jun1, DOU Qingya1, LIU Wenen1 (1. Department of Clinical Laboratory, Xiangya Hospital, Central South University, Changsha 410008; 2. Department of Clinical Laboratory, Third Hospital of Changsha, Changsha 410015; 3. Department of Microbiology, School of Basic Medicine, Central South University, Changsha 410078, China) ABSTRACT Objective: To survey antibiotic resistance of clinical isolates of Acinetobacter baumannii in Changsha and to investigate molecular epidemiological characteristics of carbapenem-resistant Acinetobacter baumannii. Methods: A total of 205 non-duplicated, clinical isolates of Acinetabacter baumannii from 10 general hospitals in Changsha were collected from March 2010 to December 2010. The K-B disk diffusion 收稿日期(Date of reception):2012–01–21 作者简介(Biography): 梁伟,硕士,主管检验师,主要从事细菌耐药机制研究。 通信作者(Corresponding author):邹明祥,Email: zoumingxiang@https://www.360docs.net/doc/473860064.html,
碳青霉烯类抗菌药物临床应用
碳青霉烯类抗菌药物临床应用 评价细则 价
及配伍 效评估 抗菌药物处方与会诊[3]
[1]适用于MIC≤8μg/ml的CRE感染(如与多黏菌素联用时则CRE的MIC可为16—32μg/ml),使用时应加大剂量、延长输注时间并联合其他抗菌药物。 [2]推荐剂量(见附录) [3]部分地区厄他培南在抗菌药物分级管理目录中属于限制使用级,遇此情况无需进行第五部分评价。 附录 碳青霉烯类抗菌药物推荐给药剂量 1.亚胺培南(剂量以亚胺培南计算) 一般为静脉滴注给药,亦可肌内注射给药,严禁静脉注射给药。 (1)静脉给药 ①成人:肾功能正常患者根据感染严重程度、细菌敏感性以及患者体重而定,每日2~3g每6~8小时给药1次;每日最大剂量不得超过50mg/kg或4g,且无资料显示剂量超过4g可提高疗效。 ②肾功能减退成人:肾功能减退患者需调整剂量,内生肌酐清除率50~90ml/min 者每次0.25~0.5g,每6~8小时给药1次;内生肌酐清除率10~50ml/min者每次0.25,每6~12小时给药1次;内生肌酐清除率6~9ml/min者每次0.125~0.25g,每12小时给药1次。血液透析患者应在透析后给药,连续性非卧床腹膜透析(CAPD)患者剂量与内生肌酐清除率< 10ml/min者同,连续肾脏替代疗法(CRRT)每次0.5~1g,每日2次。内生肌酐清除率< 20ml/min者超过推荐剂量时癫痫发生率上升。 ③新生儿:<7天新生儿,一次20mg/kg,每12小时1次;7-21天新生儿,一次20mg/kg,每8小时1次;21-28天新生儿,一次20mg/kg,每6小时1次。 ④儿童:1-3个月婴儿,一次20mg/kg,每6小时1次;3个月-18岁或者体重<40kg儿童,一次15mg/kg(最大剂量500mg),每6小时1次;体重≥40kg 儿童,一次250-500mg,每6小时1次。 ⑤对肾功能损害的儿童(血清肌酐>2mg/dl),尚无足够的临床资料作为推荐依据。 (2)肌内注射 剂量为每次0.5~0.75g,每12小时给药1次。本品0.5g和0.75g应分别溶解于1%利多卡因溶液2ml和3ml中供肌肉注射。 2.美罗培南 ①成人:肾功能正常患者根据感染严重程度、细菌敏感性以及患者体重等而定,常用量为每次0.5~1g,每8~12小时给药1次;细菌性脑膜炎患者可增至每次2g,每8小时给药1次;每日最大剂量不得超过6g。 ②肾功能减退成人:肾功能减退患者需调整剂量,内生肌酐清除率>50~ 90ml/min者每次1g,每8小时给药1次;内生肌酐清除率26~50ml/min者每次1g,每12小时给药1次;内生肌酐清除率10~25ml/min者每次0.5g,每12小时给药1次;内生肌酐清除率<10ml/min者每次0.5g,每24小时给药1次。血液透析患者剂量为每次0.5g,每24小时给药1次,每次透析结束后应补充0.5g。CAPD患者剂量与内生肌酐清除率<10ml/min者同。 ③老年人内生肌酐清除率>50ml/min者不需调整剂量,<50ml/min者按肾功能来调整剂量。
世界卫生组织医疗机构耐碳青霉烯的 肠杆菌科细菌铜绿假
·指南解读· 世界卫生组织《医疗机构耐碳青霉烯的 肠杆菌科细菌、铜绿假单胞菌和 鲍曼不动杆菌防控指南》介绍 乔甫1,宗志勇1, 2 1. 四川大学华西医院医院感染管理部(成都 610041) 2. 四川大学华西医院感染性疾病中心(成都 610041) 宗志勇:四川大学华西医院感染性疾病中心教授、博士生导师,四川大学华西医院 医院感染管理部部长。 本科毕业于华西医大临床医学专业,毕业后留华西医院感染性疾病中心工作,历任 住院医师、住院总医师、讲师、副主任医师和教授。2006年获澳大利亚政府全额奖学金 到澳大利亚悉尼大学感染与微生物中心攻读博士,2009年获博士学位回国。现主要从事 重症感染的诊治、细菌耐药性研究和医院感染防控。已发表SCI收录文章80多篇。获国 家自然科学基金优青、英国皇家学会牛顿高级学者。 【摘要】 耐碳青霉烯肠杆菌科细菌、铜绿假单胞菌和鲍曼不动杆菌是医院感染的重要病原体,并在最近几 年内广泛扩散。为预防和控制该耐药菌在医疗机构内传播,2017 年世界卫生组织组织编写了《医疗机构耐碳青 霉烯的肠杆菌科细菌、鲍曼不动杆菌和铜绿假单胞菌防控指南》。该文将从指南编写的背景、编写过程、主要防 控措施、优缺点等方面进行介绍,希望能帮助广大感控从业人员落实指南,切实降低这些多重耐药菌的医院感染。 【关键词】 耐碳青霉烯肠杆菌科细菌;耐碳青霉烯铜绿假单胞菌;耐碳青霉烯鲍曼不动杆菌;世界卫生组 织;防控指南 Interpretation of Guidelines for the Prevention and Control of Carbapenem-resistant Enterobacteriaceae, Acinetobacter baumannii and Pseudomonas aeruginosa in health care facilities QIAO Fu1, ZONG Zhiyong1, 2 1. Infection Prevention and Control Department, West China Hospital, Sichuan University, Chengdu, Sichuan 610041, P. R. China 2. Department of Infectious Diseases, West China Hospital, Sichuan University, Chengdu, Sichuan 610041, P. R. China Corresponding author: ZONG Zhiyong, Email: zongzhiyong@https://www.360docs.net/doc/473860064.html, 【Abstract】 There is a worldwide consensus that urgent action is needed to prevent and control multi-drug resistant organisms in health care settings, especially Carbapenem-resistant Enterobacteriaceae(CRE), Carbapenem-resistant Acinetobacter baumannii (CRAB) and Carbapenem-resistant Pseudomonas aeruginosa (CRPsA). In 2017, to focus on this topic, world health organization organized experts worldwide to develop guidelines for the prevention and control of CRE, CRPsA and CRAB. In this paper, we introduced the background, development process, main measures, advantages and disadvantages of the guidelines to help infection prevention and control practitioners take actions properly based on the guidelines. 【Key words】 Carbapenem-resistant Enterobacteriaceae; Carbapenem-resistant Acinetobacter baumannii; Carbapenem-resistant Pseudomonas aeruginosa; World Health Organization; Guidelines DOI:10.7507/1002-0179.201803013 通信作者:宗志勇,Email:zongzhiyong@https://www.360docs.net/doc/473860064.html,
碳青霉烯类抗生素耐药机制介绍
碳青霉烯类抗生素一种非典型beta-内酰胺类抗生素,具有抗菌谱广、抗菌活性强以及对beta-内酰胺酶稳定以及毒性低等特点,对控制耐药菌、产酶菌感染及免疫缺陷者感染发挥着重要作用。其结构与青霉素类的青霉环相似,不同之处在于噻唑环上的硫原子为碳所替代,且C2与C3之间存在不饱和双键;另外,其6位羟乙基侧链为反式构象。研究证明,正是这个构型特殊的基团,使该类化合物与通常青霉烯的顺式构象显著不同,具有超广谱的、极强的抗菌活性,以及对beta-内酰胺酶高度的稳定性。 碳青霉烯类抗生素作用方式都是抑制胞壁粘肽合成酶,即青霉素结合蛋白(PBPs),从而阻碍细胞壁粘肽合成,使细菌胞壁缺损,菌体膨胀致使细菌胞浆渗透压改变和细胞溶解而杀灭细菌。哺乳动物无细胞壁,不受此类药物的影响,因而本类药具有对细菌的选择性杀菌作用,对宿主毒性小。青霉素结合蛋白(PBPs)是存在于细胞浆膜上的蛋白,分两类,一类具有转肽酶和转糖基酶的活性,参与细胞壁的合成,另一类具有羧肽酶活性,与细菌细胞分裂和维持形态有关。近十多年来已证实细菌胞浆膜上特殊蛋白PBPs是此药的作用靶位,亚胺培南与PBP2的亲和力很强,结合后阻碍细胞壁的合成,可使细菌迅速肿胀、溶解,而且其作用很少受接种菌量(PH5.5~8.5)的影响。美罗培南能迅速渗透入肠杆菌科和铜绿假单孢菌靶位,主要是与PBP2和PBP3紧密结合。 国内已经上市的品种有亚胺培南,美罗培南,帕尼培南,法罗培南,厄他培南,比阿培南。抗菌药物出现,总是伴随着细菌耐药性的产生,碳青霉烯类抗
生素虽然刚开始使用时,细菌的耐药性相当低,对常见病原菌的敏感率很高,但碳青霉烯类与其他抗菌药物一样,在临床应用后即出现耐药菌株。目前临床上已出现亚胺培南、美罗培南等碳青霉烯类药物的耐药菌株。 细菌对碳青霉烯类抗菌药物耐药的机制主要有以下几种: 1.外膜孔蛋白减少或丢失伴高水平beta-内酰胺酶的持续产生 外膜的通透性对药物进入菌体至关重要,抗生素可以通过通道蛋白直接扩散进入胞内,并到达菌体内的相应作用部位,从而达到抑菌或杀菌的作用。外膜蛋白的表达缺失或减少时阻止药物顺利到达菌体内,可以使碳青霉烯类药物MIC值升高,当合并产ESBL或ampC酶时则使细菌对碳青霉烯类药物产生高水平耐药。 2.碳青霉烯酶产生 碳青霉烯酶是指所有能明显水解亚胺培南、美罗培南等碳青霉烯类抗生素的beta-内酰胺酶。BUSH-JM分类方法根据生化特征或氨基酸序列的同源性性将beta-内酰胺酶分为4类。第一类为头孢菌素水解酶(Amp-C酶),由染色体介导;第二类为青霉素酶和超广谱酶,其中2f亚群是由沙雷菌属与肠杆菌属产生的非金属碳青霉烯酶;第三类为可水解碳青霉烯抗生素的金属酶,为碳青霉烯酶;第四类为其他不能被克拉维酸完全抑制的青霉素酶。Ambler分类方法根据于beta-内酰胺酶的特殊性、动力学参数及其基因的核苷酸序列,将beta-内酰胺酶分为A、B、C、D四类。其中A、B、D三类为碳青霉烯酶。 A类为丝氨酸酶,活性部位为丝氨酸残基,属于Bush分群中的2f亚组。包括阴沟肠杆菌和黏质沙雷菌种由染色体介导的NMC-A、IMI、SME以及肺炎克雷伯菌、铜绿假单胞菌中质粒介导的KPC、GES酶。这类酶都是青霉素
碳青霉烯类抗菌药物临床应用评价细则
附件2 碳青霉烯类抗菌药物临床应用 评价细则 一、评价细则说明 1.本评价细则是为评价碳青霉烯类抗菌药物临床应用合理性提供参考,供专档管理和督导检查时使用。 2.所指碳青霉烯类抗菌药物包括以下品种:亚胺培南、美罗培南、帕尼培南、比阿培南、厄他培南。 3.评价表中权重分数高的部分仅代表管理侧重点,并不代表在临床应用中权重分数低的部分不重要。 4.评价表分为5部分:适应证、品种选择、给药方案、病原学及疗效评估、会诊权限。 5.每表针对1个病例进行评价,如病例中使用1个以上碳青霉烯类抗菌药物时,进行总体评价。根据不合理情况,予以扣分。 6.评价表共100分,实行扣分制,扣完为止,最低0分。
二、碳青霉烯类抗菌药物临床应用评价细则
[1]适用于MIC≤8μg/ml的CRE感染(如与多黏菌素联用时则CRE的MIC可为16—32μg/ml),使用时应加大剂量、延长输注时间并联合其他抗菌药物。 [2]推荐剂量(见附录) [3]部分地区厄他培南在抗菌药物分级管理目录中属于限制使用级,遇此情况无需进行第五部分评价。
碳青霉烯类抗菌药物推荐给药剂量 1.亚胺培南(剂量以亚胺培南计算) 一般为静脉滴注给药,亦可肌注射给药,严禁静脉注射给药。 (1)静脉给药 ①成人:肾功能正常患者根据感染严重程度、细菌敏感性以及患者体重而定,每日2~3g每6~8小时给药1次;每日最大剂量不得超过50mg/kg或4g,且无资料显示剂量超过4g可提高疗效。 ②肾功能减退成人:肾功能减退患者需调整剂量,生肌酐清除率50~90ml/min者每次0.25~ 0.5g,每6~8小时给药1次;生肌酐清除率10~50ml/min者每次0.25,每6~12小时给药1次;生肌酐清除率6~9ml/min者每次0.125~0.25g,每12小时给药1次。血液透析患者应在透析后给药,连续性非卧床腹膜透析(CAPD)患者剂量与生肌酐清除率< 10ml/min者同,连续肾脏替代疗法(CRRT)每次0.5~1g,每日2次。生肌酐清除率< 20ml/min者超过推荐剂量时癫痫发生率上升。 ③新生儿:<7天新生儿,一次20mg/kg,每12小时1次;7-21天新生儿,一次20mg/kg,每8小时1次;21-28天新生儿,一次20mg/kg,每6小时1次。 ④儿童:1-3个月婴儿,一次20mg/kg,每6小时1次;3个月-18岁或者体重<40kg儿童,一次15mg/kg(最大剂量500mg),每6小时1次;体重≥40kg儿童,一次250-500mg,每6小时1次。 ⑤对肾功能损害的儿童(血清肌酐>2mg/dl),尚无足够的临床资料作为推荐依据。 (2)肌注射 剂量为每次0.5~0.75g,每12小时给药1次。本品0.5g和0.75g应分别溶解于1%利多卡因溶液2ml和3ml中供肌肉注射。 2.美罗培南 ①成人:肾功能正常患者根据感染严重程度、细菌敏感性以及患者体重等而定,常用量为每次 0.5~1g,每8~12小时给药1次;细菌性脑膜炎患者可增至每次2g,每8小时给药1次;每日最大剂量不得超过6g。 ②肾功能减退成人:肾功能减退患者需调整剂量,生肌酐清除率>50~90ml/min者每次1g,每8小时给药1次;生肌酐清除率26~50ml/min者每次1g,每12小时给药1次;生肌酐清除率10~25ml/min者每次0.5g,每12小时给药1次;生肌酐清除率<10ml/min者每次0.5g,每24小时给药1次。血液透析患者剂量为每次0.5g,每24小时给药1次,每次透析结束后应补充0.5g。CAPD患者剂量与生肌酐清除率<10ml/min者同。 ③老年人生肌酐清除率>50ml/min者不需调整剂量,<50ml/min者按肾功能来调整剂量。 ④新生儿:<7天新生儿,一次20mg/kg,每12小时1次;7-28天新生儿,一次20mg/kg,每8小时1次。治疗脑膜炎时:<7天新生儿,一次40mg/kg,每12小时1次;7-28天新生儿,一次40mg/kg,每8小时1次。 ⑤儿童:1个月-12岁或者体重<50kg儿童,一次10mg/kg,每8小时1次;12-18岁或者体重≥50kg 儿童,一次500mg,每8小时1次。治疗院感染肺炎、腹膜炎、血流感染以及中性粒细胞缺乏的感染时,剂量可加倍。治疗脑膜炎时:1个月-12岁或者体重<50kg儿童,一次40mg/kg,每8小时1次;12-18岁或者体重≥50kg儿童,一次2g,每8小时1次。 ⑥对肾功能损害患者,如果肌酐清除率每分钟25-50ml/1.73m2,正常剂量每12小时1次;如果肌酐清除率每分钟10-25ml/1.73m2,正常半量每12小时1次;如果肌酐清除率每分钟
碳青霉烯类的适应证和注意事项
碳青霉烯类的适应证和注意事项 碳青霉烯类抗菌药物分为具有抗非发酵菌和不具有抗非发酵菌两组,前者包括亚胺培南/西司他丁(西司他丁具有抑制亚胺培南在肾内被水解作用)、美罗培南、帕尼培南/倍他米隆(倍他米隆具有减少帕尼培南在肾内蓄积中毒作用)、比阿培南和多立培南;后者为厄他培南。亚胺培南、美罗培南、帕尼培南、比阿培南等对各种革兰阳性球菌、革兰阴性杆菌(包括铜绿假单胞菌、不动杆菌属)和多数厌氧菌具强大抗菌活性,对多数β-内酰胺酶高度稳定,但对甲氧西林耐药葡萄球菌和嗜麦芽窄食单胞菌等抗菌作用差。厄他培南与其他碳青霉烯类抗菌药物有两个重要差异:血半衰期较长,可一天一次给药;对铜绿假单胞菌、不动杆菌属等非发酵菌抗菌作用差。 近年来非发酵菌尤其是不动杆菌属细菌对碳青霉烯类抗菌药物耐药率迅速上升,肠杆菌科细菌中亦出现部分碳青霉烯类耐药,严重威胁碳青霉烯类抗菌药物的临床疗效,必须合理应用这类抗菌药物,加强对耐药菌传播的防控。 【适应证】 1.多重耐药但对本类药物敏感的需氧革兰阴性杆菌所致严重感染,包括肺炎克雷伯菌、大肠埃希菌、阴沟肠杆菌、柠檬酸菌属、粘质沙雷菌等肠杆菌科细菌、铜绿假单胞菌、不动杆菌属等细菌所致血流感染、下呼吸道感染、肾盂肾炎和复杂性尿路感染、腹腔感染、盆腔感染等;用于铜绿假单胞菌所致感染时,需注意在疗程中某些菌株可出现耐药。厄他培南尚被批准用于社区获得性肺炎的治疗。 2.脆弱拟杆菌等厌氧菌与需氧菌混合感染的重症患者。 3.病原菌尚未查明的免疫缺陷患者中重症感染的经验治疗。 4.美罗培南、帕尼培南/倍他米隆则除上述适应证外,尚可用于年龄在 3 个月以上的细菌性脑膜炎患者。 【注意事项】 1.禁用于对本类药物及其配伍成分过敏的患者。 2.本类药物不宜用于治疗轻症感染,更不可作为预防用药。 3.本类药物所致的严重中枢神经系统反应多发生在原本患有癫痫等中枢神经系统疾病患者及肾功能减退患者未减量用药者,因此在上述基础疾病患者应慎用本类药物。中枢神经系统感染患者不宜应用亚胺培南/西司他丁,有指征可应用美罗培南或帕尼培南/倍他米隆时,仍需严密观察抽搐等严重不良反应。 4.肾功能不全者及老年患者应用本类药物时应根据肾功能减退程度减量用药。 5.碳青霉烯类抗菌药物与丙戊酸或双丙戊酸联合应用,可能导致后两者血药浓度低于治疗浓度,增加癫痫发作风险,因此不推荐本品与丙戊酸或双丙戊酸联合应用。
碳青霉烯类抗菌药物临床应用
1.碳青霉烯类抗菌药物临床应用专家共识 2.碳青霉烯类抗菌药物临床应用评价细则 3.替加环素临床应用评价细则 附件1 碳青霉烯类抗菌药物临床应用 专家共识 近年来,我国碳青霉烯类抗菌药物在临床应用中出现了一些不合理现象,部分细菌对其耐药性呈明显上升趋势。经相关领域专家多次研究论证,对碳青霉烯类抗菌药物的临床应用达成以下共识。 一、碳青霉烯类抗菌药物在治疗感染性疾病中发挥着重要作用 碳青霉烯类抗菌药物的抗菌谱广、抗菌活性强,对需氧、厌氧菌均具有抗菌作用,特别是对多重耐药革兰阴性杆菌,如产超广谱β—内酰胺酶(ESBL)肠杆菌科细菌具很强抗菌活性。该类药物的临床适应证广,在多重耐药菌感染、需氧菌与厌氧菌混合感染、重症感染及免疫缺陷患者感染等的抗菌治疗中发挥着重要作用。 目前我国上市的碳青霉烯类抗菌药物有5个品种:亚胺培南、美罗培南、帕尼培南、比阿培南和厄他培南。厄他培南抗菌谱相对较窄,对铜绿假单胞菌、不动杆菌等非发酵糖细菌抗菌作用差;其他4个品种的药效学特性相仿。亚胺培南、帕尼培南分别与西司他丁及倍他米隆组成合剂,后二者分别为肾脱氢肽酶抑制剂及近端肾小管有机阴离子输送系统抑制剂,并不起到抗菌作用。 二、碳青霉烯类抗菌药物临床应用存在的问题 (一)碳青霉烯类抗菌药物临床使用量逐年上升。全国抗菌药物临床应用监测网数据显示,自2011年我国开展抗菌药物临床应用专项整治以来,我国住院患者抗菌药物使用率由2011年的59.4%降至2017年的36.8%,抗菌药物使用强度同期由85.1 DDDs/100人·天降至49.7 DDDs/100人·天。多数类别抗菌药物包括第三代头孢菌素、喹诺酮类的使用强度均呈下降趋势,而同期该监测网中心成员单位的碳青霉烯类抗菌药物使用强度由1.83 DDDs/100人·天上升至3.28 DDDs/100人·天。在部分地区存在个别品种应用过多或上升过快的现象。 碳青霉烯类抗菌药物使用量增加的主要原因:1.多重耐药菌感染患者增多。近年来,全球范围内临床分离细菌对抗菌药物的耐药性总体呈上升趋势,因而选择该类药物的几率增加。2.免疫缺陷/免疫抑制治疗患者增多。3.部分医务人员临床应用不合理。 (二)革兰阴性杆菌对碳青霉烯类抗菌药物耐药呈上升趋势。全国细菌耐药监测网显示,2017年全国碳青霉烯类耐药肺炎克雷伯菌的检出率平均为9.0%,较2014年上升了2.6个百分点,个别省份检出率最高达到26.9%。老年、儿童和成人患者碳青霉烯类耐药肺炎克雷伯菌的检出率依次为10.2%、9.1%和7.8%。碳青霉烯耐药鲍曼不动杆菌(CRAB)的检出率持续较高,2017年全国平均检出率为56.1%,个别省份检出率最高达到80.4%。 三、碳青霉烯类抗菌药物临床应用的专家建议 (一)严格掌握药物临床应用适应证。《抗菌药物临床应用指导原则(2015年版)》明确碳青霉烯类抗菌药物临床应用适应证:多重耐药但对本类药物敏感的需氧革兰阴性杆菌所致严重感染;脆弱拟杆菌等
