结核感染药物治疗中耐药突变基因检测结果分析

基因突变的检测方法
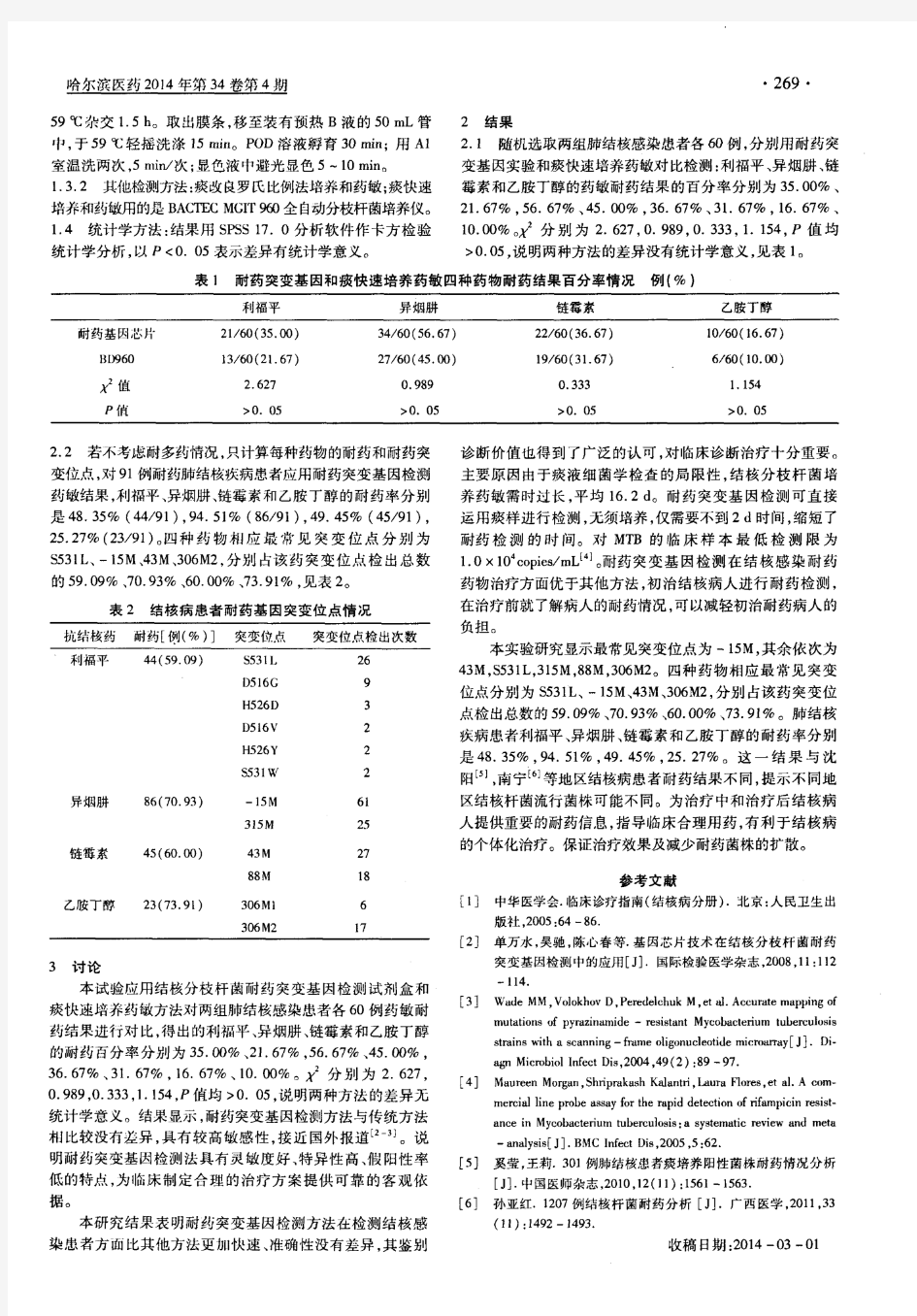
基因突变的检测方法 基因突变的研已成为当今生命科学研究的热点之一,检测方法也随之迅速发展。人类细胞癌基因的突变类型已如上所述,对于基因突变的检测,1985以前,利用Southern印迹法,可以筛选出基因的缺失、插入和移码重组等突变形式。对于用该法法不能检测的突变,只能应用复杂费时的DNA序列测定分析法。多聚酶链反应(polymerase chain reaction,PCR)技术是突变研究中的最重大进展,使基因突变检测技术有了长足的发展,目前几乎所有的基因突变检测的分子诊断技术都是建立于PCR的基础之上,并且由PCR衍生出的新方法不断出现,目前已达二十余种,自动化程度也愈来愈高,分析时间大大缩短,分析结果的准确性也有很大很提高。其中包括单链构象多态性(single-strand comformational polymorphism,SSCP)和异源双链分析法(heteroduplex analysis,HA)。下面分别介绍几种PCR衍生技术及经典突变检测方法,可根据检测目的和实验室条件选择时参考。 PCR-SSCP法 PCR-SSCP法是在非这性聚丙烯酰胺凝胶上,短的单链DNA和RNA分子依其大街基序列不同而形成不同构象,一个碱基的改变将影响其构象而导致其在凝胶上的移动速度改变。其基本原理为单链DNA在中性条件下会形成二级结构,这种二级结构依赖于其碱基组成,即使一个碱基的不同,也会形成不同的二级结构而出刺同的迁移率。由于该法简单快速,因而被广泛用于未知基因突变的检测。用PCR-SSCP法检测小于200bp的PCR产物时,突变检出率可达70%-95%,片段大于400bp时,检出率仅为50%左右,该法可能会存在1%的假阳性率。应用PCR-SSCP法应注意电泳的最佳条件,一般突变类型对检测的灵敏度无大的影响,同时该法不能测定突变的准确位点,还需通过序列分析来确定。Sarkar等认为对于大于200bp的片段,用其RNA分子来做SSCP会提高其录敏度。应用PCR-SSCP检测点突变已见报道于人类大部分的肿瘤组织或细胞,如乳腺癌、食管癌、肺癌、胃癌、肝癌、胰腺癌等。检测的基因包括多种癌基因及抑癌基因,也是检测抑癌基因p53突变最常用的方法,仅检测第5-8外显子即可发现85%以上的p53基因突变。由于该法简便快速,特别适合大样本基因突变研究的筛选工作。 异源双链分析法(HA) HA法直接在变性凝胶上分离杂交的突变型一野生型DNA双链。由于突变和野生型DNA形成的异源杂合双链DNA在其错配处会形成一突起,在非变性凝胶中电泳时,会产生与相应的同源双DNA不同的迁移率。该法与SSCP相似,所不同的是SSCP分离的是单链DNA,HA法分离的是双链DNA,也只适合于小片段的分析。但HA对一些不能用SSCP 检出的突变有互补作用,两者结合使用,可使突变检出率提高到近100%。
结核分枝杆菌耐药分析与基因检测分析
结核分枝杆菌耐药分析与基因检测分析 目的探讨结核分枝杆菌耐药情况及基因检测分析。方法从2012年3月~2014年3月我院收治的结核病患者中选取62例为研究对象,按随机数字法对患者进行分组,首次诊治患者39例为观察组,首次诊治失败后行第二次治疗患者23例为对照组,对所有患者结核分枝杆菌进行耐药分析及rpsL、rpoB、embB、KatG基因检测。结果62例患者中共19例出现耐药,耐药率为30.65%,对照组患者1种药物耐药率为26.09%,同观察组10.26%比较,差异有统计学意义(P <0.05),2种药物耐药率为17.39%,同观察组7.69%比较,差异有统计学意义(P<0.05),3种药物耐药率为8.70%,同观察组比较,差异有统计学意义(P <0.05);rpsL、rpoB、embB、KatG基因突变率分别为83.33%,86.11%,88.89%,91.67%,x2检验显示,差异无统计学意义(P>0.05)。结论结核分枝杆菌耐药的产生同菌株基因具有较大关联,且耐药率同治疗次数有关,在结核病临床治疗中,需根据患者耐药情况,选择联合用药方案,提高治疗效果。 [Abstract] Objective To investigate the analysis in drug resistance of bacteriology tuberculosis and genetic testing. Methods 62 cases of TB patients from March 2012 to March 2014 in our hospital were selected as the objects,and allocated into an observation group and a control group according to the randomly grouping method,first diagnosis and treatment in 39 patients in the observation group,first diagnosis and treatment failure underwent secondary treatment of 23 patients in the control group,all patients were resistant Bacteriology tuberculosis was analyzed and rpsL,rpoB,embB,KatG genetic were tested. Results 62 cases of patients with 19 cases of drug resistance,the drug resistance rate was 1,the control group of patients with 26.09% was compared with the control group(10.26%),(P<0.05),2 drug resistance rate was 17.39% and 7.69%,the differences were significant (P<0.05),3 drug resistance rate was 8.70%,compared with the observation group,the difference was statistically significant (P<0.05);rpoB,embB,rpsL,KatG gene mutation rate was 86.11%,88.89%,91.67%,83.33%,x2 test showed no statistical significance (P>0.05). Conclusion The generation of drug-resistant Bacteriology tuberculosis strains with genes associated with a larger,and the number of drug-related rates with treatment in the clinical treatment of tuberculosis,to be based drug resistance in patients choose combination therapy programs,improve the therapeutic effect. [Key words] Bacteriology tuberculosis;Drug resistance;Gene;Detect 重大传染性疾病对于人们健康及社会稳定均具有较大危害,因此,对其进行快速诊断历来为人类生存发展所必须。自1882年发现结核分枝杆菌以来,结核病便成为严重影响患者健康的重要传染疾病。世界卫生组织1993年称“全球结核病处于紧急状态”,1998年称“遏制结核病行动刻不容缓,1999年数据显示[1],全世界每年因结核病死亡人数高达300万,是其他传染病死亡人数之和;世界卫生组织(WHO)将结核病与艾滋病、疟疾列为21世纪人类需要攻克的三大传染
细菌耐药性检测方法
细菌耐药性检测方法 1、细菌耐药表型检测:判断细菌对抗菌药物的耐药性可根据 NCCLS 标准,通过测量纸片 扩散法、肉汤稀释法和 E 试验的抑菌圈直径、 MIC 值和 IC 值获得。也可通过以下方法进行 检测: (1)耐药筛选试验:以单一药物的单一浓度检测细菌的耐药性被称为耐药筛选试验,临床 上常用于筛选耐甲氧西林葡萄球菌、 万古霉素中介的葡萄球菌、 耐万古霉素肠球菌及氨基糖 苷类高水平耐药的肠球菌等。 ( 2)折点敏感试验:仅用特定的抗菌药物浓度(敏感、中介或耐药折点 MIC ),而不使用 测定 MIC 时所用的系列对倍稀释抗生素浓度测试细菌对抗菌药物的敏感性,称为折点敏感 试验。 (3)双纸片协同试验:双纸片协同试验是主要用于筛选产超广谱B 兰 阴性杆菌的纸片琼脂扩散试验。若指示药敏纸片在朝向阿莫西林 扩大现 象(协同),说明测试菌产生超广谱B -内酰胺酶 ( 4)药敏试验的仪器化和自动化:全自动细菌鉴定及药敏分析仪如: Microscan 等运用折点敏感试验的原理可半定量测定抗菌药物的 MIC 值。 2.B -内酰胺酶检测: 主要有碘淀粉测定法 ( iodometric test )和头孢硝噻吩纸片法 ( nitrocefin test )。临床常用头孢硝噻吩纸片法,B -内酰胺酶试验可快速检测流感嗜血杆菌、淋病奈瑟 菌、卡他莫拉菌和肠球菌对青霉素的耐药性。如B -内酰胺酶阳性,表示上述细菌对青霉素、 氨苄西林、 阿莫西林耐药; 表示葡萄球菌和肠球菌对青霉素 (包括氨基、 羧基和脲基青霉素) 耐 药。 3.耐药基因检测:临床可检测的耐药基因主要有:葡萄球菌与甲氧西林耐药有关的 MecA 基因,大肠埃希菌与B -内酰胺类耐药有关的 blaTEM 、blaSHV 、blaOXA 基因,肠球菌与万古 霉素耐药有关的 vanA 、 vanB 、 vanC 、 vanD 基因。检测抗菌药物耐药基因的方法主要有: PCR 扩增、PCR-RFLP 分析、PCR-SSCP 分析、PCR-线性探针分析、生物芯片技术 、自动 DNA 测序 4.特殊耐药菌检测 (1 )耐甲氧西林葡萄球菌检测:对 1u g 苯唑西林纸片的抑菌圈直径W 10伽,或其MIC > 4u g/ml 的金黄色葡萄球菌和对 1u g 苯唑西林纸片的抑菌圈直径W 17 mm,或MIC > 0.5u g/ml 的凝固酶阴性葡萄球菌被称为耐甲氧西林葡萄球菌( MRS )。对MRS 不论其体外药敏试验 结果,所有的B -内酰胺类药物和B -内酰胺/B -内酰胺酶抑制剂均显示临床无效;绝大多数 的 MRS 常为多重耐药,耐药范围包括氨基糖甙类、大环内酯类、四环素类等。 (2) 耐青霉素肺炎链球菌检测:当对 1u g 苯唑西林纸片抑菌圈直径〈20 mm 或MIC > 0.06 u g/ml 均应视为耐青霉素肺炎链球菌 (PRSP )。临床治疗显示 PRSP 对氨卞西林、氨卞西林 /舒巴坦、头胞克肟、头胞唑肟,临床治疗疗效很差,但应检测对头胞曲松、头胞噻肟和美 洛培南等的 MIC 以判断是否对这些抗生素敏感。 (3) 耐万古霉素肠球菌检测: 肠球菌对30 g 万古霉素纸片抑菌圈直径W 14 mm 或MIC > 32 u g/ml 被称为耐万古霉素肠球菌(VRE )。针对多重万古霉素药物目前尚无有效治疗方法, 但对青霉素敏感的 VRE 可用青霉素和庆大霉素联合治疗,若对青霉素耐药而不是高水平耐 氨基糖甙类可用壁霉素 +庆大霉素。 (4) 产超广谱B -内酰胺酶的肠杆菌科细菌检测: 超广谱B -内酰胺酶是一种能水解青霉素、 -内酰胺酶(ESBLs )革 /克拉维酸方向有抑菌圈 Vitek-2 、BD-Pheonix 、
利福平和异烟肼耐药基因突变快速检测方法在结核病中的应用
龙源期刊网 https://www.360docs.net/doc/562232737.html, 利福平和异烟肼耐药基因突变快速检测方法在结核病中的应用 作者:辛宝林于秀坤 来源:《中国实用医药》2016年第09期 【摘要】目的探讨利福平和异烟肼耐药基因突变采用PCR线性杂交酶显色法建立快速检测方法的应用价值。方法 88份送检的结核病患者临床标本,得结核分枝杆菌分离株64株, 采用PCR线性杂交酶显色法建立利福平和异烟肼耐药基因突变快速检测方法进行检测,同时采用比例法检测,并以比例法为标准评价快速检测方法的诊断价值。结果快速检测方法中对利福平耐药24份,仅对异烟肼耐药24份,对利福平和异烟肼均耐药22份,不耐药18份。以耐药不耐药作为分割点,比例法药敏试验结果为参考标准,快速检测方法的灵敏度 100.0%,特异度90.0%,准确度97.7%;两种检验方法一致性好(P>0.05)。结论 PCR线性杂交酶显色法建立快速检测方法可在12 h内对利福平和异烟肼耐药基因突变的作出判断,与比例法药敏试验一致性好,可信度高,值得临床推广。 【关键词】利福平;异烟肼;耐药;基因突变;结核分枝杆菌;快速检测 DOI:10.14163/https://www.360docs.net/doc/562232737.html,ki.11-5547/r.2016.09.115 利福平和异烟肼是结核病的最重要的一线抗结核药物[1]。近年来结核分枝杆菌基因突变 发生耐药的情况也时有发生,世界卫生组织报道每年有新增48.9万例耐多药结核病,其总量占结核病患者的4.8%,而在我国则更为严重。耐多药结核病的早期确诊有利于患者的病情控制,比例法药敏试验虽然结果可靠,且被公认为判断结核分枝杆菌耐药的金标准,但该方法需要细菌培养,耗时2~4个月,易贻误病情。随着分子生物学的飞速发展,为结核分枝杆 菌耐药性快速检测提供可能。本中心采用PCR线性杂交酶显色法建立利福平和异烟肼耐药基因突变快速检测方法对送检的疑似耐药结核病患者临床标本进行检测,并将结果与比例法药 敏试验进行分析,现报告如下。 1 材料与方法 1. 1 材料取2013年10月~2015年5月送检的疑似耐药结核病患者临床标本88份,其中痰65份,肺泡灌洗23份。 1. 2 去污染处理将1~2倍于痰及肺泡灌洗液样本的4%NaOH放置于样本中,震荡混匀,静置20 min,再将pH=6.8的磷酸缓冲液加入样本中, 3000 r/min离心1 min,沉淀后去除上清液,将1 ml磷酸缓冲液加入其中,混匀,获得去污染样本。 1. 3 方法
乙型肝炎病毒耐药基因及分型检测
乙型肝炎现状如何? 乙型病毒性肝炎是由乙肝病毒(hepatitis B virus,HBV)感染引起的、以肝脏炎性病变为主,并可引起多器官损害的一种疾病,主要存在于肝细胞内,可引起肝细胞炎症、坏死和纤维化。 乙型肝炎病毒(HBV)感染呈世界性分布,全球约有3.6亿感染者,每年约有100万人死于与HBV相关的肝脏疾病。我国属于感染的高发区,现有的慢性HBV感染者约9300万例。 乙型肝炎病毒(HBV)基因分型的临床意义 HBV根据DNA差异可分为A、B、C、D、E、F、G、H八种类型,不同型别在流行特征,致病性,对药物治疗反应等方面存在差异,其中,我国以B型和C型为主,感染HBV基因型B的患者发生肝纤维化及肝细胞癌的平均年龄要比感染HBV基因型C的患者的年龄大。 通过分型检测,可判断病毒复制活跃程度及突变发生率情况。研究表明,与HBV-B型相比,C型复制较活跃,不易发生HBeAg血清转换;HBV-B型易产生前C区突变,C型核心启动子区变异发生率更高,与重型肝炎发病机制密切相关,可作为肝癌高危指标之一。同时,HBV-B、C型患者易产生拉米夫定耐药突变,通过分型检测,可指导临床治疗方案制定,有针对性进行临床治疗,更大程度上提高患者的生活质量。 乙肝的治疗方式有哪些? HBV感染主要的治疗方法是抗病毒治疗,国内外普遍使用的药物有干扰素和核苷(酸)类。由于干扰素需要反复注射,且副作用较多,近年来,核苷(酸)类似物(NA)已成为抗HBV感染的主要方法之一,NA因其抑制病毒复制能力强、使用方便、耐受性好且疗效确切,适用于不同阶段的肝病患者,是长期治疗的合理选择。但随着治疗时间的延长,往往会出现病毒耐药株,从而需要监测乙型肝炎病毒耐药基因型,指导临床用药。 乙肝病毒产生耐药的机理是什么? HBV对某种药物的耐药性一般是指由HBV基因组上某些位点的变异导致这种药物对HBV的抑制作用减弱或无作用。通常分为以下几种: (1)原发性耐药变异:指药物作用靶位的基因及其编码的氨基酸发生变异,导致变异病毒株对治疗药物的敏感度下降; (2)继发性耐药变异(又称补偿性耐药变异):指由于原发性耐药变异病毒株复制能力下降,在原发性耐药变异的基础上,病毒株也可在其他位点发生变异,这些变异可部分恢复变异病毒的复制能力或可导致变异病毒对药物敏感度的进一步下降; (3)基因型耐药:指检测到已在体外的表型分析研究中被证实与抗病毒药物耐药相关的HBV变异;(4)表型耐药:通过体外复制系统证实检测到的HBV变异会降低其对抗病毒药物的敏感度。 HBV属于嗜肝DNA病毒科,基因组长约3.2kb,是部分双链环状DNA结构。HBV基因组含有4个部分重叠的开放读框(open reading frame,ORF),分别为S基因区、C基因区、P基因区和x基因区。产物为含末端蛋白、间隔区、逆转录酶区和RNA酶H区4部分的HBV聚合酶。 HBV虽然属于DNA病毒,但其复制过程并非DNA—DNA的直接复制过程,而是经过前基因组RNA的中间过程,即DNA—RNA—DNA的复制过程。在前基因组RNA逆转录为负链DNA的过程中,HBV逆转录酶由于缺乏严格的校正机制,导致HBV复制过程中核苷酸错配率较高,发生变异的频率为每年(1.4~3.2)X105核苷酸替换/位点。HBV复制的这种过程和特点,决定了同一患者体内不同的HBV株基因序列之间也存在差别。 核苷(酸)类药物主要通过抑制HBV聚合酶的逆转录酶区活性,阻止HBV复制过程中以HBV的前基因组RNA为模板逆转录生成新的病毒DNA,从而发挥抑制病毒复制的作用,HBV前基因组RNA是以HBV 的cccDNA为模板合成的,即NA的药效靶点在cccDNA的下游,所以NA不能直接清除已经存在的cccDNA。
扬州市结核分枝杆菌利福平耐药基因突变分析
扬州市结核分枝杆菌利福平耐药基因突变分析 发表时间:2019-05-28T10:05:48.223Z 来源:《医药前沿》2019年9期作者:戴洁1 曾方林1 王金富(通讯作者)1,2 [导读] 目的:了解本地区结核分枝杆菌利福平耐药基因的突变特征。 (1扬州市第三人民医院江苏扬州 225025)(2扬州大学人兽共患病学重点实验室江苏扬州 225002)【摘要】目的:了解本地区结核分枝杆菌利福平耐药基因的突变特征。方法:利用基因芯片检测346例经鉴定为结核分枝杆菌的菌株利福平耐药基因,分析本地区利福平耐药基因突变特征。结果:346例结核分枝杆菌中利福平耐药基因发生突变的例数为58例(16.7%)。利福平rpoB基因耐药位点分布如下:531位点为58.6%,526位点为31.1%,511位点为6.9%,516位点为3.4%。结论:本地区MTB对利福 平耐药rpoB基因耐药位点以531位点最多,526位点次之。 【关键词】结核分枝杆菌;基因突变;利福平【中图分类号】R96 【文献标识码】A 【文章编号】2095-1752(2019)09-0223-02 利福平(RFP)是从利福霉素B得到的一种半合成抗生素,能抑制细菌DNA转录合成RNA,达到杀菌作用。绝大多数的RFP耐药相关基因是rpoB(RNA聚合酶 β亚基),rpoB基因的突变会引起RFP与细菌RNA聚合酶的亲和力降低,导致细菌对RFP耐药[1]。rpoB基因的突变主要是密码子507到533(RNA聚合酶(rpoB)β-亚单位的81-by)热点区域。514位和533位密码子突变是引起低水平耐药的常见突变位点。D516V,H526Y, H526D,S531L,这4个位点的突变是引起高水平耐药的常见突变[2]。某些密码子突变引起的rpoB基因突变并不会导致细菌对RFP耐药。本研究利用基因芯片技术对扬州地区结核分枝杆菌RFP耐药基因突变位点特征进行了分析,现报道如下。 1.资料与方法 1.1 一般资料 收集我院2017年经传统固体培养,并经鉴定为结核分枝杆菌的菌株共346例。 1.2 仪器与试剂 仪器:基因芯片仪器、试剂由北京博奥生物有限公司提供;固体培养和药敏试剂由珠海贝索生物有限公司提供。基因芯片检测RFP rpoB基因6个位点,共13种突变型:511位CTG→CCG,513位CAA→CCA、CAA→AAA,516位GAC→GTC、GAC→TAC、GAC→GGC,526位CAC→GAC、CAC→TAC、CAC→CTC、CAC→CGC,531位TCG→TTG、TCG→TGG,533位CTG→CCG。 1.3 方法 1.3.1痰液化处理将痰标本用4%的氢氧化钠(NaOH)溶液液化,液化好的上清液用于接种固体培养基和核酸提取。 1.3.2传统培养及鉴定培养严格按《结核病实验室检测操作规程》的要求进行,采用PNB和TCH进行鉴定,并定期用H37RV进行质控。 1.3.3核酸提取煮沸法提取核酸。 1.3.4基因芯片核酸进行PCR扩增,产物用杂交缓冲液处理后进行杂交,再用芯片洗干仪进行洗涤和甩干,最后用芯片判别系统进行扫描和结果判读,并详细记录芯片信息判读结果。 2.结果 346例结核分枝杆菌中耐利福平例数为58例(16.7%)。 58例利福平耐药标本中,RFP耐药相关基因rpoB基因的531(TCG→TTG)突变位点为34例(58.6%),526(CAC→TAC)突变位点为12例(20.7%),526(CAC→CGC)突变位点为5例(8.6%),526(CAC→GAC)突变位点为1例(1.7%),516(GAC→GTC)突变位点为1例(1.7%),516(GAC→TAC)突变位点为1例(1.7%),511(CTG→CCG)突变位点为4例(7.0%)。 3.讨论 MTB耐药性的增加,导致耐药结核病感染率逐年上升,加大了结核病防治的难度。许多研究表明,耐药基因突变导致是导致MTB耐药的主要原因,通过检测相关耐药基因是否发生突变,从而可推断该MTB是否发生耐药。基因芯片技术是近些年比较流行的一种基因检测的分子技术,其通过PCR技术对待测菌的基因片段进行扩增,将扩增片段与芯片杂交,即可得到基因突变位点和突变类型。该法具有快速、高通量、灵敏等特点[3],近来在MTB耐药检测中应用广泛,我们前期的研究[4]也验证了基因芯片在MTB异烟肼耐药检测中具有较好的应用效能。 RFP主要作用于结核分枝杆菌DNA依赖的RNA聚合酶的β亚单位,干扰转录的开始及RNA延伸,发挥抑菌和杀菌作用。绝大多数MTB 对RFP产生耐药是由于rpoB基因507-533位发生了突变。rpoB基因507-533位区域称为利福平耐药决定区(RRDR),约85%的耐药菌株出现531位Ser位点、526位His和516位Asp的变异。本次实验采用博奥公司生产的结核分枝杆菌耐药试剂盒检测rpoB基因RRDR的531、526、516、511、533位密码子,结果显示扬州地区531、526突变位点为优势突变位点,其中531位占58.6%,526位占31.0%,最常见突变位点为531(TCG→TTG)突变位点(58.6%)和526(CAC→TAC)突变位点(20.7%),与相关文献结果相似[5,6]。 另外据相关报道最近在RFP 耐药菌株中发现了两个新的rpo B突变(Ser531Gly和 Asp516Thr),以及一个不属于rpo B基因的突变位点(Ile572Phe)[7]。然而博奥结核分枝杆菌耐药检测试剂无法包含上述所有突变基因和突变形式,在检测的结果中,有可能出RFP实际上耐药而结果敏感的情况,因此该方法检测的RFP敏感只能作为参考,并不能明确诊断,是该方法的缺点。 【参考文献】 [1] Cohen K, van Cutsem G, Boulle A, et al. Effect of rifampicin-based antitubercular therapy on nevirapine plasma concentrations in South African adults with HIV-associated tuberculosis [J].Antimicrob Chemother,2008,61(2):389-393. [2] Madania A,Habous M,Zarzour H,et al.Characterization of mutadons causing rifampicin and isoniazid resistance of Mycobacterium tubercul-osis in Syria[J].Pol J microbiol, 2012,61(1):23-32. [3] MOSTREM P,GORDON M,SOLA C,et al.Methods used in the molecular epidemiology of tuberculosis[J].Clinical Microbiology Infection,2002,8(11):694-704.
结核分枝杆菌常见耐药基因突变的检测与分析
分类号:R 378.91+1 密级:一般 U D C :616-093 编号:2010212554 广州医学院 硕士学位论文 结核分枝杆菌常见耐药基因突变的检测与分析 研究生:杨辉 导师:吴爱武教授 陈心春教授 申请学位级别:医学硕士年级:二零一零级 学科专业:临床检验诊断学研究方向:感染与免疫 论文提交日期:2013年5月论文答辩日期:2013年6月 学位类型:医学科学学位学位授予单位:广州医学院 答辩委员会主席: 评议人: 二0一三年三月
广州医学院 硕士研究生学位论文 结核分枝杆菌常见耐药基因突变的检测与 分析 Detection and evaluation of common drug-resistance gene mutations in Mycobacterium tuberculosis 专业名称: 临床检验诊断学 研究生: 杨辉 导师: 吴爱武教授 陈心春教授 二0一三年三月·广州
目录 中文摘要~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~1 英文摘要~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~4 英文缩略词~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~ 7 前言~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~8 第一部分利福平耐药结核分枝杆菌rpoB 基因的检测与分析~~~~~~~~~~~~ 11 1.材料和方法~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~ 11 2.结果~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~16 3.讨论~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~18 4.小结~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~20 第二部分异烟肼耐药结核分枝杆菌相关耐药基因的检测与分析~~~~~~~~~~~21 1.材料和方法~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~ 21 2.结果~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~27 3.讨论~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~30 4.小结~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~31 第三部分HRMA技术检测结核分枝杆菌利福平与异烟肼耐药~~~~~~~~~~~~ 32 1.材料和方法~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~ 32 2.结果~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~36 3.讨论~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~42 4.小结~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~44 全文总结~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~ 45 参考文献~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~ 46 综述~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~51 附录~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~59 攻读学位期间取得研究成果~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~ 61 致谢~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~63 学位原创性声明~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~64 学术论文知识产权声明~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~64 关于学术论文使用授权的说明~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~64
HBV耐药基因突变检测
HBV耐药基因突变检测 项目简介:HBV是一种经血液传播的嗜肝DNA病毒,是导致慢性肝炎、肝硬化和肝癌的重要因素。抗病毒治疗是最常见的乙肝治疗方式。国内外公认的抗病毒药物主要有干扰素和核苷(酸)类药物两类。核苷(酸)类药物因口服方便、毒副作用少、病毒载量下降较快而受到广泛关注。 长期服用核苷(酸)类药物易产生耐药。在用药过程中,患者体内HBV DNA及谷丙转氨酶(ALT)逐渐下降,继而达到一个平稳期,患者病情减轻。此时,HBV很难被完全清除,而是处于一个低复制非活动时期。随着用药时间的延长,对药物敏感的野生株数量下降,具有耐药突变的变异株因对药物不敏感,而得以不断复制、增加,从而导致HBV DNA及ALT重新上升,使得肝炎复发。耐药发生的直接后果即为药物疗效的降低和丧失,具体表现为肝炎复发、肝病急性加重、肝硬化,甚至出现肝衰竭。 乙型肝炎病毒耐药是指在核苷酸类似物作用下,药物靶乙型肝炎病毒 P 基因中的某些位点发生改变,导致这种药物对乙型肝炎病毒的抑制作用下降或消失。自拉米夫定上市以来,目前经美国FDA 批准先后上市的核苷酸类似物有阿德福韦、恩替卡韦和替比夫定。这些药物作用下出现的病毒耐药均与乙型肝炎病毒 P 基因变异有关。如拉米夫定耐药相关突变位点为D 区M204V/ I、B 区L180M,阿德福韦相关突变位点为D 区N236T、B 区A181V,替比夫定为M204I,L180M,病毒只需要1 个上述位点突变就可发生对这些药物耐药。而对恩替卡韦耐药必须建立在拉米夫定耐药基础上(L180M +M204I/V),同时出现Al84G 或S202I 或M250V 突变。随着用药时间推移,各类核苷酸类似物发生耐药的几率是不尽相同的。其中拉米夫定几率最高,而恩替卡韦由于具有较高耐药基因屏障,所以产生耐药的几率最低,在用药后的4 年内都维持在1.1%。 因此通过检测HBV耐药基因突变点有助于判断治疗的效果、制定个体化抗病毒治疗方案。使用核苷酸药物导致耐药基因突变原理如下图所示。
肿瘤基因检测的解读流程
从临床进入基因检测流程是入口,检测结果结合临床信息进行合理解读是出口,这一入一出之间需经历检测前临床咨询部分、实验室部分、信息分析部分、临床解读部分共四个环节。其中的第四部分临床解读部分即是根据检测结果、患者信息、医生共识综合判断,临床和遗传咨询有效衔接、充分沟通,最终出具临床解读报告。 在做成临床解读报告之前,首先需要将解读的各个环节进行明确,包括解读的步骤流程,解读的技术细节。这样才有可能真正的做到解读的规范化,使解读过程有据可依,有章可循,才能出具一份好的临床解读报告,基因检测才能更好的服务患者和临床医生。从大的框架讲,基因检测数据解读可分为三个步骤:原始数据→分析数据、基于数据库的解读→与患者个体表征/临床病例结合的解读。1、读懂原始数据 将测序的原始序列数据(FASTQ)去除接头及低质量序列,经BWA软件比对至GRCh37/38(NCBI版本)或hg19/hg38(UCSC版本)人类基因组参考序列上,Picard 去除重复序列,使用GATK检测SNV与Indel变异,使用ANNOVAR进行变异注释。最后获得一份.vcf文件(图1)。
Func.refGene:变异所处参考基因的功能区(exonic,intronic,UTR3,UTR5,splicing,upstream,downstream,intergenic)(此处的exonic特指外显子编码氨基酸区,不包括外显子的UTR区) Gene.refGene:变异所处参考基因名称(如果是基因间,则是两侧的基因)GeneDetail.refGene:非外显子区处于特定转录本中的具体位置(如果是基因间,则是距离两侧的基因的距离) ExonicFunc.refGene:外显子区的变异类型(frameshift insertion,frameshiftdeletion,stopgain,stoploss,nonframeshift insertion,nonframeshiftdeletion,synonymous SNV,nonsynonymous SNV),如果这一栏是一个“.”的话,就说明该变异不在外显子区 AAChange.refGene:氨基酸水平的改变(同一个基因可能具有多个转录本,氨基酸改变的位置在不同的转录本中有可能不一样) 经注释后的vcf文件还会包含如下信息: CLINSIG:该变异在ClinVar数据库中的临床意义(Benign,Likely benign,Uncertain significance,Likelypathogenic,Pathogenic,Drug-response)CLINDBN:该变异所引起的疾病名称 CLINACC:该变异的登记号和版本号(VariantAccession and Versions)
结核分支杆菌两种耐药基因的快速检测
结核分支杆菌两种耐药基因的快速检测 近年来,全球结核病呈现死灰复燃的趋势,其主要原因是耐药(DR-TB)和耐多药(MDR-TB)结核病的广泛分布和迅速传播。作为一线抗结核药物,INH和RFP 结核病的预防、治疗方面起着重要作用。但由于单药化疗和不规则化疗,其耐药情况越来越严重。有研究表明结核分杆菌耐异烟肼的产生与过氧化氢酶-过氧化物酶的编码基因KatG基因的缺失和突变有关;而利福平耐药则与RNA聚合酶的p亚基的编码基因rpoB突变有关。我们在用PCR-SSCP方法单独检测KatG 和rpoB基因突变时,发现在非变性聚丙烯酰胺凝胶中,这两种基因的迁移率不同,且差异很大。因此,我们在一个反应中同时扩增KatG和rpoB基因。再根据其SSCP图谱进行分析,这样就可以同时检测异烟肼和利福平耐药性。我们采用PCR-SSCP银染法直接检测临床分离株和临床痰标本中结核分支杆菌rpoB基因和KatG基因突变,现将结果报告如下。 1 资料与方法 1.1 标本来源107株临床分离株和39例肺结核病患者涂阳痰标本均来自吉林市结核病防治研究所。107株临床分离株按结核病诊断细菌学规程进行菌种鉴定及药敏实验证实为结核分支杆菌,其中63例耐RFP,55例耐INH,49例耐SM。65例肺结核病患者涂阳痰标本根据临床症状、涂片结果、胸部X线和培养结果确诊,其中33例耐RFP,27例耐INH,28例耐SM。 1.2 引物序列为 1.3 方法 1.3.1 dNA的提取用传统酚/氯仿抽提法提取标本中DNA。 1.3.2 PCR扩增采用25 μl反应体系,4xdNTPs终浓度为0.2 mmol/L,引物终浓度为0.2 μmol/L,扩增程序为94℃变性1 min,61℃退火1 min,72℃延伸1 min,循环30次,最后72℃延伸10 min。扩增产物经2%琼脂糖凝胶电泳。紫外检测rPOB出现258bp条带、KatG出现282bp条带即为扩增阳性。 1.3.3 SSCP银染PCR扩增阳性的标本进行SSCP检测,扩增产物加等量甲酰胺变性液95℃变性10 min,立即冰浴5 min,在8%非变性聚丙烯酰胺凝胶中电泳,条件为6℃/100V电压,电泳约2~3 h,电泳结束后,取凝胶板经硝酸银染色,观察结果并照相。 2 结果 2.1 61株结核分支杆菌临床分离株中,26株药物敏感株中,各有1株KatG 基因和rpoB基因发生突变。35株同时耐异烟肼和利福平分离株中,有22株有KatG基因突变,突变率62.9%。同时有31株有rpoB基因发生突变,突变率为88.6%。结果见表1。 2.2 用PCR-SSCP技术分析对39例同时耐INH和耐RFP肺结核病患者的痰标本和24例非结核性肺部疾病组痰标本进行rpoB和KatG基因突变的检测。以结核分支杆菌H37RV为对照,39例耐RFP痰标本中31例PCR扩增阳性,其中25例SSCP图谱与H37Rv标准株有差异,rpoB突变率为64.1%。耐INH肺结核病患者的痰标本有28例扩增阳性,17例SSCP图谱与H37Rv标准株有差异,突变率为4 3.5%。24例非结核病患者的痰标本rpoB基因和KatG基因PCR扩增
耐药基因型检测
耐药基因型检测操作规程作业指导书 1目的 本操作规程是关于使用in-house方法进行耐药性检测过程标准操作和结果分析保存的规程。 2适用范围 适用于HIV-1耐药基因型测定。 3职责 在使用in-house方法进行耐药性检测过程中,研究人员必须依照本标准操作规程进行操作。 4作业程序 4.1核酸提取:推荐使用QIAGEN公司QIAamp Viral RNA Mini Kit 提取RNA。 4.2引物 4.2.1 扩增引物 第一轮PCR: 外侧上游引物MAW 26:5’-TTGGAAATGTGGAAAGGAAGGAC-3’; HXB2 2028-2050 外侧下游引物RT21:5’-CTGTA TTTCTGCTA TTAAGTCTTTTGA TGGG-3’; HXB2 3509-3539 第二轮PCR: 内侧上游引物PRO-1 :5’-CAGAGCCAACAGCCCCACCA-3’; HXB2 2147-2166 内侧下游引物RT20 :5’-CTGCCAGTTCTAGCTCTGCTTC-3’; HXB2 3441-3462 4.2.2 测序引物 正向测序引物: PROS3 :5’-GCCAACAGCCCCACCA-3’ RTAS :5’-CTCAGA TTGGTTGCAC-3’ RTBS :5’-CCTAGTATAAACAATGAGACAC-3’; HXB2 2946-2967 反向测序引物: PROC1S :5’-GCTGGGTGTGGTA TTCC-3’ RT20S3 :5’-GTTCTAGCTCTGCTTC-3’ 参照国际标准株HXB2株(全基因1-9719bp)POL基因序列(2253-5096bp),其中蛋白酶(2253-2549bp),逆转录酶基因(2250-4229bp),整合酶基因(4230-5096bp)。我们所使用的方法扩增产物长度为1.3kb,包括蛋白酶基因全长(1-99 codon)和逆转录酶基因前300个氨基酸(1-300 codon)。
基因突变的检测方法(完整资料).doc
此文档下载后即可编辑 基因突变的检测方法 基因突变的检测方法 基因突变的研已成为当今生命科学研究的热点之一,检测方法也随之迅速发展。人类细胞癌基因的突变类型已如上所述,对于基因突变的检测,1985以前,利用Southern印迹法,可以筛选出基因的缺失、插入和移码重组等突变形式。对于用该法法不能检测的突变,只能应用复杂费时的DNA序列测定分析法。多聚酶链反应(polymerase chain reaction,PCR)技术是突变研究中的最重大进展,使基因突变检测技术有了长足的发展,目前几乎所有的基因突变检测的分子诊断技术都是建立于PCR的基础之上,并且 由PCR衍生出的新方法不断出现,目前已达二十余种,自动化 程度也愈来愈高,分析时间大大缩短,分析结果的准确性也有很大很提高。其中包括单链构象多态性(single-strand comformational polymorphism,SSCP)和异源双链分析法(heteroduplex analysis,HA)。下面分别介绍几种PCR衍生技术及经典突变检测方法,可根据 检测目的和实验室条件选择时参考。 PCR-SSCP法PCR-SSCP法是在非这性聚丙烯酰胺凝胶上,短的单链DNA和RNA分子依其大街基序列不同而形成不同构象, 一个碱基的改变将影响其构象而导致其在凝胶上的移动速度改变。其基本原理为单链DNA在中性条件下会形成二级结构,这种二级结构依赖于其碱基组成,即使一个碱基的不同,也会形成不同的二级结构而出刺同的迁移率。由于该法简单快速,因而被广泛用于未知基因突变的检测。用PCR-SSCP法检测小于200bp 的PCR产物时,突变检出率可达70%-95%,片段大于400bp时,检出率仅为50%左右,该法可能会存在1%的假阳性率。应用PCR-SSCP法应注意电泳的最佳条件,一般突变类型对检测的灵敏度无大的影响,同时该法不能测定突变的准确位点,还需通过
细菌耐药性检测方法
细菌耐药性检测方法 1、细菌耐药表型检测:判断细菌对抗菌药物的耐药性可根据NCCLS标准,通过测量纸片扩散法、肉汤稀释法和E试验的抑菌圈直径、MIC值和IC值获得。也可通过以下方法进行检测: (1)耐药筛选试验:以单一药物的单一浓度检测细菌的耐药性被称为耐药筛选试验,临床上常用于筛选耐甲氧西林葡萄球菌、万古霉素中介的葡萄球菌、耐万古霉素肠球菌及氨基糖苷类高水平耐药的肠球菌等。 (2)折点敏感试验:仅用特定的抗菌药物浓度(敏感、中介或耐药折点MIC),而不使用测定MIC时所用的系列对倍稀释抗生素浓度测试细菌对抗菌药物的敏感性,称为折点敏感试验。 (3)双纸片协同试验:双纸片协同试验是主要用于筛选产超广谱β-内酰胺酶(ESBLs)革兰阴性杆菌的纸片琼脂扩散试验。若指示药敏纸片在朝向阿莫西林/克拉维酸方向有抑菌圈扩大现象(协同),说明测试菌产生超广谱β-内酰胺酶 (4)药敏试验的仪器化和自动化:全自动细菌鉴定及药敏分析仪如:Vitek-2、BD-Pheonix、Microscan等运用折点敏感试验的原理可半定量测定抗菌药物的MIC值。 2.β-内酰胺酶检测:主要有碘淀粉测定法(iodometric test)和头孢硝噻吩纸片法(nitrocefin test)。临床常用头孢硝噻吩纸片法,β-内酰胺酶试验可快速检测流感嗜血杆菌、淋病奈瑟菌、卡他莫拉菌和肠球菌对青霉素的耐药性。如β-内酰胺酶阳性,表示上述细菌对青霉素、氨苄西林、阿莫西林耐药;表示葡萄球菌和肠球菌对青霉素(包括氨基、羧基和脲基青霉素)耐药。 3.耐药基因检测:临床可检测的耐药基因主要有:葡萄球菌与甲氧西林耐药有关的MecA 基因,大肠埃希菌与β-内酰胺类耐药有关的blaTEM、blaSHV、blaOXA基因,肠球菌与万古霉素耐药有关的vanA、vanB、vanC、vanD基因。检测抗菌药物耐药基因的方法主要有:PCR扩增、PCR-RFLP分析、PCR-SSCP 分析、PCR-线性探针分析、生物芯片技术、自动DNA 测序 4.特殊耐药菌检测 (1)耐甲氧西林葡萄球菌检测:对 1цg苯唑西林纸片的抑菌圈直径≤10㎜,或其MIC≥4цg/ml的金黄色葡萄球菌和对1цg苯唑西林纸片的抑菌圈直径≤17㎜,或MIC≥0.5цg/ml 的凝固酶阴性葡萄球菌被称为耐甲氧西林葡萄球菌(MRS)。对MRS不论其体外药敏试验结果,所有的β-内酰胺类药物和β-内酰胺/β-内酰胺酶抑制剂均显示临床无效;绝大多数的MRS 常为多重耐药,耐药范围包括氨基糖甙类、大环内酯类、四环素类等。 (2)耐青霉素肺炎链球菌检测:当对1цg苯唑西林纸片抑菌圈直径〈20㎜或MIC〉0.06цg/ml均应视为耐青霉素肺炎链球菌(PRSP)。临床治疗显示 PRSP对氨卞西林、氨卞西林/舒巴坦、头胞克肟、头胞唑肟,临床治疗疗效很差,但应检测对头胞曲松、头胞噻肟和美洛培南等的MIC以判断是否对这些抗生素敏感。 (3)耐万古霉素肠球菌检测:肠球菌对30цg万古霉素纸片抑菌圈直径≤14㎜或MIC≥32цg/ml被称为耐万古霉素肠球菌(VRE)。针对多重万古霉素药物目前尚无有效治疗方法,但对青霉素敏感的VRE可用青霉素和庆大霉素联合治疗,若对青霉素耐药而不是高水平耐氨基糖甙类可用壁霉素+庆大霉素。 (4)产超广谱β-内酰胺酶的肠杆菌科细菌检测:超广谱β-内酰胺酶是一种能水解青霉素、
