各元素熔点表
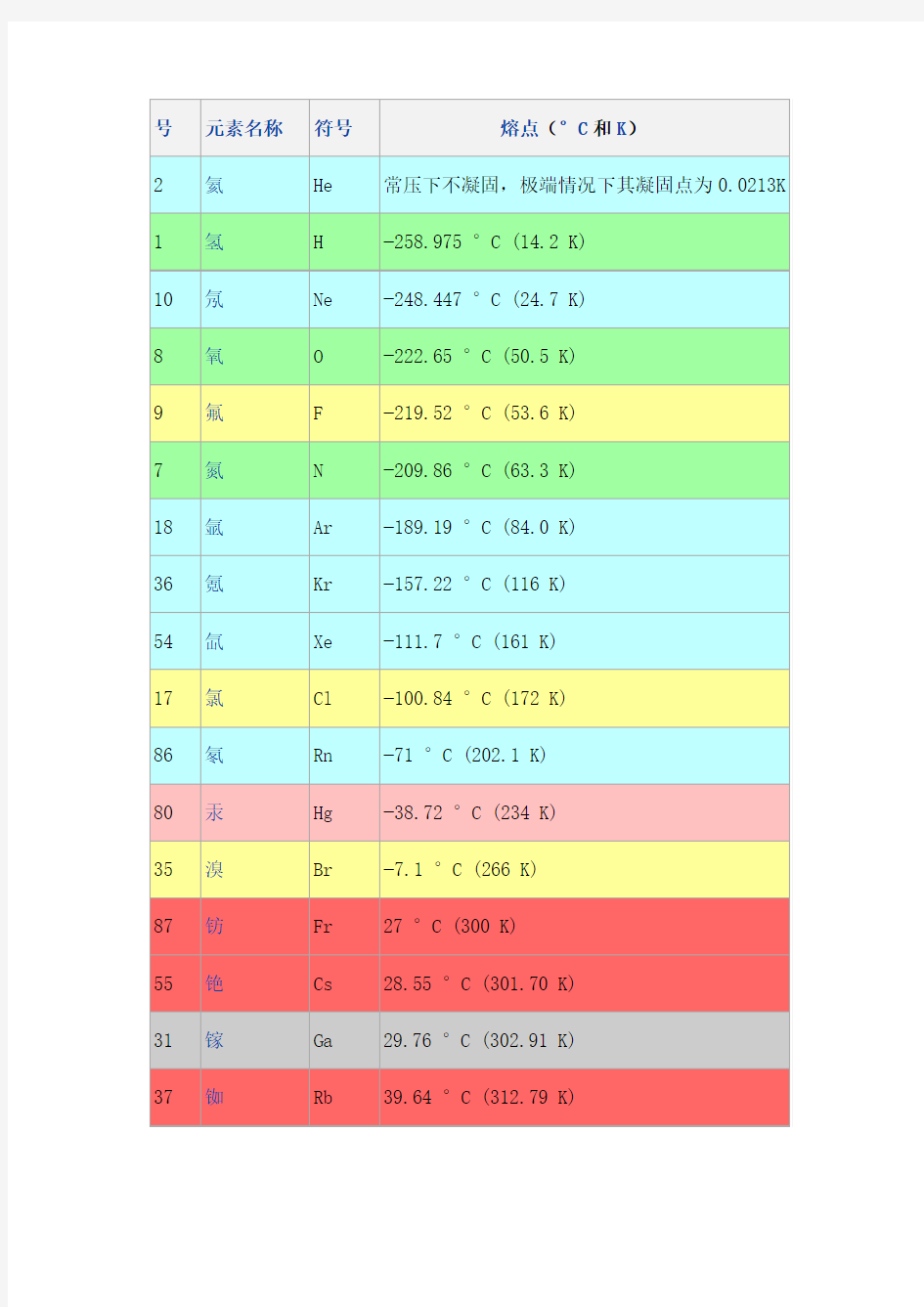
号元素名称符号熔点(°C和K)
2 氦He 常压下不凝固,极端情况下其凝固点为0.0213K 1 氢H ?258.975 °C (14.2 K)
10 氖Ne ?248.447 °C (24.7 K)
8 氧O ?222.65 °C (50.5 K)
9 氟 F ?219.52 °C (53.6 K)
7 氮N ?209.86 °C (63.3 K)
18 氩Ar ?189.19 °C (84.0 K)
36 氪Kr ?157.22 °C (116 K)
54 氙Xe ?111.7 °C (161 K)
17 氯Cl ?100.84 °C (172 K)
86 氡Rn ?71 °C (202.1 K)
80 汞Hg ?38.72 °C (234 K)
35 溴Br ?7.1 °C (266 K)
87 钫Fr 27 °C (300 K)
55 铯Cs 28.55 °C (301.70 K)
31 镓Ga 29.76 °C (302.91 K)
37 铷Rb 39.64 °C (312.79 K)
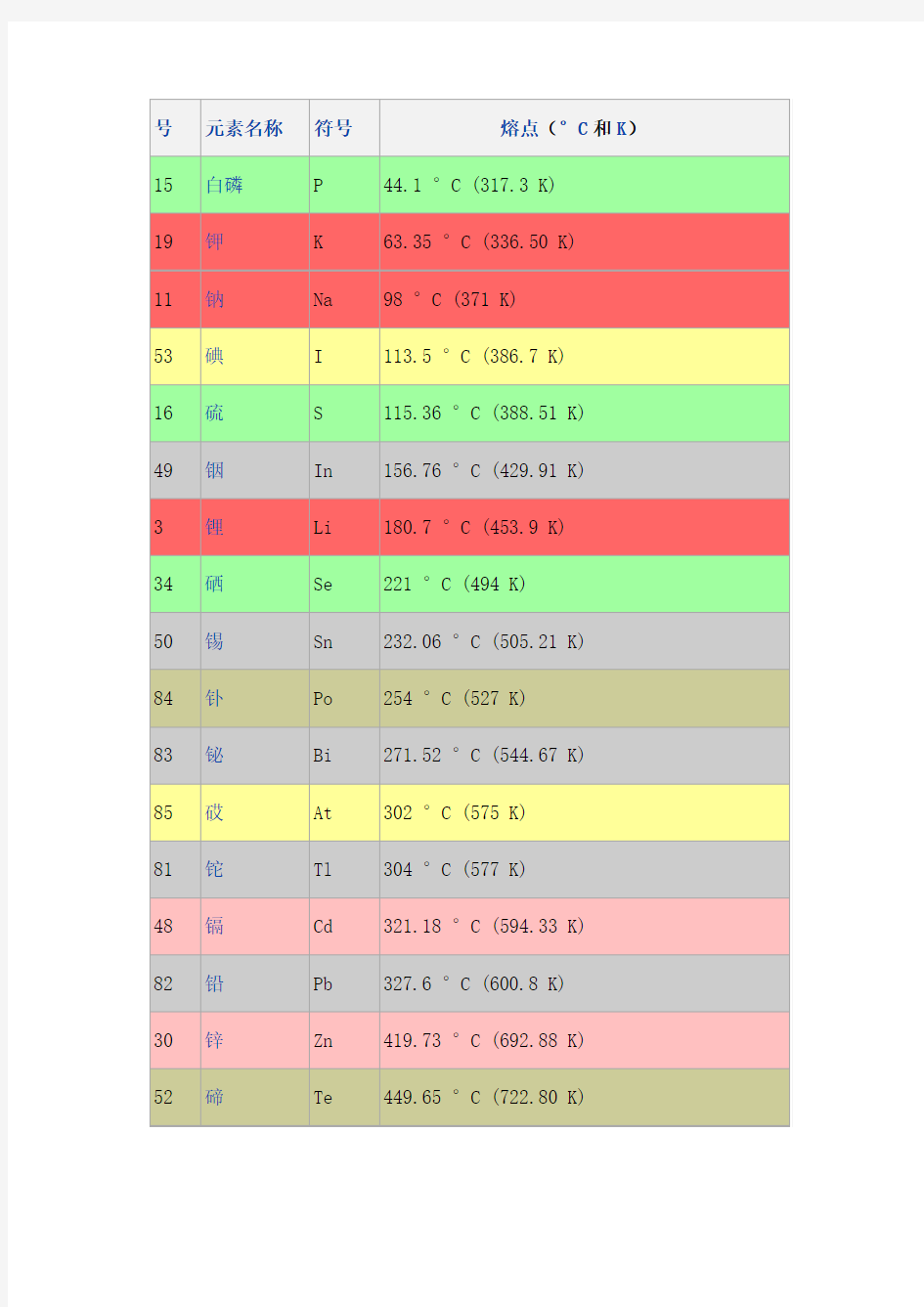
号元素名称符号熔点(°C和K)15 白磷P 44.1 °C (317.3 K)
19 钾K 63.35 °C (336.50 K)
11 钠Na 98 °C (371 K)
53 碘I 113.5 °C (386.7 K)
16 硫S 115.36 °C (388.51 K)
49 铟In 156.76 °C (429.91 K)
3 锂Li 180.7 °C (453.9 K)
34 硒Se 221 °C (494 K)
50 锡Sn 232.06 °C (505.21 K)
84 钋Po 254 °C (527 K)
83 铋Bi 271.52 °C (544.67 K)
85 砹At 302 °C (575 K)
81 铊Tl 304 °C (577 K)
48 镉Cd 321.18 °C (594.33 K)
82 铅Pb 327.6 °C (600.8 K)
30 锌Zn 419.73 °C (692.88 K)
52 碲Te 449.65 °C (722.80 K)
号元素名称符号熔点(°C和K)51 锑Sb 630.9 °C (904.1 K)
93 镎Np 640 °C (913 K)
94 钚Pu 640 °C (913 K)
12 镁Mg 650 °C (923 K)
13 铝Al 660.25 °C (933.40 K)
88 镭Ra 700 °C (973 K)
56 钡Ba 729 °C (1,002 K)
38 锶Sr 769 °C (1,042 K)
58 铈Ce 798 °C (1,071 K)
33 砷As 817 °C (1,090 K)
63 铕Eu 822 °C (1,095 K)
70 镱Yb 824 °C (1,097 K)
20 钙Ca 839 °C (1,112 K)
99 锿Es 860 °C (1,130 K)
57 镧La 920 °C (1,190 K)
59 镨Pr 931 °C (1,204 K)
61 钷Pm 931 °C (1,204 K)
号元素名称符号熔点(°C和K)32 锗Ge 938.3 °C (1,211.4 K)
47 银Ag 961 °C (1,234 K)
97 锫Bk 986 °C (1,259 K)
95 镅Am 994 °C (1,267 K)
60 钕Nd 1,016 °C (1,289 K)
89 锕Ac 1,050 °C (1,320 K)
79 金Au 1,064.58 °C (1,337.73 K) 96 锔Cm 1,067 °C (1,340 K)
62 钐Sm 1,072 °C (1,345 K)
29 铜Cu 1,084.6 °C (1,357.8 K)
92 铀U 1,132 °C (1,405 K)
25 锰Mn 1,246 °C (1,519 K)
4 铍Be 1,278 °C (1,551 K)
64 钆Gd 1,312 °C (1,585 K)
65 铽Tb 1,357 °C (1,630 K)
66 镝Dy 1,407 °C (1,680 K)
14 硅Si 1,410 °C (1,680 K)
号元素名称符号熔点(°C和K)28 镍Ni 1,453 °C (1,726 K)
67 钬Ho 1,470 °C (1,740 K)
27 钴Co 1,495 °C (1,768 K)
101 钔Md 1,521 °C (1,794 K)
102 锘No 1,521 °C (1,794 K)
68 铒Er 1,522 °C (1,795 K)
39 钇Y 1,526 °C (1,799 K)
26 铁Fe 1,535 °C (1,808 K)
21 钪Sc 1,539 °C (1,812 K)
69 铥Tm 1,545 °C (1,818 K)
46 钯Pd 1,552 °C (1,825 K)
91 镤Pa 1,600 °C (1,870 K)
98 锎Cf 1,652 °C (1,925 K)
22 钛Ti 1,660 °C (1,930 K)
71 镥Lu 1,663 °C (1,936 K)
90 钍Th 1,755 °C (2,028 K)
78 铂Pt 1,772 °C (2,045 K)
号元素名称符号熔点(°C和K)40 锆Zr 1,852 °C (2,125 K)
24 铬Cr 1,857 °C (2,130 K)
23 钒V 1,902 °C (2,175 K)
45 铑Rh 1,966 °C (2,239 K)
43 锝Tc 2,200 °C (2,470 K)
72 铪Hf 2,227 °C (2,500 K)
44 钌Ru 2,250 °C (2,520 K)
5 硼 B 2,300 °C (2,570 K)
77 铱Ir 2,443 °C (2,716 K)
41 铌Nb 2,468 °C (2,741 K)
42 钼Mo 2,617 °C (2,890 K)
100 镄Fm 2,781 °C (3,054 K)
103 铹Lr 2,961 °C (3,234 K)
73 钽Ta 2,996 °C (3,269 K)
76 锇Os 3,027 °C (3,300 K)
75 铼Re 3,180 °C (3,450 K)
74 钨W 3,407 °C (3,680 K)
熔点与沸点
第十一章第一节《科学探究:熔点与沸点》 学习目标: 1、知道水有三种状态,且能在三种状态间相互转化;了解自然界中的水循环。 2、知道常见的一些晶体和非晶体;知道晶体有熔点、非晶体没有熔点。 3、了解晶体和非晶体在熔化时的区别;理解晶体和非晶体的熔化图像。 4、知道汽化及汽化的两种方式;理解液体的沸腾图像。 预习作业: 1、水有三种状态,它们分别是、、。并且,水的三种状态在一定条件下是可以的。 2、熔化是指物质从的过程。熔点是指。 3、固体分为和,其中有熔点没有熔点。例如 、、、等属于晶体,、等属于非晶体。 4、汽化是指物质从的过程。汽化的两种方式是。 5、晶体的熔点也会由于杂质的存在或外界压强的增大而,物质的沸点也会由于的增大而。 6、在1个标准大气压下,冰的熔点是,水的沸点是。 课堂练习: 1、已知液态氢的沸点是-253℃,固态氢熔点是-259℃,那么-260℃的氢是态,-255℃的氢是态,-250℃的氢是态,-259℃的氢是。 2、某些高山上的雪,为什么终年不化? 3、把一小块冰放在手心里,冰块会发生变化吗?手有什么感觉? 4、2008年初我国大部分地区持续降雪,形成天气,人们往冰冻的路面上撒盐。 这样做的目的是什么? 5、通过查阅一些晶体的熔点表可以知道,铝的熔点是660℃,能不能用铝壶在1000℃的火炉上烧水? 课后作业: 1.在松香、铜块、玻璃、白糖、食盐、海波中,属于晶体的是它们的共同特征是有一定的。 2.铅的熔点是328℃,那么温度为328℃的铅( ) A.一定是固态B.一定是液态 C.一定是固态和液态共存 D.可能是固态和液态共存 3.如图所示,烧瓶中的水停止沸腾后,若从烧瓶中往外抽气, 会看到水又沸腾起来,这是由于()
熔点 沸点 凝固点与压强的关系原因分析
熔点、沸点、凝固点与压强的关系原因分析 一、熔点、沸点、凝固点 1、凝固点 凝固点是晶体物质凝固时的温度,不同晶体具有不同的凝固点。在一定压强下,任何晶体的凝固点,与其熔点相同。同一种晶体,凝固点与压强有关。凝固时体积膨胀的晶体,凝固点随压强的增大而降低;凝固时体积缩小的晶体,凝固点随压强的增大而升高。在凝固过程中,液体转变为固体,同时放出热量。所以物质的温度高于熔点时将处于液态;低于熔点时,就处于固态。非晶体物质则无凝固点。 液-固共存温度浓度越高,凝固点越低,液体变为固体的过程叫凝固 2、沸点 饱和蒸汽压:在一定温度下,与液体或固体处于相平衡的蒸汽所具有的压力称为饱和蒸汽压。沸点:在一定压力下,某物质的饱和蒸汽压与此压力相等时对应的温度。沸腾是在一定温度下液体内部和表面同时发生的剧烈汽化现象。 液体沸腾时候的温度被称为沸点。浓度高,沸点高,不同液体的沸点是不同的, 几种不同液体的沸点/摄氏度(在标准大气压下) 液态铁:2750 液态铅:1740 水银(汞):357 亚麻仁油:287 食用油:约250 萘:218 煤油:150 甲苯:111 水:100 酒精:78 乙醚:35 液态氨:-33 液态氧:-183 液态氮:-196 液态氢:-253 液态氦:-268.9 所谓沸点是针对不同的液态物质沸腾时的温度。 液体开始沸腾时的温度。沸点随外界压力变化而改变,压力低,沸点也低。 沸点:液体发生沸腾时的温度;即物质由液态转变为气态的温度。当液体沸腾时,在其内部所形成的气泡中的饱和蒸汽压必须与外界施予的压强相等,气泡才有可能长大并上升,所以,沸点也就是液体的饱和蒸汽压等于外界压强的温度。液体的沸点跟外部压强有关。当液体所受的压强增大时,它的沸点升高;压强减小时;沸点降低。例如,蒸汽锅炉里的蒸汽压强,约有几十个大气压,锅炉里的水的沸点可在200℃以上。又如,在高山上煮饭,水易沸腾,但饭不易熟。这是由于大气压随地势的升高而降低,水的沸点也随高度的升高而逐浙下降。(在海拔1900米处,大气压约为79800帕(600毫米汞柱),水的沸点是93.5℃)。 在相同的大气压下,液体不同沸点亦不相同。这是因为饱和汽压和液体种类有关。在一定的温度下,各种液体的饱和汽压亦一定。例如,乙醚在20℃时饱和气压为5865.2帕(44
熔点和沸点的测定
蒸馏及沸点的测定 杨高升有机化学教研室 (2007 年3 月9 日) 一、实验目的 1、了解测定沸点的原理与意义 2、学习并掌握蒸馏操作 二、实验原理 3、学习并掌握常量法(即蒸馏法)测定沸点的方法 1、沸点(boiling point, b.p.) ——液态物质的蒸汽压与其所处体系的压力相等时的温度 液态物质沸腾 液态与气态平衡 物质处于沸点时: 纯净的液态化合物在一定的压力下均有固定的沸点 不同化合物有不同的沸点 沸程范围反映液态物质的纯度
常用术语 ——将液态物质加热到沸腾变为蒸气,再将蒸气冷 凝为液体的过程 2、蒸馏(distillation) 沸程始馏温度~终馏温度 不同温度范围的馏出液 某一馏分之前的馏出液 最后没有蒸馏出来的物质 馏分 前馏分 残留物 蒸馏的用途 液体物质的分离与纯化 测定化合物的沸点 回收溶剂或浓缩溶液 液体化合物的 沸点相差较大 (>30 o C) 常压蒸馏
蒸馏方法 适于沸点较低且比较稳定的液体化合物适于沸点较高或较不稳定的液体化合物适于沸点较为接近的液体化合物 适于沸点较高(但有一定蒸汽压)、容易 分解且不溶于水的化合物 减压蒸馏 分馏 水蒸气蒸馏 冷凝水 冷凝水 3、常压蒸馏装置
三、实验步骤及结果 2、蒸馏装置的安装 3、蒸馏操作 (1)加料 (4)加热 (2)通冷却水 (5)接收馏出液 1、接好冷却水的进出水管 .. 将磁搅拌子小心放入圆底烧瓶 .. 将待蒸液体倒入圆底烧瓶 .. 安装好蒸馏装置 注意检查进出水管、冷凝管是否完好! 装、拆各练习三次 (3)开动磁搅拌 前馏分与主馏分要 用不同的瓶子接收 顺序不 得有误液体体积为 烧瓶容积的 2/3 ~ 1/3 4、沸程记录
常用金属熔点汇总
钨熔3410 铁熔点1535 沸点:2750 钢熔点1515 铜熔点1083 金熔点1064 铝熔点660 镁熔点648.8 铅熔点328 金刚石:3550 各种铸铁:1200左右 银:962 锡:232 铟156.61 T 有色金属基本分类 在物质世界里,有色金属是一个光辉夺目、五彩缤纷的金属王国。在目前已发现的109种元素中有93种元素被人们称为是金属(含半金属),其余16种为非金属。在这93种金属元素中除铁以外的92种金属(含半金属)统称为有色金属或非铁金属。 有色金属的分类 有色金属按其性质、用途、产量及其在地壳中的储量状况一般分为有色轻金属、有色重金属、贵金属、稀有金属和半金属五大类。在稀有金属中,根据其物理化学性质、原料的共生关系、生产工艺流程等特点,又分稀有轻金属、稀有重金属、稀有难熔金属、稀散金属、稀土金属、稀有放射性金属。 一、有色轻金属 有色轻金属一般是指密度在 4.5克/厘米3以下的有色金属,有7种,包括铝(Al)、镁(Mg)、钠(Na)、钾(K)、钙(Ca)、锶(Sr)、钡(Ba)。这类金属的共同特点是:密度小,化学活性大,与氧、硫、碳和卤素的化合物都非常稳定。对这类金属的提取和工业生产, 通常采用熔盐电解法或金属热还原法。 二、有色重金属 有色重金属一般是指密度在 4.5克/厘米3以上的有色金属,有12种,它们是铜(Cu)、铅(Pb)、锌(Zn八镍(Ni)、钻(Co)、锡(Sn)、镉(Cd)、铋(Bi);锑(Sb)、汞(Hs)、锰(Mn)和铬(Cr)。这类金属通常采用火法冶炼或湿法冶炼来提取和进行工业生产。 三、稀有金属 稀有金属通常是指那些自然界中含量很少、分布稀散或难以从原料中提取的金属。稀有金属按其某些共同点又将其细分为: (一)稀有轻金属
判断有机物熔点沸点的规律讲课讲稿
判断有机物熔点沸点 的规律 有机物熔沸点规律 中学的有机化学知识系统性强,用归纳和演绎的方法很容易掌握各类有机物的化学性质。但对于其物理性质总觉得杂乱无章,无规律可循,其实有机物的熔、沸点高低也是由其结构决定的。有机物的晶体大多是分子晶体,它们的熔、沸点取决于有机物分子间作用力的大小,而分子间作用力与分子的结构(有无H键、有无极性基团、饱和程度)、分子量等有关。主要分为下面四个情况: 1.组成和结构相似的物质,分子量越大,其分子间作用力就越大。所以有机物中的同系物随分子中碳原子个数增加,熔、沸点升高。在通常状况下分子中含四个碳原子以下的烷烃、烯烃、炔烃是气体,含四个碳原子以上的是液体,含更多碳原子的是固体。 2.分子式相同时,直键分子间的作用力要比带支键分子间的作用力大,支键越多, 排列越不规则,分子间作用力越小。如: 分子间作用力:正戊烷>异戊烷>新戊烷。 沸点:30.07C>279C>95C 3?分子中元素种类和碳原子个数相同时,分子中有不饱和键的物质熔、沸点要低些。如:C2H6 C2H4硬脂酸油酸 熔点:-88.63C>-103.7C 69.5C>14.0C 4.分子量相近时,极性分子间作用力大于非极性分子间的作用力。分子中极性基团越多,分子间作用力越大。如:
分子间作用力:C2H5OH>CH3OCH3 C2H5CI>CH3CH2CH3 沸点:78.5C>34.51C 12.27C>0.5C 苯同系物看取代基位置 相同的取代物,邻位>间位>对位 女如:二甲苯有三种同分异构体:邻二甲苯、间二甲苯、对二甲苯。我们可以这样理解,把这些分子看作一个球体,这三种分子的体积依次增大,分子间的距离也增大,因而分子间作用力减小,熔沸点就降低。因此它们的沸点依次降低。 分子量相同看分子极性 如果有机物分子是极性分子,由于极性分子具有偶极,而偶极是电性的。因此,极性分子之间除了具有色散力外,还具有偶极之间的静电引力。这样,极性分子之间的分子间力比非极性分子要大得多,所以使沸点升高。例如分子量相同的丁烷和丙酮:分子量结构沸点(C) 丙酮58 CH3COCH3 56.2 丁烷58 CH3CH2CH2CH3 —0.5 丙酮分子中含有羰基,由于碳氧电负性不同,碳原子上带有部分正电荷,氧原子上带有部分负电荷。当这样的极性分子相互接近时,势必产生较大的分子间力,从而表现出沸点值较大程度地升高。 不要忘记看氢键 如果有机物分子间能形成氢键,在液态时,分子间就能通过氢键结合形成较大的缔合体。这样的液体沸腾气化时,不仅要破坏分子间的范德华力,而且还必须消耗较多的能量破坏分子间的氢键,因此,含有氢键的有机物较之分子量相近的其它有机物,应具有反常的高沸点。例如甲醇和乙烷: 分子量结构沸点(°C) 甲醇32 CH3OH 64.9 乙烷30 CH3—CH3 —88.6 醇的沸点反常高就是由于其分子间有较强的氢键而发生缔合。除了醇之外,酚、羧酸和胺等也含有氢键,其沸点也相应较高。
熔点沸点凝固点与压强的关系原因分析修订稿
熔点沸点凝固点与压强的关系原因分析 Coca-cola standardization office【ZZ5AB-ZZSYT-ZZ2C-ZZ682T-ZZT18】
熔点、沸点、凝固点与压强的关系原因分析 一、熔点、沸点、凝固点 1、凝固点 点是物质凝固时的温度,不同晶体具有不同的凝固点。在一定压强下,任何晶体的凝固点,与其熔点相同。同一种晶体,凝固点与压强有关。凝固时体积膨胀的晶体,凝固点随压强的增大而降低;凝固时体积缩小的晶体,凝固点随压强的增大而升高。在凝固过程中,液体转变为固体,同时放出热量。所以物质的温度高于熔点时将处于液态;低于熔点时,就处于固态。非晶体物质则无凝固点。 液-固共存温度浓度越高,凝固点越低,液体变为固体的过程叫凝固 2、沸点 饱和蒸汽压:在一定温度下,与液体或固体处于相平衡的蒸汽所具有的压力称为饱和蒸汽压。沸点:在一定压力下,某物质的饱和蒸汽压与此压力相等时对应的温度。沸腾是在一定温度下液体内部和表面同时发生的剧烈现象。 液体时候的温度被称为沸点。浓度高,沸点高,不同液体的沸点是不同的,几种不同液体的沸点/(在下) 液态铁:2750 液态铅:1740 (汞):357 亚麻仁油:287 食用油:约250 :218 煤油:150 :111 :100 :78 :35 液态氨:-33 液态氧:-183 液态氮:-196 液态氢:-253 液态氦: 所谓沸点是针对不同的液态物质沸腾时的温度。 液体开始沸腾时的温度。沸点随外界压力变化而改变,低,沸点也低。 沸点:发生沸腾时的;即物质由液态转变为气态的温度。当液体沸腾时,在其内部所形成的气泡中的饱和蒸汽压必须与外界施予的压强相等,气泡才有可能长大并上升,所以,沸点也就是液体的饱和蒸汽压等于外界压强的温度。液体的沸点跟外部压强有关。当液体所受的压强增大时,它的沸点升高;压强减小时;沸点降低。例如,里的蒸汽压强,约有几十个大气压,锅炉里的水的沸点可在200℃以上。又如,在高山上煮饭,水易沸腾,但饭不易熟。这是由于大
熔点,沸点的测定1
有机化学实验报告 实验名称:熔点、沸点及其测定 学院: 专业:化学工程与工艺 班级: 姓名:学号 指导教师: 日期: 一、实验目的 1、了解熔点测定的意义和应用;
2、掌握熔点测定的操作方法; 3、了解温度计的矫正方法。 二、实验原理 1、纯物质有固定的,短程熔点; 2、杂质对熔点的影响:降低熔点,扩大其熔点间隔。 三、主要试剂及物理性质 四、仪器装置 图1. Thiele管熔点测定装置 提勒管(b形管)特点:在侧管处用酒精灯加热,受热浴液沿管作上升运动促使整个b形管内浴液循环对流,使温度均匀而不需要搅拌。 五、实验步骤及现象 1、温度计的校正 ⑴0℃的测定校正:用100ml小烧杯装一定量混合均匀的冰水混合物,用
温度计测其温度,直至温度恒定读数,该数据即为0℃的校正值。 ⑵100℃的测定校正:取一定量的蒸馏水于电炉加热至沸腾,用温度计测 量其温度,直至温度恒定读数,该数据即为100℃的校正值。 2、毛细管熔点测定法 ⑴装样:取干燥、研细的待测样品放在称量纸上,将毛细管开口一端插入 样品中,使少量样品挤入熔点管中。取一支长玻璃管,垂直桌面,使毛细管在其中自由落下,将样品夯实。重复操作使所装样品约有2~3mm高为止。 ⑵安装:向b形管中加入石蜡油作为浴液,直到支管上沿。将已装好的毛 细管固定在温度计上,然后小心悬于b形管中,使温度计水银球处在b形管直管中部。 ⑶测定:在b形管弯曲部分加热。快速加热观察并记录样品刚开始熔化时 的温度,继续加热记录样品全部熔化时的温度;第二、三次测量时,减慢加热速度,每分钟升1℃左右,接近熔点时,每分钟约0.2℃,观察并记录实验数据。 六、实验结果
元素周期表熔沸点的递变规律
个人收集整理-ZQ 首先,判断元素单质地熔沸点要先判断其单质地晶体类型,晶体类型不同,决定其熔沸点地作用也不同.金属地熔沸点由金属键键能大小决定;分子晶体由分子间作用力地大小决定;离子晶体由离子键键能地大小决定;原子晶体由共价键键能地大小决定.所以第一主族地碱金属熔沸点是由金属键键能决定,在所带电荷相同地情况下,原子半径越小,金属键键能越大,所以碱金属地熔沸点递变规律是:从上到下熔沸点依次降低.第七主族地卤素,其单质是分子晶体,故熔沸点由分子间作用力决定,在分子构成相似地情况下,相对分子质量越大,分子间作用力也越大,所以卤素地熔沸点递变规律是:从上到下熔沸点依次升高.用这样地方法去判断同主族元素地熔沸点递变规律就行了,因为理解才是最重要地.同周期地话,不太好说了.通常会比较同一类型地元素单质熔沸点,比如说比较、、地熔沸点,则由金属键键能决定,所带电荷最多,原子半径最小,所以金属键最强,故熔沸点是:<<.非金属元素一般不会比较它们单质之间地熔沸点,一般比较他们地氢化物地熔沸点.比较时要注意、、、他们地分子间除分子间作用力外,还有氢键,所以同主族氢化物熔沸点他们是最高地,其余地按分子间作用力大小排列.如氧族元素氢化物地熔沸点是:>>>;卤素:>>>.同周期比较地话,是从左至右熔沸点依次升高,因为气态氢化物地热稳定性是这样递变地.另外有时还要注意物质地类型,比如让你比较金刚石、钙、氯化氢地熔沸点,只要知道金刚石是原子晶体,熔沸点最高,其次是金属钙,最后是分子晶体氯化氢.还有原子晶体地:比较金刚石、晶体硅、碳化硅地熔沸点,那就要看共价键了,原子半径越小,共价键键能越大,故熔沸点:金刚石>碳化硅>晶体硅. 1 / 1
科学探究熔点与沸点导学案教案
科学探究熔点与沸点导 学案教案 集团标准化工作小组 [Q8QX9QT-X8QQB8Q8-NQ8QJ8-M8QMN]
第十一章第一节《熔点与沸点》导学案(2)第2课时 请你探究: 做一做:冰的熔化和水的沸腾实验 1.右图是冰的熔化实验装置图和冰熔化过 程的坐标图,从图中我么可以看出,冰是从 ___℃ 开始熔化的,熔化过程持续了_____min,冰在 熔化 过程中温度保持℃不变,这便是晶体 的与 非晶体的区别,即晶体在熔化过程中温度, 而非晶体在熔化过程中温度。 2.右图是水沸腾实验的装置图和水沸 腾时的 坐标图,从图中我们可以看出:水在沸腾 时温度保持,这个温度叫做它 的,但图中水沸腾时没有达到 100℃,原因可能是与 有关。 小组交流: 1.为什么不用酒精灯直接给盛有冰的试管加热,而要通过烧杯中的水间接试管加热 2.为使烧杯中的水尽快沸腾,有哪些好的方法 小组展示: (向全班汇报小组共同的见解,提出小组的疑问,由其他同学解答或教师点拨)
请你阅读: 阅读课本P6一7. 1.说出日常生活中,哪些固体是晶体,哪些是非晶体 2.通过查阅一些晶体的熔点表可以知道,铝的熔点是660℃,能不能用铝壶在1000℃的火炉上烧水 拓展提升: 小明和小红都想帮妈妈煮粥。小明认为粥锅里的水烧开后,可继续火烧得很旺,煮得満锅沸腾,这样会很快将粥煮好;小红则认为,沸腾后应改用小火,盖上锅盖,让锅内微微沸腾,将粥煮好。你认为谁的想法更合理,请说出理由。 巩固提高: 1.在松香、铜块、玻璃、白糖、食盐、海波中,属于晶体的是 它们的共同特征是有一定的。 2.铅的熔点是328℃,那么温度为328℃的铅( ) A.一定是固态B.一定是液态 C.一定是固态和液态共存D.可能是固态和液态共存 3.如图所示,烧瓶中的水停止沸腾后,若从烧瓶中往 外抽气,会看到水又沸腾起来,这是由于 () A.气压升高,水温升高 B.气压降低,水温升高 C.气压降低,水的沸点降低 D.气压升高,水的沸点降低 4.甲、乙两个烧杯里都有冰水混合物,甲杯里的冰少一些, 乙杯里的冰多一些,甲杯放在阳光下,乙杯放在背阴处在两杯里的冰都还未完全熔化时,比较它们的温度,则下列说法中正确是( ) A.甲杯水的温度高 B.乙杯水的温度高 C.两杯水的温度相同 D.无法比较温度的高低
物质熔沸点大小的比较方法
物质熔沸点高低的比较方法 陕西吴亚南主编 物质熔沸点的大小比较通常出现在高考试题中,而关于物质熔沸点的大小比较方法介绍的却又较少,且不集中。现将有关规律一并总结如下。 一、先将物质分类:从物质的晶体类型上一般分为分子晶 体,离子晶体,原子晶体和金属晶体。不同物质类别熔沸点的比较方法不同。一般情况下:原子晶体﹥离子晶体﹥分子晶体 1、对于分子晶体: a、结构相似时,相对分子质量越大分子间作用力越强 其熔沸点越高。如:CH4﹤SiH4﹤GeH4;CH4﹤C2H6﹤C3H8﹤C4H10 b、能形成分子间氢键时熔沸点陡然增高。如:H2O﹥ H2Te﹥H2Se﹥H2S(能形成氢键的元素有N,O,F) c、当形成分子内氢键时熔沸点降低。如:邻羟基甲苯 的熔沸点低于对羟基甲苯 d、对于烃类物质碳原子数相同时支链越多熔沸点越 低。 e、都能形成氢键时要比氢键的数目和强弱。如:H2O ﹥NH3﹥HF
f、组成和结构不相同但相对分子质量相同或相近时极 性越大熔沸点越高。如:CO﹥N2;CH3OH﹥C2H6 g、芳香烃中临﹥间﹥对 2、对于离子晶体:a、要看离子半径的大小和离子所带电 荷的多少,离子半径越小,离子所带电荷越多则离子键越强晶格能越大熔沸点越高。如:NaCl﹤MgCl2<MgO 3、原子晶体:要看原子半径的大小,原子半径越小作用力 越大,熔沸点越高。如:金刚石﹥二氧化硅﹥碳化硅﹥单晶硅 4、金属晶体:比金属离子的半径和离子所带电荷的多少。 如Na﹤Mg﹤Al 二、也可从物质在常温常压下的状态去分析。 常温常压下固体﹥液体﹥气体(熔沸点)如:碘单质﹥水﹥硫化氢 三、易液化的气体沸点较高。 四、注意: 1、熔点高不一定沸点也高。如I2和Hg 2、MgO和Al2O3由于晶格类型不同,氧化镁的熔沸点 高于氧化铝。 3、同主族元素形成的单质熔沸点的变化不能一言概 论。(一般是金属部分从上至下熔沸点降低,非金属 部分从上至下升高,但都有特例)。
有机化学实验一有机化合物熔点和沸点的测定
实验一有机化合物熔点和沸点的测定 一、有机化合物熔点的测定: (一)实验目的 1.了解有机化合物熔点、沸点的概念、测定的原理及意义。 2.掌握微量法测定熔点、沸点的操作技术。 物质熔点的测定是有机化学工作者经常用的一种技术,所得的数据可用来鉴定晶状的有机化合物,并作为该化合物纯度的一种指标。 测定的意义:可以鉴别未知的固态化合物和判断化合物的纯度。 (二)熔点测定原理 什么叫熔点——用物质的蒸气压与温度的关系理解。熔点的定义:固、液两态在标准大气压下达到平衡状态,即固相蒸气压与液相蒸气压相等时的温度。固态物质受热后,从开始熔化(初熔)至完全熔化(全熔)的温度范围就是该化合物的熔点(实际上是熔点范围。称为熔程或熔距。) 测熔点时几个概念:始熔(初熔)、全熔、熔点距、物质纯度与熔点距关系。 始熔(初熔)——密切注意熔点管中样品变化情况。当样品开始塌落,并有液相产生时(部分透明),表示开始熔化(初熔),即记录为初溶温度t1。 全熔——当固体刚好完全消失时(全部透明),则表示完全熔化(全熔)。记录温度t2 。 熔距或熔程——从初熔到全熔的温度范围。t1~t2为熔程。纯净物一般不超过0.5~10C 化合物的熔点是指在常压下该物质的固—液两相达到平衡时的温度。但通常把晶体物质受热后由固态转化为液态时的温度作为该化合物的熔点。纯净的固体有机化合物一般都有固定的熔点。在一定的外压下,固液两态之间的变化是非常敏锐的,自初熔至全熔(称为熔程) 纯净的固体有机化合物转化为液态时的温度不超过0.5-1℃。若混有杂质则熔点有明确变化,不但熔点距扩大,而且熔点也往往下降。
因此,熔点是晶体化合物纯度的重要标志。有机化合物熔点一般不超过350℃,较易测定,故可借测定熔点来鉴别未知有机物和判断有机物的纯度。 (三)熔点测定方法: 1)显微熔点测定仪《实验化学》第二版书上P104 2)数字熔点测定仪《实验化学》第二版书上P105 3)双浴式熔点测定器《实验化学》第二版书上P102 4)毛细管法测熔点,用b形管测熔点装置(本实验使用)及其它测定方法。(四)实验仪器及药品 毛细管法测熔点,用b形管测熔点装置(本实验使用) (1)实验仪器:b形熔点测定管、玻璃管(30—40cm)、温度计、酒精灯、表 面皿、毛细熔点管、指形管(沸点管) (2)药品:苯甲酸、尿素、苯甲酸加尿素混合物、酒精、 测定物导热液为甘油——测定完毕需回收,请倒回原瓶中 测定熔点装置图: (五)实验步骤及实验关键 1.样品填装——将0.1~0.2克待测样品粉末(干燥、研碎迅速)放在干净的 表面皿上聚成小堆,将毛细管开口垂直插入此小堆内将样品 挤入毛细管中,在桌面上踮几下,再在玻璃管中自由落下十 次左右,使样品填装结实、均匀、紧密,高度2~3mm为宜。 (因测定时到了初熔时样品塌落下来,如果中间有空隙,会
有机物熔点和沸点的测定
实验项目名称:微量法熔沸点测定 一、实验目的: 1. 了解熔点和沸点的测定意义 2. 掌握毛细观测熔沸点的方法 二、实验原理 纯物质有固定的熔沸点,而有固定的熔沸点的不一定是纯物质。通过混合法测定熔沸点可以验证物质的纯度。 熔点:在大气压下,固体化合物加热到由固态转变为液体,并且固、液两相处于平衡时的温度就是该化合物的熔点。溶距:被加热的纯固体化合物从始终至全溶的温度变化范围为溶距(熔点范围或溶程)纯固体化合物溶距不超过0.5~1℃,若含有杂质时,则其熔点比纯固体化合物的熔点低,且溶距变宽。 沸点:一个化合物的沸点,就是当它受热时其蒸汽压升高,当达到与外界大气压相等时,它开始沸腾,这是的液体温度及该液体的沸点 三、主要试剂及主、副产物的物理常数 酒精灯、b形管、石蜡油、温度计、橡胶圈、熔点管(由毛细管制备)、沸点管、待测样品。
待测粉末占熔点管3毫米左右,待测液占沸点管1厘米左右,石蜡液液面达b型管上支管面。 五、实验简单操作步骤 1、温度计的校正 用冰/水,沸水校正温度计。 2、熔点的测定 (1)样品装入 将熔点管开口端插入待测样品粉末中,然后倒置,使粉末进入熔点管闭口端。将熔点管放在空气冷凝管上口,自由落下,反复多次,使样品填实。 (2)熔点测定 将b形管垂直夹于铁架上,以石蜡油作浴液,石蜡油液面高度在叉管口处。用橡胶圈将熔点管捆绑于温度计上,使样品的部分置于水银球侧面中部,将此温度计装入开口橡皮塞中,刻度向外插入b形管中,用外焰进行加热。粗测样品的熔点。然后用第二支熔点管进行精测。在接近熔点15摄氏度时减慢加热速度为每分钟上升一摄氏度。记录初熔温度和全熔温度。平行精测一次。 3、沸点测定 (1)样品装入 用滴管吸取待测样品于沸点外管中,将干净的熔点管倒插入沸点
乙二醇水溶液的冰点和沸点
乙二醇(ethylene glycol)又名“甘醇”、“1,2-亚乙基二醇”,简称EG。化学式为(HOCH2)?,是最简单的二元醇。乙二醇是无色无臭、有甜味液体,对动物有毒性,人类致死剂量约为1.6 g/kg。乙二醇能与水、丙酮互溶,但在醚类中溶解度较小。 冰点:-12.6℃ 沸点:197.3℃ 密度:相对密度(水=1)1.1155(20℃); 相对密度(空气=1):2.14 与水任意比例混合,混合后由于改变了冷却水的蒸气压,冰点显著降低。 其降低的程度在一定范围内随乙二醇的含量增加而下降。 当乙二醇的含量为60%时,冰点可降低至- 48.3℃,超过这个极限时,冰点反而要上升。 乙二醇防冻液在使用中易生成酸性物质,对金属有腐蚀作用。 乙二醇有毒,但由于其沸点高,不会产生蒸气被人吸入体内而引起中毒。 乙二醇的吸水性强,储存的容器应密封,以防吸水后溢出。 由于水的沸点比乙二醇低,使用中被蒸发的是水,当缺少冷却液时,只要加入净水就行了。 这种防冻液用后能回收(防止混入石油产品),经过沉淀、过滤,加水调整浓度,补加防腐剂,还可继续使用,一般可用3—5年。 但要过滤多遍,以防对机动车造成损伤。 有很多人认为乙二醇的冰点很低,防冻液的冰点是由乙二醇和水按照不同比例混合后的一个中和冰点,其实不然,混合后由于改变了冷却水的蒸气压,冰点才会显著降低。 其降低的程度在一定范围内随乙二醇的含量增加而下降,但是一旦超过了一定的比例,冰点反而会上升。 40%的乙二醇和60%的软水混合成的防冻液,防冻温度为-25℃;当防冻液中乙二醇和水各占50%时,防冻温度为-35℃。 PX-C8T浓度计是根据乙二醇浓度与折射率的对应关系而设计的光学仪器,该产品不仅可以测量乙二醇的浓度,同时液可以测量乙二醇冰点,以及测量电瓶液比重,在测量时,只要滴几滴乙二醇在折光仪棱镜上,然后向着光观察,就可以快速读出乙二醇的浓度。测量范围:乙二醇浓度:0-100%;乙二醇冰点:0到-60℃;电池液比重:1.10到1.40。 PX-C8T乙二醇浓度计,又称防冻液乙二醇浓度计,乙二醇浓度测试仪,乙二醇浓度测试仪,乙二醇浓度检测仪,乙二醇浓度测量仪,是为测量乙二醇等水溶液的乙二醇浓度的比例而设计的精密的光学仪器。简单易用,且价格优惠。只要滴几滴液体在棱镜上,然后向着光观察,就可以读出溶液的浓度。如果标有T(A TC)的是增加了温度自动补偿系统。 下面是乙二醇水溶液的冰点和沸点与浓度的关系,数据来源ASHRAE手册(2005版)。
熔点与沸点 练习题
例如图所示,一个烧杯中盛有O℃的碎冰,把装有O℃碎冰的试管插入烧杯里的碎冰中(试管底部不接触烧杯底),对烧杯缓缓加热?当烧杯中的冰有一半熔化时,试管中冰将( ) A?不会熔化 B?全部熔化 C?熔化一半 D?烙化少于一半 分析与解选择A晶体的熔化要同时满足两个必要的条件:一是温度要达到烙点;二是要继续吸热.烧杯中的冰在烙化时温度处于O℃,与试管内冰的温度相同,试管内的冰不能继续吸热,所以不会烙化。 1?自然界里的水是这样"旅行"的: 太阳照射使地面水温升高,含有_______________的热空气快速上升,在上升中,空气逐渐冷却,水蒸气凝结成________ 或___________,形成了云?当云层中的小水滴__________成大水滴时,便产生了雨?假如上空的温度较低,小水滴__________,水便以__________的 形式降落到地面? 2?实验探究:将冰放大水壶,然后不断加热,冰变成___________;再不断加热,水沸腾,水变成____________;戴上手套,拿勺子靠近壶嘴,勺子上有_____________?由此实验探究可知,水有三种状态,它们分别是 ___________ 、___________和__________?水的三种状态在一定条件下是可以____________的. 3?如图是海波的熔化图像,海波的熔点约是________℃,BC段海波是__________态,在这段时间内海波处于_____________过程中,海波吸热,温度_____________. 4?当某些地区出现了严重的千旱时,为了缓解旱情,可以实施人工降雨,有一种人工降雨的
熔点沸点的测定
熔点、沸点的测定 实验目的 了解测定的熔点的原理; 掌握熔点测定的方法; 熟悉微量法测定液体化合物沸点的原理和仪器装置; 学习沸点测定的操作方法及其应用。 实验原理 熔点是固体物质的固液两态在一个大气压力下达到平衡时的温度。纯净的固体化合物一般都有固定的熔点,固液两相互之间的变化非常敏锐,从初熔到全熔的温度范围一般不超过0.5~1℃。当混有杂质时,熔点就有显著地变化,熔点降低,熔程增长。 沸点是液体的蒸汽压等于外界大气压时液体沸腾的温度,液体的沸点与外界压力的大小有关,纯净的液体有机物在一定的压力下具有一定的沸点。液体含杂质时则沸点降低。但是具有固定费电的液体不一定都是纯净的有机物。 试剂的物理性质 名称 相对分子质量 性状 折射率 相对密度 熔点 沸点 萘 128.18 白的晶体 1.58212 1.162 80.2 217.9
四氯化碳 153.84 无色透明 1.4607 1.595 -22.8 76.8 实验装置 实验结果 熔点测定结果 沸点测定结果 名称/沸点 第一次 第二次 四氯化碳 74.5 75 未知样 80 80.4 思考题 貌似血管法测定熔点时,使用提勒管的好处是什么?如何选择溶液?怎样控制升温速度?
答:使用提勒管的好处是管内液体因温度差而发生对流作用时省去人工搅拌的麻烦。 装置中的溶液,温度低于100时可以用水,温度低于140,最好选用液体石蜡和甘油,若温度高于140,可选用浓硫酸。硅油可以加热到250,且比较稳定,透明度高,无腐蚀性,但价格较贵。 哪些因素会影响熔点测定的结果? 答:温度计要矫正;毛细血管既要封严,又不扭成块,也不弯曲;样品必须干燥,并要研磨很细,装填紧密结实,受热时均匀;严格控制升温速度观察准确。 微量法沸点测定与常量法沸点测定有什么不同?(仪器装置、实际用量等) 答:仪器装置:温度计的位置不同 微量法:样品的高度恰好与温度计的水银球高度重合,一起放入b形管上下两插管口之间。 常量法:蒸馏瓶上面有一温度计水银球的上缘要与蒸馏头支管的下缘齐平,偏高偏低沸点都不准确。 试剂用量:微量法:样品不宜过少,8滴左右。 常量法:蒸馏液体的体积应占蒸馏烧瓶容量的1/3~2/3.
物质熔沸点高低的规律小结
物质熔沸点高低的规律小结 熔点是固体将其物态由固态转变(熔化)为液态的温度。熔点是一种物质的一个物理性质,物质的熔点并不是固定不变的,有两个因素对熔点影响很大,一是压强,平时所说的物质的熔点,通常是指一个大气压时的情况,如果压强变化,熔点也要发生变化;另一个就是物质中的杂质,我们平时所说的物质的熔点,通常是指纯净的物质。沸点指液体饱和蒸气压与外界压强相同时的温度。外压力为标准压(1.01×105Pa)时,称正常沸点。外界压强越低,沸点也越低,因此减压可降低沸点。沸点时呈气、液平衡状态。 在近年的高考试题及高考模拟题中我们常遇到这样的题目: 下列物质按熔沸点由低到高的顺序排列的是, A、二氧化硅,氢氧化钠,萘 B、钠、钾、铯 C、干冰,氧化镁,磷酸 D、C2H6,C(CH3)4,CH3(CH2)3CH3 在我们现行的教科书中并没有完整总结物质的熔沸点的文字,在中学阶段的解题过程中,具体比较物质的熔点、沸点的规律主要有如下: 根据物质在相同条件下的状态不同 一般熔、沸点:固>液>气,如:碘单质>汞>CO2 2. 由周期表看主族单质的熔、沸点 同一主族单质的熔点基本上是越向下金属熔点渐低;而非金属单质熔点、沸点渐高。但碳族元素特殊,即C,Si,Ge,Sn越向下,熔点越低,与金属族相似;还有ⅢA族的镓熔点比铟、铊低;ⅣA族的锡熔点比铅低。 3. 同周期中的几个区域的熔点规律 ①高熔点单质C,Si,B三角形小区域,因其为原子晶体,故熔点高,金刚石和石墨的熔点最高大于3550℃。金属元素的高熔点区在过渡元素的中部和中下部,其最高熔点为钨(3410℃)。 ②低熔点单质非金属低熔点单质集中于周期表的右和右上方,另有IA的氢气。其中稀有气体熔、沸点均为同周期的最低者,如氦的熔点(-272.2℃,26×105Pa)、沸点(268.9℃)最低。 金属的低熔点区有两处:IA、ⅡB族Zn,Cd,Hg及ⅢA族中Al,Ge,Th;ⅣA族的Sn,Pb;ⅤA族的Sb,Bi,呈三角形分布。最低熔点是Hg(-38.87℃),近常温呈液态的镓(29.78℃)铯(28.4℃),体温即能使其熔化。 4. 从晶体类型看熔、沸点规律 晶体纯物质有固定熔点;不纯物质凝固点与成分有关(凝固点不固定)。 非晶体物质,如玻璃、水泥、石蜡、塑料等,受热变软,渐变流动性(软化过程)直至液体,没有熔点。 ①原子晶体的熔、沸点高于离子晶体,又高于分子晶体。 在原子晶体中成键元素之间共价键越短的键能越大,则熔点越高。判断时可由原子半径推导出键长、键能再比较。如 键长:金刚石(C—C)>碳化硅(Si—C)>晶体硅(Si—Si)。 熔点:金刚石>碳化硅>晶体硅 ②在离子晶体中,化学式与结构相似时,阴阳离子半径之和越小,离子键越强,熔沸点越高。反之越低。 如KF>KCl>KBr>KI,CaO>KCl。 ③分子晶体的熔沸点由分子间作用力而定,分子晶体分子间作用力越大物质的熔沸点越高,
物质熔沸点的比较
物质熔沸点的比较 在近年的高考试题及高考模拟题中我们常遇到这样的题目: 下列物质按熔沸点由低到高的顺序排列的是, A、二氧化硅,氢氧化钠,萘 B、钠、钾、铯 C、干冰,氧化镁,磷酸 D、C2H6,C(CH3)4,CH3(CH2)3CH3 在中学阶段的解题过程中,具体比较物质的熔点、沸点的规律主要有如下: 1.根据物质在相同条件下的状态不同 一般熔、沸点:固>液>气,如:碘单质>汞>CO2 2. 由周期表看主族单质的熔、沸点 同一主族单质的熔点一般是越向下金属熔点渐低;而非金属单质熔点、沸点渐高。但碳族元素特殊,即C,Si,Ge,Sn越向下,熔点越低,与金属族相似;还有ⅢA族的镓熔点比铟、铊低;ⅣA族的锡熔点比铅低。 3. 从晶体类型看熔、沸点规律 晶体纯物质有固定熔点;不纯物质凝固点与成分有关(凝固点不固定)。 非晶体物质,如玻璃、水泥、石蜡、塑料等,受热变软,渐变流动性(软化过程)直至液体,没有熔点。 ① 一般顺序:原子晶体>离子晶体>分子晶体。 在原子晶体中成键元素之间共价键越短的键能越大,则熔点越高。 判断时可由原子半径推导出键长、键能再比较。如 键长:金刚石(C—C)>碳化硅(Si—C)>晶体硅(Si—Si)。 熔点:金刚石>碳化硅>晶体硅 ②在离子晶体中,要通过比较离子键的强弱,一般来说,阴阳离子所带的电荷数目越多,离子半径越小,则键能越大,其熔沸点越高。 如MgO>MgCl2>NaCl >CsCl。(一个相同,另一个元素不同) ③分子晶体的熔沸点由分子间作用力而定,分子晶体分子间作用力越大物质的熔沸点越高,反之越低。(具有氢键的分子晶体,熔沸点反常地高,如:H2O>H2Te>H2Se>H2S,C2H5OH>CH3—O—CH3)。对于分子晶体而言又与极性大小有关,其判断思路大体是: ⅰ组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔沸点越高。如:CH4<SiH4 <GeH4<SnH4。 ⅱ组成和结构不相似的物质(相对分子质量相近),分子极性越大,其熔沸点就越高。如: CO>N2,CH3OH >CH3—CH3。 ⅲ在高级脂肪酸形成的油脂中,不饱和程度越大,熔沸点越低。如:C17H35COOH(硬脂酸)>C17H33COOH (油酸); ⅳ烃、卤代烃、醇、醛、羧酸等有机物一般随着分子里碳原子数增加,熔沸点升高,如C2H6>CH4, C2H5Cl >CH3Cl,CH3COOH>HCOOH。 ⅴ同分异构体:链烃及其衍生物的同分异构体随着支链增多,熔沸点降低。如:正戊烷>异戊烷>新戊烷。 芳香烃的异构体有两个取代基时,熔点按对、邻、间位降低。(沸点按邻、间、对位降低) ④金属晶体:原子半径越小,金属键越强,熔沸点越高。如:Na<Mg<Al。 合金的熔沸点一般说比它各组份纯金属的熔沸点低。如铝硅合金<纯铝(或纯硅)。 5. 某些物质熔沸点高、低的规律性 ①同周期主族(短周期)金属熔点。如Li
各元素熔点表
号元素名称符号熔点(°C和K) 2 氦He 常压下不凝固,极端情况下其凝固点为0.0213K 1 氢H ?258.975 °C (14.2 K) 10 氖Ne ?248.447 °C (24.7 K) 8 氧O ?222.65 °C (50.5 K) 9 氟 F ?219.52 °C (53.6 K) 7 氮N ?209.86 °C (63.3 K) 18 氩Ar ?189.19 °C (84.0 K) 36 氪Kr ?157.22 °C (116 K) 54 氙Xe ?111.7 °C (161 K) 17 氯Cl ?100.84 °C (172 K) 86 氡Rn ?71 °C (202.1 K) 80 汞Hg ?38.72 °C (234 K) 35 溴Br ?7.1 °C (266 K) 87 钫Fr 27 °C (300 K) 55 铯Cs 28.55 °C (301.70 K) 31 镓Ga 29.76 °C (302.91 K) 37 铷Rb 39.64 °C (312.79 K)
号元素名称符号熔点(°C和K)15 白磷P 44.1 °C (317.3 K) 19 钾K 63.35 °C (336.50 K) 11 钠Na 98 °C (371 K) 53 碘I 113.5 °C (386.7 K) 16 硫S 115.36 °C (388.51 K) 49 铟In 156.76 °C (429.91 K) 3 锂Li 180.7 °C (453.9 K) 34 硒Se 221 °C (494 K) 50 锡Sn 232.06 °C (505.21 K) 84 钋Po 254 °C (527 K) 83 铋Bi 271.52 °C (544.67 K) 85 砹At 302 °C (575 K) 81 铊Tl 304 °C (577 K) 48 镉Cd 321.18 °C (594.33 K) 82 铅Pb 327.6 °C (600.8 K) 30 锌Zn 419.73 °C (692.88 K) 52 碲Te 449.65 °C (722.80 K)
熔点.沸点的测定实验报告(4)沈杰
有机化学实验报告 实验名称:熔点的测定、沸点的测定 学院:化学工程学院 专业:化学工程与工艺 班级:化工11-4班 姓名:沈杰学号11402010417 指导教师:肖勋文、何炎军 日期:2012年09月24日
一、实验目的 1、了解熔点和沸点的意义和应用 2、了解玻璃温度计的种类和校正方法 3、掌握熔点沸点测定的操作方法 二、实验原理 1.每一个晶体有机物都是具有一定的熔点,利用测定熔点,可以估计出有机化合物的纯度; 2.纯净有机物都有一定沸点,利用沸点可以估计出有机物的纯度。 三、主要试剂及物理性质 尿素、苯甲酸、未知溶液;尿素参考熔点:132.7℃苯甲酸参考熔点:122.4℃丙酮、乙醇、未知溶液;丙酮参考沸点:56.1℃乙醇参考沸点:78.2℃ 浴液:石蜡。 四、仪器装置 沸点测定装置图
五、实验步骤及现象 1.装样:把毛细管开口一端垂直插入样品中,使一些样品进入毛细管内,然后,把毛细管垂直桌面上下轻轻振动,使样品进入管底,再用力在桌面上下振动,尽量使样品装得紧密。 2.加热:开始快,低于熔点15℃时慢,1~2℃/分,快到熔点时0.2~0.3℃/分。 3.记录:记录 始熔 :113℃ 全熔:113.5℃ 如某化合物 112℃开始萎缩塌落;113℃度时有液滴生成;113.5℃时全部成为透明体 1个样品重复测2次,样品两个已知,一个未知 实验流程图 1、熔点测定 2、沸点测定 六、关键点:1.样品结实 2.加热快慢 沸点步骤:1.装样0.50cm 左右 2.加热先快后慢 3.当有连续气泡时停止加热,冷却 4.记录,当最后一个气泡冒出而缩回时为沸点 关键:不要加热太快,防止液体沸腾蒸发干 几个概念:1.始熔:样品开始融化 2.熔距:开始熔化至完全熔化的温度范围,也叫熔点范围,熔距:一般不超过0.5℃ 3.全熔固体样品消失成为透明液体时 制备内管 装样倒扣内管 固定外管 固定温度计 加热到连串气泡从内管逸出 观察记录最后一个气泡刚要缩进内管时的温度 制备毛细管 装样 固定毛细管 固定温度计缓慢加热 观察记录初熔和全熔的温度
(完整word版)高中化学各物质熔沸点判断
高中化学熔沸点的比较 根据物质在相同条件下的状态不同 1.一般熔、沸点:固>液>气,如:碘单质>汞>CO2 2. 由周期表看主族单质的熔、沸点 同一主族单质的熔点基本上是越向下金属熔点渐低;而非金属单质熔点、沸点渐高。 但碳族元素特殊,即C,Si,Ge,Sn越向下,熔点越低,与金属族相似; 还有ⅢA族的镓熔点比铟、铊低;ⅣA族的锡熔点比铅低。 3. 从晶体类型看熔、沸点规律 晶体纯物质有固定熔点;不纯物质凝固点与成分有关(凝固点不固定)。非晶体物质,如玻璃、水泥、石蜡、塑料等,受热变软,渐变流动性(软化过程)直至液体,没有熔点。 ①原子晶体的熔、沸点高于离子晶体,又高于分子晶体。 在原子晶体中成键元素之间共价键越短的键能越大,则熔点越高。判断时可由原子半径推导出键长、键能再比较。如键长:金刚石(C—C)>碳化硅(Si—C)>晶体硅(Si—Si)。熔点:金刚石>碳化硅>晶体硅 ②在离子晶体中,化学式与结构相似时,阴阳离子半径之和越小,离子键越强,熔沸点越高。反之越低。 如KF>KCl>KBr>KI,ca*>KCl。 ③分子晶体的熔沸点由分子间作用力而定,分子晶体分子间作用力越大物质的熔沸点越高,反之越低。(具有氢键的分子晶体,熔沸点反常地高,如:H2O>H2Te>H2Se>H2S)。 对于分子晶体而言又与极性大小有关,其判断思路大体是: ⅰ组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔沸点越高。如:CH4<SiH4<GeH4<SnH4。 ⅱ组成和结构不相似的物质(相对分子质量相近),分子极性越大,其熔沸点就越高。如: CO>N2,CH3OH>CH3—CH3。 ⅲ在高级脂肪酸形成的油脂中,不饱和程度越大,熔沸点越低。如: C17H35COOH(硬脂酸)>C17H33COOH(油酸); ⅳ烃、卤代烃、醇、醛、羧酸等有机物一般随着分子里碳原子数增加,熔沸点升高,如C2H6>CH4,C2H5Cl>CH3Cl,CH3COOH>HCOOH。
