第五章 酶学练习题

酶学练习题
《酶工程》期末复习题整理#(精选.)
第一章 1.酶工程:是生物工程的重要组成部分,是随着酶学研究迅速发展,特别是酶的推广应用,使酶学和工程学相互渗透、结合、发展而成的一门新的技术科学,是酶学、微生物学的基本原理与化学工程有机结合而产生的边缘科学技术。 2.化学酶工程:指自然酶、化学修饰酶、固定化酶及化学人工酶的研究和应用 3.生物酶工程:是酶学和以基因重组技术为主的现代分子生物学技术结合的产物,亦称高级酶工程。 4.酶工程的组成部分? 答:酶工程主要指自然酶和工程酶(经化学修饰、基因工程、蛋白质工程改造的酶)在国民经济各个领域中的应用。内容包括:酶的产生;酶的分离纯化;酶的改造;生物反应器。5.酶的结构特点? 答:虽然少数有催化活性的RNA分子已经鉴定,但几乎所有的酶都是蛋白质,因而酶必然具有蛋白质四级结构形式。其中一级结构是指具有一定氨基酸顺序的多肽链的共价骨架;二级结构为在一级结构中相近的氨基酸残基间由氢键的相互作用而形成的带有螺旋、折叠、转角、卷曲等细微结构;三级结构系在二级结构基础上进一步进行分子盘区以形成包括主侧链的专一性三维排列;四级结构是指低聚蛋白中各折叠多肽链在空间的专一性三维排列。具有低聚蛋白结构的酶(寡聚酶)必须具有正确的四级结构才有活性。具有活性的酶都是球蛋白,即被广泛折叠、结构紧密的多肽链,其氨基酸亲水基团在外表,而疏水基团向内。 6.酶活性中心:是酶结合底物和将底物转化为产物的区域,通常是整个酶分子中相当小的一部分,它是由在线性多肽链中可能相隔很远的氨基酸残基形成的三维实体。 7.酶作用机制有哪几种学说? 答:锁和钥匙模型、诱导契合模型 8.酶催化活力的影响因素? 答:底物浓度、酶浓度、温度、pH等。 9.酶的分离纯化的初步分离纯化的步骤? 答:(一)材料的选择和细胞抽提液的制备 1.材料的选择:目的蛋白含量要高,而且容易获得 2.细胞破碎方法及细胞抽提液的制备。为了确保可溶性细胞成分全部抽提出来,应当使用类似于生理条件下的缓冲液。动物组织和器官要尽可能除去结缔组织和脂肪、切碎后放人捣碎机中。完全破碎酵母和细菌细胞。 3.膜蛋白的释放:膜蛋白存在于细胞膜或有关细胞器的膜上。按其所在位置大体可分为外周 蛋白和固有蛋白两种类型 4.胞外酶的分离:胞外酶是在微生物发酵时分泌到发酵液中的。发酵后可通过离心或过滤将菌体从发酵液中分离弃去,所得发酵清液通常要适当浓缩,然后再作进一步纯化。目前常用的浓缩方法是超滤法。 (二)蛋白质的浓缩和脱盐 浓缩方法主要有:沉淀法、吸附法、干胶吸附法、渗透浓缩法、超滤浓缩法
分子生物学实验复习题附答案(最新整理)
分子生物学复习题 实验一DNA的制备 (1)为什么分子生物学实施时要担心EB? 溴化乙锭(Ethidium bromide)是DNA诱变剂,溴化乙锭可以嵌入碱基分子中,导致错配。具有高致癌性(接触致癌) (2)DNA加样缓冲液的用途是什么? 由于植物细胞匀浆含有多种酶类(尤其是氧化酶类)对DNA的抽提产生不利的影响,在抽提缓冲液中需加入抗氧化剂或强还原剂(如巯基乙醇)以降低这些酶类的活性。 线状DNA大小/kb60-520-110-0.87-0.56-0.44-0.23-0.1 (4)琼脂糖凝胶电泳分离DNA的原理是什么 DNA分子在pH值高于其等电点的溶液中带负电荷,在电场中向阳极移动。DNA分子在电场中通过琼脂糖凝胶而泳动,除了电荷效应以外,还有分子筛效应。由于DNA分子可片段的相对分子质量不同,移动速度也不同,所以可将相对分子质量不同或构象不同的DNA分离。DNA片段迁移距离(迁移率)与碱基对的对数成反比,因此通过已知大小的标准物移动的距离与未知片段的移动距离时行比较,便可测出未知片段的大小。但是当DNA分子大小超过20kb时,普通琼脂糖凝胶就很难将它们分开。此时电泳的迁移率不再依赖于分子大小,因此,就用琼脂糖凝胶电泳分离DNA时,分子大小不宜超过此值。 (5)琼脂糖凝胶电泳时胶中DNA是靠什么发出荧光的?为什么? 溴化乙锭是一种高度灵敏的荧光染色剂,可插入DNA双螺旋结构的两个碱基之间,形成一种荧光络合物。在254nm波长紫外光照射下,呈现橙黄色的荧光。用溴化乙啶检测DNA,可检出10-9g以上的DNA 含量。 (6)制备基因组DNA时用到的以下试剂分别起什么作用? CTAB等离子型表面活性剂,能溶解细胞膜和核膜蛋白,使核蛋白解聚,从而使DNA得以游离出来 氯仿有机溶剂,能使蛋白质变性,并使抽提液分相,因核酸(DNA、RNA)水溶性很强,经离心后即可从抽提液中除去细胞碎片和大部分蛋白质。 无水乙醇上清液中加入无水乙醇使DNA沉淀,沉淀DNA溶于TE溶液中,即得植物总DNA溶液。75%乙醇,乙醇轻轻洗涤管壁 实验二RNA的制备 1.制备RNA时通常要注意些什么?为什么? 应该要注意(1)不要徒手操作,必须带手套;(2)加样时不能够大声说话,防止唾液等进入; 由于RNA分子的结构特点,容易受RNA酶的攻击反应而降解,加上RNA酶极为稳定且广泛存在,因而在提取过程中要严格防止RNA酶的污染,并设法抑制其活性,这是本实验成败的关键。 2.制备的RNA通常有哪些用途?制备的DNA通常又有哪些用途? 研究基因的表达和调控时常常要从组织和细胞中分离和纯化RNA。 质粒DNA构建克隆载体,分离目的基因 3.RNA制备好后是通过什么方法检测其有没有降解的?从胶上检测什么指标来判断RNA质量好坏?为什么?
生物化学检验中的诊断酶学课件ptConvertor
诊断酶学 目的要求:熟悉酶在体内的病生变化机制; 掌握酶促反应动力学的基本原理及酶活性测定方法; 掌握肝胆疾病的酶学指标应用与评价; 第一节概述 临床酶学:指临床实验室应用酶作为多种疾病的诊断、预防、治疗及预后评估的学科。包括基础酶学、诊断酶学、治疗酶学 基础酶学:注重酶的动力学研究; 诊断酶学:应用酶、酶试剂对疾病进行诊断; 治疗酶学:利用酶制剂进行疾病治疗; 一、复习酶的概念、结构与功能 1.基本概念酶是活细胞的产物,是生物催化剂; 生物催化剂的特性:(1)高度不稳定性;(2)催化效率极高; (3)高度特异性;(4)催化作用的可调节性; 2.结构与功能 (1)酶的化学组成 单纯酶 结合酶酶蛋白 + 辅助因子=全酶 辅基结合紧密 辅酶结合疏松 (2)酶的活性中心 指酶分子表面的能与底物结合并起催化反应的特定区域,该区域由酶的必需基团所组成。 酶的活性中心被占据或构象发生改变均可导致酶的催化效率下降或消失。 二、血浆(清)酶分类 1.血浆特异酶在血浆中发挥作用,其降低表示合成该酶的组织受损。 2.非血浆特异酶在血浆中含量较低且无任何功能 (1)外分泌酶来源于外分泌腺,其浓度与分泌的腺体功能有关 (2)代谢酶存在于各种组织细胞,参与物质代谢; 血清中大量出现时提示细胞受损; 代谢酶分为:一般代谢酶器官特异性酶 四、血清酶变化的病生机制 过多 细胞内酶生成过少 变异 K2 K1 K3 组织间隙血管内 K4 K8 抑制抑制 酶激活酶激活 变化变化 K7 K5 K6 图示说明:不同组织或器官中的酶进入血中的途径不同;
不同的酶其清除方式不同; 控制血清酶水平的因素: 1.酶在细胞内的合成速度 2.酶从细胞释入血清的速度 取决于三个方面:细胞内外酶浓度差; 酶蛋白分子量的大小; 酶在细胞内的定位及存在形式; 3.酶在细胞外间隙的分布和运送 酶从胞内进入血液的途径: (1)直接进入血液 (2)部分直接入血,部分进入组织间隙 (3)经淋巴系统入血 4.酶从血中清除的速度 可用酶的半衰期表示 *血清酶从血清中消失的速率因人不同,因酶而异,随疾病过程的不同时间而变化。 5.其它 注意激活剂或抑制剂对酶活性的影响 五、其它影响血清酶的因素 1. 生理因素的影响性别、年龄、进食、运动、妊娠等 2.测定方法的影响方法的不同(速率法、终点法) 测定条件的不同 单位的差异 3.标本的影响 (1)最好用血清(2)溶血的影响 (3)尽快、及时分离(4)样品的存放 4.其它因素对酶活性测定的影响 (1)温度的影响(2)抑制剂的影响 (3)样品中酶浓度的影响(4)反应体系中其它物质的影响 其它酶和物质;工具酶的污染;非酶反应;容器的污染等。 第二节酶活性测定的基本知识 一、酶活性的概念酶活性即酶促反应速度(v): 指在规定的条件下,单位时间(t)内底物(s)的减少量或产物(p)的增加量。 v = - d[s] / dt v = d[p] / dt 注意:强调单位时间的变化量 二、酶促反应进程
第五章 酶
第五章酶 (Enzyme) 主要内容:介绍酶的概念、作用特点和分类、命名,讨论酶的结构特征和催化功能以及酶专一性及高效催化的策略,进而讨论影响酶作用的主要因素。对酶工程和酶的应用作一般介绍。思考题? 第一节酶的概念及作用特点 第二节酶的命名和分类 第三节酶活力测定和分离纯化 第四节酶催化作用的结构基础和 高效催化的策略 第五节酶促反应的动力学 第六节重要的酶类及酶活性的调控 第七节酶工程简介 目录 第一节酶概念及作用特点 一、酶的概念 二、酶催化作用的特点 三、酶的化学本质、酶的类别和组成 酶 是活细胞产生的,具有催化生物反应功能的蛋白质大分子及核酸;是生物体内进行新陈代谢不可缺少的受多种因素调节控制的具有催化能力的生物催化剂。 酶催化作用的特点 酶具有一般催化剂的特征: 用量少而催化效率高;不改变化学反应的平衡点;可降低反应的活化能。 酶作为生物催化剂的特点 极高的催化效率 高度的专一性 易失活 活性可调控 有些酶需辅助因子 酶作为生物催化剂的特点 1、催化效率很高: 比较Fe3+和H2O2酶同样条件下的催化效果: 1mol/L H2O2酶 104M 1mol/L Fe3+ 10-6M 酶促反应比非催化反应高10-1020倍; 比一般催化反应高107-1013倍。 酶能够显著降低反应的活化能 活化能(Activation energy):在一定温度下1mol 底物全部进入活化态所需要的自由能。
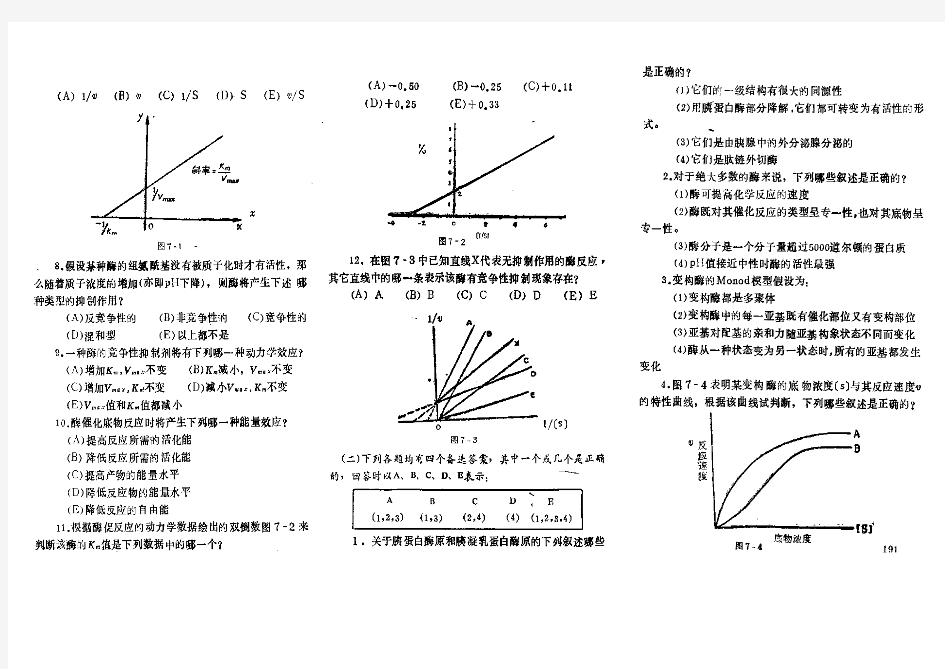
0℃,分解H2O2量 2、酶具有高度专一性 是指酶对催化的反应和反应物有严格的选择性。一种酶只能催化一种或一类十分相似的反应。底物(substrate ,S):酶作用的物质。 酶专一性类别(P332) 酶专一性类型( p332) 1 、结构专一性 概念:酶对所催化的分子(底物,Substrate)化学结构的特殊要求和选择。 类别:绝对专一性和相对专一性 2 、立体异构专一性 概念:酶除了对底物分子的化学结构有要求外,对其立体异构也有一定的要求 类别:旋光异构专一性和几何异构专一性 绝对专一性和相对专一性 绝对专一性有的酶对底物的化学结构要求非常严格,只作用于一种底物,不作用于其它任何物质。 相对专一性有的酶对底物的化学结构要求比上述绝对专一性略低一些,它们能作用于一类化合物或一种化学键。 1)键专一性有的酶只作用于一定的键,而对键两端的基团并无严格要求。 2)基团专一性另一些酶,除要求作用于一定的键以外,对键两端的基团还有一定要求,往往是对其中一个基团要求严格,对另一个基团则要求不严 格。 消化道内几种蛋白酶的专一性 (苯丙.酪.色-COOH) (精.赖-COOH) (脂肪族) 胰凝乳蛋白酶 胃蛋白酶 弹性蛋白酶 羧肽酶 胰蛋白酶 糜蛋白酶 羧肽酶 3、酶易失活: 凡使pr变性的因素都可使酶破坏, 酶在温和条件下作用。 4、酶活性受到调节和控制:
食品酶学复习题(1)
1.酶的特性有哪些?(1)催化效率高:比一般的酶高106-1013倍;(2)酶作用的专一性:一种酶作用于一种或一类分子结构相似的物质(3)易变性:大多数酶的化学本质是蛋白质,因而会被高温、酸、强碱等破坏(4)酶的催化条件温和;(5)酶在生物体内参与每一次反应后,它本身的性质和数量都不会发生改变。 8. 国际酶学委员会推荐的分类和命名规则的主要依据是什么? 酶学委员会提出以酶所催化的化学反应性质作为酶的分类和命名规则的主 要依据,每一种酶都给以三个名称:系统名,惯用名和一个数字编号。 2、脂肪酶和脂肪氧化酶的不同?脂肪酶水解脂肪,产生甘油、甘油一酯和脂肪酸脂肪氧化酶催化顺,顺-1,4-戊二烯的不饱和脂肪酸及酯的氢化氧化作用。4、酶活力:指酶催化反应的能力,它表示样品中酶的含量。 3、Km值代表反应速度达到最大反应速度一半时的底物浓度。 固定化酶:是指在一定的空间范围内起催化作用,并能反复和连续使用的酶。优点:同一批固定化酶能在工艺流程中重复多次的使用;固定化后,和反应物分开,有利于控制生产过程,同时也省去了热处理使酶失活的步骤;稳定性显著提高;可长期使用,并可预测衰败的速度;提供了研究酶动力学的良好模型。26.固定化酶的稳定性增强主要表现在哪些方面?操作稳定性(2)贮藏稳定性(3)热稳定性(4)对蛋白酶的稳定性(5)酸碱稳定性。 27.什么是糖酶?常见的糖酶有哪几种?(四种以上) 糖酶:裂解多糖中将单糖连接在一起的化学键,使多糖降解为小分子,催化糖单位结构上的重排形成新的糖类化合物的酶。 常见的糖酶:α-淀粉酶、糖化酶、β-淀粉酶,乳糖酶,果胶酶,纤维素酶等最常见的微生物产酶发酵类型是液体深层发酵 2. 琼脂糖凝胶过滤和离子交换法等纯化酶的机理各是什么? 琼脂糖凝胶过滤:不同式样通过凝胶时,能进入颗粒状凝胶的微孔的小分子被阻滞,不能进入微孔的大分子未被阻滞,改变颗粒状凝胶的微孔大小可能改变凝胶量分级分离范围。(琼脂糖凝胶过滤根据分子大小而设计的方法) 离子交换法:改变PH或提高溶液离子强度,根据酶结合到离子交换剂上的能力将混合物中的蛋白质分离开。(离子交换法按分子所带正负电荷多少分离的方法)5. 一些乳制品中为什么添加乳糖酶? 乳糖的溶解度比较低,在冷冻乳制品中容易析出,使得产品带有颗粒状结构,乳糖部分水解可以防止出现这种情况。 .酶的动力学研究包括哪些内容?图示竞争性抑制、非竞争性抑制、反竞争性抑制的区别。酶促反应动力学以化学动力学为基础,通过对酶促反应速度的测定来讨论诸如底物浓度、抑制剂、温度、pH和激活剂等因素对酶促反应速度的影响。 4. 酶制剂的保存需要考虑哪些因素?(1) 温度:在低温条件下(0-4℃)使用、处理和保存,有的需要更低的温度,加入甘油或多元醇有保护作用。(2) pH与缓冲液:pH应在酶的pH稳定范围内,采用缓冲液保存。(3) 酶蛋白浓度:一般酶浓度高较稳定,低浓度时易于解离、吸附或发生表面变性失效。(4) 氧:有些酶易于氧化而失活。(5) 为提高酶稳定性,常加入下列稳定剂:如钙离子保护淀粉酶,锰离子保护溶菌酶,二巯基乙醇保护巯基酶。(常加入下列稳定剂:①底物、抑制剂和辅酶,它们的作用可能是通过降低局部的能级水平,使酶蛋白处于不稳定状态的扭曲部分转入稳定状态。②对巯基酶,可加入-SH保护剂。如二巯基乙醇、GSH(谷胱甘肽)、DTT(二硫苏糖醇)等。③其他如Ca2+能保护α-淀粉酶,Mn2+能稳定溶菌酶,Cl-能稳定透明质酸酶。)
临床化学--诊断酶学练习题
临床化学--诊断酶学练习题 一、A1 1、血清ALP活性升高最常见于 A、急性肾炎 B、骨肿瘤 C、恶性贫血 D、甲状腺功能低下 E、梗阻性黄疸 2、肌酸激酶组织含量最高的是 A、肺脏 B、骨骼肌 C、肾脏 D、红细胞 E、肝脏 3、有助于诊断骨骼和肝脏疾病的血清酶是 A、AST B、CK C、ALP D、ACP E、LPS 4、急性肝炎时AST/ALT比值 A、小于1 B、大于1 C、等于1 D、大于3 E、大于2 5、在人体组织中ACP含量最多的是 A、肝脏 B、心肌 C、红细胞 D、血小板 E、前列腺 6、酒精中毒时血清酶活力升高最明显的时 A、GGT B、ALP C、CK D、LD
E、ALT 7、急性心肌梗死时,下列血清酶最早升高的是 A、ALT B、LD C、CK D、AST E、ALP 8、肝病时血清LD同工酶升高最明显的是 A、LD1 B、LD2 C、LD3 D、LD4 E、LD5 9、ALT在人体各组织中含量最多的是 A、肺脏 B、心肌 C、脑组织 D、红细胞 E、肝脏 10、孕妇血清中酶活性增高最明显的是 A、LD B、ALP C、CK D、AMY E、LPS 11、LD5主要组织来源是 A、心脏 B、肺 C、肝脏 D、脾脏 E、肾脏 12、心肌酶谱不包括 A、ALT B、AST C、CK D、α-HBD E、LD
13、肌钙蛋白由几个亚单位组成 A、2 B、3 C、4 D、5 E、6 14、LD由H和M亚基组成几种同工酶 A、2 B、3 C、4 D、5 E、6 15、胞质中CK的同工酶有几种 A、2 B、3 C、4 D、5 E、6 16、CK同工酶由几个亚基组成 A、2 B、3 C、4 D、5 E、6 17、心肌中主要含有的CK同工酶是 A、CK-BB B、CK-MB C、CK-MM D、CK-BB和CK-MB E、CK-MM和CK-MB 18、关于乳酸脱氢酶性质的叙述错误的是 A、由两种亚单位组成 B、有5种同工酶 C、在肝脏中含量最高 D、具有“冷变性”的特点 E、血清中LD的增高对任何单一组织或器官都是非特异性的 19、转氨酶的辅酶是 A、烟酸
临床化学之诊断酶学
诊断酶学 一、血清酶 (一)血清酶的分类 1.血浆特异酶:在血浆中发挥特定催化作用的酶。如胆碱酯酶、脂蛋白脂肪酶、铜氧化酶等。 大多数在肝内合成。 血浆特异酶活性的改变,除了反映血液功能外,还反映来源器官的功能。 2.非血浆特异酶:在血浆中浓度很低,且无功能。 (1)分泌酶:来源于外分泌腺的酶。如胰淀粉酶、胰脂肪酶、胰蛋白酶、胃蛋白酶和前列腺酸性磷酸酶等。 血液中分泌酶以失活状态存在,不发生催化作用。 在血液中的浓度和其分泌腺体的功能活动和疾病有关,例如,急性胰腺炎时,血淀粉酶就会升高。 (2)代谢酶(细胞酶):在细胞内发挥催化功能的酶。正常时这些酶存在于组织细胞中,血浆中酶活性很低。细胞内、外浓度差异悬殊。 当酶来源的组织细胞发生病变,细胞膜通透性增加或细胞坏死时,细胞内酶大量进入血浆,导致血浆酶活性显著增高。其下降的临床意义很少。 这一类酶较多,如转氨酶、乳酸脱氢酶、肌酸激酶等,它们在肝病、心脏病时都可能出现变化。 (二)血清酶生理变异及其病理生理机制 1.血清酶生理变异 (1)性别:CK和GGT都是男性高于女性。 (2)年龄:碱性磷酸酶(与骨生长发育相关)。 (3)进食:酗酒可引起γ-GGT明显升高。 (4)运动:剧烈运动可引起血清中多种酶升高,如CK、LD、AST等。 (5)妊娠与分娩:妊娠时ALP升高,分娩时可能有CK、CK-BB、LD升高。 2.血清酶病理改变机制: (1)酶合成异常: 血浆特异酶大多数是在肝合成,当肝功能障碍时酶浓度常下降。如血清胆碱酯酶活性在有肝功能障碍时可能下降。 由于酶基因变异也可引起特定酶减少或消失,如肝-豆状核综合征患者血中铜氧化酶活性可明显下降。如有骨细胞增生时,血中ALP可上升。 (2)细胞酶的释放: 是疾病时大多数血清酶增高的主要机制,影响细胞酶释放的主要原因有: 1)细胞内、外酶浓度的差异; 2)酶在细胞内的定位和存在的形式; 3)酶蛋白分子量的大小:酶释放的速度和分子量成反比。例如LD分子量大于CK,而当有心肌梗死时,LD在血液中升高的时间就晚于CK。
(整理)酶学部分的练习题
第一部分填空 1、全酶由和组成,在催化反应时,二者所起的作用不同,其中决定酶的专一性和高效率,起传递电子、原子或化学基团的作用。 2、酶是生物体活细胞产生的,具有催化活性的。 3、竞争性抑制剂使酶对底物的表观 Km _______________ ,而 Vmax_ ____________ 。 4、酶是产生的,具有催化活性的。 5、如果一个酶对A、B、C三种底物的米氏常数分别为K m a、K m b和K m c,且K m a﹥ K m b﹥K m c,则此酶的最适底物是_________,与酶亲和力最小的底物是_________。 6、___________抑制剂不改变酶促反应V max , ___________抑制剂不改变酶促反 应K m 。 7、全酶由__________和__________组成。 8、如果一个酶对A、B、C三种底物的米氏常数分别为K m a、K m b和K m c,且K m a﹥ K m b﹥K m c,则此酶的最适底物是_________,与酶亲和力最小的底物是_________。 9、辅酶和辅基的区别在于前者与酶蛋白结合,后者与酶蛋白结合。 10、当酶促反应速度为最大反应速度的80%时,底物浓度是Km值的倍。 11、酶活力是指,一般用 表示。 12、酶反应的温度系数Q10一般为。 13、在适当浓度的β-巯基乙醇和8M脲溶液中,RNase(牛)丧失原有活性。这主要是因为RNA酶的被破坏造成的。其中β-巯基乙醇可使RNA 酶分子中的键破坏。而8M脲可使键破坏。当用透析方法去除β-巯基乙醇和脲的情况下,RNA酶又恢复原有催化功能,这种现象称为。 14、T.Cech从自我剪切的RNA中发现了具有催化活性的,称之为这是对酶概念的重要发展。 15、酶的活性中心包括_________和_________两个功能部位。 16、1981年以前发现的酶化学本质是_________,均由活_________产生。
生物化学酶试题及答案.docx
【测试题】 ■一■ '、名词解释 1.酶 13 .最适PH 2 . .固定化酶 14 .不可逆性抑制 3 . .同工酶 15 .可逆性抑制 4 . .酶的特异性 16 .激活剂 5 . .酶的活性中心 17 .抑制剂 6 . .酶原及酶原激活 18 .核酶 7 . .抗体酶 19 .变构酶 8 . .活化能 20 .酶的共价修饰 9 . .诱导契合假说 21 .酶的VmaX 10 .初速度 22 .结合酶 11. Km 值 23 .酶活力 12 .最适温度 24 .比活力 一 、、填空题 25.酶是由 产生的对特异底物起高效催化作用的 26.酶加速反应的机制是通过降低反应的 ,而不改变反应的 。 27 .结合酶,其蛋白质部分称 ,非蛋白质部分称 ,二者结合其复合物称 。 28. _______________________________________ 酶活性中心与底物相结合那些基团称 ,而起催化作用的那些基团称 _________________________________________ 。 29. ________________________________________________________________ 当Km 值近似 ES 的解离常数K S 时,Km 值可用来表示酶对底物的 _________________________________________ 。 30. _________________________________ 酶的特异性包括_特异性, 特异性和 特异性。 31 .米曼二氏根据中间产物学说推导出 V 与[S ]的数学方程式简称为 ,式中的 .. 为米氏常数, 它的值等于酶促反应速度达到 _____ 一半时的 ____ 。 32 ?在其它因素不变的情况下,[S ]对酶促反应V 作图呈 线,双倒数作图呈 线,而变构酶的动 力学曲线呈 型。 33 ?可逆性抑制是指抑制剂与酶进行 ______ 结合影响酶的反应速度, ______ 抑制剂与酶的活性中心结 合, ____ 抑制剂与酶的活性中心外的必需基团结合。 34. 反竞争性抑制剂使酶对底物表观 Km_,VmaX 。 35. 无活性状态的酶的前身物称为 ,在一定条件下转变 成有活性酶的过程称 。其实质是 的 形成和暴露过程。 36?丙二酸是 酶的 抑制剂,增加底物浓度可 抑制。 37、同工酶是指催化化学反应 ______ ,而酶蛋白分子结构、理化性质及免疫学性质 _______ 的一组酶。 38. 辅酶与辅基的区别在于前者与酶蛋白 ,后者与酶蛋白 。 39. ____________________ 肌酸激酶的亚基分 型和 型。 40. _____________ 最适温度 酶的特征性常数,它与反应时间有关,当反应时间延长时,最适温度可以 ____ 。 41?某些酶以 ____ 形式分泌,不仅可保护 ____ 本身不受酶的水解破坏,而且可输送到特定的部位与环境 转变成—■发挥其催化作用。 42. 不可逆抑制剂常与酶 以 键相结合使酶失活。 43. 当非竞争性抑制剂存在时,酶促反应动力学参数 如下 Km _,Vma _______ 。 44. 当酶促反应速度为最大反应速度的 80%寸,底物浓度是 Km 的_ 倍。 三、选择题 A 型题 45. 关于酶概念的叙述下列哪项是正确的?
临床检验技师考试辅导(11)
第五章诊断酶学 《考纲要求》 1. 血清酶熟练掌握 (1) 分类、生理变异与病理生理机制 (2) 酶活性与酶质量测定方法及其评价 (3) 同工酶及其亚型测定的临床意义 2. 常用血清酶及同工酶测定的参考值及临床意义掌握 肌酸激酶及同工酶和其亚型 孚L 酸脱氢酶及同工酶 氨基转移酶及同工酶 碱性磷酸酶及同工酶 丫 -谷氨酰基转移酶及同工酶 淀粉酶及同工酶 酸性磷酸酶及同工酶 3. 酶促反应动力学熟练掌握 (1) 酶促反应 (2) 酶活性浓度测定方法 一、血清酶 血清酶的分类 血清酶生理变异及其病理生理机制 酶活性和质量测定方法及其评价 酶活力测定的影响因素 工具酶 标本采集要点及酶活性表示法 同工酶和亚型测定的临床意义 血清酶的分类: 根据酶的来源及其在血清中发挥催化功能的情况,可将血清酶分为两大类。 1. 血浆特异酶 在血浆中发挥特定催化作用的酶。 如凝血酶、纤溶酶、胆碱酯酶(CHE 、脂蛋白脂肪酶、铜氧化酶等。 (1) 大多在肝内合成; (2) 以酶原状态分泌入血,在一定的条件下被激活; (3) 有的可以作为肝功能试验的一部分。 血浆特异酶活性的改变,除了反映血液功能外,还反映来源器官的功能。 2. 非血浆特异酶: 在血浆中浓度很低,且无功能,又可分为两种。 (1) 分泌酶:指来源于外分泌腺的酶 。 如a -淀粉酶(AMY 、前列腺酸性磷酸酶(ACP 在血液中的浓度和其分泌腺体的功能活动和疾病有关, 高。 例如,急性胰腺炎时,血淀粉酶就会升高。 (2) 代谢酶:(细胞酶) 在细胞内发挥催化功能的酶。 (1) (2) (3) (4) (5) (6) (7) (四) (五) (六 、脂肪酶(LPS )、胃蛋白酶、胰蛋白酶、 ALP 等。 来源增加或排泄受阻时,血浆中此类酶活性增
第五章 酶习题--生化习题及答案
第五章酶 一、单项选择题 1.关于酶的叙述哪项是正确的? A.体内所有具有催化活性的物质都是酶B.所有的酶都含有辅基或辅酶C.大多数酶的化学本质是蛋白质D.都具有立体异构特异性 E.能改变化学反应的平衡点并加速反应的进行 2.有关酶的辅酶叙述正确的是 A.是与酶蛋白结合紧密的金属离子B.分子结构中不含维生素的小分子有机化合物C.在催化反应中不与酶的活性中心结合D.在反应中参与传递氢原子、电子或其他基团E.是与酶蛋白紧密结合的小分子有机化合物 3.酶和一般化学催化剂相比具有下列特点,例外的是 A.具有更强的催化效能B.具有更强的专一性 C.催化的反应无副反应D.可在高温下进行 E.其活性可以受调控的 4. 酶能使反应速度加快,主要在于 A. 大大降低反应的活化能 B. 增加反应的活化能 C. 减少了活化分子 D. 增加了碰撞频率 E. 减少反应中产物与底物分子自由能的差值 5. 在酶促反应中,决定反应特异性的是 A. 无机离子 B. 溶液pH C. 酶蛋白 D. 辅酶 E. 辅助因子 6.酶的特异性是指 A.酶与辅酶特异的结合B.酶对其所催化的底物有特异的选择性C.酶在细胞中的定位是特异性的D.酶催化反应的机制各不相同 E.在酶的分类中各属不同的类别 7.酶促反应动力学研究的是 A.酶分子的空间构象B.酶的电泳行为 C.酶的活性中心D.酶的基因来源
E.影响酶促反应速度的因素 8. 在心肌组织中,哪一种乳酸脱氢酶同工酶的含量最高 A. LDH1 B. LDH2 C. LDH3 D. LDH4 E. LDH5 9. 酶与一般催化剂的区别是 A. 只能加速热力学上可以进行的反应 B. 不改变化学反应的平衡点 C. 缩短达到化学平衡的时间 D. 具有高度特异性 E. 能降低活化能 10.关于活化能的描述哪一项是正确的 A. 初态底物分子转变为活化分子所需的能量 B. 是底物和产物能量水平的差值 C. 酶降低反应活化能的程度与一般催化剂相同 D. 活化能越大,反应越容易进行 E. 是底物分子从初态转变到过渡态时所需要的能量 11.酶与一般催化剂具有下列共性,例外的是 A.同时加快正、逆反应速度 B. 不能改变反应平衡点 C.降低反应活化能 D. 反应前后自身没有质与量的改变E.由特定构象的活性中心发挥作用 12.金属离子作为辅助因子具有下列作用,例外的是 A.稳定酶蛋白活性构象B.中和阳离子 C.参与构成酶的活性中心D.连接酶和底物的桥梁 E.中和阴离子 13. 在形成酶-底物复合物时 A. 只有酶的构象发生变化 B. 只有底物的构象发生变化 C. 只有辅酶的构象发生变化 D. 酶和底物的构象都发生变化 E. 底物的构象首先发生变化 14.有关酶蛋白或辅助因子的叙述正确的是 A.酶蛋白或辅助因子单独存在时均有催化作用 B.一种酶蛋白可与多种辅助因子结合成全酶 C.一种酶蛋白只能与一种辅助因子结合成特异性的全酶 D.酶蛋白参与传递氢原子或电子的作用
酶学复习题
第一章 酶学与酶工程 1、酶学(Enzymology)研究酶的理论(basic principle, biosynthesis, property, modification-up stream process)。研究酶的结构与功能、酶的催化机制、酶反应动力学、酶的生物合成以及调节机制等的理论学科。 酶工程(Enzyme engineering)研究酶的生产与应用(production and application)。 2、酶工程研究的热点 a.基因工程和蛋白质工程 基因工程与蛋白质工程构建酶是十分诱人的领域:在30亿年生物进化中,只发现了1055种功能蛋白和酶,经计算300个氨基酸可组成不同序列的蛋白质有约10390种,因而在自然界,绝大多数新蛋白或酶仍未产生,有待人类去进行人工定向进化,创造开发新酶类,其中对大量天然蛋白质的DNA测序,建立大量蛋白质功能基因库,为杂交提供重要信息,通过计算机模拟,从头设计及合成全新的非天然有用酶已成为可能。此外,利用天然酶的多样性,通过靶子基因的定点突变噬菌体展示技术,结合化学修饰技术,赋予酶的新结构,新特性,改进酶的催化功能,可使酶制剂工业进入一个崭新的时代。 b.人工合成酶 人工合成酶(Synzyme)是合成具有催化功能的高聚物分子,目前使用分子印迹和生物印迹技术制备人工酶,原理与抗体酶过渡态理论大致相同,已经初步制备了具有蛋白酶功能,氧化还原酶催化功能的人工酶,人工酶亦可用于手性药物及化合物的分离纯化及生物传感器的分子识别,目前人工酶的催化转换数仍很低,需要多学科配合,对酶催化分子机理的深入了解,才会有可能在特殊反应中优于天然酶。 c.酶的定向固定化技术 优点:进一步研究蛋白质结构;且不影响酶的活性和催化功能 d.非水酶学(nonaqueous enzymology) 特点:绝大多数有机物在非水体系溶解度较高;与水中相比,非水系统内酶的稳定性较高;从非水体系内回收产物比水中容易。 e.糖生物学(glucobiology)和糖基转移酶(glucosyltransferase) f.极端环境微生物的新酶种 已发现的极端生命形式包括嗜热菌(thermophiles)、嗜冷茵(psychrophiles)、嗜碱菌(alkaliphiles)、嗜酸菌(acidophiles)、嗜盐苗(halophiles)、嗜压菌(barophiles)等,来自极端微生物的极端酶(extremozymes),可在苛刻条件下行使功能,将极大地拓展酶的应用空间,并是建立高效率、低成本生物技术加工过程的新基础,PCR技术中的高温Taq DNA聚合酶、洗涤剂中的碱性酌等都具代表意义。 g.不可培养微生物的新酶种 3、国内外酶制剂生产应用差异 a.规模:国外多公司重组;国内重复建设、效益低 b.投入:国外开发经费高达15%;国内研究开发投入仅占销售额的1% c.开发重点:国外大力研制、开发新酶种和新用途;国内品种少,剂型少 对我国酶制剂生产的建议:走集约化、规模化经营;加大科研能力;发展具有自己知识产权的新技术;调整产品结构、大力开发新品种。 第二章 1、名词解释
酶的代谢4
第五章诊断酶学 第五章诊断酶学 (一)A1型题(标准型) 1.诊断AMI的金标准是: A.AST B.CK-MB C.LD D.CK E.ChE 2.血浆特异酶的是: A.LD B.CK C.ALT D.ChE E.AST 3.属血浆非特异酶的是: A.AST B.ChE C.LCAT D.脂蛋白脂酶 E.铜氧化酶 4.肾脏中含量最多的酶是: A.γ-GT B.LD C.AST D.AMY E.ALT 5.心脏中含量最多的酶是() A.AST B.CK C.ACP D.LPS E.LD 6.肝脏中含量最多的是: A.ALT B.CK C.LD
D.LPS E.ACP 7.女性高于男性的酶是: A.AST B.CK C.LP D.LDH E.LD 8.雌激素可抑制下列哪种酶: A.ALP B.CK C.LD D.γ-GT E.AST 9.新生儿比成人含量低的酶是: A.AMY B.ALP C.CK D.LD E.AST 10.心肌酶谱常用的除下列哪种酶: A.CK B.AST C.LD D.LPS E.ACP 11.肝酶谱常用的除下列哪种酶: A.AST B.AMY C.LD D.ALT E.CK 12.血清中γ-GT主要来自: A.肝脏 B.胰脏 C.肾脏 D.肠 E.肺
13.肝胆疾病检出阳性率最高的是: A.AST B.LD C.γ-GT D.ALT E.CK 14. 标本发生溶血时对酶测定不产生影响的是: A.AST B.ALT C.CK D.γ-GT E.LD 15. 可判断恶性肿瘤有无肝转移的酶是: A.γ-GT B.AST C.ALT D.LD E.CK 16. 可用于判断乙醇中毒的酶是: A.γ-GT B.AST C.ALT D.LD E.ACP 17. 在常用心肌酶中,AMI时升高最迟的是: A. CK B. LD C.AST D.γ-GT E.ALT 18. 判断前列腺癌最重要的指标之一是: A.ACP B.ALP C.AMY D.CK E.LD 19. 人体胰腺中含()最多 A.ACP
食品酶学第五章 蛋白酶2002
第五章蛋白酶及其应用 PROTEINASE 水解蛋白质中肽键的酶。 水解类型: 外切蛋白酶---从肽链的任意一段切下单个的氨基酸。蛋白质被分解为单个的氨基酸。 内切蛋白酶---与蛋白质内部的肽键反应,水解蛋白质为多肽类或肽类。 地位: 蛋白酶是食品工业中最重要的一类酶。 应用广泛:如干酪生产、肉类嫩化、植物蛋白质改性等大量使用。 存在广泛: 植物:papaya, fig, kiwifruit, pineapple, etc. 动物:消化道---胃蛋白酶、胰凝乳酶、羧肽酶、氨肽酶等。 微生物:蛋白酶等。 第一节蛋白酶的特异性要求 一、对R1和R2基团性质有要求 例如: 胰凝乳蛋白酶仅能水解:R1是酪氨酸、苯丙氨酸或色氨酸残基的侧链的肽键。 胰蛋白酶仅能水解:R1是精氨酸或赖氨酸残基的侧链的肽键。 胃蛋白酶和羧肽酶对R2基团有特异性要求,如果是苯丙氨酸残基的侧链,水解速度最快。 二、氨基酸的构型 蛋白酶的底物---蛋白质和多肽是由L-氨基酸构成的。 三、底物分子的大小 一般没有要求。 但酸性蛋白酶有严格要求。 四、X和Y的性质要求 肽链内切酶:X和Y必须继续衍生出去,X可以是酰基或氨基酸残基,Y可以是酰胺基或酯基或氨基酸残基。 肽链端解酶:X和Y分别是-H或-OH 羧肽酶:要求Y是-OH,R2侧链结构的要求上,X不是-H时,才表现出高的活力。 氨肽酶:要求X是-H,并不优先选择Y不是-OH。 五、对肽键的要求 多数蛋白酶不仅能水解肽键,还能作用于酰胺(-NH2)、酯(-COOR)和硫羟酸酯(-COSR)等。 第二节蛋白酶的分类 一、根据来源分类: 如papain, ficin, 胰蛋白酶,胃蛋白酶(pepsin ),凝乳酶 二、作用模式分类 肽链端解酶:从肽链的一个末端开始将氨基酸水解下来。 羧肽酶:从肽链的羧基末端开始。 氨肽酶:从肽链的氨基末端开始。 肽链内切酶:从肽链的内部将肽链裂解。 三、活性部位的化学性质分类 1、丝氨酸蛋白酶
最新酶学与酶工程复习资料
酶学与酶工程复习资料 上一届考试试题 一、名字解释 1、酶的活性中性:酶分子中直接与底物结合,并和酶催化作用直接有关的区域叫酶的活性中心,参与构成酶的活性中心和维持酶的特定构象所必需的基团为酶的必需基团。 2、米式方程及各字母的意义:米氏方程表示一个酶促反应的起始速度v与底物浓度S关系的速度方程,v=V max·S/(K m+S)。其中 K m值称为米氏常数,V max是酶被底物饱和时的反应速度,[S]为底物浓度。由此可见K m值的物理意义为反应速度(v)达到1/2V max时的底物浓度(即K m=[S]),单位一般为mol/L,只由酶的性质决定,而与酶的浓度无关。 3、别构效应:一个蛋白质与其配体(或其他蛋白质)结合后,蛋白质的空间结构发生改变,使它适用于功能的需要,这一类变化称为别构效应或变构效应。 4、遗传密码:遗传密码决定蛋白质中氨基酸顺序的核苷酸顺序,由3个连续的核苷酸组成的密码子所构成。 5、盐析:增加中性盐浓度使蛋白质、气体、未带电分子溶解度降低的现象。是蛋白质分离纯化中经常使用的方法,最常用的中性盐有硫酸铵、硫酸钠和氯化钠等。 6、内囊性包埋法:系利用天然的或合成的高分子材料(统称为囊材)作为囊膜壁壳,将固态或液态药物包裹成为的药库型微型胶囊。 7、固定化酶:水溶性酶经物理或化学方法处理后,成为不溶于水的但仍具有酶活性的一种酶的衍生物。在催化反应中以固相状态作用于底物。 8、必需水:维持酶分子完整的空间构象所必需的最低水量。 二、问答题 1、温度对酶促反应的影响及原因。 答:温度对酶促反应的影响包括两方面:一方面是当温度升高时,反应速度也加快,这与一般化学反应相同。另一方面,随温度升高而使酶逐步变性,即通过减少有活性的酶而降低酶的反应速度。在低于最适温度时,前一种效应为主,在高于最适温度时,则后一种效应为主,因而酶活性丧失,反应速度下降。 2、操纵子的定义及组成。 答:操纵子:指启动基因、操纵基因和一系列紧密连锁的结构基因的总称,基因表达的协同单位,转录的功能单位。很多功能上相关的基因前后相连成串,由一个共同的控制区进行转录的控制,包括结构基因以及调节基因的整个DNA 序列。操纵子通常由2个以上的编码序列与启动序列、操纵序列以及其他调节序列在基因组中成簇串联组成。 3、蛋白质合成过程当中的主要物质。 答:主要为mRNA、tRNA、氨基酸、核糖核蛋白体以及有关的酶和辅助因子。蛋白质合成是以mRNA为模板,以氨基酸为底物,在核糖体上通过各种tRNA、酶和辅助因子的作用,合成多肽链的过程。 4、酶生物合成模式有哪几种及其特点?简述其接近理想模式的方法? 答:1、同步合成型:酶的生物合成与细胞生长同步进行的一种酶生物合成模式。该类型酶的 生物合成速度与细胞生长速度紧密联系,又称为生长偶联型。2、延续合成型:酶的生物合成在细胞的生长阶段开始,在细胞生长进入平衡期后,酶还可以延续合成一段较长时间。3、中期合成型:酶在细胞生长一段时间以后才开始,而在细胞生长进入平衡期以后,酶的生物合成也随着停止。4、滞后合成型:酶是在细胞生长一段时间或者进入平衡期以后才开始其生物合成并大量积累,又称为非生长偶联型,许多水解酶的生物合成都属于这一类型。 在酶的发酵生产中,为了提高产酶率和缩短发酵周期,最理想的合成模式应是延续合成型。属于延续合成型的酶,在发酵过程中没有生长期和产酶期的明显差别。细胞一开始生长就有酶产生,直至细胞生长进入平衡期以后,酶还可以继续合成一段较长的时间。对于其他合成模式的酶,可以通过基因工程\细胞工程等先进技术,选育得到优良的菌株, 并通过工艺条件的优化控制, 使他们的生物合成模式更加接近于延续合成型。其中对于同步合成型的酶,要尽量提高其对应的mRNA的稳定性,为此适当降低发酵温度是可取的措施;对于滞后合成型的酶,要设法降低培养基中阻遏物的浓度,尽量减少甚至解除产物阻遏或分解代谢物阻遏作用,使酶的生物合成提早开始;而对于中期合成型的酶,则要在提高mRNA的稳定性以及解除阻遏两方面考虑,使其生物合成的开始时间提前,并尽量延迟其生物合成停止的时间。
酶学部分的练习题参考答案学习资料
第一部分填空 1、脱辅酶,辅因子,脱辅酶,辅因子 2、蛋白质或RNA 3、增大,不变 4、生物体活细胞,蛋白质或RNA 5、C,A 6、竞争性,非竞争性 7、酶蛋白,酶辅助因子 8、K m c,K m a 9、疏松,紧密 10、4 11、酶的催化能力,活力单位 12、2---3 13、空间结构,二硫,氢,复性 14、RNA,核酶 15、结合,催化 16、蛋白质,细胞 17、活化能,平衡常数 18、酶的催化能力高,专一性强,酶活力受调节 19、结合部位,催化部位,结合部位,催化部位 20、别构调节,共价修饰 21、结构,立体异构 22、一半,底物23、4,924、竞争性,非竞争性25、竞争性 1、全酶由和组成,在催化反应时,二者所起的作用不同,其中决定酶的专一性和高效率,起传递电子、原子或化学基团的作用。 2、酶是生物体活细胞产生的,具有催化活性的。 3、竞争性抑制剂使酶对底物的表观 Km _______________ ,而 Vmax_ ____________ 。 4、酶是产生的,具有催化活性的。 5、如果一个酶对A、B、C三种底物的米氏常数分别为K m a、K m b和K m c,且K m a﹥K m b﹥K m c,则此酶的最适底物是_________,与酶亲和力最小的底物是_________。 6、___________抑制剂不改变酶促反应V max, ___________抑制剂不改变酶促反应K m。 7、全酶由__________和__________组成。 8、如果一个酶对A、B、C三种底物的米氏常数分别为K m a、K m b和K m c,且K m a﹥K m b﹥K m c,则此酶的最适底物是_________,与酶亲和力最小的底物是_________。 9、辅酶和辅基的区别在于前者与酶蛋白结合,后者与酶蛋白结 合。 10、当酶促反应速度为最大反应速度的80%时,底物浓度是Km值的倍。 11、酶活力是指,一般用表示。 12、酶反应的温度系数Q10一般为。 13、在适当浓度的β-巯基乙醇和8M脲溶液中,RNase(牛)丧失原有活性。这主要是因为RNA酶的被破坏造成的。其中β-巯基乙醇可使RNA酶分子中的 键破坏。而8M脲可使键破坏。当用透析方法去除β-巯基乙醇和脲的情况下,RNA酶又恢复原有催化功能,这种现象称为。
诊断酶学
52 诊断酶学 一、概述 (一)酶的组成、结构与功能 1.酶的本质和特征 ⑴酶的化学本质:绝大部分的酶是蛋白质,有些酶是核酸和酶蛋白组成的复合体,极少数酶是核酸。 ⑵酶除了具有蛋白质的理化性质、一般催化剂的共同性质外,还具有极高的催化效率、高度的特异性(specificity)及催化作用的可调节性等特点。 ⑶由酶所催化的反应称为酶促反应。 ⑷核酶(ribozyme):具有催化作用的核糖核酸。 (二)酶的催化作用机制 1.酶活性中心是酶分子执行催化功能部位 酶分子中能和底物特异结合并将底物转化为产物的区域称为酶的活性中心(active center),酶活性中心是由空间上彼此靠近的化学基团组成的具有特定空间结构的区域。 2.酶反应的诱导契合学说(induced fit hypothesis) 在酶促反应中,酶与底物结合时,底物首先和酶分子上的活性中心相结合,形成酶-底物中间复合物(ES)。在构象上相互诱导,致使活性中心与底物完全紧密结合,这一过程称为诱导契合学说。(三)酶的分类与编号 1. 根据酶所催化反应类型可将酶分为六大类,即: 氧化还原酶类(oxidoreductases) 转移酶类(transferases) 水解酶类(hydrolases) 裂解酶类(或裂合酶类)(lyases) 异构酶类(isomerases) 合成酶类〔synthetases或连接酶类(ligases)〕 2. 国际酶学委员会将每种酶用4个数字加以系统编号。数字前冠以EC,数字之间用黑点隔开。第一个数字表示酶的类别,第二个表示
亚类,第三个表示亚-亚类,第四个表示酶的编号序数。 (四)同工酶的概念与特征 同工酶是指催化相同化学反应,但酶蛋白的分子结构、理化性质乃至免疫学性质不同的一组酶。 同工酶存在于同一种属或同一个体的不同组织或同一细胞的不同亚细胞结构中,使不同的组织、器官和不同的亚细胞结构具有不同的代谢特征,这为同工酶用来诊断不同器官的疾病提供了理论依据。 (五)工具酶参与的指示反应 通常把酶学分析中作为试剂用于测定化合物浓度或酶活性浓度的酶称为工具酶。常用工具酶多为氧化还原酶类。 在临床生化检验中,许多项目的测定均有工具酶参与,最常用的有两类分光光度法: 一类是利用较高特异性的氧化酶产生过氧化氢(H2O2),再加氧化发色剂比色; 另一类是利用氧化-还原酶反应使其连接到NAD(P)-NAD(P)H的正/逆反应后,直接通过分光光度法或其他方法测定NAD(P)H的变化量。 附:酶循环法 酶循环法(enzymatic cycling methods)采用两类工具酶进行循环催化反应,使被测物放大扩增,从而使检测灵敏度提高。目前临床上已应用于总胆汁酸、HCY的测定。 (六)代谢物浓度的酶法测定技术 1.终点法 在代谢物酶促反应中,随着时间的延续,待测物浓度逐渐减少而产物逐渐增多,一定时间后反应趋于平衡,测定反应达到平衡后待测物(底物)或产物变化的总量,即终点法(又称平衡法)。 (1)直接法:如果待测物与产物在理化性质上有可直接进行检测的差异,如吸收光谱不同,则可直接测定待测物或产物本身信号的改变来进行定量分析.
