2014年上半年FDA批准新药

来源:医药经济报
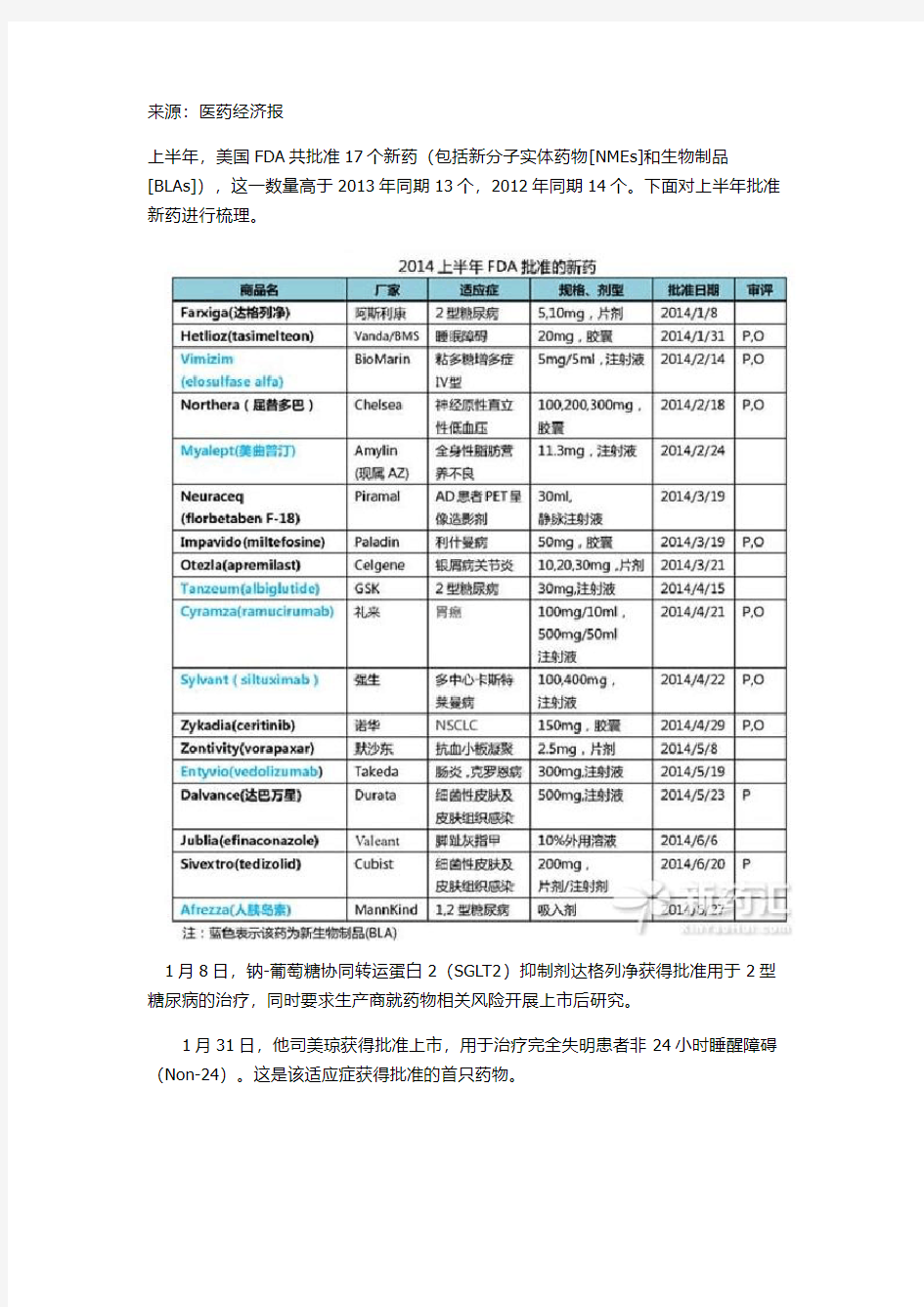
上半年,美国FDA共批准17个新药(包括新分子实体药物[NMEs]和生物制品[BLAs]),这一数量高于2013年同期13个,2012年同期14个。下面对上半年批准新药进行梳理。
1月8日,钠-葡萄糖协同转运蛋白2(SGLT2)抑制剂达格列净获得批准用于2型糖尿病的治疗,同时要求生产商就药物相关风险开展上市后研究。
1月31日,他司美琼获得批准上市,用于治疗完全失明患者非24小时睡醒障碍(Non-24)。这是该适应症获得批准的首只药物。
2月14日,elosulfase 成为首个被FDA批准的粘多糖沉积症 IVA型治疗药物,比预期的提前两周获得批准。
2月18日,FDA授予屈昔多巴加速批准,用于原发性自主神经衰弱(帕金森病,多系统萎缩症和纯自主神经衰弱)、多巴胺β羟化酶缺乏症、非糖尿病性自主神经病变等患者有症状神经源性体位性低血压(NOH)的治疗。屈昔多巴是首个也是唯一一个获FDA批准用于NOH治疗的药物,也是近20年NOH对症治疗的首个新治疗选择。
2月24日,美曲普汀被FDA批准用于全身性脂肪营养不良患者,该药是瘦素类似物。
3月19日,Florbetaben F18成为FDA批准的第3只阿尔茨海默病诊断试剂,用于PET扫描检测β-淀粉样蛋白斑。
3月19日,FDA批准米替福新治疗一种被称为利什曼原虫病的热带病。米替福新是FDA批准第一个治疗皮肤或粘膜利什曼原虫病药物。
3月21日,口服磷酸二酯酶-4抑制剂阿普斯特获批准用于成年活动性银屑病关节炎治疗。据 FDA声明,作为上市后要求,生产商将通过一项妊娠注册研究评估该药物对妊娠女性的暴露效应。
4月15日,每周1次皮下注射剂阿必鲁泰获得批准用于结合饮食和锻炼,用于改善2型糖尿病患者的血糖控制。阿必鲁泰属于胰高血糖素样肽-1(GLP-1)受体激动剂。
4月21日,ramucirumab获得批准用于治疗晚期胃癌或胃食管结合部腺癌。ramucirumab是特异性阻断血管内皮生长因子受体2(VEGFR2)及下游血管生成相关通路的人源化单克隆抗体。ramucirumab被批准用于治疗不可切除的疾病,或者那些对含铂类或含氟尿嘧啶治疗方案治疗后发生进展的患者。
4月23日,FDA批准siltuximab用来治疗罕见病多中心型巨大淋巴结增生症(MCD)。
4月29日,色瑞替尼获得批准用于有某些类型晚期(转移)非小细胞肺癌(NSCLC)患者。色瑞替尼是一种间变性淋巴瘤激酶(ALK)酪氨酸激酶抑制剂阻断促进癌细胞发生蛋白,用于既往唯一被批准ALK酪氨酸激酶抑制剂克唑替尼治疗过有转移ALK-阳性NSCLC患者。
5月8日,FDA批准了沃拉帕沙用于心脏病、中风以及心血管疾病治疗。沃拉帕沙是一种首创的蛋白酶激活受体1(PAR-1)拮抗剂,可以抑制血凝凝块的形成。
5月20日,FDA正式批准vedolizumab用于治疗中重度克罗恩病和溃疡性结肠炎(UC),该药物是一种可注射的单克隆抗体。
5月23日,达巴万星获得批准,用于治疗由革兰氏阳性菌(包括耐甲氧西林金黄色葡萄球菌,MRSA)导致的急性细菌性皮肤和皮肤结构感染(ABSSSI)。
6月9日,efinaconazole获FDA批准用于脚趾甲灰指甲的治疗,该药是首个外用三唑类抗真菌药物。
6月20日,FDA批准磷酸泰地唑胺用于治疗成人急性细菌性皮肤和皮肤组织感染(ABSSSIs)。磷酸泰地唑胺获批具体的目标是由革兰氏阳性细菌。
