小花盾叶薯蓣甙的酶降解_英文_

Enzymatic Degradation of Parvifloside
JIN Jian_Ming,LI U Xi_Kui,TENG Rong_Wei,YANG Chong_Ren *
(State Key L aboratory o f Phytoc hemistry and Plant Resource s in We st China ,Kunming Institute o f Botany ,
The Chinese Ac ademy o f Scie nce s ,Kunmi ng 650204,Chi na)
Abstract : Parvifloside (1),a new furostanol pentaglyc oside,was isolated from the fresh rhizomes of Dioscorea parvi f lora C.T.Ting.On the basis of spectroscopic and chemical methods,its struc ture was eluci dated as (25R )_26_O_ _glucopyranosyl_furost_5_en_3 ,22 ,26_triol 3_O_ _D _glucopyranosyl (1 3)_ _D _glu copyranosyl (1 4)_[ _L _rhamnopyranosyl (1 2)]_ _D _glucopyranoside.Six prosapogenins (2-7)were obtained from the enzymatic degradation of 1by cellulase,but only 3and 4were obtained by _glucosidase.The structures of all compounds were determined by spectroscopic data.The activity of the isolated compounds on deformation of mycelia ger minated from P yricularia oaryzae P_2b c onidia was evaluated.Key words: Dioscorea parvi f lora ;parvifloside;steroidal glycoside;enzymatic degradation It is well known that the furostanol saponin,a kind of C _27steroidal glycoside which is widely distributed in higher plants,especially in Monocotyledoneae [1],is easi ly transformed to its spirostanol counterpart by _glucosi dase or cellulase [2,3].We have reported a series of steroidal saponins with different aglycone and sugar link age patterns from liliaceous plants [3-6].The phylogenetic pathway of these glycosides in plant secondary metabolism is still ambiguous.Dioscorea parviflora ,an ende mic species of family Diosc oreaceae in Yunnan Province,is used as a material to produce diosgenin which is a precur sor material for industrial synthesis of steroidal drugs in China [7].Previous studies have reported the isolation of
four steroidal saponins from this plant [8]
.In this study,we report the isolation and structural elucidation of a ne w furostanol pentaglycoside from the fresh rhizomes of D.parviflora .The enzymatic degradation of the ne w furostanol saponin and the activity of the isolated c om pounds on deformation of mycelia germinated from Pyricu laria oaryzae P_2b conidia were carried out as well.
1 Results and Discussion
The 70%EtOH extract of the fresh rhizomes of D.parviflora was partitioned by n _butanol and water,the aqueous soluble phase was chromatographed successively on Diaion HP_20,silica gel and RP_8to afford 1as white a morphous https://www.360docs.net/doc/604676664.html,pound 1showed red color reac tion to Ehrlich reagent (p_dimethylaminobenzaldehyde (1g)and 20%hydrochloric acid (100mL))in TLC.After the normal procedure with refluxed in 70%aqueous ace tone,it afforded 22_hydroxy form of furostanol glycoside,which was further indicated by the charac teristic ketal carbon signal at !110.9in 13C _NMR spectrum [3].A quasi molecular ion peak of 1was observed at m/z 1225.5817([M-H]-)in the high resolution negative ion FAB mass spec trum,indicating the molecular formula as C 57H 94O 28(calcd for C 57H 93O 28,1225.5853).Acid hydrolysis of 1gave a steroidal sapogenin (1a )and the
sugar residues which were identified as glucose and rham nose by TLC.The steroidal sapogenin (1a )was con
firmed as diosgenin by 1H_and 13C _NMR spectra [9]
.The presence of five sugar units in 1was indicated by anomer ic proton signals (!4.78(1H,d,J =7.6Hz), 4.91(1H,d,J =7.5Hz), 5.09(1H,d,J =7.3Hz),5.27(1H,d,J =7.5Hz)and 6.13(1H,br s))and anomeric carbon signals (!100.3,102.1,104.5,105.5and 105.8)in 1H_and 13C_NMR spectra.Broad singlet peak at !6.13indicated the _orientation at the anomeric center of rhamnose.The J values of the other four anomers of the sugar moieties indicated the _orienta tion at the anomeric center of the D _pyranoses.The above evidence suggested that 1was (25R )_furost_5_en_3 ,22?,26_triol pentaglycoside.
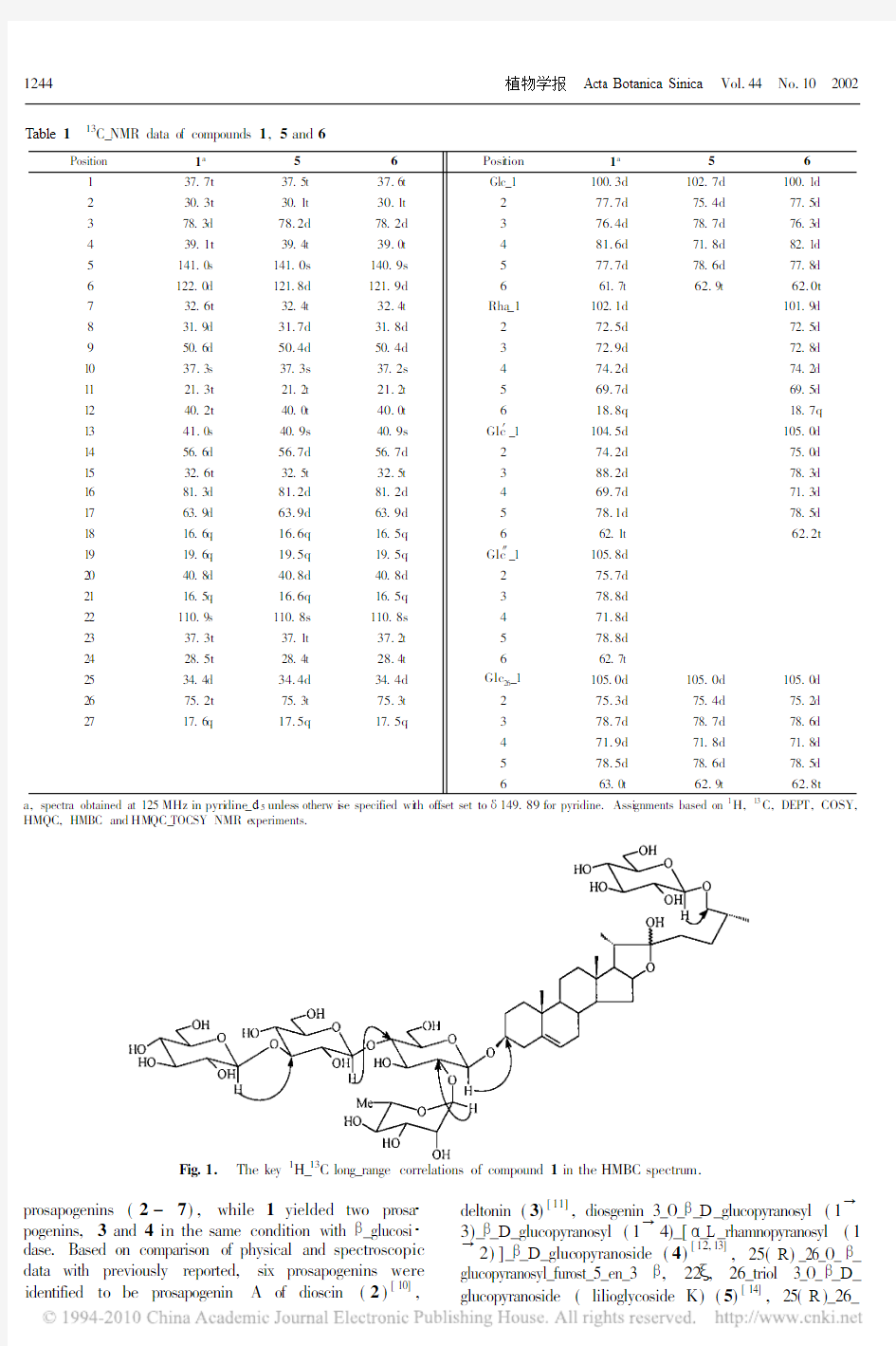
The sugar linkages were determined by the assign ment of 1H and 13C _NMR signals due to the sugar moi eties that were established by analyses of 2D NMR experi ments.13C _NMR chemical shifts due to sugar moieties were assigned easily by H MQC_TOC SY spec trum (Table
1).Three_bond 1H_13
C long_range correlations were ob served in H MBC spectrum.The cross signals were shown at !4.91(H_1of inner glucopyranosyl residue )and 78.3(C _3of aglycone ), 6.13(H_1of ter minal rhamnopyranosyl residue)and 77.7(C_2of inner glu copyranosyl residue), 5.09(H_1of middle glucopyra nosyl residue )and 81.6(C _4of inner gluc opyranosyl residue), 5.27(H_1of terminal glucopyranosyl residue)and 88.2(C_3of middle glucopyranosyl residue ),as well as 4.78(H_1of glucopyranosyl residue)and 75.2(C_26of aglycone)(Fig.1).Thus,the structure of 1was determined to be 25(R )_26_O_ _glucopyranosyl_furost_5_en_3 ,22 ,26_triol 3_O_ _
D _glucopyranosyl (1 3)_ _D _glucopyranosyl (1 4)_[ _L _rha mnopyranosyl (1 2)]_ _D _glucopyranoside,and it was named parvi floside.
Enzymatic hydrolysis of 1with cellulase afforded six
Received:2001 08 08 Accepted:2002 03 28
Supported by the Nati onal Natural Science Foundati on of China (39969005).
*Author for c orrespondence.Tel:+86_871_5223424;Fax:+86_871_5150124.E_mail:
植 物 学 报
Acta Bo tanica Sinica 2002,44(10):1243-1249
Table1 13C_NMR data of compounds1,5and6
Position1a56Posi tion1a56 137.7t37.5t37.6t Glc_1100.3d102.7d100.1d
230.3t30.1t30.1t277.7d75.4d77.5d
378.3d78.2d 78.2d376.4d78.7d76.3d
439.1t39.4t39.0t481.6d71.8d82.1d
5141.0s141.0s140.9s577.7d78.6d77.8d
6122.0d121.8d121.9d661.7t62.9t62.0t
732.6t32.4t32.4t Rha_1102.1d101.9d
831.9d31.7d31.8d272.5d72.5d
950.6d50.4d50.4d372.9d72.8d
1037.3s37.3s37.2s474.2d74.2d
1121.3t21.2t21.2t569.7d69.5d
1240.2t40.0t40.0t618.8q18.7q
1341.0s40.9s40.9s Glc_1104.5d105.0d
1456.6d56.7d56.7d274.2d75.0d
1532.6t32.5t32.5t388.2d78.3d
1681.3d81.2d81.2d469.7d71.3d
1763.9d63.9d63.9d578.1d78.5d
1816.6q16.6q16.5q662.1t62.2t
1919.6q19.5q19.5q Glc!_1105.8d
2040.8d40.8d40.8d275.7d
2116.5q16.6q16.5q378.8d
22110.9s110.8s110.8s471.8d
2337.3t37.1t37.2t578.8d
2428.5t28.4t28.4t662.7t
2534.4d34.4d34.4d Glc26_1105.0d105.0d105.0d
2675.2t75.3t75.3t275.3d75.4d75.2d
2717.6q17.5q17.5q378.7d78.7d78.6d
471.9d71.8d71.8d
578.5d78.6d78.5d
663.0t62.9t62.8t
a,spectra obtained at125MHz in pyri dine_d5unles s otherw i se specified wi th offset set to!149.89for pyridine.Assi gnments based on1H,13C,DEP T,COSY, HMQC,HMBC and HM QC_TOCSY NMR e xperiments.
Fig.1. The key1H_13C long_range correlations of compound1in the HMBC spectru m.
prosapogenins(2-7),while1yielded two prosa
pogenins,3and4in the same condition with _glucosi dase.Based on comparison of physical and spectrosc opic
data with previously reported,six prosapogenins were identified to be prosapogenin A of dioscin(2)[10],deltonin(3)[11],diosgenin3_O_ _D_glucopyranosyl(1 3)_ _D_glucopyranosyl(1 4)_[_L_rhamnopyranosyl(1 2)]_ _D_gluc opyranoside(4)[12,13],25(R)_26_O_ _ glucopyranosyl_furost_5_en_3 ,22 ,26_triol3_O_ _D_
glucopyranoside(lilioglycoside K)(5)[14],25(R)_26_
1244
植物学报 Acta Botanica Sinica Vol.44 No.10 2002
Fig.2. The enzymatic degradation of saponin1.
1,parviflos ide;2,prosapogenin A of diosci n;3,deltonin;4,diosgenin3_O_ _D_glucopyranos yl(1 3)_ _D_glucopyranosyl(1 4)_[_L_rhamnopyranos yl(1 2)]_ _D_gluc opyranoside;5,lilioglyc osi de K;6,deltoside;7,protobioside;C,crude cellulas e;G, _glucosidase.
O_ _glucopyranosyl_furost_5_en_3 ,22 ,26_triol3_O_ _ D_glucopyranosyl(1 4)_[_L_rhamnopyranosyl(1 2)]_ _D_glucopyranoside(deltoside)(6)[11]and25 (R)_26_O_ _glucopyranosyl_furost_5_en_3 ,22 ,26_triol 3_O__L_rha mnopyranosyl(1 2)_ _D_glucopyranoside (protobioside)(7).
I t is well known that furostanol glycosides were easily transformed to the corresponding spirostanol saponin by _ gluc osidase or cellulase[3,9].They only lost a glucosyl unit a t C_26position of aglycones.In our research,1not only transferred to its spirostanol counterpart4,but also gave prosapogenin3by _glucosidase.After hydrolyzed by cellulase,1not only yielded spirostanol prosapogenins 2-4,but also gave furostanol glycosides5-7(Fig.2). The glucosyl unit at C_26position of furostanol gly cosides may be the optimal substrate of _glucosidase,so furostanol glycosides were easily transformed to the corre sponding spirostanol saponins by _glucosidase. Spirostanol saponins can also be degraded by _glucosi dase,if spirostanol saponins have the gluc osyl unit which is the optimal substrate of _glucosidase and are soluble in water.After4was incubated with _glucosidase in a Na Ac_HOAc(pH5.0)buffer at25?for16h,3was detected on TLC.Why was not3degraded by _gluc osi dase?The glucosyl unit at C_3position of3may not be the optimal substrate of _glucosidase and3is insoluble in water,so3could not be degraded by _glucosidase.
The cellulase used in the experiment was proven to be very impure by electrophoresis.The activity of its _ glucosidase might be very low.We suggested the cellulase used in the experiment was crude cellulase.It is reported for the first time that the furostanol glycoside was de grad ed partially and formed a series of prosapogenins with both of spirostanol and furostanol skeleton after hydrolyzed by crude cellulase.The enzymatic degradation or transforma tion of crude cellulase may be a good way to establish molecular bank of steroidal saponins for bioassay test. Moreover,it may be an important route to the formation of molecular diversity of steroidal saponins in plants.
Compounds2,3and5e xhibited significant activity of morphological deformation of mycelia germinated from Pyricularia oaryzae P_2b c onidia and sho wed minimum
JIN Jian_Ming et al:Enzymatic Degradation of Parvifloside1245
Table2 13C_NMR data of compounds1a,2-4
Position1a234Posi tion234 137.2t37.6t37.6t37.5t Glc_1100.5d100.2d100.0d 231.4t30.3t30.2t30.2t278.0d78.5d77.3d 371.6d78.2d78.3d78.3d379.7d76.2d76.2d 442.2t39.1t39.0t39.0t472.0d82.1d81.5d 5140.8s141.0s140.9s140.8s578.2d77.7d77.7d 6121.3d121.8d121.8d121.8d662.8t62.1t61.6t 732.0t32.4t32.3t32.3t Rha_1102.0d101.8d101.8d 831.5d31.8d31.8d31.7d272.6d72.4d72.5d 950.0d50.5d50.4d50.3d372.9d72.8d72.8d 1036.6s37.2s37.2s37.2s474.3d74.2d74.2d 1120.8t21.2t21.2t21.1t569.5d69.4d69.4d 1239.7t40.0t40.0t39.9t618.7q18.6q18.7q 1340.2s40.6s40.6s40.5s Glc_1105.2d104.6d 1456.4d56.8d56.8d56.7d275.0d73.8d 1531.8t32.3t32.4t32.3t378.3d88.3d 1680.8d81.2d81.2d81.2d471.4d69.5d 1762.0d63.0d63.0d62.9d577.5d78.0d 1816.2q16.4q16.4q16.4q662.2t61.8t 1914.5q19.5q19.4q19.4q Glc!_1105.9d 2041.5d42.1d42.2d42.0d275.6d 2114.5q15.0q15.0q15.1q378.2d 22109.2s109.3s109.3s109.3s471.7d 2331.3t31.9t31.9t31.9t578.7d 2428.7t29.3t29.3t29.3t662.6t 2530.2d30.7d30.7d30.6d
2666.8t67.0t67.0t66.9t
2717.1q17.3q17.3q17.4q
morphological defor mation concentration as1.17, 1.17 and1.95#g/mL,respectively(Table3).This result suggested that the sugar linkage might play an important role in the biological activity of steroidal saponins.
Table3 Effect of compounds1-6on deformation of mycelia ger minated from Pyricu laria oaryzae P_2b conidia
Compounds Sample quantity(mg)Mmdc(#g/mL)
1 1.5187.50
20.6 1.17
30.6 1.17
4 1.375.00
5 1.0 1.95
6 1.713.30 Mmdc,mini mum morphol ogical deformation concentrati on.
2 Experimental
2.1 General experimental procedures
The melting point was determined on XRC_1instru ment and was uncorrected.Optical rotations were mea sured in pyridine with HORIB A SEPA_300high_sensitive polarime ter.IR(KBr)spectra were measured on Bio_Rad FTS_135spectrophotometer.NMR spectra were recorded on a Bruker DRX_500or Brucker AM_400instrument at 25?,using TMS as an internal standard.The negative ion FAB mass spectra were rec orded on a VG AutoSpec mass spectrometer using glycerol as matrix.MPLC was carried out on B chi681chroma tography syste m and B chi684fraction collector.Diaion HP_20(Mitsubishi Chemical Industries),silica gel(Qingdao Haiyang Chem ical Co.),RP_8(Merck)were used for column chro matography.Precoated silica gel plates(Qingdao Haiyang Chemical Co.)were used for TLC and HPTLC.Detection was done by spraying the plates with10%H2SO4,fol lowed by heating.
2.2 Plant material
The fresh rhizomes of Dioscorea parvi f lora C.T. Ting were c ollected in Qiubei C ounty,Yunnan Province, China,in May1999.The plant was identified by Prof. LU Chun_Chao.A voucher specimen was preserved at the herbarium of Kunming Institute of Botany,the Chinese Academy of Sciences.
2.3 Extraction and isolation
The fresh rhizomes of D.parvi f lora(70kg)were crushed and e xtracted with70%aqueous ethanol(70L) for4h three times.The concentrated e xtract was parti tioned between n_butanol and water.The aqueous layer was subjec ted to Diaion HP_20column chromatography and gave a MeOH eluate(81g),which was frac tionated on a silica gel column eluting with C HCl3_MeOH_H2O(7 #3#0.5)and was divided into18fractions.Fractions16 and17were combined(15g),and c hromatographed to
1246
植物学报 Acta Botanica Sinica Vol.44 No.10 2002
yield a pair of22_hydroxy and22_methoxy forms of furostanol saponins by silica gel(CHCl3_MeOH_H2O(7# 2.5#0.4))and RP_8(50%aqueous Me OH).After re fluxed with70%aqueous acetone for10h[15],compound 1was afforded(11.3g).
2.4 Acid hydrolysis of1
Compound1(80mg)was refluxed with2mol/L HCl_dioxane(1#1,V/V,4mL)on water bath for6h. After cooling,the reaction mixture was evaporated to dry ness.The dry reaction mixture was e xtrac ted by C HCl3 four times.The C HCl3extrac t was chromatographed on an silica gel column and gave a steroidal sapogenin(1a)(19 mg).Sugar residues were checked on an HPTLC silica gel50000F254plate using C HCl3_MeOH_Me2CO_H2O(3# 3#3#1)as developing solvent(R f0.51(glucose),0.68 (rhamnose)).
2.5 Enzymatic hydrolysis of1
Compound1(350mg)and cellulase(Dongfeng Bioche m.Co.,350mg)in a NaOAc_HOAc buffer(pH 5.0,50mL)were incubated at25?for16h.The re ac tion liquid was extrac ted with n_butanol four times.The n_butanol layer(320mg)was chromatographed by silica gel[C HCl3_MeOH,10#1]and RP_8MPLC,and afford ed2(37mg),3(55mg),4(8mg),5(24mg),6 (25mg)and7,respectively.(7was only determined by negative ion FAB mass spectrum and comparison of au thentic sample on TLC because its quantity was very low).
Compound1(90mg)and _glucosidase(90mg) (SIGMA)in a NaOAc_HOAc buffer(pH5.0,90mL) were incubated at25?for16h.The resulting mixture was extracted by n_butanol four times.The n_butanol ex tract(75mg)was chromatographed to give3(15mg) and4(46mg)by silica gel MPLC(CHCl3_MeOH,10#
1).
2.6 Bioassay
A90_well flat_bottomed assay plate was used for the bioassay.The first,middle and last columns were pre served for negative and positive controls.Rhizoxin was used for positive control with the final concentrations of1 #mol/L,0.5#mol/L,0.25#mol/L,0.125#mol/L, 60nmol/L,30nmol/L,16nmol/L,and8nmol/L. One column(eight wells)was usually used for one test material with eight different concentrations.Each50#L of conidia suspension of Pyricularia oaryzae P_2b(4?104conidia/mL)was first poured into each well,and50 #L of each test solution was then added to the first well. The suspension was mixed and taken50#L to the second well.The procedure was repeated to the last well of the column.For negative control,50#L of water was added to the first well follo wed by the procedure as above.The assay plates were incubated at27?for16h,and the shape of mycelia ger minated from c onidia was observed and c ompared with controls under an inverted micro scope[16].
2.7 Identification
Parvifloside(1) A white amorphous powder (70%aqueous acetone),mp194-196?.[]D28.5 -46.07%(c0.036,pyridine).IR?KB r max c m-1:3401, 2930,1073,1035.HRFAB_MS m/z1225.5817[M
-H]-(calcd for C57H93O28,1225.5853).Ne gative ion FAB_MS m/z1225[M-H]-,1079[M-H-
146]-,1063[M-H-162]-,901[M-H-162-
162]-,755[M-H-162-162-146]-.1H_NMR (C5D5N):!0.89(3H,s,H_18), 1.04(3H,s,H_
19),0.98(3H,d,J=6.3Hz,H_27),1.33(3H,d, J=6.1Hz,H_21), 1.73(3H,d,J=4.8Hz,Rha H_6), 3.61, 4.05(1H each,H_26), 3.92(1H,H_ 3), 4.78(1H,d,J=7.6Hz,Glc26H_1),4.91(1H, d,J= 6.0Hz,Glc H_1), 4.95(1H,H_16), 5.09 (1H,d,J=7.3Hz,Glc H_1), 5.27(1H,d,J= 7.5Hz,Glc!H_1), 5.31(1H,s,H_6), 6.16(1H, br s,Rha H_1).13C_NMR data see Table1.
Diosgenin(1a) A white amorphous po wder (C HCl3).IR?KBr max c m-1:3392,2946,1456,1375, 1174,1052,980,918,899,864(intensity:899> 918).EI_MS m/z:414,355,342,326,300,282, 271,253,139(base peak),115.1H_NMR(CDCl3):!
0.74(3H,s,H_18),0.97(3H,s,H_19),0.73 (3H,d,J=6.1Hz,H_27),0.92(3H,d,J=6.96 Hz,H_21).13C_NMR data see Table2.
Prosapogenin A of dioscin(2) A white amor phous powder(MeOH),mp239-241?.[]D19.2 -50.15%(c0.1,pyridine).I R?KBr max cm-1:3414, 2943,1633,1455,1051,981,919,899(intensity: 899>919).Negative ion FAB_MS m/z721[M-H]-.
1H_NMR(C
5
D5N):!0.67(3H,d,J=5.4Hz,H_ 27),0.81(3H,s,H_18), 1.03(3H,s,H_19), 1.12(3H,d,J=7.0Hz,H_21),1.77(3H,d,J= 5.6Hz,Rha H_6), 3.95(1H,m,H_3), 5.03(1H, d,J=7.2Hz,Glc H_1), 5.28(1H,br d,J=4.8 Hz,H_6), 6.37(1H,br s,Rha H_1).13C_NMR data see Table2.
Deltonin(3) A white amorphous po wder (MeOH),mp300-304?(decomposed).[]D19.2 -83.85%(c0.0325,pyridine).IR?KBr max cm-1:3440, 2938,1633,1455,1062,984,917,900(intensity: 900>917).Negative ion FAB_MS m/z883[M-H]-, 721[M-H-162]-.1H_NMR(C5D5N):!0.68(3H, d,J= 5.0Hz,H_27),0.81(3H,s,H_18), 1.03 (3H,s,H_19), 1.12(3H,d,J=6.8Hz,H_21), 1.78(3H,d,J=7.0Hz,Rha H_6), 3.83(1H,m, H_3), 4.92(1H,d,J= 6.5Hz,Glc H_1), 5.10 (1H,d,J=7.8Hz,Glc H_1),5.28(1H,br s,J= 4.2Hz,H_6), 6.21(1H,br s,Rha H_1).13C_NMR data see Table2.
Compound4 A white a morphous po wder (MeOH),mp282-286?(decomposed).[]D20.4 -85.00%(c0.015,pyridine).IR?KBr ma x c m-1:3410, 2937,1633,1455,1050,983,919,899(intensity: 899>919).Negative ion FAB_MS m/z1045[M-H]-,883[M-H-162]-,721[M-H-162-
JIN Jian_Ming et al:Enzymatic Degradation of Parvifloside1247
162]-.1H_NMR(C5D5N):0.68(3H,d,J=5.6Hz, H_27),0.82(3H,s,H_18), 1.04(3H,s,H_19),
1.12(3H,d,J=7.0Hz,H_21),1.75(3H,d,J=
6.2Hz,Rha H_6), 3.88(1H,m,H_3), 4.93(1H,
d,J=7.7Hz,Glc H_1), 4.95(1H,16_H), 5.08
(1H,d,J=7.9Hz,Glc H_1), 5.27(1H,d,J= 7.9Hz,Glc!H_1), 5.31(1H,s,6_H), 6.22(1H, br s,Rha H_1).13C_NMR data see Table2.
Lilioglycoside K(5) A white amorphous powder (70%aqueous acetone),mp204-208?.[]D19.7 -25.00%(c0.04,pyridine).IR?KBr max cm-1:3401, 2923,1078,1028.Ne gative ion FAB_MS m/z:755 [M-H]-,593[M-H-162]-.1H_NMR(C5D5N): !0.88(3H,s,H_18),1.04(3H,s,H_19),0.95 (3H,d,J=6.6Hz,H_27), 1.33(3H,d,J=6.3 Hz,H_21), 4.79(1H,d,J=7.7Hz,Glc26H_1), 4.89(1H,d,J=7.7Hz,Glc3H_1).13C_NMR data see Table1.
Deltoside(6) A white amorphous powder(70% aqueous acetone),mp245-247?.[]D20.7-48.62% (c0.145,pyridine).IR?KBr max cm-1:3401,2930, 1073,1035.Negative ion FAB_MS m/z:1063[M-H]-,901[M-H-162]-,755[M-H-162-146]-.1H_NMR(C5D5N):!0.88(3H,s,H_18), 1.04(3H,s,H_19),0.97(3H,d,J=5.8Hz,H_ 27),1.33(3H,br d,H_21), 1.74(3H,d,J=4.5 Hz,Rha H_6), 3.61, 4.04(1H each,both dd_like, H_26), 3.92(1H,dd_like,H_3), 4.79(1H,d,J= 7.2Hz,Glc26H_1), 4.93(1H,d_like,Glc H_1), 5.12(1H,d,J=6.6Hz,Glc H_1), 5.27(1H,s, H_6), 6.22(1H,br s,Rha H_1).13C_NMR data see Table1.
Protobioside(7) Ne gative ion FAB_MS m/z901 [M-H]-,755[M-H-146]-. Acknowledgements:The authors are grateful to the ana lytical group of State Key Laboratory of Phytochemistry and Plant Resources in West China,Kunming Institute of Botany,the Chinese Academy of Sciences for measure ments of all spec tra.We are also grateful to Professor Xingcong LI(University of Mississippi)for revision of the manuscript.
References:
[1] Yang T_R(杨崇仁),Chou J(周俊).On the origin of
monocotyledonal from comparative studies of the chemical
constituents.Acta Phytota x on Sin(植物分类学报),
1978,16:1-9.(in Chinese with English abstract)
[2] Kawaski T,Komori T,Miyahara K,Nohara T,Hosokawa
I,M ihashi K.Furostanol bi sglycosides corresponding to
dioscin and gracillin.Che m Pharm Bull,1974,22:2164-
2175.
[3] Li X C,Wang D Z,Yang C R.Steroidal saponi ns from
Chlorophytum mala yense.Phytochemistry,1990,29:3893
-3898.
[4] Li X C,Yang C R,Ichikawa M,Matsuura H,Kasai R,
Yamasaki K.Steroid saponins from Polygonatu m
kingianum.Phytochemistry,1992,31:3559-3563.
[5] Li X C,Wang Y F,Wang D Z,Yang C R.Steroidal
saponins from Diuranthera ma jor.Phytochemistry,1990,
29:3899-3901.
[6] Di ng Y,Chen Y Y,Wang D Z,Yang C R.Steroidal
saponins from a cultivated form of Agave sisalana.Phyto
chemistry,1989,28:2787-2791.
[7] Wu Z_Y(吴征镒),Zhuo T_Y(周太炎),Xiao P_G(肖
培根).Outline of New Chinese Herbal.Vol. 1.Shang
hai:Shanghai Science and Technology Publisher,1988.
520.(in Chinese)
[8] Liu C_L(刘承来),Chen Y_Y(陈延镛),Ge S_B(葛绍
彬).Isolation and identification of steroidal saponins from
Dioscorea parvi flora C.T.T ing.Acta Bot Sin(植物学
报),1985,27:635-639.(i n Chinese wi th English ab
stract)
[9] Agrawal P K,Jain D C,Gup ta R K,Thakur R S.Carbon_
13NMR spectroscopy of steroidal sapenins and steroidal
saponins.Ph ytochemistry,1985,24:2479-2496. [10] Hu K,Dong A J,Yao X S.Antineoplastic agent.&.
Three spiros tanol glycoside from rhizomes of Dioscorea col
lettii var.h ypoglauca.Plan ta Med,1996,62:573-575.
[11] Watanabe Y,Sanada S,Ida Y,Shoji https://www.360docs.net/doc/604676664.html,parative stud
ies on the constituents of ophiopogonis tuber and i ts con
geners.?.Studies on the constituents of the subterranean
part of Ophiop ogon planisca p us Nakai.(1).Chem Pharm
Bull,1983,31:3486-3495.
[12] Vasil'eva I S,Paseshnichenko V A,Guseva A R.Steroid
saponins from Dioscorea caucasica Lipsky rhizomes.Prikl
Biokhim Mikr obiol,1984,20:404-406.
[13] Jain D C,Tripathi A K.Insect feeding_deterren t activity of
some saponin glycosides.Ph ytother Res,1991,5:139-
141.
[14] Guriev A.Studies on steroid glycoside content in some spec
imen motives of the species Lilium.lilioglycoside from L.
regale.Stiinte Biol Chim,1995,3:20-22.
[15] Konishi T,Shoji J.Studies on the constituents of Aspargi
radix.&.On the structures of furostanol oli gosides of As
p a ragus cochinchinensis(Loureio)Merrill.Chem Pharm
Bull,1979,27:3086-3094.
[16] Kobayashi H,Nami koshi M,Yoshi moto T,Yukushi T.A
screening method for anti mi totic and antifungal substances
using conidia of Pyricua ria oryzae,modification and appli
cation to tropical marine fungi.J Antibiotics,1996,49:873
-879.
1248
植物学报 Acta Botanica Sinica Vol.44 No.10 2002
小花盾叶薯蓣甙的酶降解
金建明 刘锡葵 滕荣伟 杨崇仁*
(中国科学院昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室,昆明650204)
摘要: 从小花盾叶薯蓣(Dioscorea parvi flora C.T.Ting)的新鲜根状茎中分离到一个新的呋甾烷型配糖体,命名为小花盾叶薯蓣甙(parvifloside)(1),其结构通过波谱和化学方法鉴定为:(25R )_26_O_ _glucopyranosyl _furos t_5_en _3 ,22 ,26_triol 3_O_ _D _glucopyranosyl (1 3)_ _D _glucopyranosyl (1 4)_[ _L _rhamnopyranosyl (1 2)]_ _D _glucopyra noside 。化合物1在纤维素酶粗酶和 _葡萄糖苷酶中进行水解,得到降解产物2-7。对1的酶解现象进行了讨论。同时,对所分离的甾体皂甙的抗稻瘟霉菌活性进行了初步筛选。关键词: 小花盾叶薯蓣;小花盾叶薯蓣甙;甾体皂甙;酶降解
中图分类号:R914 文献标识码:A 文章编号:0577 7496(2002)10 1243 07
收稿日期:2001 08 08 接收日期:2002 03 28基金项目:国家自然科学基金(39969005)。*通讯作者。Tel.:+86_871_5223424;Fa x:+86_871_5150124;E_mail:
(责任编辑:王 葳)
JIN Jian _Ming et al :Enzymatic Degradation of Parvifloside 1249
过氧化氢酶
过氧化氢酶 过氧化氢酶,是催化过氧化氢分解成氧和水的酶,存在于细胞的过氧化物体内。过氧化氢酶是过氧化物酶体的标志酶, 约占过氧化物酶体酶总量的40%。过氧化氢酶存在于所有已知的动物的各个组织中,特别在肝脏中以高浓度存在。过氧化氢酶在食品工业中被用于除去用于制造奶酪的牛奶中的过氧化氢。过氧化氢酶也被用于食品包装,防止食物被氧化。 触酶 过氧化氢酶(CAT)是一种酶类清除剂,又称为触酶,是以铁卟啉为辅基的结合酶。它可促使H2O2分解为分子氧和水,清除体内的过氧化氢,从而使细胞免于遭受H2O2的毒害,是生物防御体系的关键酶之一。CAT作用于过氧化氢的机理实质上是H2O2的歧化,必须有两个H2O2先后与CAT相遇且碰撞在活性中心上,才能发生反应。H2O2浓度越高,分解速度越快。 来源 几乎所有的生物机体都存在过氧化氢酶。其普遍存在于能呼吸的生物体内,主要存在于植物的叶绿体、线粒体、内质网、动物的肝和红细胞中,其酶促活性为机体提供了抗氧化防御机理。 CAT是红血素酶,不同的来源有不同的结构。在不同的组织中其活性水平高低不同。过氧化氢在肝脏中分解速度比在脑或心脏等器官快,就是因为肝中的CAT含量水平高。 过氧化氢酶历史 作为一种物质,过氧化氢酶是在1811年被过氧化氢(H2O2)的发现者泰纳尔(Louis Jacques Thénard)首次发现。1900年,Oscar Loew将这种能够降解过氧化氢的酶命名为“catalase”,即过氧化氢酶,并发现这种酶存在于许多植物和动物中。1937年,詹姆斯·B·萨姆纳将来自牛肝中的过氧化氢酶结晶,并在次年获得了该酶的分子量。1969年,牛的过氧化氢酶的氨基酸序列得以解出。而后,1981年,其三维结构得以解析。 功能 过氧化氢是一种代谢过程中产生的废物,它能够对机体造成损害。为了避免这种损害,过氧化氢必须被快速地转化为其他无害或毒性较小的物质。而过氧化氢酶就是常常被细胞用来催化过氧化氢分解的工具。 但过氧化氢酶真正的生物学重要性并不是如此简单:研究者发现基因工程改造后的过氧化氢酶缺失的小鼠依然为正常表现型,这就表明过氧化氢酶只是在一些特定条件下才对动物是必不可少的。 一些人群体内的过氧化氢酶水平非常低,但也不显示出明显的病理反应。这很有可能是因为正常哺乳动物细胞内主要的过氧化氢清除剂是过氧化物还原酶(peroxiredoxin),而不是过氧化氢酶。
过氧化氢酶(CAT)活性检测试剂盒说明书 紫外分光光度法
过氧化氢酶(CAT)活性检测试剂盒说明书紫外分光光度法 注意:正式测定之前选择2-3个预期差异大的样本做预测定。货号:BC0200规格:50T/48S 产品内容: 提取液:液体60mL×1瓶,4℃保存;试剂一:液体60mL×1瓶,4℃保存;试剂二:液体100μL×3瓶,4℃保存。产品说明: CAT(EC 1.11.1.6)广泛存在于动物、植物、微生物和培养细胞中,是最主要的H 2O 2清除酶,在活性氧清除系统中具有重要作用。 H 2O 2在240nm 下有特征吸收峰,CAT 能够分解H 2O 2,使反应溶液240nm 下的吸光度随反应时间而下降,根据吸光度的变化率可计算出CAT 活性。试验中所需的仪器和试剂: 紫外分光光度计、台式离心机、可调式移液器、1mL 石英比色皿、研钵、冰和蒸馏水操作步骤:一、粗酶液提取: 1、细菌、细胞或组织样品的制备 细菌或培养细胞:收集细菌或细胞到离心管内,离心后弃上清;按照细菌或细胞数量(104 个):提取液体积(mL)为500-1000:1的比例(建议500万细菌或细胞加入1mL 提取液),超声波破碎细菌或细胞(功率20%或200w,超声3秒,间隔10秒。重复30次);8000g 4℃离心10分钟,取上清,置冰上待测。 组织:按照组织质量(g):提取液体积(mL)为1:5-10的比例(建议称取约0.1g 组织,加入1mL 提取液),进行冰浴匀浆。8000g 4℃离心10分钟,取上清,置冰上待测。2、血清(浆)样品:直接检测。
二、CAT 测定操作 1、分光光度计预热30min 以上,调节波长至240nm 处,蒸馏水调零。 2、CAT 检测工作液的配置:用时在每瓶试剂二(100μL)中加入20ml 试剂一,充分混匀,作为工作液; 用不完的试剂4℃保存一周。 3、测定前将CAT 检测工作液37℃(哺乳动物)或25℃(其他物种)水浴10min。 4、取1mLCAT 检测工作液于1mL 石英比色皿中,再加入35μL 样本,混匀5s;室温下立即测定240nm 下的 初始吸光值A1和1min 后的吸光值A2。计算ΔA=A1-A2。三、CAT 活性计算: 1、血清(浆)CAT 活力的计算: 单位的定义:每毫升血清(浆)在反应体系中每分钟催化1nmol H 2O 2降解定义为一个酶活力单位。CAT(U/mL)=[ΔA×V 反总÷(ε×d)×109 ]÷V 样÷T=678×ΔA 2、组织、细菌或细胞中CAT 活力计算:(1)按样本蛋白浓度计算: 单位的定义:每mg 组织蛋白在反应体系中每分钟催化1nmol H 2O 2降解定义为一个酶活力单位。CAT(U/mg prot)=[ΔA×V 反总÷(ε×d)×109 ]÷(V 样×Cpr)÷T=678×ΔA÷Cpr (2)按样本鲜重计算: 单位的定义:每g 组织在反应体系中每分钟催化1nmol H 2O 2降解定义为一个酶活力单位。CAT(U/g 鲜重)=[ΔA×V 反总÷(ε×d)×109 ]÷(W×V 样÷V 样总)÷T=678×ΔA÷W 3、按细菌或细胞中CAT 活力计算: 单位的定义:每1万个细菌或细胞在反应体系中每分钟催化1nmol H 2O 2降解定义为一个酶活力单位。CAT(U/104cell)=[ΔA×V 反总÷(ε×d)×109]÷(500×V 样÷V 样总)÷T=1.356×ΔA V 反总:反应体系总体积,1.035×10-3L;ε:H 2O 2摩尔吸光系数,4.36×104L/mol/cm;d:比色皿光径,1cm; V 样:加入样本体积,0.035mL;V 样总:加入提取液体积,1mL;T:反应时间,1min。 W:样本鲜重,g; Cpr:上清液蛋白浓度,mg/mL;
酶的作用机理 模型
酶 山东省青岛市城阳第一高级中学高二(二)班 作者姓名:孙一丹王辉韩德琛 指导教师:杨永丰 摘要:大千世界,无奇不有,最奇莫过于生命:而生命,则是一大群化学反应的有机结合体。在这不计其数的反应中,酶,作为其中极重要的一员,无时无刻不控 制影响着生命体的新陈代谢。下面我们将探索神奇的酶世界。本文中将介绍一 种我们自主设想的模型——“带孔的橡皮球”,浅释酶的催化原理。 注:本文中图片均为借助画图板工具手工绘制。 关键词:酶催化原理酶工程 酶的神奇 氧分子是很挑食的,如果不同时给它四个电子,它就不吃。似乎这么慷慨大方的只有碱金属,要不然,谁愿意在常温下给那么多电子啊。但在生物体内却大不相同。是什么能让有机物在体内安静的与氧分子化合?是酶。纤维素是由D-葡萄糖以β1,4-糖苷键连接而成的,如果靠氢离子来分解,需要稀酸加压或浓酸才能催化,而一些以纤维素为碳源的细菌真菌,则可以通过纤维素酶在温和的条件下来分解它们,从而得到养分。 一且生物的几乎所有的生命活动都离不开酶,正是因为有酶协调有序参与才使生命新陈代谢有条不紊地进行着。 酶为什么有这么强大的功能? 下面我们来探讨这个问题。 关于酶 酶是一种高效的生物催化剂,其化学本质是蛋白质。当然也有少数酶是RNA,叫做核酶。所以要认清酶的真面目,首先要搞明白蛋白质的化学情况。 一、蛋白质档案 蛋白质的基本组成单位是氨基酸。在500余种天然氨基酸中,只有20种参与构成了绝大多数的蛋白质。由于除了甘氨酸之外的氨基酸都含有手性碳原子,所以氨基酸有L和D之分。构成生物体的氨基酸基本是L型。 根据其侧链集团的性质,这20种氨基酸可分为酸性氨基酸、碱性氨基酸和非极性氨基酸。 由氨基酸互相脱水缩合而形成的聚酰胺肽长链,叫做肽链。肽链的羧基端称为C-端,氨基端称为N-端。蛋白质是有一条或多条肽链构成的,有的还携有辅酶或辅基、金属离子。 蛋白质是有其构成层次的。1951年丹麦生物化学家Linderstrom-Lang第一次提出蛋白质的一、二、三级结构概念,1958年美国晶体学家Bernal提出蛋白质的四级结构概念。后经国际生物化学与分子生物学协会(IUBMB)的生化命名委员会采纳并作出定义。 一级结构是指蛋白质肽链中氨基酸的种类和排列顺序。如:
溶菌酶
溶菌酶 溶菌酶 溶菌酶( Lysozyme,E.C.3.2.17),全称为1,4-p -N -溶菌酶,又称为细胞壁溶解酶,是自然界普遍存在的一种酶,因其能溶解细菌细胞壁具有溶菌作用而得名。 (一)溶菌酶的结构及物理化学性质 溶菌酶易溶于水,遇碱易破坏,不溶于丙酮、乙醚,是一种白色、无臭的结晶粉末。相对分子质量为14.7ku,由129个氨基酸残基组成,碱性氨基酸残基及芳香族氨基酸如色氨酸残基的比例很高,含有4个二硫键,如图2 -24所示,其等电点为10~11。在37℃条件下溶菌酶的生物学活性可保持6h,当温度较低时保持时间更长,利于溶菌酶在体内发挥作用。禽蛋蛋清是溶菌酶的重要来源,蛋清溶菌酶的物理化学性质如表17 -1所示。溶菌酶由两个区域组成,由一个长的α螺旋所联接,其二级结构大多是α螺旋。N末端的区域( f40~80)由一些螺旋线组成,大多数是反平行的β折叠。第二个区域由fl~39和f89~129氨基酸残基组成。分子中的这两个区域被一个螺旋体(f87天冬氨酸- 114精氨酸)所分离,分子组成了内部疏水外部亲水的基本结构,对溶菌酶发挥抗菌功能起着巨大的作用。 表17 -1 蛋清溶菌酶的物理化学特性 特性数值 相对分子质量14 400 亚基数 1 氨基酸129 等电点10.7 二硫键数 4 碳水化合物所占比例0 E1%280nm 26.4 93℃时的D热值(每分钟破坏90%的活性)110 酶活力的实验通过浑浊溶壁微球菌的细胞溶解 (二)溶菌酶的来源 溶菌酶在自然界中普遍存在,在人和许多哺乳动物的组织和分泌液中,均发现有溶菌酶存在,其物化性质基本相似,溶菌酶的来源如表17 -2所示。溶菌酶主要分布于禽蛋和鸟类蛋清中,尤其是浓厚蛋白的系带膜状层中。禽蛋中异常丰富,占整个蛋清中的 3.5%,鸡蛋蛋清是溶菌酶的主要商业来源。 表17 -2溶菌酶的来源
光催化降解甲基橙
N-TiO2的制备及可见光降解有机污染物的测定 一、目的要求 1、N掺杂TiO2光催化剂的简易液溶液制备; 2、测定甲基橙在可见光作用下的光催化降解反应速率常数; 3、了解可见光分光光度计的构造、工作原理、掌握分光光度计的使用方法。 二、实验原理 国内外大量研究表明,光催化法能有效地将烃类、卤代有机物、表面活性剂、染料、农药、酚类、芳烃类等有机污染物降解,最终无机化为CO2, H2O。因此,光催化技术具有在常温常压下进行,彻底消除有机污染物,无二次污染等优点。 光催化技术的研究涉及到原子物理、凝聚态物理、胶体化学、化学反应动力学、催化材料、光化学和环境化学等多个学科,因此多相光催化科技是集这些学科于一体的多种学科交叉汇合而成的一门新兴的科学。 光催化以半导体如TiO2,ZnO,CdS,WO3,SnO2,ZnS,SrTiO3等作催化剂,其中TiO2具有价廉无毒、化学及物理稳定性好、耐光腐蚀、催化活性好等优点。TiO2是目前广泛研究、效果较好的光催化剂之一。 半导体之所以能作为催化剂,是由其自身的光电特性所决定的。半导体粒子含有能带结构,通常情况下是由一个充满电子的低能价带和一个空的高能导带构成,它们之前由禁带分开。研究证明,当pH=1时锐钛矿型TiO2的禁带宽度为3.2eV,半导体的光吸收阈值λg与禁带宽度Eg的关系为 (nm)=1240/E g(eV) 当用能量等于或大于禁带宽度的光(λ<388nm的近紫外光)照射半导体光催化剂时,半导体价带上的电子吸收光能被激发到导带上,因而在导带上产生带负电的高活性光生电子(e-),在价带上产生带正电的光生空穴(h+),形成光生电子-空穴对。空穴具有强氧化性;电子则具有强还原性。 当光生电子和空穴到达表面时,可发生两类反应。第一类是简单的复合,如果光生电子与空穴没有被利用,则会重新复合,使光能以热能的形式散发掉。 第二类是发生一系列光催化氧化还原反应,还原和氧化吸附在光催化剂表面上物质。 TiO2→e-+h+ OH-+h+→·OH
过氧化氢酶活力的测定实验报告
竭诚为您提供优质文档/双击可除过氧化氢酶活力的测定实验报告 篇一:实验35过氧化氢酶的活性测定 植物在逆境下或衰老时,由于体内活性氧代谢加强而使h2o2发生累积。h2o2可以直接或间接地氧化细胞内核酸,蛋白质等生物大分子,并使细胞膜遭受损害,从而加速细胞的衰老和解体。过氧化氢酶可以清除h2o2,是植物体内重要的酶促防御系统之一。因此,植物组织中h2o2含量和过氧化氢酶活性与植物的抗逆性密切相关。本实验用分光光度法测定过氧化氢含量,利用高锰酸钾滴定法和紫外吸收法测定过氧化氢酶活性。 一、过氧化氢含量的测定 【原理】 h2o2与硫酸钛(或氯化钛)生成过氧化物—钛复合物黄色沉淀,可被h2so4溶解后,在415nm波长下比色测定。在一定范围内,其颜色深浅与h2o2浓度呈线性关系。 【仪器和用具】 研钵;移液管0.2ml×2支,5ml×1支;容量瓶10ml×
7个,离心管5ml×8支;离心机;分光光度计。 【试剂】 100μmol/Lh2o2丙酮试剂:取30%分析纯h2o257μl,溶于100ml,再稀释100倍;2mol/L硫酸;5%(w/V)硫酸钛;丙酮;浓氨水。【方法】 1.制作标准曲线:取10ml离心管7支,顺序编号,并按表40-1加入试剂。 待沉淀完全溶解后,将其小心转入10ml容量瓶中,并用蒸馏水少量多次冲洗离心管,将洗涤液合并后定容至10ml 刻度,415nm波长下比色。 2.样品提取和测定:(1)称取新鲜植物组织2~5g(视h2o2含量多少而定),按材料与提取剂1∶1的比例加入4℃下预冷的丙酮和少许石英砂研磨成匀浆后,转入离心管 3000r/min下离心10min,弃去残渣,上清液即为样品提取液。(2)用移液管吸取样品提取液1ml,按表35-1加入5%硫酸钛和浓氨水,待沉淀形成后3000rpm/min离心10min,弃去上清液。沉淀用丙酮反复洗涤3~5次,直到去除植物色素。(3)向洗涤后的沉淀中加入2mol硫酸5ml,待完全溶解后,与标准曲线同样的方法定容并比色。3.结果计算:植物组织中h2o2含量(μmol/gFw)= 式中c—标准曲线上查得样品中h2o2浓度(μmol);Vt —样品提取液总体积(ml);V1—测定时用样品提取液体积
过氧化氢酶(CAT)活性的测定
过氧化氢酶(CAT)活性的测定:紫外吸收法 一、目的与要求 过氧化氢酶普遍存在于植物的所有组织中,其活性与植物的代谢强度及抗寒、抗病能力有一定关系,故常加以测定。 二、原理 过氧化氢酶(catalase)属于血红蛋白酶,含有铁,它能催化过氧化氢分解为水和分子氧,在此过程中起传递电子的作用,过氧化氢则既是氧化剂又是还原剂。可根据H2O2的消耗量或O2的生成量测定该酶活力大小。过氧化氢在240nm 波长下有强烈吸收,过氧化氢酶能分解过氧化氢,使反应溶液的吸光度(A240)随反应时间而降低。根据测量吸光率的变化速度即可测出过氧化氢酶的活性。三、材料、仪器设备及试剂 (一)材料:小麦或其它叶片 (二)仪器设备:1. 研钵;2.紫外分光光度计;3. 离心机;4. 恒温水浴; 5. 容量瓶。 (三)试剂: 1. 0.2 mol/L pH7.8磷酸缓冲液(pH7.8: 0.2mol/L Na2HP04 91.5 ml; 0.2mol/L NaH 2P0 4 8.5 ml); 2.0.1 mol/LH2O2 (30%的H2O2溶液5.68ml稀释至1000ml) 二、实验步骤: 1、酶液提取称取新鲜植物叶片或其它组织0.5g,置于研钵中,加入2~3ml 4℃下预冷的pH7.0磷酸缓冲液和少量石英砂研磨匀浆后,转入25ml 容量瓶中,并用缓冲液冲研钵数次,合并冲洗液,并定容到刻度。混合均匀,将容量瓶置5℃冰箱中静置10min,取上清液在4000r/min下离心15min,上清液即为过氧化氢粗提液,5℃下保存备用。 2、测定10ml试管3支,其中2支为样品测定管,1支为空白管,按表1-1顺序加入试剂。 25℃预热后,逐管加入0.6ml0.1mol/l的H2O2,每加完1管立即记时,并迅速倒入石英比色杯中,260nm下测定吸光度,每隔1min读数1次,共测4min,待3支管全部测完后,按式(1-1)计算酶活性。
光催化材料的项目报告书
项目报告书
光催化材料的研究概况 摘要: 光催化降解污染物是近年来发展起来的一种节能、高效的绿色环保新技术.它在去除空气中有害物质,废水中有机污染物的光催化降解,废水中重金属污染物的降解,饮用水的深度的处理,除臭,杀菌防霉等方面都有重要作用,但是作为新功能材料,它也面临着很多局限性:催化效率不高,催化剂产量不高,有些催化剂中含有有害重金属离子可能存在污染现象。但是我们也应当看到他巨大的发展潜力和市场利用价值,作为处理环境污染的一种方式,它以零二次污染,能源消耗为零,自发进行无需监控等优势必将居于污染控制的鳌头。本文主要综述了光催化反应基本原理、新型光催化材料开发策略及研究进展。分析了提高光催化材料量子效率的关键所在及开展新型光催化材料研究工作的重要性,展望了该领域的未来发展方向。 关键词:光催化原理、光催化材料、研究与开发 正文:光催化的由来 早在1839年,Becquerel 就发现了光电现象,然而未能对其进行理论解释。直到1955年,Brattain和Gareet 才对光电现象进行了合理的解释,标志着光电化学的诞生。1972年,日本东京大学Fujishima和Honda研究发现,利用TiO2单晶进行光催化反应可使水分解成氢和氧。这一开创性的工作标志着光电现象应用于光催化分解水制氢研究的全面启动。在过去40年里,人们在光催化材料开发与应用方面的研究取得了丰硕的成果 光催化材料 光催化材料是指在光作用下可以诱发光氧化一还原反应的一类半导体材料。世界上能作为光催化材料的有很多,包括二氧化钛、氧化锌、氧化锡、二氧化锆、硫化镉等多种氧化物硫化物半导体,其中二氧化钛(Titanium Dioxide)因其氧化能力强,化学性质稳定无毒,成为世界上最当红的纳米光触媒材料。 例如光催化净化空气: 图表1 光催化涂料 光催化材料对净化空气具有以下功效: 具有光催化降解甲醛、苯、氨等有害气体的功效。 具有抗污、屏蔽紫外线功效。
过氧化物酶、过氧化氢酶活性测定方法及试剂配制
过氧化物酶(POD )活性测定 【实验原理】 过氧化物酶广泛分布于植物的各个组织器官中,在有H 202存在条件下,过氧化物酶能使愈创木酚氧化,生成茶褐色的4-邻甲氧基苯酚,可用分光光度计测生成物的含量来测定活性。 【实验试剂】 愈创木酚、30%过氧化氢、20mmol/LKH2PO4、100mmol/L 磷酸缓冲液(pH6.0)、反应混合液[100mmol/L 磷酸缓冲液(Ph6.0)50mL ,加入愈创木酚28uL,加热搅拌,直至愈创木酚溶解,待溶液溶解冷却后,加入30%过氧化氢19uL ,混合均匀保存在冰箱中] 【方法步骤】 (1)、粗酶液的提取 称取小麦叶片0.25g ,加20mmol/LKH2PO4 2.5mL ,于研钵中研成匀浆,以4000r/min 离心10分钟,收集上清液保存在冷处,所得残渣再用20mmol/LKH2PO4 2.5mL 提取一次,全并两次上清液,所得的即为粗酶提取液(酶活性过高,稀释10倍)。 (2)、酶活性的测定 取试管3只,于一只中加入反应混合液3mL ,KH2PO41mL ,作为校零对照,另外三只中加入反应混合液3mL ,稀释后的酶液1mL (如表1),立即开启秒表,于分光光度计470nm 波长下测量OD 值,每隔1min 读数一次(4min )。以每分钟表示酶活性大小,将每分钟OD 值增加0.01定义为一个活力单位。 表1 紫外吸收法测定POD 酶活性配置表 4.结果计算 以每分钟吸光度变化值表示酶活性大小,即以 ΔA 470 /[min · g (鲜重) ]表示之。也可以用每 min 内 A 470 变化 0.01 为 1 个过氧化物酶活性单位( u )表示。 POD 总活性[u/g(FW)]= 式中:POD 总活性以酶单位每克鲜重表示。其中 △470=ACK-AE 比活力单位以酶单位每毫克蛋白表示。 ACK ——照光对照管的吸光度。 AE ——样品管的吸光度。 Vt ——样品液总体积,mL 。 FW t V . V A T ? ? ? ? 1 470 01 0 ?
溶菌酶
内容 1:溶菌酶简介 1.1 溶菌酶 溶菌酶(N-乙酰胞壁质聚糖水解酶,EC3.2.1.17)又称为胞壁质酶,是一种专门作用于微生物细胞壁的水解酶。溶菌酶是由129个氨基酸构成的单纯碱性球蛋白,化学性质非常稳定。 溶菌酶存在 在自然界中,溶菌酶普遍存在于鸟类、家禽的蛋清和哺乳动物的眼泪、唾液、血液、鼻涕、尿液、乳汁和组织细胞中(如肝、肾、淋巴组织、肠道等)。 从木瓜、芜青、大麦、无花果和卷心菜、萝卜等植物中也能分离出溶菌酶,其中以蛋清含量最高。 溶菌酶生理作用 在生物体内溶菌酶具有抗菌消炎,抗病毒,增强机体免疫力的生理功能,还可激活血小板,改善组织局部血液循环障碍,分泌脓液,增强局部防卫功能,具有止血、消肿等作用。它还可以作为一种宿主抵抗因子,对组织局部起保护作用 2:溶菌酶的种类 溶菌酶的研究最早是从尼科尔(Nicoile)1907年发表枯草杆菌溶解因子的报告开始的。两年后,Laschtschenko指出:鸡卵白强烈抑菌作用是酶作用的结果。1922年英国细菌学家弗莱明(Fleming)发现人的唾液、眼泪中存在这种能溶解细菌细胞壁的酶,因其具有溶菌作用,故命名为溶菌酶。 1937年由Abraham与Robinson从卵蛋白中最先分离出晶体溶菌酶,此后人们在人和动物的多种组织、分泌液及某些植物、微生物中也发现了溶菌酶的存在。 根据来源不同,将溶菌酶分为三类 (1)动物源溶菌酶 ?动物源溶菌酶包括鸡蛋清溶菌酶及人和哺乳动物溶菌酶。 ?鸡蛋清溶菌酶是目前研究和应用最多的,在鸡蛋清中约含有3.5%左右的酶,分子 量为14000,其等电点在pH10.8左右,最适效应温度在50℃,化学性质稳定,pH 在1.2~11.3之间改变时对酶结构影响很小,pH在4~7范围内100℃处理1min仍 有近100%的活力,在210℃条件下加热1.5h仍具有活性。 鸡蛋清溶菌酶在碱性环境条件下稳定性较差,分解G+细菌,但对G-细菌不起作用。研究表明其它鸟类蛋清溶菌酶也是由129个氨基酸残基组成,但其排列顺序和鸡蛋清溶菌酶不同,并且活性部位也不相同。 人溶菌酶分子量为14600,对人的溶菌酶研究发现它是由130个氨基酸残基组成,也有4个S-S键,其一级结构氨基酸顺序及组成与鸡蛋清溶菌酶相比有极大的差异,但三级结构有相似性,其溶菌活性比鸡蛋清溶菌酶高2倍。对于哺乳动物溶菌酶,目前仅从牛、马、羊等动物的乳汁中分离出溶菌酶,其化学性质与人溶菌酶相似,但结构尚不清楚,其溶菌活性远低于人溶菌酶。 (2)植物源溶菌酶 目前发现含溶菌酶的植物有近170种,在木瓜、无花果、大麦等植物中均已分离出溶菌酶。植物源溶菌酶分子量较大,约为24000~29000单位,其对溶壁小球菌的溶菌活性不超过鸡蛋清溶菌酶的1/3,但其对胶体状甲壳质的分解活性则是鸡蛋清溶菌酶的10倍。 (3)微生物源溶菌酶 上世纪60年代从微生物中分离出溶菌酶,根据其作用对象分为细菌细胞壁溶菌酶和真菌细胞壁溶菌酶。
过氧化氢酶
过氧化氢酶在不同条件下的分解 1、摘要 通过本次实验来探究在各类植物中所含的过氧化氢酶。在试验中通过过氧化氢与四种不同的蔬菜然后用排水集氧气法观察实验现象。实验结果发现马铃薯的效果最好,每一种蔬菜都有不同含量的过氧化氢酶,而这些蔬菜取材都非常的方便,这也就为以后做实验的效率变得更加高。 关键词:过氧化氢酶蔬菜氧气 Summary: Through this experiment to explore the various types of plants containing catalase. In the experiment, four kinds of vegetables were treated by hydrogen peroxide, and then the experimental phenomena were observed by the method of draining oxygen. The experimental results showed that the best effect of potato, each kind of vegetables have different content of catalase, and these vegetables are very convenient, which will be more efficient in the future to do the experiment. Key world: CAT Vegetable Oxygen 1.2 实验背景 1.2.1 什么是过氧化氢酶? 过氧化氢酶(CAT),是催化过氧化氢分解成氧和水的酶,存在于细胞的过氧化物体内。过氧化氢酶是过氧化物酶体的标志酶, 约占过氧化物酶体酶总量的40%。过氧化氢酶存在于所有已知的动物的各个组织中,特别在肝脏中以高浓度存在。过氧化氢酶在食品工业中被用于除去用于制造奶酪的牛奶中的过氧化氢。过氧化氢酶也被用于食品包装,防止食物被氧化。① 1.2.2测定植物过氧化氢酶的生物学意义是? 过氧化氢酶大量分布于动植物细胞内,属于活性氧清除剂,可分解机体代谢过程中产生的活性氧如过氧化氢,超氧阴离子等,这些物质可对机体尤其是质膜产生毒害作用,测定这种酶的活力可以评价机体受活性氧毒害程度.过氧化氢酶的活性与植物的代谢强度及抗寒、抗病能力均有关系,可以根据这种酶的活性水平判断植物是否受到氧化损伤(比较某种因素或者复合因素作用下与正常状态下的酶活水平)。② 2、材料与方法 2.1实验对象 马铃薯、菠菜、苹果、青菜 2.2实验器材 锥形瓶、试管、塑料水槽、电子天平、称量纸、导管、量筒、剪刀、研钵、
基于光催化原理的完全可降解塑料的研究
基于光催化原理的完全可降解塑 料的研究 Solid-phase Photocatalytic Degradation of Polyethylene Plastics (申请清华大学理学硕士学位论文) 培 养 单 位 :化学系 学 科 :分析化学 研 究 生 :李宗威 指 导 教 师 : 朱永法教授 : 二○○五年五月
基于光催化原理的完全可降解塑料的研究李宗威
关于学位论文使用授权的说明 本人完全了解清华大学有关保留、使用学位论文的规定,即: 清华大学拥有在著作权法规定范围内学位论文的使用权,其中包括:(1)已获学位的研究生必须按学校规定提交学位论文,学校可以采用影印、缩印或其他复制手段保存研究生上交的学位论文;(2)为教学和科研目的,学校可以将公开的学位论文作为资料在图书馆、资料室等场所供校内师生阅读,或在校园网上供校内师生浏览部分内容;(3)根据《中华人民共和国学位条例暂行实施办法》,向国家图书馆报送可以公开的学位论文。 本人保证遵守上述规定。 (保密的论文在解密后遵守此规定) 作者签名:导师签名: 日期:日期:
摘 要 塑料是当今世界最广泛应用的材料之一,由于其自身的难降解性,废弃塑料造成的“白色污染”已经成为世界性的环境难题。然而,目前的处理方法还存在塑料不能完全降解,具有二次污染,成本高等难以克服的缺点。 本论文研究的是基于光催化原理的完全可降解塑料。利用纳米薄膜的制备技术,制备了分别添加催化剂TiO2、TiO2/CuPc、TiO2/C60以及油酸表面修饰的TiO2的聚乙烯薄膜。对各种复合薄膜进行光催化降解研究,利用SEM、FT-IR、XPS等技术研究薄膜在光照前后的表面形貌、结构、成分的变化。利用色谱技术定性、定量跟踪测定反应体系中生成的挥发性有机物和最终产物CO2。通过UV-Vis、SPS等分析手段对催化剂的光电性质进行研究,提出了光催化反应机理。结果表明,添加了催化剂的复合薄膜表现出了高度增强的光降解性能,降解速率和降解程度均远远高于纯的聚乙烯薄膜。复合薄膜的光催化降解反应主要产物是CO2和H2O,降解过程是环境友好的。光催化反应起始于聚乙烯与催化剂的界面处,催化剂表面产生的活性氧物种扩散进入聚乙烯骨架内使其降解。影响复合薄膜的光催化降解性能的因素有催化剂的添加量、催化剂分散性能、催化剂光电性质等。PE-(TiO2/CuPc)和PE-(OA/TiO2)复合薄膜的降解性能要优于PE-TiO2复合薄膜,前者是由于提高了催化剂的电子空穴对分离,抑制载流子复合以提高量子效率;后者是由于改善了催化剂的分散性能,催化剂与聚乙烯的有效接触面积增加,从而提高了催化剂的光催化效率。由于C60的光敏化作用,TiO2/C60催化剂的光响应范围扩展到了可见光区域,因而PE-(TiO2/C60)薄膜具有可见光降解性能。 本论文的工作表明添加了适宜催化剂的聚乙烯塑料在自然环境中就表现出很好的降解性能,具有很强的应用前景。 关键词:光催化降解聚乙烯TiO2CuPc C60 I
过氧化氢酶活力的测定
实验三过氧化氢酶活性得测定 一、实验目得: 了解过氧化氢酶得作用,掌握碘量法测定过氧化氢酶活性得原理与方法; 二、实验原理: 过氧化氢酶就是一类色素蛋白,含有铁,它能催化过氧化氢分解为水与分子氧,在此过程中起传递电子得作用,过氧化氢既就是氧化剂又就是还原剂。 R(Fe+2)2+H2O2---R(Fe+3OH)2 R(Fe+3OH)2+ H2O2 ----R(Fe+2)2+2H2O+O2 并合上式:H2O2 ----2H2O+O2 据此,可根据消耗H2O2得消耗量或O2得生成量测定该酶活力大小。在反应系统中加入一定量得过氧化氢溶液,经酶促反应后,加入过量得KI溶液生成得I2用标准得Na2S2O3滴定,根据N a2SO3消耗得体积计算H2O2得消耗量。 三、实验材料、仪器与试剂: 1、实验材料:小白菜 2、仪器:恒温水浴锅、研钵、容量瓶、刻度吸管、100mL三角瓶 3、试剂: (1)0、05mol/L H2O2 (2)2mol/LH2SO4 (3)0、1mol/L Na2S2O3 (4)1%淀粉溶液(5)10%(NH4)6Mo7O24 (6)pH7、8得磷酸缓冲液(7)20% KI (8)CaCO3 四、实验步骤: (1)酶液提取: 称取2.5g白菜叶,加少量CaCO3,2mLpH7、8得缓冲液少量,研成匀浆,移入100ml 容量瓶,用上述缓冲液冲洗研钵数次转入容量瓶中定容,静置10分钟,过滤。取滤液10mL于另一100mL得容量瓶中稀释定容待测(根据酶活高低而定)。 (2)酶促反应: 取锥形瓶4个,编好号各加入10ml酶液之后,立即向两个瓶中加入2mol/L H2SO45mL,终止酶活性,作空白对照。向另外两瓶各加H2O25mL,摇匀,在加入H2O2得那一刻起,记录时间,5分钟后迅速向实验瓶中加入2mol/LH2SO45mL,终止酶活性。向三角瓶中加1mL 20% KI与3滴(NH4)6Mo7O24,摇匀后迅速用标准Na2S2O3溶液进行滴定至淡黄色,加入1mL1%淀粉指试剂,蓝色恰好消失,记录消耗得Na2S2O3得体积V0,V;
过氧化氢酶(CAT)活性测定
过氧化氢酶(CAT)活性测定 高锰酸钾滴定法 (李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社.2000.165-167)一、原理 过氧化氢酶(catalase,CA T)普遍存在于植物的所有组织中,其活性与植物的代谢强度及抗寒、抗病能力有一定关系,它属于血红蛋白酶,含有铁,能催化过氧化氢分解为水和分子氧,在此过程中起传递电子的作用,过氧化氢则既是氧化剂又是还原剂。 22 R(Fe OH 3+-) R(Fe2+ 2 2) 2 +2 H O 2+O2 因此,可以根据H2O2的消耗量或者O2的生成量测定该酶活力的大小。 在该体系中加入一定量(反应过量)的H2O2溶液,经酶促反应后,用标准高锰酸钾溶液(在酸性条件下)滴定多余的H2O2,即可求出消耗的H2O2的量。 5H2O2+2KMnO4+4H2SO45O2+2KHSO4+8H2O+2MnSO4 二、材料、仪器设备及试剂 (一)材料 植物器官(花瓣、叶片等) (二)仪器设备 冰箱、离心机、微量加样器(1ml、20μl、100μl)、移液管、精密电子天平、试管、研钵、剪刀、镊子、三角瓶、恒温水浴、容量瓶、酸式滴定管 (三)试剂 (1)10% H2SO4 (2)0.2mol/L PH7.8磷酸缓冲液 (3)0.1mol/L高锰酸钾标准液:称取KMnO4(AR)3.1605g,用新煮沸冷却蒸馏水配制 成1000mL,再用0.1mol/L草酸溶液标定 (4) 0.1mol/L H2O2:取30% H2O2(大约等于17.6 mol/L)5.68mL,稀释至1000mL,用 0.1mol/L高锰酸钾标准液(在酸性条件下)进行标定 (5) 0.1mol/L草酸:称取优级纯H2C2O4.2H2O12.607g,用蒸馏水溶解后,定溶1000mL。
光催化材料在环境保护中的应用
光催化材料在环境保护中的应用 谭强150110115 摘要:光催化材料对于环境的保护有着深远的意义,近几年来,光催化降解污染物发展成为了一种节能、高效的绿色环保新技术。综述了光催化材料的反应机理和种类,阐述了影响光催化反应的条件和提高反应的效率等问题以及其在环保领域的应用,并提出了其今后的发展方向和前景的展望。同时又介绍了光催化材料的特点及发展历程,对光催化纳米材料在处理水污染、治理大气污染、控制噪声污染等方面的应用进行了综合性的评述。作为新功能材料,它也存在着一些局限性,例如:催化效率不高,催化剂产量不高,部分催化剂中含有有害重金属离子可能存在污染现象。但是我们也应当看到它隐含的巨大发展潜力和市场利用价值,作为处理环境污染的一种方式,它凭借零二次污染,能源消耗为零,自发进行无需监控等一些优势必将居于污染控制的鳌头。 关键字:光催化材料应用催化效率环境保护 引言 光催化是半导体材料的独特性能之一 , 主要应用于环境保护方面。光催化材料是指通过该材料、在光的作用下发生的光化学反应所需的催化剂,世界上能作为光催化材料的有很多,包括二氧化钛、氧化锌、氧化锡、二氧化锆、硫化镉等多种氧化物硫化物半导体,其中二氧化钛(Titanium Dioxide)因其氧化能力强,化学性质稳定无毒,成为世界上最当红的纳米光触媒材料。1972年Fujishima 等人发现了TiO2微粒经过光的照射能使水发生氧化还原反应并生成氢气,是光催化反应研究的开始。特别是在近年来由于日益严重的污染状况 , 有机物的光催化降解研究受到了非常大的重视。经过了近30年来的研究 ,特别是对光催化降解有机污染物的研究,使光催化在环境保护方面取得了比较大的进展。 由于经济的发展迅速,造成了环境的很大污染,迫使人们不断寻求方便快捷的处理污染的方法。通过不断研究,已发现有3000多种难降解的有机化合物可以在紫外线的照射下通过纳米 TiO 来迅速降解。特别是在水中有机污染物浓度较低或者用其它方法很难降解时,该技术就更显示出其更明显的优势和价值。 1.光催化材料的反应机理
过氧化氢酶CAT试剂盒说明书
过氧化氢酶C A T试剂 盒说明书 集团文件版本号:(M928-T898-M248-WU2669-I2896-DQ586-M1988)
过氧化氢酶(CAT)试剂盒说明书 一、测定原理: 过氧化氢酶(CAT)分解H2O2的反应可通过加入钼酸铵而迅速中止,剩余的H2O2与钼酸铵作用产生一种淡黄色的络合物,在405nm处测定其变化量,可计算出CAT的活力。试剂一(ml) 二、试剂组成与配制: 试剂一:液体100 ml×1瓶,4℃保存6个月。 试剂二:底物液体10 ml×1瓶,4℃保存6个月。 试剂三:显色粉剂×1瓶,4℃保存6个月。加双蒸水至100 ml溶解,4℃保存1个月。(如果底部有不溶粉末沉淀,直接取上清使用,不影响测定结果) 试剂四:液体10 ml×1瓶,4℃保存6个月。天冷时会凝固,临用前37℃水浴至透明方可使用。 三、组织样本的检测 1、组织匀浆液的制备:准确称取组织重量,按重量(g):体积(ml)=1:9的比例加入9倍体积的生理盐水,冰水浴条件下,制备成10%的组织匀浆,2500转/分离心10分钟,取上清,再用生理盐水稀释成最佳取样浓度,待测(最佳取样浓度摸索减附录)。 2、操作表:
混匀,波长405nm ,光径0.5cm ,双蒸水调零,测定各管吸光度值。 注:一般样本没有高脂等导致显着差异情况,对照管的样本更换成双蒸 水,做1-2管对照即可。如需做样本自身对照,则试剂盒所测定样本数 量减至48样。 3.组织中CAT 活力的计算: (1)定义:每毫克组织蛋白每秒种分解1umol 的H2O2的量为一个活力单 位。 (2)计算公式: )ml /mgprot (601271)OD -OD ()mgprot /U (CAT *待测样本蛋白浓度取样量 值测定值对照活力组织匀浆中 ÷???=注:*271为斜率的倒数 (3)计算举例: 取10%水稻叶片匀浆0.05ml 做CAT 检测,测得对照管吸光度为0.605, 测定管吸光度为0.332,同时测得10%水稻叶片匀浆蛋白浓度为3.1303 mgprot/ml 。则计算结果为: ()/mgprot U 7351.101303.305 .0601271332.0704.0)mgprot /U (CAT =÷???-=活力组织匀浆中注:1.测定血清和血浆时,如果样本不溶血,每批样本只需要随机挑2
过氧化氢酶(CAT)活性检测试剂盒说明书 微量法
过氧化氢酶(CAT)活性检测试剂盒说明书微量法 注意:正式测定前务必取2-3个预期差异较大的样本做预测定货号:BC0205规格:100T/96S 产品内容: 提取液:液体100mL×1瓶,4℃保存;试剂一:液体30mL×1瓶,4℃保存;试剂二:液体125μL×1瓶,4℃保存。产品说明: CAT(EC 1.11.1.6)广泛存在于动物、植物、微生物和培养细胞中,是最主要的H 2O 2清除酶,在活性氧清除系统中具有重要作用。 H 2O 2在240nm 下有特征吸收峰,CAT 能够分解H 2O 2,使反应溶液240nm 下的吸光度随反应时间而下降,根据吸光度的变化率可计算出CAT 活性。需自备的仪器和用品: 紫外分光光度计/酶标仪、台式离心机、可调式移液器、微量石英比色皿/96孔(UV 板)、研钵、冰和蒸馏水操作步骤:一、粗酶液提取: 1、细菌、细胞或组织样品的制备 收集细菌或细胞到离心管内,离心后弃上清;按照每500万细菌或细胞加入1mL 提取液,超声波破碎细菌或细胞(功率20%,超声3s,间隔10s,重复30次);8000g 4℃离心10min,取上清,置冰上待测。 称取约0.1g 组织,加入1mL 提取液进行冰浴匀浆。8000g 4℃离心10min,取上清,置冰上待测。2、血清(浆)样品:直接检测。二、测定步骤:
1、分光光度计或酶标仪预热30min 以上,调节波长至240nm,蒸馏水调零。 2、CAT 检测工作液的配制:用时在试剂二中加入25mL 试剂一,充分混匀,作为工作液。 3、测定前将CAT 检测工作液在37℃(哺乳动物)或25℃(其它物种)水浴10min 以上。 4、在微量石英比色皿或96孔板中加入10μL 样本和190μL 工作液,立即混匀并计时,记录240nm 下初始吸光值A1和1min 后的吸光值A2。计算ΔA=A1-A2。三、CAT 活性计算: a.用微量石英比色皿测定的计算公式如下1、血清(浆)CAT 活力的计算: 单位的定义:每毫升血清(浆)每分钟催化1nmol H 2O 2降解定义为一个酶活力单位。CAT(U/mL)=[ΔA×V 反总÷(ε×d)×109 ]÷V 样÷T=459×ΔA 2、组织、细菌或细胞中CAT 活力计算:(1)按样本蛋白浓度计算: 单位的定义:每mg 组织蛋白每分钟催化1nmol H 2O 2降解定义为一个酶活力单位。CAT(U/mg prot)=[ΔA×V 反总÷(ε×d)×109]÷(Cpr×V 样)÷T=459×ΔA÷Cpr (2)按样本鲜重计算: 单位的定义:每g 组织每分钟催化1nmol H 2O 2降解定义为一个酶活力单位。 CAT(U/g 鲜重)=[ΔA×V 反总÷(ε×d)×109]÷(V 样÷V 样总×W)÷T=459×ΔA÷W (3)按细菌或细胞数量计算: 单位的定义:每1万个细菌或细胞每分钟催化1nmol H 2O 2降解定义为一个酶活力单位。CAT(U/104cell)=[ΔA×V 反总÷(ε×d)×109]÷(V 样÷V 样总×500)÷T =0.917×ΔA V 反总:反应体系总体积,2×10-4 L;ε:H 2O 2摩尔消光系数,4.36×104 L/mol /cm;d:比色皿光径,1cm;V 样:加入样本体积,0.01mL;V 样总:加入提取液体积,1mL;T:反应时间,1min;W:样本鲜重,g;Cpr:样本蛋白质浓度,mg/mL;500:细胞或细菌总数,500万;109:单位换算系数,1mol=109nmol。b.用96孔板测定的计算公式如下1、血清(浆)CAT 活力的计算:
MCM_41分子筛担载纳米TiO_2复合材料光催化降解罗丹明B
MCM -41分子筛担载纳米TiO 2复合材料光催化降解罗丹明B 冯利利1 赵威1刘洋1焦亮2李星国1,* (1北京大学化学与分子工程学院,稀土材料化学及应用国家重点实验室,北京分子科学国家实验室,北京100871; 2 北京航空航天大学材料科学与工程学院,北京100191) 摘要:采用溶胶-凝胶法将TiO 2担载在介孔MCM -41分子筛上,制备了不同TiO 2含量的系列TiO 2/MCM -41复合材料,利用X 射线衍射、 N 2吸附、紫外-可见光谱和透射电镜等方法对其进行表征.TiO 2的晶型为锐钛矿相,复合材料的比表面积和孔体积随其中TiO 2担载量(复合材料中TiO 2与MCM -41的质量比)的增加而减小,TiO 2的平均粒径随其担载量的增加而增大.以罗丹明B 的光催化降解为探针反应,评价了TiO 2/MCM -41复合材料的光催化降解活性.结果表明,在紫外光照射下,罗丹明B 在该复合材料上的光催化降解反应遵循一级反应动力学,复合材料对罗丹明B 的光催化降解活性明显高于商用TiO 2(P -25),复合材料的光催化降解活性由复合材料的吸附能力和所含TiO 2的光催化活性共同决定.关键词:MCM -41分子筛;纳米二氧化钛; 罗丹明B; 光催化降解 中图分类号:O643.3 Photocatalytic Degradation of Rhodamine B by Nanocrystalline TiO 2 Loaded into MCM -41Molecular Sieves FENG Li -Li 1 ZHAO Wei 1 LIU Yang 1 JIAO Liang 2 LI Xing -Guo 1,* (1Beijing National Laboratory of Molecular Sciences,State Key Laboratory of Rare Earth Materials Chemistry and Applications, College of Chemistry and Molecular Engineering,Peking University,Beijing 100871,P.R.China ; 2 School of Materials Science and Engineering,Beijing University of Aeronautics and Astronautics,Beijing 100191,P.R.China ) Abstract :TiO 2/MCM -41composites with various titania content were prepared by loading titania into the mesopores of MCM -41molecular sieves via the sol -gel method.TiO 2/MCM -41composites were characterized by X -ray diffraction(XRD),N 2adsorption,ultraviolet -visible (UV -Vis)absorption spectroscopy and transmission electron microscopy (TEM)techniques.The titania crystalline phase was anatase.The BET surface area and pore volume of the composites decreased with the increase of titania loading (mass ratio of TiO 2to MCM -41in the composite).The average crystal size of these titania particles increased as the titania loading increased.The photocatalytic activities of TiO 2/MCM -41composites were evaluated by the photocatalytic degradation of Rhodamine B.The degradation of Rhodamine B followed first -order reaction kinetics.The composites showed higher photocatalytic activities than P -25commercial pure titania nanoparticles.The photocatalytic activities of the composites depended on their adsorption abilities and the activity of titania loaded into the MCM -41molecular sieves.Key Words :MCM -41molecular sieve; Nanocrystalline titania; Rhodamine B; Photocatalytic degradation [Article] https://www.360docs.net/doc/604676664.html, 物理化学学报(Wuli Huaxue Xuebao ) Acta Phys.-Chim.Sin .,2009,25(7):1347-1351 Received:February 25,2009;Revised:March 24,2009;Published on Web:April 21,2009. * Corresponding author.Email:xgli@https://www.360docs.net/doc/604676664.html,;Tel:+86-10-62765930. The project was supported by the National Natural Science Foundation of China (20671004,20821091),National High -Tech Research and Development Program of China (863)(2007AA05Z118,2007AA030114),and University Scientific and Technological Innovation Major Project Cultivation Project,Ministry of Education of China (707002). 国家自然科学基金(20671004,20821091),国家高技术研究发展计划(863)项目(2007AA05Z118,2007AA030114)及教育部高等学校科技创新工程重大项目培育项目(707002)资助 鬁Editorial office of Acta Physico -Chimica Sinica July 1347
