副族元素

高中化学奥林匹克竞赛辅导讲座
第12讲副族元素及其化合物
【竞赛要求】
钛、钒、铬、锰、铁、钴、镍、铜、银、金、锌、汞、钼、钨。过渡元素氧化态。氧化物和氢氧化物的酸碱性和两性。水溶液中的常见离子的颜色、化学性质、定性检出(不使用特殊试剂)和分离。制备单质的一般方法。
【知识梳理】
一、通论
d区元素是指IIIB~VIII族元素,ds区元素是指IB、IIB族元素。d区元素的外围电子构型是(n-1)d1~10ns1~2(Pd例外),ds区元素的外围电子构型是(n-1)d10ns1~2。它们分布在第4、5、6周期之中,而我们主要讨论第4周期的d区和ds区元素。
第4周期d区、ds区元素某些性质
*()内为不稳定氧化态。
同一周期的d区或ds区元素有许多相似性,如金属性递变不明显、原子半径、电离势等随原子序数增加虽有变化,但不显著,都反映出d区或ds区元素从左至右的水平相似性。
d区或ds区元素有许多共同的性质:
(1)它们都是金属,因为它们最外层都只有1~2个电子。它们的硬度大,熔、沸点较高。第4周期d区元素都是比较活泼的金属,题目能置换酸中的氢;而第5、6周期的d区元素较不活泼,它们很难和酸作用。
(2)除少数例外,它们都存在多种氧化态,且相邻两个氧化态的差值为1或2,如Mn,它有–1,0,1,2,3,4,5,6,7;而p区元素相邻两氧化态间的差值常是2,如Cl,它有–1,0,1,3,5,7等氧化态。最高氧化态和族号相等,但VIII族除外。第4周期d区元素最高氧化态的化合物一般不稳定;而第5、6周期d区元素最高氧化态的化合物则比较稳定,且最高氧化态化合物主要以氧化物、含氧酸或氟化物的形式存在,如WO3、WF6、MnO-
4
、
FeO-2
4、CrO-2
4
等,最低氧化态的化合物主要以配合物形式存在,如[Cr(CO)5]2–
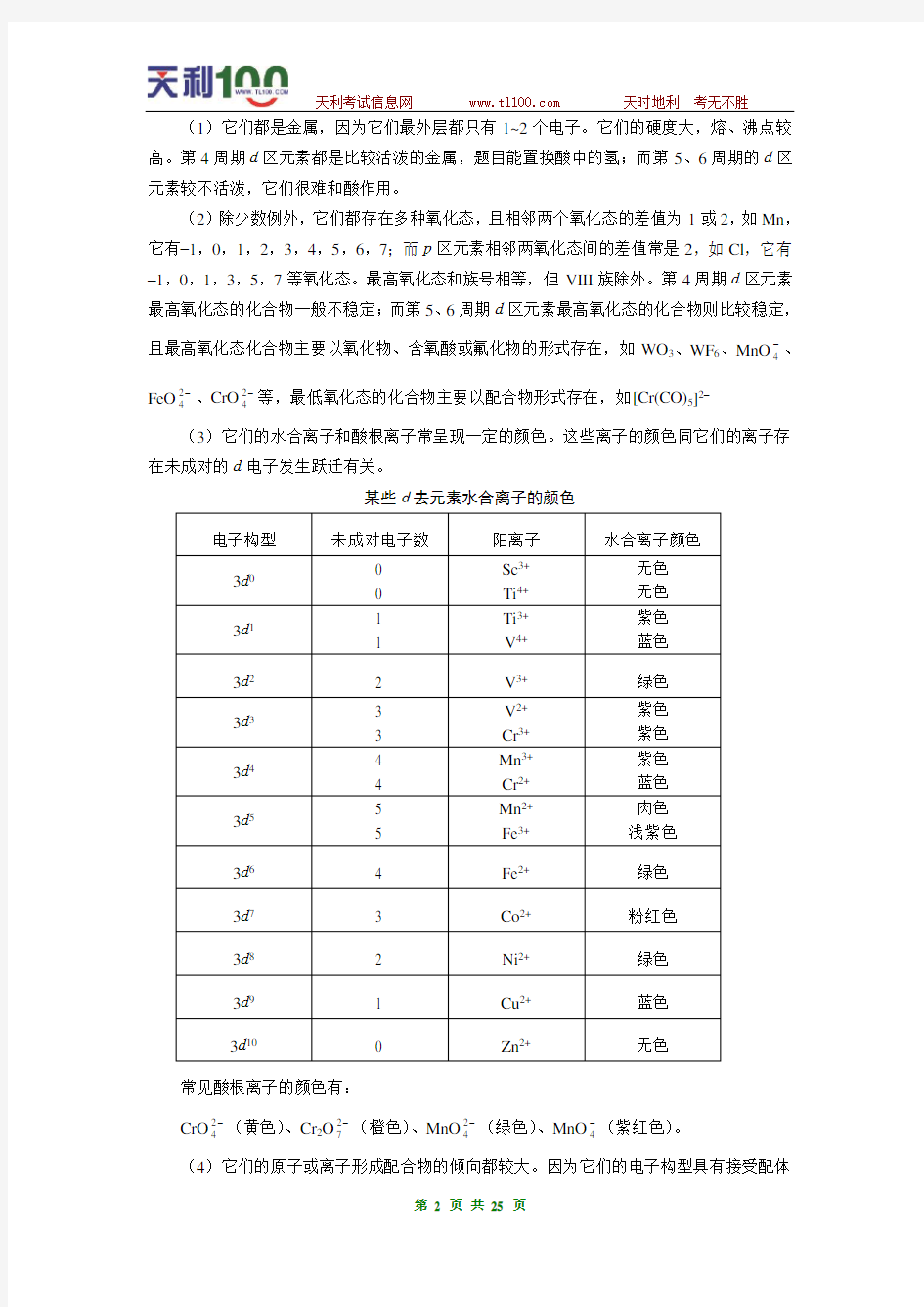
(3)它们的水合离子和酸根离子常呈现一定的颜色。这些离子的颜色同它们的离子存在未成对的d电子发生跃迁有关。
某些d去元素水合离子的颜色
常见酸根离子的颜色有:
CrO-2
4(黄色)、Cr2O-2
7
(橙色)、MnO-2
4
(绿色)、MnO-
4
(紫红色)。
(4)它们的原子或离子形成配合物的倾向都较大。因为它们的电子构型具有接受配体
孤电子对的条件。
以上这些性质都和它们的电子层结构有关。
二、d区元素
(一)钛副族
1、钛副族元素的基本性质
钛副族元素原子的价电子层结构为(n-1)d2ns2,所以钛、锆和铪的最稳定氧化态是+4,其次是+3,+2氧化态则比较少见。在个别配位化合物中,钛还可以呈低氧化态0和– l。锆、铪生成低氧化态的趋势比钛小。它们的M(Ⅳ)化合物主要以共价键结合。在水溶液中主要以MO2+形式存在,并且容易水解。由于镧系收缩,铪的离子半径与锆接近,因此它们的化学性质极相似,造成锆和铪分离上的困难。
2、钛及其化合物
(1)钛
钛是活泼的金属,在高温下能直接与绝大多数非金属元素反应。在室温下,钛不与无机酸反应,但能溶于浓、热的盐酸和硫酸中:
2Ti + 6HCl(浓) 2TiCl3 + 3H2↑
2Ti + 3H2SO4(浓) 2Ti2(SO4)3 + 3H2↑
钛易溶于氢氟酸或含有氟离子的酸中:
Ti + 6HF TiF 2
+ 2H+ + 2H2↑
6
(2)二氧化钛
二氧化钛在自然界以金红石为最重要,不溶于水,也不溶于稀酸,但能溶于氢氟酸和热的浓硫酸中:
TiO2 + 6HF = H2[TiF6]+ 2H2O
TiO2 + 2H2SO4 = 2Ti (SO4)2 + 2H2O
TiO2 + H2SO4 = 2Ti OSO4 + H2O
(3)四氯化钛
四氯化钛是钛的一种重要卤化物,以它为原料,可以制备一系列钛化合物和金属钛。它在水中或潮湿空气中都极易水解将它暴露在空气中会发烟:
TiCl4 + 2H2O = TiO2 + 4HCl
(4)钛(Ⅳ)的配位化合物
钛(Ⅳ)能够与许多配合剂形成配合物,如[TiF6]2-、[TiCl6]2-、[TiO(H2O2)]2+ 等,其中与H2O2的配合物较重要。利用这个反应可进行钛的比色分析,加入氨水则生成黄色的过氧钛酸H4TiO6沉淀,这是定性检出钛的灵敏方法。
(二)钒副族
1、钒副族元素基本性质
钒副族包括钒、铌、钽三个元素,它们的价电子层结构为(n-1)d3ns2,5个价电子都可以
参加成键,因此最高氧化态为+5,相当于d0的结构,为钒族元素最稳定的一种氧化态。按V、Nb、Ta顺序稳定性依次增强,而低氧化态的稳定性依次减弱。铌钽由于半径相近,性质非常相似。
2、钒及其化合物
(1)钒
金属钒容易呈钝态,因此在常温下活泼性较低。块状钒在常温下不与空气、水、苛性碱作用,也不与非氧化性的酸作用,但溶于氢氟酸,也溶于强氧化性的酸(如硝酸和王水)中。在高温下,钒与大多数非金属元素反应,并可与熔融苛性碱发生反应。
(2)五氧化二钒
V2O5可通过加热分解偏钒酸铵或三氯氧化钒的水解而制得:
2NH4VO3 V2O5 + 2NH3 + H2O
2VOCl3 + 3H2O = V2O5 + 6HCl
在工业上用氯化焙烧法处理钒铅矿,提取五氧化二钒。
V2O5比TiO2具有较强的酸性和较强的氧化性,它主要显酸性,易溶于碱:
V2O5 + 6NaOH = 2Na3VO4 + 3H2O
也能溶解在强酸中(pH<1)生成VO2+ 离子。V2O5是较强的氧化剂:
V2O5 + 6HCl = 2VOCl2 + Cl2 + 3H2O
(3)钒酸盐和多钒酸盐
钒酸盐有偏钒酸盐MVO3、正钒酸盐M3VO4和多钒酸盐(M4V2O7、M3V3O9)等。只有当溶液中钒的总浓度非常稀(低于10-4 mol·L-1)且溶液呈强碱性(pH>13)时,单体的钒酸根才能在溶液中稳定存在;当pH下降,溶液中钒的总浓度小于10-4 mol·L-1时,
溶液中以酸式钒酸根离子形式存在,如HVO-2
4、H2VO-
4
;当溶液中钒的总浓度大于10-4
mol·L-1时,溶液中存在一系列聚合物种(多钒酸盐)如V2O-4
7、V3O-3
9
、V4O-4
12
、V10O-6
28
等。
(三)铬副族
1、铬副族的基本性质
周期系第VIB族包括铬、钼、钨三个元素。铬和钼的价电子层结构为(n-1)d5ns1,钨为(n-1)d4ns2。它们的最高氧化态为+6,都具有d区元素多种氧化态的特征。它们的最高氧化态按Cr、Mo、W的顺序稳定性增强,而低氧化态的稳定性则相反。
2、铬及其化合物
(1)铬
铬比较活泼,能溶于稀HCl、H2SO4,起初生成蓝色Cr2+ 溶液,而后为空气所氧化成绿色的Cr3+ 溶液:
Cr + 2HCl = CrCl2 + H2↑
4CrCl 2 + 4HCl + O 2 = 4CrCl 3 + 2H 2O
铬在冷、浓HNO 3中钝化。
(2)铬(III)的化合物
向Cr 3+ 溶液中逐滴加入2 mol ·dm –3 NaOH ,则生成灰绿色Cr(OH)3沉淀。Cr(OH)3具有两性:
Cr(OH)3 + 3H + = Cr 3+ + 3H 2O
Cr(OH)3 +OH -
= Cr(OH)-
4 (亮绿色) 铬(III)的配合物配位数都是6(少数例外),其单核配合物的空间构型为八面体,Cr 3+ 离子提供6个空轨道,形成六个d 2sp 3杂化轨道。
(2)铬酸、铬酸盐和重铬酸盐
若向黄色CrO -24溶液中加酸,
溶液变为橙色Cr 2O -27(重铬酸根)液;反之,向橙色Cr 2O -27溶液中加碱,又变为CrO -2
4黄色液:
2 CrO -2
4(黄色) + 2H + Cr 2O -27(橙色) + H 2O K = 1.2×1014
H 2CrO 4是一个较强酸(1a K = 4.1,2a K = 3.2×10-7),只存在于水溶液中。
氯化铬酰CrO 2Cl 2是血红色液体,遇水易分解:
CrO 2Cl 2 + 2H 2O = H 2CrO 4 + 2HCl
常见的难溶铬酸盐有Ag 2CrO 4(砖红色)、PbCrO 4(黄色)、BaCrO 4(黄色)和SrCrO 4
(黄色)等,它们均溶于强酸生成M 2+ 和Cr 2O -27。
K 2Cr 2O 7是常用的强氧化剂(0
/3272+-Cr O Cr ?= 1.33 V )饱和K 2Cr 2O 7溶液和浓H 2SO 4混合液用作实验室的洗液。在碱性溶液中将Cr(OH)-4 氧化为CrO -24,
要比在酸性溶液将Cr 3+ 氧化为Cr 2O -27容易得多。而将Cr(VI)转化为Cr(III),则常在酸性溶液中进行。
3、钼和钨的重要化合物
(1)钼、钨的氧化物
MoO 3、WO 3和CrO 3不同,它们不溶于水,仅能溶于氨水和强碱溶液生成相应的合氧酸盐。
(2)钼、钨的含氧酸及其盐
钼酸、钨酸与铬酸不同,它们是难溶酸,酸性、氧化性都较弱,钼和钨的含氧酸盐只有铵、钠、钾、铷、锂、镁、银和铊(I)的盐溶于水,其余的含氧酸盐都难溶于水。氧化性很弱,在酸性溶液中只能用强还原剂才能将它们还原到+3氧化态。
(四)锰副族
1、锰副族的基本性质
ⅦB族包括锰、锝和铼三个元素。其中只有锰及其化合物有很大实用价值。同其它副族元素性质的递变规律一样,从Mn到Re高氧化态趋向稳定。低氧化态则相反,以Mn2+ 为最稳定。
2、锰及其化合物
(1)锰
锰是活泼金属,在空气中表面生成一层氧化物保护膜。锰在水中,因表面生成氢氧化锰沉淀而阻止反应继续进行。锰和强酸反应生成Mn(II)盐和氢气。但和冷浓H2SO4反应很慢(钝化)。
(2)锰(II)的化合物
在酸性介质中Mn2+ 很稳定。但在碱性介质中Mn(II)极易氧化成Mn(IV)化合物。
Mn(OH)2为白色难溶物,Ksp= 4.0×10-14,极易被空气氧化,甚至溶于水中的少量氧气也能将其氧化成褐色MnO(OH)2沉淀。
2Mn(OH)2 + O2 = 2 MnO(OH)2↓
Mn2+在酸性介质中只有遇强氧化剂(NH4)2S2O8、NaBiO3、PbO2、H5IO6时才被氧化。
2Mn2+ + 5S2O-2
8+ 8H2O = 2MnO-
4
+ 10SO-2
4
+ 16H+
2Mn2+ + 5NaBiO3 + 14H+ = 2MnO-
4
+5Bi3+ + 5Na+ + 7H2O (3)锰(IV)的化合物
最重要的Mn(IV)化合物是MnO2,二氧化锰在中性介质中很稳定,在碱性介质中倾向于转化成锰(Ⅵ)酸盐;在酸性介质中是一个强氧化剂,倾向于转化成Mn2+。
2MnO2 + 2H2SO4 (浓) = 2MnSO4+ O2↑+ 2H2O
MnO2 + 4HCl(浓) = MnCl2 + Cl2↑+ 2H2O
简单的Mn(IV)盐在水溶液中极不稳定,或水解生成水合二氧化锰MnO(OH)2,或在浓强酸中的和水反应生成氧气和Mn(II)。
(4)锰(VI)的化合物
最重要的Mn(VI)化合物是锰酸钾K2MnO4。在熔融碱中MnO2被空气氧化生成K2MnO4。
2MnO2 + O2 + 4KOH = 2K2MnO4 (深绿色) + 2H2O
在酸性、中性及弱碱性介质中,K2MnO4发生歧化反应:
3K2MnO4 + 2H2O = 2KMnO4 + MnO2 + 4KOH
锰酸钾是制备高锰酸钾(KMnO4)的中间体。
2MnO-2
4+ 2H2O 电解2MnO-
4
+ 2OH-+ H2↑
KMnO4是深紫色晶体,是强氧化剂。和还原剂反应所得产物因溶液酸度不同而异。例
如和SO-2
3
反应:
酸性2MnO-
4+ 5 SO-2
3
+ 6H+ = 2Mn2+ + 5SO-2
4
+ 3H2O
近中性2MnO-
4+ 3 SO-2
3
+ H2O = 2MnO2 + 3 SO-2
4
+ 2OH-
碱性:2MnO-
4+ SO-2
3
+ 2OH-= 2MnO-2
4
+ SO-2
4
+ H2O
MnO-
4
在碱性介质中不稳定:
4 MnO-
4+ 4OH-= 4 MnO-2
4
+ O2 + 2H2O
KMnO4晶体和冷浓H2SO4作用,生成绿褐色油状Mn2O7,它遇有机物即燃烧,受热爆炸分解:
2KMnO4 + H2SO4(浓) = Mn2O7 + K2SO4 + H2O
2Mn2O7 = 3O2 + 4MnO2
(五)铁系元素
1、铁系元素基本性质
位于第4周期、第一过渡系列的三个VIII族元素铁、钴、镍,性质很相似,称为铁系元素。铁、钴、镍三个元素原子的价电子层结构分别是3d64s2、3d74s2、3d84s2,它们的原子半径十分相近,最外层都有两个电子,只是次外层的3d电子数不同,所以它们的性质很相似。铁的最高氧化态为+6,在一般条件下,铁的常见氧化态是+2、+3,只有与很强的氧化剂作用时才生成不稳定的+6氧化态的化合物。钴和镍的最高氧化态为+4,在一般条件下,钴和镍的常见氧化态都是+2。钴的+3氧化态在一般化合物中是不稳定的,而镍的+3氧化态则更少见。
2、铁的化合物
(1)铁的氧化物和氢氧化物
铁的氧化物颜色不同,FeO、Fe3O4为黑色,Fe2O3为砖红色。
向Fe2+ 溶液中加碱生成白色Fe(OH)2,立即被空气中O2氧化为棕红色的Fe(OH)3。Fe(OH)3显两性,以碱性为主。新制备的Fe(OH)3能溶于强碱。
(2)铁盐
Fe(II)盐有两个显著的特性,即还原性和形成较稳定的配离子。Fe(II)化合物中以(NH4)2SO4·FeSO4·6H2O(摩尔盐)比较稳定,用以配制Fe(II)溶液。向Fe(II)溶液中缓慢加入过量CN-,生成浅黄色的Fe(CN)-4
6
,其钾盐K4[Fe(CN)6]·3H2O是黄色晶体,俗称黄
血盐。若向Fe3+ 溶液中加入少量Fe(CN)-4
6
溶液,生成难溶的蓝色沉淀KFe[Fe(CN)6] ,俗
称普鲁士蓝。
Fe 3+ + K + + Fe(CN)-46= KFe[Fe(CN)6]↓
Fe(III)盐有三个显著性质:氧化性、配合性和水解性。Fe 3+ 能氧化Cu 为Cu 2+,用以制印刷电路板。[FeSCN]2+具有特征的血红色。[Fe(CN)6]3-
的钾盐K 3[Fe(CN)6] 是红色晶体,俗称赤血盐。向Fe 2+ 溶液中加入[Fe(CN)6]3-
,生成蓝色难溶的KFe[Fe(CN)6],俗称滕布尔蓝。
Fe 2+ + K + + [Fe(CN)6]3-
= KFe[Fe(CN)6]↓ 经结构分析,滕布尔蓝和普鲁士蓝是同一化合物,它们有多种化学式,本章介绍的KFe[Fe(CN)6]只是其中的一种。
Fe(III)对F -
离子的亲和力很强,FeF 3(无色)的稳定常数较大,在定性和定量分析中用以掩蔽Fe 3+。
Fe 3+ 离子在水溶液中有明显的水解作用,在水解过程中,同时发生多种缩合反应,随着酸度的降低,缩合度可能增大而产生凝胶沉淀。利用加热水解使Fe 3+ 生成Fe(OH)3除铁,是制备各类无机试剂的重要中间步骤。
3、钴、镍及其化合物
(1)钴、镍
钴和镍在常温下对水和空气都较稳定,它们都溶于稀酸中,与铁不同的是,铁在浓硝酸中发生“钝化”,但钴和镍与浓硝酸发生激烈反应,与稀硝酸反应较慢。钴和镍与强碱不发生作用,故实验室中可以用镍制坩埚熔融碱性物质。
(2)钴、镍的氧化物和氢氧化物
钴、镍的氧化物颜色各异,CoO 灰绿色,Co 2O 3黑色;NiO 暗绿色,Ni 2O 3黑色。
向Co 2+ 溶液中加碱,生成玫瑰红色(或蓝色)的Co(OH)2,放置,逐渐被空气中O 2氧化为棕色的Co(OH)3。向Ni 2+ 溶液中加碱生成比较稳定的绿色的Ni(OH)2。
Co(OH)3为碱性,溶于酸得到Co 2+(因为Co 3+ 在酸性介质中是强氧化剂):
4Co 3+ + 2H 2O = 4Co 2+ + 4H + + O 2↑
(3)钴、镍的盐
常见的Co(II)盐是CoCl 2·6H 2O ,由于所含结晶水的数目不同而呈现多种不同的颜色: CoCl 2·6H 2O (粉红)C ?3.52CoCl 2·2H 2O(紫红)C ?90CoCl 2·H 2O (蓝紫)C ?120CoCl 2(蓝)
这个性质用以制造变色硅胶,以指示干燥剂吸水情况。
Co(II)盐不易被氧化,在水溶液中能稳定存在。而在碱性介质中,Co (OH)2能被空气中O 2氧化为棕色的Co (OH)3沉淀。
Co (III)是强氧化剂(0/23+
+Co Co ?= 1.8 V ),在水溶液中极不稳定,易转化为Co 2+。Co (III)只存在于固态和配合物中,如CoF 3、Co 2O 3、Co 2 (SO 4)3·18H 2O ;[Co (NH 3)6]Cl 3、K 3[Co (NH)6]、Na 3[Co (NO 2)6]。
常见的Ni(II)盐有黄绿色的NiSO 4·7H 2O ,绿色的NiCl 2·6H 2O 和绿色的Ni(NO 3)2·6H 2O 。常见的配离子有[Ni(NH 3)6]2+、[Ni(CN)4]2-、[Ni(C 2O 4)3] 4-
等。Ni 2+ 在氨性溶液中同丁二酮肟(镍试剂)作用,生成鲜红色的螯合物沉淀,用以鉴定Ni 2+。
三、ds 区元素
(一)铜族元素
1、铜族元素的基本性质
铜族元素包括铜、银、金,属于I B 族元素,位于周期表中的ds 区。铜族元素结构特征为(n -1)d 10ns 1,从最外层电子说,铜族和IA 族的碱金属元素都只有1个电子,失去s 电子后都呈现+1氧化态;因此在氧化态和某些化合物的性质方面I B 与I A 元素有一些相似之处,但由于I B 族元素的次外层比I A 族元素多出10个d 电子,它们又有一些显著的差异。如:
(1)与同周期的碱金属相比,铜族元素的原子半径较小,第一电离势较大,表现在物理性质上:I A 族单质金属的熔点、沸点、硬度均低;而I B 族金属具有较高的熔点和沸点,有良好的延展性、导热性和导电性。
(2)化学活泼性:铜族元素的标准电极电势比碱金属为正。I A 族是极活泼的轻金属,在空气中极易被氧化,能与水剧烈反应,同族内的活泼性自上而下增大;IB 族都是不活泼的重金属,在空气中比较稳定,与水几乎不起反应,同族内的活泼性自上而下减小。
(3)铜族元素有+1、+2、+3等三种氧化态,而碱金属只有+1一种。碱金属离子一般是无色的,铜族水合离子大多数显颜色。
(4)IIA 族所形成的化合物多数是离子型化合物,I B 族的化合物有相当程度的共价性。IA 族的氢氧化物都是极强的碱,并且非常稳定;IB 族的氢氧化物碱性较弱,且不稳定,易脱水形成氧化物。
(5)IA 族的离子一般很难成为配合物的形成体,IB 族的离子有很强的配合能力。
2、铜、银、金及其化合物
(1)铜、银和金
铜族元素的化学活性从Cu 至Au 降低,主要表现在与空气中氧的反应和与酸的反应上。 室温时,在纯净干燥的空气中,铜、银、金都很稳定。在加热时,铜形成黑色氧化铜,但银和金不与空气中的氧化合。在含有CO 2的潮湿空气中放久后,铜表面会慢慢生成一层绿色的铜锈:
2Cu + O 2 + H 2O + CO 2 = Cu(OH)2·CuCO 3
银和金不发生上述反应。
铜、银可以被硫腐蚀,特别是银对硫及硫化物(H 2S )极为敏感,这是银器暴露在含有
这些物质的空气中生成一层Ag 2S 的黑色薄膜而使银失去白色光泽的主要原因。金不与硫直接反应。
铜族元素均能与卤素反应。铜在常温下就能与卤素反应,银反应很慢,金必须加热才能与干燥的卤素起反应。
铜、银、金都不能与稀盐酸或稀硫酸作用放出氢气,但在有空气存在时,铜可以缓慢溶解于稀酸中,铜还可溶于热的浓盐酸中:
2Cu + 4HCl + O 2 = 2CuCl 2 + 2H 2O
2Cu + 2H 2SO 4 + O 2 = 2CuSO 4 + 2H 2O
2Cu + 8HCl (浓) 2H 3[CuCl 4] + H 2↑
铜和银溶于硝酸或热的浓硫酸,而金只能溶于王水(这时HNO 3做氧化剂,HCl 做配位剂):
Au + 4HCl + HNO 3 = HAuCl 4+ NO ↑+ 2H 2O
(2)铜的化合物
①Cu(I) 的化合物
在酸性溶液中Cu + 离子易于歧化而不能在酸性溶液中稳定存在。
2Cu +
Cu + Cu 2+ K = 1.2×106(293K )
但必须指出,Cu + 在高温及干态时比Cu 2+ 离子稳定。
Cu 2O 和Ag 2O 都是共价型化合物,不溶于水。Ag 2O 在573K 分解为银和氧;而Cu 2O 对热稳定。CuOH 和AgOH 均很不稳定,很快分解为M 2O 。
用适量的还原剂(如SO 2、Sn 2+、Cu …… )在相应的卤素离子存在下还原Cu 2+ 离子,可制得CuX 。如:
Cu 2+ + 2Cl -+
Cu 2CuCl ↓(白) H[CuCl 2]
2Cu 2+ + 4I = 2CuI ↓(白) + I 2
Cu + 为d 10型离子,具有空的外层s 、p 轨道,能和X -(F - 除外)、NH 3、S 2O 23、CN -
等配体形成稳定程度不同的配离子。
无色的[Cu(NH 3)2]+ 在空气中易于氧化成深蓝色的[Cu(NH 3)4]2+ 离子。
②Cu(I) 的化合物
+2氧化态是铜的特征氧化态。在Cu 2+ 溶液中加入强碱,即有蓝色Cu(OH)2絮状沉淀析出,它微显两性,既溶于酸也能溶于浓NaOH 溶液,形成蓝紫色[Cu(OH)4]2-
离子: Cu(OH)2 + 2OH -= [Cu(OH)4]2-
Cu(OH)2 加热脱水变为黑色CuO 。
在碱性介质中,Cu 2+ 可被含醛基的葡萄糖还原成红色的Cu 2O
,用以检验糖尿病。最常
见铜盐是CuSO4·5H2O(胆矾),它是制备其他铜化合物的原料。
Cu2+ 为d9构型,绝大多数配离子为四短两长键的细长八面体,有时干脆成为平面正方形结构。如[Cu(H2O)4]2+(蓝色)、[Cu(NH3)4]2+(深蓝色)、[Cu(en)2]2+(深蓝紫)、(NH4)2CuCl4
离子等均为平面正方形。由于Cu2+ 有一定的氧化性,所以与还原性(淡黄色)中的CuCl-2
4
阴离子,如I-、CN-等反应,生成较稳定的CuI及[Cu (CN)2]-,而不是CuI2和[Cu (CN)4 ]2-。
(3)银的化合物
氧化态为+I的银盐的一个重要特点是只有AgNO3、AgF和AgClO4等少数几种盐溶于水,其它则难溶于水。非常引人注目的是,AgClO4和AgF的溶解度高得惊人(298K时分别为5570 g·L-1和1800 g·L-1)。
Cu(I)不存在硝酸盐,而AgNO3却是一个最重要的试剂。固体AgNO3极其溶液都是氧化?= 0.799 V),可被氨、联氨、亚磷酸等还原成Ag。
剂(0
Ag+
/Ag
2NH2OH + 2AgNO3 = N2↑+ 2Ag↓+ 2HNO3 + 2H2O
N2H4 + 4AgNO3 = N2↑+ 4Ag↓+ 4HNO3
H3PO3 + 2AgNO3 + H2O = H3PO4 + 2Ag↓+ 2HNO3
Ag+ 和Cu2+ 离子相似,形成配合物的倾向很大,把难溶银盐转化成配合物是溶解难溶银盐的重要方法。
(4)金的化合物
Au(III)化合物最稳定,Au+ 像Cu+ 离子一样容易发生歧化反应,298K时反应的平衡常数为1013。
3Au+Au3+ + 2Au
可见Au+(aq) 离子在水溶液中不能存在。
Au+ 像Ag+ 一样,容易形成二配位的配合物,例如[Au(CN)2]-。
在最稳定的+III氧化态的化合物中有氧化物、硫化物、卤化物及配合物。
碱与Au3+ 水溶液作用产生一种沉淀物,这种沉淀脱水后变成棕色的Au2O3。Au2O3溶于浓碱形成含[Au(OH)4]-离子的盐。
将H2S通入AuCl3的无水乙醚冷溶液中,可得到Au2S3,它遇水后很快被还原成Au(I) 或Au。
金在473K时同氯气作用,可得到褐红色晶体AuCl3。在固态和气态时,该化合物均为二聚体(类似于Al2Cl6)。AuCl3易溶于水,并水解形成一羟三氯合金(III)酸:
AuCl3 + H2O = H[AuCl3OH]
将金溶于王水或将Au2Cl6溶解在浓盐酸中,然后蒸发得到黄色的氯代金酸HAuCl4·4H2O。由此可以制得许多含有平面正方形离子[AuX4]-的盐(X = F,Cl,Br,I,
CN,SCN,NO3)。
(二)锌族元素
1、锌族元素的基本性质
锌族元素包括锌、镉、汞,是IIB族元素,与铜族元素同处于周期表中的ds区。锌族元素结构特征为(n-1)d10ns2,锌族和II A族的碱土金属元素都有两个s电子,失去s电子后都能呈+2氧化态。故II B与II A族元素有一些相似之处,但锌族元素由于次外层有18个电子,对原子核的屏蔽较小,有效核电荷较大,对外层S电子的引力较大,其原子半径、M2+ 离子半径都比同周期的碱土金属为小,而其第一、第二电离势之和以及电负性都比碱金属为大。由于是18电子层结构,所以本族元素的离子具有很强的极化力和明显的变形性。因此锌族元素在性质上与碱土金属有许多不同。如:
(1)主要物理性质:IIB族金属的熔、沸点都比II A族低,汞在常温下是液体。II A族和II B族金属的导电性、导热性、延展性都较差(只有镉有延展性)。
(2)化学活泼性:锌族元素活泼性较碱土金属差。II A族元素在空气中易被氧化,不但能从稀酸中置换出氢气,而且也能从水中置换出氢气。II B族在干燥空气中常温下不起反应,不能从水中置换出氢气,在稀的盐酸或硫酸中,锌易溶解,镉较难,汞则完全不溶解。
(3)化合物的键型及形成配合物的倾向:由于IIB族元素的离子具有18电子构型,因而它们的化合物所表现的共价性,不管在程度上或范围上都比IIA族元素的化合物所表现的共价性为大。IIB族金属离子形成配合物的倾向比IIA族金属离子强得多。
(4)氢氧化物的酸碱性:II B族元素的氢氧化物是弱碱性的,且易脱水分解,IIA的氢氧化物则是强碱性的,不易脱水分解。而Be(OH)2和Zn(OH)2都是两性的。
(5)盐的溶解度及水解情况:两族元素的硝酸盐都易溶于水;II B族元素的硫酸盐易溶,而钙、锶、钡的硫酸盐则是微溶;两族元素的碳酸盐又都难溶于水。IIB族元素的盐在溶液中都有一定程度的水解,而钙、锶和钡的盐则不水解。
(6)某些性质的变比规律:II B族元素的金属活泼性自上而下减弱,但它们的氢氧化物的碱性却自上而下增强;而IIA族元素的金属活泼性以及它们的氢氧化物的碱性都自上而下增强。
2、锌、汞及其化合物
(1)锌和汞
锌在含有CO2的潮湿空气中很快变暗,生成一层碱式碳酸锌,它是一层较紧密的保护膜:
4Zn + 2O2 + 3H2O + CO2 = ZnCO3·3Zn(OH)2
锌在加热条件下,可以与绝大多数非金属反应,在1273 K时锌在空气中燃烧生成氧化锌;而汞在约620 K时与氧明显反应,但在约670 K以上HgO又分解为单质汞。
锌粉与硫磺共热可形成硫化锌。汞与硫磺粉研磨即能形成硫化汞。这种反常的活泼性是因为汞是液态,研磨时汞与硫磺接触面增大,反应就容易进行。
锌既可以与非氧化性的酸反应又可以与氧化性的酸反应,而汞在通常情况下只能与氧化性的酸反应。汞与热的浓硝酸反应,生成硝酸汞:
3Hg + 8HNO3 = 3Hg(NO3)2 + 2NO↑+ 4H2O
用过量的汞与冷的稀硝酸反应,生成硝酸亚汞:
6Hg+ 8HNO3 = 3Hg2(NO3)2 + 2NO↑+ 4H2O
和汞不同,锌与铝相似,都是两性金属,能溶于强碱溶液中:
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
锌和铝又有区别,锌溶于氨水形成氨配离子,而铝不溶于氨水形成配离子:
Zn + 4NH3 + 2H2O = [Zn(NH3)4]2+ + H2↑+ 2OH-
锌、汞都能与其它各种金属形成合金。锌与铜的合金称为黄铜,汞的合金称为汞齐。
(2)锌、汞的化合物
Zn2+ 和Hg2+ 离子均为18电子构型,均无色,故一般化合物也无色。但Hg2+ 离子的极化力和变形性较强,与易变形的S2-、I-形成的化合物往往显共价性,呈现很深的颜色和较低的溶解度。如ZnS(白色、难溶)、HgS(黑色或红色,极难溶);ZnI2(无色、易溶)、HgI2(红色或黄色,微溶)。
Zn2+和Hg2+ 离子溶液中加适量碱,发生如下反应:
Zn2+ + 2OH-= Zn (OH)2↓(白色)
Hg2+ + 2OH-= HgO(黄色) + H2O
Zn (OH)2为两性,既可溶于酸又可溶于碱。受热脱水变为ZnO。Hg (OH)2在室温不存在,只生成HgO。而HgO也不够稳定,受热分解成单质。
ZnCl2是固体盐中溶解度最大的(283K,333g/100g H2O)它在浓溶液中形成配合酸:ZnCl2 + H2O = H[ZnCl2 (OH)]
这种酸有显著的酸性,能溶解金属氧化物:
FeO + 2 H[ZnCl2 (OH)] = Fe [ZnCl2 (OH)]2 + H2O
故ZnCl2的浓溶液用作焊药。
HgCl2(熔点549K)加热能升华,常称升汞,有剧毒!稍有水解,但易氨解:
HgCl2 + 2H2O = Hg(OH)Cl + H3O+ + Cl-
+ Cl-
HgCl2 + 2NH3 = Hg(NH2)Cl↓(白色) + NH
4
可被SnCl2还原成Hg2Cl2(白色沉淀):
2HgCl2 + SnCl2 + 2HCl = Hg2Cl2↓+ H2SnCl6
若SnCl2过量,则进一步还原为Hg:
Hg2Cl2 + SnCl2 + 2HCl = 2Hg2Cl2↓(黑色) + H2SnCl6
红色HgI2可溶于过量I-溶液中:
Hg2+ + 2I-= HgI2↓;HgI2 + 2I-= [HgI4]2-(无色)
或NH3。
K2[HgI4]和KOH的混合液称为奈斯勒试剂用以检验NH+
4
NH4Cl + 2 K2[HgI4] +4KOH = Hg2NI·H2O↓(红色) + KCl + 7KI + 3H2O 在水溶液中能稳定存在,且与Hg2+ 有下列平衡:
Hg+2
2
Hg2+ + Hg Hg+2
K = 166
Hg2Cl2俗称甘汞,微溶于水,无毒,无味,但见光易分解:Hg2Cl2光HgCl2 + Hg
在氨水中发生歧化反应:
Hg2Cl2 +2NH3 = HgNH2Cl↓(白色) + Hg↓(黑色) + NH4Cl
离子。
此反应可用以检验Hg+2
2
【典型例题】
例1、市场上出现过一种一氧化碳检测器,其外观像一张塑料信用卡,正中由一个直径不到2cm的小窗口,露出橙红色固态物质。若发现橙红色转为黑色而在短时间内不复原,表明室内一氧化碳浓度超标,有中毒危险。一氧化碳不超标时,橙红色虽也会变黑却能很快复原。已知检测器的化学成分:亲水性硅胶、氯化钙、固体酸H8[Si(Mo2O7)6]·28H2O、CuCl2·2H2O和PdCl2·H2O(注橙红色为复合色,不必细究)。
(1)CO与PdCl2·H2O的反应方程式为。
(2)(1)的产物之一与CuCl2·2H2O反应而复原,化学方程式为。
(3)(2)的产物之一复原的反应方程式为。
分析:CO与PdCl2·H2O产物是Pd、HCl和CO2,只有Pd与CuCl2反应能复原。CuCl2与Pd反应生成Cu还是CuCl呢?因为Cu(I) 比Cu(0) 更易被氧化,只能是CuCl(CuCl可被空气中的O2氧化成CuCl2)。
解:(1)CO + PdCl2·H2O = CO2 + Pd + 2HCl + H2O
(2)Pd + CuCl2·2H2O = PdCl2·2H2O + 2CuCl + 2H2O
(3)4CuCl + 4HCl + 6H2O + O2 = 4CuCl2·2H2O
例2、铬的化学性质丰富多彩实验结果常出人意料。将过量30%的H2O2加入(NH4)2CrO4的氨水溶液,加热至50℃后冷却至0℃,析出暗棕红色晶体A。元素分析报告:A含Cr 31.1%,N 25.1%,H 5.4%。在极性溶剂中A不导电。红外图谱证实A有N—H键,且与游离氨分子键能相差不太大,还证实A中的铬原子周围有7个配位原子提供孤对电子与铬原子形成配位键,呈五角双锥构型。
(1)以上信息表明A 的化学式为 ,请画出A 的可能结构式。
(2)A 中铬的氧化数是多少?
(3)预期A 最特征的化学性质是什么?
(4)写出生成晶体A 的化学方程式 。 分析:①元素分析报告表明A 中Cr ︰N ︰H ︰O =
52%1.31︰14%1.25︰1%4.5︰16%4.38= 1︰3︰9︰4,A 的最简化学式为CrN 3H 9O 4。
②A 在极性溶剂中不导电,说明A 中无外界。
③红外图谱证实A 中与NH 3参与配位。
④A 中有7个配位原子,五角双锥构型,故A 中三氮四氧全配位。
解:(1)A 的化学式为Cr(NH 3)3O 4或CrN 3H 9O 4,A 的可能结构式如下图:
或
(注:还可画出其他结构式,但本题强调的是结构中有2个过氧键,并不要求判断它们在结构中的正确位置。)
(2)A 中铬的氧化数为 +4。
(3)氧化还原性(或易分解或不稳定等类似表述均可)。
(4)CrO 2
4+ 3NH 3 + 3H 2O 2 = Cr(NH 3)3 (O 2)2 + O 2 + 2H 2O + 2OH -
例3、次磷酸H 3PO 2是一种强还原剂,将它加入CuSO 4水溶液,加热到40 ~ 50℃,析出一种红棕色难溶物A 。经鉴定:反应后的溶液是磷酸和硫酸的混合物;X 射线衍射证实A 是一种六方晶体,结构类同于纤维锌矿(ZnS ),组成稳定;A 的主要化学性质如下:(1)温度超过60℃,分解成金属铜和一种气体;(2)在氯气中着火;(3)遇盐酸放出气体。
(1)写出A 的化学式。
(2)写出A 的生成反应方程式。
(3)写出A 与氯气反应的化学方程式。
(4)写出A 与盐酸反应的化学方程式。
分析:MX 具有ZnS 的结构,是M ︰X = 1︰1的组成,A 只可能是CuS 、CuP 、CuO 和CuH 等,显然,只有CuH 才与其他信息对应。解决了A 是什么,其余问题就迎刃而解。
解:(1)CuH
(2)4CuSO 4 + 3H 3PO 2 + 6H 2O = 4CuH + 3H 3PO 4 + 4H 2SO 4
(3)2CuH + 3Cl 2 = 2CuCl 2 + 2HCl
(4)CuH + HCl = CuCl + H 2 或CuH + 2HCl = HCuCl 2 + H 2或CuH + 2HCl = H 2CuCl 3 +
O O O O
Gr NH 3 H 3N
NH 3
O O O Gr
3 N H 3 NH 3
H2
例4、用黄铜矿炼铜按反应物和生成物可将总反应写成:
CuFeS2 + SiO2 + O2→Cu + FeSiO3 + SO2
事实上冶炼反应是分步进行的。①黄铜矿在氧气作用下生成硫化亚铜和硫化亚铁;②硫化亚铁在氧气作用下生成氧化亚铁,并与二氧化硅反应生成矿渣;③硫化亚铜与氧气反应生成氧化亚铜;④硫化亚铜与氧化亚铜反应生成铜。
(1)写出上述分步反应的化学方程式。
(2)配平总反应方程式的系数。
(3)据最新报道,有一种叫Thibacillus ferroxidans 的细菌在氧气存在下可以将黄铜矿氧化成硫酸盐。反应是在酸性溶液中发生的。试写出配平的化学方程式。
(4)最近我国学者发现,以精CuFeS2矿为原料在沸腾炉中和O2(空气)反应,生成物冷却后经溶解、除铁、结晶,得到CuSO4·5H2O,成本降低了许多。实验结果如下:
回答如下问题:
①CuFeS2和O2主要反应的方程式为。
②实际生产过程中沸腾炉的温度为600~620℃。控制反应温度的方法是
。
③温度高于600~620℃生成物中水溶性Cu(%)下降的原因是
。
分析:化学方程式配平的方法很多,现以(2)为例。由于氧化还原的电子得失总数相等,可假设CuFeS2 中Cu、Fe、S的氧化态分别为+2、+2、–2,这样,铁在反应中氧化态不变,1 mol CuFeS2?
?
?→
?-mole
10 1 mol Cu + 2 mol SO
2
,10 mol e-应由5/2 mol O2获得。
(3)中生成的硫酸盐,因有氧气参加反应,应为Cu2+、Fe3+ 盐。
(4)中的反应类似“煅烧黄铁矿”的反应:4FeS2 + 11O2 = 2Fe2O3 + 8SO2。从题给信息看,生成物中没有水溶性铁,可见黄铜矿在沸腾炉里的燃烧产物中铁是以氧化物的形式存在的,而不是硫酸盐。
解:(1)①2CuFeS2 + O2Cu2S + 2FeS + SO2
②2FeS + 3O22FeO + 2SO2;FeO + SiO2FeSiO3
③2Cu2S + 3O22Cu2O + 2SO2
④Cu2S + 2Cu2O 6Cu + SO2。
(2)2CuFeS2 + 2SiO2 + 5O22Cu + 2FeSiO3 + 4SO2。
(3)4CuFeS2 + 2H2SO4 +17O2细菌4CuSO4 +Fe2(SO4)3 + 2H2O.
(4)①4CuFeS2 + 15O24CuSO4 + 2Fe2O3 + 4SO2
②控制加入CuFeS2的速度(因CuFeS2与O2反应放热)
③CuSO4 = CuO + SO3(写成SO2 + 1/2O2也可)
例5、向硫酸四氨合铜的水溶液中通入SO2至溶液呈微酸性,生成白色沉淀A。元素分析表明A含Cu、N、S、H、O五种元素,而且物质的量之比为Cu︰N︰S = 1︰1︰1。激光拉曼光谱和红外光谱显示A的晶体里有一种呈三角椎体和一种呈正四面体的离子(或分子)。磁性实验指出A呈逆磁性。
(1)写出A的化学式。
(2)写出生成A的配平的化学方程式
(3)将A和足量的10 mol/L H2SO4混合微热,生成沉淀B、气体C和溶液D。B是主要产品,尽管它是常见物质,本法制得的呈超细粉末状,有重要用途。写出这个反应式(配平)。
(4)按(3)操作得到B的最大理论产率是多大?
(5)有人设计了在密闭容器里使A和硫酸反应,结果B的产率大大超过按(4)的估计。问:在这种设计操作下,B的最大理论产率多大?试对此作出解释。
分析:(4)A与H2SO4混合发生复分解反应生成SO2气体,同时Cu+ 在酸性条件下歧化为Cu2+ 和Cu。2Cu+ = Cu2+ + Cu故(3)的产率最大为50%
(5)在密闭容器中反应生成的SO2与Cu2+反应,Cu2+ 被还原成Cu+,Cu+ 再歧化,循环往复。故理论产率会接近100%。
解:
(1)A为CuNH4SO3
(2)2Cu(NH3)4SO4 + 3SO2 + 4H2O = 2CuNH4SO3↓+ 3(NH4)2SO4
(3)2CuNH4SO3 + 2H2SO4 = Cu + CuSO4 + 2SO2 + 2H2O + (NH4)2SO4
(4)50%
(5)100%,因为SO2循环使用,直至所有CuSO4还原为Cu,故理论产率可达100%。
例6、在MnCl2溶液中加入适量的HNO3,再加入NaBiO3,溶液中出现紫色后又消失。试说明其原因,并写出有关反应的化学方程式。
分析:NaBiO3固体是极强的氧化剂,在酸性介质中能将Mn2+ 离子氧化为MnO-
4
(紫
色),但MnO-
4
离子也具有强氧化性,如溶液中存在还原剂,氧化还原反应能继续发生。Cl
-离子具有还原性,故MnO-
4离子与Cl-离子发生氧化还原反应,MnO-
4
的紫色立即消失。
当Mn2+过多时,Mn2+ 也可作还原剂与MnO-
4
发生氧化还原反应,生成中间价态的Mn4+ 的
化合物,MnO 2的存在使溶液产生棕褐色的沉淀。从上面的分析可知,是还原性物质的存在与具有强氧化性的MnO -
4发生氧化还原反应而使紫色消失的。
解:NaBiO 3在适量的HNO 3溶液中,能把Mn 2+ 氧化为MnO -
4,使溶液呈紫色。即:
2 Mn 2+ + 5 NaBiO
3 + 14H + = 2 MnO -
4 + 5Bi 3+ + 5Na + + 7H 2O
但是,当溶液中有Cl - 存在时,紫色出现后会立即腿去。这是由于MnO -
4被Cl -
还原的缘故。
2 MnO -
4+ 10 Cl -
+ 16H + = 2 Mn 2+ + 5Cl 2↑+ 8H 2O 当Mn 2+ 过多时,也会在紫色出现后立即消失。这是因为生成的MnO -
4 又被过量Mn
2+ 的还原:
2 MnO -
4+ 3 Mn 2+ + 2H 2O = 5MnO 2↓(棕褐色) + 4H +
例7、在K 2Cr 2O 7的饱和溶液中加入浓硫酸,并加热到200℃时,发现溶液的颜色变为蓝绿色,经检查反应开始时溶液中并无任何还原剂存在,试说明上述变化的原因。
分析:反应开始时溶液中并无还原剂存在,为何溶液的颜色会变为蓝绿色?(有Cr 3+存在)解答本题的关键要知道CrO 3的熔点为196℃,加热到200℃时则分解成Cr 2O 3
(绿色)。 解:在K 2Cr 2O 7的饱和溶液中加入浓硫酸,即可析出暗红色的CrO 3晶体:
K 2Cr 2O 7 + H 2SO 4(浓) = 2CrO 3↓+ K 2SO 4 + H 2O
CrO 3的熔点为196℃,对热不稳定。加热超过熔点则分解放出氧气:
CrO 3 2Cr 2O 3 + 3O 2↑
Cr 2O 3是溶解或熔融皆难的两性氧化物,和浓硫酸反应生成Cr 2(SO 4)3和H 2O :
Cr 2O 3 + 3H 2SO 4 = Cr 2(SO 4)3 + 3H 2O
Cr 2O 3是绿色物质,部分Cr 2O 3与H 2SO 4反应后生成蓝绿色的Cr 2(SO 4)3溶液,我们观察到溶液的颜色即为Cr 3+离子的显色(蓝绿色)。
例8、金属M 溶于稀盐酸时生成MCl 2,其磁偶极矩为5.0Wb ·m 。在无氧操作条件下,MCl 2溶液遇NaOH 溶液,生成一白色沉淀A 。A 接触空气就逐渐变成绿色,最后变成棕色沉淀B 。灼烧时,B 生成了红棕色粉末C ,C 经不彻底还原而生成了铁磁性的黑色物D 。
B 溶于稀盐酸生成溶液E ,它使KI 溶液氧化成I 2,但在加入KI 前先加入NaF ,则KI 将不被E 所氧化。
若向B 的浓NaOH 悬浮液中通入Cl 2可得紫红色溶液F ,加入BaCl 2时就会沉淀出红棕色固体G ,G 是一种强氧化剂。
试确认各字母所代表的化合物,并写出反应的化学方程式。
分析:M 2+ 磁偶极矩为5.0 Wb ·m ,根据公式)2(+=n n μ 估算出M 2+ 有4个成单的
d电子,符合此条件的金属可能位于VIB、VIIB族,也可能是铁,Cr2+、Mn2+ 和Fe2+ 都有4个成单的电子。
实验操作中,C经不彻底还原而生成了铁磁性的黑色物D。D所代表的化合物应是Fe3O4,这样,就确定M所代表的金属是铁。根据以上的两个条件,确定M代表的金属是铁后,将其代入实验中进行检验,证明判断是正确的。
金属元素有多种,但根据M2+ 离子的M2+ 磁偶极矩为5.0 Wb·m,就把金属M划定在一个很小的范围内,又通过生成铁磁性的黑色物就能够确定M所代表的金属是铁,这是解答此题的重要条件。
解:M为Fe,A为Fe(OH)2,B为Fe(OH)3,C为Fe2O3,D为Fe3O4,E为FeCl3,F ,G为BaFeO4·H2O。
为FeO 2
4
【知能训练】
1、阅读如下信息后回答问题:元素M,其地壳丰度居第12位,是第3种蕴藏最丰富的过渡元素,是海底多金属结核的主要成分,是黑色金属,主要用途:炼钢,也大量用来制作干电池,还是动植物必需的微量元素。
(1)M的元素符号是。
(2)M的最重要矿物的化学式是。
(3)M的三种常见化合物是、和。
2、在硫酸铬溶液中,逐滴加入氢氧化钠溶液,开始生成灰兰色沉淀,继续加碱,沉淀又溶解,再向所得溶液中加溴水,直到溶液的绿色转为黄色。写出各步的化学方程式。
3、写出下列实验的现象和反应的化学方程式。
(1)向黄血盐溶液中滴加碘水。
(2)将3rnol·L-1的CoCl2溶液加热,再滴入AgNO3溶液。
(3)将[Ni(NH3)6]SO4溶液水浴加热一段时间后再加入氨水。
4、橙红色晶体A受热剧烈分解得到绿色固体B和无色、无味的气体C。C与KMnO4、KI等均不发生反应。B不溶于NaOH溶液和盐酸,将B与NaOH固体共熔后冷却得到绿色固体D。D溶于水后加入H2O2得到黄色溶液E。将A溶于稀硫酸后加入Na2SO3得到绿色溶液F。向F中加入过量NaOH溶液和溴又得到E。请确定各字母所代表的物质,并写出化合物A分解反应的化学方程式。
5、铁与各种钢有多种用途,在化学工业中可作储罐材料,铁易锈蚀。为在不同的特殊条件下应用它,有必要有铁(Ⅱ)和铁(Ⅲ)化合物的性质的知识。
(1)众所周知,铁能跟氯气发生反应,但另一方面,氯又可用钢瓶运输和保存。在不存在第三种反应物时,氯化铁反应的必要条件是什么?该反应的产物是什么?
(2)在高温(约973K)下铁和气态氯化氢作用的反应产物是什么?
(3)在隔绝空气的条件下令铁跟盐酸作用并蒸发所得溶液至开始结晶,问得到的晶体的组成是什么?
(4)在氯化铁(Ⅲ)溶液里加入如下物质,写出生成物的化学式。
①过量盐酸;②氰离子;③2,4-戊二酮(乙酰丙酮)和氨。
(5)水龙头上经常出现锈斑,它由什么组成?是怎样生成的?试用总反应式写出生成过程。
6、回答下列各题
(1)向少量FeCl3溶液中加入过量的饱和(NH4)2C2O4溶液后,滴加少量KSCN溶液并不出现红色,但再滴加盐酸则溶液立即变红色。请解释其原因。
(2)Co3+的盐一般不如Co2+的盐稳定,但生成某些配合物时,Co3+却比Co2+稳定。请解释其原因。
(3)由CoSO4·7H2O制无水CoCl2。
(4)由粗镍制备高纯度的镍。
7、铂的配合物是一类新抗癌药,如顺式–二氯二氨合铂对一些癌症有较高治愈率。铂元素化学性质不活泼,几乎完全以单质形式分散于各种矿石中,铂的制备一般是先用王水溶解经处理后的铂精矿,滤去不溶渣,在滤液中加入氯化铵,使铂沉淀出来,该沉淀经1000℃缓慢灼烧分解,即得海绵铂。回答下列问题:
(1)写出上述制备过程有关的化学方程式;
(2)氯铂酸与硝酸钠在500℃熔融可制得二氧化铂,写出化学方程式。PtO2在有机合成中广泛用作氢化反应的催化剂,试问此反应中实际起催化作用的物种是什么?
(3)X射线分析测得K2[PtCl6]晶胞为面心立方,[PtCl6]2-中Pt4+位于立方体的八个顶角和六个面心。问Pt4+采用何种类型杂化?[PtCl6]2-空间构型?K+占据何种类型空隙?该类型空隙被占百分率?标出K+在晶胞中的位置。
8、矿物胆矾就是CuSO4·5H2O,当它溶于水渗入地下,遇到黄铁矿(FeS2),铜将以辉铜矿(Cu2S)的形式沉积下来;而反应得到的铁和硫则进入水溶液,该溶液无臭味,透明不浑浊,绿色,呈强酸性,在有的矿区常可见到这种具有强腐蚀性的地下水(俗称黑水)渗出地面,上述反应可以用一个化学方程式来表示,试写出配平的化学方程式。
9、根据《本草纲目》有关记载:“水银乃至阴之毒物,因火煅丹砂而出,加以盐、(明)矾而为轻粉(Hg2Cl2),加以硫磺升而为银朱”。写出主要化学反应方程式。
10、锌钡白(立德粉)是ZnSO4和BaS以相同物质的量混合后反应制成白色颜料。写出由菱锌矿(ZnCO3)为主要原料制锌钡白的有关反应的化学方程式。若菱锌矿中含有Fe2
+、Ni2+等杂质,在制备过程中如何除去?(已知:E0
Fe 2+
/Fe
= -0.44,E0Ni2+/Ni = -0.25)
11、地球化学家用实验证实,金矿常与磁铁矿共生的原因是:在高温高压的水溶液(即所谓“热液”)里,金的存在形式是AuS-络离子,在溶液接近中性时,它遇到Fe2+离子会发生反应,同时沉积出磁铁矿和金矿,试写出配平的化学方程式。
无机化学考研复习总结笔记
无机化学复习总结 无机化学复习不完全攻略(原创,有不足,请指点)5 j5 K# N. x2 r) 转载自free kao yan6 n! Z+ E9 T; _) m/ U 首先说明一下,我是复习考有机专业的,因为接触无机比较早,也看过一些无机的教材,对无机的知识点略有了解,同时应版主要求,把版中无机的讨论带动起来,故介绍一下个人学的无机的心得,供大家参考,仅代表个人观点. & B$ {0 `1 t3 h7 ~ 无机的东西比较杂,并且比较松散,主要可以分为理论部分和元素化合物部分! V% q* h7 C' G+ O 理论部分主要分为四大结构和四大平衡,以及化学热力学,动力学初步和溶液 四大结构:原子结构,分子结构,配合物结构,晶体结构 四大平衡:酸碱平衡,沉淀溶解平衡,配位离解平衡,氧化还原平衡 如果你考物化的话化学热力学和动力学基础就不用看了,物化讲的比这个透彻得多,平衡的总纲以及溶液部分在物化里面也是讲的很详细; 如果你分析化学学得好的话,四大平衡也可以少看很多,因为分析化学就是建立在四大平衡的基础上的(仪器分析不算,呵呵); 5 `2 f: h; A$ f/ f+ F5 k 而结构化学里面所涉及到的结构问题又比无机的四大结构深多了,同样如果你在这方面比较强,那四大结构又省了很多事. 但是如果每门掌握的都不透彻怎么办呢?不要担心,无机的理论部分
仅仅是是一个大纲性质的东西,也就是总结性的概括.所以每种理论都有,但是每种理论要求都比较简单,按照四大结构-四大平衡-化学热力学初步-化学动力学初步-溶液的顺序自己仔细地过一遍也不是很难的事情,起码我感觉比自学有机容易多了,呵呵 如果你的化学基础比较扎实,也不要在旁边偷偷笑,正所谓"结构决定性质",无机尽管理论比较简单,但是其精髓在于用简单的理论解释大量的现象和物质性质,在你掌握相关理论的基础上要能够灵活地把它们运用到平时见到的单质和化合物的性质解释.这样才算真正掌握了无机的理论. 总的来说无机的理论部分重点在运用. s5 V [. M$ }# E) Z 而无机化学的重点则元素部分,这个也是无机主要讲的东西以及无机的特点., Y2 A. _0 I, {& Q3 Y4 ^" z- G" a 首先建议周期表最好是背过,认识并且会写除f区以外的元素,镧系最好能背过,一些重要的比如说La Ce也要知道的.* ~8 E+ ?2 e3 m$ G2 @ 个人感觉主族元素里面比较重要的是B,P,S,Sn,Pb,As,Bi,4 W' N: X5 ?8 h 副族里Hg,Co,Cr,Mn,Ti,V,Cu等比较重要,下面分主族和副族元素分开介绍:, I* Q6 y8 _- _' l' b, U7 Y w 第一主族里面要注意过氧化物,超氧化物,臭氧化物的结构和生成条件,焰色反应的火焰颜色(包括碱土金属和少量过渡金属的都要知道),以及碱金属的不溶盐;
同主族元素的性质
高一化学导学案 第一章原子结构与元素周期表 第3节元素周期表的应用(第二课时) 【学习目标】 1、以I A族和VII A族元素为例,掌握同主族元素性质的递变规律,并能运用原子结构的理论初步解释这些递变规律。 2、能够利用同主族元素性质的特点来预测未知元素的性质。 3、了解元素周期表中各个区域元素的应用。 【学习重点、难点】 1、同主族元素性质的递变规律。 2、原子结构、元素性质和它在元素周期表中位置的关系(“位、构、性”三角关系) 【课前预习区】 1、元素周期表中,同主族元素原子的核外电子排布有什么特点? 2、同主族元素的性质的递变规律是什么? 【课堂互动区】 一、预测同主族元素的性质 【问题组】 1、VII A族元素的原子结构和性质有什么异同点? 2、碱金属元素的原子结构和性质有什么异同点? 【归纳总结一】 (一)VII A族元素原子结构和性质的相似性和递变性
【针对练习一】 1、下列有关卤族元素的说法中,正确的是() A.原子半径:F>Cl>Br>I B.最外层电子数:F>Cl>Br>I C.熔、沸点:F2>Cl2>Br2>I2 D.热稳定性:HF>HCl>HBr>HI 【自学课本P23观察·思考】预测金属钾的性质 【实验设计】钠、钾跟水反应的实验(请填写课本上的表) 注意:实验时,剩余的钠钾要。 【归纳总结二】 (二)碱金属元素原子结构和性质的相似性和递变性 1、相似性 (1)原子的最外电子层都有______ 个电子。 (2)最高化合价均为______价。 (3)都是活泼的金属元素,单质都能与氧气、水等物质发生反应。(4)最高价氧化物对应的水化物一般具有很强的______。 【针对练习二】 1、下列关于碱金属元素的原子结构和性质的叙述不正确的是( ) A.碱金属原子最外层都只有1个电子,在化学反应中容易失去 B.碱金属单质都是强还原剂 C.碱金属单质都能在氧气中燃烧生成过氧化物 D.碱金属单质都能与水反应生成碱
《预测同主族元素的性质》导学案.doc
第三节元素周期表的应用(第2课时) 主备:邢永宁审核:李丽马伟民件鸿雨 教师寄语:成功源于不断的积累! 【学习口标】 1?掌握以V1IA族和I A族为代表的同主族元素性质的递变规律 2.通过探究实验的学习,培养学生的实验设计能力。 3?了解元素周期表在生产实践中的指导作用。 【课前小测】 1 ?同周期元素性质的递变规律___________________________________________________ 2.第I A族包括___________ 七种元素,第VUA族包括________________________ o 【预习】课木P22【交流?研讨】 【预测同主族元索的性质】 【自学课本P23】 【自测填表】 %1V1IA族元素 元素符号原子结构 示意图 单质与虫化合最高价氧化物对应的水化 物 原子得 电子能 力条件难 易 氢化物 稳定性 化学式酸性强弱 F C1 Br I
结论:第V1IA族元索最外层都有个电子,在化学反应中都易电子,它们原子得电子能力都_____ ,都是—的非金屈元素。它们都能形成气态氢化物,最高价氧化物的水化 物都是______ ,能与大多数金属 ,其单质常做_____________ 剂。但是从氟到碘,原子电子层数,原子半径,失电子能力,得电子能力______________________ 」 %1单质的氧化性实验探究 (F2> CI2、Br2> I2) 实验步骤实验现象离子方程式 向ImL澳化钠溶液中加入 ImL氯水,再加入2mL四氯 化碳用力振荡 向ImL碘化钠溶液中加入 ImL氯水,再加入2mL四氯 化碳用力振荡 向ImL碘化钠溶液中加入 ImL溪水,再加入2mL四氯 化碳用力振荡 结论:______________________________________ 注意:氧族、氮族等非金属主族元索性质的递变规律类似VIIA族元索,但原子得电子能力比同周期的VIIA族元素 ___ 。 二、根据同主族元素性质的相似性和递变规律预测某种元素单质和化合物的性质 【自学课本P2?观察?思考】预测金屈钾的性质 【实验设计】 (1)钠、钾跟水反应的实验(请填写课本上的表) 注意:实验吋,剩余的钠钾要____________________ o (2)预测I A族元素(乂称碱金属元素)性质的递变 元素符号原子结构示 意图 原子 半径 原子失 电了能 最高价 单质反应的剧烈程 度
高中化学鲁科版必修2作业: 第1章第3节第2课时 预测同主族元素的性质 作业 含解析
[基础达标] 1.宇宙飞船的太阳能电池板有“飞船血液”之称,它可将太阳能直接转化为电能,我国 在砷化镓太阳能电池研究方面国际领先。砷(As)和镓(Ga)都是第4周期元素,分别属于ⅤA 族和ⅢA族。下列有关说法正确的是() A.As的非金属性强于P B.AsH3的稳定性强于PH3 C.Ga的原子序数比Ca大1 D.太阳能电池利用的是可再生能源,属于绿色电池 解析:选D。根据同主族元素性质的递变规律,非金属性P>As,对应氢化物稳定性AsH3
第二课时 预测同主族元素的性质
第二课时预测同主族元素的性质 一、预测同主族元素的性质 1 .同主族元素的相似性 在元素周期表中位于同主族的元素原子的最外层电子数_____,因此,同主族元素具有____的性质。 第ⅦA 族元素,该族元素包括___________________等元素,其原子最外层都有______个电子,得电子能力很______,所以第ⅦA 族元素都是________的_______元素。因此它们在性质上表现出很多共性,如元素的最高化合价为________、最低化合价为________;它们存在的最高价氧化物对应的水化物具有很强的__________性;它们都能形成____________;在氧化还原反应中,它们的单质常做____________。 2 .同主族元素性质的递变规律 同主族元素原子从上到下电子层数依次________,原子半径逐渐________,失电子能力逐渐________,得电子能力逐渐____________。从而引起同主族元素的单质及化合物有关化学性质的_________________。 第VllA 族元素原子从上到下___________依次增多,_____________逐渐增大,_________逐渐减弱,因此它们在化学性质上表现递变性。从________到________,单质跟H2发生的化合反应越来越_____进行:氟气跟H2在________就能化合,并发生_______;氯气在__________的条件下,能跟H 2发生的化合反应;溴蒸气跟H2的反应在________时能地进行;而碘跟H2的反应要在____________下才能进行,生成的碘化氢,同时发生________。从______到_____,单质的氧化性依次减弱:F :能跟水剧烈反应产生O2 ,反应方程式为2F2 + 2H2O =4HF + O2 , C12、Br2、I 2都不能置换水中的氧;C12能跟NaBr 、KI 发生______反应,反应的离子方程式为______________;Br 2能跟KI发生反应,反应的离子方程式为_____________。 3 .根据同主族元素性质的__________和_____________,可以预测某种元素的单质及其化合物的性质。 ⅠA 族中的金属元素______________________等称为碱金属元素。由于碱金属元素原子的最外层都有________电子,因此碱金属元素的及性质相似:都是__________的金属元素;元素的最高化合价为_________ ;单质都能与_______、_________等物质发生反应;碱金属元素最高价氧化物对应的水化物一般具有_________的碱性。但是由于碱金属元素原子的___________、_____________递增,使碱金属元素的原子失电子能力逐渐___________,即金属性逐渐_________。因此,锂与氧气反应__________钠与氧气反应剧烈,而铷和铯遇到空气立即______;钾与水反应比钠于水反应___________,并发生__________爆炸,铷和铯遇水则立即__________甚至__________。 二、学习元素周期表的意义 1 .根据在元素周期表中位置相近的元素具有__________这一规律,可以利用元素周期表寻找____________。人们不但在金属元素和非金属元素的交界处寻找________,还在过渡元素中寻找优良的___________。目前,人们已经用铁、镍做催化剂使石墨在高温和高压下转化成金刚石;利用少量稀土元素能大大改善催化剂性能的特点,广泛采用过渡元素做催化剂进行石油化工生产。在元素周期表里,从班B 族到VIB 族的过渡元素如钦(Ti )、担(Ta )、钥(Mo )、钨(W )等的单质,____________具有等特点,人们利用它们制成的特种合金来制造火箭、导弹、宇宙飞船等。此外,人们还利用元素周期表寻找合适的__________等。 2 、科学研究发现,地球上化学元素的分布跟它们在元素周期表里的位置有着密切的关系。例如,相对原子质量较小的元素在地壳中含量较_________,相对原子质量较大的元素在地壳中含量较__________;原子序数是偶数的元素在地壳中的含量较_______,原子序数是奇数的元素在地壳中的含量较___________;处于地球表面的元素多数呈现___________,处于岩层深处的元素多数呈现__________;碱金属一般是强烈的________元素,主要富集于岩石圈的有的科学家把元素周期表分为10 个区(每个区里的元素的性质相似),并认为同一区域的元素往往是 ___________.
高中化学竞赛第12讲副族元素及其化合物
文档来源为:从网络收集整理.word 版本可编辑.欢迎下载支持. 第12讲 副族元素及其化合物 【竞赛要求】 钛、钒、铬、锰、铁、钴、镍、铜、银、金、锌、汞、钼、钨。过渡元素氧化态。氧化物和氢氧化物的酸碱性和两性。水溶液中的常见离子的颜色、化学性质、定性检出(不使用特殊试剂)和分离。制备单质的一般方法。 【知识梳理】 一、通论 d 区元素是指IIIB~VIII 族元素,ds 区元素是指IB 、IIB 族元素。d 区元素的外围电子构型是(n -1)d 1~10ns 1~2(Pd 例外),ds 区元素的外围电子构型是(n -1)d 10ns 1~2。它们分布在第4、5、6周期之中,而我们主要讨论第4周期的d 区和ds 区元素。 同一周期的d 区或ds 区元素有许多相似性,如金属性递变不明显、原子半径、电离势等随原子序数增加虽有变化,但不显著,都反映出d 区或ds 区元素从左至右的水平相似性。 d 区或ds 区元素有许多共同的性质: (1)它们都是金属,因为它们最外层都只有1~2个电子。它们的硬度大,熔、沸点较高。第4周期d 区元素都是比较活泼的金属,题目能置换酸中的氢;而第5、6周期的d 区元素较不活泼,它们很难和酸作用。 (2)除少数例外,它们都存在多种氧化态,且相邻两个氧化态的差值为1或2,如Mn ,它有–1,0,1,2,3,4,5,6,7;而p 区元素相邻两氧化态间的差值常是2,如Cl ,它有–1,0,1,3,5,7等氧化态。最高氧化态和族号相等,但VIII 族除外。第4周期d 区元素最高氧化态的化合物一般不稳定;而第5、6周期d 区元素最高氧化态的化合物则比较稳定,且最高氧化态化合物主要以氧化物、含氧酸或氟 化物的形式存在,如WO 3、WF 6、MnO -4、FeO -24、CrO - 24等,最低氧化态的化合物主要以配合物形式存在, 如[Cr(CO)5] 2– (3)它们的水合离子和酸根离子常呈现一定的颜色。这些离子的颜色同它们的离子存在未成对的d 电子发生跃迁有关。
综合实验1_同周期、同主族元素性质的递变
综合实验1 同周期、同主族元素性质的递变 实验目的: 1.结合所学知识了解实验方案的意义,巩固对同周期、同主族元素性质递变规律的认识。2.掌握常见药品的取用、液体的加热以及萃取等基本操作。 3.能准确描述实验现象,并根据现象得出相应结论。 实验原理: 同周期元素从左到右,金属性渐弱,非金属性渐强。同主族元素从上到下,非金属性渐弱,金属性渐强。元素金属性的强弱可以从元素的单质跟水或酸溶液反应置换出氢气的难易,或由元素最高氧化物对应水化物——氢氧化物的碱性强弱来判断;元素非金属性的强弱可以从元素最高氧化物水化物的酸性强弱,或跟氢化合生成气态氢化物的难易以及氢化物的稳定程度来判断,另外也可以由非金属单质是否能把其它元素从它们的化合物里置换出来加以判断。 实验器材: 仪器:试管、小烧杯、酒精灯、胶头滴管、试卷夹。 试剂:钠块、镁条、铝片、氯水(新制)、溴水、氯化钠溶液、溴化钠溶液、碘化钠溶液、稀盐酸(1mol/L)、酚酞试液 其它材料:镊子、滤纸、砂纸、玻璃片、火柴(或打火机)。 实验步骤 1.同周期元素性质的递变 (1)取100mL小烧杯,向烧杯中注入约50mL水,然后用镊子取绿豆大小的一块钠,用滤纸将其表面的煤油擦去,放入烧杯中,盖上玻璃片,观察现象。反应完毕后,向烧杯中滴入2~3滴酚酞试液,观察现象。 (2)取两支试管各注入约5mL的水,取一小片铝和一小段镁带,用砂纸擦去氧化膜,分别投入两支试管中。若前面两支试管反应缓慢,可在酒精灯上加热,反应一段时间再加入2~3滴酚酞试液,观察现象。 (3)另取两支试管各加入2mL 1mol/L盐酸,取一小片铝和一小段镁带,用砂纸擦去氧化膜,分别投入两支试管中,观察现象。 2. 同主族元素性质的递变 (1)在三支试管里分别加入约3 mL氯化钠、溴化钠、碘化钠溶液,然后在每一支试管里分别加入新制备的氯水2mL,观察溶液颜色的变化。再各加入少量四氯化碳,振荡试管,观察四氯化碳层的颜色。
主族元素及其化合物
郴州市第二中学化奥辅导资料 ——主族元素及其化合物(2014-3-17) 【知识梳理】 一、氢和稀有气体 (一)氢 氢位于周期表的第一周期IA族,具有最简单的原子结构。氢在化学反应中有以下几种成键情况:H+、H-、共价型氢化物。此外,可形成氢键,以及在缺电子化合物中存在的氢桥键。 (二)稀有气体 [PtF6]- 稀有气体化合物:O2 + PtF6 = O+ 2 由于O2的第一电离能(1175.7 kJ·mol-1)和氙的第一电离能(1171.5 kJ·mol-1)非常接近,于是想到用氙代替氧可能会发生同样的反应。结果成功了。 Xe + PtF6 = Xe +[PtF6]- (1)氟化物 ①制备:氙和氟在密闭的镍反应器中加热就可得到氙氟化物 F2 + Xe(过量)→XeF2、F2 + Xe(少量)→XeF4 、F2 + Xe(少量)→XeF6 ②性质 (a)强氧化性:氧化能力按XeF2——XeF4——XeF6顺序递增。 一般情况被还原为单质。
二、s 区元素 (一)通性 1、它们的价电子构型为ns 1~2,内层为稀有气体稳定电子层结构。价电子很易失去呈+1、+2氧化态。都是活泼性很高的金属,只是碱土金属稍次于碱金属而己。 2、有较大的原子半径。因为每一周期是从碱金属开始建立新的电子层。原子半径变化的规律:同周期从IA 到IIA 减小,同族中从上到下增大。 3、电离势和电负性均较小,其变化规律为同周期从IA 到IIA 增大,同族中从上到下顺序减小。 (二)单质 1、存在:由于它们的化学活泼性,决定它们只可能以化合物形式存在于自然界中。如盐 (X - 、CO -23、SiO -23、SO -24等);氧化物(Li 2O 、BeO 等) 2、性质 (1)物性:单质具有金属光泽,有良好的导电性和延展性,除Be 和Mg 外,其它均较软。它们在密度、熔点、沸点和硬度方面往往差别较大。 (2)化性:活泼。 ①它们具有很高的化学活泼性,能直接或间接地与电负性较高的非金属元素形成相应的化合物。如可与卤素、硫、氧、磷、氮和氢等元素相化合。一般均形成离子化合物(除Li 、Be 及Mg 的卤化物外)。 ②单质与水反应放出氢气。其中Be 和Mg 由于表面形成致密的氧化膜因而对水稳定。 ③标准电极电势均很负,是很强的还原剂。它们的还原性在于态及有机反应中有广泛的应用。如高温下Na 、Mg 、Ca 能把其它一些金属从氧化物或氯化物中还原出来。 3、制备:单质的制备多数采用电解它们的熔盐。如电解NaCl 、BeCl 2、MgCl 2等。 注意:不能电解KCl ,因为会产生KO 2和K ,发生爆炸。 其他方法: ①金属置换 KCl + Na → NaCl +K ↑ (K 比Na 易挥发,离开体系; NaCl 晶格能大于KCl ) BeF 2 + Mg → MgF 2 + Be ②热分解 4KCN = 4K + 4C + 2N 2 2MN 3 2M +3N 2 (M = Na 、K 、Rb 、Cs ) ③热还原 K 2CO 3 + 2C 2K ↑+ 3CO 2KF + CaC 2 CaF 2 + 2K ↑+ 2C 1273~1423K 1473K 真空
副族元素
副族元素
————————————————————————————————作者:————————————————————————————————日期:
高中化学奥林匹克竞赛辅导讲座 第12讲副族元素及其化合物 【竞赛要求】 钛、钒、铬、锰、铁、钴、镍、铜、银、金、锌、汞、钼、钨。过渡元素氧化态。氧化物和氢氧化物的酸碱性和两性。水溶液中的常见离子的颜色、化学性质、定性检出(不使用特殊试剂)和分离。制备单质的一般方法。 【知识梳理】 一、通论 d区元素是指IIIB~VIII族元素,ds区元素是指IB、IIB族元素。d区元素的外围电子构型是(n-1)d1~10ns1~2(Pd例外),ds区元素的外围电子构型是(n-1)d10ns1~2。它们分布在第4、5、6周期之中,而我们主要讨论第4周期的d区和ds区元素。 第4周期d区、ds区元素某些性质 Sc3d14s2 Ti 3d24s2 V 3d3 4s2 Cr 3d54 s1 Mn 3d54 s2 Fe 3d64s2 Co 3d74s2 Ni 3d84s2 Cu 3d104s1 Zn 3d104 s2 熔点/℃1953 1675 4 3 1083 419 沸点/℃2727 326 77 3 2595 907 原子半径 /Pm 164 7 126 125 125128137 M2+半径 /Pm - 9 67 72 74 I1kJ·m ol-1631658 650 652.8 71 7.4 759. 4 758 7 36.7 745. 5 906.4 室温密度 /gcm-3 2.99 4.5 5.96 7.20 7.207.86 8.9 8.90 8.92 7.14 氧化态3–1,0, 2 3,4 –1,0,2 3,4, 5 –2,–1,0 2,3,4 5,6 –1,0,1 2,3,4 5,6,7 0,2,3 4,5,6 0,2 3,4 0,2 3,(4)* 1,2 3 (1) 2 *()内为不稳定氧化态。 同一周期的d区或ds区元素有许多相似性,如金属性递变不明显、原子半径、电离势等
《无机化学》研究生入学考试大纲
《无机化学》研究生入学考试大纲 科目代码:836 一、考查总目标 《无机化学》主要考察学生对无机化学基础理论和元素化学基本知识掌握情况。基础理论包括物质结构基础(原子结构和元素周期律、分子结构、晶体结构和配合物结构)、化学热力学与化学动力学基础(化学热力学、化学平衡、化学动力学)和水溶液化学原理(酸碱平衡、沉淀平衡、氧化还原平衡和配位平衡)。元素化学包括主族元素、过渡元素及其化合物的存在、制备、性质和应用。要求考生系统掌握无机化学的基本知识、基础理论和基本方法,并能运用相关理论和方法分析、解决实际问题。 二、考试形式与试卷结构 (一)试卷成绩及考试时间 本试卷满分150分,考试时间为180分钟。 (二)答题方式 答题方式为闭卷、笔试。 (三)试卷内容结构 物质结构基础:约35分 化学热力学与化学动力学基础:约25分 水溶液化学原理:约35分 主族元素:约30分 过渡元素:约25分 (四)试卷题型结构 选择题:每小题2 分,共50分 填空题:每空2 分,约35分 简答题:约35分 完成并配平反应方程式:10分 计算题:20 分 三、考查范围 (一)考查目标 1、掌握元素周期律,化学热力学,近代物质结构,化学平衡以及基础电化学等基本 原理;并具有对一般无机化学问题进行理论分析和计算的能力, 2、熟悉常见元素及其化合物的性质。培养学生运用无机化学原理去掌握有关无
机化学中元素和化合物的基本知识,并能从微观和宏观相结合来阐述元素及其化合物的性质,熟悉离子的分离和鉴定。 (二)考核要求 第一章原子结构和元素周期系 1.掌握原子、分子、元素、核素、同位素、原子质量、平均原子质量、分子量、式量等基本概念。 2.了解电子等微观粒子运动的特殊性;掌握波函数、电子云、原子轨道、电子层的概念,会看波函数与电子云图形,重点掌握描述电子运动状态的四个量子数的物理意义、取值规律和合理组合。 3.根据电子排布三原则和鲍林原子轨道近似能级图,掌握原子核外电子排布规律(特殊情况除外),能书写一般元素的原子核外电子排布式和价电子构型,并根据电子排布式判断元素在周期表中的位置及有关性质。 4.理解原子的电子层结构和元素周期表的关系,元素的若干性质(原子半径、电离能、电子亲合势、电负性)与原子的电子层结构的关系。 第二章分子结构 1.了解路易斯结构式。 2.熟悉键能、键长、键角和键的极性等键参数的概念,并能用键参数解释分子的稳定性、极性等性质。 3.掌握价键理论及杂化轨道理论,理解杂化对分子性质的影响,能用杂化轨道理论解释一般分子和离子的空间构型。 4.理解离域Π键形成的条件和特点,了解等电子体原理。 5.掌握分子轨道理论的基本要点,并能用分子轨道理论解释第一、二周期简单 的双原子分子的形成及稳定性,其中以O 2分子和N 2 分子的分子轨道能级图、 分子轨道表示式为重点。 6.掌握电子对互斥理论的基本论点,能用价层电子对互斥理论预测元素分子和离子的空间构型。 7.了解分子间力产生的原因和特点,理解分子间力对化合物性质的影响。8.理解氢键形成的条件和特点,掌握氢键对化合物性质的影响。
知识点主族元素碱金属和卤素
第一章第二节主族元素碱金属和卤素 (一)碱金属元素: 1.原子结构相似性:最外层电子数均为,均易电子,具有强性递变性:随着核电荷数的递增,电子层数逐渐,原子半径逐渐,失电子能力逐渐,还原性(元素金属性)逐渐。从Li到Cs的金属性逐渐增强。 2.碱金属化学性质的相似性: 4Li + O2 Li2O 2Na + O2 Na2O2 点燃点燃 2 Na + 2H2O =2NaOH + H2↑ 2K + 2H2O =2KOH + H2↑ 2R + 2 H2O = 2 ROH + H2 ↑ ★★结论:碱金属元素原子的最外层上都只有___个电子,都显___ 价. 它们的化学性质相似。都能与水和氧气反应 ★★结论:1)原子结构的递变性导致化学性质的递变性。 ★★★2)金属性强弱的判断依据:与水或酸反应越容易,金属性越强;最高价氧化物对应的水化物(氢氧化物)碱性越强, 碱性:LiOH <NaOH <KOH < RbOH < CsOH 3.碱金属物理性质的相似性和递变性: 1)相似性:银白色固体、硬度小、密度小(轻金属)、熔点低、易导热、导电、有展性。2)递变性(从锂到铯):①密度逐渐增大(K反常)②熔点、沸点逐渐降低 ★★小结:碱金属原子结构的相似性和递变性,导致了碱金属化学性质、物理性质的相似性和递变性。 (二)卤族元素: 1.原子结构相似性:最外层电子数均为,均易电子,具有强性递变性:随着核电荷数的递增,电子层数逐渐,原子半径逐渐,得电子能力逐渐,氧化性(元素非金属性)逐渐。还原性(元素金属性)逐渐从F到I的非金属性逐渐减弱。 2.卤素单质物理性质的递变性:(从F2到I2) (1)卤素单质的颜色逐渐加深;(2)密度逐渐增大;(3)单质的熔、沸点升高 3.卤素单质与氢气的反应:X2 + H2= 2 HX 卤素单质与H2的剧烈程度:依次减弱;生成的氢化物的稳定性:依次减弱生成的氢化物的稳定性:HF HCl HBr HI
298#《无机化学》作业1复习资料
298#《无机化学》作业1复习资料 一、选择题 1、在室温下,把20gNaCl溶解在100ml水中所得到的分散系是() A.乳状液B.悬浊液C.胶体溶液D.离子分散系 2、配合物〔CoCl2(en)2〕+配位数是() A.2 B.4 C.6 D.8 3、下列哪个是配合物() A.[Cu(NH3)4]SO4B.KAl(SO4)2?12H2O C.(NH4)2SO4D.CuSO4 4、相同温度下,下列溶液中渗透压最大的是:() A.0.2mol/L蔗糖(C12H22O11)溶液B.50g/L葡萄糖(M B=180)溶液 C.0.01mol/L CaCl2溶液D.0.01mol/L乳酸钠(C3H5O3Na)溶液 5、能使红细胞发生皱缩现象的溶液是:() A.1g/L NaCl溶液B.12.5g/L NaHCO3液 C.9g/L NaCl溶液D.1.0mol/L NaCl溶液 6、会使红细胞发生溶血现象的是:() A.9g/L氯化钠溶液B.50g/L葡萄糖溶液 C.100g/L葡萄糖溶液D.生理盐水和等体积水混合液 7、在0.1mol/L氨水中要使电离度和pH值都减小应加入的物质是: () A.NH4Cl B.NaOH C.H2O D.NH3 8、下列各组分子、离子中不是共轭酸碱对的是:() A.HCl—Cl-B.H2CO3—CO32-C.H2CO3—HCO3-D.NH4+--NH3 9、欲配制PH=3.5缓冲液,应选择的缓冲对是:() A.HCOOH(Pka=3.76)和HCOONa B.H3PO4(Pka=2.16)和NaH2PO4 C.H2C8H4O4和(Pka=2.95) KHC8H4O4D.HAc(Pka=4.75)和NaAc 10、缓冲溶液的缓冲能力大小用()来衡量。() A.缓冲比 B.缓冲范围C.总浓度 D.缓冲容量 11、下列配离子中,最稳定的是:() A.[Cu(NH3)4]2+(K s=2.09×1013)B.[Cu(en)2]2+(K s=1.0×1020)C.[Gd(NH3)4]2+(K s=1.32×107)D.[Zn(NH3)4]2+(K s=2.88×108) 12、0.05mol/L HCN溶液中,若有0.01%的HCN电离,则HCN电离常数是: () A.5×10-8B.5×10-6 C.5×10-10 D.2.5×10-7 13、人体血液中平均每100ml中含19mgK+,则血液中K+(Mr=39)的浓度是:() A.0.49mol/L B.4.9mol/L C.4.9×10-3mol/L D.4.9×10-4mol/L 14、在H2CO3H++ HCO3-平衡体系中,若()可产生同离子效应 A.加入氢氧化钠 B.加入盐酸C.用水稀释D.升高温度 15、如果c(1/2H2SO4)= 0.48 mol?L-1,则c(H2SO4)等于。() A.0.12 mol?L-1 B.0.24mol?L-1C.0.48mol?L-1 D.0.96 mol?L-1 16、非电解质稀溶液的蒸气压下降、沸点升高、凝固点降低的数值取决于() A.溶液的体积B.溶液的质量浓度 C.溶液的温度D.溶液的质量摩尔浓度 17、对于零级反应,下列说法正确的是() A.活化能很低B.速率常数等于零 C.反应速率与反应物浓度无关D.反应物浓度不随时间变化 18、某一元弱酸的K a=1.0×10-7,0.1 mol·L-1该弱酸溶液的pH值为()
18年春高中化学第1章原子结构与元素周期律1.3.2预测同主族元素的性质课时训练鲁科版必修2
第2课时预测同主族元素的性质 课时训练7 预测同主族元素的性质 基础夯实 1.下列关于同主族元素的说法中错误的是( ) A.同主族元素原子序数递增,元素原子失电子能力逐渐增强 B.同主族元素原子序数递增,单质氧化性逐渐增强 C.同主族元素原子最外层电子数都相同 D.同主族元素的原子半径,随原子序数增大而逐渐增大 答案:B 2.已知钾在空气中燃烧生成KO2。自然界中仅存在极微量的金属钫(Fr),它的已知同位素都有放射性,它是碱金属元素中密度最大的元素。根据它在周期表中的位置预言其性质,其中不正确的是( ) A.在已知元素中(稀有气体除外),它具有最大的原子半径 B.在空气中燃烧时,生成氧化物Fr2O C.氧化物的水化物是极强的碱 D.单质的失电子能力比钠强 答案:B 解析:根据同主族和同周期元素性质递变规律可知,原子半径最大的元素位于周期表的左下角,即钫,A正确;碱金属元素从上到下,失电子能力逐渐增强,D正确;由于Na在氧气中燃烧生成Na2O2,K在氧气中燃烧生成KO2,据此可知,Fr在空气中燃烧应生成比Fr2O更复杂的氧化物,B错误。 3.我国在砷化镓太阳能电池研究方面处于国际领先地位。砷(As)和镓(Ga)都是第4周期元素,分别属于ⅤA和ⅢA族。下列说法中,不正确的是( ) A.原子半径:Ga>As>P B.热稳定性:NH3>PH3>AsH3 C.酸性:H3AsO4>H2SO4>H3PO4 D.Ga(OH)3可能是两性氢氧化物 答案:C 解析:元素的非金属性越强,其相应的最高价含氧酸的酸性越强,所以酸性:H2SO4>H3PO4>H3AsO4,故C项错误。 4.X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的得电子能力比Y强的是( ) A.X原子的电子层数比Y原子的电子层数多 B.与H2化合的能力X 主族元素与化合物 一、氢和稀有气体 (一)氢 氢在化学反应中有以下几种成键情况: 1、氢原子失去1s电子成为H+ 。但是除了气态的质子外,H+ 总是与其它的原子或分子相结合。 2、氢原子得到1个电子形成H-离子,主要存在于氢和IA、IIA中(除Be外)的金属所形成的离子型氢化物的晶体中。 3、氢原子与电负性极强的元素相结合的氢原子易与电负性极强的其它原子形成氢键,以及在缺电子化合物中存在的氢桥键。 (二)稀有气体 1、稀有气体的存在、性质和制备 (1)存在:稀有气体的价电子结构称为饱和电子层结构,不易形成化学键,以单质形式存在。 (2)物性:均为单原子分子,He是所有单质中沸点最低的气体。 (3)制备:①空气的液化②稀有气体的分离 2、稀有气体化合物 O2 + PtF6 = O2+[PtF6]- 由于O2的第一电离能(1175.7 kJ·mol-1)和氙的第一电离能(1171.5 kJ·mol-1)非常接近。 Xe + PtF6 = Xe +[PtF6]- (1)氟化物 (a)强氧化性:氧化能力按XeF2、XeF4、XeF6递增。 一般情况被还原为单质。 NaBrO3 + XeF2 + H2O → NaBrO4 + 2HF + Xe XeF2 + H2 → 2HF + Xe XeF2 + 2Cl- → 2F- + Xe + Cl2 XeF4 + Pt → 2PtF4 + Xe (b)与水反应:氙氟化物与水反应活性不同 2XeF2 + 2H2O = 2Xe + 4HF + O2 (在碱中迅速反应) 6XeF4 + 12H2O = 2XeO3 + 4Xe + 3O2 + 24HF XeF6 + 3H2O = XeO3 + 6HF XeF6 + H2O = XeOF4 + 2HF(不完全水解) (2)氧化物 氙的氧化物是无色、易潮解、易爆炸的晶状固体。由氟化物水解制备。 XeO3:是一种易潮解和易爆炸的化合物,具有强氧化性。 XeO4:很不稳定,具有爆炸性的气态化合物。 (3)稀有气体化合物的构型 分子价电子对数价电子对构型可能构型最稳定构型 Xe F2 5 三角双锥三种直线型 主族元素部分 卤素 一、通性卤素位于周期表第七主族, 价层电子构型ns 2np 5,包括F 、Cl 、Br 、I 、At 五种元素 (一)卤素原子的 物理性质 1. 从上到下,原子半径、离子半径增大2. 易得电子形成阴离子1/2X 2+e -→X- 3. 第一电离能从 F →I 依次减小 4. 电负 性从F →I 减小 5.Φθ (X 2/X-)值从F →I 逐渐减小6. 氧化值: F (-1,0) Cl ,Br ,I (-1,0,+1,+3,+5,+7) (二)卤素的存在 卤素以X-负一价离子的形式存在于矿石和海水中 F: 存在于萤石CaF 2、冰晶石Na 3AlF 6、氟磷灰石Ca 5F(PO 4)3 Cl: 主要存在于海水、盐湖、盐井,盐床中,主要有钾石盐KCl 、光卤石KCl ·MgCl 2.6H 2O Br: 主要存在于海水中 I: 主要被海藻所吸收 At: 放射性元素,人工合成 X 2+H 2=2HX (反应条件) 发生氧化反应而放出氧气 2X 2+2H 2O=4H ++4X -+O 2↑ F 2,Cl 2,Br 2能与水发生氧化反应,而I 2不能发生此反应 能发生:4I -+O 2+4H +=2I 2+2H 2O 卤素元素符号 F Cl Br I 价电子构型 2s 22p 5 3s 23p 5 4s 24p 5 5s 25p 5 常见氧化态 -I -I,0,I,III,V ,VII -I,0,I,III,V ,VII -I,0,I,III,V ,VII 共价半径/pm 64 99 114.2 133.3 电负性 3.98 3.16 2.96 2.66 电离能/ (kJ/mol ) 1681 1251 1140 1008 第2课时预测同主族元素的性质 1.以ⅠA族、ⅦA族元素为例,掌握同主族元素性质的递变规律。(重点) 2.能运用原子结构理论初步解释同主族元素性质的递变规律。 3.掌握由同主族元素的性质特点预测不熟悉元素的性质。(难点) 4.了解元素周期表的应用。 同主族元素的性质 [基础·初探] 1.卤族元素原子结构和性质的相似性和递变性 (1)相似性 最高化合价均为+7 0 均为-最低化合价 1 气态氢化物HBr HI HF HCl 最高价氧化物HClO(强酸) HBrO无(强酸) HIO(强酸) 444的水化物(2)单质的物理性质及递变性 单CB物理性 紫黄深浅黄绿颜棕气气状液固 逐渐增密 逐渐升熔、沸 结构及化学性质的递变性(3) 规律结构及性质I FCl Br ――→原子半径原子半径逐渐增大页 1 第 I ClBrF2222→――单质的氧化性氧化性逐渐减弱----IFBr Cl 阴离子的还原性―→―还原性逐渐增强I ClF Br2222→――H化合的难易程度与2化合越来越难H与2HIHF HCl HBr ――→氢化物的稳定性稳定性逐渐减弱HIOHBrO HClO444→――最高价氧化物对应水化物的酸性酸性逐渐减弱 2.碱金属元素原子结构和性质的相似性与递变性(1)相似性1个电子。①原子的最外电子层都有价。1②最高化合价均为+③都是活泼的金属元素,单质都能与氧气、水等物质发生反应。④最高价氧化物对应的水化物一般具有很强的碱性。递变性(2) 规结构及性 CRNL原子半原子半径增CRLN单质的还原单质还原性增CRLN与水、氧气应的剧烈程反应越来越剧CsONaOKORbOLiO最高价氧化物应水化物的碱碱性逐渐增强3.同主族元素性质的递变规律页 2 第 [探究·升华] [思考探究] 1.Li、Na、K在空气中燃烧分别生成LiO、NaO、KO(超氧化钾)说明什2222么问题?如何保存钾单质? 【提示】说明Li、Na、K活动性依次增强;保存钾时应保存在煤油中,以避免与空气中的O、HO反应。222.利用原子结构如何解释F、Cl、Br、I得失电子能力的变化? 【提示】F、Cl、Br、I最外层都有7个电子,都易得一个电子达到稳定结构,但原子半径依次增大,得电子能力逐渐减弱。 [认知升华] 元素周期表中元素性质的变化规律 [题组·冲关] 题组1卤素性质变化规律 1.下列关于ⅦA族元素的说法中不符合递变规律的是() A.F、Cl、Br、I的氧化性逐渐减弱2222----的还原性逐渐增强Br.FI、Cl、、BC.HF、HCl、HBr、HI的热稳定性逐渐减弱 D.HF、HCl、HBr、HI水溶液的酸性逐渐减弱 【解析】从F到I原子半径逐渐增大,单质的氧化性逐渐减弱,则其对应阴离子的还原性逐渐增强,故A、B两项均正确;从F到I,其气态氢化物的热稳定性逐渐减弱,C项正确;F半径较小,与H结合稳定,HF在水中难以电离-出H, 化学专业英语之副族元素 GROUPS IB AND IIB ELEMENTS Physical properties of Group IB and IIB These elements have a greater bulk use as metals than in compounds, and their physical properties vary widely. Gold is the most malleable and ductile of the metals. It can be hammered into sheets of 0.00001 inch in thickness; one gram of the metal can be drawn into a wire 1.8 mi in length1. Copper and silver are also metals that are mechanically easy to work. Zinc is a little brittle at ordinary temperatures, but may be rolled into sheets at between 120° to 150℃; it becomes brittle again about 200℃-The low-melting temperatures of zinc contribute to the preparation of zinc-coated iron .galvanized iron; clean iron sheet may be dipped into vats of liquid zinc in its preparation. A different procedure is to sprinkle or air blast zinc dust onto hot iron sheeting for a zinc melt and then coating. Cadmium has specific uses because of its low-melting temperature in a number of alloys. Cadmium rods are used in nuclear reactors because the metal is a good neutron absorber. Mercury vapor and its salts are poisonous, though the free metal may be taken internally under certain conditions. Because of its relatively low boiling point and hence volatile nature, free mercury should never be allowed to stand in an open container in the laboratory. Evidence shows that inhalation of its vapors is injurious. The metal alloys readily with most of the metals (except iron and platinum) to form amalgams, the name given to any alloy of mercury. Copper sulfate, or blue vitriol (CuSO4? 5H2O) is the most important and widely used salt of copper. On heating, the salt slowly loses water to form first the trihydrate (CuSO4? 3H z O), then the monohydrate (CuSO4? H2O), and finally the white主族元素与化合物
元素化学主族部分
2019版第1章第3节第2课时预测同主族元素的性质语文
化学专业英语之第一和第二副族元素
