2021基础有机化学考研化学药学类考研典型题解析题库

2021基础有机化学考研化学药学类考研典型题解析
题库
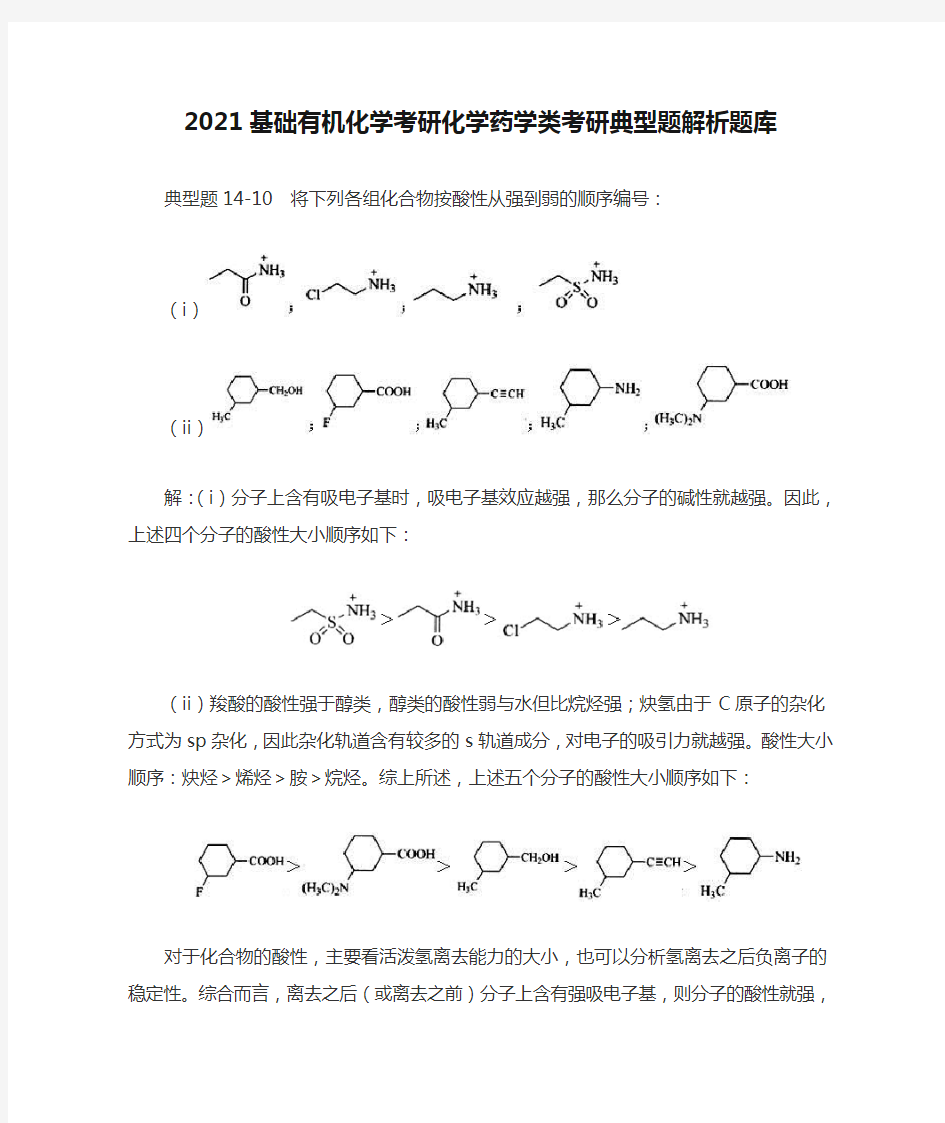
典型题14-10 将下列各组化合物按酸性从强到弱的顺序编号:
(i)
(ii)
解:(i)分子上含有吸电子基时,吸电子基效应越强,那么分子的碱性就越强。因此,上述四个分子的酸性大小顺序如下:
(ii)羧酸的酸性强于醇类,醇类的酸性弱与水但比烷烃强;炔氢由于C原子的杂化方式为sp杂化,因此杂化轨道含有较多的s轨道成分,对电子的吸引力就越强。酸性大小顺序:炔烃>烯烃>胺>烷烃。综上所述,上述五个分子的酸性大小顺序如下:
对于化合物的酸性,主要看活泼氢离去能力的大小,也可以分析氢离去之后负离子的稳定性。综合而言,离去之后(或离去之前)分子上含有强吸电子基,则分子的酸性就强,而具有给电子基团时,一般负离子就不稳定,原化合物的酸性就很弱。
典型题14-11 为什么胺的碱性要强于醇或醚?
解:O原子的电负性比N原子的电负性大,因此形成羟基时,对共用电子对具有更大的吸引力,最终引起氨基上N原子的一个孤对电子与质子具有更强的结合能力。根据酸碱理论,胺的碱性就比醇的碱性强。
典型题14-12 解释以下事实:
(i)吗啉盐酸盐的酸性比六氢吡啶的盐酸盐酸性强;
(ii)3-溴-1-氮杂二环[2.2.2]辛烷共轭酸的酸性比3-氯-1-氮杂二环[2.2.2]辛烷共轭酸的酸性弱;
(iii)氮丙烷与H+反应后形成的正离子的pK a小于六氢吡啶正离子的pK a。解:一般而言,共轭酸的酸性强弱和该化合物共轭碱的碱性强弱恰好相反。共轭酸的酸性越强,那么其共轭碱的碱性就越弱;共轭酸的酸性越弱,那么其共轭碱的碱性就越强。
(i)吗啉的结构式为:
O原子取代亚甲基,O本身具有一定的吸电子效应,因此吗啉的碱性比六氢吡啶的碱性要弱,因而其共轭酸的酸性比六氢吡啶的共轭酸酸性强。
(ii)氯的电负性强于溴,因而最终3-氯-1-氮杂二环[2.2.2]辛烷的碱性弱于3-溴-1-氮杂二环[2.2.2]辛烷,而其共轭酸的酸性便要强。
(iii)氮丙啶为三元环结构,其中N—C具有更多的p轨道成分,氮原子上的孤对电子具有更多的s轨道成分,因此氮丙啶的碱性比六氢吡啶弱,其共轭酸的pK a比六氢吡啶要小。
典型题14-13 在学习过程中你会发现四级铵盐相对比较稳定,而稳定的氧鎓盐炔相对较少。你能通过网络检索列举一些稳定的氧鎓盐吗?尝试总结一下这些稳定的氧鎓盐的结构特点。
解:稳定的氧鎓盐有如下几类。
(i)吡喃盐类化合物。该类化合物具有很好的芳香性,也具有稳定的平面结构,是一种很稳定的氧鎓盐。结构式如下:
(ii)四氟硼酸三乙基盐。该类化合物具有稳定的氧正离子角锥形结构,氧正离子与多个给电子基团相连,是常用的烷基化试剂。结构式如下:
(iii)氧杂三环癸烷。该类化合物具有碗形结构,氧杂三环癸烷可以在水中稳定存在。
结构式如下:
典型题14-14 用环己醇、不超过四个碳的有机物和适当的无机试剂为原料合成下列化合物:
(i);
(ii);(iii);
(iv)
解:(i)合成路线如下:
(ii)合成路线如下:
(iii)合成路线如下:
(iv)合成路线如下:
典型题14-15 以相应的卤代烷为原料,用直接烷基化的方法合成一下化合物:(i)1-己胺;
(ii)三甲基正丙基碘化铵;
(iii)六氢吡啶。
解:由于氨或胺的氮原子上的孤对电子具有较强的亲核能力,因此容易与卤代烷发生S N2取代反应。因此,上述目标化合物的合成路线可分别如下:
(i)
(ii)
(iii)
典型题14-16 利用NaN3和Gabriel合成法合成下列胺:
(i)1-戊胺;
(ii)环己胺;
(iii)甘氨酸;
(iv)3-乙基己胺。
解:制备一级胺最好的方法之一就是利用叠氮化合物代替氨:叠氮离子N3-是一个亲核基团,在S N2反应中它的亲核能力强于氨,因此可以与一级和二级卤
代烷反应生成烷基取代的叠氮化合物,接着还原一级胺。还原方法包括:催化氢化、氢化铝锂及三苯基膦还原。其次,最常见的方法就是Gabriel法。上述化合物的合成路线为:
(i)
(ii)
(iii)
(iv)
典型题14-17 画出在三苯基膦的作用下,正丁基叠氮转化为正丁胺的反应机理。
解:反应机理如下:
典型题14-18 多巴胺属于神经递质的脑内分泌物,可帮助细胞传送脉冲,具有传递快乐、兴奋情绪的功能,又被称为快乐物质,因此在医学上被用来治疗抑郁症。此外,吸烟和吸毒可增加多巴胺的分泌,使吸食者感到兴奋。多巴胺的化学名称为4-(2-乙氨基)苯-1,2-二酚。画出其结构式,并设计两条以邻苯二酚为原料合成多巴胺的路线。
解:多巴胺的结构式如下:
合成路线有两种,分别为:
①由醛制备胺:
②在苯环上引入甲酰基,再用叠氮化合物重排:
典型题14-19 以不超过五个碳的有机物及其他必要试剂通过还原胺化反应合成:
(i);
(ii);
(iii)。
解:胺或氨可以与醛或者酮发生亲核加成反应,生成亚胺。亚胺中的碳氮双键类似于醛、酮中的碳氧双键,可在催化氢化或氢化试剂作用下被还原成相应的一级、二级或三级胺。一般合成方法为:从氨到一级胺;从一级胺到二级胺;从二级胺到三级胺。因此,上述化合物的合成路线为:
(i)
(ii)
(iii)
典型题14-20 利用还原胺化反应合成下列化合物:
(i)以六氢吡啶为原料合成N-环戊基六氢吡啶
(ii)以四氢吡咯为原料合成N-乙基四氢吡咯
(iii)以环己酮为原料合成环己胺
(iv)以环戊醇为原料合成环戊胺
解:在一级胺的合成方法中,利用甲酸铵代替氨或还原试剂将醛或酮在高温下转化为胺的反应称为Leuckart-Wallach反应。在此过程中,甲酸根负离子作为还
原剂提供一个氢负离子将亚胺还原成胺。根据此特征反应,上述四个反应的产物分别为:
(i);
(ii);
(iii);
(iv)。
典型题14-21 完成下列反应式。
(i)
(ii)
(iii)
解:(i)酮和胺优先发生亲核加成反应,生成碳氮双键;在NaBH(OAc)3可被还原成脂肪胺。因此产物如下:
(ii)氰基可被加氢还原剂直接还原成饱和脂肪胺。因此产物如下:
(iii)酮和胺优先发生亲核加成反应,生成碳氮双键;在NaBH3CN可被还原成脂肪胺。因此产物如下:
典型题14-22 结合第18章知识,以苯胺为原料合成对氨基苯磺酰胺。
解:以苯胺合成对氨基苯磺酰胺,最重要的一步就是需要先将苯环磺化,然后再与氨反应。但是必须注意在磺化之前需要保护苯环上已有的氨基。因此基本合成路线为:
典型题14-23 完成下列反应式。
(i)
(ii)
(iii)
解:酰氯、磺酰氯均可以在碱性条件下与胺反应,最终生成酰胺和磺酰胺。一级胺与磺酰氯反应生成磺酰胺后,N原子上还有一个氢,由于受到磺酰基的影响,
N上的氢原子具有弱酸性,可以和碱发生反应转化为盐类,进而与碘代烷反应,水解后生成二级磺酰胺。上述各反应产物依次如下:
(i)
(ii)
(iii)
典型题14-24 Sildenafil是磷酸二酯酶5(PDE5)的一种选择性抑制剂,并且是第一例具有治疗男性勃起功能障碍作用的药物。Pfizer公司以VIAFGRA为商标生产这种药物,在1998年通过美国食品和药品监督管理局(FDA)批准后的第一年,全球销售额就达到7.88亿美元。它就是一种磺酰胺类药物,其合成中的一步就是磺酰胺的构建。完成以下反应式:
解:酰氯、磺酰氯均可以在碱性条件下与胺反应,最终生成酰胺和磺酰胺。因此上述反应过程为:
典型题14-25 根据Hofmann消除反应的机理推测以下列底物为原料经彻底的甲基化、Ag2O处理后加热的主要产物:
(i)环己胺;
(ii)2,4-二甲基四氢吡咯;
(iii)N-乙基六氢吡啶;
(iv);
(v)。
解:Hofmann消除反应一般需要经历三个步骤:(1)氮原子的彻底的甲基化反应;(2)四级铵盐与湿的氧化银反应;(3)四级铵碱的醇溶液在减压条件下浓缩;然后在200℃的作用下热消除生成烯烃、水合三级胺。因此,根据Hofmann消除反应的机理,上述化合物经热消除后形成的产物可为:
(i);
(ii);
(iii);
(iv);
(v)。
典型题14-26 完成下列反应式。
(i)
;(ii);
(iii);
(iv);
(v)。
解:上述反应均属于Hofmann消除反应,Hofmann消除反应属于E2型的β-消除反应。在反应过程中,底物四级铵碱被碱夺取的氢原子必须在β位碳原子上。
反应的立体化学应符合反式消除。离去基团的三级胺和β氢原子必须处于反式共平面。因此上述反应过程产物分别如下:
(i)各步产物分别为:
(ii)产物有两个,分别为:、CH2=CHCH3
(iii)
(iv)产物有两个,分别为:、CH2=CHPh
(v)产物有两个,分别为:、
典型题14-27 完成下列反应式。
(i)
(ii)
(iii)
解:Hofmann消除和Zaitsev消除的情况正好相反。其原因是Hofmann消除受反应物的诱导效应制约,即碱进攻的β位碳原子上取代基较小,电子云的密度
较小,因而是酸性较强的氢原子。这个氢原子空阻也很小,易于被碱夺取生成Hofmann消除产物,最终形成双键碳上取代基较少的烯烃。因此上述反应产物分别如下:
(i)
(ii)
(iii)
典型题14-28 写出以下三级胺经双氧水处理并加热后的主要产物:
(i)N,N-二甲基环己胺
(ii)N,N-二乙基环己胺
(iii)N-乙基六氢吡啶
(iv)N,N-二甲基-1-甲基环己胺
解:上述三级胺经双氧水处理并加热后的主要产物分别如下:
(i)
(ii)
(iii)
(iv)
典型题14-29 完成下列反应式(注意产物的立体化学性质):
(i)
(ii)
(iii)
(iv)
解:三级胺在过氧化氢和加热的条件下发生Cope消除反应。三级胺与过氧化氢或过氧羧酸发生氧化反应得到中间物氧化胺,氧化胺加热之后,发生E2顺式消除,最终生成烯烃。
(i)
(ii)
(iii)
(iv)
典型题14-30 设计一个鉴别以下胺类化合物的实验方案:
己胺、六氢吡啶、N-甲基六氢吡啶。
解:六氢吡啶是一个二级胺,该化合物的结构简式如下:
因此,己胺、六氢吡啶、N-甲基六氢吡啶三个化合物分别是一级胺、二级胺和三级胺。鉴别一级胺、二级胺和三级胺最常用的方法就是Hinsberg反应。一级胺、二级胺和三级胺与磺酰氯的反应统称为Hinsberg反应,此反应经常在碱性条件下进行。由于三级胺上的N原子没有H可以离去,因此三级胺补语磺酰氯发生酰基化反应,二级胺只有一个H,生成的磺酰胺不能与碱反应。一级胺与磺酰氯反应之后,还可以在于碱反应生成盐。因此可有如下区分方案,通过观察不同的现象即可区分不同的化合物。
发生Hinsberg反应后三种不同化合物的现象:
①己胺反应后的磺酰胺可以溶于NaOH溶液中;
②六氢吡啶反应后的产物不能溶于NaOH溶液中;
③N-甲基六氢吡啶与磺酰氯不发生反应。
典型题14-31 完成下列反应:
(i)
(ii)
(iii)
(iv)
解:一级脂肪胺与亚硝酸反应液的产物为N-亚硝基胺,该产物不稳定,进而会互变异构转换成偶氮化合物,在酸性条件下会失水生成重氮盐;烷基重氮盐非常不稳定,会分解释放氮气,最后转变为烯烃。若碳原子上还有羟基,最终会发生烯醇式重排形成酮。上述化合物均服从此反应机理,因此产物分别为:
(i)
(ii)
(iii)
(iv)
中科院分析化学考研真题
分析化学 一选择题(每题2 分,共40 分) 1 使用分析天平进行称量过程中,加、减砝码或取、放物体时,应把天平梁托起,这是为了 A 称量快速 B 减少玛瑙刀口的磨损 C 防止天平盘的摆动 D 防止指针的跳动 2 若试样的分析结果精密度很好,但准确度不好,可能原因是 A 试样不均匀 B 使用试剂含有影响测定的杂质 C 有过失操作 D 使用的容量仪器经过了校正 3 有一组平行测定所得的分析数据,要判断其中是否有异常值,应该用 A F 检验法加t 检验法 B F 检验法 C t 检验法 D Q 检验法 4 共轭酸碱对的K a 和K b 的关系是 A K a=K b B K a K b=1 C K a K b= K W D K a/K b= K W 5 若测定污水中痕量三价铬与六价铬应选用下列哪种方法 A 原子发射光谱法 B 原子吸收光谱法 C 荧光光度法 D 化学发光法 6 金属离子M 与L 生成逐级配位化合物ML、ML2···MLn,下列关系式中正确的是 A [MLn]=[M][L]n B [MLn]=Kn[M][L] C [MLn]=βn[M]n[L] D [MLn]=βn[M] [L] n 7 指出下列叙述中错误的结论 A 酸效应使配合物的稳定性降低 B 水解效应使配合物的稳定性降低 C 配位效应使配合物的稳定性降低 D 各种副反应均使配合物的稳定性降低 8 下列四种萃取剂中对金属离子萃取效率最好的是 ANOH B CH3CH2OH C CH3CH2OCH2CH3 D CH3(CH2)3OH 9 循环伏安法主要用于 A 微量无机分析 B 定量分析 C 定性和定量分析 D 电极过程研究 10 在制备纳米粒子时,通常要加入表面活性剂进行保护,这主要是为了防止 A 颗粒聚集长大 B 均相成核作用 C 表面吸附杂质 D 生成晶体形态 11 在EDTA 配位滴定中,下列有关掩蔽剂的叙述错误的是 A 配位掩蔽剂必须可溶且无色 B 沉淀掩蔽剂生成的沉淀,其溶解度要很小 C 氧化还原掩蔽剂必须能改变干扰离子的氧化态 D 掩蔽剂的用量越多越好 12 气液色谱中,保留值实际上反映的是下列哪两者间的相互作用 A 组分和载气 B 载气和载体 C 组分和固定液 D 组分和载体 13 下列化合物中,不能发生麦氏重排的是 A B C D 14 下列化合物中,所有质子是磁等价,在NMR 光谱中只有一个吸收峰的结构是 A CH3CH2CH2Br B C CH2=CHCl D CH3OH 15 下列化合物中,同时有n→π*,π→π*,σ→σ*跃迁的化合物是 A 一氯甲烷 B 丙酮 C 1,3-丁二烯 D 甲醇 16 下列化合物中,νC=O 最大的是 A COR Cl B COR R' C COR OR' D COR 科目名称:分析化学第3 页共5 页 17 关于荧光效率,下面错误的叙述是 A 具有长共轭的π→π*跃迁的物质具有较大的荧光效率 B 分子的刚性和共平面性越大,荧光效率越大 C 顺式异构体的荧光效率大于反式异构体
分析化学考研试卷及答案
一、选择题 原子吸收 4.空心阴极灯中对发射线宽度影响最大的因素:(C) (A)阴极材料 (B)填充气体 (C)灯电流 (D)阳极材料 2.下列有关原子发射光谱分析发的叙述不正确的是:(C) (A)要判断某元素是否存在,至少应有2-3条灵敏线出现 (B)光谱线的自吸现象对发射光谱定量分析影响很大 (C)分析线中必须包含着最后线 (D)谱线的灵敏度标记数字越大,说明谱线越灵敏 3.在原子吸收分析中,当溶液的提升速度较低时,一般在溶液中混入表面张力小、密度小的有机溶剂,其目的是:(B) (A)使火焰容易燃烧 (B)提高雾化效率 (C)增加溶液黏度 (D)增加溶液提升量 分离与富集 1.在约6mol/LHCl介质中,用乙醚萃取10.0mgFe3+,已知分配比为99,经二次等体积萃取后,分出有机相,又用等体积6mol/LHCl洗一次,Fe3+将损失(D) A.0.001mg B0.01mg C.0.09mg D0.1mg 配位滴定法 1.已知EDTA的pKa1~pKa6分别为0.9 , 1.6 , 2.0, 2.67 , 6.16, 10.26 .在pH=13.0时,含有c mol/LEDTA溶液中,下列叙述中正确的是(B) A.[HY]=[Y] B. c(Y) =[Y] C.[H2Y]=[Y] D.[H2Y]=[HY] 2.已知EDTA的各级离解常数分别为10-0.9,10-1.6, 10-2.0, 10-2.67, 10-6.16, 10-10.26,在pH=2.67-6.16的溶液中,EDTA最主要的存在形式是(B) A.H3Y- B.H2Y2- C.HY3- D Y4- 3.用指示剂(In),以EDTA(Y)滴定金属离子M时常加入掩蔽剂(X)消除某干扰离子(N)的影响,不符合掩蔽剂加入条件的是(A) A.K NX < K NY B.K NX >> K NY C.K MX << K MY D.K MIn> K MX 4.对于EDTA(Y)配位滴定中的金属指示剂(In),要求它与被测金属离子(M)形成的配合物的条件稳定常数(B) A.> K`MY B. < K`MY C.≈ K`MY D. ≥ 108.0 5.用EDTA滴定含NH3的Cu2+溶液,则下列有关pCu突跃范围大小的叙述,错误的是(BD) A.Cu2+的浓度越大,pCu突跃范围越大。 B.NH3的浓度越大,pCu突跃范围越大。 C.适当地增大酸度,则pCu突跃范围变大。 D.酸度越大,[NH3]愈小,则pCu突跃范围变大。
中科院分析化学考研真题
分析化学一选择题(每题2 分,共40 分) 1 使用分析天平进行称量过程中,加、减砝码或取、放物体时,应把天平梁托起,这是为了 A 称量快速 B 减少玛瑙刀口的磨损 C 防止天平盘的摆动 D 防止指针的跳动 2 若试样的分析结果精密度很好,但准确度不好,可能原因是 A 试样不均匀 B 使用试剂含有影响测定的杂质 C 有过失操作 D 使用的容量仪器经过了校正 3 有一组平行测定所得的分析数据,要判断其中是否有异常值,应该用 A F 检验法加t 检验法 B F 检验法 C t 检验法 D Q 检验法 4 共轭酸碱对的K a 和K b 的关系是 A K a=K b B K a K b=1 C K a K b= K W D K a/K b= K W 5 若测定污水中痕量三价铬与六价铬应选用下列哪种方法 A 原子发射光谱法 B 原子吸收光谱法 C 荧光光度法 D 化学发光法 6 金属离子M 与L 生成逐级配位化合物ML、ML2···MLn,下列关系式中正确的是 A [MLn]=[M][L]n B [MLn]=Kn[M][L] C [MLn]=βn[M]n[L] D [MLn]=βn[M] [L] n 7 指出下列叙述中错误的结论 A 酸效应使配合物的稳定性降低 B 水解效应使配合物的稳定性降低 C 配位效应使配合物的稳定性降低 D 各种副反应均使配合物的稳定性降低 8 下列四种萃取剂中对金属离子萃取效率最好的是 ANOH B CH3CH2OH C CH3CH2OCH2CH3 D CH3(CH2)3OH 9 循环伏安法主要用于 A 微量无机分析 B 定量分析 C 定性和定量分析 D 电极过程研究 10 在制备纳米粒子时,通常要加入表面活性剂进行保护,这主要是为了防止 A 颗粒聚集长大 B 均相成核作用 C 表面吸附杂质 D 生成晶体形态 11 在EDTA 配位滴定中,下列有关掩蔽剂的叙述错误的是 A 配位掩蔽剂必须可溶且无色 B 沉淀掩蔽剂生成的沉淀,其溶解度要很小 C 氧化还原掩蔽剂必须能改变干扰离子的氧化态 D 掩蔽剂的用量越多越好 12 气液色谱中,保留值实际上反映的是下列哪两者间的相互作用 A 组分和载气 B 载气和载体 C 组分和固定液 D 组分和载体 13 下列化合物中,不能发生麦氏重排的是 A B C D 14 下列化合物中,所有质子是磁等价,在NMR 光谱中只有一个吸收峰的结构是 A CH3CH2CH2Br B C CH2=CHCl D CH3OH 15 下列化合物中,同时有n→π*,π→π*,σ→σ*跃迁的化合物是 A 一氯甲烷 B 丙酮 C 1,3-丁二烯 D 甲醇 16 下列化合物中,νC=O 最大的是 A COR Cl B COR R' C COR OR' D COR 科目名称:分析化学第3 页共5 页 17 关于荧光效率,下面错误的叙述是 A 具有长共轭的π→π*跃迁的物质具有较大的荧光效率 B 分子的刚性和共平面性越大,荧光效率越大
考研,分析化学考研复习题
分析化学考研习题训练 第一套 一、选择题 1.以下属于偶然误差的特点的是[ ] (A)误差的大小是可以测定和消除的; (B)它对分析结果影响比较恒定; (C)在同一条件下重复测定,正负误差出现的机率相等,具有抵消性; (D)通过多次测定,误差的值始终为正或为负。 2.下列叙述中不正确的是[ ] (A)误差是以真值为标准,偏差是以平均值为标准。实际工作中获得的所谓“误差”,实质上是偏差。 (B)对某项测定来说,它的系统误差大小是可以测定的。 (C)对偶然误差来说,大小相近的正误差和负误差出现的机会是相等的。 (D)某测定的精密度愈好,其准确度愈高。 3.下列情况将导致分析结果精密度下降的是[ ] (A)试剂中含有待测成分;(B)使用了未校正过的容量仪器; (C)滴定管最后一位读数不确定;(D)操作过程中溶液严重溅出 4.计算式 000 .1 ) 80 . 23 00 . 25 ( 1010 .0- ? = x的计算结果(x)应取几位有效数字[ ] A:二位;B:三位;C:四位D:五位 5.测定试样中CaO的百分含量,称取试样0.908g,滴定耗去EDTA标准溶液20.50mL,以下结果表示正确的是[ ] A:10%;B:10.1%;C:10.08%;D:10.077% 二、填空题 1.系统误差包括误差、误差和误差。系统误差的特点是;偶然误差的特点是。在定量分析过程中,影响测定结果准确度的是误差,影响测定结果精密度的是误差。偶然误差可以通过途径消除,而对于系统误差,则针对其来源,可采用不同的方法消除。如对于方法误差,可以采用校正等途径消除,对于试剂误差,可以采用方法消除。 2、下列情况会对分析结果产生什么影响(填使结果混乱、无影响、负误差、正误差)
分析化学考研问答题及答案电子教案
分析化学考研问答题 及答案
三、大题 原子吸收 1.原子吸收光谱分析的光源应当符合哪些条件?为什么空心阴极灯能发射半宽度很窄的谱线? 原子吸收光谱分析的光源应当符合以下基本条件: ⑴谱线宽度“窄”(锐性),有利于提高灵敏度和工作曲线的直线性。 ⑵谱线强度大、背景小,有利于提高信噪比,改善检出限。 ⑶稳定,有利于提高测量精密度。⑷灯的寿命长。空心阴极灯能发射半宽度很窄的谱线,这与灯本身的构造和灯的工作参数有关系。从构造上说,它是低压的,故压力变宽小。从工作条件方面,它的灯电流较低,故阴极强度和原子溅射也低,故热变宽和自吸变宽小。正是由于灯的压力变宽、热变宽和自吸变宽较小,致使等发射的谱线半宽度很窄。 2.简述背景吸收的产生及消除背景吸收的方法。 背景吸收是由分子吸收和光散射引起的。分子吸收指在原子化的过程中生成的气体分子、氧化物、氢氧化物和盐类等分子对辐射线的吸收。在原子吸收分析中常碰到的分子吸收有:碱金属卤化物在紫外区的强分子吸收;无机酸分子吸收;火焰气体或石墨炉保护气体(Ar)的分子吸收。分子吸收与共存元素的浓度、火焰温度和分析线(短波和长波)有关。光散射是指在原子化过程中固体微粒或液滴对空心阴极灯发出的光起散射作用,使吸光度增加。 消除背景吸收的办法有:改用火焰(高温火焰);采用长波分析线;分离或转化共存物;扣除方法(用测量背景吸收的非吸收线扣除背景,用其他元素的吸收线扣除背景,用氘灯背景校正和塞曼效应背景校正法)等。
3.在原子吸收分析中,为什么火焰法(火焰原子化器)的绝对灵敏度比非火焰法(石墨原子化器)低? 火焰法是采用雾化进样。因此: ⑴试液的利用率低,大部分试液流失,只有小部分(约X%)喷雾液进入火焰参与原子化。 ⑵稀释倍数高,进入火焰的喷雾液被大量气体稀释,降低原子化浓度。 ⑶被测原子在原子化器中(火焰)停留时间短,不利于吸收。 4.什么是原子吸收光谱分析中的化学干扰?用哪些方法可消除此类干扰? 待测元素与共存元素发生化学反应,引起原子化效率的改变所造成的影响统称为化学干扰,影响化学干扰的因素很多,除与待测元素及共存元素的性质有关外,还与喷雾器、燃烧器、火焰类型、温度以及火焰部位有关。 为抑制化学干扰,可加入各种抑制剂,如释放剂、保护剂、缓冲剂等,或采用萃取等化学分离分离方法来消除干扰。 分离与富集 1.重要的萃取分离体系(根据萃取反应的类型)。 螯合物萃取体系, 离子缔合物萃取体系, 溶剂化合物萃取体系, 简单分子萃取体系 配位滴定法 1.根据EDTA的酸效应曲线(即Ringbom曲线),可获得哪些主要信息?
分析化学考研填空题及参考答案教学内容
二、填空题 原子吸收 1.空心阴极灯是一种(锐性)光源,它的发射光谱具有(谱线窄、强度大)特点。当灯电流升高时,由于(自吸变宽、热变宽)的影响,导致谱线轮廓(变宽),测量灵敏度(下降),工作曲线(线性关系变差),灯寿命(变短)。 2.在原子吸收分析中,干扰效应大致上有(光谱干扰),(化学干扰),(电离干扰),(物理干扰),(背景吸收干扰)。 3.试样在原子化过程中,除离解反应外,可能还伴随着其他一系列反应,在这些反应中较为重要的是(电离),(化合),(还原)反应。 4.在原子吸收光谱中,当吸收为1%时,其吸光度(A)为(0.0044)。 5.原子吸收光谱分析方法中,目前在定量方面应用比较广泛的主要方法有(标准曲线法 ),(标准加入法)。 6.原子吸收法测定NaCl中微量K时,用纯KCl配置标准系列制作工作曲线,经过多次测量结果(偏高)。其原因是(电离干扰),改正办法是(排除电离干扰,加入NaCl使标样与试样组成一致)。 分离与富集 1.用CCl4从含有KI的水溶液中萃取I2,其分配比D可表示为。(设在两相中的分配系数为K D,I2可形成I3-,其形成常数为K I3-,)在条件下,D=K D。2.已知I2在CS2和水中的分配比为420,今有100mLI2溶液,欲使萃取率达99.5%,每次用5mLCS2萃取,则萃取率的计算公式为,需萃取2次。3.某溶液含Fe3+ 10mg,用等体积的有机溶剂萃取一次后,该溶液中剩余0.1mg, 则Fe3+在水、油两相中的分配比= 99 。 4.用氯仿萃取某50ml水溶液中的OsO4,欲使其回收率达99.8%,试问(1)每次用5ml氯仿萃取,需萃取6 次?(2)每次用10ml萃取,需萃取4 次?已知:分配比D=19.1. 5.用苯萃取等体积的乙酰丙酮的水溶液,萃取率为84%,则乙酰丙酮在苯与水两相中的分配比是 5.25 ?若使乙酰丙酮的萃取率达97%以上,至少用等体积的苯萃取 2 次?6.含CaCl2和HCl的水溶液,移取20.00ml,用0.1000mol/L的NaOH溶液滴定至终点,用去15.60ml,另移取10.00ml试液稀释至50.00ml,通过强碱性阴离子交换树脂,流出液用0.1000mol/L的HCl滴至终点,用去22.50ml。则试液中HCl的浓度为0.7800 mol/L ,CaCl2的浓度为0.1125 mol/ L. 7.痕量Au3+的溶液在盐酸介质中能被阴离子交换树脂交换而得到富集,这时Au3+是以AuCl4- 形式被交换到树脂上去的。 8.将Fe3+和Al3+的HCl溶液通过阴离子交换树脂,其中Fe3+ 以FeCl 4-形式被保留在柱上,可在流出液中测定 A l3+ 。 配位滴定法 1.EDTA在水溶液中有七种存在形式,其中Y 4-能与金属离子形成配合物。 2.用EDTA配位滴定法测定珍珠粉中的钙含量时,宜采用的滴定方式是直接滴定。3.在氨性缓冲溶液中,用EDTA滴定易与NH3配位的Ni2+、Zn2+等金属离子时,其滴定曲线受金属离子的浓度和氨的辅助配位效应的影响。 4.为了测定Zn2+与EDTA混合溶液中Zn的含量(已知EDTA过量),移取等体积试液两份,其中一份调节pH为大于4.0 ,以Zn标准溶液为滴定剂,以EBT为指示剂,滴定其中游离的EDTA量;另一份试液调节pH 为 1 ,以二甲酚橙为指示剂,用Bi 3+ 标准溶液滴定其中的EDTA总量。 5.某含EDTA、Cd2+和Ca2+的NH3-NH4Cl缓冲溶液中,lgαY(H)=0.45, lgαY(Ca)=4.40, lgαCd(NH3)=3.40,
大连理工大学2006分析化学A试卷
姓名:__________大连理工大学 学号:__________ 课程名称:分析化学试卷: A 闭卷 院系:__________授课院(系):___化院___ 考试日期:2006 年 7 月 6 日试卷共 7 页 _____ 级_____ 班 一、判断题(每题1分,共15分) 1.在分析数据中,小数点后的所有的“0”均为有效数字。() 2.精密度是指在相同条件下,多次测定值间相互接近的程度。() 3.对于多元酸,只要有合适的指示剂,每个质子都可分别滴定。() 4.滴定分析中指示剂选择不当将产生偶然误差。() 5.酸碱滴定中滴定曲线突跃范围的大小取决于指示剂和标准溶液的pKa,与被滴定物的浓度和pKa性质无关。() 6.酸效应系数的数值越大,表示酸效应引起的副反应越严重。() 7.如果配位滴定的终点误差ΔpM为0.2~0.5,允许终点误差TE 为0.1%,则金属离子能 被直接滴定的条件为:cK’MY≥106或lg cK’MY≥6。() 8.碘量法中的主要误差来源是由于硫代硫酸钠标准溶液不稳定,容易与空气和水中的氧 反应,使滴定结果偏高。() 9.在色谱分析中,如果在某种固定液中两待测组分的分配系数相同,要想使其获得分离, 理论上讲需要无穷长的分离柱。() 10.氟离子选择性电极测定溶液中F- 时,如果溶液的pH值较低,测定结果将偏低。 () 11.某化合物在最大吸收波长处的摩尔吸光系数为104L?mol-1?cm-1,现在其他波长处进行测定,其灵敏度一定低。() 12.1802年人们已发现原子吸收现象,但在1955年以前原子吸收光谱分析法一直没有建立,这是由于人们一直无法提高分光光度计单色器的分辨率。() 13.紫外吸收光谱与红外吸收光谱两者都属于电子光谱,差别是两者使用的波长范围有 不同,紫外吸收光谱主要获得有关分子中共轭体系大小的信息,红外吸收光谱则获得基团 是否存在的信息。() 14.某化合物-CH2CX2-部分中质子的化学位移受X的电负性影响。如果X的电负性增 大,质子的化学位移将向高场移动。() 15.质谱图中出现了(M+2):M=1:1的峰,说明该化合物含有氯元素。()
分析化学考研选择题及答案
一、选择题 原子吸收 1.原子吸收分析中光源的作用是:(C) (A)提供试样蒸发和激发所需要的能量 (B)产生紫外光 (C)发射待测元素的特征谱线 (D)产生具有足够浓度的散射光 2.原子吸收分析法测定铷(Rb)时,加入1%钠盐溶液其作用是:(C) (A)减少背景 (B)提高火焰温度 (C)减少Rb电离 (D)提高Rb+的浓度 3.采用测量峰值吸收系数的方法来代替测量积分吸收系数的方法必须满足下列那些条件:(AC) (A)发射线轮廓小于吸收线轮廓 (B)发射线轮廓大于吸收线轮廓 (C)发射线的中心频率与吸收线中心频率重合 (D)发射线的中心频率小于吸收线中心频率 4.空心阴极灯中对发射线宽度影响最大的因素:(C) (A)阴极材料 (B)填充气体 (C)灯电流 (D)阳极材料 5.原子吸收分析中,吸光度最佳的测量范围是:(A) (A)0.1-0.5 (B)0.01-0.05 (C)0.6-0.8 (D)>0.9 6.下列有关原子吸收法的叙述中错误的是:(AC) (A)在原子吸收测定中,做到较高准确度的前提是保证100%的原子化效率 (B)背景吸收是一种宽带吸收,其中包括分子吸收、火焰气体吸收和光散射引起的损失(C)分析难挥发元素采用贫燃火焰较好 (D)背景吸收在原子吸收光谱分析中会使吸光度增加,导致分析结果偏高 7.在原子吸收光谱分析中,加入消电离剂可以抑制电离干扰。一般来说,消电离剂的电离电位:(B) (A)比待测元素高 (B)比待测元素低 (C)与待测元素相近 (D)与待测元素相同 8.测定钾、钠、铁时,光谱通带应选:(A) (A)钾、钠选0.4nm,铁选0.1nm (B)钾、钠选0.1nm,铁选0.4nm (C)钾、钠、铁均选0.1nm (D)钾、钠、铁均选1.0nm
有机化学考研试题
一、名词解释,每个三分 五个中文,五个英文的,英文要先翻译再解释 光化学烟雾、POPs、富营养化、优先控制污染物。。。反正都是常规的 二、简答,每个5分,共六个 简述斯德哥尔摩公约 影响水体中沉积物产生的因素有哪些 水体絮凝有那些种 光化学烟雾反应机制 写出十种优先控制污染物 三、论述,每个20,两个 第一个是关于磷循环的 第二个忘了 四、实验设计 在一个有进水有出水的圆形池塘里设计采样点(不多于15个),污泥层和水层的界面如何采样等 2010生态环境研究中心环境化学试题(即中科院各院所) 名词解释(3分*10): 酸雨,水体富营养化, 毒物剂量-效应关系, 联合国气候变化框架公约, 环境持久性有毒污染物, 环境内分泌干扰物, 生物积累,温室气体, 生物修复(忘了一个)简答(10分*5) (1)毒物的联合作用 (2)水体中有机污染物的迁移转化 (3)土壤胶体的性质 (4)光化学烟雾的形成过程 (5)大气颗粒物按粒径大小分为哪几类 论述(15分*2) (1)DDT(有机氯农药)在土壤中的迁移转化 (2)沉积物中重金属的来源及结合类型 计算(10分*2) (1)计算水中CO2的浓度,H+的浓度(25摄氏度)(和课本上的例题一样) (2)计算A污染物质的生物浓缩系数及达到稳态95%时所需时间t(已知鱼体内吸收和消解A的速率常数)(这题型以前我没见过,所以也就没做出来,题目大概是这个意思) 实验设计(10分*2) (1)设计实验研究某区域土壤受持久性有机污染物的污染状况(提示:从采样、样品处理、分析样品、上报数据几方面进行论述)
(2)蜈蚣草能够富集某类重金属,所以可以用于受这类重金属污染的土壤的修复。 设计试验,验证蜈蚣草具有富集某类重金属的作用 11年中科院环境化学试题 1名词解释 Pts其他忘记,都很基础的 2简答 忘记(也较简单的) 3论述 大气中有哪些重要的自由基,并说明其来源。 有关重金属在土壤和植物体中的迁移转化。 4计算 第一个和书上一样的,在戴树桂编的环境化学第三章中(水环境化学)讲解二氧化碳与水体平衡,数字之类的好像都没变,我只列出了过程,没算出da-an,计算过程很麻烦,所以复习时最好把da-an都记住。 第二个是有关总碳的,书上的例题很简单,但考试的题目很变态,告诉我们的是阿尔法0和阿尔法1(书上是阿尔法1和阿尔法2)好像要根据他们算出阿尔法2, 5实验设计(3选2) 一、我国南方沿海城市(测空气的污染程度),在城市中城市北面城市南面共设置三个监测点, 问题1假如要在这几个点中选参照点,冬季应该选哪个夏季应选哪个(南还是北)本人认为此题应根据夏季是海风冬季是陆风来判断 问题2 题目给出一张图表,好像是要判断哪几种污染物,并说明为什么那个时段会出现波动,类似于第二章大气环境化学中光化学烟雾日变化曲线,本人认为答题原理差不多。 问题3 好像有好像没有忘记了 二、是有关大气布点的,此题我没做,所以完全没印象,其实从09年开始有水体中的布点,10年有土壤的布点,就会想到11年有大气的布点,因为环境化学就一直在说明这三个问题,只不过要回答这个问题要学习下《环境监测》中有关的知识。 三、在一个水平放置的管中的气体有的会分解成小分子物质,大颗粒的会沉降下来,有的会发生光化学反应,试设计一个实验将其中的气体分类。
分析化学考研问答题及答案
三、大题 原子吸收 1.原子吸收光谱分析的光源应当符合哪些条件?为什么空心阴极灯能发射半宽度很窄的谱线? 原子吸收光谱分析的光源应当符合以下基本条件: ⑴谱线宽度“窄”(锐性),有利于提高灵敏度和工作曲线的直线性。 ⑵谱线强度大、背景小,有利于提高信噪比,改善检出限。 ⑶稳定,有利于提高测量精密度。 ⑷灯的寿命长。 空心阴极灯能发射半宽度很窄的谱线,这与灯本身的构造和灯的工作参数有关系。从构造上说,它是低压的,故压力变宽小。从工作条件方面,它的灯电流较低,故阴极强度和原子溅射也低,故热变宽和自吸变宽小。正是由于灯的压力变宽、热变宽和自吸变宽较小,致使等发射的谱线半宽度很窄。 2.简述背景吸收的产生及消除背景吸收的方法。 背景吸收是由分子吸收和光散射引起的。分子吸收指在原子化的过程中生成的气体分子、氧化物、氢氧化物和盐类等分子对辐射线的吸收。在原子吸收分析中常碰到的分子吸收有:碱金属卤化物在紫外区的强分子吸收;无机酸分子吸收;火焰气体或石墨炉保护气体(Ar)的分子吸收。分子吸收与共存元素的浓度、火焰温度和分析线(短波和长波)有关。光散射是指在原子化过程中固体微粒或液滴对空心阴极灯发出的光起散射作用,使吸光度增加。 消除背景吸收的办法有:改用火焰(高温火焰);采用长波分析线;分离或转化共存物;扣除方法(用测量背景吸收的非吸收线扣除背景,用其他元素的吸收线扣除背景,用氘灯背景校正和塞曼效应背景校正法)等。 3.在原子吸收分析中,为什么火焰法(火焰原子化器)的绝对灵敏度比非火焰法(石墨原子化器)低? 火焰法是采用雾化进样。因此: ⑴试液的利用率低,大部分试液流失,只有小部分(约X%)喷雾液进入火焰参与原子化。 ⑵稀释倍数高,进入火焰的喷雾液被大量气体稀释,降低原子化浓度。 ⑶被测原子在原子化器中(火焰)停留时间短,不利于吸收。 4.什么是原子吸收光谱分析中的化学干扰?用哪些方法可消除此类干扰? 待测元素与共存元素发生化学反应,引起原子化效率的改变所造成的影响统称为化学干扰,影响化学干扰的因素很多,除与待测元素及共存元素的性质有关外,还与喷雾器、燃烧器、火焰类型、温度以及火焰部位有关。 为抑制化学干扰,可加入各种抑制剂,如释放剂、保护剂、缓冲剂等,或采用萃取等化学分离分离方法来消除干扰。 分离与富集 1.重要的萃取分离体系(根据萃取反应的类型)。 螯合物萃取体系, 离子缔合物萃取体系, 溶剂化合物萃取体系, 简单分子萃取体系 配位滴定法 1.根据EDTA的酸效应曲线(即Ringbom曲线),可获得哪些主要信息? (1)由于H+离子存在使EDTA参加主反应的能力降低的现象,称为EDTA的酸效应。 (2)单独滴定某种金属离子时允许的最低PH
云南大学有机化学考研真题
一、选择题(共10题,每题2分,共20分) 1. 下列碳正离子的稳定性顺序是.....................................….......…..[ ] (A) C>B>A>D (B) B>A>C>D (C) D>C>A>B 2. 下列化合物中,酸性最强的是 ...............…....…....[ ] A. B. C. D.CH 3CH 2COOH CH C COOH NC CH 2COOH H 2C CHCOOH (A) C>B> D> A (B) B>A>C>D (C) A>D>B>C 3. 下列化合物双键的构型是: ...................................………....…....[ ] CH 3Cl C=C H CH 3 (A)E 型, 反式 (B) Z 型, 反式 (C) Z 型, 顺式 (D) E 型, 顺式 4.下列化合物或离子中有芳性的是 ……. ...............…………...[ ] 5. 反-1-氯-3-溴环己烷的稳定构象式是……………………………….[ ] 6. 下列分子中没有手性的是 ................…………...[ ] 7. 下列化合物中,哪个在1H-NMR 中只有单峰? ......…………...[ ] A. B. C. D.C C CH 3H H H 3C C C H CH 3H H 3C C C H H Cl C C H H F 8. 下列化合物中手性碳原子的构型是 … .......…………...[ ] A.(C 6H 5)2CH (C 6H 5)3C B.C 6H 5CH 2 C.CH 3CHCH 2CH 3 D.
2005年山东青岛科技大学分析化学考研真题B卷
2005年山东青岛科技大学分析化学考研真题B卷 一、填空题(共38分,每空1分) 在分析化学中,有时用和表示不同情况下分析结果的精密度,精密度高准确度高。 已知NH4+是NH3的共轭酸,KbNH3 =1.80?10-5, 则反应 NH4+ + OH-= NH3 + H2O 的平衡常数为。 酸碱指示剂的实际变色范围一般与理论变色范围不一致,其原因是1),2) 。 在配合滴定中,越低,滴定曲线的起点,滴定突跃就,而配合物的越大,滴定突跃就。 用0.200 mol/L 的氢氧化钡溶液滴定0.100 mol/L 的醋酸溶液至化学计量点时,溶液的pH值为。(已知醋酸的 pka = 4.74) 莫尔法测定氯离子时,以为滴定剂,以为指示剂,控制指示剂的浓度为。 氧化还原滴定突跃大小,与其它滴定法不同,它只是与,有关,而与无关。 单色酸碱指示剂,当指示剂用量增加时,在较高的下变色,而增加离子强度时,指示剂的变小。 9. 毛细管色谱柱由于高,因此k很小,一般需采用进样法,这对痕量分析来说极为不利。 10. 在气相色谱法中,选哪种检测器最适宜? (1)农作物中含氯农药残留;(2)酒中水含量; (3)啤酒中微量硫化物;(4)分离苯和甲苯异构体。11. 用氟离子选择性电极测定水样中F-时,加入“总离子强度调节缓冲溶液”,其中NaCl和HAc-NaAc的作用分别是和。 12. 在加入支持电解质、极大抑制剂和除氧剂后,极谱分析中的极限电流是指。 13. 极谱定量分析的基础是,定量的方法主要有和。对于不可逆过程,由于的影响,氧化波的半波电位比还原波的半波电位。 14. 气体库仑计阳极反应为,阴极反应为,生成气体总体积16800 mL,则通过的总电量为库仑。 15. 极谱分析中,还原波方程式是,氧化波方程式是。 16. 原子发射线的自吸现象是由于。
分析化学考研题
化学化工学院授课教案 课程名称:分析化学选论 授课专业:化学、应用化学 授课班级:2010级本1、2班,2010级本1、2、3班授课教师:何琴 授课时间:12-13-2 参考教材名称及版本:华中师大等编《分析化学(上 册)》第三版
绪论精选题 1.(中科大2001填空题)样品采集的关键是 2.(中科大2002选择题)实验室中使用铂坩埚,要尽量避免使用() A、热氢氟酸 B、浓热高氯酸 C、浓热硫磷混酸 D、碳酸钠熔融 3.(华中科大2006填空题)常用的分解试样的方法有法、法、 法 4.(中科大2009)下列试样用什么试剂溶解或分解 (1)银合金;(2)钠长石(NaAlSi3O8)中SiO2的测定. 5.(华南理工2006综合题20分)有一试样经与分析得知其中含有二氧化硅(常量)、 铁(微量)、铝(常量)、钙(常量)、镁(微量)、钾(微量)、钠(微量)、锰(微量)等组分,现需采用易于开展工作的仪器及方法,对上述样品中的各组分晶型定量分析,你计划如何工作。 提示:(1)根据上述样品应采用什么方法对样品进行分解?(2)如何制备各组分的测定试液?(3)针对样品的不同组分及含量,应采用什么方法进行测定(写 出测定方法的名称、采用的试剂或标准溶液与试剂等)
《误差和分析数据的处理》精选题 1.(南开选择题1)以下情况产生的误差属于系统误差的是() A、称量时读错了砝码 B、试剂中含有少量干扰测定的离子 C、滴定时有溶液溅出 D、滴定管读数最后一位估计不准 2.(华南理工2006)下列情况中哪个不属于系统误差() A、滴定管未经校正 B、所用试剂中含有干扰离子 C、天平两臂不等长 D、砝码错误 3.(中科大2003)下列有关系统误差的正确描述是() A、系统误差具有随机性 B、系统误差在分析过程中不可避免 C、系统误差具有单向性 D、系统误差是由一些不确定的偶然因素造成的 4.(南开填空题)分析测定中系统误差的特点是 5.(南开2004填空)常用的消除系统误差的方法是、、 6.(中科大2002 选择3)消除分析方法中存在的系统误差,可以采用的方法是() A、增大试样称量质量 B、用两组测量数据对照 C、增加测定次数 D、进行仪器校准 7.(南开2000华中科大2006选择)分析测试中随机误差的特点是() A、大小误差出现的概率相同 B、正负误差出现的概率相同 C、数值有一定的范围 D、数值有规律可循 8.(北师大2002 选择)测定中出现下列情况,所引起的误差属于偶然误差的是() A、测定时所加试剂中含有微量的被测物 B、某分析人员滴定管读数总是偏高或偏低 C、某分析人员几次读取同一滴定管的读数不能取得一致 D、滴定时少量溶液溅出
2007考研有机化学真题及答案
中科院2007年有机化学考研试题 一、完成下列反应,若有立体化学问题请注明;若不反应,用NR 表示(共20分,除第3小题4分外,其余各题每小题2分) 注:每题后括号内为答案 1. 丙酮 I 2. 甲醇 3 CH 3 I * 叔卤代烃发生的是S N 1过程,因此I 的构型不能确定,尽管这里不存在手性的问题。 3. ( ) 3 CH 3CH 3 O O O 3 3 4.( ) () H + EtOH BF PhMgBr 3 3 3 5.(() i.NaOH OH i.NaOH O NR * 简单的芳香卤代烃不发生S N 反应。 6.+ Cl AlCl 3 7. OH OH CH 3 CH 3 24 O 8. EtOH O O O EtO O * 逆Dieckmann 缩合。
9. Br 2 H 2 O 二、为下列转变提供所需的试剂,必要时注明用量。有的转变可能需要不止一步反应,请分别写出每步反应所需的试剂(20分,每小题2分) 1.Br 解:1 NaCN ; 2 H 3O +或 1 Mg/乙醚;2 CO 2;3 H 3O + 2. () OH O H O 解:1 SOCl 2; 2 LiAlH(t-BuO)3; 3 H 3O + 或1 LiAlH 4;2 H 3O +; 3 CrO 3/Py 3. n -Bu OH O -Bu 3O 解:1 SOCl 2;2 Me 2Cd 或 与过量的MeLi 反应后水解 4. () NH O O 解:1 NH 2OH/H +;2 H 2SO 4或 PCl 5,Beckmann 重排。 5. () HO NH 2 O 解:NaNO 2/HCl 6. Ph O Ph O 解:1 LDA (1mol );2 MeI ;必须用强碱,否则易导致自身缩合。 7. O O Br 解:Br 2(1mol )/HAc 8. () 解:1 B 2H 6;2 H 2O 2/OH -
分析化学考研模拟试题简答题及答案
分析化学考研模拟试题简答题 1. 6分 简答如何检验和消除测量过程中的系统误差以提高分析结果的准确度。 答:进行对照试验,回收试验,空白试验,校准仪器和用适当的方法对分析结果校正。 2. 什么是基准物质?什么是标准溶液? 能用于直接配制或标定标准溶液的物质;是一种已知准确浓度的的溶液。 3. 分别简单阐述酸碱滴定指示剂,络合滴定指示剂, 氧化还原滴定指示剂和沉淀滴定指示剂指示滴定终点的原理. 答:酸碱指示剂变色是随着酸度的变化,指示剂结合或离解出H+,结构发生变化,从而发生颜色改变;络合指示剂与金属离子络合前后颜色不同,游离的试剂为一种颜色,与金属离子形成络合物又一种颜色;氧化还原指示剂变色分为几种情况:一种是随氧化还原电位变化的试剂,在氧化态和还原态,结构不同,各有不同颜色,如二苯胺磺酸钠,还原态无色,氧化态紫红色;另一种自身指示剂,如高锰酸钾;还有显色指示剂如I2,与淀粉显兰色。沉淀滴定指示剂,是根据溶度积大小,在化学计量点被测物质沉淀基本完全后,指示剂与被测离子形成有色沉淀或有色络合物指示终点。还有吸附指示剂,吸附在沉淀表面后发生颜色变化。 4. 在进行络合滴定时,为什么要加入缓冲溶液控制滴定体系保持一定的pH? 答:络合滴定过程中,随着络合物的生成,不断有H+释放出,使体系酸度增大,会降低络合物的条件稳定常数,使滴定突跃减小;也会使指示剂变色范围改变,导致测定误差大。所以,要加入缓冲溶液控制溶液pH;还用于控制金属离子的水解。 5. 吸光光度法中测量条件的选择应注意哪几点? 答:测量波长选具有最大光吸收,干扰最小;吸光度读数在0.2-0.8范围,最好接近0.4343;选择适当参比溶液。 6.什么是准确度?什么是精密度? 答:准确度指分析结果与真值的接近程度。精密度指平行测定分析结果间的靠近程度。 7. 10 分 某同学拟用如下实验步骤标定0.02 mol/L Na2S2O3, 请指出其三种错误(或不妥)之处, 并予改正。 称取0.2315 g 分析纯K2Cr2O7, 加适量水溶解后, 加入1 g KI, 然后立即加入淀粉指示剂, 用Na2S2O3滴定至蓝色褪去, 记下消耗Na2S2O3的体积, 计算Na2S2O3浓度。 [Mr(K2Cr2O7)= 294.2] 答:(1) K2Cr2O7试剂含吸附水, 要在120 C 烘约3h。 (2) n(K2Cr2O7): n(Na2S2O3)= 1:6 ,
研究生入学考试分析化学试题
2004 年研究生入学考试分析化学试题? 四、计算题 4.根据下列电池: Ag︱Ag2CrO4(固),CrO42-(x mol/L)║SCE 若测得的电池电动势为-288mV,试计算CrO42-的浓度(25℃)。 已知φSCE=0.245V,φ○-Ag+/Ag=0.799V,Ag2CrO4的K sp为2.0?10-12。 2003 年研究生入学考试分析化学试题 一、名词解释 4.相界电位 二、选择题 13.玻璃电极的电位() A.随溶液中氢离子活度的增高向负方向变化 B.随溶液中pH的增高向正方向变化 C.与溶液中的子强度有关 D.随溶液中氢离子活度的增高向正方向变化 四、计算题 3. 25℃时,下列电池的电动势为0.482V,计算溶液中IO3-的平衡浓度。 (-)Ni(s)︱Ni2+(0.0250mol/L)║IO3-,Cu2+︱Cu(s)(+) 已知Cu(IO3)2的K sp3.20?10-7,φ○-Ni2+/Ni=-0.231V,φ○-Cu2+/Cu=0.337V。 2002 年研究生入学考试分析化学试题 一、名词解释 6. potentiometric titration 四、计算题 2. 25℃时,实验测得以下三个电池的电动势如下: (1)Hg︱KCl(s),Hg2Cl2(s)║Ag+(0.01000mol/L)︱Ag EMF=0.4397V (2) Hg︱KCl(s),Hg2Cl2(s)║AgI(s)︱Ag EMF=0.08240V (3) Ag︱PbI2(s),AgI(s)║Hg2Cl2(s),KCl(s)︱Hg EMF=0.2382V 请使用实验数据,计算AgI与PbI2的溶度积(饱和甘汞电极的电极电位为0.2415V) 2001 年研究生入学考试分析化学试题 六、计算题 2.下列电池 Ni(s)︱NiSO4(0.0250mol/L)║KIO3(0.10mol/L),Cu(IO3)2(s)︱Cu(s)的电动势为0.482V,求Cu(IO3)2的K sp(φ○-Ni2+/Ni=-0.231V,φ○-Cu2+/Cu=0.337V)。 2000 年研究生入学考试分析化学试题 一、名词解释 1.指示电极和参比电极 四、计算题 3. 25℃时,下列电池的电动势为-0.372V,计算AgAc的K sp(φ○-Cu2+/Cu=0.337V,φ○-Ag+/Ag=0.799V)。
分析化学考研问答题及答案
三、大题 原子吸收 1. 原子吸收光谱分析的光源应当符合哪些条件?为什么空心阴极灯能发射半宽度很窄的谱线? 原子吸收光谱分析的光源应当符合以下基本条件: ⑴谱线宽度“窄”(锐性),有利于提高灵敏度和工作曲线的直线性。 ⑵谱线强度大、背景小,有利于提高信噪比,改善检出限。 ⑶稳定,有利于提高测量精密度。 ⑷ 灯的寿命长。 空心阴极灯能发射半宽度很窄的谱线,这与灯本身的构造和灯的工作参数有关系。从构造上说,它是低压的,故压力变宽小。从工作条件方面,它的灯电流较低,故阴极强度和原子溅射也低,故热变宽和自吸变宽小。正是由于灯的压力变宽、热变宽和自吸变宽较小,致使等发射的谱线半宽度很窄。 2. 简述背景吸收的产生及消除背景吸收的方法。 背景吸收是由分子吸收和光散射引起的。分子吸收指在原子化的过程中生成的气体分子、氧化物、氢氧化物和盐类等分子对辐射线的吸收。在原子吸收分析中常碰到的分子吸收有:碱金属卤化物在紫外区的强分子吸收;无机酸分子吸收;火焰气体或石墨炉保护气体(Ar)的分子吸收。分子吸收与共存元素的浓度、火焰温度和分析线(短波和长波)有关。光散射是指在原子化过程中固体微粒或液滴对空心阴极灯发出的光起散射作用,使吸光度增加。 消除背景吸收的办法有:改用火焰(高温火焰);采用长波分析线;分离或转化共存物;扣除方法(用测量背景吸收的非吸收线扣除背景,用其他元素的吸收线扣除背景,用氘灯背景校正和塞曼效应背景校正法)等。 3. 在原子吸收分析中,为什么火焰法(火焰原子化器)的绝对灵敏度比非火焰法(石墨原子化器)低?
火焰法是采用雾化进样。因此: ⑴试液的利用率低,大部分试液流失,只有小部分(约X%喷雾液进入火 焰参与原子化。 ⑵稀释倍数高,进入火焰的喷雾液被大量气体稀释,降低原子化浓度。 ⑶ 被测原子在原子化器中(火焰)停留时间短,不利于吸收。 4. 什么是原子吸收光谱分析中的化学干扰?用哪些方法可消除此类干扰?待测元素与共存元素发生化学反应,引起原子化效率的改变所造成的影响统称为化学干扰,影响化学干扰的因素很多,除与待测元素及共存元素的性质有关外,还与喷雾器、燃烧器、火焰类型、温度以及火焰部位有关。 为抑制化学干扰,可加入各种抑制剂,如释放剂、保护剂、缓冲剂等,或采用萃取等化学分离分离方法来消除干扰。 分离与富集 1.重要的萃取分离体系(根据萃取反应的类型)。 螯合物萃取体系, 离子缔合物萃取体系, 溶剂化合物萃取体系, 简单分子萃取体系 配位滴定法 1.根据EDTA的酸效应曲线(即Ringbom曲线),可获得哪些主要信息? (1)由于H+离子存在使EDTA参加主反应的能力降低的现象,称为EDTA的酸效应。 (2)单独滴定某种金属离子时允许的最低PH
有机化学考研习题附带答案
综合练习题(一) 一选择题 (一)A型题 1 下列体系中既有p-π共轭又有π-π共轭的是() 2 氨基(-NH2)既具有邻、对位定位效应,又可使苯环致活的主要原因是() A +I效应 B -I效应 C 供电子p-π共轭(+C效应) D π-π共轭效应 E 吸电子p-π共轭(-C效应) 3 化合物 发生硝化反应易难顺序为() A ④①②⑤③ B ③⑤②①④ C ⑤③②④① D ①④②③⑤ E ④①⑤③② 4 下列化合物中最易与 H2SO4反应的是() 5 稳定性大小顺序为() A ①②③④ B ①③②④ C ③①④② D ②①③④ E ③④①②
6 下列卤烃在室温下与AgNO3醇溶液作用产生白色沉淀的是() A 溴化苄 B 异丙基氯 C 3-氯环己烯 D 烯丙基碘 E 丙烯基氯 7 ①吡咯②吡啶③苯胺④苄胺⑤对甲苯胺的碱性由强到弱顺序为() A ④②③⑤① B ②④③①⑤ C ④②⑤③① D ⑤③②④① E ②⑤③④① 8 下列化合物即可与NaHSO3作用,又可发生碘仿反应的是() A (CH3)2CHCHO B CH3COCH3 C (CH3)2CHOH D E 9 化合物与NaOH醇溶液共热的主要产物是() 10 下列各组反应中两个反应均属同一反应机制的是() 11化合物 的酸性强到弱顺序为()
A ②④⑤③① B ④②⑤①③ C ④②⑤③① D ⑤③②④① E ②⑤④①③ 12 下列化合物即能产生顺反异构,又能产生对映异构的是() A 2,3-二甲基-2-戊烯 B 4-氯-2-戊烯 C 3,4-二甲基-2-戊烯 D 2-甲基-4-氯-2-戊烯 E 4-甲基-2-氯-2-戊烯 13 两分子丙醛在稀碱作用下的最终产物是() 14 下列物质最易发生酰化反应的是() A RCOOR B RCOR C RCOX D (RCO)2O E RCONH2 15 在酸性或碱性条件下均易水解的是() A 油脂 B 缩醛 C 糖苷 D 蔗糖 E 淀粉 16 溶于纯水后,溶液PH=的氨基酸,估计其等电点() A 等于 B 小于 C 大于 D 等于7 E 无法估计 17 化合物分子中含有的杂环结构是() A 吡啶 B 嘧啶 C 咪唑 D 嘌呤 E 喹啉 18 下列物质能发生缩二脲反应的是() 19 下列化合物烯醇化趋势最大的是()
