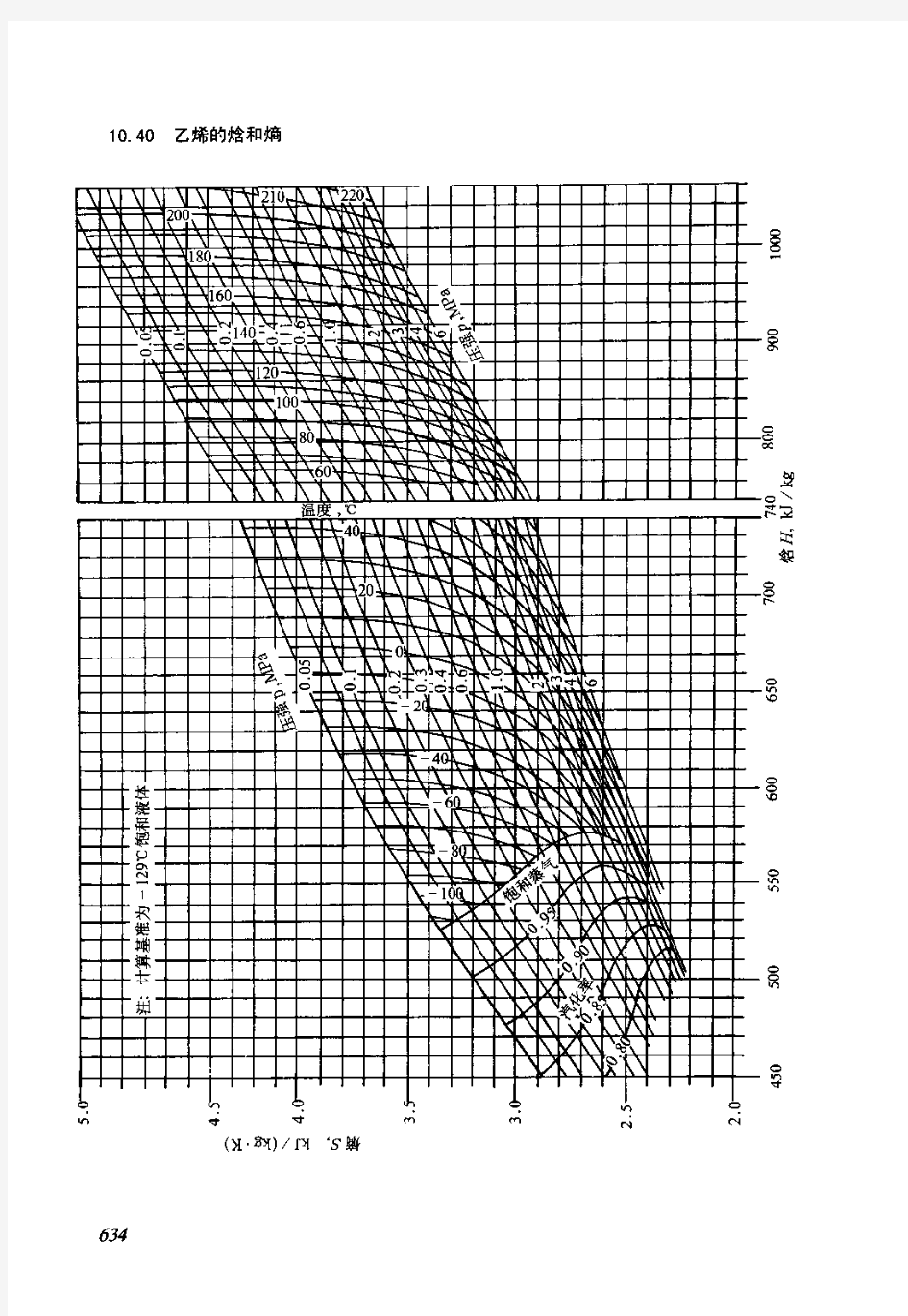
乙烯的焓和熵
焓和熵的由来
焓和熵的由来 熵S:物理学上指热能除以温度所得的商,标志热量转化为功的程度。熵的单位就是焦耳每开尔文,即J/K。熵是热力系内微观粒子无序度的一个量度,熵的变化可以判断热力过程是否为可逆过程。(可逆过程熵不变)热力学能与动能、势能一样,是物体的一个状态量。能量可以转化为功,能量守恒定律宣称,宇宙中的能量必须永远保持相同的值。那么,能够把能量无止境地转化为功吗?既然能量不灭,那么它是否可以一次又一次地转变为功?1824年,法国物理学家卡诺证明:为了作功,在一个系统中热能必须非均匀地分布,系统中某一部分热能的密集程度必须大于平均值,另一部分则小于平均值,所能荼得的功的数量妈决于这种密集程度之差。在作功的同时,这种差异也在减小。当能量均匀分布时,就不能再作功了,尽管此时所有的能量依然还存在着。德国物理学家克劳修斯重新审查了卡诺的工作,根据热传导总是从高温到低温而不能反过来这一事实,在1850年的论文中提出:不可能把热量从低温物体传到高温物体而不引起其他变化。这就是热力学第二定律,能量守恒则是热力学第一定律。1854年,克劳修斯找出了热与温度之间的某一种确定产关系,他证明当能量密集程度的差异减小时,这种关系在数值上总在增加,由于某种原因,他在1856年的论文中将这一关系式称作“熵”(entropy)。 在作理论分析时,有时用熵的概念比较方便。在自然界发生的许多过程中,有的过程朝一个方向可以自发地进行,而反之则不行。
例如,一个容器的两边装有温度、压力相同的两种气体,在将中间的隔板抽开后,两种气体会自发地均匀混合,但是,要将它们分离则必须消耗功。混合前后虽然温度、压力不变,但是两种状态是不同的,单用温度与压力不能说明它的状态。两个温度不同的物体相互接触时,高温物体会自发地将热传给低温物体,最后两个物体温度达到相等。但是,相反的过程不会自发地发生。上述现象说明,自然界发生的一些过程是有一定的方向性的,这种过程叫不可逆过程。过程前后的两个状态是不等价的。用什么物理量来度量这种不等价性呢?通过研究,找到了“熵”这个物理量。有些过程在理想情况下有可能是可逆的,例如气缸中气体膨胀时举起一个重物做了功,当重物下落时有可能将气体又压缩到原先的状态。根据熵的定义,熵在一个可逆绝热过程的前后是不变的。而对于不可逆的绝热过程,则过程朝熵增大的方向进行。或者说,熵这个物理量可以表示过程的方向性,自然界自发进行的过程总是朝着总熵增加的方向进行,理想的可逆过程总熵保持不变。对上述的两个不可逆过程,它们的终态的熵值必大于初态的熵值。 在制氧机中常遇到的节流阀的节流膨胀过程和膨胀机的膨胀过程均可近似地看成是绝热过程。二者膨胀后压力均降低。但是,前者是不可逆的绝热膨胀,膨胀前后熵值肯定增大。后者在理想情况下膨胀对外作出的功可以等于压缩消耗的功,是可逆绝热膨胀过程,膨胀前后熵值不变,叫等熵膨胀。实际的膨胀机膨胀会有损失,也是不可逆过程,熵也增大。但是,它的不可逆程度比节流过程小,增加的熵值也小。因此,熵的增加值反映了这个绝热过程不可逆程度的大小。
甲烷的性质
甲烷 甲烷分子式CH4。最简单的有机化合物。甲烷是没有颜色、 没有气味的气体,沸点-161.4℃,比空气轻,它是极难溶于 水的可燃性气体。甲烷和空气成适当比例的混合物,遇火花 会发生爆炸。化学性质相当稳定,跟强酸、强碱或强氧化剂 (如KMnO4)等一般不起反应。在适当条件下会发生氧化、热解及卤代等反应。 甲烷在自然界分布很广,是天然气、沼气、坑气及煤气的主要成分之一。它可用作燃料及制造氢、一氧化碳、炭黑、乙炔、氢氰酸及文字甲醛等物质的原料。 413kJ/mol、109°28′,甲烷分子是正四面体空间构型,上面的结构式只是表示分子里各原子的连接情况,并不能真实表示各原子的空间相对位置。 1.物质的理化常数: 国标编号21007 CAS号74-82-8 中文名称甲烷 英文名称methane;Marsh gas 别名沼气 分子式CH4 外观与性状无色无臭气体 分子量16.04 蒸汽压53.32kPa/-168.8℃闪点:-188℃ 熔点-182.5℃沸点:-161.5℃溶解性微溶于水,溶于醇、乙醚 密度相对密度(水=1)0.42(-164℃);相对密度(空气=1)0.55 稳定性稳定 危险标记4(易燃液体) 主要用途用作燃料和用于炭黑、氢、乙炔、甲醛等的制造 2.对环境的影响: 一、健康危害 侵入途径:吸入。 健康危害:甲烷对人基本无毒,但浓度过高时,使空气中氧含量明显降低,使人窒息。当空气中甲烷达25%-30%时,可引起头痛、头晕、乏力、注意力不集中、呼吸和心跳加速、共济失调。若不及时脱离,可致窒息死亡。皮肤接触液化本品,可致冻伤。 二、毒理学资料及环境行为 毒性:属微毒类。允许气体安全地扩散到大气中或当作燃料使用。有单纯
甲烷危险特性(甲烷理化性)
甲烷的危险有害特性表 标识中文名甲烷英文名Methane 分子式CH4危规号21007UN编号:1971 分子量16.04危险性类别第2.1类易燃气体 理化特性熔点(℃)-182.5沸点(℃)-161.5 燃烧热(kJ/mol)889.5 饱和蒸气压 (kPa) 53.32(-168.8℃) 相对密度(水=1) 0.42(-164℃) (空气=1) 0.55 外观性状无色无臭气体 溶解性微溶于水,溶于醇、乙醚 稳定性---聚合危害--- 禁忌物 强氧化剂、氟、 氯 燃烧(分解)产 物 一氧化碳、二氧化 碳 主要用途用作燃料和用于炭黑、氢、乙炔、甲醛等的制造 燃爆特性燃烧性易燃 建规火险分 级 甲 闪点(℃)-188引燃温度(℃)538 爆炸下限(V%) 5.3 爆炸上限 ( V%) 15 危险特性 易燃,与空气混合能形成爆炸性混合物,遇热源和明火有燃烧爆炸的危险。与五氧化溴、氯气、次氯酸、三氟化氮、液氧、二氟 化氧及其它强氧化剂接触剧烈反应 灭火方法 切断气源。若不能切断气源,则不允许熄灭泄漏处的火焰。喷水冷却容器,可能的话将容器从火场移至空旷处。灭火剂:雾状水、 泡沫、二氧化碳、干粉 毒性及健康危 害 车间卫生标 准 未制定标准 侵入途径吸入、皮肤接触 急性毒性 LD50:无资料 LC50:无资料 健康危害 甲烷对人基本无毒,但浓度过高时,使空气中氧含量明显降低,使人窒息。当空气中甲烷达25%~30%时,可引起头痛、头晕、乏 力、注意力不集中、呼吸和心跳加速、共济失调。若不及时脱离, 可致窒息死亡。皮肤接触液化本品,可致冻伤。 急救措施皮肤接触若有冻伤,就医治疗 眼睛接触--- 吸入 迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸。就医 食入--- 应急急救措施
关于焓和熵的概念
关于焓和熵的概念 熵和焓的概念 (2008-11-22 15:23:21) 转载 标签: 杂谈 解释1、焓是物体的一个热力学能状态函数。在介绍焓之前我们需要了解一下分子热运动、热力学能和热力学第一定律:1827年,英国植物学家布朗把非常细小的花粉放在水面上并用显微镜观察,发现花粉在水面上不停地运动,且运动轨迹极不规则。起初人们以为是外界影响,如振动或液体对流等,后经实验证明这种运动的的原因不在外界,而在液体内部。原来花粉在水面运动是受到各个方向水分子的撞击引起的。于是这种运动叫做布朗运动,布朗运动表明液体分子在不停地做无规则运动。从实验中可以观察到,布朗运动随着温度的升高而愈加剧烈。这表示分子的无规则运动跟温度有关系,温度越高,分子的无规则运动就越激烈。正因为分子的无规则运动与温度有关系,所以通常把分子的这种运动叫做分子的热运动。在热学中,分子、原子、离子做热运动时遵从相同的规律,所以统称为分子。既然组成物体的分子不停地做无规则运动,那么,像一切运动着的物体一样,做热运动的分子也具有动能。个别分子的运动现象(速度大小和方向)是偶然的,但从大量分子整体来看,在一定条件下,他们遵循着一定的统计规律,与热运动有关的宏观量——温度,就是大量分子热运动的统计平均值。分子动能与温度有关,温度越高,分子的平均动能就越大,反之越小。所以从分子动理论的角度看,温度是物体分子热运动的平均动能的标志(即微观含义,宏观:表示物体的冷热程度)。分子间存在相互作用力,即化学上所说的分子间作用力(范德华力)。分子间作用力是分子引力与分子斥力的合力,存在一距离r0使引力等于斥力,在这个位置上分子间作用力为零。分子引力与分子斥力都随分子间距减小而增大,但是斥力的变化幅度相对较大,所以分子间距大于r0时表现为引力,小于r0时表现为斥力。因为分子间存在相互作用力,所以分子间具有由它们相对位置决定的势能,叫做分子势能。分子势能与弹簧弹性势能的变化相似。物体的体积发生变化时,分子间距也发生变化,所以分子势能同物体的体积有关系。物体中所有分子做热运动的动能和分子势能的总和叫做物体的热力学能,也叫做内能,
焓熵的相关概念
焓是物体的一个热力学能状态函数。<br/>在介绍焓之前我们需要了解一下分子热运动、热力学能和热力学第一定律:<br/>1827年,英国植物学家布朗把非常细小的花粉放在水面上并用显微镜观察,发现花粉在水面上不停地运动,且运动轨迹极不规则。起初人们以为是外界影响,如振动或液体对流等,后经实验证明这种运动的的原因不在外界,而在液体内部。原来花粉在水面运动是受到各个方向水分子的撞击引起的。于是这种运动叫做布朗运动,布朗运动表明液体分子在不停地做无规则运动。从实验中可以观察到,布朗运动随着温度的升高而愈加剧烈。这表示分子的无规则运动跟温度有关系,温度越高,分子的无规则运动就越激烈。正因为分子的无规则运动与温度有关系,所以通常把分子的这种运动叫做分子的热运动。<br/>在热学中,分子、原子、离子做热运动时遵从相同的规律,所以统称为分子。<br/>既然组成物体的分子不停地做无规则运动,那么,像一切运动着的物体一样,做热运动的分子也具有动能。个别分子的运动现象(速度大小和方向)是偶然的,但从大量分子整体来看,在一定条件下,他们遵循着一定的统计规律,与热运动有关的宏观量——温度,就是大量分子热运动的统计平均值。分子动能与温度有关,温度越高,分子的平均动能就越大,反之越小。所以从分子动理论的角度看,温度是物体分子热运动的平均动能的标志(即微观含义,宏观:表示物体的冷热程度)。<br/>分子间存在相互作用力,即化学上所说的分子间作用力(范德华力)。分子间作用力是分子引力与分子斥力的合力,存在一距离r0使引力等于斥力,在这个位置上分子间作用力为零。分子引力与分子斥力都随分子间距减小而增大,但是斥力的变化幅度相对较大,所以分子间距大于r0时表现为引力,小于r0时表现为斥力。因为分子间存在相互作用力,所以分子间具有由它们相对位置决定的势能,叫做分子势能。分子势能与弹簧弹性势能的变化相似。物体的体积发生变化时,分子间距也发生变化,所以分子势能同物体的体积有关系。<br/>物体中所有分子做热运动的动能和分子势能的总和叫做物体的热力学能,也叫做内能,焓是流动式质的热力学能和流动功之和,也可认为是做功能力。<br/>2、熵是热力系内微观粒子无序度的一个量度,熵的变化可以判断热力过程是否为可逆过程。(可逆过程熵不)热力学能与动能、势能一样,是物体的一个状态量。<br/>能可以转化为功,能量守恒定律宣称,宇宙中的能量必须永远保持相同的值。那么,能够把能量无止境地转化为功吗?既然能量不灭,那么它是否可以一次又一次地转变为功?<br/>1824年,法国物理学家卡诺证明:为了作功,在一个系统中热能必须非均匀地分布,系统中某一部分热能的密集程度必须大于平均值,另一部分则小于平均值,所能荼得的功的数量妈决于这种密集程度之差。在作功的同时,这种差异也在减小。当能量均匀分布时,就不能再作功了,尽管此时所有的能量依然还存在着。<br/>德国物理学家克劳修斯重新审查了卡诺的工作,根据热传导总是从高温到低温而不能反过来这一事实,在1850年的论文中提出:不可能把热量从低温物体传到高温物体而不引起其他变化。这就是热力学第二定律,能量守恒则是热力学第一定律。<br/>1854年,克劳修斯找出了热与温度之间的某一种确定产关系,他证明当能量密集程度的差异减小时,这种关系在数值上总在增加,由于某种原因,他在1856年的论文中将这一关系式称作“熵”(entropy),entropy一诩源于希腊语,本意是“弄清”或“查明”,但是这与克劳修斯所谈话的内容似乎没有什么联系。热力学第二定律宣布宇宙的熵永远在增加着。<br/>然而,随着类星体以及宇宙中其他神秘能源的发现,天文学家们现在已经在怀疑:热力学第二定律是否果真在任何地方任何条件下都成立<br/>熵与温度、压力、焓等一样,也是反映物质内部状态的一个物理量。它不能直接用仪表测量,只能推算出来,所以比较抽象。在作理论分析时,有时用熵的概念比较方便。<br/> 在自然界发生的许多过程中,有的过程朝一个方向可以自发地进行,而反之则不行。例如,如图4a所示,一个容器的两边装有温度、压力相同的两种气体,在将中间的隔板抽开后,两种气体会自发地均匀混合,但是,
甲烷理化性质及危险特性表
甲烷理化性质及危险特性表 稳定性:稳定 聚合危险性:不聚合 禁忌物:强氧化剂、氟、氯。 有害燃烧产物:一氧化碳、二氧化碳。 健康危害数据 甲烷对人基本无毒,但浓度过高时,使空气中氧含量明显降低,使人窒息。当空气中甲烷达 25%?30%时,可引 起头痛、头晕、乏力、注意力不集中、呼吸和心跳加速、共济失调。若不及时脱离,可致窒息死亡。皮肤接触液化本 品,可致冻伤。 泄漏紧急处理 迅速撤离泄漏污染区人员至上风处,并进行隔离,严格限制岀入。切断火源。建议应急处理人员戴自给正压式呼 吸器,穿防静电工作服。尽可能切断泄漏源。合理通风,加速扩散。喷雾状水稀释、溶解。构筑围堤或挖坑收容产生 的大量废水。如有可能,将漏岀气用排风机送至空旷地方或装设适当喷头烧掉。也可以将漏气的容器移至空旷处,注 意通风。漏气容器要妥善处理,修复、检验后再用。 运输注意事项: 采用刚瓶运输时必须戴好钢瓶上的安全帽。钢瓶一般平放,并应将瓶口朝同一方向,不可交叉;高度不得超过车 辆的防护栏板,并用三角木垫卡牢,防止滚动。运输时运输车辆应配备相应品种和数量的消防器材。装运该物品的车 辆排气管必须配备阻火装置,禁止使用易产生火花的机械设备和工具装卸。严禁与氧化剂等混装混运。夏季应早晚运 输,防止日光曝晒。中途停留时应远离火种、热源。公路运输时要按规定路线行驶,勿在居民区和人口稠密区停留。 铁路运输时要禁止溜放。 储存注意事项: 储存于阴凉、通风的库房。远离火种、热源。库温不宜超过 30 'C 。应与氧化剂等分开存放,切忌混储。采用防爆 型照明、通风设施。禁止使用易产生火花的机械设备和工具。储区应备有泄漏应急处理设备。 操作注意事项: 密闭操作,全面通风。操作人员必须经过专门培训,严格遵守操作规程。远离火种、热源,工作场所严禁吸烟。 使用防爆型的通风系统和设备。防止气体泄漏到工作场所空气中。避免与氧化剂接触。在传送过程中,钢瓶和容器必 须接地和跨接,防止产生静电。搬运时轻装轻卸,防止钢瓶及附件破损。配备相应品种和数量的消防器材及泄漏应急 处理设备。 包装类别:052 包装方法:钢质气瓶。
焓&熵
焓enthalpy 为了引出焓这个概念,我们先讨论恒容和恒压过程的热效应。 对于一个封闭体系,△U=Q-W,封闭体系,恒容变化(不做体积功),且不做非体积功时,△U=Q,即封闭系、恒容、W'=0时,△U=Q v(Q v为恒容热效应),dU=δQ v。 上式是热力学中常用的一个公式,使用此公式时,一定要满足前面的条件,请大家注意,在热力学中用公式必须满足条件。 在化学中,我们更关心恒压过程,因为化学效应一般是在恒压条件下进行的。 封闭体系、恒压时,△U=Q p-W,若W'=0,则Q p=△U+W=△U+P e△V=U2-U1+ (P e V2-P e V1),因恒压P e=P1=P2,则Q p=(U2+P2V2)-(U1+P1V1),为了数学表达的方便,引进一个物理量,焓:H=U+PV,这里要说明一下,焓在这里无明确的物理意义,可以理解为,为了表达方便,专门设为一个符号,H即U+PV,之所以要提出焓这一物理量,是因为U+PV经常会用到,所以专门用一个符号来代替它。则上式 Qp=H2-H1=△H。 ∴封闭体系、恒压、W'=0时, Qp=△H,dH=δQ p。 这里要特别说明的是,H是状态系数,因为U、P、V都是状态系数,状态确定,U、P、V都是一定值,当然H也是确定值,也就是说从始态→终态,所有途径的△H都是的一样的,也就是说,在计算△H时,可以设计一条方便计算得途径。 焓是热力学的基本概念之一,以后经常要用到。总的来说,封闭体系不做非体积功时的过程,内能变化可以通过测定恒容热效应来求,焓变可以通过测恒压热效应求得。 焓 焓(enthalpy),符号H,是一个系统的热力学参数。 物理意义:⑴H=U+pV 焓=流动内能+推动功 ⑵焓表示流动工质所具有的能量中,取决于热力状态的那部分能量 定义一个系统内: H = U + pV 式子中"H"为焓,U为系统内能,p为其压强,V则为体积。 对于在大气内进行的化学反应,压强一般保持常值,则有 ΔH = ΔU + pΔV 规定放热反应的焓取负值。如:
熵焓自由能
熵、焓、自由能 熵 . 熵:热量与温度之商乘坐熵,记作S。 S = Q / T . 熵变; 熵的变化量称为熵变,记作ΔS ΔS = ΔQ / T . Q 为系统吸收的热量,T为系统的温度。 熵变等于系统从热源吸收的热量与系统的热力学温度之比,可用于度量热量转变 为功的程度。 熵表示热量转化为功的程度,也表示系统中的无序程度, 1、熵越大,其做功能力下降,无序程度增加。 2、熵是表示物质系统状态的一个物理量,它表示该状态可能出现的程度。、 3、孤 立体系(即绝热体系)中实际发生的过程必然要使它的熵增加。 4、对于纯物质的晶体,在热力学零度时,熵为零. :有两种表述形式。 表述1:不可能用有限个手段和程序使一个物体冷却到绝对温度零度。表述2: 一切纯物质的晶体,在热力学零度时,熵为零。 标准熵:1 mol物质在下所计算出的熵值,称标准摩尔熵,简称标准熵。用ST q 表示,单位:J·mol-1 ·K-1 熵的规律:
(1) 同一物质,气态熵大于液态熵,液态熵大于固态熵; ST q(g) > ST q(l) > ST q(s) S q H2O (g) > H2O (l) > H2O (s) (2) 相同组成的分子中,分子中原子数目越多,熵值越大; S q O2 (g) < S q O3 (g) S q NO (g) < S q NO2 (g) < S q N2O4 (g) S q CH2=CH2 (g) < S q CH3-CH3 (g) (3) 相同元素的原子组成的分子中,分子量越大,熵值越大; S q CH3Cl(g) < S q CH2Cl2 (g) < S q CHCl3(g) (4) 同一类物质,越大,结构越复杂,熵值越大; S qCuSO4(s) < S qCuSO4·H2O(s) < SqCuSO4·3H2O(s) < SqCuSO4·5H2O (s) S qF2(g) < S qCl2(g) < S qBr2(g) < SqI2 (g) (5) 固体或液体溶于水时,熵值增大,气体溶于水时,熵值减少。 反应熵变的计算公式 一般地,对于标准状态下的反应:m A + n B =x C + y D 熵变 =(x × C 的标准熵 + y × D的标准熵)-(m × A的标准熵 + n × B的标准熵) = [x Sq,C + y Sq,D] – [m Sq,A + n Sq,B] 热力学第二定律: 孤立体系(即绝热体系)的自发过程是体系熵增加的过程,即:
甲烷物性参数
甲烷分子式CH4。最简单的有机化合物。甲烷是没有颜色、没有气味的气体,沸点-161.4℃,比空气轻,它是极难溶于水的可燃性气体。甲烷和空气成适当比例的混合物,遇火花会发生爆炸。化学性质相当稳定,跟强酸、强碱或强氧化剂(如KMnO4)等一般不起反应。在适当条件下会发生氧化、热解及卤代等反应。甲烷在自然界分布很广,是天然气、沼气、坑气及煤气的主要成分之一。它可用作燃料及制造氢、一氧化碳、炭黑、乙炔、氢氰酸及甲醛等物质的原料。 413kJ/mol、109°28′,甲烷分子是正四面体空间构型,上面的结构式只是表示分子里各原子的连接情况,并不能真实表示各原子的空间相对位置。 甲烷的产生:据德国核物理研究所的科学家经过试验发现,植物和落叶都产生甲烷,而生成量随着温度和日照的增强而增加。另外,植物产生的甲烷是腐烂植物的10到100倍。他们经过估算认为,植物每年产生的甲烷占到世界甲烷生成量的10%到30%。 1.物质的理化常数: 国标编号21007 CAS号74-82-8 中文名称甲烷 英文名称methane;Marsh gas 别名沼气 分子式CH4 外观与性状无色无臭气体 分子结构:甲烷分子是正四面体形分子、非极性分子。 分子量16.04 蒸汽压53.32kPa/-168.8℃闪点:-188℃ 熔点-182.5℃沸点:-161.5℃溶解性微溶于水,溶于醇、乙醚 密度相对密度(水=1)0.42(-164℃);相对密度(空气=1)0.55 稳定性稳定 危险标记4(易燃液体) 主要用途用作燃料和用于炭黑、氢、乙炔、甲醛等的制造 2.对环境的影响: 一、健康危害 侵入途径:吸入。
健康危害:甲烷对人基本无毒,但浓度过高时,使空气中氧含量明显降低,使人窒息。当空气中甲烷达25%-30%时,可引起头痛、头晕、乏力、注意力不集中、呼吸和心跳加速、共济失调。若不及时脱离,可致窒息死亡。皮肤接触液化本品,可致冻伤。 二、毒理学资料及环境行为 毒性:属微毒类。允许气体安全地扩散到大气中或当作燃料使用。有单纯性窒息作用,在高浓度时因缺氧窒息而引起中毒。空气中达到25~30%出现头昏、呼吸加速、运动失调。 急性毒性:小鼠吸入42%浓度×60分钟,麻醉作用;兔吸入42%浓度×60分钟,麻醉作用。 危险特性:易燃,与空气混合能形成爆炸性混合物,遇热源和明火有燃烧爆炸的危险。与五氧化溴、氯气、次氯酸、三氟化氮、液氧、二氟化氧及其它强氧化剂接触剧烈反应。 燃烧(分解)产物:一氧化碳、二氧化碳。 3.现场应急监测方法: 4.实验室监测方法:气相色谱法《空气中有害物质的测定方法》(第二版),杭士平编 可燃溶剂所显色法;容量分析法《水和废水标准检验法》第20版(美) 5.环境标准: 前苏联车间空气中有害物质的最高容许浓度300mg/m3 美国车间卫生标准窒息性气体 6.应急处理处置方法: 一、泄漏应急处理 迅速撤离泄漏污染区人员至上风处,并进行隔离,严格限制出入。切断火源。建议应急处理人员戴自给正压式呼吸器,穿消防防护服。尽可能切断泄漏源。合理通风,加速扩散。喷雾状水稀释、溶解。构筑围堤或挖坑收容产生的大量废水。如有可能,将漏出气用排风机送至空旷地方或装设适当喷头烧掉。也可以将漏气的容器移至空旷处,注意通风。漏气容器要妥善处理,修复、检验后再用。二、防护措施
熵和焓的理解
熵 entropy 描述的重要态函数之一。熵的大小反映系统所处状态的稳定情况,熵的变化指明热力学过程进行的方向,熵为提供了定量表述。 为了定量表述热力学第二定律,应该寻找一个在可逆过程中保持不变,在不可逆过程中单调变化的态函数。克劳修斯在研究卡诺热机时,根据卡诺定理得出,对任意循环过程都有,式中 Q是系统从温度为T的热源吸收的微小热量,等号和不等号分别对应可逆和不可逆过程。可逆循环的表明存在着一个态函数熵,定义为 对于绝热过程Q=0,故S≥0,即系统的熵在可逆绝热过程中不变,在不可逆绝热过程中单调增大。这就是熵增加原理。由于孤立系统内部的一切变化与外界无关,必然是绝热过程,所以熵增加原理也可表为:一个孤立系统的熵永远不会减少。它表明随着孤立系统由非平衡态趋于平衡态,其熵单调增大,当系统达到平衡态时,熵达到最大值。熵的变化和最大值确定了孤立系统过程进行的方向和限度,熵增加原理就是热力学第二定律。 能量是物质运动的一种量度,形式多样,可以相互转换。某种形式的能量如内能越多表明可供转换的潜力越大。熵原文的字意是转变,描述内能与其他形式能量自发转换的方向和转换完成的程度。随着转换的进行,系统趋于平衡态,熵值越来越大,这表明虽然在此过程中能量总值不变,但可供利用或转换的能量却越来越少了。内能、熵和热力学第一、第二定律使人们对与热运动相联系的能量转换过程的基本特征有了全面完整的认识。 从微观上说,熵是组成系统的大量微观粒子无序度的量度,系统越无序、越混乱,熵就越大。热力学过程不可逆性的微观本质和统计意义就是系统从有序趋于无序,从概率较小的状态趋于概率较大的状态。 在信息论中,熵可用作某事件不确定度的量度。信息量越大,体系结构越规则,功能越完善,熵就越小。利用熵的概念,可以从理论上研究信息的计量、传递、变换、存储。此外,熵在控制论、概率论、数论、天体物理、生命科学等领域也都有一定的应用。 注:熵的增加系统从几率小的状态向几率大的状态演变,也就是从有规则、有秩序的状态向更无,更无秩序的演变。 焓 enthalpy
熵和焓的理解
熵 entropy 描述热力学系统的重要态函数之一。熵的大小反映系统所处状态的稳定情况,熵的变化指明热力学过程进行的方向,熵为热力学第二定律提供了定量表述。 为了定量表述热力学第二定律,应该寻找一个在可逆过程中保持不变,在不可逆过程中单调变化的态函数。克劳修斯在研究卡诺热机时,根据卡诺定理得出,对任意循环过程都有Image:熵1.jpg,式中Image:熵2.jpg Q是系统从温度为T的热源吸收的微小热量,等号和不等号分别对应可逆和不可逆过程。可逆循环的Image:熵3.jpg表明存在着一个态函数熵,定义为 Image:熵4.jpg 对于绝热过程Q=0,故S≥0,即系统的熵在可逆绝热过程中不变,在不可逆绝热过程中单调增大。这就是熵增加原理。由于孤立系统内部的一切变化与外界无关,必然是绝热过程,所以熵增加原理也可表为:一个孤立系统的熵永远不会减少。它表明随着孤立系统由非平衡态趋于平衡态,其熵单调增大,当系统达到平衡态时,熵达到最大值。熵的变化和最大值确定了孤立系统过程进行的方向和限度,熵增加原理就是热力学第二定律。 能量是物质运动的一种量度,形式多样,可以相互转换。某种形式的能量如内能越多表明可供转换的潜力越大。熵原文的字意是转变,描述内能与其他形式能量自发转换的方向和转换完成的程度。随着转换的进行,系统趋于平衡态,熵值越来越大,这表明虽然在此过程中能量总值不变,但可供利用或转换的能量却越来越少了。内能、熵和热力学第一、第二定律使人们对与热运动相联系的能量转换过程的基本特征有了全面完整的认识。 从微观上说,熵是组成系统的大量微观粒子无序度的量度,系统越无序、越混乱,熵就越大。热力学过程不可逆性的微观本质和统计意义就是系统从有序趋于无序,从概率较小的状态趋于概率较大的状态。 在信息论中,熵可用作某事件不确定度的量度。信息量越大,体系结构越规则,功能越完善,熵就越小。利用熵的概念,可以从理论上研究信息的计量、传递、变换、存储。此外,熵在控制论、概率论、数论、天体物理、生命科学等领域也都有一定的应用。 注:熵的增加表示系统从几率小的状态向几率大的状态演变,也就是从比较有规则、有秩序的状态向更无规则,更无秩序的状态演变。 焓 enthalpy 热力学中表征物质系统能量的一个重要状态参量,常用符号H表示。对一定质量的物质,焓定义为H=U+pV,式中U为物质的内能,p为压力,V为体积。单位质量物质的焓称为比焓,表示为h=u+p/ρ,u为单位质量物质的内能(称为比内能),ρ为密度,1/ρ为单位质量物质的体积。焓具有能量的量纲。一定质量的物质按定压可逆过程由一种状态变为另一种状态,焓的增量便等于在此过程中吸入的热量。
甲烷理化性质与危险特性表
甲烷理化性质及危险特性表 物质名称:甲烷英文名称:methane 危险性类别:第2.1类易燃气体危险货物编号:21007UN编号:1971 物化特性 熔点(℃)-182.5沸点(℃)-161.5溶解性微溶于水,溶于醇、乙醚。 相对密度(空气=1)0.55 饱和蒸气压 (kPa) 53.32(-168.8 ℃) 燃烧热889.5kJ/mol 相对密度(水=1) 0.42(-164 ℃) 外观与气味无色无臭气体。 火灾爆炸危险数据 闪点(℃)-188爆炸极限(%)上限15下限5.3引燃温度(℃)538 临界温度(℃)-82.6临界压力(MPa)4.59燃烧性本品易燃,具窒息 性。 灭火剂雾状水、泡沫、二氧化碳、干粉。 灭火方法切断气源。若不能切断气源,则不允许熄灭泄漏处的火焰。喷水冷却容器,可能的话将容器从火 场移至空旷处。 危险特性易燃,与空气混合能形成爆炸性混合物,遇热源和明火有燃烧爆炸的危险。与五氧化溴、氯气、 次氯酸、三氟化氮、液氧、二氟化氧及其它强氧化剂接触剧烈反应。 反应活性数据 稳定性:稳定聚合危险性:不聚合禁忌物:强氧化剂、氟、氯。有害燃烧产物:一氧化碳、二氧化碳。 健康危害数据 侵入途径吸入、皮肤接触 急性毒性LD50无资料LC50无资料 健康危害 甲烷对人基本无毒,但浓度过高时,使空气中氧含量明显降低,使人窒息。当空气中甲烷达25%~30%时,可引起头痛、头晕、乏力、注意力不集中、呼吸和心跳加速、共济失调。若不及时脱离,可致窒息死亡。皮肤接触液化本品,可致冻伤。 泄漏紧急处理 迅速撤离泄漏污染区人员至上风处,并进行隔离,严格限制出入。切断火源。建议应急处理人员戴自给正压式呼吸器,穿防静电工作服。尽可能切断泄漏源。合理通风,加速扩散。喷雾状水稀释、溶解。构筑围堤或挖坑收容产生的大量废水。如有可能,将漏出气用排风机送至空旷地方或装设适当喷头烧掉。也可以将漏气的容器移至空旷处,注意通风。漏气容器要妥善处理,修复、检验后再用。 运输注意事项: 采用刚瓶运输时必须戴好钢瓶上的安全帽。钢瓶一般平放,并应将瓶口朝同一方向,不可交叉;高度不得超过车辆的防护栏板,并用三角木垫卡牢,防止滚动。运输时运输车辆应配备相应品种和数量的消防器材。装运该物品的车辆排气管必须配备阻火装置,禁止使用易产生火花的机械设备和工具装卸。严禁与氧化剂等混装混运。夏季应早晚运输,防止日光曝晒。中途停留时应远离火种、热源。公路运输时要按规定路线行驶,勿在居民区和人口稠密区停留。铁路运输时要禁止溜放。 储存注意事项: 储存于阴凉、通风的库房。远离火种、热源。库温不宜超过30℃。应与氧化剂等分开存放,切忌混储。采用防爆型照明、通风设施。禁止使用易产生火花的机械设备和工具。储区应备有泄漏应急处理设备。 操作注意事项: 密闭操作,全面通风。操作人员必须经过专门培训,严格遵守操作规程。远离火种、热源,工作场所严禁吸烟。使用防爆型的通风系统和设备。防止气体泄漏到工作场所空气中。避免与氧化剂接触。在传送过程中,钢瓶和容器必须接地和跨接,防止产生静电。搬运时轻装轻卸,防止钢瓶及附件破损。配备相应品种和数量的消防器材及泄漏应急处理设备。 包装类别:O52 包装方法:钢质气瓶。 废弃处置:处置前应参阅国家和地方有关法规。建议用焚烧法处置。 急救措施
焓和熵的介绍
焓(enthalpy),符号H,是一个系统的热力学参数。定义一个系统内: H = U + pV 式子中"H"为焓,U为系统内能,p为其压强,V则为体积。焓不是能量,仅具有能量的量纲,它没有明确的物理意义。焓有下述一些特性: 焓的绝对值无法求得,使用配分函数求出的焓值也不是绝对值。焓是系统的容量性质,与系统内物质的数量成正比。焓是一个状态函数,也就是说,系统的状态一定,焓是值就定了。 单位质量的物质所含有的热量叫作焓. "系统的状态一定,焓值也确定了。" 焓是代表流动工质沿着流动方向往前方传递的总能量(内能、推动功、动能、势能)中,直接取决于热力状态的那部分能量。举例:单位时间内锅炉主蒸汽的热焓-(锅炉给水的热焓+排污水的热焓)/单位时间内进炉煤的低位发热值,就是锅炉的效率啊。引用焓的概念,可使热工计算大为简单,对借助于图解法来研究工质的热力过程更为方便。熵的说明:热量是工质与外界存在温差时所传递的能量,则温度T是传热的推动力,只要工质与外界有微小的温差就能传热,于是相应地也应有某一状态参数的变化来标志有无传热,这个状态参数定名为熵。根据熵的变化,可以判断工质在可逆过程中是吸热、放热,还是绝热。熵的更重要的作用是用以恒量过程的不可逆程度。如:蒸汽经过节流孔板,喷嘴等处可以理 解为等熵绝热过程的。 焓是单位物质所含能量的多少!汽轮机中就是一个焓降的过程,焓降的过程就是对外做功的过程!实际上,哪怕效率非常高的机组,焓降也不会很高,我们为什么不能让焓降更大呢?这就引出了熵,霍金语:“熵是一种新的世界观” 熵的多少代表了我们利用这些能量所需要付出代价的多少。焓降的过程伴随着熵增,当焓降到一定程度,熵会增到一定程度,也就说我们利用这些能所需要的代价越来越高,熵增到一定程度,需要付出的代价已经不划算利用这些能源了!熵是一种代价,它决定了我们不能靠能量守恒定律而尽情挥霍能源。举例,同样参数的汽轮机,背压机组能发电20-30MW,凝气机组能发电100MW,因为我们建立了真 空,付出了循环水的“代价” 熵描述热力学系统的重要态函数之一。熵的大小反映系统所处状态的稳定情况,熵的变化指明热力学过程进行的方向,熵为热力学第二定律提供了定量表述。用符号“S”表示,单位为:j/K 焓(enthalpy),符号H,是一个系统的热力学参数。物理意义:⑴H=U+pV 焓=流动内能+推动功⑵焓表示流动工质所具有的能量中,取决于热力状态的那部分能量定义一个系统内: H = U + pV 式子中"H"为焓,U为系统内能,p为其压强,V则为体积。对于在大气内进行的化学反应,压强一般保持常值,则有ΔH = ΔU + pΔV 规定放热反应的焓取负值。如: SO3(g)+H2O(l)==H2SO4(l);ΔH= -130.3 kJ/mol 表示每生成1 mol H2SO4 放出 130.3 kJ 的热。严格的标准热化学方程式格式: H2(g)+1/2O2(g)==H2O(l) ΔrHθm=-286kJ·mol-1 (θ表示标准态,r 表示反应,m表示1mol反应.含义为标准态下进行一摩尔反应的焓变) 熵熵 shāng entropy 物理意义:物质微观热运动时,混乱程度的标志。热力学中表征物质状态的参量之一,通常用符号S表示。在经典热力学中,可用增量定义为dS=(dQ/T),式中T为物质的热力学温度;dQ为熵增过程中加入物质的热量;下标“可逆”表示加热过程所引起的变化过程是可逆的。若过程是不可逆的,则dS>(dQ/T)不可逆。单位质量物质的熵称为比熵,记为s。熵最初是根据热力学
焓和熵,你必须掌握的知识学习资料
焓和熵, 你必须 掌握的 知识
焓和熵,你必须掌握的知识 焓h印 英语为:enthalpy 在介绍焓之前我们需要了解一下分子热运动、热力学能和热力学第一定律: 1827年,英国植物学家布朗把非常细小的花粉放在水面上并用显微镜观察,发现花粉在水面上不停地运动,且运动轨迹极不规则。起初人们以为是外界影响,如振动或液体对流等,后经实验证明这种运动的的原因不在外界,而在液体内部。原来花粉在水面运动是受到各个方向水分子的撞击引起的。于是这种运动叫做布朗运动,布朗运动表明液体分子在不停地做无规则运动。从实验中可以观察到,布朗运动随着温度的升高而愈加剧烈。这表示分子的无规则运动跟温度有关系,温度越高,分子的无规则运动就越激烈。正因为分子的无规则运动与温度有关系,所以通常把分子的这种运动叫做分子的热运动。 在热学中,分子、原子、离子做热运动时遵从相同的规律,所以统称为分子。 既然组成物体的分子不停地做无规则运动,那么,像一切运动着的物体一样,做热运动的分子也具有动能。个别分子的运动现象(速度大小和方向)是偶然的,但从大量分子整体来看,在一定条件下,它们遵循着一定的统计规律,与热运动有关的宏观量——温度,就是大量分子热运动的统计平均值。分子动能与温度有关,温度越高,分子的平均动能就越大,反之越小。所以从分子动理论的角度看,温度是物体分子热运动的平均动能的标志(即微观含义, 宏观:表示物体的冷热程度)o
分子间存在相互作用力,即化学上所说的分子间作用力(范德华力)。分子间作用力是分子引力与分子斥力的合力,存在一距离r0 使引力等于斥力,在这个位置上分子间作用力为零。分子引力与分子斥力都随分子间距减小而增大,但是斥力的变化幅度相对较大,所以分子间距大于r0 时表现为引力,小于r0时表现为斥力。因为分子间存在相互作用力,所以分子间具有由它们相对位置决定的势能,叫做分子势能。分子势能与弹簧弹性势能的变化相似。物体的体积发生变化时,分子间距也发生变化,所以分子势能同物体的体积有关系。 物体中所有分子做热运动的动能和分子势能的总和叫做物体的热力学能,也叫做内能。热力学能与动能、势能一样,是物体的一个状态量。 初中我们学过,改变物体内能的方式有两个:做功和热传递。一个物体,如果它跟外界不发生热交换,也就是它既没有吸收热量也没有放出热量,则外界对其做功等于其热力学能的增量: AJ仁W 如果物体对外界做功,则W为负值,热力学能增加量△ U1也为负值,表示热力学能减少。 如果外界既没有对物体做功,物体也没有对外界做功,那么物体吸收的热量等于其热力学能的增量: AJ2=Q 如果物体放热,则Q为负值,热力学能增加量△ U2也为负值,表示热力学能减少。 一般情况下,如果物体跟外界同时发生做功和热传递的过程,那么物体热力学能的增量等于外界对物体做功加上物体从外界吸收的热量,即: AJ= AJ1+ AJ2=Q+W 因为热力学能U 是状态量,所以: AJ= AJ末态-A U初态=Q+W 上式即热力学第一定律的表达式。
关于焓和熵的概念
熵和焓的概念 (2008-11-22 15:23:21) 转载 标签: 杂谈 解释 1、焓是物体的一个热力学能状态函数。在介绍焓之前我们需要了解一下分子热运动、热力学能和热力学第一定律: 1827年,英国植物学家布朗把非常细小的花粉放在水面上并用显微镜观察,发现花粉在水面上不停地运动,且运动轨迹极不规则。起初人们以为是外界影响,如振动或液体对流等,后经实验证明这种运动的的原因不在外界,而在液体内部。原来花粉在水面运动是受到各个方向水分子的撞击引起的。于是这种运动叫做布朗运动,布朗运动表明液体分子在不停地做无规则运动。从实验中可以观察到,布朗运动随着温度的升高而愈加剧烈。这表示分子的无规则运动跟温度有关系,温度越高,分子的无规则运动就越激烈。正因为分子的无规则运动与温度有关系,所以通常把分子的这种运动叫做分子的热运动。在热学中,分子、原子、离子做热运动时遵从相同的规律,所以统称为分子。既然组成物体的分子不停地做无规则运动,那么,像一切运动着的物体一样,做热运动的分子也具有动能。个别分子的运动现象(速度大小和方向)是偶然的,但从大量分子整体来看,在一定条件下,他们遵循着一定的统计规律,与热运动有关的宏观量——温度,就是大量分子热运动的统计平均值。分子动能与温度有关,温度越高,分子的平均动能就越大,反之越小。所以从分子动理论的角度看,温度是物体分子热运动的平均动能的标志(即微观含义,宏观:表示物体的冷热程度)。分子间存在相互作用力,即化学上所说的分子间作用力(范德华力)。分子间作用力是分子引力与分子斥力的合力,存在一距离r0使引力等于斥力,在这个位置上分子间作用力为零。分子引力与分子斥力都随分子间距减小而增大,但是斥力的变化幅度相对较大,所以分子间距大于r0时表现为引力,小于r0时表现为斥力。因为分子间存在相互作用力,所以分子间具有由它们相对位置决定的势能,叫做分子势能。分子势能与弹簧弹性势能的变化相似。物体的体积发生变化时,分子间距也发生变化,所以分子势能同物体的体积有
Methane sat(甲烷饱和温度对照表)
REFPROP Version 8.02014-2-18 11:22:56 2: methane: V/L sat. p=10.0 to 4600.0 kPa Liquid Vapor Liquid Vapor Temperature Pressure Density Density Enthalpy Enthalpy (C)(kPa)(kg/m^3)(kg/m^3)(kJ/kg)(kJ/kg) 1-178.0720.000445.600.41051-57.001480.94 2-174.4430.000440.660.59543-44.661487.81 3-171.6740.000436.840.77503-35.222492.94 4-169.4150.000433.690.95080-27.465497.05 5-167.4860.000430.97 1.1236-20.821500.50 6-165.7970.000428.57 1.2940-14.973503.48 7-164.2880.000426.40 1.4625-9.7265506.10 8-162.9090.000424.42 1.6293-4.9513508.44 9-161.64100.00422.59 1.7946-0.55734510.56 10-160.48110.00420.88 1.9587 3.5214512.50 11-159.39120.00419.28 2.12167.3347514.28 12-158.37130.00417.77 2.283610.921515.93 13-157.41140.00416.34 2.444614.310517.46 14-156.49150.00414.98 2.604917.528518.90 15-155.63160.00413.67 2.764420.593520.25 16-154.80170.00412.42 2.923323.522521.52 17-154.01180.00411.22 3.081626.330522.72 18-153.26190.00410.06 3.239329.028523.86 19-152.53200.00408.95 3.396631.626524.94 20-151.83210.00407.87 3.553334.133525.97 21-151.15220.00406.82 3.709736.557526.95 22-150.50230.00405.80 3.865638.903527.89 23-149.87240.00404.81 4.021241.179528.79 24-149.25250.00403.85 4.176543.389529.65 25-148.66260.00402.91 4.331445.538530.47 26-148.08270.00402.00 4.486147.630531.27 27-147.52280.00401.10 4.640549.668532.03 28-146.97290.00400.23 4.794751.657532.77 29-146.44300.00399.38 4.948653.598533.48 30-145.92310.00398.54 5.102455.495534.16 31-145.41320.00397.72 5.255957.351534.82 32-144.91330.00396.91 5.409359.167535.46 33-144.42340.00396.12 5.562560.945536.08 34-143.95350.00395.35 5.715662.688536.67 35-143.48360.00394.59 5.868664.398537.25 36-143.03370.00393.84 6.021466.075537.81 37-142.58380.00393.10 6.174167.723538.36 38-142.14390.00392.38 6.326769.341538.89 39-141.71400.00391.66 6.479270.931539.40 40-141.29410.00390.96 6.631772.494539.89 41-140.88420.00390.26 6.784174.033540.38 42-140.47430.00389.58 6.936475.547540.85 43-140.07440.00388.917.088777.037541.30 44-139.68450.00388.247.240978.506541.75 45-139.29460.00387.587.393179.952542.18 46-138.91470.00386.947.545381.378542.60 47-138.53480.00386.297.697482.784543.01 48-138.16490.00385.667.849584.171543.41 49-137.80500.00385.048.001685.540543.79 50-137.44510.00384.428.153886.890544.17 51-137.09520.00383.818.305988.224544.54 52-136.74530.00383.208.458089.540544.90 53-136.39540.00382.608.610290.841545.25 54-136.05550.00382.018.762392.126545.59 55-135.72560.00381.428.914593.396545.92 56-135.39570.00380.849.066894.651546.25
