理想气体的定压比热容
(fb212型气体比热容比的测定)实验讲义
(FB212型气体比热容比测定仪)实验讲义 气体比热容比的测定 比热容是物质的重要参量,在研究物质结构、确定相变、鉴定物质纯度等方面起着重要 的作用。本实验将介绍一种较新颖的测量气体比热容的方法。 【实验目的】 测定空气分子的定压比热容与定容比热容之比γ值。 【实验原理】 气体的定压比热容P C 与定容比热容V C 之比 V P C /C =γ,在热力学过程特别是绝热过程中是一个 很重要的参数,测定的方法有好多种。这里介绍一种较新颖的方法,通过测定物体在特定容器中的振动周期来计算γ值。实验基本装置如图1所示,振动物体小球D 的直径比玻璃諧振腔E 直径仅小mm 02.0~01.0 。它能在此精密的玻璃諧振腔E 中上下移动,在储气瓶A 的壁上有一充气孔B ,并插入一根细管,通过它各种气体可 以注入到储气瓶A 中。 钢球D 的质量为m ,半径为 r (直径为d ),当瓶子内压力P 满足下面条件时,钢球 D 处于力平衡状态,这时2 L m g P P r π?=+ ?,式中L P 为大气压强 。为了补偿由于空气阻尼引起振动物体D 振幅的衰减,通过B 管不断注入一个小气压的气流,在精密玻璃諧振腔E 的中央开设有一个小孔C 。当振动物体A 处于小孔下方的半个振动周期时,注入气体使储气瓶A 内压力增大,引起物体D 向上移动,而当物体D 处于小孔上方的半个振动周期时,容器内的气体将通过小孔流出,使储气瓶A 内压力减小从而使物体D 下沉。以后重复上述过程,只要适当控制注入气体的流量,物体D 能在玻璃諧振腔E 的小孔C 上下作简谐振动,振动周 期可利用光电计时装置来测得。 若物体偏离平衡位置一个较小距离dx ,则容器内的压力变化dp ,物体的运动方程为:
理想气体基本热力过程要点
理想气体的基本热力过程 热力设备中,热能与机械能的相互转化,通常是通过气态工质的吸热、膨胀、放热、压缩等热力过程来实现的。 实际的热力过程都很复杂,而且几乎都是非平衡、非可逆的过程。但若仔细观察会发现,某些常见过程非常近似一些简单的可逆过程。 常见的主要有四种简单可逆过程-基本热力过程,指系统某一状态参数保持不变的可逆过程。 包括定容过程、定压过程、定温过程和绝热过程。 我们以1kg理想气体的闭口系统为例来分析这几种基本热力过程,分析方法包括5点: (1)依据过程特点建立过程方程式; (2)由过程方程和理想气体状态方程确定初、终态基本状态参数之间的关系,即P1、v1、T1和P2、v2、T2之间的关系; (3)绘制过程曲线; 我们主要绘制两种坐标图P-v图和T-s图,因为P-v图上可以表示过程中做功量的多少,而T-s图上可以表示过程中吸收或放出热量的多少; (4)分析计算△u,△h,△s; (5)分析计算过程的热量q和功w。 一、定容过程 定容过程即工质的容积在整个过程中维持不变,dv=0,通常是一定量的气体在刚性容器中进行定容加热或定容放热。 (1)依据过程特点建立过程方程式 定容过程的特点是体积保持不变,所以建立过程方程式: v=常数; 或dv=0 或v1=v2 (2)由过程方程和理想气体状态方程确定初、终态基本状态参数之间的关系 过程方程式:v1=v2
理想气体状态方程:112212 Pv P v T T = 由以上两个方程可以得到初末基本状态参数之间的关系: 122211 v v P T P T =???=?? 即定容过程中工质的压力与温度成正比。 (3)绘制过程曲线; 定容过程有两种情况:定容加热和定容放热。 (4)分析计算△u ,△h ,△s ; 2211 v v u u u c dT c T ?=-==?? 2 211p p h h h c dT c T ?=-==?? 222111 ln ln ln p v v v P P s c c c v P P ?=+=或222111ln ln ln v v T v T s c R c T v T ?=+= (5)分析计算过程的热量q 和功w 。 容积变化功:2 10w Pdv ==? 根据q=△u+w 可得: v q u c T =?=? 总结:定容过程中系统与外界无容积变化功,加给工质的热量全部用于增加工质的热力学能,而没有热能与机械能的转化。
一气体定压比热容测定
工程热力学实验 指导书 哈尔滨理工大学 热能与动力工程实验室
实验一 气体定压比热容测定实验 一.实验目的 1. 了解气体比热测定装置的基本原理和构思。 2. 熟悉本实验中测温、测压、测热、测流量的方法。 3. 掌握由基本数据计算出比热值和比热公式的方法。 4. 分析本实验产生误差的原因及减小误差的可能途径。 二.实验原理 引用热力学第一定律解析式,对可逆过程有: pdv du q +=δ 和 vdp dh q -=δ 定压时0=dp p p T h dT vdp dh dT q c ??? ????=??? ??-=??? ??=δ 此式直接由p c 的定义导出,故适用于一切工质。 在没有对外界作功的气体的等压流动过程中: p Q m dh δ1= 则气体的定压比热容可以表示为: ()122 1t t m Q c p t t pm -= kJ/kg ?℃ 式中:m ——气体的质量流量,kg/s ; p Q ——气体在等压流动过程中的吸热量,kJ/s 。 由于气体的实际定压比热是随温度的升高而增大,它是温度的复杂函数。实验表明,理想气体的比热与温度之间的函数关系甚为复杂,但总可表达为: +++=2et bt a c p 式中a 、b 、e 等是与气体性质有关的常数。在离开室温不很远的温度范围内,空气的定压比热容与温度的关系可近似认为是线形的,假定在0-300℃之间,空气真实定压比热与温度之间进似地有线性关系: bt a c p += 则温度由1t 至2t 的过程中所需要的热量可表示为:
()dt bt a q t t ?+=2 1 由1t 加热到2t 的平均定压比热容则可表示为: ()2211 22121t t b a t t dt bt a c t t t t pm ++=-+=? 若以(t 1+t 2)/2为横坐标,21t t pm c 为纵坐标(如下图所示),则可根据不同温度范 围的平均比热确定截距a 和斜率b,从而得出比热随温度变化的计算式bt a +。 大气是含有水蒸气的湿空气。当湿空气气流由温度1t 加热到2t 时,其中水蒸气的吸热量可用式下式计算: ()dt t m Q t t w w ?+=2 10001172.0844.1 式中:w m ——气流中水蒸气质量,kg/s 。 则干空气的平均定压比热容由下式确定: ()()1212)(')(21t t m m Q Q t t m m Q c w w p w p t t pm ---=--= 式中:'p Q ——为湿空气气流的吸热量。 三.实验设备
空气比定压热容的测定
气比定压热容的测定 一、实验目的 (1)了解比热容测定装置的设备组成及各设备的作用,掌握比热容测定方法。 (2)掌握本实验中的温度、压力、流量、热量等的测定方法。 (3)掌握计算比热值和求得比热容公式的方法,并计算空气的比定压热容。 (4)列表示平均比热容与温度的关系,并用方程表示。 二、实验原理 实验台通过在定压条件下加热空气,根据空气温度的变化和流量的大小测出空气的定压比热容,即根据()()[]K kg /kJ 1221?-=t t m Q c p t t p 确定,式中:m 为气体 的质量流量,kg/s ;p Q 为气体在等压流动过程中的吸热量,kJ/s 。 在距室温不很远的温度围,空气的比定压热容与温度的关系可近似认为是线性的,即可近似表示为bt a c p +=,由1t 加热到2t 的平均比热容为 2 )(21122121t t b a t t bt a c t t t t p ++=-+=?,因此,若以221t t +为横坐标,p c 为纵坐标,则可根据不同温度围的平均比热容确定截距a 和斜率 b ,从而得出比热容随温度变化的近似关系式。 (1)空气中水蒸气容积成分iv ?的确定。大气是含有水蒸气的湿空气,当湿 空气的温度由1t 加热到2t 时,根据布置在流量计出口的干湿球温度计读数t 、 w t ,从干湿球温度计的湿度表中查的空气的相对湿度?,再由?和干球温度t 从湿空气的焓湿图查出含湿量d ,则可用下式计算出空气中水蒸气的容积成分(也称为体积分数) %100622/1622/iv ?+=d d ? 式中:d 为含湿量,g (水蒸气)/kg (干空气)。 (2)湿空气的吸热量p Q 的确定。当比热议出口空气温度稳定时,湿空气吸收的热量即为电热器消耗的电功率。功率的测定方法有两种,一种是根据测量的电压和电流计算;另一种由功率表直接测量。吸热量的单位为kJ/s 。 (3)干空气质量流量m 的确定 ) (15.27305.287/1000/10)1()8.9(iv 0+??-??+==t h p T R V p m a a a a τ? 式中:0p 为当地的大气压力,Pa ;a p 为干空气的压力,Pa ;a V 为干空气的体积,
实验一 空气定压比热容测定
实验一 空气定压比热容测定 一、实验目的 1.增强热物性实验研究方面的感性认识,促进理论联系实际,了解气体比热容测定的基本原理和构思。 2.学习本实验中所涉及的各种参数的测量方法,掌握由实验数据计算出比热容数值和比热容关系式的方法。 3.学会实验中所用各种仪表的正确使用方法。 二、实验原理 由热力学可知,气体定压比热容的定义式为 ( )p p h c T ?=? (1) 在没有对外界作功的气体定压流动过程中,p dQ dh M =, 此时气体的定压比热容可表示 为 p p T Q M c )(1??= (2) 当气体在此定压过程中由温度t 1被加热至t 2时,气体在此温度范围内的平均定压比热容可由下式确定 ) (1221 t t M Q c p t t pm -= (kJ/kg ℃) (3) 式中,M —气体的质量流量,kg/s; Q p —气体在定压流动过程中吸收的热量,kJ/s 。 大气是含有水蒸汽的湿空气。当湿空气由温度t 1被加热至t 2时,其中的水蒸汽也要吸收热量,这部分热量要根据湿空气的相对湿度来确定。如果计算干空气的比热容,必须从加热给湿空气的热量中扣除这部分热量,剩余的才是干空气的吸热量。 低压气体的比热容通常用温度的多项式表示,例如空气比热容的实验关系式为 3 16 2 7 4 10 87268.410 02402.410 76019.102319.1T T T c p ---?-?+?-=(kJ/kgK) 式中T 为绝对温度,单位为K 。该式可用于250~600K 范围的空气,平均偏差为0.03%,最大偏差为0.28%。 在距室温不远的温度范围内,空气的定压比热容与温度的关系可近似认为是线性的,即可近似的表示为 Bt A c p += (4) 由t 1加热到t 2的平均定压比热容则为 m t t t t pm Bt A t t B A dt t t Bt A c +=++=-+= ? 2 2 11 22 1 2 1 (5) 这说明,此时气体的平均比热容等于平均温度t m = ( t 1 + t 2 ) / 2时的定压比热容。因此,可以对某一气体在n 个不同的平均温度t m i 下测出其定压比热容c p m i ,然后根据最小二乘法原理,确定
1空气定压比热的测定
实验一空气定压比热的测定 气体定压比热的测定是工程热力学的基本实验之一。实验中涉及温度、压力、热量(电功)、流量等基本量的测量;计算中用到比热及混合气体(湿空气)的方面的基本知识。 一、实验目的 1、了解比热测定装置的基本原理和构思。 2、熟悉本实验中的测温、测压、测热量、测流量的方法。 3、掌握由基本数据计算出比热值和求得比热公式的方法。 4、增加热物性研究方面得感性认识,促进理论联系实际。 5、分析本实验产生误差得原因及减小误差得可能途径。 二、原理及计算 气体定压比热的定义为,在没有对外界做功的气体等压流动过程中, 则气体的热容可表示为。当气体在此等压过程中,由温度t1加热到温度t2时,气体在此温度范围内的平均定压比热值可由下式确定 kJ/kg.K,即单位质量的工质温度升高一度时所吸收的热量。 式中: m—气体的质量流量。㎏/s Qp—气体在等压流动过程中的吸热量。kJ/s 大气是含有水蒸汽的湿空气,当湿空气的温度由t1加热到温度t2时,根据流量计出口空气的干湿球温度计读数,可从湿空气的焓湿图查出含湿量d(即比湿度ω)克/千克干空气,并根据下式计算出水蒸汽的容积成分: 电热器消耗的电功率可由电压和电流的乘积计算。如要考虑电表的内耗,应扣除毫安表的内耗。设毫安表的内阻为RmA欧(Ω),则可得电热器单位时间放出的热量:
J/s 也可由功率表直接读出。 干空气流量(质量流量)为: = ㎏/s 水蒸汽的流量(质量流量)为: =㎏/s 水蒸汽吸收的热量为: = = = J/s 干空气的定压比热为: J/㎏.K 由以上计算过程可以看出,要测量计算气体的定压比热Cpm,需要测定的有关量分别是:
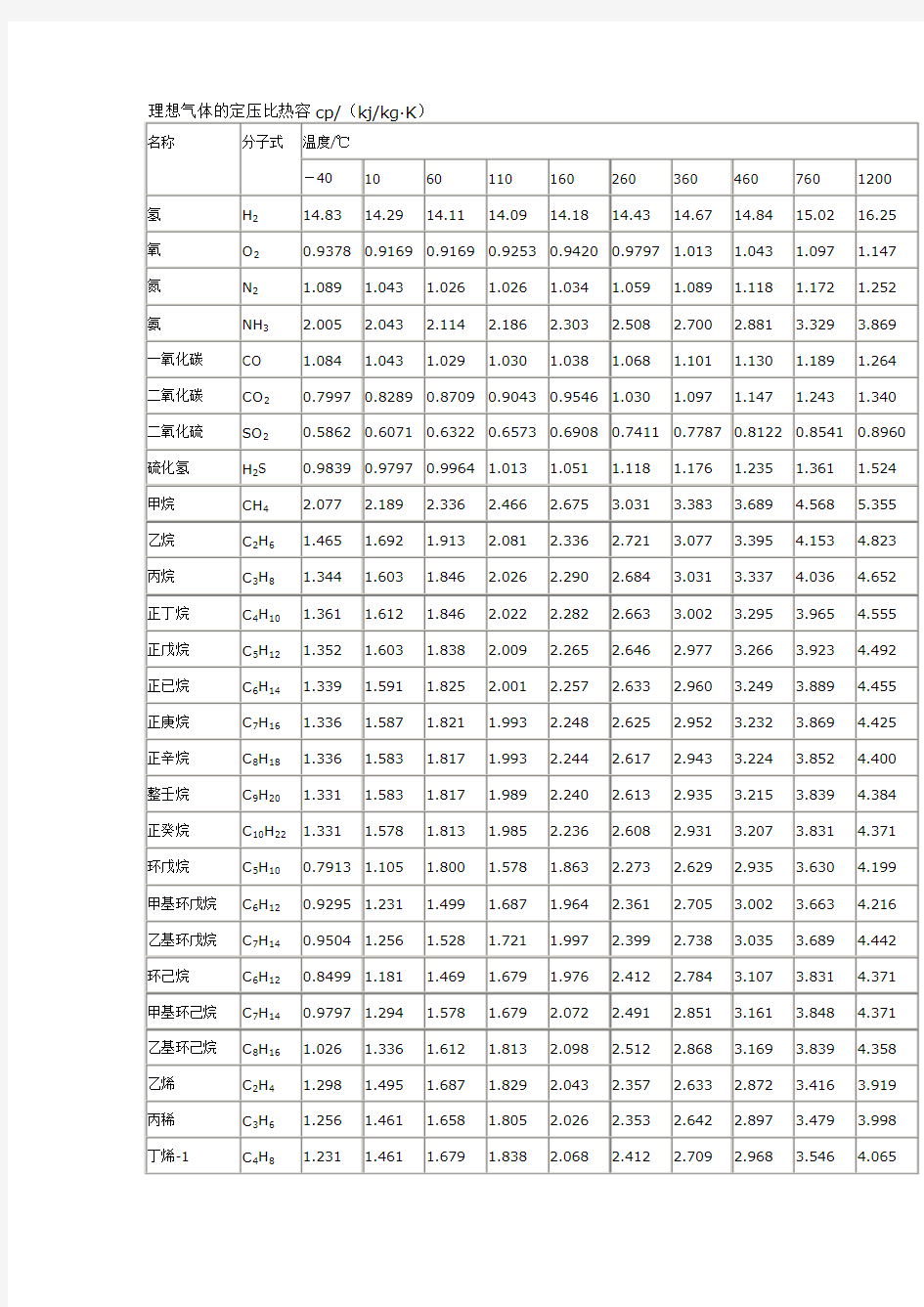
理想气体的定压比热容cp
理想气体的定压比热容cp/(kj/kg·K) 名称分子式温度/℃ -40 10 60 110 160 260 360 460 760 1200 氢H214.83 14.29 14.11 14.09 14.18 14.43 14.67 14.84 15.02 16.25 氧O20.9378 0.9169 0.9169 0.9253 0.9420 0.9797 1.013 1.043 1.097 1.147 氮N2 1.089 1.043 1.026 1.026 1.034 1.059 1.089 1.118 1.172 1.252 氨NH3 2.005 2.043 2.114 2.186 2.303 2.508 2.700 2.881 3.329 3.869 一氧化碳CO 1.084 1.043 1.029 1.030 1.038 1.068 1.101 1.130 1.189 1.264 二氧化碳CO20.7997 0.8289 0.8709 0.9043 0.9546 1.030 1.097 1.147 1.243 1.340 二氧化硫SO20.5862 0.6071 0.6322 0.6573 0.6908 0.7411 0.7787 0.8122 0.8541 0.8960 硫化氢H2S 0.9839 0.9797 0.9964 1.013 1.051 1.118 1.176 1.235 1.361 1.524 甲烷CH4 2.077 2.189 2.336 2.466 2.675 3.031 3.383 3.689 4.568 5.355 乙烷C2H6 1.465 1.692 1.913 2.081 2.336 2.721 3.077 3.395 4.153 4.823 丙烷C3H8 1.344 1.603 1.846 2.026 2.290 2.684 3.031 3.337 4.036 4.652 正丁烷C4H10 1.361 1.612 1.846 2.022 2.282 2.663 3.002 3.295 3.965 4.555 正戊烷C5H12 1.352 1.603 1.838 2.009 2.265 2.646 2.977 3.266 3.923 4.492 正已烷C6H14 1.339 1.591 1.825 2.001 2.257 2.633 2.960 3.249 3.889 4.455 正庚烷C7H16 1.336 1.587 1.821 1.993 2.248 2.625 2.952 3.232 3.869 4.425 正辛烷C8H18 1.336 1.583 1.817 1.993 2.244 2.617 2.943 3.224 3.852 4.400 整壬烷C9H20 1.331 1.583 1.817 1.989 2.240 2.613 2.935 3.215 3.839 4.384 正癸烷C10H22 1.331 1.578 1.813 1.985 2.236 2.608 2.931 3.207 3.831 4.371 环戊烷C5H100.7913 1.105 1.800 1.578 1.863 2.273 2.629 2.935 3.630 4.199 甲基环戊烷C6H120.9295 1.231 1.499 1.687 1.964 2.361 2.705 3.002 3.663 4.216 乙基环戊烷C7H140.9504 1.256 1.528 1.721 1.997 2.399 2.738 3.035 3.689 4.442 环己烷C6H120.8499 1.181 1.469 1.679 1.976 2.412 2.784 3.107 3.831 4.371 甲基环己烷C7H140.9797 1.294 1.578 1.679 2.072 2.491 2.851 3.161 3.848 4.371 乙基环己烷C8H16 1.026 1.336 1.612 1.813 2.098 2.512 2.868 3.169 3.839 4.358 乙烯C2H4 1.298 1.495 1.687 1.829 2.043 2.357 2.633 2.872 3.416 3.919 丙稀C3H6 1.256 1.461 1.658 1.805 2.026 2.353 2.642 2.897 3.479 3.998 丁烯-1 C4H8 1.231 1.461 1.679 1.838 2.068 2.412 2.709 2.968 3.546 4.065 戊烯-1 C5H10 1.269 1.499 1.712 1.871 2.106 2.449 2.747 3.006 3.588 4.099 己烯-1 C6H12 1.277 1.507 1.725 1.884 2.123 2.466 2.767 3.031 3.613 4.124 庚烯-1 C7H14 1.281 1.516 1.733 1.897 2.135 2.483 2.784 3.048 3.630 4.141 辛烯-1 C8H16 1.285 1.520 1.742 1.905 2.144 2.491 2.797 3.061 3.643 4.153 环戊烯0.7704 1.038 1.281 1.453 1.699 2.060 2.369 2.642 3.249 3.726
气体定压比热测定
1 干气体定压比热测定实验 干气体定压比热的测定是工程热力学的基本实验之一。实验中涉及温度、压力、热量(电功)、流量等基本量的测量;计算中用到比热及混合气体(混空气)方面的知识。 一、实验目的 1. 了解实验装置的基本原理和结构。 2. 熟悉温度、压力、热量、流量等基本量的测量方法。 3. 掌握由基本数据计算出比热值和求得比热公式的方法。 4. 分析产生误差的原因及减小误差的途径。 二、实验原理 本实验测定的是干空气的定压质量比热P C ,而不是定压容积比热P C ¢。 P C :P =const 时,1kg 气体温度升高1K 时所吸收的热量,kJ/(kg K) ; P C :P =const '时,1Nm 3气体温度升高1K 时所吸收的热量,kJ/(kg K) 。 根据定义,对于1kg 工质, P q C t = D kJ/(kg K) (1) 对于mkg 工质, P Q C m t = D kJ/(kg K) (2) 在这里我们所求的就是干空气的定压质量比热P C ,“干”用下标“g ”表示,即 g P g Q C m t = D kJ/(kg K) (3) 各参数值的测定如下: (1)t ?测定:我们将一定流量的气体通入比热仪,在比热仪中队气体进行加热后气体流出。这样,气体进入比热仪与流出比热仪就存在了温度差t ?,只要我们在比热仪进口设置温度计1t 和出口设置温度计2t ,即可求出21-t t t ?=。 (2)g m 的测定:由于干空气的质量不好测定,我们可以测定空气的质量流量g m kg/s ,干空气符合理想气体定律: g g g P V m R T = kg/s (4) 分母上,g R 为干空气的气体常数,287J/(kg K)g R = ; 0T 为干空气热力学温度,00(273.15)T t K =+ 分子上,g P 为空气中干空气的分压力,根据道尔顿分压定律,
实验 气体定压比热测定
实验 气体定压比热测定 一、实验目的 1. 了解气体比热测定装置的基本原理和装置结构。 2. 熟悉本实验中温度、压力、热量、流量的测量方法。 3. 掌握由测量数据计算定压比热的方法。 4. 分析本实验中误差产生的原因及减小误差的可能途径。 二、实验原理 根据定压比热的概念,气体在t ℃时的定压比热表示为 p dq c dt = (1) 当式(1)的温度间隔dt 为无限小时,p c 即为某一温度t 时气体的真实定压比热(由于气体的定压比热随温度的升高而增大,所以在给出定压比热的数值时,必须指明是哪个温度下的定压比热)。如果已得出()p c f t =的函数关系,温度由1t 至2t 的过程中所需要的热量即可按下式求得: 22 21 1 ()d p q c dt a bt ct t ==+++?? (2) 上式采用逐项积分来求热量十分复杂。在本实验的温度测量范围内(不高于300℃),空气的定压比热与温度的关系可近似认为是线性,即可表示为: p c a bt =+ (3) 则温度由1t 至2t 的过程中所需要的热量可表示为: ()2 1 d t t q a bt t =+? (4) 由1t 加热到2t 的平均定压比热容则可表示为: ()2 1 2 1 1 2 21 d 2 t t t p t a bt t t t c a b t t ++==+-? (5) 实验中,通过实验装置是湿空气,当湿空气气流由温度1t 加热到2t 时,其中水蒸气的吸热量可用式(4)计算,其中 1.833a =,0.0003111b =,则水蒸气的吸热量为: ()2 1 w w 1.8330.0003111d t t Q m t t =+? ()() 22 w 21211.8330.0001556kJ/s m t t t t ??=-+-?? (6) 式中:w m ——气流中水蒸气质量,kg/s 。 则干空气的平均定压比热容由下式确定: () () 2 1 w w 21w 21()()p p t pm t Q Q Q c m m t t m m t t '-= = ---- (7)
空气比热容比的测定
空气比热容比的测定 气体的定压比热容与定容比热容之比称为气体的绝热指数,它是一个重要的热力学常数,在热力学方程中经常用到,本实验用新型扩散硅压力传感器测空气的压强,用电流型集成温度传感器测空气的温度变化,从而得到空气的绝热指数;要求观察热力学现象,掌握测量空气绝热指数的一种方法,并了解压力传感器和电流型集成温度传感器的使用方法及特性。 【预习重点】 1.了解理想气体物态方程,知道理想气体的等温及绝热过程特征和过程方程。 2.预习定压比热容与定容比热容的定义,进而明确二者之比即绝热指数的定义。 3.认真预习实验原理及测量公式。 【实验目的】 1.用绝热膨胀法测定空气的比热容比。 2.观测热力学过程中状态变化及基本物理规律。 3.了解压力传感器和电流型集成温度传感器的使用方法及特性。 【实验原理】 理想气体的压强P 、体积V 和温度T 在准静态绝热过程中,遵守绝热过程方程:PV γ 等于恒量,其中γ是气体的定压比热容P C 和定容比热容V C 之比,通常称γ=V P C C /为该气体的比热容比(亦称绝热指数)。 如图1所示,我们以贮气瓶内空气(近似为理想气体)作为研究的热学系统,试进行如下实验过程。 (1)首先打开放气阀A ,贮气瓶与大气相通,再关闭A ,瓶内充满与周围空气同温(设为0T )同压(设为0P )的气体。 (2)打开充气阀B ,用充气球向瓶内打气,充入一定量的气体,然后关闭充气阀B 。此时瓶内空气被压缩,压强增大,温度升高。等待内部气体温度稳定,即达到与周围温度平衡,此时的气体处于状态I (1P ,1V ,0T )。 (3)迅速打开放气阀A ,使瓶内气体与大气相通,当瓶内压强降至0P 时,立刻关闭放气阀A ,将有体积为ΔV 的气体喷泻出贮气瓶。由于放气过程较快,瓶内保留的气体来不及与外界进行热交换,可以认为是一个绝热膨胀的过程。在此过程后瓶中的气体由状态I (1P ,1V ,0T )转变为状态II (0P ,2V ,1T )。2V 为贮气瓶容积,1V 为保留在瓶中这部分气体 在状态I (1P ,0T )时的体积。 (4)由于瓶内气体温度1T 低于室温0T ,所以瓶内气体慢慢从外界吸热,直至达到室温 图1 实验装置简图
空气比热容比的测量实验报告
南昌大学物理实验报告课程名称:普通物理实验(2) 实验名称:空气比热容比的测量 学院:专业班级: 学生姓名:学号: 实验地点:座位号: 实验时间:
一、 实验目的: 1. 学习用绝热膨胀法测定空气的比热容比。 2. 观察热力学过程中状态变化及基本物理规律。 3. 学习气体压力传感器和电流型集成温度传感器的原理及使用方法。 二、 实验仪器: 气压计、FD-TX-NCD 空气比热容测定仪。 三、 实验原理: 遵循两条基本原则:其一是保持系统为孤立系统;其二是测量一个系统 的状态参量时,应保证系统处于平衡态。 气体的定压比热容P C 和定容比热容V C 之比称为气体的比热容比,用符号γ 表示(即p V C C γ=),又称气体的绝热系数。 如图所示,实验开始时,首先打开活塞C2,储气瓶与大气相通,当瓶内充满与周围空气同压强同温度的气体后,再关闭活塞C2。 打开充气活塞C1,将原处于环境大气压强为0p 、室温为0T 的空气,用打气球从活塞C1处向瓶内打气,充入一定量的气体,然后关闭充气活塞C1。此时瓶内空气被压缩而压强增大,温度升高,等待瓶内气体温度稳定,即达到与周围温度平衡。此时的气体处于状态I(1p ,1V ,0T ),其中1V 为储气瓶容积。 然后迅速打开放气阀门C2,使瓶内空气与周围大气相通,瓶内气体做绝热膨胀,将有一部分体积为V ?的气体喷泻出储气瓶。当听不见气体冲出的声音,即瓶内压强为大气压强0p ,瓶内温度下降到1T (1T <0T ),此时,立即关闭放气阀门C2,。由于放气过程较快,瓶内保留的气体由状态I(1p ,1V ,0T )转变为状态II (0p ,2V ,1T )。
气体定压比热容的测定
气体定压比热容的测定 测定气体定压比热容的基本测量项目,是测量巳知流量的气体的吸热量(或放热量)和温度变化值。基本方法可以分为两类。一类称为混合法,即预先将气体加热,让它流过量热器时受冷却(达到与量热器热平衡),由量热器测定气体的放热量。另一类称为定流法,即让气体流过量热器时被加热,由量热器测定气体的吸热量,因此,除了要准确测定气体在量热器人口和出口的温度之外,还必须仔细消除量热器热损失的影响或确定它的修正值,才能准确地测定气体的吸热量或放热量.本实验采用定流法测定空气的平均定压比热容。 一、实验原理 气体的定压比热容定义为 p p T h c ??? ????= (2-1) 在没有对外界作功的气体的等压流动过程中,p dQ m dh 1=, 则气体的定压比热容可以表示为 p p T Q m c )(1??= (2-2) 当气体在此等压过程中由温度t 1加热至温度t 2时,气体在此温度范围内的平均定压比热容值可以由下式确定: )(1221t t m Q c p t t pm -= kJ/(kg ·℃) (2-3) 式中,m —— 气体的质量流量kg/s ; Q P —— 气体在等压流动过程中的吸热量,kJ/s 低压气体的定压比热容通常用温度的多项式表示,例如下面空气的定压比热容的实验关系式: c P = 1.02319-1.76019×10-4T+4.02402×l0-7T 2 -4.87268×lO -10T 3 kJ/(kg ·K ) 式中T 为绝对温度,K 。该式用于250~600 K ,平均偏差为0.03%,最大偏差为0.28%。 在离开室温不很远的温度范圈内,空气的定压比热容与温度的关系可近似认为是线性的,即可近似表示为 bt a c p += (2-4) 由t 1加热到t 2的平均定压比热容则表示为 2)(21122121t t b a t t dt bt a c t t t t pm ++=-+=? (2-5) 大气是含有水蒸气的湿空气,当湿空气气流由温度t 1加热到t 2时,其中水蒸气的吸热量可用下式计算:
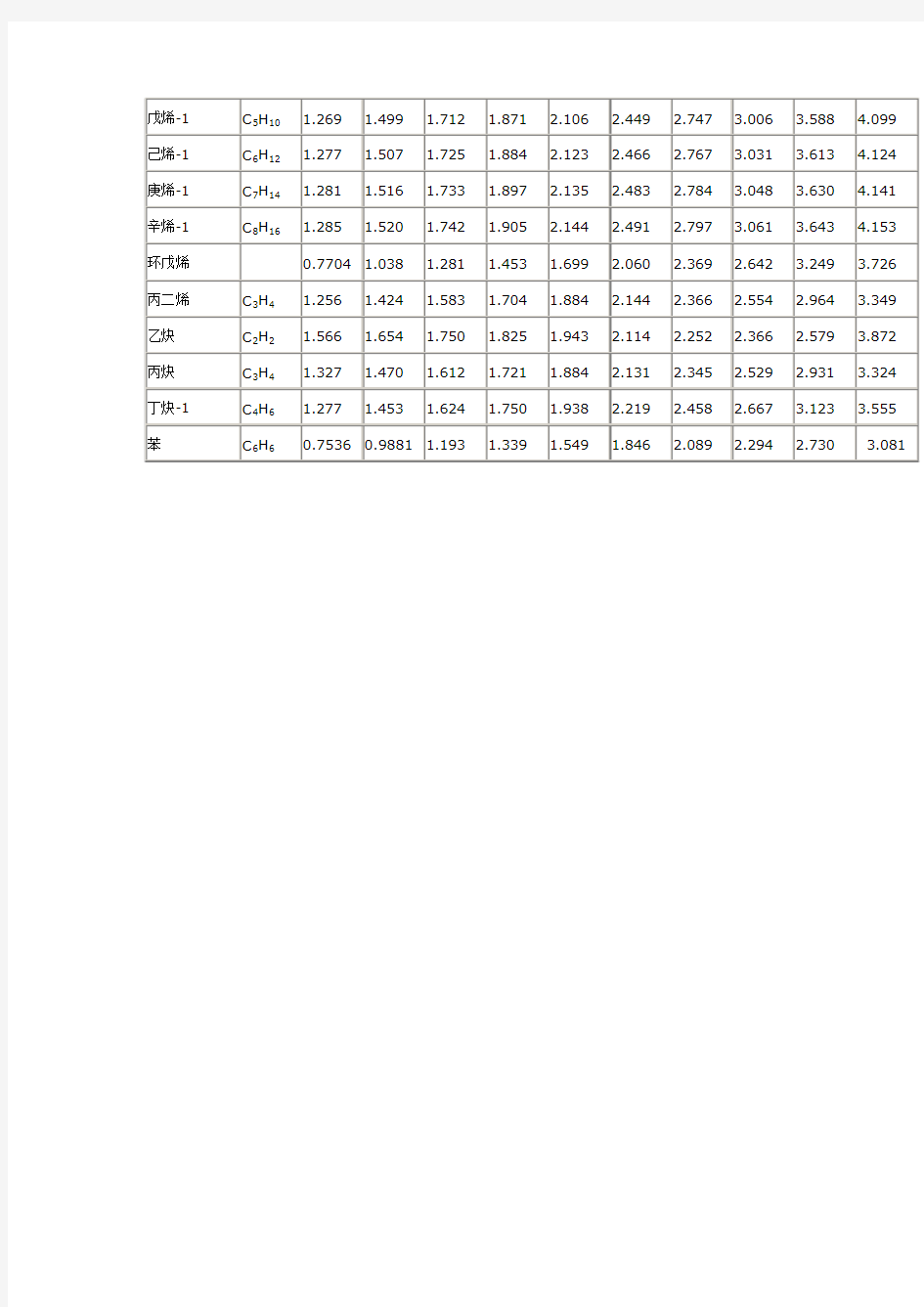
理想气体定压比热容
理想气体的定压比热容cp/(kJ/kg·K) 名称分子式温度/℃ -40 10 60 110 160 260 360 460 760 1200 氢H 14.83 14.29 14.11 14.09 14.18 14.43 14.67 14.84 15.02 16.25 2 氧O 0.9378 0.9169 0.9169 0.9253 0.9420 0.9797 1.013 1.043 1.097 1.147 2 氮N 1.089 1.043 1.026 1.026 1.034 1.059 1.089 1.118 1.172 1.252 2 氨NH 2.005 2.043 2.114 2.186 2.303 2.508 2.700 2.881 3.329 3.869 3 一氧化碳CO 1.084 1.043 1.029 1.030 1.038 1.068 1.101 1.130 1.189 1.264 二氧化碳CO 0.7997 0.8289 0.8709 0.9043 0.9546 1.030 1.097 1.147 1.243 1.340 2 二氧化硫SO 0.5862 0.6071 0.6322 0.6573 0.6908 0.7411 0.7787 0.8122 0.8541 0.8960 2 硫化氢H S 0.9839 0.9797 0.9964 1.013 1.051 1.118 1.176 1.235 1.361 1.524 2 甲烷CH 2.077 2.189 2.336 2.466 2.675 3.031 3.383 3.689 4.568 5.355 4 乙烷C H6 1.465 1.692 1.913 2.081 2.336 2.721 3.077 3.395 4.153 4.823 2 丙烷C H8 1.344 1.603 1.846 2.026 2.290 2.684 3.031 3.337 4.036 4.652 3 正丁烷C H10 1.361 1.612 1.846 2.022 2.282 2.663 3.002 3.295 3.965 4.555 4 正戊烷C H12 1.352 1.603 1.838 2.009 2.265 2.646 2.977 3.266 3.923 4.492 5 正已烷C H14 1.339 1.591 1.825 2.001 2.257 2.633 2.960 3.249 3.889 4.455 6 正庚烷C H16 1.336 1.587 1.821 1.993 2.248 2.625 2.952 3.232 3.869 4.425 7 正辛烷C H18 1.336 1.583 1.817 1.993 2.244 2.617 2.943 3.224 3.852 4.400 8 整壬烷C H20 1.331 1.583 1.817 1.989 2.240 2.613 2.935 3.215 3.839 4.384 9 正癸烷C H22 1.331 1.578 1.813 1.985 2.236 2.608 2.931 3.207 3.831 4.371 10 环戊烷C H100.7913 1.105 1.800 1.578 1.863 2.273 2.629 2.935 3.630 4.199 5 甲基环戊烷C H120.9295 1.231 1.499 1.687 1.964 2.361 2.705 3.002 3.663 4.216 6
理想气体比热、内能、焓和熵
理想气体的比热和热量 为了计算在状态变化过程中的吸热量和放热量,我们引入了比热容的概念。 一、比热容的定义 比热容与我们前面所讲过的比容、比内能、比焓、比功等参数类似,它是一个比参数,那么它的广延参数就是热容,所以在讲比热容之前我们先看一下热容。 1.热容 热容指的是物体在一定的准静态过程中,温度升高或降低1K 时吸收或放出的热量,用符号C 表示。 根据热容的定义,我们可以得到:若工质在一定的准静态过程中,温度变化了△T ,过程中热量为Q ,那么这个过程中的比热为: Q C T =? 而物体的比热容是随温度变化的,并不是一个常数,我们上面的表示方法仅仅表示的是工质在这一过程中的平均比热容,若我们精确的表示工质在某一温度处的热容,则: Q C dT δ= 单位为J/K 2.比热容 用符号c 表示,比热容是热容的比参数。比参数是广延参数与质量的比值。 所以比热容的定义为:1kg 物体在一定的准静态过程中温度升高或降低1K 时吸收或放出的热量。 C q c m dT δ== 单位:J/(kgK) 这个比容又叫比质量热容,除了比质量热容外,热容还有两种比参数,分别是容积比热和摩尔比热。 容积比热用符号c ’表示,指的是1Nm 3工质在一定的准静态过程中温度升高或降低1K 时吸收或放出的热量。单位为J/( Nm 3K)。 摩尔比热用符号Mc 表示,指的是1mol 工质在一定的准静态过程中温度升高或降低1K 时吸收或放出的热量。单位为J/( molK)。
三个比容之间的关系:'Mc M c Vm c =?=? 二、理想气体的比热 热量是过程参数,其数值的大小与所进行的热力过程有关,同样比热也是过程参数,也与工质所进行的热力过程有关,不同热力过程的比热值也是不相同的。在我们工程热力学的研究范围中,最常用到的比热有两种: 一个是定容过程的比热,一个是定压过程的比热。 定容过程:整个热力过程中工质的容积保持不变。比如固定容器中的气体被加热。 定压过程:整个热力过程中工质的压力保持不变。比如气缸活塞系统,活塞上放一质量不变的重物,对工质进行加热的过程。 两个过程的比热分别称为定容比热c v 和定压比热c p 。 1.定容比热c v 1kg 物体在定容过程中温度变化1K 时吸收或放出的热量。 定容过程的特点是:体积变化为0,即dv=0 对于可逆过程:q du pdv du δ=+= ∴v du pdv du c dT dT += = 即v du c dT = 2.定压比热c p 1kg 物体在定压过程中温度变化1K 时吸收或放出的热量。 定压过程的特点是:压力变化为0,即dp=0 对于可逆过程:q dh vdp dh δ=-= ∴p dh vdp dh c dT dT -= = 即p dh c dT = 这两个式子只适用于准静态过程、平衡过程、可逆过程。 对于理想气体来说,c v 、c p 仅是温度的函数,与其他参数无关。 三、c v 与c p 的关系 1.关系1
气体比热容的测量
气体比热容比C 缓冲瓶 P /C V 的测定 (补充讲义) 【实验目的】 1.观测热力学过程中状态变化及基本物理规律。 2.测定多种气体(单原子、双原子、多原子)的定压比热容与定容比热容之比。 【实验原理】 气体的定压比热容C P 与定容比热容C V P C /C =γ之比V 。在热 力学过程特别是绝热过程中是一 个很重要的参数,测定的方法有好 多种。这里介绍一种较新颖的方 法,通过测定物体在特定容器中的 振动周期来计算γ值。 实验基本装置如图所示. 振动物体小球的直径比玻璃管直径仅小0.01~0.02mm。它能在此精密的玻璃管中上下移动,在瓶子的壁上有一小口,并插入一根细管,通过它各种气体可以注入到烧瓶中。 为了补偿由于空气阻尼引起振动物体A 振幅的衰减,通过C 管一直注入一个小气压的气流. 在精密玻璃管B 的中央开设有一个小孔。当振动物体A 处于小孔下方的半个振动周期时,注入气体使容器的内压力增大,引起物体A 向上移动,而当物体A 处于小孔上方的半个振动周期时,容器内的气体将通过小孔流出,使物体下沉。以后重复上述过程,只要适当控制注入气体的流量,物体A 能在玻璃管B 的小孔上下作简谐振动,振动周期可利用光电计时装置来测得。 钢球A 的质量为m,半径为r(直径为d),当瓶子内压力P 满足下面条件时钢球A 处于力平衡状态。 2L r mg P P π+ =, 式中P L 为大气压强。 若物体偏离平衡位置一个较小距离x,则容器内的压力变化ΔP,物体的运动方程为 dP r dt x d m 222π= (1) 因为物体振动过程相当快,所以可以看作绝热过程,绝热方程 (2) 常数=r PV 将(2)式求导数得出:
大学物理空气比热容的测量实验报告
大物实验报告撰写模板2 空气比热容比的测定 在热学中比热容比是一个基本物理量。过去,由于实验测量手段的原因使得对它的测量误差较大。现在通过先进的传感器技术使得测量便得简单而准确。本实验通过压力传感器和温度传感器来测量空气的比热容比。 一、实验目的 1. 用绝热膨胀法测定空气的比热容。 2. 观察热力学过程中状态变化及基本物理规律。 3. 学习气体压力传感器和电流型集成温度传感器的原理及使用方法。 二、实验原理 理想气体定压摩尔热容量和定体摩尔热容量之间的关系由下式表示 R C C v p =- (4-6-1) 其中, R 为普适气体常数。气体的比热容比γ定义为 v p C C = γ (4-6-2) 气体的比热容比也称气体的绝热系数,它是一个重要的物理量,其值经常出现在热力学方程中。 测量仪器如图4-6-1所示。1为进气活塞C 1,2 为放气活塞C 2,3为电流型集成温度传感器,4为气体压力传感器探头。实验时先关闭活塞C 2,将原处于环境大气压强为P 0、室温为T 0的空气经活塞C 1送入贮气瓶B 内,这时瓶内空气压强增大,温度升高。关闭活塞C 1,待瓶内空气稳定后,瓶内空气达到状态Ⅰ(101,,V T P ) ,V 1为贮气瓶容积。 然后突然打开阀门C 2,使瓶内空气与周围大气相通,到达状态Ⅱ(),,220V T P 后,迅速关闭活塞C 2。由于放气过程很短,可认为气体经历了一个绝热膨胀过程,瓶内气体压强减小,温度降低。绝热膨胀过程应满足下述方程 γ γ2 011V P V P = (4-6-3) 在关闭活塞C 2之后,贮气瓶内气体温度将升高,当升到温度T 0时,原气体的状态为Ⅰ(101,,V T P )改变为状态Ⅲ(202,,V T P ) ,两个状态应满足如下关系:
2.气体定压比热容的测定
实验二 气体定压比热容的测定 一、实验目的 1. 掌握气体比热容测定装置的基本原理,了解辐射屏蔽绝热方法的基本思路; 2. 进一步熟悉温度、压力和流量的测量方法; 3. 测定空气的定压比热容,并与文献中提供的数据进行比较。 二、实验原理 按定压比热容的定义, T q c p p d δ= T c q p p d ?=δ ? ?=2 1 d T T p p T c m Q 气体定压比热容的积分平均值: T m Q T T m Q c p p pm ?= -= ) (12 (1) 式中,Q p 是气体在定压流动过程中由温度T 1被加热到T 2时所吸收的热量(W ),m 是气体的质量流量(kg/s ),△T 是气体定压流动受热的温升(K )。这样,如果我们能准确的测出气体的定压温升△T ,质量流量m 和加热量Q ,就可以求得气体的定压比热容c pm 。 在温度变化范围不太大的条件下,气体的定压比热容可以表示为温度的线性函数,即 c p =a +bT 不难证明,温度T 1至T 2之间的平均比热容,在数值上等于平均温度T m =( T 1+T 2)/2下气体的真实比热容,即 c pm =c p [(T 1+T 2)/2]=a+b T m (2) 据此,改变T 1或T 2,就可以测出不同平均温度下的比热容,从而求得比热容与温度的关系。 三、实验设备 实验所用的设备和仪器主要有风机、流量计、比热仪主体、调压变压器、温度计等。实验时,被测气体由风机经流量计送入比热仪主体,经加热、均流、旋流、混流后流出。在此过程中,分别测定:在流量计出口处的干、湿球温度T 0和T w ,气体流经比热仪主体的进出口温度T 1和T 2;气体的体积流量V ;电加热功率P 以及实验时的大气压p b 和流量计出口处的表压p e 。 气体的流量由节流阀控制,气体出口温度由输入电加热器的功率来调节。本比热仪可测300℃以下气体的定压比热容。 前已指出,提高测量精度的关键是提高Q p 、ΔT 和m 的测量精度,设电加热器的功率为P ,则, P=Q g +Q ζ (3) 其中,Q g 是气体所吸收的热量,Q ζ是损失到环境中的热量。由于杜瓦瓶实际上是一个高度真空的多层瓶,且每一层的内壁上都镀有高反射率的水银。这样,按着传热学理论,通过杜瓦瓶的散热损失将很小,因此在(3)式中的Q ζ 实际上很小,完全可以忽略不计。这样,P=Q g 。如果通入比热仪本体的是纯气体,则Q p =Q g =P 。
空气定压比热测定实验报告
空气定压比热测定实验报告 一、实验原理及过程简述 实验原理: 气体的定压比热定义为: 在没有对外界作出功的气体的等压流动过程中,,则气体的定压比热可表示为: 式中 —气体的质量流量,—气体在定压流动过程中的吸热量, 低压气体的定压比热容通常用温度的多项式表示,例如空气的定压比热容的实验关系式: 在与室温相近的温度范围内,空气的定压比热容与温度的关系可近似看为线性的,可近似表示为: 由T 1加热到T 2的平均比热容 大气是含水蒸气的湿空气,当湿空气气流由T 1加热到T 2时,其中水蒸气的吸热量可用下式计算: 式中,为气流中的水蒸气质量,。于是,干空气的平均定压比热容由下式确定: 为湿空气气流的吸热量。 实验过程: 1、用温湿度计表测量空气的干球温度及相对温度,由湿空气的焓-湿图确定含湿量,并计算出水蒸气的容积成分。 2、调节加热器功率,使出口温度升高至一定温度,当实验工况稳定后测定每10升气体通过流量计所需时间;比热仪进口温度和出口温度;当地大气压力和流量计出口处的表压;电热器的功率W 。 实验中需要计算干空气的质量流量、水蒸气的质量流量,电加热器的放热量,水蒸气吸收热量等数据并记录。 p T h Cp ??? ????=m Q d dh g &&=) (122 1 T T m Q Cpm g T T -= &&m &s kg g Q &s kJ 263101658.01006791.09705.0T T C p --?+?-=K kg kJ ?bT a Cp +=2 )(1 2122 1 2 1T T b a T T dt bT a C T T T T pm ++=-+= ?K kg kJ ?dT m Q T T w w ?-?+=2 1 )105345.06878.1(3&&)](102672.0)(6878.1[2 122312T T T T m w -?+-=-&s kJ w m &s kg ) ()(121221T T m Q Q T T m Q Cpm g w g g T T --=-=&&&&&K kg kJ ?w Q &),(0K T ?w r ),(s τ),(1K T ),(2K T ),(Pa B ),(2O mmH h ?g m &w m &
