3,4,5,6-四氯-2-三氯甲基吡啶在银电极上的电还原行为论文

第三章3,4,5,6-四氯-2-三氯甲基吡啶在Ag
电极上的电还原行为
二氯甲基吡啶类化合物是一类高效低毒的农药,广泛用于杀虫剂、除草剂、杀真菌剂[1]。这类化合物目前主要的合成方法是用金属离子在酸性条件下还原三氯甲基吡啶[3],其缺点是:成本高、反应速率慢、选择性低、废物处理困难,近年来随着环境状况的恶化,污染严重的方法和技术逐步被取代[4]。而电化学合成作为一种绿色合成逐渐受到人们重视。美国陶氏化学公司采用电还原的方法合成的3,4,5,6-四氯-2-二氯甲基吡啶和2,3,5,6-四氯-4-二氯甲基吡啶产率较高,但缺点是选用了有毒的汞电极[2]。汞由于其剧毒和在生物体内累积的特点已在生产中逐步淘汰。因此,选择合适的电极材料成为关键。
最近有研究发现,由于卤素原子的特殊吸附作用,银电极对有机卤化物的脱卤有较好的催化作用[5~7],本课题组曾以银为电极研究了电还原3,4,5,6-四氯吡啶甲酸生产除草效率较高的3,6-二氯吡啶甲酸并且已经工业化[8]。但迄今为止以银为电极合成2,3,5,6-四氯-4-二氯甲基吡啶未见报导,本文为此作了一些基础研究,在美国Dow化学公司研究的基础上改用银电极,采用循环伏安法、计时电量法、恒电位电解等方法研究了3,4,5,6-四氯-2-三氯甲基吡啶(以下简称七氯吡啶)在银电极上的电还原行为并对其反应机理进行了初步探讨。
如无特殊说明,实验温度均为298K,支持电解质均为TBAP(四丁基高氯酸铵,下同),所有电位均相对于SCE(饱和甘汞电极,下同)。
3.1七氯吡啶在乙腈和水的混合溶液中的循环伏安行为
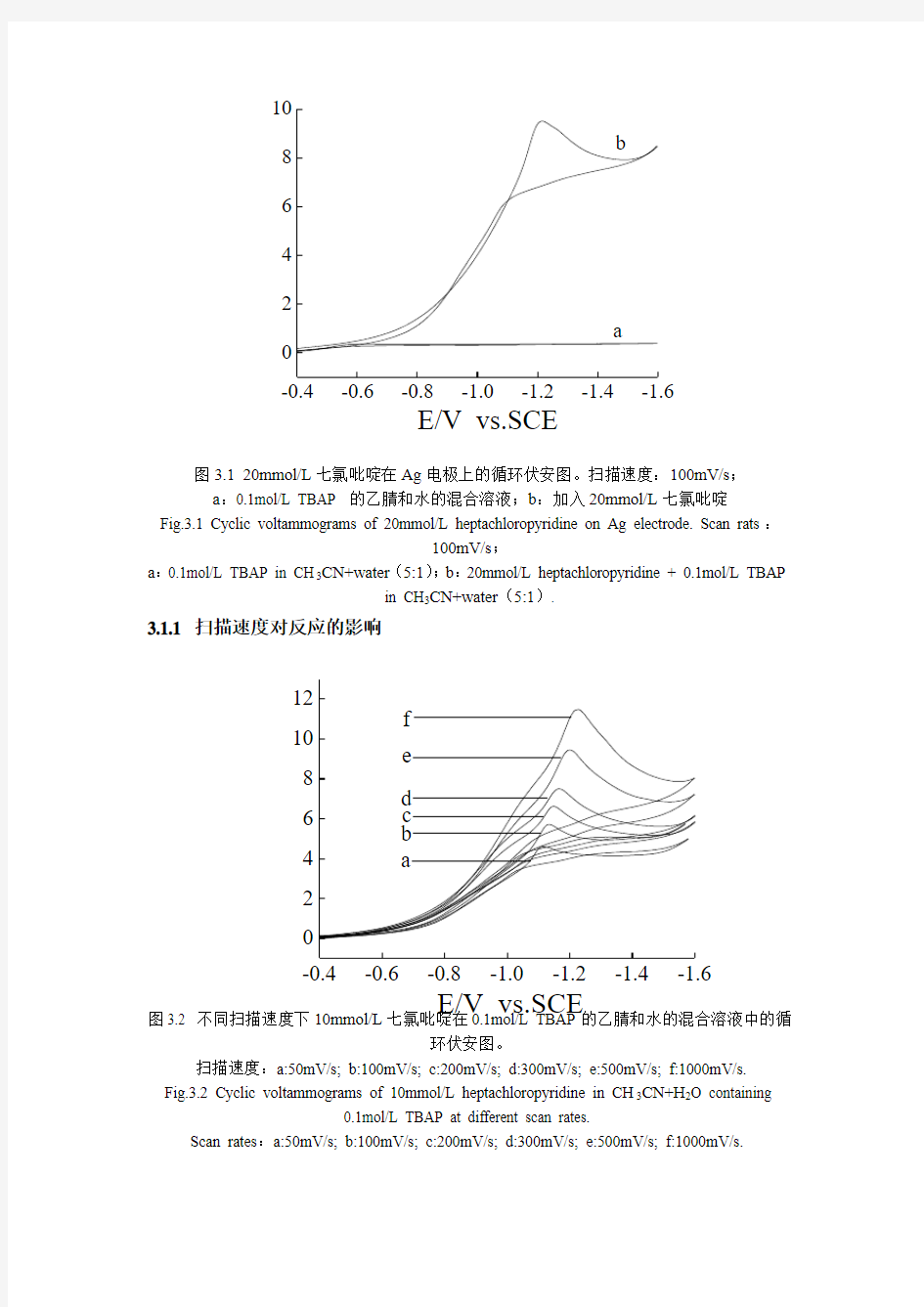
图3.1为Ag电极在空白溶液中与加入底物(20mmol/L的七氯吡啶)后的对比循环伏安图。由图中可见,在空白溶液中(曲线a),Ag电极在扫描电位范围内没有明显的阴极反应。当加入20mmol/L的七氯吡啶后(曲线b),在-1.2V左右出现了还原峰,但是在反向扫描时没有出现对应的氧化峰,所以此反应是一个完全不可逆的还原反应。
-0.4
-0.6
-0.8
-1.0
-1.2
-1.4
-1.6
02468
10b
I /μA
E/V vs.SCE
a
图3.1 20mmol/L 七氯吡啶在Ag 电极上的循环伏安图。扫描速度:100mV/s ; a :0.1mol/L TBAP 的乙腈和水的混合溶液;b :加入20mmol/L 七氯吡啶
Fig.3.1 Cyclic voltammograms of 20mmol/L heptachloropyridine on Ag electrode. Scan rats :
100mV/s ;
a :0.1mol/L TBAP in CH 3CN+water (5:1);
b :20mmol/L heptachloropyridine + 0.1mol/L TBAP
in CH 3CN+water (5:1).
3.1.1 扫描速度对反应的影响
-0.4
-0.6
-0.8-1.0-1.2-1.4-1.6
0246810
12f e d c a
I /μA
E/V vs.SCE b 图3.2 不同扫描速度下10mmol/L 七氯吡啶在0.1mol/L TBAP 的乙腈和水的混合溶液中的循
环伏安图。
扫描速度:a:50mV/s; b:100mV/s; c:200mV/s; d:300mV/s; e:500mV/s; f:1000mV/s. Fig.3.2 Cyclic voltammograms of 10mmol/L heptachloropyridine in CH 3CN+H 2O containing
0.1mol/L TBAP at different scan rates.
Scan rates :a:50mV/s; b:100mV/s; c:200mV/s; d:300mV/s; e:500mV/s; f:1000mV/s.
图3.2为10mmol/L 七氯吡啶在不同扫描速度下的循环伏安图。从图中可以看出,随着扫描速度的增大,峰电流增大,峰电位负移。
图3.3是峰电流与扫描速度平方根线性关系图
I p /μA
v 1/2
/s
-1/2
图3.3 峰电流I p 与扫描速度平方根v 1/2的关系图
Fig.3.3 Variation of I p of 10mmol/L heptachloropyridine in CH 3CN+H 2O containing 0.1mol/L
TBAP vs. v 1/2, T=288K
R=0.996
I p ∝v 1/2,符合完全不可逆反应的特征[9],说明七氯吡啶在电极界面的传质为线性扩散,在50~1000mV/s 扫速范围内,反应受七氯吡啶向电极/溶液界面的扩散所控制,相同电位下,电流随扫描速度加快而增大,是因为反应为扩散控制时,扫描速度加快达到同样电位所需要的时间越短,扩散层越薄,扩散流量越大,所以电流越大。在生产过程中可以通过机械搅拌的方法提高反应速率。
从图3.2中可以看出,在扫描速度比较小时,电位移动较大,而在扫描速度较大时,电位负移的幅度变小。作出七氯甲基吡啶还原峰电位(E)与扫描速度(v )
之间的关系,如图3.4所示。可以清楚地看出,随着扫速的增大,v E ??的值逐渐变
小,根据不可逆随后化学反应的判据[10],可说明该电极过程具有随后不可逆化学反应的特征。
E p /V v s .S C E
v/s
-1
图3.4 峰电位E p 与扫描速度v 之间的关系。
Fig.3.4 Variation of peak potential(E p ) of 10mmol/L heptachloropyridine in CH 3CN+H 2O
containing 0.1mol/L TBAP vs. scan rate(v ).
3.1.2 浓度对反应的影响
图3.5为七氯吡啶在不同浓度下的循环伏安图。由图中可以看出,随着七氯吡啶浓度增大,峰电流也增大。
-0.4
-0.6
-0.8
-1.0
-1.2
-1.4
-1.6
05101520
25e d a
I /μA
E/V vs.SCE
b c
图3.5 不同浓度的七氯吡啶在0.1mol/L TBAP 的乙腈和水的混合溶液中的循环伏安图。扫描
速度:100mV/s 。
a:5mmol/L; b:10mmol/L; c:20mmol/L; d:30mmol/L; e:40mmol/L;
Fig.3.5 Cyclic voltammograms of heptachloropyridine at various concentrations in CH 3CN+H 2O
containing 0.1mol/L TBAP. Scan rats: 100mV/s.
a:5mmol/L; b:10mmol/L; c:20mmol/L; d:30mmol/L; e:40mmol/L;
由图3.6中I p 与C 的关系图可见,在5~40 mM 浓度范围内,随着底物浓度的增大,峰电流增大,峰电流与底物浓度成良好的线性关系,进一步说明此反应由扩散控制。底物浓度增大时,反应速率随之增大,峰电流也增大。且在较高底物浓度(40 mM)的情况下,电极反应控制步骤仍是液相传质步骤。这表明银电极对七氯吡啶脱氯反应有很高的电催化活性,适合于七氯吡啶电解合成3,4,5,6-四氯-2-二氯甲基吡啶。
I p /μA
C/mmolL
-1
图3.6 峰电流与七氯吡啶浓度的关系图。
Fig.3.6 Variation of I p vs. concentrations of heptachloropyridine in CH 3CN+H 2O containing
0.1mol/L TBAP.
3.1.3 温度对反应的影响
图3.7为不同温度下30mmol/L 七氯吡啶在乙腈溶液中的循环伏安图。由图可知,随着温度的升高峰电流增大。温度对反应有促进作用。这可能因为温度升高,反应物的热运动加快,动能增大,有利于反应物的扩散。由电化学步骤控制的反应的温度系数比较大,而此反应的温度系数较小,说明此反应电化学步骤比较迅速,不是控制步骤。由于温度对反应的影响较小,所以实际生产过程中不需要额外加热。
-0.4
-0.6
-0.8-1.0-1.2-1.4-1.6
05101520
25e d c b I /μA
E/V vs.SCE
a
图3.7不同温度下30mmol/L 七氯吡啶在0.1mol/L TBAP 的乙腈和水的混合溶液中的循环伏
安图。扫速:100mV/s 。
温度:a:288K; b:293K; c:298K; d:303K; e:308K.
Fig.3.7 Cyclicvoltammograms of 30mmol/L heptachloropyridine in CH 3CN+water containing
0.1mol/L TBAP at different temperatures. Scan rates :100mV/s 。
T= a:288K; b:293K; c:298K; d:303K; e:308K.
3.1.4 大幅度电势阶跃法研究
对于扩散控制的电极反应,反应开始前只有氧化态物种而不存在还原态物种时,电流~时间关系符合Cottrell 方程。考虑到双电层充电和一些氧化态物种吸
0.00
0.05
0.10
0.150.200.25
12345678Q /m C
t/s
图3.8 10mmol/L 的七氯吡啶在银电极的电量~时间曲线。T=288K
Fig.3.8 charge~time curve for 10mmol/L heptachloropyridine in CH 3CN+water containing
0.1mol/L TBAP. T=288K
附的影响,电量~时间关系符合Cottrell 积分方程[11]。
o dl o o d nFA Q t C nFAD Q Γπ2=2
/12
/1*2/1++
图3.8是采用计时电量法测出的Q ~t 曲线,图10为拟合的Q ~t 1/2直线,根据斜率可求出扩散系数。
Q /m C
t /s
图3.9 Q 与t 1/2关系图。T=288K
Fig.3.9 Charge vs. t 1/2. T=288K
拟合的直线方程为
Q(mC) =-1.27+16.36t 1/2(s 1/2)
代入Cottrell 积分方程可求得扩散系数
D=2.7×10-5 cm 2/s 。
3.2 七氯吡啶在不同溶剂中的循环伏安行为
3.2.1 七氯吡啶在DMF(N,N-二甲基甲酰胺)溶液中的循环伏安行为
图3.10是20mmol/L 七氯吡啶的DMF(N,N-二甲基甲酰胺,下同)溶液和空白溶液的对比循环伏安曲线。从图中可以看出:在空白溶液中(图中a 曲线)银电极没有明显的阴极反应,当加入底物后(图中b 曲线),在-1.0V 后出现明显的阴极反应电流,峰电位为-1.1V ,而在回扫的过程中却未出现对应的氧化峰。此现象表明七氯吡啶在DMF 溶液中在银电极上发生了还原反应,且此反应为不可逆反
应。
-0.6
-0.9
-1.2
-1.5
-1.8
1234
5I /μA
E/V vs.SCE
a
b
图3.10 20mmol/L 七氯吡啶在DMF 的循环伏安图。扫描速度:0.1V/s 。
a :0.1mol/LTBAP 的DMF 溶液;
b :加入20mmol/L 七氯吡啶
Fig.3.10 Cyclic voltammograms of 20mmol/L heptachloropyridine in DMF containing 0.1mol/L
TBAP on Ag electrode. Scan rate: 0.1V/s.
a :0.1mol/L TBAP in DMF ;
b :add 20mmol/L heptachloropyridine.
-0.4-0.6-0.8-1.0-1.2-1.4-1.6-1.8
369
1215I /μA
E/V vs.SCE
a
b c d e
图3.11 不同扫描速度下20mmol/L 七氯吡啶在0.1mol/L TBAP-DMF 溶液中的循环伏安图。
扫描速度:a:40mV/s; b:160mV/s; c:360mV/s; d:640mV/s; e:1000mV/s.
Fig.3.11 Cyclic voltammograms of 20mmol/L heptachloropyridine in DMF containing 0.1mol/L
TBAP at different scan rates.
Scan rates :a:40mV/s; b:160mV/s; c:360mV/s; d:640mV/s; e:1000mV/s.
采用不同的扫描速度研究七氯吡啶在DMF 溶液中的循环伏安行为,分析其
峰电流、峰电位与扫描速度的关系。
图3.11是不同扫描速度下七氯吡啶在DMF 溶液中的循环伏安曲线。由图可见,随着扫描速度的增大,峰电流增大,峰电位负移,符合完全不可逆反应的特征。
I p /μA
v 1/2
/s
-1/2
图3.12 峰电流I p 与扫描速度平方根v 1/2的关系图
Fig.3.12 Variation of I p of 20mmol/L heptachloropyridine in DMF containing 0.1mol/L TBAP vs.
v 1/2, T=298K R=0.977
E p /V v s .S C E
v/s
图3.13 峰电位E p 与扫描速度v 之间的关系。
Fig.3.13 Variation of peak potential(E p ) of 20mmol/L heptachloropyridine in DMF containing
0.1mol/L TBAP vs. scan rate(v ).
图3.12是峰电流与扫描速度平方根的关系图,图中表明峰电流与扫描速度
平方根基本成直线关系,说明七氯吡啶在DMF 溶液中在银电极上的还原反应是由扩散所控制的。在实际生产过程中若用DMF 作溶剂,可以通过机械搅拌的方法提高反应速率。
图3.13是峰电位与扫描速度的关系图。随着扫描速度的增大,峰电位负移,但在扫描速度比较小时,电位移动较大,而在扫描速度较大时,电位负移的幅度变小。符合随后化学反应的特征。
综上所述,七氯吡啶在DMF 溶液中在银电极上的还原反应是由扩散所控制的完全不可逆反应。反应是EC(电极反应-化学反应)过程。 3.2.3 七氯吡啶在乙腈溶液中的循环伏安行为
图3.10是20mmol/L 七氯吡啶的乙腈溶液和空白溶液的对比循环伏安曲线。从图中可以看出:在空白溶液中(图中a 曲线)银电极没有明显的阴极反应,当加入底物后(图中b 曲线),在-1.0V 后出现明显的阴极反应电流,峰电位为-1.2V ,而在回扫的过程中却未出现对应的氧化峰。此现象表明七氯吡啶在乙腈溶液中在银电极上发生了还原反应,且此反应同样为不可逆反应。
-0.4-0.6-0.8-1.0-1.2-1.4-1.6-1.8
12345
67a
I /μA
E/V vs.SCE
b
图3.14 20mmol/L 七氯吡啶在乙腈的循环伏安图。扫描速度:0.1V/s 。
a :0.1mol/LTBAP 的乙腈溶液;
b :加入20mmol/L 七氯吡啶
Fig.3.14 Cyclic voltammograms of 20mmol/L heptachloropyridine on Ag electrode. Scan rate:
0.1V/s.
a :0.1mol/L TBAP in CH 3CN ;
b :add 20mmol/L heptachloropyridine.
采用不同的扫描速度研究了七氯吡啶在乙腈溶液中的循环伏安行为,分析
其峰电流、峰电位与扫描速度的关系。
图3.14是不同扫描速度下的七氯吡啶在乙腈溶液中的循环伏安曲线。由图可见,随着扫描速度的增大,峰电流增大,峰电位负移,符合完全不可逆反应的特征。并且随着扫描速度的增大在-1.5V 附近出现一个新的还原峰,可能是发生
了新的还原反应,但由于其反应速率较小,所以在扫描速度较小时此还原峰不明显。在-1.2V 处发生的还原反应命名为反应Ⅰ,在-1.5V 处发生的还原反应命名
为反应Ⅱ(下同)。 -0.3
-0.6
-0.9
-1.2
-1.5
-1.8
0.0
2.55.07.510.012.5
15.017.5I /μA
E /V vs. SCE
a
b
c d e f
图3.15 不同扫描速度下20mmol/L 七氯吡啶在0.1mol/L TBAP-乙腈溶液中的循环伏安图。
扫描速度:a:1000mV/s; b:500mV/s; c:300mV/s; d:200mV/s; e:100mV/s; f:50mV/s.
Fig.3.15 Cyclic voltammograms of 20mmol/L heptachloropyridine in CH 3CN containing 0.1mol/L
TBAP at different scan rates.
Scan rates :a:1000mV/s; b:500mV/s; c:300mV/s; d:200mV/s; e:100mV/s; f:50mV/s.
图3.16是反应Ⅰ的峰电流与扫描速度平方根的关系图,图中表明峰电流与扫描速度平方根基本成直线关系,说明七氯吡啶在乙腈溶液中银电极上的还原反应Ⅰ是由扩散所控制的。在实际生产过程中若用乙腈作溶剂,可以通过增加机械搅拌的方法提高反应速率。
图3.17是反应Ⅰ峰电位与扫描速度的关系图。随着扫描速度的增大,峰电位负移,但在扫描速度比较小时,电位移动较大,而在扫描速度较大时,电位负移的幅度变小。符合随后化学反应的特征。
综上所述,七氯吡啶在乙腈溶液中在银电极上的还原反应是由扩散所控制的
完全不可逆反应。反应是EC(电极反应-化学反应)过程。
I p /μA
v 1/2
/ s
-1/2
图3.16 峰电流I p 与扫描速度平方根v 1/2的关系图
Fig.3.16 Variation of I p of 20mmol/L heptachloropyridine in CH 3CN containing 0.1mol/L TBAP
vs. v 1/2, T=298K
R=0.999
E p /V v s . S C E
v/s
-1
图3.17峰电位E p 与扫描速度v 之间的关系。
Fig.3.17 Variation of peak potential(E p ) of 20mmol/L heptachloropyridine in CH 3CN containing
0.1mol/L TBAP vs. scan rate (v ).
3.2.4七氯吡啶在乙醇溶液中的循环伏安行为
图3.18是20mmol/L 七氯吡啶的乙醇溶液和空白溶液的对比循环伏安曲线。从图中可以看出:在空白溶液中(图中a 曲线)银电极没有明显的阴极反应,当加
入底物后(图中b 曲线),有明显的阴极反应电流,出现两个还原峰,峰电位分别为-1.2V(反应ⅰ)和-1.47V(反应ⅱ),而在回扫的过程中却未出现对应的氧化峰。此现象表明七氯吡啶在乙醇溶液中在银电极上发生了还原反应,且此反应为不可逆反应。
-0.6
-0.9
-1.2
-1.5
-1.8
246810
12a
I /μA
E/V vs.SCE
b
图3.18 20mmol/L 七氯吡啶在乙醇的循环伏安图。扫描速度:0.1V/s 。
a :0.1mol/LTBAP 的乙醇溶液;
b :加入20mmol/L 七氯吡啶
Fig.3.18 Cyclic voltammograms of 20mmol/L heptachloropyridine in C 2H 5OH containing
0.1mol/L TBAP on Ag electrode. Scan rate: 0.1V/s.
a :0.1mol/L TBAP in C 2H 5OH ;
b :add 20mmol/L heptachloropyridine.
采用不同的扫描速度研究了七氯吡啶在乙醇溶液中的循环伏安行为,分析其峰电流、峰电位与扫描速度的关系。
图3.19是不同扫描速度下的七氯吡啶在乙醇溶液中的循环伏安曲线。由图可见,随着扫描速度的增大,峰电流增大,峰电位负移,符合完全不可逆反应的特征。
图3.20是反应ⅰ的峰电流与扫描速度平方根的关系图,图中表明峰电流与扫描速度平方根基本成直线关系,说明七氯吡啶在乙腈溶液中银电极上的还原反应Ⅰ是由扩散所控制的。在实际生产过程中若用乙腈作溶剂,可以通过增加机械搅拌的方法提高反应速率。
图3.21是反应ⅰ峰电位与扫描速度的关系图。随着扫描速度的增大,峰电位负移,但在扫描速度比较小时,电位移动较大,而在扫描速度较大时,电位负移的幅度变小。符合随后化学反应的特征。
-0.6
-0.9-1.2-1.5-1.8
3691215
18e d c b I /μA
E/V vs.SCE
a
图3.19 不同扫描速度下20mmol/L 七氯吡啶在0.1mol/L TBAP-乙醇溶液中的循环伏安图。
扫描速度:a:40mV/s; b:160mV/s; c:360mV/s; d:640mV/s; e:810mV/s.
Fig.3.19 Cyclic voltammograms of 20mmol/L heptachloropyridine in C 2H 5OH containing
0.1mol/L TBAP at different scan rates.
Scan rates :a:40mV/s; b:160mV/s; c:360mV/s; d:640mV/s; e:810mV/s.
I p /μA
v 1/2
/s
-1/2
图3.20 峰电流I p 与扫描速度平方根v 1/2的关系图
Fig.3.20 Variation of I p of 0.02mol/L heptachloropyridine in C 2H 5OH containing 0.1mol/L TBAP
vs. v 1/2, T=298K
R=0.989
E p /V v s .S C E
v/s
-1
图3.21 峰电位E p 与扫描速度v 之间的关系。
Fig.3.21 Variation of peak potential(E p ) of 20mmol/L heptachloropyridine in C 2H 5OH containing
0.1mol/L TBAP vs. scan rate(v ).
综上所述,七氯吡啶在乙腈溶液中在银电极上的还原反应ⅰ是由扩散所控制的完全不可逆反应。反应是EC(电极反应-化学反应)过程。
综合七氯吡啶在各种溶剂中的循环伏安行为列于下表中。
表3.1 不同溶剂中七氯吡啶在银电极上的电还原行为
Table 3.1 Electrochemical reductive of
由图中可以看出,七氯吡啶在四种溶剂中的反应都是由扩散控制的EC 过程,说明七氯吡啶在银电极的电化学步骤相对较快,而在溶剂中扩散相对较慢;在有活泼氢存在的溶剂中,反应峰电流较大,可能是由于此时反应中H +浓度较高引起的。
3.3 恒电位电解
根据七氯吡啶的循环伏安行为,选择乙腈和水作为溶剂,进行恒电位电解。 3.3.1 合成工艺
七氯吡啶电解合成3,4,5,6-四氯-2-二氯甲基吡啶的工艺流程如图3.22所示,电解装置见图3.23。
图3.22 工艺流程图
Fig .3.22 Schematic flow sheet of preparation of 3,4,5,6-tetrachloro-2-dichloromethylpyridine
图3.23 电解装置示意图
A-对电极Pt ;B-阳离子交换膜;C-工作电极银电极 D-磁力转子;E-参比饱和甘汞电极;F-恒电位仪
七氯吡啶
乙腈和水的混合溶液
产品
旋转蒸发仪
Fig.3.23Scheme of the experimental setup
3.3.2操作过程
电解合成的操作过程如下:
先将配制好的阴极液和阳极液(NaOH溶液)计量分别灌入阴极室和阳极室,开启搅拌器,并调好规定的转速。待体系稳压电源开关,通电电解若干小时,最后取出反应液。
电解后的反应液用二氯甲烷萃取分离,萃取液用蒸馏水洗两次。
3.3.3电解结果
恒电位电解的结果列于下表中。
表3.2 七氯吡啶在银电极上的电解实验结果
Table 3.2 results of the electrolysis of heptachloropyridine at Ag.
从电解结果看出,在乙腈和水的混合溶液中,电极电位在-1.2V 时,主要产物为3,4,5,6-四氯-2-二氯甲基吡啶和3,4,5,6-四氯-2-一氯甲基吡啶,原料全部转化;而提高电极电位至-1.4V 时,原料未电解完全时已有部分3,4,5,6-四氯-2-一氯甲基吡啶生成,说明提高电极电位有利于3,4,5,6-四氯-2-二氯甲基吡啶转化为3,4,5,6-四氯-2-二氯甲基吡啶;在更高电位时有微量二聚物产生。说明高电位下七氯吡啶得到更多电子形成脱多氯的产物,所以实际生产中应控制电极电位。而在乙腈溶液中主要产物3,4,5,6-四氯-2-二氯甲基吡啶较为容易转化,因此水溶剂有助于抑制副产物的产生。
根据电解实验结果和随后化学反应的判断,电还原七氯吡啶合成3,4,5,6-四氯-2-二氯甲基吡啶的反应式为:
N
CCl 3
Cl
Cl
Cl Cl
+2e
-N
CCl 2-
Cl
Cl
Cl
Cl
+Cl -
N
CCl 2-Cl
Cl
Cl Cl
+H +
N
CHCl 2
Cl
Cl
Cl
Cl
3.4 产物分析
3.4.1 气相色谱分析
R e l a t i v e A b u n d a n c e
图3.24 原料气相色谱图
Fig.3.24 Gas Chromatogram of starting material
R e l a t i v e A b u n d a n c e
图3.25 产物气相色谱图
Fig.3.25 Gas Chromatogram of products
3.4.2 质谱分析
R e l a t i v e A b u n d a n c
e
图3.26 原料的质谱图
Fig.3.26 MS analysis of starting material
#1469RT:13.07AV:1SB:212.97 , 13.16NL:8.56E6
T:+ c Full ms [ 35.00-500.00]
R e l a t i v e A b u n d a n c e
图3.27 产物的质谱图
Fig.3.27 MS analysis of the product
从质谱图的对比可以判断产物分子式为C 6NCl 6H ,即脱一个氯还原的产物。原料的C-Cl 的键长如下表所示。
氧化还原与电极电势
氧化还原与电极电势 一、基本概念 氧化还原反应发生的重要标志就是反应中发生了电子的得失或偏移。 氧化态:化合物或单质中,元素所呈现的带电状态称为氧化态。它是用一定数值表示的。 氧化数:表示元素氧化态的代数值称为氧化数(或称为氧化值)。 二、原电池电动势 利用氧化还原反应获得电流的装置叫原电池。原电池有半电池、电极、盐桥三个部分组成。 构成原电池的两极间的电势差称为原电池的电动势。 影响电池电动势的主要因素有两个:一是体系中物质的浓度;二是体系所处的温度。 标准状态下原电池的电动势称为标准电池电动势,此时两极各物质均处于标准状态。 三、电极电势(?) 标准电极电势----由于电极电势绝对数值的不可测性,所以电极电势的数值是相对的。它是以氢电极作为标准,并规定以标准状态下的氢电极的电极电势为零来作参考。 标准氢电极----标准状态下的氢电极称为标准氢电极,且此时其标准氢电极为零。即 θ?2 H H + =0。 Nerst 方程式: 还原态氧化态 lg 0592.0n + =θ?? (T =298.15K) 四、氧化还原反应进行的方向和程度 (1)利用?可判断氧化剂、还原剂的相对强弱 ?大的电对中的氧化型物质的氧化能力强于?小的电对中的氧化型物质。同理,?小的电对中的还原型物质的还原能力强于?大的电对中的还原型物质的还原能力。 (2)判断氧化还原反应的方向 反应总是向由强氧化剂和强还原剂反应生成较弱的氧化剂和较弱的还原剂的方向进行。 若反应是在标准状态进行,可直接由θ ?来判断反应进行的方向。若反应不在标准状态进行,一般需要通过Nerst 方程式计算出?,在进行判断。 综合练习 例1:根据下列氧化还原反应-22Cl 2Cu Cl Cu +→++组成原电池。已知: Pa 1013252Cl =p ,-1Cu L mol 10.02?=+c ,-1 Cl L mol 10.0-?=c ,试写出此原电池符号, 并计算原电池的电动势。(V 34.0Cu /Cu 2=+ θ ?,V 36.1- 2 Cl /Cl =θ ?) 分析:首先应根据Nerst 方程式由θ ?及各物质浓度求出这两个点对构成的两个电极电 势,然后确定原电池的正负极。最后计算原电池的电动势。 由Nerst 方程式计算 0.31V lg 20592 .034.022Cu Cu /Cu =+ =++ c ? 1.42V )(lg 2059 2.036.12 Cl Cl Cl Cl Cl /Cl --2 2- 2 =+=θθ ?c c p p 由此可知电对Cu Cu 2+ 构成了电池的负极,另一极则为正极。原电池符号为: )Pt(,(101325Pa)Cl |)L (0.01mol Cl ||)L (0.10mol Cu |Cu )(2-1--12+??-+
2020-2021备战高考化学 氧化还原反应 培优 易错 难题练习(含答案)及答案
一、高中化学氧化还原反应练习题(含详细答案解析) 1.224Na S O (连二亚硫酸钠)是易溶于水,不溶于甲醇的白色固体,在空气中极易被氧化,是一种还原性漂白剂。制取224Na S O 的方法很多, (1)在碱性溶液中用4NaBH 还原3NaHSO 法制备224Na S O 的反应原理为:3222244NaBH NaHSO NaOH Na S O NaBO H O ++→++(未配平)反应装置如图所示: ①实验开始及整个过程中均需通入2N ,其目的是 __________________________________。 ②制备过程中温度需控制在10~45℃,采用水浴加热的主要优点是 ______________________。 ③为使3NaHSO 尽可能完全被还原,加入三口烧瓶中的反应液,应控制( )() 34n NaHSO n NaBH ______________。 (2)用HCOONa 还原2SO 制备224Na S O 的装置(夹持加热仪器略)如下: ①装置a 烧瓶中发生反应的化学方程式为_________________________________。 ②装置b 用于净化2SO ,适宜的试剂是______________________________。 ③装置c 在70~83℃生成224Na S O 并析出,同时逸出2CO ,该反应的化学方程式为________________________,加入3CH OH 的目的是________________________;利用反应后的浊液分离提纯224Na S O 需经过的操作为 _____________________________________________________。
第八章 氧化还原反应与电极电位
氧化还原反应与电极电位首页难题解析学生自测题学生自测答案章后习题解答难题解析[TOP] 例8-1 写出并配平下列各电池的电极反应、电池反应,注明电极的种类。 (1)(-) Ag(s)│AgCl(s) │HCl(sln)│Cl2(100kp)│Pt(s) (+) (2)(-) Pb(s)│PbSO4(s)│K2SO4(sln)‖KCl(sln)│PbCl2(s)│Pb(s) (+) (3)(-) Zn(s)│Zn2+(c1)‖MnO4-(c2), Mn2+(c3), H+(c4)│Pt(s) (+) (4)(-) Ag(s) | Ag+ (c1) ‖Ag+(c2) │Ag(s) (+) 分析将所给原电池拆分为两个电极。负极发生氧化反应,正极发生还原反应,写出正、负极反应式,由正极反应和负极反应相加构成电池反应。 解(1)正极反应Cl2(g)+2e-→ 2 Cl-(aq) 属于气体电极 负极反应Ag(s)+Cl-(aq) → AgCl(s)+e-属于金属-难溶盐-阴离子电极 电池反应2Ag(s)+ Cl2(g) →2AgCl(s) n=2 (2)正极反应PbCl2(s)+2e-→Pb(s)+2Cl- (aq) 属于金属-难溶盐-阴离子电极负极反应Pb(s)+SO42-(aq)→PbSO4(s)+2e-属于金属-难溶盐-阴离子电极 电池反应PbCl2(s) +SO42-(aq)→PbSO4(s) +2Cl-(aq) n=2 (3)正极反应MnO4-(aq) +8H+(aq)+5e-→Mn2+(aq)+ 4H2O(l) 属于氧化还原电极负极反应Zn(s) → Zn2+(aq)+2e-属于金属-金属离子电极电池反应2MnO4- (aq)+16H+(aq)+5Zn(s)→2Mn2+(aq)+8H2O(l)+5Zn2+ (aq)n=10 (4)正极反应Ag+(c2) +e- → Ag(s) 属于金属-金属离子电极 负极反应Ag(s) → A g+ (c1) + e-属于金属-金属离子电极 电池反应Ag+(c2) → Ag+ (c1) n=1 例8-2 25℃时测得电池(-) Ag(s)│AgCl(s)│HCl(c)│Cl2(100kp)│Pt(s) (+) 的电动势为?( Cl2/Cl-)=1.358V, θ?( Ag+/Ag)=0.799 6V,求AgCl的溶度积。 1.136V,已知θ ?AgCl/Ag 。其分析首先根据电池电动势和已知的标准电极电位,由Nernst方程求出θ 次:AgCl的平衡AgCl(s)Ag+ (aq)+ Cl-(aq),方程式两侧各加Ag:
氧化还原反应和电极电势
氧化还原反应和电极电势 知识点一:氧化还原反应 一、基本概念: 1、氧化值(氧化数)和原子价(化学价) 氧化数:假定把化合物中成键的电子全部归于电负性大的原子后,原子所带的形式电荷数,就叫该元素的氧化数。 它与离子带的电荷表示不一样。Zn 2+→Zn +2(与化合价表示法类似)。 氧化数与化合价含义不同。氧化数有许多人为的规定: ①单质中,元素的氧化值为零。 ②在单原子离子中,元素的氧化值等于该离子所带的电荷数 。 ③在大多数化合物中,氢的氧化值为 +1;只有在金属氢化物中氢的氧化值为 -1。 ④通常,氧在化合物中的氧化值为-2;但是在过氧化物中,氧的氧化值为-1,在氟的氧化物中,如OF 2和O 2F 2中,氧的氧化值分别为+2和+1。 ⑤中性分子中,各元素原子氧化值的代数和为零;复杂离子的电荷等于各元素氧化值的代数和。 例:56 H I O I 7+的氧化值是; 246 S O S 2.5- +的氧化值是; 氧化数与化合价的区别: a.含义不同,氧化数仅表示了元素原子在化合物中的化合状态;而化合价则表示元素的化合能力(原子个数比)。 b.由于化合价表示在离子化合物中原子得失电子数,共价化合物中共用电子对数,∴它只能是整数,不能是分数; 而氧化数实质上是化合物中原子所带有的形式电荷数(表观电荷数),∴它可以是整数,也可以是分数。 2、氧化还原反应 在一个反应中,氧化数升高的过程称为氧化;氧化数降低的过程称为还原。 在化学反应过程中,元素的原子或离子在反应前后氧化数发生了变化的一类反应称为氧化还原反应。 在氧化还原反应中,氧化数降低的物质称氧化剂;氧化数升高的物质称还原剂。
【化学】化学氧化还原反应的专项培优 易错 难题练习题
一、高中化学氧化还原反应练习题(含详细答案解析) 1.高氯酸铵是一种常见的强氧化剂,常用作火箭发射的推进剂。根据下列信息回答问题:已知:①高氯酸铵受热分解为N2、Cl2、O2和H2O;②Mg3N2易水解;③Cu与N2在酒精灯加热条件下不反应。 (1)写出高氯酸铵受热分解的化学反应方程式: _____________,Mg3N2的电子式为 ________。 (2)现有23.5g NH4ClO4分解,用下列装置设计实验,验证其分解产物并计算分解率。(注:①装置中空气已除尽;②装置可重复使用;③B~F装置中的试剂均过量且能与相应物质反应完全。) ①用E装置质量的增加来验证生成的气体产物之一,则E中盛放的试剂是:_______。 ②请按气流由左至右的方向连接装置:A →E→D →B→______→_____→_______→E (选择B~F 装置,并用B~F字母填空)。 ③证明产物中有Cl2的实验现象:________。 ④反应结束后,若C装置质量增加了2.38g,则NH4ClO4的分解率是:________%。 (3)样品中NH4ClO4的含量(杂质中不含NH4+)还可用蒸馏法测定(如图所示,加热和夹持装置已略去),实验步骤如下: 步骤1:组装仪器,检查气密性;准确称取样品a g(不超过0.5g)于蒸馏烧瓶中,加入约150mL 水溶解。 步骤2:准确量取40.00mL 约0.1mol/L H2SO4于锥形瓶中。 步骤3:向蒸馏烧瓶中加入20mL 3mol/L NaOH溶液;加热蒸馏使NH3全部挥发。 步骤4:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。 步骤5:向锥形瓶中加2~3滴甲基橙,用c mol/L NaOH标准溶液滴定至终点,消耗NaOH标
氧化还原及电极电位
第八章氧化还原反应与电极电位 首页 难题解析 学生自测题 学生自测答案 章后习题解答 难题解析 [TOP] 例 8-1 写出并配平下列各电池的电极反应、电池反应,注明电极的种类。 (1) (-) Ag(s)│AgCl(s) │HCl(sln)│Cl2(100kp)│Pt(s) (+) (2) (-) Pb(s)│PbSO4(s)│K2SO4(sln)‖KCl(sln)│PbCl2(s)│Pb(s) (+) (3) (-) Zn(s)│Zn2+(c1)‖MnO4-(c2), Mn2+(c3), H+(c4)│Pt(s) (+) (4) (-) Ag(s) | Ag+ (c1) ‖Ag+(c2) │Ag(s) (+) 分析将所给原电池拆分为两个电极。负极发生氧化反应,正极发生还原反应,写出正、负极反应式,由正极反应和负极反应相加构成电池反应。 解(1)正极反应 Cl2(g)+2e- → 2 Cl- (aq) 属于气体电极 负极反应 Ag(s)+Cl-(aq) → AgCl(s)+e- 属于金属-难溶盐-阴离子电极 电池反应 2Ag(s)+ Cl2(g) →2AgCl(s) n=2 (2)正极反应 PbCl2(s)+2e- →Pb(s)+2Cl- (aq) 属于金属-难溶盐-阴离子电极负极反应 Pb(s)+SO42-(aq) →PbSO4(s)+2e- 属于金属-难溶盐-阴离子电极电池反应 PbCl2(s) +SO42- (aq)→PbSO4(s) +2Cl-(aq) n=2 (3)正极反应 MnO4-(aq) +8H+(aq)+5e- →Mn2+(aq)+ 4H2O(l) 属于氧化还原电极负极反应 Zn(s) → Zn2+(aq)+2e- 属于金属-金属离子电极 电池反应2MnO4- (aq)+16H+(aq)+5Zn(s)→2Mn2+(aq)+8H2O(l)+5Zn2+ (aq) n=10 (4)正极反应 Ag+(c2) +e- → Ag(s) 属于金属-金属离子电极负极反应 Ag(s) → Ag+ (c1) + e- 属于金属-金属离子电极 电池反应 Ag+(c2) → Ag+ (c1) n=1 例 8-2 25℃时测得电池 (-) Ag(s)│AgCl(s)│HCl(c)│Cl2(100kp)│Pt(s) (+) 的电动势为1.136V,已知 ( Cl2/Cl-)=1.358V, ( Ag+/Ag)=0.799 6V,求AgCl的溶度积。 分析首先根据电池电动势和已知的标准电极电位,由Nernst方程求出 AgCl/Ag 。其次:AgCl的平衡AgCl(s) Ag+ (aq)+ Cl-(aq),方程式两侧各加Ag: AgCl(s) + Ag(s) Ag+ (aq)+ Cl-(aq) + Ag(s) AgCl与产物Ag组成AgCl/Ag电对;反应物Ag与Ag+组成Ag+/Ag电对。AgCl(s)的溶度积常数为: = 。 解由电池表达式: 正极反应 Cl2 (g)+ 2e- → 2 Cl-(aq), = + lg 负极反应 Ag(s) + Cl-(aq) → AgCl(s) + e-, = + lg 电池反应 Cl2(g) + 2Ag(s) → 2AgCl(s) E = - =( + lg )-( + lg ) =1.136V, 将和数据带入 =-1.136 V=1.358 V-1.136 V=0.222V, 又由 AgCl(s) + Ag Ag+ + Cl- + Ag = =(0.222-0.799 6)V/0.059 16V=-9.76
氧化还原反应与电极电势.
实验六氧化还原反应与电极电势 一、实验目的 1.熟悉电极电势与氧化还原反应的关系。 2.了解浓度、酸度、温度对氧化还原反应的影响。 3.了解原电池的装置和原理。 二、实验原理 氧化还原反应的实质是物质间电子的转移或电子对的偏移。氧化剂、还原剂得失电子能力的大小,即氧化还原能力的强弱,可根据它们相应电对的电极电势的相对大小来衡量。电极电势的数值越大,则氧化态的氧化能力越强,其氧化态物质是较强的氧化剂。电极电势的数值越小,则还原态的还原能力越强,其还原态物质是较强的还原剂。只有较强的氧化剂和较强的还原剂之间才能够发生反应,生成较弱的氧化剂和较弱的还原剂,故根据电极电势可以判断反应的方向。 利用氧化还原反应产生电流的装置称原电池。原电池的电动势E池= φ+-φ-,根据能斯特方程,当氧化型或还原型物质的浓度、酸度改变时,电极电势的数值会随之发生改变。本实验利用伏特计测定原电池的电动势来定性比较浓度、酸度等因素对电极电势及氧化还原反应的影响。 三、仪器和试药 仪器:试管、烧杯、表面皿、培养皿、U形管、伏特计、水浴锅、导线、砂纸、鳄鱼夹。 试药:HCl (2mol·L-1)、HNO3 (1mol·L-1, 浓)、H2SO4 (1, 3mol·L-1)、HAc (3mol·L-1)、H2C2O4 (0.1mol·L-1)、NH3·H2O (浓)、NaOH (6 mol·L-1, 40%)、ZnSO4 (1mol·L-1)、CuSO4 (1mol·L-1)、KI (0.1mol·L-1)、KBr (0.1mol·L-1)、AgNO3 (0.1, 0.5mol·L-1)、FeCl3 (0.1mol·L-1)、Fe2(SO4)3 (0.1mol·L-1)、FeSO4(0.4,1mol·L-1)、K2Cr2O7(0.4mol·L-1)、KMnO4(0.001mol·L-1)、Na2SO3 (0.1mol·L-1)、Na3AsO3 (0.1mol·L-1)、MnSO4 (0.1mol·L-1)、KSCN (0.1mol·L-1)、溴水(Br2)、碘水(I2)、CCl4、NH4F (1mol·L-1、固体)、KCl(饱和溶液)、SnCl2 (0.5mol·L-1)、CuCl2 (0.5mol·L-1)、(NH4)2C2O4(饱和溶液)、锌粒、小锌片、小铜片、琼脂、电极(锌片、铜片、铁片、碳棒)、红色石蕊试纸。 四、实验内容 1.电极电势和氧化还原反应 (1)向试管中加入10滴0.1mol·L-1的KI溶液和2滴0.1mol·L-1的FeCl3溶液后,摇匀,再加入10滴CCl4溶液充分振荡,观察CCl4层颜色的变化,解释原因并写出相应的反应方程式。 (2)用0.1mol·L-1KBr代替KI溶液进行同样实验,观察CCl4层颜色的变化。 (3)用溴水(Br2) 代替FeCl3溶液与0.1mol·L-1的KI溶液作用,又有何现象? 根据实验结果比较Br2/ Br-、I2/ I-、Fe3+/Fe2+三个电对的电极电势相对大小,指出最强的氧化剂和还原剂,并说明电极电势和氧化还原反应的关系。 2.浓度对电极电势的影响 (1)在两只50mL烧杯中,分别加入25mL 1mol·L-1的ZnSO4溶液和25mL 1mol·L-1的CuSO4溶液,在ZnSO4溶液中插入仔细打磨过的Zn片,在CuSO4溶液中插入仔细打磨过的Cu片,用导线将Cu片、Zn片分别与伏特计的正负极相连,两个烧杯溶液间用KCl盐桥连接好,测量电池电动势。
氧化还原反应难题
氧化还原反应难题
作者: 日期: 2
氧化还原反应难题 1 对于反应:14CuSO^ 5FeS + 12HO====7CS+ 5FeSQ+ 12HSO 下列各项判断正确的是()A. 反应中的氧化剂只有CuSO B. 7 mol CuSO 4能氧化5 mol —1价的硫 C. 被氧化的硫和被还原的硫物质的量之比是 3 : 7 D. FeS2既是氧化剂,又是还原剂 1. 高锰酸钾和氢溴酸溶液可以发生下列反应: KMnO+ HBr Br? + MnBr+KBr+H k O其中还原剂是_______ 。若消耗0.1 mol氧化剂,则被氧化的还原剂的物质的量是_______ mol。 2. 根据例题反应,P+ CuSO+ HO CuP J + HPO+ H b SQ 试求31.0 g磷做氧化剂时,所能氧化的磷的质量。 3. 用热的稀HNO与适量的Fe粉反应,反应后溶液中加入 KSCN(aq不显红色,收集到标准状况下的N2O气体4.48 L,试求被氧化Fe粉的质量。 4. 三氟化溴溶于水可发生如下反应: BrF3+ HO HBrO + Br? + HF+ Q f (1)其中发生自身氧化还原反应的物质是__________________ ; ⑵当有5.0 mol水参加反应时,由水还原的BrF3的物质的量为 ____________ 由BrF3还原的BrF3的物质的量为_____________ ; ⑶当有5.0 mol水作还原剂参加化学反应时,由水还原的BrF3的物质的量为_____________ 由BrF3还原的BrF3的物质的量为________
⑷当有5.0 mol水未参加氧化还原反应时,由水还原的BrF3的物质的量为____________ 由BrF3还原的BrF3的物质的量为 ______________ 2
第八章 氧化还原反应与电极电位(大纲)
第八章
1 1.1 基本要求 [TOP]
氧化还原反应与电极电位
掌握离子-电子法配平氧化还原反应式、电池组成式的书写;根据标准电极电位判断氧化还原反应 方向;通过标准电动势计算氧化还原反应的平衡常数;电极电位的 Nernst 方程、影响因素及有关 计算。
1.2 熟悉氧化值的概念和氧化还原反应的定义,熟练计算元素氧化值;熟悉原电池的结构及正负极反应 的特征;熟悉标准电极电位概念;熟悉电池电动势与自由能变的关系。 1.3 了解电极类型、电极电位产生的原因;了解电位法测量溶液 pH 的原理及 pH 操作定义;了解电化学 与生物传感器及其应用。 2 重点难点 [TOP]
2.1 重点 2.1.1 标准电极电位表的应用。 2.1.2 电极反应与电池反应,电池组成式的书写。 2.1.3 通过标准电动势计算氧化还原反应的平衡常数。 2.1.4 电极电位的 Nernst 方程、影响因素及有关计算。 2.2 难点 2.2.1 电极电位的产生 2.2.2 用设计原电池的方法计算平衡常数 2.2.3 Nernst 方程的推导
3
讲授学时 建议 6 学时
[TOP]
4
内容提要
[TOP]
第一节
第二节
第三节
第四节
第五节
4.1 第一节 氧化还原反应 4.1.1 氧化值
1
氧化值是某元素原子的表观荷电数,这种荷电数是假设把化学键中的电子指定给电负性较大的原子 而求得。确定元素氧化值的规则:1)单质中原子的氧化值为零。2)单原子离子中原子的氧化值等于离 子的电荷。3)氧的氧化值在大多数化合物中为-2,但在过氧化物中为-1。4)氢的氧化值在大多数化合 物中为+1,但在金属氢化物中为-1。5)卤族元素:氟的氧化值在所有化合物中均为-1,其它卤原子的 氧化值在二元化合物中为-1,但在卤族的二元化合物中,列周期表靠前的卤原子的氧化数为-1;在含氧 化合物中按氧的氧化值为-2 决定。6)电中性化合物中所有原子的氧化值之和为零。 4.1.2 氧化还原反应 元素的氧化值发生了变化的化学反应称为氧化还原反应。氧化还原反应可被拆分成两个半反应。 半反应中元素的氧化值升高称为氧化,元素的氧化值降低称为还原。氧化还原反应中,氧化反应和还原 反应同时存在,还原剂被氧化,氧化剂被还原,且得失电子数相等。 半反应的通式为 或 氧化型 + ne Ox + ne
-
还原型 Red
式中 n 为得失电子数,氧化型(Ox)包括氧化剂及相关介质,还原型(Red)包括还原剂及相关介质。氧化 型物质及对应的还原型物质称为氧化还原电对(Ox/Red) 。 4.1.3 氧化还原反应方程式的配平 离子-电子法(或半反应法)配平氧化还原反应方程式的方法是:1)写出氧化还原反应的离子方程 式。2)将离子方程式拆成氧化和还原两个半反应。3)根据物料平衡和电荷平衡,分别配平半反应(注意 不同介质中配平方法的差异) 。4)根据氧化剂和还原剂得失电子数相等,找出两个半反应的最小公倍数, 并把它们配平合并。5)可将配平的离子方程式写为分子方程式。 4.2 第二节 原电池与电极电位 4.2.1 原电池 将化学能转化成电能的装置称为原电池。原电池中电子输出极为负极;电子输入极为正极。正极发 生还原反应;负极发生氧化反应,正极反应和负极反应构成电池反应,即氧化还原反应。 常用的电极有金属-金属离子电极、气体电极、金属-金属难溶盐-阴离子电极、氧化还原电极四种 类型。 将两个电极组合起来构成一个原电池,原电池可用电池组成式表示。习惯上把正极写在右边,负极 写在左边;用“|”表示两相之间的界面;中间用“‖”表示盐桥。如 Zn-Cu 电池的电池组成式: (-) Zn(s)│Zn (c1) ‖Cu (c2)│Cu(s) 4.2.2 电极电位的产生和电池电动势
2+ 2+
[TOP]
(+)
2
实验五 氧化还原反应与电极电势
实验五 氧化还原反应与电极电势 一、实验目的 1、掌握电极电势对氧化还原反应的影响。 2、定性观察浓度、酸度对电极电势的影响。 3、定性观察浓度、酸度、温度、催化剂对氧化还原反应的方向、产物、速度的影响。 4、通过实验了解原电池的装置。 二、实验原理 氧化剂和还原剂的氧化、还原能力强弱,可根据她们的电极电势的相对大小来衡量。电极电势的值越大,则氧化态的氧化能力越强,其氧化态物质是较强氧化剂。电极电势的值越小,则还原态的还原能力越强,其还原态物质是较强还原剂。只有较强的氧化剂才能和较强还原剂反应。即φ氧化剂-φ还原剂﹥0时,氧化还原反应可以正方向进行。故根据电极电势可以判断氧化还原反应的方向。 利用氧化还原反应而产生电流的装置,称原电池。原电池的电动势等于正、负两极的电极电势之差:E = φ正-φ负。根据能斯特方程: ] [][lg 0591.0还原型氧化型半?+=n θ?? 其中[氧化型]/[还原型]表示氧化态一边各物质浓度幂次方的乘积与还原态一边各物质浓度幂次方乘积之比。所以氧化型或还原型的浓度、酸度改变时,则电极电势φ值必定发生改变,从而引起电动势E 将发生改变。准确测定电动势是用对消法在电位计上进行的。本实验只是为了定性进行比较,所以采用伏特计。浓度及酸度对电极电势的影响,可能导致氧化还原反应方向的改变,也可以影响氧化还原反应的产物。 三、仪器和药品 仪器:试管,烧杯,伏特计,表面皿,U 形管 药品:2 mol·L -1 HCl ,浓HNO 3, 1mol·L -1 HNO 3,3mol·L -1HAc ,1mol·L -1 H 2SO 4,3mol·L -1 H 2SO 4,0.1mol·L -1 H 2C 2O 4,浓NH 3·H 2O (2mol·L -1),6mol·L -1NaOH ,40%NaOH 。 1mol·L -1 ZnSO 4,1mol·L -1 CuSO 4,0.1mol·L -1KI ,0.1mol·L -1AgNO 3,0.1mol·L -1KBr ,0.1mol·L -1FeCl 3,0.1mol·L -1Fe 2(SO 4)3,0.1mol·L -1FeSO 4,1mol·L -1FeSO 4, 0.4mol·L -1K 2Cr 2O 7, 0.001mol·L -1KMnO 4,0.1mol·L -1Na 2SO 3,0.1mol·L -1Na 3AsO 3, 0.1mol·L -1 MnSO 4, 0.1mol·L -1NH 4SCN , 0.01mol·L -1I 2水,Br 2水,CCl 4,固体NH 4F ,固
orp氧化还原电位
关于氧化还原电位(ORP、Eh)去极化测定法的二十个问题 方建安 (中科院南京土壤研究所技术服务中心,南京传滴仪器设备有限公司)经常有人打电话或网上发Email于我,询问有关氧化还原电位(ORP)测定,特别是ORP去极化测定法的有关问题,为此把问题与答复集中成文,供大家参考和讨论。 一氧化还原电位是指什么? 氧化还原电位,简称ORP (是英文Oxidation-Reduction Potential的缩写)或Eh,作为介质(包括土壤、天然水、培养基等)环境条件的一个综合性指标,已沿用很久,它表征介质氧化性或还原性的相对程度。 二氧化还原电位的传统测定方法是什么? 长期以来氧化还原电位是采用铂电极直接测定法。即将铂电极和参比电极直接插入介质中来测定。ORP电极是一种可以在其敏感层表面进行电子吸收或释放的电极,该敏感层是一种惰性金属,通常是用铂和金来制作。参比电极是饱和甘汞电极或银/氯化银电极。 三氧化还原电位的传统测定法有什么特点? 氧化还原电位的传统测定法十分简单,它由ORP复合电极和mV计组成。但达到平衡电位值的时间较长,特别在测定弱平衡体系时,由于铂电极并非绝对的惰性,其表面可形成氧化膜或吸附其它物质。影响各氧化还原电对在铂电极上的电子交换速率,因此平衡电位的建立极为缓慢,在有的介质中需经几小时甚至一、二天, 而且测定误差甚大,通常40-100mV。因此通常在ORP测定中人为规定一个读数时间,如5分钟,或者10分钟,或者30分钟------等。在发表文章或上报数据时,必须标识读数时间。 四用什么方法可以得到相对精确的测定结果? 如果充分考虑了铂电极的表面性质和电极电位建立的动力学过程,对复杂的介质,如果采用了去极化法测定氧化还原电位,可以在较短时间2分钟内得到较为精确的结果,这个结果相当于传统测定方法平衡48小时的电位,通常两者小于10mV或更好。 五什么是氧化还原电位去极化法测定法? 将极化电压调节到600-750mV,以银—氯化银电极作为辅助电极,铂电极接到电源的正端,阳极极化(极化时间5-15秒中自由选择),接着切断极化电源(去极化时间在20秒以上自由选择),去极化时监测铂电极的电位(对甘汞电极)。电极电位E(毫伏)和去极化时间的对数logt之间存在直线关系。以相同的方法进行阴极极化和随后的去极化监测。阳极去极化曲线与阴极去极化曲线的延长线的交点相当于平衡电位。二条曲线的方程为: E阳=a1+b1logt阳E阴=a2+b2logt阴 求解此二直线方程可得到平衡电位公式E=(a2b1-a1b2)/(b1-b2) 平衡电位加上该温度下 参比电极的电位值,即 可求出ORP值。 将有关两条去极化曲线 的数据输入计算机,即 可自动算出土壤的ORP 值。 这种方法如果用手工测 定,不但过程操作紧张, 测定误差大,而且数学 处理繁重。 六现在有这种ORP去 极化法自动测定仪器 吗? 这种方法是中国科 学院南京土壤研究所电
氧化还原反应经典练习题目
氧化还原反应练习题 一、选择题 1.下列反应一定属于氧化还原反应的是( ) A.化合反应 B.分解反应 C.置换反应 D.复分解反应 2.下列反应中,属于非氧化还原反应的是 ( ) A.3CuS+8HNO3=3Cu(NO3)2+2NO↑+3S↓+4H2O B.3Cl2+6KOH =5KCl+KClO3+3H2O C.3H2O2+2KCrO2+2KOH =2K2CrO4+4H2O D.3CCl4+K2Cr2O7=2CrO2Cl2+3COCl2+2KCl (COCl2碳酰氯) 3.某元素在化学反应中由化合态变为游离态,则该元素( ) A.一定被氧化 B.一定被还原 C.既可能被氧化,也可能被还原 D.以上都不是 4.根据以下几个反应: ①Cl2+2KI ==== 2KCl+I2 ②2FeCl2+Cl2 ==== 2FeCl3 ③2FeCl3+2KI ==== 2FeCl2+2KCl+I2判断氧化性由强到弱的顺序是( ) A.Cl2>I2>Fe3+B.Cl2>Fe3+>I2 C. Fe3+>I2>Cl2 D.Fe3+>I2>Cl2 5.下列关于氧化还原反应说法正确的是() A.肯定一种元素被氧化,另一种元素被还原 B.某元素从化合态变成游离态,该元素一定被还原 C.在反应中不一定所有元素的化合价都发生变化 D.在氧化还原反应中非金属单质一定是氧化剂 6.下列变化过程属于还原反应的是( ) A.HCl→MgCl2 B.Na→Na+ C.CO→CO2 D. Fe3+→Fe 7.下列叙述正确的是( ) A.氧化还原反应的本质是化合价发生变化 B.有单质产生的分解反应一定是氧化还原反应 C.氧化剂在同一反应中既可以是反应物,也可以是生成物 D.还原剂在反应中发生还原反应 8.下列变化需要加入氧化剂的是( )
氧化还原反应难题
氧化还原反应的配平和计算难题赏析 1、已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化: 如果分别用等物质的量的这些物质氧化足量的KI,得到I 2 最多的是( ) A.Fe3+ B. C.Cl2 D.HNO2 2、将4.9克Mg和Fe的混合物在一定量的稀HNO 3 溶液中完全溶解(溶液中有Fe2+),得到标况下气体2.24L(假设全为NO气体),则向反应后的溶液中加入足量的烧碱,在空气中不断搅拌,充分反应后,则生成沉淀的质量是 ( ) A. 6g B. 8g C. 10g D. 12g 3、Cu 2S与一定浓度的HNO 3 反应,生成Cu(NO 3 ) 2 、CuSO 4 、NO、NO 2 和水,当NO和NO 2 的物质 的量之比为1:1时,实际参加反应的Cu 2S与HNO 3 的物质的量之比是多少? 4、羟胺(NH 2 OH)是一种还原剂,能将某些氧化剂还原。现用25.00mL 0.049 mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.65mL 0.020 mol/L 的KMnO 4酸性溶液完全作用。已知(未配平):FeSO 4 +KMnO 4 +H 2 SO 4 →Fe 2 (SO 4 ) 3 +K 2 SO 4 +MnSO 4 +H 2 O 则在上述反应中,羟胺的氧化产物是()。 A.N 2 B.N 2 O C.NO D.NO 2 5、下列有关硫化亚铁跟浓硫酸反应的方程式正确的是() A. 2 FeS+6H 2SO 4 =Fe 2 (SO 4 ) 3 +3SO 2 ↑+2S+6H 2 O B. 4 FeS+18H 2SO 4 =2Fe 2 (SO 4 ) 3 +9SO 2 ↑+7S+18H 2 O C. 6 FeS+16H 2SO 4 =3Fe 2 (SO 4 ) 3 +6SO 2 ↑+7S+16H 2 O D. 8 FeS+18H 2SO 4 =4Fe 2 (SO 4 ) 3 +3SO 2 ↑+11S+18H 2 O 6、已知KH和H 2 O反应生成H2和KOH,反应中1 molKH() A.失去1 mol电子B.得到1 mol电子 C.失去2 mol电子D.没有电子得失 7、三氟化溴溶于水可发生如下反应: BrF3+H2O?→ ?HBrO3+Br2+HF+O2↑ (1)其中发生自身氧化还原反应的物质是____________; (2)当有5.0 mol水参加反应时,由水还原的BrF3的物质的量为____________,由BrF3还原的BrF3的物质的量为____________; (3)当有 5.0 mol水作还原剂参加化学反应时,由水还原的BrF3的物质的量为____________,由BrF3还原的BrF3的物质的量为____________;
实验五--氧化还原反应与电极电势
实验五--氧化还原反应与电极电势
————————————————————————————————作者:————————————————————————————————日期:
实验五 氧化还原反应与电极电势 一、实验目的 1、掌握电极电势对氧化还原反应的影响。 2、定性观察浓度、酸度对电极电势的影响。 3、定性观察浓度、酸度、温度、催化剂对氧化还原反应的方向、产物、速度的影响。 4、通过实验了解原电池的装置。 二、实验原理 氧化剂和还原剂的氧化、还原能力强弱,可根据她们的电极电势的相对大小来衡量。电极电势的值越大,则氧化态的氧化能力越强,其氧化态物质是较强氧化剂。电极电势的值越小,则还原态的还原能力越强,其还原态物质是较强还原剂。只有较强的氧化剂才能和较强还原剂反应。即φ氧化剂-φ还原剂﹥0时,氧化还原反应可以正方向进行。故根据电极电势可以判断氧化还原反应的方向。 利用氧化还原反应而产生电流的装置,称原电池。原电池的电动势等于正、负两极的电极电势之差:E = φ正-φ负。根据能斯特方程: ] [][lg 0591.0还原型氧化型半?+=n θ?? 其中[氧化型]/[还原型]表示氧化态一边各物质浓度幂次方的乘积与还原态一边各物质浓度幂次方乘积之比。所以氧化型或还原型的浓度、酸度改变时,则电极电势φ值必定发生改变,从而引起电动势E 将发生改变。准确测定电动势是用对消法在电位计上进行的。本实验只是为了定性进行比较,所以采用伏特计。浓度及酸度对电极电势的影响,可能导致氧化还原反应方向的改变,也可以影响氧化还原反应的产物。 三、仪器和药品 仪器:试管,烧杯,伏特计,表面皿,U 形管 药品:2 mol·L -1 HCl ,浓HNO 3, 1mol·L -1 HNO 3,3mol·L -1HAc ,1mol·L -1 H 2SO 4,3mol·L -1 H 2SO 4,0.1mol·L -1 H 2C 2O 4,浓NH 3·H 2O (2mol·L -1),6mol·L -1NaOH ,40%NaOH 。 1mol·L -1 ZnSO 4,1mol·L -1 CuSO 4,0.1mol·L -1KI ,0.1mol·L -1AgNO 3,0.1mol·L -1KBr ,0.1mol·L -1FeCl 3,0.1mol·L -1Fe 2(SO 4)3,0.1mol·L -1FeSO 4,1mol·L -1FeSO 4, 0.4mol·L -1K 2Cr 2O 7, 0.001mol·L -1KMnO 4,0.1mol·L -1Na 2SO 3,0.1mol·L -1Na 3AsO 3, 0.1mol·L -1 MnSO 4, 0.1mol·L -1NH 4SCN , 0.01mol·L -1I 2水,Br 2水,CCl 4,固体NH 4F ,固
氧化还原反应与电极电位
第八章氧化还原反应与电极电位首页难题解析学生自测题学生自测答案章后习题答案难题解析[TOP] 例8-1 写出并配平下列各电池的电极反应、电池反应,注明电极的种类。 (1)(-) Ag,AgCl(s) |HCl |Cl2(100kp),Pt (+) (2)(-) Pb, PbSO4(s)| K2SO4‖KCl| PbCl2(s),Pb (+) (3)(-) Zn | Zn2+‖MnO4-, Mn2+, H+| Pt (+) (4)(-) Ag | Ag+ (c1)‖Ag+(c2) |Ag (+) 析将所给原电池拆分为两个电极。负极发生氧化反应,正极发生还原反应,写出正、负极反应式,由正极反应和负极反应相加构成电池反应。 解(1)正极反应Cl2+2e-→ 2 Cl-此电极为气体电极 负极反应Ag+Cl-→ AgCl(s)+e-此电极为金属-难溶盐-阴离子电极 电池反应2Ag+Cl2→2AgCl(s) n=2 (2)正极反应PbCl2(s)+2e-→Pb+2Cl- 此电极为金属-难溶盐-阴离子电极 负极反应Pb+SO42- →PbSO4(s)+2e-此电极为金属-难溶盐-阴离子电极 电池反应PbCl2(s) +SO42-→PbSO4(s) +2Cl-n=2 (3)正极反应MnO4- +8 H++5e-→Mn2++ 4 H2O 此电极为氧化还原电极 负极反应Zn → Zn2++2e-此电极为金属及其离子电极 电池反应2MnO4- +16 H++5Zn→2Mn2++8 H2O+5Zn2+ n=10 (4)正极反应Ag+(c2) +e- → Ag 此电极为金属及其离子电极 负极反应Ag → Ag+ (c1) + e-此电极为金属及其离子电极 电池反应Ag+(c2) → Ag+ (c1) n=1 例8-2 25℃时测得电池(-) Ag,AgCl(s) |HCl(c) |Cl2(100kp),Pt (+) 的电动势为 1.136V,已知θ ?( Cl2/Cl-)=1.358V, θ?( Ag+/Ag)=0.799 6V,求AgCl的溶度积。 ?AgCl/Ag 。(2) AgCl的平衡析首先根据电池电动势和已知的标准电极电位,由Nernst方程求出θ AgCl(s)Ag+ + Cl-,方程式两侧各加Ag:
【化学】化学氧化还原反应的专项培优 易错 难题练习题(含答案)附详细答案
【化学】化学氧化还原反应的专项培优 易错 难题练习题(含答案)附详细答案 一、高中化学氧化还原反应 1.工业上处理含苯酚废水的过程如下。回答下列问题: Ⅰ.测定废水中苯酚的含量。 测定原理: +3Br 2→↓+3HBr 测定步骤: 步骤1:准确量取25.00mL 待测废水于250mL 锥形瓶中。 步骤2:将5.00mL 1amol L -?浓溴水(量)迅速加入到锥形瓶中,塞紧瓶塞,振荡。 步骤3:打开瓶塞,向锥形瓶中迅速加入bmL 10.10mol L -?KI 溶液(过量),塞紧瓶塞,振荡。 步骤4:滴入2~3滴指示剂,再用10.010mol L -?223Na S O 标准溶液滴定至终点,消耗223Na S O 溶液1V mL (反应原理:2223246I 2Na S O 2NaI Na S O +=+)。待测废水换为蒸馏水,重复上述步骤(即进行空白实验),消耗223Na S O 溶液2V mL 。 (1)“步骤1”量取待测废水所用仪器是________。 (2)为了防止溴的挥发,上述步骤中采取的措施包括迅速加入试剂和________。 (3)“步骤4”滴定终点的现象为________。 (4)该废水中苯酚的含量为________1mg L -?(用含1V 、2V 的代数式表示)。如果空白实验中“步骤2”忘记塞紧瓶塞,则测得的废水中苯酚的含量________(填“偏高”“偏低”或“无影响”,下同);如果空白实验中“步骤4”滴定至终点时俯视读数,则测得的废水中苯酚的含量________。 Ⅱ.处理废水。采用Ti 基2PbO 为阳极,不锈钢为阴极,含苯酚的废水为电解液,通过电解,阳极上产生羟基(·OH ),阴极上产生22H O 。通过交排列的阴阳两极的协同作用,在各自区域将苯酚深度氧化为2CO 和2H O 。 (5)写出阳极的电极反应式:________。 (6)写出苯酚在阴极附近被22H O 深度氧化的化学方程式:________。 【答案】(酸式)滴定管 塞紧瓶塞 滴入一滴溶液后,锥形瓶内溶液蓝色恰好褪去,且半分钟不恢复原色 ()2194V -V 15 偏低 偏低 2H O e OH H -+-=?+ 652222C H OH 14H O 6CO 17H O +=↑+ 【解析】 【分析】 向呈有待测废水加入浓溴水反应后得到三溴苯酚的沉淀,再加入KI 溶液与剩下的Br 2发生氧化还原反应得到I 2,方程式为Br 2+2I -===I 2+2Br -,再用Na 2S 2O 3标准溶液滴定I 2,可根据消耗的Na 2S 2O 3标准溶液的体积和浓度算出溶液中剩余的Br 2的物质的量,再设置一个空白实
氧化还原反应难点分析
氧化还原反应难点分析 1 氧化性、还原性相对强弱的比较 (1)利用元素的化合价比较:一般来说,元素的化合价越高,物质的氧化性越强。如H2SO4、SO2、S的氧化性强弱逐渐减弱。元素的化合价越低,物质的还原性越强。如H2S、S、SO2的还原性逐渐减弱。若元素的化合价最高,该元素所决定的物质只有氧化性。如浓H2SO4,若元素的化合价最低,该元素所决定的物质只有还原性。如Na,若为中间价,具两性。 (2)利用与同种还原剂或氧化剂的反应情况比较:如Cl2能将Fe氧化为+3价,而S只能将Fe氧化为+2价,氧化性Cl2>S。Mg与盐酸反应很快,Fe与盐酸反应较慢,Cu与盐酸不反应,还原性Mg>Fe>Cu。 (3)利用金属活动性顺序的关系比较: 在金属活动性顺序中从前到后,金属原子的还原性逐渐减弱,金属离子的氧化性逐渐增强。氧化性,还原性的强弱在于得失电子能力强弱,与得失电子的多少无关。如还原性Na>Fe (4)根据反应反应条件判断 如:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O 2KMnO4+16HCl== 2KCl + 2MnCl2+5Cl2↑+8H2O 同样是将浓盐酸氧化为Cl2,MnO2必须在加热的条件下才能进行,而KMnO4在常温下即可进行,说明氧化性:KMnO4>MnO2 2 氧化还原反应基本规律 (1)守恒定律(电子、质量) (2)强弱定律氧化性:氧化剂>氧化产物还原性:还原剂>还原产物 (3)转化规律氧化还原反应中,以元素相邻价态间的转化最容易,同种元素不同价态间若发生反应,元素的化合价只靠近而不交叉。同种元素相邻价态间不发生反应。(4)先后规律在浓度相差不大的溶液中,同时含有几种还原剂(或氧化剂)时,若加入氧化剂(或还原剂),则它首先与还原性(或氧化性)最强的还原剂(或氧化剂)作用。 3 氧化还原反应配平的一般步骤: (1)找出反应前后化合价发生变化的元素 (2)分析各变价元素的化合价升、降的价数 (3)以化学式为单位,求出化合价升、降价数的最小公倍数,使有关元素的化合价升、降总价数相等。
