FI12 - Preparations for Vendor & Customer Transactions

Preparations for Vendor & Customer Transactions
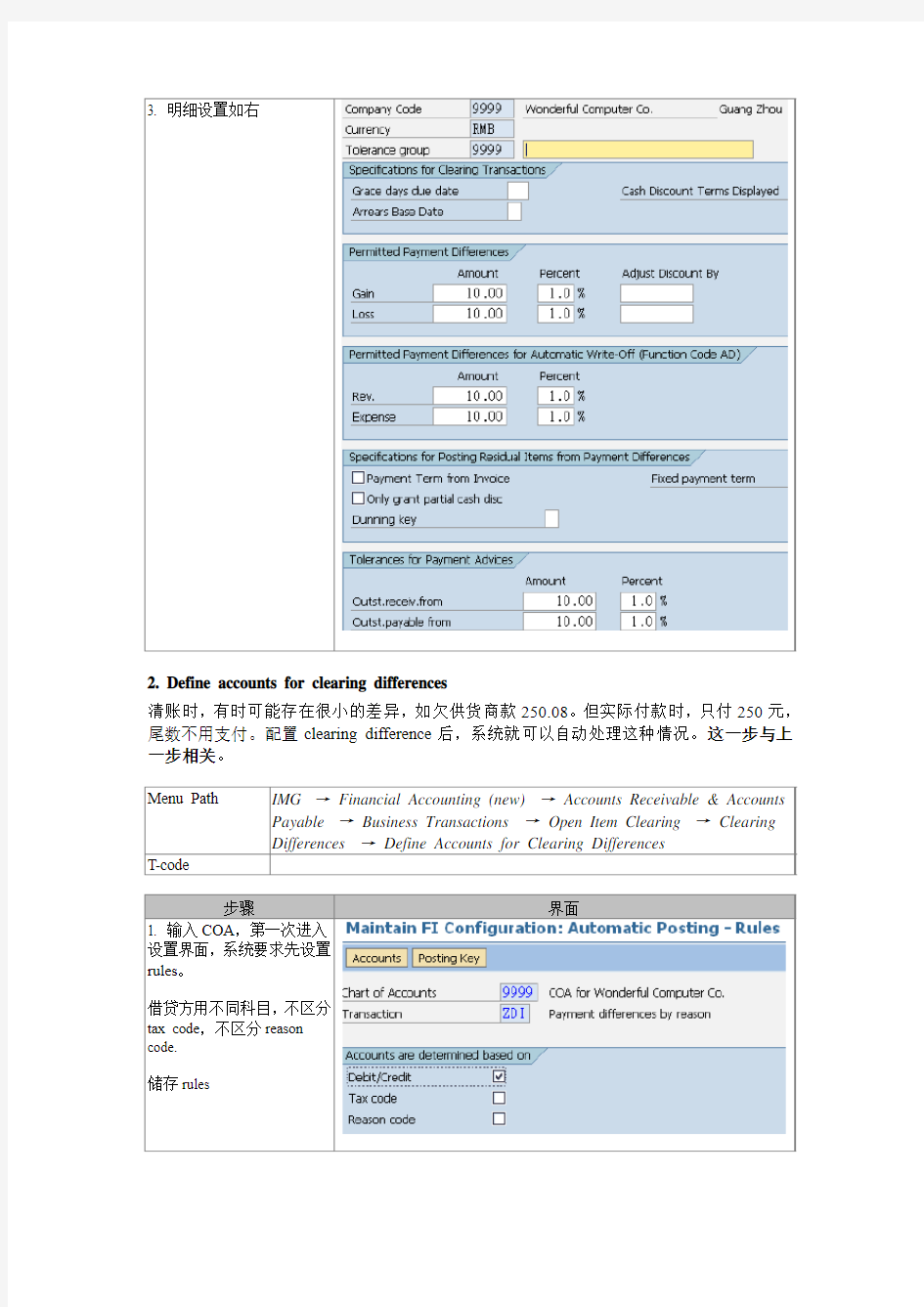
Vendor和Customer在SAP系统中属于reconciliation account,具有open item管理功能。因此首先要定义tolerance group,以及配置open item clearing。主要内容如下:
1. Define tolerances for vendors / customers
2. Define accounts for clearing differences
3. Define accounts for exchange rate differences
4. Define accounts for rounding differences
1. Define tolerances for vendors / customers
2. Define accounts for clearing differences
清账时,有时可能存在很小的差异,如欠供货商款250.08。但实际付款时,只付250元,尾数不用支付。配置clearing difference后,系统就可以自动处理这种情况。这一步与上一步相关。
3. Define accounts for exchange rate differences
对于外币业务,有时会出现汇率差异,典型的情况是,支付多张发票时,每张发票折算成本位币之和,与外币总额按汇率折算成本位币之金额有一点差异。这种情况就需要配置汇率差异所使用的科目。
此项设置方法在Config for Account Clearing中已有讲解,请参考,不再重复。
4. Define accounts for rounding differences
设置完成后,可以进行Vendor / Customer的收付款和结清。
经典与量有关的离子方程式的书写
与量有关的离子方程式的书写 一.复分解反应 1 . (1)酸式盐与碱的反应 “少定多变”,把量少的反应物的系数定为“1”,以量少的反应物离子数来确定量多的反应物离子前面的系数。【例1】①少量NaHCO3与Ca(OH)2反应; ②过量NaHCO3与Ca(OH)2反应: 【例2】NH4HSO4与NaOH反应 当NaOH少量时: 当NaOH过量: (2)多元弱酸的酸酐与碱的反应 【例3】将SO2通入NaOH溶液中: 思考:(1)将CO2通入NaOH溶液中的存在的溶质有几种情况? (2)将SO2或CO2通入氨水中,溶液中存在的溶质有几种情况?请写出相应的离子方程式。 (3)碳酸钠溶液中通入二氧化硫气体,发生的离子方程式为: 2.定量型 【例4】明矾与等物质的量Ba(OH)2反应: 3.目标型 【例5】向明矾(kAl(SO4)2·12H2O)溶液中滴加Ba(OH)2溶液,写出符合下列条件的离子方程式。 ①当Al3+完全沉淀时的离子方程式: ②当SO42-完全沉淀时的离子方程式: 4.条件不同相同反应物之间的反应 (1)反应物滴加的顺序不同 【例6】向碳酸钠溶液中滴加盐酸: 【例7】向AlCl3溶液中滴加NaOH溶液: 【例8】向NaAlO2溶液中滴加盐酸: (2)反应条件不同:常温:NH4++OH-=NH3·H2O 加热:NH4++OH- NH3↑+H2O (3)微溶物状态不同 石灰乳中加入苏打溶液:Ca(OH)2+CO32-=CaCO3↓+2OH-,澄清石灰水中加入苏打溶液:Ca2++CO32-=CaCO3↓二.氧化还原反应 【例9】将x mol Cl2通入a mol FeBr2溶液中, ①当x≤0.5amol时,反应的离子方程式是; ②当x≥1.5amol时,反应的离子方程式是; ③当x=amol时,反应的离子方程式是。 【例10】将x mol Fe加入含a mol HNO3的稀溶液中,写出下列配比下的离子方程式: ⑴当x≤0.25amol时,反应的离子方程式是; ⑵当x≥0.375amol时,反应的离子方程式是;
与量有关的离子方程式的书写
一、写出下列反应的离子方程式(产物与过量的物质继续反应型) 1.向Na2CO3溶液中滴入盐酸溶液至过量 2.向Ba(OH)2溶液中通入CO2气体至过量 3.向AlCl3溶液中滴入NaOH溶液至过量 4.向NaAlO2溶液中滴入盐酸溶液至过量 5.向NaAlO2溶液中通入CO2气体至过量 二、写出下列反应的离子方程式(酸式盐与碱反应型) 6.向NaHCO3溶液中加入足量澄清石灰水 7.向NaHCO3溶液中加入少量澄清石灰水 8.向Ca(HCO3)2溶液中加入少量NaOH溶液 9.向Ca(HCO3)2溶液中加入足量NaOH溶液
10.向Mg (HCO3)2溶液中加入少量的澄清石灰水 11.向Mg(HCO3)2溶液中加入足量的澄清石灰水 三、写出下列反应的离子方程式(限制条件型) 12.向Ba(OH)2溶液中逐滴加入NaHSO4溶液至刚好沉淀完全 13.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性 14.氢氧化钡溶液与KAl(SO4)2·12H2O(明矾)的反应 生成沉淀的物质的量最大:_________________________________。 生成沉淀的质量最大:_______________________________________________。 四、写出下列反应的离子方程式(竞争反应型) 15.向NH4HCO3溶液中加入少量NaOH溶液 16.向NH4HCO3溶液中加入足量NaOH溶液并加热
五、写出下列反应的离子方程式(氧化还原型) 17.含有a molFeBr2的溶液中,通入x molCl2。写出发生反应的离子方程式: (1)x=0.4a(2)x=0.6a (3)x=a (4)x=1.5a 六、离子方程式的书写判断 18.向10mL0.1mol·L-1NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是( ) A.x=10时,溶液中有NH+4、Al3+、SO2-4,且c(NH+4)=c(Al3+) B.x=20时,溶液中所发生反应的离子方程式为Al3++2SO2-4+2Ba2++4OH-===AlO-2+2H2O+2BaSO4↓C.x=30时,溶液中有Ba2+、AlO-2、OH-,且c(OH-) 跟量有关的离子方程式的书写 一连续性 指反应生成的离子因又能跟剩余(过量)的反应物继续反应而跟用量有关。 1.(1)可溶性多元弱酸(或其酸酐)与碱溶液反应。如SO2通入Ca(OH)2溶液中: ①碱过量:; ②碱不足:。 ③1mol Ca(OH)2溶液中通入1.2 mol SO2: (2)多元弱酸(或其酸酐)与更弱酸的盐溶液反应。如CO2通入NaAlO2溶液中: ①NaAlO2过量:; ②NaAlO2不足: ③将少量SO2通入到Ca(ClO)2溶液中 (3)多元弱酸盐与强酸反应。如Na2CO3溶液与稀盐酸: 盐酸不足:; 盐酸过量:。 (4)铝盐溶液与强碱溶液 铝盐过量:; 强碱过量:。 (5)AgNO3溶液中加入过量氨水。 (6)Fe与稀HNO3溶液 Fe过量:; HNO3过量:。 二先后型 一种反应物的两种或两种以上的组成离子,都能跟另一种反应物的组成离子反应,但因反应次序不同而跟用量有关。又可称为竞争型。 1.NH4HSO4溶液与NaOH溶液的反应: NaOH不足:; NaOH过量:。 2.某溶液中含有1mol H2SO4和1mol NH4Al(SO4)2,加入NaOH x mol x=1 :; x=3 :; x=6 :; x=6.5 :; 3.将xmol Cl2通入a mol FeBr2溶液中, ①当x≤0.5a mol时,; ②当x≥1.5a mol时,; ③当x= a mol时,; ④当x=1.4a mol时,; 4.将Cl2通入FeI2溶液中,当Fe2+被氧化1/2时, 5.将x mol Fe加入含amol HNO3的稀溶液中,写出下列配比时的离子方程式: ⑴当x≤0.25a mol时,; ⑵当x≥0.375a mol时,; ⑶把6.72g铁粉放入100ml 4mol/L的稀硝酸中,。 三配比型 当一种反应物中有两种或两种以上组成离子参与反应时,因其组成比例不协调(一般为复盐或酸式盐),当一种组成离子恰好完全反应时,另一种组成离子不能恰好完全反应(有剩余或不足)而跟用量有关。 1.(1)Ca(HCO3)2溶液与NaOH溶液: NaOH不足:; NaOH过量:。 (2)NaHSO4溶液与Ba(HCO3)2溶液: NaHSO4不足:; NaHSO4过量:。 (3)Ca(OH)2溶液与Ca(HCO3)2溶液: Ca(OH)2不足:; Ca(OH)2过量:。 (4)NaHSO4溶液与Ba(OH)2溶液: 溶液呈中性时:; SO2-4完全沉淀时:。 2.向明矾(KAl(SO4)2·12H2O)溶液中滴加Ba(OH)2溶液,写出符合下列条件的离子方程式。 ①当沉淀物质的量最多时的离子方程式: ②当沉淀质量最多时的离子方程式: 3.①碳酸钠溶液中加入少量氯水 ②碳酸钠溶液中加入过量氯水 ③氯水中加入过量碳酸钙 与量有关的离子方程式 总结 集团档案编码:[YTTR-YTPT28-YTNTL98-UYTYNN08] 与量有关的离子方程式的书写技巧:a.生成物与过量的反应物继续反应的情况: 例:AlCl 3与NaOH(由少到多):Al3++3OH-→Al(OH) 3 ↓Al(OH) 3 +OH-→AlO 2 -+2H 2 O b.滴加顺序不同,离子反应不同: 例:Na 2CO 3 中逐滴加入HCl:CO 3 2-+H+→HCO 3 - HCO 3-+H+→H 2 O+CO 2 ↑ NaOH中逐滴加入AlCl 3:Al3++4OH-→AlO 2 -+2H 2 O?3AlO 2 -+Al3++6H 2 O→4Al(OH) 3 ↓ c.一种物质中有两种离子参加反应时,反应物用量不同,反应不同。 书写原则:不足量物质参加反应的离子按组成比参加反应,而过量物质则按需要确定其离子的物质的量。 反应物I反应物II滴加顺序离子方程式 Ca(OH)2少量CO2Ca2++2OH-+CO2?→CaCO3↓+H2O 足量CO2Ca2++2OH-+2CO2?→Ca2+?+2HCO3- 氨水少量SO22NH3·H2O+2SO2→2NH4++SO32-+H2O 足量SO2NH3·H2O+2SO2→2NH4++HSO3- AlCl3少量NaOH NaOH滴入AlCl3Al3++3OH-→Al(OH)3↓ 足量NaOH AlCl3滴入NaOH Al3++4OH-→AlO2-+2H2O NaAlO2少量HCl盐酸滴入NaAlO2H++AlO2-+H2O?→Al(OH)3↓ 足量HCl NaAlO2滴入盐酸AlO2-+4H+→2H2O+Al3+ FeBr2少量Cl2氯水滴入FeBr22Fe2++Cl2→2Fe3++2Cl- 足量Cl2FeBr2滴入氯水2Fe2++4Br-+3Cl2→2Fe3++2Br2+6Cl- Ca(OH)2少量NaHCO3NaHCO3滴入石灰水Ca2++OH-+HCO3-→CaCO3↓+H2O 足量NaHCO3石灰水滴入NaHCO3Ca2++2OH-+2HCO3-→CaCO3↓+2H2O+CO32- Ca(HCO3)2少量NaOH NaOH滴入Ca(HCO3)2Ca2++OH-+HCO3-→CaCO3↓+H2O 足量NaOH Ca(HCO3)2滴入NaOH Ca2++2OH-+2HCO3-→CaCO3↓+2H2O+CO32- AgNO3少量NH3·H2O NH3·H2O滴入AgNO3Ag++NH3·H2O→AgOH↓+NH4+ 足量NH3·H2O AgNO3滴入NH3·H2O Ag++2NH3·H2O→[Ag(NH3)2]++2H2O 一、生成的产物可与过量的物质继续反应的离子反应 一、NAOH 1、向AlCl3溶液中滴入NaOH溶液至过量,先出现白色沉淀,后沉淀消失。其离子反应分步写: (1)Al3++3OH-==Al(OH)3↓(2)Al(OH)3+OH-==AlO2-+2H2O 若向NaOH溶液中滴入AlCl3溶液至过量,边滴边振荡,开始时无明显现象,后出现白色沉淀。其离子反应分步写:(1)Al3++4OH-==AlO2-+2H2O(2)3AlO2-+Al3++6H2O==4Al(OH)3↓ 若向AlCl3溶液中加入过量NaOH溶液,其离子反应一步完成:Al3++4OH-==AlO2-+2H2O 若向足量Al2(SO4)3溶液中加入少量的NaOH溶液,其离子方程式为:Al3++3OH-==Al(OH)3↓ 2、向足量的Ca(HCO3)2溶液中逐渐滴入NaOH溶液 化学方程式:NaOH+Ca(HCO3)2==H2O+CaCO3↓+NaHCO3 离子方程式:OH-+Ca2++HCO3-==H2O+CaCO3↓ 若向足量的NaOH溶液中逐渐滴入Ca(HCO3)2溶液 化学方程式:Ca(HCO3)2+2NaOH==2H2O+CaCO3↓+Na2CO3 离子方程式:Ca2++2HCO3-+2OH-==2H2O+CaCO3↓+CO32- 3、向足量的NH4HCO3溶液中逐渐滴入NaOH溶液 化学方程式:NH4HCO3+2NaOH==NH3.H2O+H2O+Na2CO3 离子方程式:NH4++HCO3-+2OH-==NH3.H2O+H2O+CO32- 若向NH4HCO3溶液中加入过量NaOH溶液并加热 化学方程式:NH4HCO3+2NaOH==NH3↑+2H2O+Na2CO3 离子方程式:NH4++HCO3-+2OH-==NH3↑+2H2O+CO32- 4、向NaOH溶液中逐渐滴入Mg(HCO3)2溶液至沉淀完全 化学方程式:Mg(HCO3)2+4NaOH==2H2O+Mg(OH)2↓+2Na2CO3 离子方程式:Mg2++2HCO3-+4OH-==2H2O+Mg(OH)2↓+2CO32- 若向Mg(HCO3)2溶液中逐渐滴入NaOH溶液至沉淀完全 化学方程式:2NaOH+Mg(HCO3)2==Mg(OH)2↓+2NaHCO3 离子方程式:2OH-+Mg2+==Mg(OH)2↓ 5、碳酸氢钙与烧碱 在碳酸氢钙溶液中滴入少量烧碱溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O 反滴时则为:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O 6、氢氧化钠与氢硫酸 NaOH溶液滴入足量氢硫酸中与氢硫酸滴入NaOH溶液中均无明显现象,发生的离子反应方程式分别为:(1)OH-+H2S=HS-+H2O(2)2OH-+H2S=S2-+2H2O 若将氢硫酸换成亚硫酸、碳酸或磷酸,则原理类似。 与“量”有关的离子方程式书写一.酸性氧化物与碱溶液(或盐溶液) CO2+NaOH----- (SO2) CO2+Ca(OH)2----- (SO2) CO2+ NH3·H2O ----- (SO2) CO2+ Ca(ClO)2----- CO2+Na2SiO3(NaAlO2) ----- CO2+ -ONa----- SO2+ Ca(ClO)2----- 二.多元弱酸盐溶液与强酸 Na2CO3 Na2SO3 Na2S + HCl 三.酸式盐溶液与强碱溶液的反应(以少定多) ...... 1.碳酸氢钙加氢氧化钠 碳酸氢钙少:氢氧化钠少: 2.碳酸氢钠加氢氧化钙 碳酸氢钠少:氢氧化钙少: 3. 碳酸氢钠加氢氧化钡 碳酸氢钠少:氢氧化钡少: 4.碳酸氢钙加氢氧化钙 5 .碳酸氢镁加氢氧化钙四.可溶性铝盐与强碱(或弱碱)溶液之间的反应 Al3++OH- AlO2-+H+ Al3++NH3·H2O AlO2-+CO2+H2O 五.FeBr2溶液与Cl2之间的反应 FeBr2溶液中通入少量Cl2 FeBr2溶液中通入过量Cl2 六.涉及金属的反应 有关金属量不同离子反应也不同的问题,比较重要的有铁与稀硝酸的反应。如果铁的量不足,产物是Fe3+、NO和H2O ;如果铁过量,产物是Fe2+、NO和H2O 。 七. 目标型 向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全: 向明矾溶液中逐滴加入Ba(OH)2溶液至Al3+刚好沉淀完全: 一。单选 1.能正确表示下列反应的离子方程式是() A.碳酸氢钙溶液和氢氧化钠溶液混合HCO3-+OH-==CO32-+H2O B.醋酸钠溶液和盐酸混合CH3COONa+H+ == CH3COOH + Na+ C.少量金属钠放入冷水中Na+ 2H2O== Na++2OH-+H2↑ D.硫酸铜溶液和氢氧化钡溶液混合Cu2+ + SO42- +Ba2+ + 2OH-== Cu(OH)2↓+ BaSO4↓ 2.(07江苏高考题)下列离子方程式书写正确的是() A.过量的SO2通入NaOH溶液中:SO2+2OH-=SO32-+H2O B.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 C.NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O D.NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32- 3.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是() A .二硫化碳的分子模型为 B.向碳酸氢镁溶液中加入过量氢氧化钠:Mg2++HCO- 3+OH-MgCO3↓+H2O C.硫氢化钠的水解:HS-+H2O H3O++S2- D.表示氢气燃烧热的热化学方程式:2H2(g)+O2(g)2H2O(g);ΔH=-571kJ/mol 4..(2009·广东茂名模拟)下列离子方程式书写正确的是() A.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-= CaSO3↓+2HClO B.NH4HSO3溶液与足量的NaOH溶液混合后加热:NH4++HSO3-+2OH-△NH3↑+SO32-+2H2O C.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH- D.氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-= CaSO4↓+H2O 5.下列反应的离子方程式正确的是() A.硫酸铝溶液和小苏打溶液反应:Al3++3HCO- 3 ===3CO2↑+Al(OH)3↓ B.向Ca(ClO)2溶液中通入二氧化硫:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO C.硫化亚铁中加入盐酸:S2-+2H+===H2S↑ D.钠和冷水反应:Na+2H2O===Na++H2↑+2OH- 6.下列离子方程式书写正确的是()A.FeCl2溶液中通Cl2:Fe2++Cl2===Fe3++2Cl- B.澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO- 3 ===CaCO3↓+H2O C.FeS固体放入稀硝酸溶液中:FeS+2H+===Fe3++H2S↑ D.AlCl3溶液中加入过量氨水:Al3++4OH-===AlO2-+2H2O 7.下列反应的离子方程式书写正确的是()A.浓烧碱溶液中加入铝片:Al + 2OH-=AlO2-+H2↑ B.以石墨作电极电解氯化铝溶液:2Cl-+2H2O 电解2OH-+H2↑+Cl2↑ C.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2 +2H+=2Fe3++2H2O D.硫酸氢钠溶液与足量氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O 8.能正确表示下列反应的离子方程式是()A.醋酸钠的水解反应CH3COO-+H3O+=CH3COOH+H2O B.碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-C.苯酚钠溶液与二氧化碳反应C6H5O-+CO2+H2O=C6H5OH+CO32- D.稀硝酸与过量的铁屑反应3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O 9.下列反应的离子方程式正确的是()A.次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2===CaCO3↓+2HClO B.FeSO4溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+===Fe3++4H2O C.用氨水吸收少量SO2:NH3·H2O+SO2===NH4++HSO3- D.硝酸铁溶液中加过量氨水:Fe3++3NH3·H2O===Fe(OH)3↓+3NH4+ 10.下列离子方程式书写正确的是()A.过量Cl2通入FeBr2溶液中:3Cl2+2Fe2++4Br-===6Cl-+2Fe3++2Br2 B.过量CO2通入NaAlO2溶液中:CO2+2H2O+AlO2-===Al(OH)3↓+HCO3- C.在溶液中NH4HSO3与NaOH等物质的量混合: NH4++HSO3-+2OH-===SO32-+NH3↑+2H2O D.Mg(HCO3)2溶液中加入过量石灰水: Mg2++2HCO3-+Ca2++2OH-===CaCO3↓+2H2O+MgCO3↓ 二。双选 11.下列离子方程式书写正确的是 A.过量氯气通入溴化亚铁溶液中3Cl2 + 2Fe2 + + 4Br- = 6Cl-+2Fe3++2Br2 B.过量二氧化碳通入偏铝酸钠溶液中CO2+2H2O+AlO2- = Al(OH)3↓+HCO3- C.亚硫酸氢铵溶液与等物质的量氢氧化钠混合 NH4+ +HSO3- +2OH- = SO32-+NH3↑+2H2O D.碳酸氢镁溶液中加入过量石灰水 Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓ 12.下列离子方程式正确的是 A. 把少量SO2通入Ca(ClO)2溶液中:SO2+H2O +Ca2++ 2ClO-= 2HClO +CaSO3↓ B.铁屑溶于足量稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O C.碳酸氢钙溶液中加入足量烧碱溶液:HCO3-+OH-=CO32-+H2O D.过量的Cl2通入FeBr2的溶液中:2Fe2++4Br-+3Cl2==2Fe3++6Cl-+2Br2 13、下列反应的离子方程式书写正确的是 A.铁屑溶于足量稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O B.碳酸氢钙溶液中加入足量烧碱溶液:HCO3-+OH-=CO32-+H2O C.金属钠溶于足量水中:2Na+2H2O=2Na++H2↑+2OH- D.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- 14.下列离子方程式书写正确的是 A.澄清石灰水与少量小苏打溶液混合: 高三化学中有关量的离子方程式总结 一、NaOH 1、向AlCl3溶液中滴入NaOH溶液至过量,先出现白色沉淀,后沉淀消失。其离子反应分步写: (1)Al3++3OH-==Al(OH)3↓(2)Al(OH)3+OH-==AlO2-+2H2O 若向NaOH溶液中滴入AlCl3溶液至过量,边滴边振荡,开始时无明显现象,后出现白色沉淀。其离子反应分步写:(1)Al3++4OH-==AlO2-+2H2O(2)3AlO2-+Al3++6H2O==4Al(OH)3↓ 若向AlCl3溶液中加入过量NaOH溶液,其离子反应一步完成:Al3++4OH-==AlO2-+2H2O 若向足量Al2(SO4)3溶液中加入少量的NaOH溶液,其离子方程式为:Al3++3OH-==Al(OH)3↓ 2、向足量的Ca(HCO3)2溶液中逐渐滴入NaOH溶液 化学方程式:NaOH+Ca(HCO3)2==H2O+CaCO3↓+NaHCO3 离子方程式:OH-+Ca2++HCO3-==H2O+CaCO3↓ 若向足量的NaOH溶液中逐渐滴入Ca(HCO3)2溶液 化学方程式:Ca(HCO3)2+2NaOH==2H2O+CaCO3↓+Na2CO3 离子方程式:Ca2++2HCO3-+2OH-==2H2O+CaCO3↓+CO32- 3、向足量的NH4HCO3溶液中逐渐滴入NaOH溶液 化学方程式:NH4HCO3+2NaOH==NH3.H2O+H2O+Na2CO3 离子方程式:NH4++HCO3-+2OH-==NH3.H2O+H2O+CO32- 若向NH4HCO3溶液中加入过量NaOH溶液并加热 化学方程式:NH4HCO3+2NaOH==NH3↑+2H2O+Na2CO3 离子方程式:NH4++HCO3-+2OH-==NH3↑+2H2O+CO32- 4、向NaOH溶液中逐渐滴入Mg(HCO3)2溶液至沉淀完全 化学方程式:Mg(HCO3)2+4NaOH==2H2O+Mg(OH)2↓+2Na2CO3 离子方程式:Mg2++2HCO3-+4OH-==2H2O+Mg(OH)2↓+2CO32- 若向Mg(HCO3)2溶液中逐渐滴入NaOH溶液至沉淀完全 化学方程式:2NaOH+Mg(HCO3)2==Mg(OH)2↓+2NaHCO3 离子方程式:2OH-+Mg2+==Mg(OH)2↓ 5、碳酸氢钙与烧碱 在碳酸氢钙溶液中滴入少量烧碱溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O 反滴时则为:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O 6、氢氧化钠与氢硫酸 NaOH溶液滴入足量氢硫酸中与氢硫酸滴入NaOH溶液中均无明显现象,发生的离子反应方程式分别为:(1)OH-+H2S=HS-+H2O(2)2OH-+H2S=S2-+2H2O 若将氢硫酸换成亚硫酸、碳酸或磷酸,则原理类似。 二、HCl 1、向NaAlO2溶液中滴入盐酸溶液至过量,其离子反应分步写: (1)AlO2-+H++H2O==Al(OH)3↓(2)Al(OH)3+3H+==Al3++3H2O 若向盐酸溶液中滴入NaAlO2溶液至过量,其离子反应分步写: (1)AlO2-+4H+==Al3++2H2O(2)3AlO2-+Al3++6H2O==4Al(OH)3↓ 若向NaAlO2溶液中加入过量盐酸溶液,其离子反应一步完成:AlO2-+4H+==Al3++2H2O 若向足量NaAlO2溶液中加入少量的盐酸溶液,其离子方程式为: AlO2-+H++H2O==Al(OH)3↓ 2、向Na2CO3溶液中滴入盐酸溶液至过量,其离子反应分步写: (1)CO32-+H+==HCO3-(2)HCO3-+H+==CO2↑+H2O 若向盐酸溶液中滴入Na2CO3溶液至不再产生气体,其离子反应一步完成:CO32-+2H+==CO2↑+H2O 若向足量Na2CO3溶液中加入少量的盐酸溶液,其离子方程式为:CO32-+H+==HCO3- 三、CO2 一、FeBr2、FeI2溶液与氯气反应的问题 例1、FeBr2溶液与氯气反应的问题,有下列三种情况,分别讨论如下:a、Cl2不足时,n(FeBr2):n(Cl2)==1:0.5时,只有Fe2+被Cl2氧化, 2Fe2++Cl2==2Fe3++2Cl— b、当n(FeBr2):n(Cl2)==1:1时,Fe2+全部被Cl2氧化,Br—部分被氧化,2Fe2++2Br—+2Cl2==2Fe3++4Cl—+Br2 c、Cl2过量时即当n(FeBr2):n(Cl2)==1:1.5时,Fe2+、Br—均被Cl2氧化,2Fe2++4Br—+3Cl2==2Fe3++6Cl—+2Br2 例2、FeI2溶液与氯气反应的问题,有下列三种情况,分别讨论如下:a、Cl2不足时即当n(FeI2):n(Cl2)==1:1时,只有I—被Cl2氧化, 2I—+CI2==2Cl—+I2↓ b、当n(FeI2):n(Cl2)==4:5时,I—全部被Cl2氧化,Fe2+部分被氧化,2Fe2++8I—+5Cl2==2Fe3++10Cl—+4I2↓ c、Cl2过量时即当n(FeI2):n(Cl2)==1:1.5时,I—、Fe2+均被Cl2氧化,2Fe2++4I—+3Cl2==2Fe3++6Cl—+2I2↓ 说明:以上都是我们中学老师普遍观点。实际上并不是这样的。二、SO2通入某些盐溶液中 (一)SO2通入NaClO溶液中 1、少量SO2气体通入NaClO溶液中: 3ClO-+SO2+H2O══SO42-+Cl-+2 HClO 2、过量SO2气体通入NaClO溶液中: ClO-+SO2+H2O══SO42-+Cl-+2H+ 与与与与与与与与与与与与与与与与与与 1.常见物质的电离平衡常数如下表,下列离子反应方程式错误 ..的是()物质H2CO3HClO HAlO2 电离常数 (25℃)K a1=4.4×10?7 K a=3×10?8K a=6.3×10?13 K a2=4.7×10?11 A. NaClO溶液中通入过量CO2:ClO+CO2+H2O=HClO+HCO3 B. NaClO溶液中通入少量CO2:2ClO?+CO2+H2O=2HClO+CO32? C. NaAlO2溶液中加入过量CO2:AlO2?+CO2+2H2O=HCO3?+Al(OH)3↓ D. NaAlO2溶液中通入少量CO2:2AlO2?+CO2+3H2O=CO32?+2Al(OH)3↓ 2.下列离子方程式书写正确的是() A. 向碳酸钠溶液中滴加与其溶质的物质的量相等的盐酸:CO32?+2H+=CO2↑ +H2O B. 向苯酚钠溶液中通入少量的CO2:+CO2+H2O→+HCO3? C. 足量铁粉与稀硝酸反应:Fe+4H++NO3?=Fe3++2H2O+NO↑ D. 向漂白粉溶液中通入少量二氧化硫:Ca2++2ClO?+SO2+H2O=CaSO3↓ +2HClO 3.下列有关化学用语表示正确的是() ①甲烷的燃烧热为?890.3kJ?mol?1,则甲烷燃烧的热化学方程式可表示为: 2CH4(g)+4O2(g)=2CO2(g)+4H2O(l)△H=?1780.6kJ?mol?1 ②500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成 NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H= ?38.6kJ?mol?1 ③次氯酸钙溶液中通入过量的CO2:Ca2++2ClO?+2CO2+2H2O=Ca(HCO3)2+ 2HClO ④硫酸工业尾气处理中用氨水吸收过量的SO2:NH3?H2O+SO2=NH4++HSO3? ⑤S2?的结构示意图: ⑥原子核内有10个中子,8个质子的原子:?818O ⑦三氟化氮的电子式: ⑧2gH2在25℃101kpa下燃烧,生成液态的水放出285.8kJ?mol?1的热量,则该反 应的热化学方程式为:2H2(g)+O2(g)=2H2O(1)△H=?285.8kJ?mol?1. For personal use only in study and research; not for commercial use 一、写出下列反应的离子方程式(产物与过量的物质继续反应型) 1.向Na2CO3溶液中滴入盐酸溶液至过量 2.向Ba(OH)2溶液中通入CO2气体至过量 3.向AlCl3溶液中滴入NaOH溶液至过量 4.向NaAlO2溶液中滴入盐酸溶液至过量 5.向NaAlO2溶液中通入CO2气体至过量 二、写出下列反应的离子方程式(酸式盐与碱反应型) 6.向NaHCO3溶液中加入足量澄清石灰水 7.向NaHCO3溶液中加入少量澄清石灰水 8.向Ca(HCO3)2溶液中加入少量NaOH溶液 9.向Ca(HCO3)2溶液中加入足量NaOH溶液 10.向Mg (HCO3)2溶液中加入少量的澄清石灰水 11.向Mg(HCO3)2溶液中加入足量的澄清石灰水 三、写出下列反应的离子方程式(限制条件型) 12.向Ba(OH)2溶液中逐滴加入NaHSO4溶液至刚好沉淀完全 13.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性 14.氢氧化钡溶液与KAl(SO4)2·12H2O(明矾)的反应 生成沉淀的物质的量最大:_________________________________。 生成沉淀的质量最大:_______________________________________________。 四、写出下列反应的离子方程式(竞争反应型) 15.向NH4HCO3溶液中加入少量NaOH溶液 16.向NH4HCO3溶液中加入足量NaOH溶液并加热 五、写出下列反应的离子方程式(氧化还原型) 17.含有a molFeBr2的溶液中,通入x molCl2。写出发生反应的离子方程式: (1)x=0.4a(2)x=0.6a (3)x=a (4)x=1.5a 六、离子方程式的书写判断 18.向10mL0.1mol·L-1NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是( ) A.x=10时,溶液中有NH+4、Al3+、SO2-4,且c(NH+4)=c(Al3+) 第 1 页 共 2 页 《第1讲 与量有关的离子方程式的书写》练习 1.(08·上海·20)下列离子方程式书写正确的是 ( ) A .AgNO 3溶液滴入少量的Na 2S 溶液 2Ag + +S 2- →Ag 2S ↓ B .过量的CO 2通入Ca(ClO)2溶液中 ClO -+CO 2+H 2O →HCO 3-+HClO C .向Na 2CO 3溶液中加入过量CH 3COOH 溶液 CO 32- +2H + → CO 2↑+H 2O D .向Ba(OH)2溶液中加入少量的NaHSO 3溶液 2HSO 3-+Ba 2++2OH -→BaSO 3↓+SO 32-+2H 2O 【答案】AB 【解析】 A .正确; B .正确; C .CH 3COOH 为弱酸,在离子方程式中不能拆,正确的离子方程式为CO 32-+2CH 3COOH →CO 2↑+H 2O +2CH 3COO -,C 错误; D .NaHSO 3少量,1NaHSO 3+ Ba(OH)2= H 2O+BaSO 3↓+NaOH ,正确的离子方程式为HSO 3- +Ba 2++OH -=BaSO 3↓+H 2O ,D 错误。 2.在含有n mol FeBr 2的溶液中,通入Cl 2的物质的量为x mol 。 ①当x ≤0.5n mol 时,反应的离子方程式为: 。 ②x ≥1.5n mol 时,反应的离子方程式为: 。 ③x = n mol 时,反应的离子方程式为: 。 【答案】 ①2Fe 2++Cl 2=2Fe 3++2Cl - ②2Fe 2++4Br -+3Cl 2=2Fe 3++2Br 2+6Cl - ③2Fe 2++2Br -+2Cl 2=2Fe 3++Br 2+4Cl - 【解析】氧化性顺序:Cl 2>Br 2>Fe 3+, 21)()(22≤FeBr n Cl n 时,只够氧化Fe 2+,Cl 2+2Fe Br 2=3 2FeCl 3+3 4 Fe Br 3 2 3) ()(22≥ FeBr n Cl n 时,能够完全氧化Fe 2+,3Cl 2+2Fe Br 2=2FeCl 3+2Br 2 3.将1 mol Cl 2 通入到含1 mol FeBr 2的溶液中,所发生反应的离子方程式为 ( ) A .Cl 2+2Fe 2+=2Fe 3++2Cl - B .Cl 2+2Br -=Br 2+2Cl - C .3Cl 2+2Fe 2++4Br -=2Fe 3++2Br 2+2Cl - D .2Cl 2+2Fe 2++2Br -=2Fe 3++Br 2+4Cl - 4.能正确表示下列反应的离子方程式的是 ( ) A .将0.5 mol Cl 2通入含1 mol FeBr 2的溶液中:2C12+2Fe 2++2Br -=2Fe 3++Br 2+4C1- B .碳酸氢铵与热的浓NaOH 溶液反应:NH 4++OH - =NH 3↑+H 2O C .在漂白粉溶液中通入过量二氧化碳:Ca 2++CO 2+H 2O =2H ++CaCO 3↓ D .将物质的量浓度相同的NaHCO 3溶液和Ba(OH)2溶液等体积混合: HCO 3- +Ba 2+ +OH - =BaCO 3↓+H 2O . 与量有关的离子方程式的书写技巧: a.生成物与过量的反应物继续反应的情况: 例:AlCl3与NaOH(由少到多):Al3+ + 3OH-→Al(OH)3↓Al(OH)3 + OH-→AlO2- + 2H2O b.滴加顺序不同,离子反应不同: 例:Na2CO3中逐滴加入HCl: CO32- + H+→HCO3- HCO3- + H+→H2O + CO2↑ NaOH中逐滴加入AlCl3: Al3+ + 4OH-→AlO2- + 2H2O 3AlO2- + Al3+ + 6H2O →4Al(OH)3↓ c.一种物质中有两种离子参加反应时,反应物用量不同,反应不同。 书写原则:不足量物质参加反应的离子按组成比参加反应,而过量物质则按需要确定其离子的物质的量。 反应物I反应物II滴加顺序离子方程式 Ca(OH)2少量CO2Ca2+ + 2OH- +CO2 →CaCO3↓+H2O 足量CO2Ca2+ + 2OH- +2CO2 →Ca2+ +2HCO3- 氨水少量SO22NH3·H2O +2SO2→2NH4+ +SO32- +H2O 足量SO2NH3·H2O +2SO2→2NH4+ +HSO3- AlCl3少量NaOH NaOH滴入AlCl3Al3+ + 3OH-→Al(OH)3↓ 足量NaOH AlCl3滴入NaOH Al3+ + 4OH-→AlO2- + 2H2O NaAlO2少量HCl 盐酸滴入NaAlO2H++AlO2- + H2O →Al(OH)3↓ 足量HCl NaAlO2滴入盐酸AlO2-+ 4H+→2H2O + Al3+ FeBr2少量Cl2氯水滴入FeBr22Fe2+ + Cl2 →2Fe3+ +2Cl- 足量Cl2FeBr2滴入氯水2Fe2+ +4Br- +3Cl2→2Fe3+ + 2Br2 +6Cl- Ca(OH)2少量NaHCO3NaHCO3滴入石灰水Ca2+ +OH- +HCO3-→CaCO3↓+H2O 足量NaHCO3石灰水滴入NaHCO3Ca2++2OH-+2HCO3-→CaCO3↓+2H2O+ CO32- Ca(HCO3)2少量NaOH NaOH滴入Ca(HCO3)2Ca2+ +OH- +HCO3-→CaCO3↓+H2O 足量NaOH Ca(HCO3)2滴入NaOH Ca2++2OH-+2HCO3-→CaCO3↓+2H2O+ CO32- AgNO3少量NH3·H2O NH3·H2O滴入AgNO3Ag+ +NH3·H2O →AgOH↓+NH4+ 足量NH3·H2O AgNO3滴入NH3·H2O Ag+ +2NH3·H2O →[Ag(NH3)2]+ + 2H2O 一、生成的产物可与过量的物质继续反应的离子反应 .. 20200216手动选题组卷 与量有关的离子反应 题号一总分 得分 一、单选题(本大题共10小题,共10.0分) 1.对下列过程的化学用语表述正确的是() A. 用硫酸铜溶液除去乙炔中的硫化氢气体:H2S+Cu2+=CuS↓+2H+ B. 向氯化铝溶液中滴入过量氨水:Al3++4OH?=AlO2?+2H2O C. 用电子式表示Na和Cl形成NaCl的过程: D. 钢铁发生电化学腐蚀的正极反应:Fe?3e?=Fe3+ 【答案】A 【解析】解:A.用硫酸铜溶液除去乙炔中的H2S气体,生成硫化铜,反应的离子方程式为:H2S+Cu2+=CuS↓+2H+,故A正确; B.氯化铝溶液中加入过量氨水,反应生成氢氧化铝沉淀,反应的方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故B错误; C.NaCl为离子化合物,书写电子式时注意,左边写钠原子和氯原子电子式,右边写氯化钠的电子式,中间用箭头连接,形成过程为: ,故C错误; D.钢铁发生电化学腐蚀时,负极上铁失电子发生氧化反应,电极反应式为Fe?2e?= Fe2+,正极上得电子发生还原反应,故D错误; 故选:A。 A.用硫酸铜溶液除去乙炔中的H2S气体,生成硫化铜; B.氨水不会溶解氢氧化铝,二者反应生成氢氧化铝沉淀; C.氯化钠是离子化合物,用电子式表示其形成过程时,左边是原子的电子式,右边为氯化钠的电子式,中间用箭头连接; D.钢铁发生电化学腐蚀时,负极上铁失电子发生氧化反应。 本题考查了化学用语的正误判断,掌握离子方程式的书写原则、电子式书写原则、电化学原理应用是解答关键,题目难度不大。 2.下列解释事实的方程式不正确 ...的是() A. 用过量氨水除去烟气中的二氧化硫:SO2+2NH3·H2O=(NH4)2SO3+H2O B. 呼吸面具中用过氧化钠吸收二氧化碳产生氧气:2Na2O2+2CO2=2Na2CO3+ O2 C. 电解饱和氯化钠溶液产生气体:2NaCl+2H O=电解2NaOH+H2↑+Cl2↑ 2 D. 用浓硝酸除去试管内壁上附着的铜:8H++2NO3?+3Cu=3Cu2++2NO↑ +4H2O 【答案】D 【解析】【分析】 本题考查化学方程式和离子方程式的书写,难度一般。 【解答】 高考频度:★★★★★难易程度:★★★☆☆ 下列离子方程式的书写及评价均合理的是 选项离子方程式评价 A 将2 mol Cl2通入到含1 mol FeI2的溶液中: 2Fe2++2I?+2Cl2 = 2Fe3++4Cl?+I2 正确;Cl2过量,可将Fe2+、 I?均氧化 、 B Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3?+OH?= BaCO3↓+H2O 正确;酸式盐与碱反应生成正盐和水C 1 mol·L?1的Na[Al(OH)4]溶液和mol·L?1的HCl溶液 等体积互相均匀混合: 2[Al(OH)4]?+5H+= Al3++Al(OH)3↓+5H2O 正确;[Al(OH)4]?与Al(OH)3消耗的H +的物质的量之比为2∶3 D 过量SO2通入到NaClO溶液中: SO2+H2O+ClO?= HClO+HSO3? ) 正确;说明酸性:H2SO3强于HClO 【参考答案】C 1.过量与少量型 书写原则:“.以少定多 ....”.,以少量物质的离子计量数(充分反应)....”.,即先根据题给条件判断 ...........“.少量物质 确定所需“过量物质”的离子数目。如向Ca(HCO3)2溶液中加入过量NaOH溶液的离子方程式的书写方法为 2.定量型 首先按题给条件中反应物的物质的量,结合“以少定多”的原则及离子反应顺序,逐步写出各步反应的离子方程式;然后把各步离子方程式加合即可得到总反应的离子方程式。 3.相同反应物间的离子反应 (1)反应物滴加顺序不同,离子反应不同 & (2)反应条件不同,离子反应不同 (3)微溶物状态不同,离子反应不同 CO-CaCO3+2OH?。 如石灰乳与碳酸钠溶液混合,离子方程式为Ca(OH)2+2 3 CO-CaCO3↓。 若澄清石灰水与碳酸钠溶液混合,则离子方程式为Ca2++2 3 4.氧化还原反应中涉及的“量” 对于氧化还原反应,按.“.先强后弱 ............(.或. ....).强的优先发生反应,氧化性 ....”.的顺序书写,即氧化性 ..........(.或还原性 还原性 ........ ...).弱的后发生反应。 如FeBr2溶液与不同量的新制氯水混合:当新制氯水足量时,2Fe2++4Br?+3Cl22Fe3++2Br2+6Cl?;当新制氯水少量时,2Fe2++Cl22Fe3++2Cl?;当FeBr2与Cl2的物质的量之比为1∶1 时,2Fe2++2Br?+2Cl22Fe3+ +Br2+4Cl?。 5.较特殊的反应涉及的“量” 如Mg(HCO3)2溶液与过量的NaOH溶液反应,不可忽视 Mg(OH)2比MgCO3更难溶、更稳定;明矾与足量的Ba(OH)2溶液反应,不可忽视Al(OH)3的两性;NH4HSO4溶液与足量的Ba(OH)2溶液反应,不可忽视NH3·H2O 2020年高考一轮复习题型专练 与“量”有关离子方程式的书写 考点一连续反应型离子方程式的书写 典例1、 (1)酸性氧化物与碱溶液反应。如CO2通入澄清石灰水中: CO2少量: 。 CO2过量: 。 (2)多元弱酸盐与强酸反应。如Na2CO3溶液与稀盐酸: 盐酸不足: 。 盐酸过量: 。 (3)铝盐溶液与强碱溶液。如AlCl3溶液与NaOH溶液反应: NaOH溶液少量: 。 NaOH溶液过量: 。 (4)多元弱酸的酸式钙盐(或钡盐)与强碱溶液。如Ca(HCO3)2与NaOH 溶液反应。 NaOH少量: 。 NaOH过量: 。 (5)NaAlO2溶液与强酸溶液。如NaAlO2溶液与盐酸反应: 盐酸少量: 。 盐酸过量: 。 (6)CO2通入到NaAlO2溶液中: CO2少量: 。 CO2过量: 。 (7)Fe与稀硝酸反应: Fe少量: 。 Fe过量: 。 【答案】 (1)CO 2+Ca2++2OH-CaCO3↓+H2O CO 2+OH-HCO3- (2)CO 32-+H+HCO3- CO 32-+2H+H2O+CO2↑ (3)Al3++3OH-Al(OH)3↓ Al3++4OH-AlO 2-+2H2O (4)Ca2++HCO 3-+OH-CaCO3↓+H2O Ca2++2HCO 3-+2OH-CaCO3↓+CO32-+2H2O (5)AlO 2-+H++H2O Al(OH)3↓ AlO 2-+4H+Al3++2H2O (6)2AlO 2-+CO2+3H2O2Al(OH)3↓+CO32- AlO 2-+CO2+2H2O Al(OH)3↓+HCO3- (7)Fe+NO 3-+4H+Fe3++NO↑+2H2O 3Fe+2NO 3-+8H+3Fe2++2NO↑+4H2O 【规律小结】连续型离子方程式的书写方法跟量有关的离子方程式的书写
与量有关的离子方程式总结修订稿
与量有关离子方程式书写1
与“量”有关的离子方程式书写
高三化学中有关量的离子方程式总结
与“量”有关的离子方程式汇总
与量有关的离子方程式的书写(精)
与量有关的离子方程式的书写
4专题训练3《第1讲 与量有关的离子方程式的书写》练习
与量有关的离子方程式总结
与量有关的离子方程式---有答案
与“量”有关的离子方程式
与量有关的离子方程式 类全品
