高考生物复习专题一细胞的物质和结构基础(打印版)

专题一:细胞的物质基础和结构基础专题二:细胞的代谢
专题三:细胞的生命历程
专题四:生命的遗传
专题五:生命的变异于进化
专题六:生命活动的调节
专题七:生态与环境
专题八:生物工程
1.考点预测
(1)(偶考点)有机物之间的联系与功能、无机盐的功能。
(2)(偶考点)原核细胞与真核细胞的区别、特殊细胞的结构与功能特点。
(3)(常考点)分泌蛋白的合成、加工、分泌与生物膜的联系。
(4)(常考点)物质跨膜运输的方式及相关实验分析。
(5)(常考点)创设新情境考查细胞器的结构与功能。
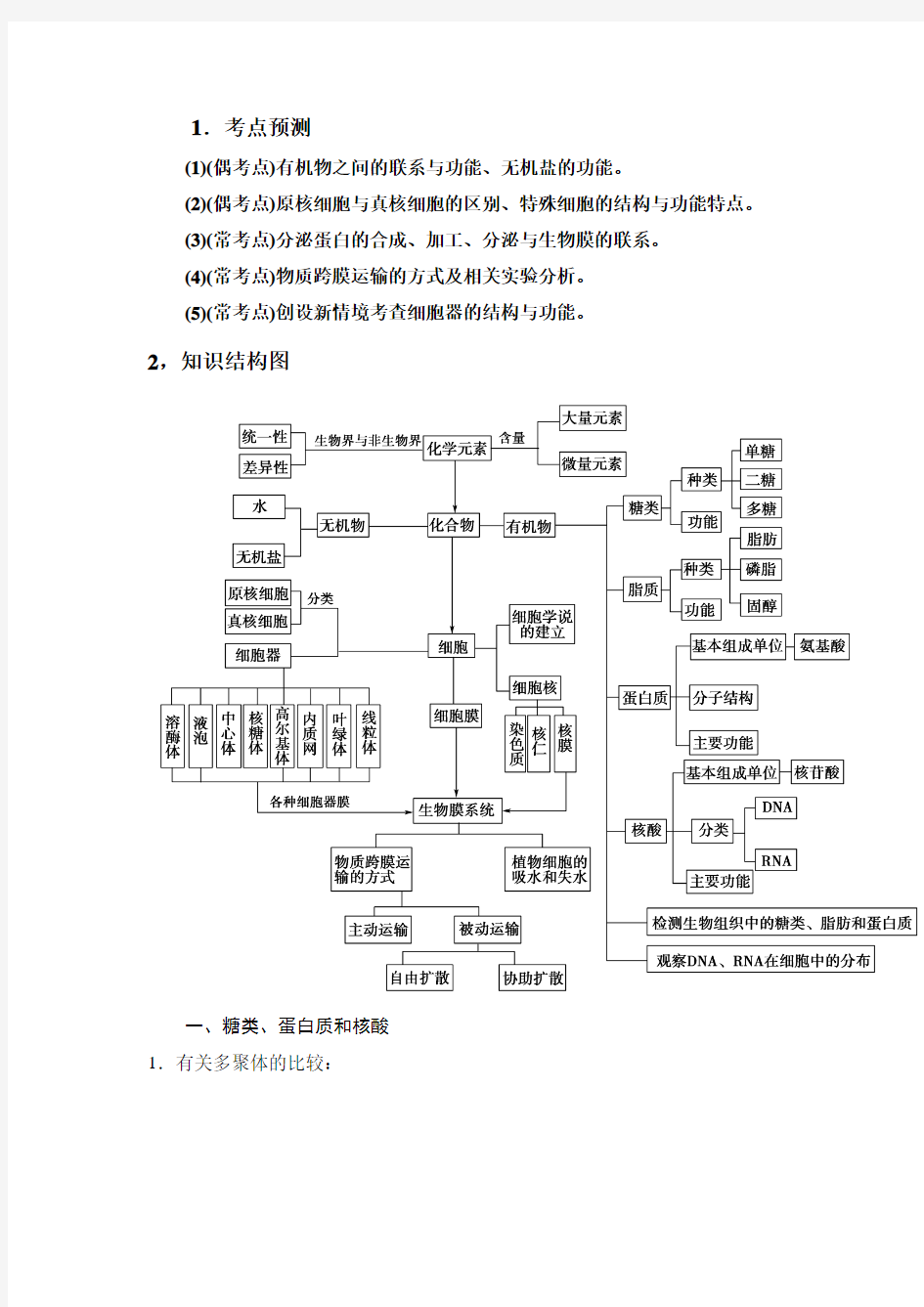
2,知识结构图
一、糖类、蛋白质和核酸
1.有关多聚体的比较:
一、糖类、蛋白质和核酸
1.有关多聚体的比较:
知识点
一.细胞中的能源物质:
①生物体中能源物质的种类及关系:
a.主要能源物质:糖类(注意:不是细胞中所有糖类都作为能源物质,如纤维素;糖也不是唯一的能源物质,还有其他物质,如蛋白质);
b.主要储能物质:脂肪;
c.生命活动的直接能源物质:ATP;
d.生命活动的最终能量来源:太阳能。
②四种糖类的合成场所或结构:
淀粉——叶绿体纤维素——高尔基体
糖原———肝脏、肌肉
糖蛋白——核糖体、内质网、高尔基体
二、生物的遗传物质
(1)真核细胞细胞核中的DNA控制着真核生物的主要遗传性状,线粒体、叶绿体中的DNA与细胞质遗传有关;原核细胞拟核中的DNA控制着原核生物的大部分遗传性状,质粒是小的环状DNA,也控制原核生物的性状。
(2)RNA作为遗传物质的前提是生物体内不存在DNA,只存在RNA;当RNA 作为遗传物质时,由于RNA单链结构不稳定,容易发生突变。
(3)少数RNA具有催化功能,是生物体内的酶。
(4)朊病毒既无DNA,也无RNA,蛋白质起遗传物质的作用。
三、DNA与蛋白质的关系
4.DNA多样性、蛋白质多样性与生物多样性的关系
五、细胞的多样性和统一性
1.细胞形态多样性与功能多样性的统一
①具有分泌功能的细胞往往形成很多突起,以增大表面积,提高分泌效率,且细胞内高尔基体和内质网含量较多。
②代谢旺盛的细胞中,自由水含量高,线粒体、核糖体等细胞器含量多,核仁较大,核孔数量多。
③衰老的细胞中自由水含量下降,酶活性降低,代谢速率减慢;细胞膜通透性下降,物质运输效率降低;细胞核体积增大,核膜内折。
④癌细胞形态结构发生改变,细胞膜上糖蛋白含量减少,使得细胞间黏着性下降,易于扩散和转移。
2.细胞的统一性表现
①细胞在元素和化合物组成上具有统一性。
②细胞表面都具有细胞膜,且膜的成分和结构都相似。
③细胞质中都含有核糖体。
④细胞中都含有DNA和RNA两种核酸,并都以DNA作为遗传物质。
⑤细胞都以分裂的方式进行增殖。
三、细胞膜及主要细胞器的结构和功能
1.细胞膜结构和功能特性及其实验验证
(1)结构特性——流动性
①结构基础:构成细胞膜的磷脂分子和蛋白质分子大都是运动的。
②验证实验:荧光标记的小鼠细胞与人细胞融合实验,如图所示:
(2)功能特性——选择透过性
①结构基础:细胞膜上载体蛋白的种类和数量。
②实验验证
含不同无机物离子的溶液+不同植物
2.细胞器之间的分工
(1)细胞器与物质代谢、能量代谢
①能够产生水的细胞器及相应生理作用:
细胞器名称细胞类型生理作用
核糖体动、植物脱水缩合作用
线粒体动、植物有氧呼吸的第三阶段
叶绿体植物光合作用的暗反应
②有“能量转换器之称”的细胞器:线粒体、叶绿体;产生ATP的场所:线粒体、叶绿体、
细胞质基质。
结构名称细胞类型生理作用
细胞质基质动、植物无氧呼吸或有氧呼吸第一阶段线粒体动、植物有氧呼吸的第二、三阶段
叶绿体植物光合作用的光反应注意:在能量代谢水平高的细胞中,线粒体的含量多,动物细胞中线粒体比植物细胞多。
③含有色素的细胞器:叶绿体、有色体、液泡。有色体和叶绿体中均含有
叶黄素和胡萝卜素,液泡的细胞液中含有花青素等色素。
④动、植物细胞中形态相同、功能可能不同的细胞器:高尔基体。
⑤与主动运输有关的细胞器:核糖体(合成载体)、线粒体(提供能量)。
(2)细胞器与细胞分裂
①参与细胞分裂的细胞器及其功能
核糖体(间期蛋白质的合成)、中心体(动物及低等植物纺锤体的形成)、高尔基体(植物细胞壁
的形成)、线粒体。
②动、植物细胞有丝分裂的不同和细胞器密切相关
前期形成纺锤体的方式不同:植物细胞是由细胞两极发出纺锤丝形成纺锤体;动物细胞是由
中心体发出星射线形成纺锤体。
末期形成子细胞的方式不同:植物细胞是细胞中部形成细胞板,扩展形成细胞壁,结果形成
两个子细胞;动物细胞是细胞膜从中部向内凹陷,细胞缢裂成两个子细胞。
(3)细胞器与遗传变异
①细胞质遗传:线粒体、叶绿体中DNA;
②含DNA(基因)的细胞器:线粒体、叶绿体(都有半自主性);
③含RNA的细胞器:线粒体、叶绿体、核糖体;
④能自我复制的细胞器:线粒体、叶绿体、中心体;
⑤能发生碱基互补配对的细胞器(结构):线粒体、叶绿体、核糖体(细胞核、拟核)。
(4)细胞器与动植物分类
①高等植物细胞具有的细胞器:叶绿体、线粒体、内质网、高尔基体、液泡、溶酶体、核糖
体;
②高等动物细胞具有的细胞器:线粒体、内质网、高尔基体、溶酶体、中心体、核糖体;
③高等植物细胞特有的细胞器:叶绿体、液泡。
(5)细胞器与生物膜
①不具膜结构的细胞器:核糖体、中心体;
②具单层膜的细胞器:内质网、高尔基体、液泡、溶酶体;
③具双层膜的细胞器:线粒体、叶绿体。
生物膜之间的联系:
1,图
②在不同结构的膜之间相互转化时,以“膜泡”或“囊泡”形式转化的是间接相连的生物膜。
(2)生物膜在功能上的联系(以分泌蛋白的合成、加工、运输为例)
四、细胞核的结构和功能
1.细胞核的结构
(1)核膜
①非封闭性双层膜,与内质网膜相连,便于物质的运输。
②其上有核孔,是大分子物质如mRNA自由离开细胞核或DNA聚合酶自由进入细胞核的孔道。一些离子、小分子物质可通过核膜。
③在核膜上有许多酶的存在,有利于各种化学反应的进行。
(2)核仁
①折光性强,在细胞周期中呈现有规律的消失(分裂前期)和重现(分裂末期),经常作为判断细胞分裂时期的典型标志。
②与RNA的合成及核糖体的形成有关。
(3)染色体
位于细胞核内,易被碱性染料染成深色,主要由DNA和蛋白质组成。
注意:染色质和染色体是同一种物质在不同时期的两种存在形式。
间期:染色质。伸展的染色质状态,有利于上面的DNA所储存的遗传信息的表达(有利于转录)。
分裂期:染色体。螺旋的染色体状态有利于遗传物质的平均分配。
2.细胞核与代谢的关系
①细胞核是遗传信息库,是细胞遗传特性和代谢活动的控制中心。
②核膜上的核孔数目多,核质间物质交换(蛋白质进入核内、RNA进入细胞质等)速率会加快,细胞代谢也会加快。
③细胞核控制细胞质的代谢活动,细胞质为细胞核提供营养和能量,细胞核和细胞质是相互依存的统一整体。
五、物质运输方式的判断及影响因素的分析
1.物质运输方式的判断
2.影响物质跨膜运输速率的因素
(1)物质浓度(在一定浓度范围内)
(2)O2浓度
(3)温度
温度可影响生物膜的流动性和有关膜的活性,因而影响物质的运输速率,如低温会使物质跨膜运输速率下降。
特别提醒
①物质跨膜运输与膜的流动性和选择透过性都有关系,选择透过性的物质基础是膜上载体蛋白的种类和数量。
②胞吞与胞吐:大分子颗粒物质(如胰岛素等蛋白质)的跨膜方式,需要能量,不需要载体蛋白,跨膜层数为0。
3.跨膜方式小结
(1)以自由扩散方式运输的物质:水、CO2、O2等小分子;甘油、乙二醇等脂溶性物质。
(2)以主动运输方式运输的物质:
①相对分子质量较大的小分子,如葡萄糖、氨基酸;
②带电粒子,如Na+、K+、Ca2+等;
③逆浓度运输的物质都是主动运输。
(3)以协助扩散方式运输的物质:血浆中的葡萄糖进入红细胞。
(4)大分子物质通过膜时则以胞吞、胞吐的方式运输。
【二轮复习】专题十一物质结构
课题名称:原子结构、晶体结构及化学键 考纲要求:1、了解原子的组成及同位素的概念。 掌握原子序数、核电荷数、质子数、中子数、核外电子数, 以及质量数与质子数、中子数之间的相互关系。 2、 以第1,2,3周期的元素为例,了解原子核外电子排布规律。 3、 理解离子键、共价键的含义。理解极性键和非极性键。 了解极性分子和非极性分子。了解分子间作用力。初 步了解氢键。 4、了解几种晶体类型(离子晶体、原子晶体、分子晶体、金属晶体)及其性质。 学习重难点:原子的组成及几个量之间的关系;离子键和共价键的含义及应用。 学习方法:该部分题目多以选择题、填空题为主,处理该部分题目时应注意概念的内涵和外延,注意选项间的 比较,同时要注意以客观事例来验证理论描述。解决原子结构题目时,应注意几个量之间的数量关系。解决化学 键与晶体结构的问题时,应注意化学键、分子间作用力与晶体结构、性质之间的关系,进行分析比较,最后要注 运功将点:用电子云摘述 I s J 檢少卜电*F ■-i 」排乐规律;用结料恥童團表总 * r-wnE -'' I 1 -惰性元累应子(唯舜子分子)__箜箜M "惰性弋质单质 典型例题 例1(' 04江苏)我国的“神舟五号”载人飞船已发射成功,“嫦娥”探月工程也正式启动。据科学家预测,月 球的土壤吸附着数百万吨的 2 He ,每百吨核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上, 氦元素主要以 4 2 He 的形式存在。下列说法正确的 ( ) A . 4 He 原子核内含有4个质子 B . 3 He 和4 He 互为同位素 C . 3 He 原子核内含有3个中子 D . 4 He 的最外层电子数为 2,所以4 He 具有较强的金属性 例2 (' 04广东、广西)下列各组物质中,互为同位素的是 ( ) 例3(' 04上海)有关晶体的下列说法中正确的是 专题十 物质结构 相互柞用 「■分子的稳定性 一化学宦一 构 成 庚 的 B -廉子得失电i 阴、阳离f 子晶岸 广原子品体 f 曲¥砸稚平勺井子晶体 片于 --- (固卷时} L —表示方法:电尹式 —7 广极性分子 一 非极性分子 A .重氢、超重氢 B .氧、臭氧 C .红磷、白磷 D .乙酸、丙酸 意看准顺序要求。 基础知识 一质子一 -原子核一:
2019年高考化学真题分类汇编专题18 物质结构与性质(选修) (解析版)
专题18 物质结构与性质(选修) 1.[2019新课标Ⅰ]在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要村料。回答下列问题: (1)下列状态的镁中,电离最外层一个电子所需能量最大的是 (填标号 )。 A.B.C.D. (2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别 是、。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是,其中与乙二胺形成的化合物稳定性相对较高的是(填“Mg2+”或“Cu2+”)。 (3)一些氧化物的熔点如下表所示: 氧化物Li2O MgO P4O6SO2 熔点/°C 1570 2800 23.8 ?75.5 解释表中氧化物之间熔点差异的原因。 (4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离= pm,Mg原子之间最短距离y= pm。设阿伏加德罗常数的值为N A,则MgCu2的密度是 g·cm?3(列出计算表达式)。 【答案】(1)A (2)sp3sp3乙二胺的两个N提供孤对电子给金属离子形成配位键Cu2+ (3)Li2O、MgO为离子晶体,P4O6、SO2为分子晶体。晶格能MgO>Li2O。分子间力(分子量)P4O6>SO2 (4 23 330 A 824+1664 10 N a- ?? ? 【解析】(1)A.[Ne]3s1属于基态的Mg+,由于Mg的第二电离能高于其第一电离能,故其再失去一个电子所需能量较高; B. [Ne] 3s2属于基态Mg原子,其失去一个电子变为基态Mg+; C. [Ne] 3s13p1属于激发态
物质结构基础
一、上表是元素周期表的一部分,请将对应的元素名称和符号填入上表。 二、仿照第一列,填写下列表格。 三、复习元素周期律和周期表,完成下列表格。
四、原子的组成(X A Z ) 电量关系: 质量关系: 同位素:指 相同、 不同的原子。 五、原子和离子结构示意图 1.当核外电子 核电荷数时,表示的是原子; 2.当核外电子 核电荷数时,表示的是阴离子; 3.当核外电子 核电荷数时,表示的是阳离子。 六、化学键类型
[巩固练习] 1、下列元素属于第二周期的是( ) A 、氢 B 、碳 C 、钠 D 、氯 2、下列元素属于第IA 族的是( ) A 、氢 B 碳 C 、硫 D 、氯 3、下列原子中,半径最小的是( ) A )F B )Na C )S D)Cl 4、下列元素处于同一周期的是( ) A )C 、N 、F B )B 、S 、Cl C)LiNaK 5、下列元素属于同一主族的是( ) A 、H Na K B 、Na Mg Al C 、O S Br D 、C Si Cl 6、下列第三周期元素中,化学性质最活泼的是( ) A 、硅 B 、磷 C 、硫 D 、氯 7、 下列物质的电子式,正确的是( ) A )氯化钾 K B O C C N D )氟化氢 H + 8、下列物质中只含有共价键的是( ) A )CaCl 2 B 、KCl C 、Cl 2 D 、KOH 9、.下列物质中,既含离子键,又含有共价键的化合物是 A.NaOH B.Na 2O C.CO 2 D.MgCl 2 10、对于第三周期从左到右的元素,下列说法中不正确的是( ) A )原子半径逐渐减小 B )金属性逐渐增强 C )最高正化合价逐渐增大 D )得电子能力逐渐增强 11、下列元素金属性最强的是( ) A 、Na B 、Mg C 、Al D 、K 12、对于第VIIA 族从上到下的元素,下列说法正确的是( ) A )原子半径逐渐减小 B )非金属性逐渐增强 C )氢化物稳定性逐渐减弱 D )原子得电子能力逐渐增强 13、考古学上常用14 6C 来测定文物的历史年代。14 6C 原子核内中子数是( ) A 、6 B 、8 C 、14 D 、20 14、关于 18 是8O 下列说法不正确的是( ) A 、它是氧元素的一种核素 B 、它与16 是8O 互为同位素 C 、它有10个中子 D 、它有18个质子
全国卷高中生物选修一知识点
高中生物选修一生物技术实践 专题一传统发酵技术的应用 课题1 果酒和果醋的制作 1、发酵:通过微生物技术的培养来生产大量代谢产物的过程。 2、有氧发酵:醋酸发酵谷氨酸发酵·无氧发酵:酒精发酵乳酸发酵 3、酵母菌是兼性厌氧菌型微生物真菌·酵母菌的生殖方式:出芽生殖(主要) 分裂生殖孢子生殖 4、在有氧条件下,酵母菌进行有氧呼吸,大量繁殖。C6H12O6+6O2→6CO2+6H2O 5、在无氧条件下,酵母菌能进行酒精发酵。C6H12O6→2C2H5OH+2CO2 6、20℃左右最适宜酵母菌繁殖酒精发酵时一般将温度控制在18℃-25℃ 7、在葡萄酒自然发酵的过程中,起主要作用的是附着在葡萄皮表面的野生型酵母菌.在发酵过程中,随着酒精 浓度的提高,红葡萄皮的色素也进入发酵液,使葡萄酒呈现深红色.在缺氧呈酸性的发酵液中,酵母菌可以生长繁殖,而绝大多数其他微生物都因无法适应这一环境而受到制约。 8、醋酸菌是单细胞细菌(原核生物),代谢类型是异养需氧型,生殖方式为二分裂 9、当氧气、糖源都充足时,醋酸菌将葡萄汁中的糖分解成醋酸;当缺少糖源时,醋酸菌将乙醇变为乙 醛,再将乙醛变为醋酸。2C2H5OH+4O2→CH3COOH+6H2O 10、控制发酵条件的作用①醋酸菌对氧气的含量特别敏感,当进行深层发酵时,即使只是短时间中断通入 氧气,也会引起醋酸菌死亡。②醋酸菌最适生长温度为30~35℃,控制好发酵温度,使发酵时间缩短,又减少杂菌污染的机会。③有两条途径生成醋酸:直接氧化和以酒精为底物的氧化。 11、实验流程:挑选葡萄→冲洗→榨汁→酒精发酵→果酒(→醋酸发酵→果醋) 12、酒精检验:果汁发酵后是否有酒精产生,可以用重铬酸钾来检验。在酸性条件下,重铬酸钾与酒精反 应呈现灰绿色。先在试管中加入发酵液2mL,再滴入物质的量浓度为3mol/L的H2SO43滴,振荡混匀,最后滴加常温下饱和的重铬酸钾溶液3滴,振荡试管,观察颜色 13、充气口是在醋酸发酵时连接充气泵进行充气用的;排气口是在酒精发酵 时用来排出二氧化碳的;出料口是用来取样的。排气口要通过一个长而弯曲 的胶管与瓶身相连接,其目的是防止空气中微生物的污染。开口向下的目的 是有利于二氧化碳的排出。使用该装置制酒时,应该关闭充气口;制醋时, 应该充气口连接气泵,输入氧气。 疑难解答 (1)你认为应该先冲洗葡萄还是先除去枝梗?为什么? 应该先冲洗,然后再除去枝梗,以避免除去枝梗时引起葡萄破损,增加被杂菌污染的机会。 (2)你认为应该从哪些方面防止发酵液被污染? 如:要先冲洗葡萄,再除去枝梗;榨汁机、发酵装置要清洗干净,并进行酒精消毒;每次排气时只需拧松瓶盖,不要完全揭开瓶盖等。 (3)制葡萄酒时,为什么要将温度控制在18~25℃?制葡萄醋时,为什么要将温度控制在30~
高考化学物质结构与性质(选考)
物质结构与性质(选考) 1.(2017·福建省莆田第一中学高三考前模拟)Fe 、HCN 与K 2CO 3在一定条件下发生如下反应: Fe +6HCN +2K 2CO 3===K 4Fe(CN)6+H 2↑+2CO 2↑+2H 2O , 回答下列问题: (1)此化学方程式中涉及的第二周期元素的电负性由小到大的顺序为________。 (2)配合物K 4Fe(CN)6的中心离子是________,该离子价电子的基态电子排布图为________。 (3)1 mol HCN 分子中含有σ键的数目为________,HCN 分子中碳原子轨道杂化类型是________,与CN - 互为等电子体的阴离子是________。 (4)K 2CO 3中阴离子的空间构型为________,其中碳原子的价层电子对数为________。 (5)冰的晶体结构模型如图,它的晶胞与金刚石相似,水分子之间以氢键相连接,在一个晶胞中有________个氢键,若氢键键长为d nm ,则晶体密度(g·cm -3)计算式为________(用N A 表示阿伏加德罗常数的值)。 答案 (1)C 负性越大,则电负性由小到大的顺序为C 第一单元 金属键 金属晶体 金 属 键 与 金 属 特 性 [基础·初探] 1.金属键 (1)概念:金属离子与自由电子之间强烈的相互作用称为金属键。 (2)特征:无饱和性也无方向性。 (3)金属键的强弱 ①主要影响因素:金属元素的原子半径、单位体积内自由电子的数目等。 ②与金属键强弱有关的性质:金属的硬度、熔点、沸点等(至少列举三种物理性质)。 2.金属特性 特性 解释 导电性 在外电场作用下,自由电子在金属内部发生定向移动,形成电流 导热性 通过自由电子的运动把能量从温度高的区域传 到温度低的区域,从而使整块金属达到同样的 温度 延展性 由于金属键无方向性,在外力作用下,金属原 子之间发生相对滑动时,各层金属原子之间仍 保持金属键的作用 [核心·突破] 1.金属键????? 成键粒子:金属离子和自由电子 成键本质:金属离子和自由电子间 的静电作用 成键特征:没有饱和性和方向性存在于:金属和合金中 2.金属晶体的性质 3.金属键的强弱对金属物理性质的影响 (1)金属键的强弱比较:金属键的强度主要取决于金属元素的原子半径和外围电子数,原子半径越大,外围电子数越少,金属键越弱。 (2)金属键对金属性质的影响 ①金属键越强,金属熔、沸点越高。 ②金属键越强,金属硬度越大。 ③金属键越强,金属越难失电子。如Na的金属键强于K,则Na比K难失电子,金属性Na比K弱。 【温馨提醒】 1.并非所有金属的熔点都较高,如汞在常温下为液体,熔点很低,为-38.9 ℃;碱金属元素的熔点都较低,K-Na合金在常温下为液态。 2.合金的熔点低于其成分金属。 3.金属晶体中有阳离子,无阴离子。 4.主族金属元素原子单位体积内自由电子数多少,可通过价电子数的多少进行比较。 第一章 物质结构基础 1.de Bloglie 关系式:h m v λ= 又 22 J k g m s -=?? 已知31 9.109510m k g -=?;6 1 5.010v m s -=??;34 6.62610 h J s -=??; 代入, 34 34 2210 31 6 1 31 6 1 6.62610 6.62610 1.45510 145.59.109510 5.0109.109510 5.010J s k g m s s m p m k g m s k g m s λ--------??????= = =?=???????? 2. (1) 3d ;n=3, l=2, m=0,±1, ±2,共5个轨道,每一轨道至多两个电子,即:3,2,0, ±1/2;3,2,1, ±1/2;3,2,-1, ±1/2;3,2,+2, ±1/2;3,2,-2, ±1/2; (2) 4s ;n=4, l=0, 即4,0,0 (±1/2); (3) 氧原子中的4个p 电子:n=2, l=1, m=0, ±1, 即2,1,0, ±1/2;2,1,1, +1/2(或-1/2);2,1,-1, +1/2(或-1/2); (4) 4s 1电子,4,0,0,+1/2或4,0,0,-1/2。 3.根据周期数、族序数和主、副族规律: (1)第3周期,零族,主族;(2)第5周期,ⅣA 族,主族;(3)第4周期ⅣB ,副族; (4)第4周期,ⅠB ,副族。 4.填表 5. (1)②, (2)③;②;④, (3)①②, (4)⑤ 6. (1)Ga 价电子构型为4s 24p 1,价电子数为3; (2)W 原子的电子构型为[Xe] 4f 145d 46s 2; (3)最外层有6个电子的元素应为ⅥA ; (4) Sb 原子的电子构型为[Kr]4d 105s 25p 3,未成对电子数为3。 7.(1)该元素属于ⅡA ;(2)金属性强,电负性小;(3)一般氧化值为+2,其氧化物的化学式可表示为XO 。 8. (1)第3周期,ⅣA 元素,硅,Si ,[Ne]3s 23p 2; (2)第4周期的铁元素,26Fe ,[Ar] 3d 64s 2; (3)有4个电子层,最高氧化值又与氯相同的金属元素是锰,25Mn ,[Ar]3d 54s 2。 (4)为29Cu ,[Ar]3d 104s 1 9.离子化合物中影响库仑作用的因素是离子电荷和离子半径,作用力越大,熔点就越高。据此即可判断:(1) MgO>BaS ;(2) KCl>CsCl ;(3) NaF>NaCl>NaBr>NaI ;(4) MgSO 4>K 2SO 4。 10.原子半径和等于共价键键长的理论值,故:(1)H C l -键长为(37+99)pm=136pm ;(2)C N -键长为(77+70)pm=147pm ;(3)C C l -键长:(77+99)pm=176pm ;(4)C F -键长:(77+64)pm=141pm ;(5) N I -键长(70+133)pm=203pm 。 专题一课题1果酒和果醋的制作 (二)果醋制作的原理 ⑴当氧气、糖源都充足时,醋酸菌将葡萄汁中的糖分解成。 ⑵当缺少糖源时,醋酸菌将乙醇变为,再变为。 反应式为:。 (三)、果酒和果醋的制作过程 挑选葡萄→冲洗→→→ ↓↓ 果酒果醋 (二)、果酒和果醋的发酵装置 1、装置中的充气口、排气口和出料口分别有哪些作用? 2、为什么排气口要通过一个长而弯曲的胶管与瓶身连接? 3、发酵瓶为什么要留有1/3的空间? 4、装置的使用:在进行酒精发酵时应关闭口,在进行果醋发酵时,充气口应连续充气,输入 专题一课题2 腐乳的制作 (一)制作腐乳的实验流程: (二)毛霉的生长: 1.腐乳制作时,温度应控制在 ,并保持一定的湿度。自然条件下毛霉的菌种来自 中的。 一、腐乳的制作过程 1、前期发酵——让豆腐上长出毛霉 (1)前期发酵的作用是什么? (2)前期发酵的温度为什么为15~18 ℃? 2、后期发酵——加盐腌制、加卤汤装瓶、密封腌制 专题一课题3 制作泡菜并检测亚硝酸盐含量 (二)亚硝酸盐含量的测定 1.原理 (1)在条件下,亚硝酸盐与发生反应后,与结合形成色染料。 (2)将显色反应后的样品与已知浓度的进行目测比较,可以大致估算出泡菜中亚硝酸盐的含量 2.测定方法:比色法 3.测定步骤 配制溶液→→制备样品处理液→ 3、制备样品处理液 称取泡菜榨汁→加入蒸馏水、提取液、氢氧化钠过滤→加入氢氧化铝乳液问题2:提取剂、氢氧化钠、氢氧化铝乳液的作用? 5、测定结果:泡菜腌制过程中亚硝酸盐含量的变化 、 (2)消毒:是指使用的物理或化学方法杀死物体表面或内部的微生物,(不包括和)常用的方法有:、、 灭菌:是指使用的理化因素杀死物体内外的微生物。包括芽孢和孢子 常用的方法有、、, 此外,实验室里还用或进行消毒。 三、制备牛肉膏蛋白胨固体培养基 (1)制备牛肉膏蛋白胨固体培养基的方法步骤: →→→→倒平板 四、纯化大肠杆菌 (1)微生物接种的方法中最常用的是和。 五、菌种的保存 为了保持菌种的纯净,需对菌种进行保藏。对于频繁使用的菌种,我们可以采用法;对于需要长期保存的菌种,可以采用法。 课题2土壤中分解尿素的细菌的分离与计数1.尿素只有被分解成之后,才能被植物吸收利用。土壤中的微生物之所以能分解尿素,是因为它们体内能合成。 2.设置对照:主要目的是排除实验组中因素对实验结果的影响,提高实验结果的可信度。 专题二十三选修3物质结构与性质(解析版) 1.【2019新课标Ⅰ卷】在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其 分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。回答下列问题: (1)下列状态的镁中,电离最外层一个电子所需能量最大的是(填标号)。 (2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是、。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是,其中与乙二胺形成的化合物稳定性相对较高的是(填“Mg2+”或“Cu2+”)。 (3)一些氧化物的熔点如下表所示: 解释表中氧化物之间熔点差异的原因。 (4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu.图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x =pm,Mg原子之间最短距离y=pm.设阿伏加德罗常数的值为N A,则MgCu2的密度是g?cm﹣3(列出计算表达式)。 2.【2019新课标Ⅱ卷】近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为 Fe?Sm?As?F?O组成的化合物。回答下列问题: (1)元素As与N同族。预测As的氢化物分子的立体结构为_______,其沸点比NH3的_______(填“高” 或“低”),其判断理由是_________________________。 (2)Fe成为阳离子时首先失去______轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式 为______________________。 (3)比较离子半径:F?__________O2?(填“大于”等于”或“小于”)。 (4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。 图中F?和O2?共同占据晶胞的上下底面位置,若两者的比例依次用x和1?x代表,则该化合物的化学式表示为____________,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=________g·cm?3。 以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中 原子1的坐标为(111 ,, 222 ),则原子2和3的坐标分别为__________、__________。 3.【2019新课标Ⅲ卷】磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能 优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。回答下列问题: (1)在周期表中,与Li的化学性质最相似的邻族元素是,该元素基态原子核外M层电子的自旋状态(填“相同”或“相反”)。 (2)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为,其中Fe的配位数为。 (3)苯胺()的晶体类型是。苯胺与甲苯()的相对分子质量相近,但苯胺的熔点(﹣5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(﹣95.0℃)、沸点(110.6℃),原因是。 (4)NH4H2PO4中,电负性最高的元素是;P的杂化轨道与O的2p 轨道形成键。 (5)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示: 2016中考生物专题训练:生物和生物圈及生物体的结 构层次【含答案及解析】 姓名___________ 班级____________ 分数__________ 一、选择题 1. 下列能体现生物体具有生殖特征的一项是() A .飞蛾扑火 B .惊弓之鸟 C .望梅止渴 D .孔雀开屏 2. 下列叙述中,属于生物因素对生物的影响的是() A .“ 春来江水绿如蓝” B .“ 草盛豆苗稀” C .“ 人间四月芳菲尽,山寺桃花始盛开” D .“ 雨露滋润禾苗壮” 3. 生物既能适应环境,也能影响环境.下列能反映生物适应环境的是() A .种瓜得瓜种豆得豆 B .螳螂捕蝉黄雀在后 C .千里之堤溃于蚁穴 D .鹰击长空鱼翔浅底 4. 假如广利河生态系统的营养结构共有 4 个营养级,分别以 a 、 b 、 c 、 d 表示.一年内输入这 4 个营养级的能量数值如下表:它们构成的食物链是()p 5. ly:宋体; font-size:10.5pt">生物种类 a b c d 能量( J/m 2 )141.1×10 5 15.91×10 5 0.881×10 5 871.271×10 5 A .a→b→c→d B .d→c→a→b C .d→a→b→c D .c→b→a→d 6. 如图为一个生态系统的模式图,相关叙述正确的是() A .若用如图表示该生态系统的碳循环,则丁为微生物 B .若用如图表示该生态系统的碳循环,则丙处于最高营养级 C .若丁为沼气池,沼渣、沼液作为甲的肥料,使能量循环利用 D .若乙为初级消费者,则乙的数量比甲的少 7. 如图是某生态系统中的食物网简图,下列有关叙述错误的是() A .该食物网中共有 3 条食物链 B .如果鹰的数量突然大量减少,则一定时间内草的数量会减少 C .该生态系统的生物成分是生产者、消费者和分解者 D .若此生态系统受到汞污染,一段时间后体内积累汞最少的生物是草 8. 如图表示某农田生态系统中食虫鸟、菜青虫、油菜、细菌和真菌等生物之间的关系(序号代表生物),图中代表油菜的是() A. 甲________ B. 乙________ C. 丙________ D. 丁 9. 某生态系统中的四种生物可以构成一条食物链,如图表示一段时间内它们的相对数量关系。下列说法正确的是() 物质结构与性质部分(共10题) 1、【2019 江苏 (物质结构与性质)】臭氧(O 3)在[Fe(H 2O)6]2+催化下能将烟气中的SO 2、NO x 分别氧化为24SO -和3NO - ,NO x 也可在其他条件下被还原为N 2。 (1)24SO -中心原子轨道的杂化类型为___________;3NO -的空间构型为_____________(用 文字描述)。 (2)Fe 2+基态核外电子排布式为__________________。 (3)与O 3分子互为等电子体的一种阴离子为_____________(填化学式)。 (4)N 2分子中σ键与π键的数目比n (σ)∶n (π)=__________________。 (5)[Fe(H 2O)6]2+与NO 反应生成的[Fe(NO)(H 2O)5]2+中,NO 以N 原子与Fe 2+形成配位键。 请在[Fe(NO)(H 2O)5]2+结构示意图的相应位置补填缺少的配体。 2、【2019 全国Ⅰ35(15分)】 Li 是最轻的固体金属,采用Li 作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题: (1)下列Li 原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)。 A . B . C . D . (2)Li +与H ?具有相同的电子构型,r (Li +)小于r (H ?),原因是______。 (3)LiAlH 4是有机合成中常用的还原剂,LiAlH 4中的阴离子空间构型是______。中心原子的杂化形式为______,LiAlH 4中,存 在_____(填标号)。 A .离子键 B .σ键 C .π键 D .氢键 (4)Li 2O 是离子晶体,其品格能可通过图(a)的 born?Haber 循环计算得到。 可知,Li 原子的第一电离能为 kJ·mol ?1,O=O 键键能为 kJ·mol ?1,Li 2O 晶格能为 kJ·mol ?1。 (5)Li 2O 具有反萤石结构,晶胞如图(b)所示。已知晶胞参数为0.4665 nm ,阿伏加德罗常数的值为N A ,则Li 2O 的密度为 ______g·cm ?3(列出计算式)。 3、【2019 全国Ⅱ35.(15分)】硫及其化合物有许多用途,相关物质的物理常数如下表所示: 回答下列问题: (1)基态Fe 原子价层电子的电子排布图(轨道表达式)为__________,基态S 原子电子占据最高能级的电子云轮廓图为_________ 形。 (2)根据价层电子对互斥理论,H 2S 、SO 2、SO 3的气态分子中,中心原子价层电子对数不同其他分子的是_________。 (3)图(a )为S 8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。 (4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图 (b )所示的三聚分子,该分子中S 原子的杂化轨道类型为________。 (5)FeS 2晶体的晶胞如图(c )所示。晶胞边长为a nm 、FeS 2相对式量为M ,阿伏加德罗常数的值为N A ,其晶体密度的计算表达 式为___________g·cm ?3;晶胞中Fe 2+位于22S -所形成的正八面体的体心,该正八面体的边长为______nm 。 4、【2019 全国Ⅲ 35.(15分)】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题: (1)Zn 原子核外电子排布式为________________。 (2)黄铜是人类最早使用的合金之一,主要由Zn 和Cu 组成。第一电离能Ⅰ1(Zn ) _______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。 专题27物质结构与性质 1.A、B、C、D、E代表5种元素。请填空: (1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素名称为________。 (2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为________,C的元素符号为________。 (3)D元素的正三价离子的3d能级为半充满,D的元素符号为________,其基态原子的电子排布式为__________________________。 (4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为________,其基态原子的电子排布式为________________________。 【答案】(1)氮(2)Cl K(3)Fe1s22s22p63s23p63d64s2 (4)Cu1s22s22p63s23p63d104s1 2.C、N、O、Al、Si、Cu是常见的六种元素。 ①Si位于元素周期表第________周期第________族。 ②N的基态原子核外电子排布式为________;Cu的基态原子最外层有________个电子。 ③用“>”或“<”填空: 原子半径 Al____Si 电负性 N____O 熔点 金刚石____晶体硅 沸点 CH 4 ____SiH 4 (2)O、Na、P、Cl四种元素中电负性最大的是________(填元素符号),其中P原子的核外电子排布式为________________________________________。 (3)周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。b、c、d中第一电离能最大的是______________(填元素符号),e的价层电子轨道示意图为________________________________________________________________________。(4)①N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下: 电离能 I n /(kJ·mol-1) I 1 578 I 2 1817 I 3 2745 I 4 11578 …… …… 则该元素是________(填写元素符号)。 ②基态锗(Ge)原子的电子排布式是________。Ge的最高价氯化物的分子式是________。 ③Ge元素可能的性质或应用有________。 1 家庭制作果酒、果醋和腐乳三种传统发酵食品的共同点是(A) A. 菌种均可来自自然环 B. 均需在相同温度下进行发酵 C. 保证在无氧环境下发酵 D. 均需要给发酵装置适时排气 2 如图表示果酒和果醋制作过程中的物质变化过程,下列叙述正确的是(C) A. 过程①和②都只能发生在缺氧条件下 B. 过程①和都③只发生在酵母细胞的线粒体中 C. 过程③和④都需要氧气的参与 D. 过程①~④所需的最适温度基本相同 3 关于发酵过程产物的说法,正确的是(B) A. 果汁发酵是否进行了无氧呼吸,可观察是否产生气泡来检验 B. 检验醋酸产生的简单易行的方法是品尝或用pH试纸鉴定 C. 当缺少氧气和糖源时,醋酸菌可以将糖分解为醋酸 D. 测定果酒、果醋的产生和亚硝酸盐的含量均可用品尝法 4 利用如图装置制作果酒和果醋,下列叙述正确的是(A) A. 制作果酒时应关闭阀b,适时打开阀a几秒钟 B. 制作果酒时如果关闭阀a,打开阀b,会导致爆瓶 C. 制作果醋时需打开阀a通气,打开阀b排 D. 制作果醋时把发酵装置放到25℃环境中比较适宜 5 在果酒、果醋和腐乳制作中,都要防止微生物污染,下列有关叙述正确的是(B) A. 果醋发酵阶段应封闭充气口,防止杂菌进入 B. 腌制腐乳的卤汤应含有适当浓度的酒精以抑制细菌的增殖 C. 用自然菌种发酵酿酒时,需将封有葡萄汁的发酵瓶高压灭菌 D. 将长满毛霉的豆腐放在瓶中加盐时,接近瓶口部分的盐要铺薄 6 下列是有关腐乳制作的几个问题,其中正确的是( A ) ①腐乳的制作主要是利用了微生物发酵的原理,起主要作用的微生物是青霉、曲霉和毛霉 ②含水量为70%左右的豆腐适于做腐乳,含水量过高的豆腐制作腐乳,不宜成形,且不利于毛霉的生长 ③决定腐乳特殊风味的是卤汤 ④腐乳的营养丰富,是因为大分子物质经过发酵作用分解成小而且易于消化的物质 ⑤卤汤中含酒量应该控制在21%左右,酒精含量过高,腐乳成熟的时间会延长;含量过低,不足以抑制微生物的生长 A.②③④ B.②③④⑤ C.①②③④ D.①④⑤ 7 某人利用乳酸菌制作泡菜,因操作不当泡菜腐烂。下列原因中正确的是( D ) ①罐口密闭缺氧,抑制了乳酸菌的生长繁殖 ②罐口密闭不严,氧气抑制了乳酸菌的生长繁殖 ③罐口密闭不严,氧气抑制了其他腐生菌的生长和繁殖 ④罐口密闭不严,促进了需氧腐生菌的生长繁殖 A. ①③ B. ①④ C. ②③ D. ②④ 高中化学选修物质结构高 考题汇总 Prepared on 22 November 2020 知识梳理:要描述一个电子的运动状态,应从四个 第n能层有___个能级,每能层有__个轨道, 每个轨道最多容纳__个电子 (2007海南·25)A、B、C、D、E代表5种元素。 请填空: (1)A元素基态原子的最外层有3个未成对电子, 次外层有2个电子,其元素符号为; (2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为,C的元素符号 为; (3)D元素的正三价离子的3d亚层为半充满,D的元素符号为,其基态原子的电子排布式为。 (4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为,其基态原子的电子排布式为。 (09年福建理综·30)[化学——物质结构与性质](13分) Q、R、X、Y、Z五种元素的原子序数依次递增。已知: ①Z的原子序数为29,其余的均为短周期主族元素; ②Y原子价电子(外围电子)排布m s n m p n ③R原子核外L层电子数为奇数; ④Q、X原子p轨道的电子数分别为2和4。 回答下列问题: (1)Z2+的核外电子排布式是。 (2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的形成配位键。 (3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是。 a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲>乙 c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙 (4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为(用元素符号作答) (5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为。 (6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于。 知识梳理:Abn型分子中孤电子对数目 =_______________________ 比较分子中键角大小的方法 _______________________________ 1.(09年海南化学·)下列说法中错误 ..的是: A.SO2、SO3都是极性分子 B.在NH4+和[Cu(NH3)4]2+中都存在配位键 C.元素电负性越大的原子,吸引电子的能力越强D.原子晶体中原子以共价键结合,具有键能大熔点高硬度大的特性 1.(2007海南·23)用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是 () 高中生物选修一生物技术实践知识点总结 专题一传统发酵技术的应用 课题一果酒和果醋的制作 1、果酒菌种:附在葡萄皮上的野生型酵母菌(真菌,兼性厌氧,主要出芽生殖还有孢子生殖) 2、在有氧条件下,酵母菌进行有氧呼吸,大量繁殖。 在无氧条件下,酵母菌能进行酒精发酵。 3、制酒条件:温度(18~25℃),发酵液缺氧呈酸性(酵母菌可以生长繁殖,而其他微生物无法适应这一环境)。 4、葡萄酒呈现深红色的原因:红葡萄皮的色素进入发酵液。 5、果醋菌种:醋酸菌(原核生物),代谢类型异养需氧型。 6、有两条途径生成醋酸:当氧气、糖源都充足时,醋酸菌将葡萄汁中的糖分解成醋酸;当缺少糖源时,醋酸菌将乙醇变为乙醛,再将乙醛变为醋酸。C2H5OH+O2→CH3COOH+H2O 7、制醋条件:①深层发酵时,短时间不通氧,醋酸菌死亡。②温度:30~35℃。 8、流程: 9、装置:充气口制酒时关闭;制醋时,连续输入氧气。 排气口长而弯曲的胶管目的是防止空气中微生物的污染;开口 向下的目的是排出酒精发酵时产生的二氧化碳。出料口是用来 取样检测。 葡萄汁只装2/3,留1/3空间的目的是让酵母菌先有氧呼 吸进行繁殖。 10、若用瓶子做装置:制酒时,要每天拧松瓶盖2~4次,目的是排二氧化碳;制醋时,将瓶口打开,盖上纱布。 挑选葡萄→冲洗→榨汁→酒精发酵→醋酸发酵 果酒果醋 11、所有用具清洗后晾干或清洗后用70%的酒精消毒。 先冲洗葡萄再除去枝梗,以避免除去枝梗时引起葡萄破损,增加被杂菌污染的机会。 12、酒精检验:酸性(3mol/L的H2SO4)重铬酸钾→灰绿色。醋酸检验:嗅味和品尝(比较pH) 13、从哪些方面防止发酵液被污染? 榨汁机要清洗干净,并晾干。发酵瓶要清洗干净,用体积分数70%的酒精消毒,或用洗洁精洗涤。装入葡萄汁后,封闭充气口。 课题二腐乳的制作 1、菌种:多种微生物如青霉、酵母、曲霉、毛霉等,主要是毛霉(真菌,代谢类型是异养需氧型。孢子生殖。)传统制作毛霉来自空气;现代生产将优质毛霉菌种直接接种在豆腐上。 2、原理:毛霉等微生物产生的蛋白酶能将豆腐中的蛋白质分解成小分子的肽和氨基酸;脂肪酶可将脂肪水解为甘油和脂肪酸。 3、实验流程:让豆腐上长出毛霉→加盐腌制→加卤汤装瓶→密封腌制(加盐之前为前期发酵,目的是创造条件让毛霉生长,使毛霉形成菌膜包住豆腐使腐乳成型。后期发酵主要是酶与微生物协同作用,生成腐乳的香气。) 4、所用豆腐的含水量为70%左右,水分过多则腐乳不易成形。豆腐生长的白毛是毛霉的白色菌丝。 5、温度:15~18℃。 6、加盐:逐层加盐,随着层数的加高而增加盐量,接近瓶口表面的盐要铺厚一些。控制盐的用量(豆腐:盐=5:1):盐的浓度过低,不足以抑制微生物的生长,可能导致豆腐腐败变质;盐的浓度过高会影响腐乳的口味。 食盐的作用:1.抑制微生物生长,避免腐败变质2.析出水分,是豆腐变硬 3.调味 7、卤汤:由酒及各种香辛料配制而成的。 8、卤汤中酒的含量:12%左右。作用:1.防止杂菌污染 2.赋予腐乳风味3.酒精含量过高,对蛋白酶的抑制作用也越大,使腐乳成熟期延长;酒精含量过低,不足以抑制微生物生长,导致豆腐腐败。 9、香辛料的作用:1.调味 2.杀菌 10、防止杂菌污染的措施:①玻璃瓶,洗净后用沸水消毒。②加卤汤后,用胶条将瓶口密封。③封瓶时,将瓶口通过酒精灯的火焰。 11、影响腐乳风味的因素:盐、酒、香辛料、豆腐含水量。 12、腐乳外部致密的“皮”是前期发酵时在豆腐表面上生长的毛霉菌丝,它能形成 物质结构与性质真题专练 1. (2016课标3卷)砷化镓(GaAs )是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回 答下列问题: (1)写出基态As 原子的核外电子排布式________________________。 (2)根据元素周期律,原子半径Ga_____________As ,第一电离能Ga____________As 。(填“大于”或“小于”) (3)AsCl 3分子的立体构型为____________________,其中As 的 杂化轨道类型为_________。 (4)GaF 3的熔点高于1000℃,GaCl 3的熔点为77.9℃,其原因是 _____________________。 (5)GaAs 的熔点为1238℃,密度为ρg·cm -3,其学科&网晶胞结构 如图所示。该晶体的类型为________________,Ga 与As 以________ 键键合。Ga 和As 的摩尔质量分别为M Ga g·mol -1和M As g·mol -1,原 子半径分别为r Ga pm 和r As pm ,阿伏伽德罗常数值为N A ,则GaAs 晶胞中原子的体积占晶胞体积的百分率为____________________。 2. (2016课标1卷)锗(Ge )是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题: (1)基态Ge 原子的核外电子排布式为[]Ar __________,有__________个未成对电子。 (2)Ge 与C 是同族元素,C 原子之间可以形成双键、叁键,但Ge 原子之间难以形成双键或叁键,从原子结构角度分析,原因是 。 (3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因 。 4GeCl 4GeBr 4GeI 熔点/℃ 49.5- 26 146 沸点/℃ 83.1 186 约400 (4)2424Zn 、Ge 、O 电负性由大至小的顺序是____________________。 (5)Ge 单晶具有金刚石型结构,其中Ge 原子的杂化方式为 __________,微粒之间存在的作用力是__________。 (6)晶胞有两个基本要素: ①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge 单晶的晶胞,其中原子坐标参数A 为()000,,;B 为11022?? ???,,;C 为11022?? ??? ,,。则D 原子的坐标参数为 。 ②晶胞参数,描述晶胞的大小和形状。已知Ge 单晶的晶胞参数 565.76pm a =,其密度为__________3g cm -?(列出计算式即可) 。 3.(2016课标2卷)东晋《华阳国志南中志》卷四种已有关于白 铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币, 亦可用于制作仿银饰品。回答下列问题:(完整版)苏教版化学选修3物质结构与性质专题3知识点
第一章 物质结构基础
(推荐)高中生物选修一专题1、2重点知识点总结
2019高考物质结构
2016中考生物专题训练:生物和生物圈及生物体的结构层次【含答案及解析】
专题复习 选修三 物质结构与性质部分(共10题)无答案
2019年高考化学复习专题27物质结构与性质练习
一遍过 高中生物选修一 专题一 综合测试
高中化学选修物质结构高考题汇总
(新)高中生物教材选修一必背
高考物质结构题
