发酵液中L_赤藓酮糖的紫外法测定

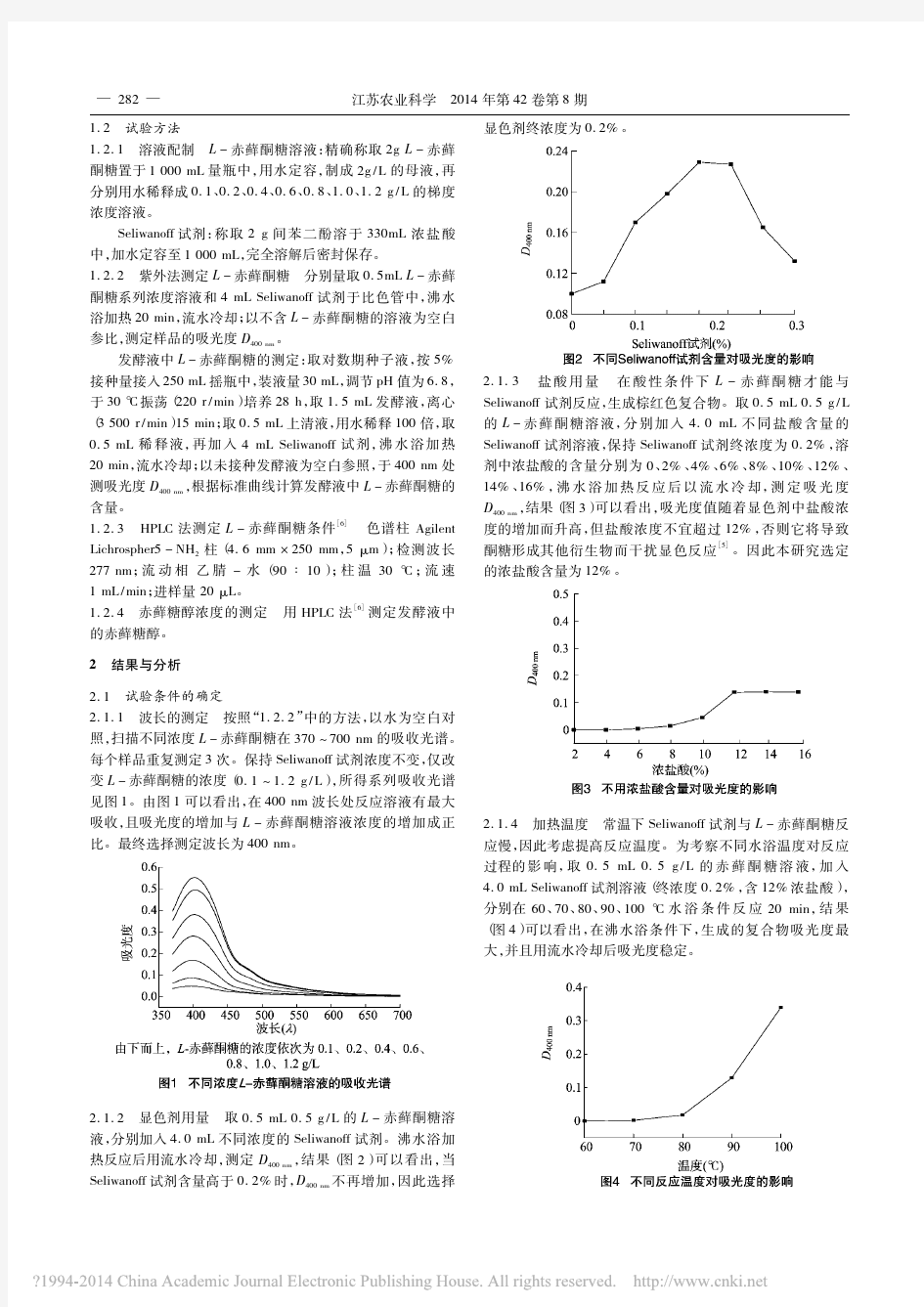
赤藓糖醇的特性及应用
赤藓糖醇的特性及应用:摘要:赤藓糖醇是一种低热量甜味剂,具有热值低、结晶性好、口感好、 无致龋性、对糖尿病人安全等特点,其应用前景极为广泛。本文主要论述了赤藓糖醇的性质、特性、生产及在食品工业中的应用。 关键词:赤藓糖醇;性质;特性;应用;生产 赤藓糖醇是一种采用生物技术生产的新型发酵型低热量甜味剂,1999年6月国际食品添加剂专家委员会(JECFA)批准赤藓糖醇作为食用甜味剂,且无需规定ADI值。目前,赤藓糖醇在美国、日本、澳大利亚、新西兰、新加坡、韩国、墨西哥等国已用于食品生产。2007年6月19日我国卫生部公告批准赤藓糖醇作为甜味剂应用于口香糖、固体饮料、调制乳等食品中。 1 赤藓糖醇的性质 赤藓糖醇在自然界分布十分广泛,海藻、蘑菇以及甜瓜、葡萄、桃等水果类中均含有赤藓糖醇。由于细菌、真菌和酵母也能产生赤藓糖醇,所以在发酵食品果酒、啤酒、酱油中也存在,另外还存在于人和哺乳动物的体液中。 赤藓糖醇为白色结晶的四碳多元醇类化合物,化学名称为1,2,3,4-丁四醇,分子式为C4H10O4,分子量122.12,熔点126℃,沸点329~331℃,溶解热-97.4J/g,其化学性质与山梨糖醇、甘露糖醇和木糖醇等糖醇相类似。 1.1 甜味纯正 赤藓糖醇与蔗糖的甜昧特性十分接近,爽净且无后苦味,甜度约为蔗糖的70%~80%。与其他甜味剂混合使用具有改善、协调味质作用,如赤藓糖醇与高甜味剂甜菊苷以1000:(1~7)混合使用,可有效掩盖甜菊苷的后苦味;将20%以上的赤藓糖醇与白砂糖并用,其后味和甜味比白砂糖更为理想;溶液中1%~3%的赤藓糖醇能有效掩饰刺激性口味,改善溶液的口感和风味。 1.2 稳定性高 赤藓糖醇在热、酸、碱条件下稳定,适用的酸碱范围为pH2~12,符合一般食品对酸碱的要求,由于不含羰基,所以在与氨基酸共存的情况下无美拉德反应发生。试验表明,赤藓糖醇在160℃高温条件下不会出现分解及热变色,避免高温加工过程食品出现的焦化。 1.3 结晶性好 赤藓糖醇吸湿性低,结晶性好,易粉碎制得粉状产品,其吸湿性在糖醇及蔗糖等甜味剂中是最小的。温度为20℃、相对湿度为90%的环境中,放置5d后的吸湿增重,麦芽糖约为17%,蔗糖约为10%,而赤藓糖醇仅为2%左右。 1.4 熔解热高 其溶解热为-97.4J/g,由于溶解热较大,溶于水时会吸收较多的能量,有很强的制冷作用。实验表明,将10g 赤藓糖醇溶解于90g水中,温度下降约4.8℃,用它添加生产的固体食品和糖果在食用时具有口感清凉特点。 2 赤藓糖醇的生物学特性 2.1 低能量值 赤藓糖醇分子能量值为1.67kJ/g,而木糖醇11.7 kJ/g,异麦芽酮糖醇8.36KJ/g,蔗糖16.72 kJ/g,故其热量值仅为蔗糖10%左右。同时由于赤藓糖醇分子小,被动扩散容易被小肠吸收,80%的赤藓糖醇可以进入血液循环,被人体吸收后的赤藓糖醇分子不能被机体内的酶系统分解,不为机体提供热量,不参与糖代谢引起血糖变化,只能透过肾脏从血液滤出,随尿液从人体排出。实验表明,一次性摄人赤藓糖醇25g,3h内有40%从尿液中排出,大约在24h内,有80%从尿液中排出,尿液总排出量达90%以上,没有被小肠摄入的20%赤藓糖醇进入大肠后,肠道细菌发酵成不饱和脂肪酸被机体利用的不到50%。因此被摄人赤藓糖醇中只有5%~10%能为人体提供能量,故赤藓糖醇的实际能量值仅为0.84KJ/g,是所有多元糖醇甜昧剂中能量最低的一种,也被称为“零”热值配料。 2.2 高耐受性,无毒副作用 赤藓糖醇的生物耐受性好,安全无毒,动物和临床实验中不会导致腹泻的山梨糖醇最大单次剂量是0.24g/kg 体重,而赤藓糖醇为0.80 g/kg体重,是木糖醇、麦芽糖醇、异麦芽糖醇和乳糖醇的2~3倍,甘露醇的3~4倍,与其他多元糖醇相比,赤藓糖醇在人体内的最大耐受量为50g/d。这是因为绝大部分赤藓糖醇能被小肠吸
赤藓糖醇
一.赤藓糖醇国内外生产状况: 赤藓糖醇是一种带有清凉口感的填充型甜味剂,不仅拥有糖醇类产品的所有卓越功能,如防止龋齿、适宜糖尿病患者食用等特点,还独具低能量值和高耐受量的特性,属于填充型的功能性食糖替代品。生产厂家主要是日本Mitsubishi公司,于1990年已经完成工业化生产, 约占世界市场80%份额,其余被欧洲Cerestar和韩国Bolak等占有。我国赤藓糖醇的主要技术指标达到国际领先水平,具备工业化生产的成熟水平。 二.赤藓糖醇国内生产厂家: 1.山东保龄宝生物技术有限公司 2.广州施健生物科技有限公司 3.菏泽鑫友食品有限公司 4.南宁富谷科技有限公司 5.滨州三元生物科技有限公司 三.甘露醇市场价格: 29万/吨—35万/吨 四.赤藓糖醇的用途: 1.赤藓糖醇在食品中的应用 (1)糖果生产 赤藓糖醇具有吸湿性低、有清凉感、结晶性良好以及低热值、非致龋性等特性,加热不会引起美拉德反应。因此在一般食品加工条件下,几乎不会出现褐变或分解现象,十分适合应用于口香糖、糖果等忌
湿食品中。 (2)巧克力生产 精炼条件下,在巧克力浆料中加入赤藓糖醇,能使巧克力在80℃以上的环境中进行加工,大大缩短加工时间,又改善了产品的风味。由赤藓糖醇部分替代糖,能使巧克力的热量减少30%。 (3)乳制品、饮料以及酒的生产 发酵乳中添加10%赤藓糖醇,能延长产品的保质期。利用赤藓糖醇溶解时的吸热作用,可生产出自冷性的固体粉末饮料。计算值是10g 赤藓糖醇溶解于90g水中,温度下降约4. 8℃,在l00ml22℃的自来水中溶解17g赤藓糖醇时,实测约有6℃的冷却效果。在含酒精饮料中,由于糖类能促进酒精与水的结合,具有缓和酒精刺激性的效果。故可作为蒸馏酒的缓冲剂, 提高发酵产品的天然风味。除此之外,赤藓糖醇也广泛用于其他食品领域,如冰淇淋、糕点等等。 (4)保健类食品 赤藓糖醇具有不易被酶降解,不参与糖代谢,不导致血糖变化的特点,适合糖尿病患者保健食品的应用;代替蔗糖制成低能量值的保健食品,适合肥胖人群、高血压病人及心血管病人食用;食用后在肠道中的代谢特点,适合肠胃功能不调人群;利用抗龋齿功能,可制成对口腔健康有益的糖果和口香糖。 五.应用前景 赤藓糖醇除在食品工业中应用外,还可应用于医药、化妆品、化工等许多方面,其可部分替代甘油的作用生产化妆品,延缓化妆品变
(整理)可溶性糖测定.
引言 可溶性糖包括葡萄糖、果糖、蔗糖等单糖和双糖,是植物品质的重要构成性状之一,尤其是以果实为目的产品的植物,可溶性糖与酸的含量及其配比是影响果实风味品质的重要因素。对于鲜食品种,一般来讲,高糖中酸,风味浓,品质优;低糖中酸,风味淡,品质差。因此,可溶性糖的定量研究对植物的品质育种、储藏、加工特性等具有重要意义。而且可溶性糖广泛存在于植物的根、茎块和种子中,是人体热量的最最主要来源,具有较高的营养价值。本文重点介绍蒽酮比色法、铜还原碘量法、费林试剂法、原子吸收法、气相色谱法、液相色谱-蒸发光散射法,及连续流动法这几种实验如何定量测定可溶性糖含量。
1 蒽酮比色法 1.1 原理 糖在硫酸作用下生成糠醛,糠醛再与蒽酮作用形成绿色络合物,颜色的深浅与糖含量有关。在625 nm波长下的OD值与糖含量成正比。由于蒽酮试剂与糖反应的呈色强度随时间变化,故必须在反应后立即在同一时间内比色。 1.2 仪器与材料 1.2.1实验仪器 分光光度计,电炉,铝锅,电子天平,20ml刻度试管,刻度吸管5ml 1支、1ml 2支,漏斗。1.2.2实验试剂 (1)蒽酮乙酸乙酯试剂:取分析纯蒽酮1g,溶于50ml乙酸乙酯中,贮于棕色瓶中,在黑暗中可保存数星期,如有结晶析出,可微热溶解。 (2)浓硫酸(比重1.84)。 1.2.3实验材料 植物叶片。 1.3 实验方法 1.3.1标准曲线的制作 取20ml刻度试管11支,从0~10分别编号,按表24-1加入溶液和水。 表1 各试管加溶液和水的量 管号 0 1、2 3、4 5、6 7、8 9、10 100μg/ml蔗糖液 0 0.2 0.4 0.6 0.8 1.0 (ml) 水(ml) 2.0 1.8 1.6 1.4 1.2 1.0 蔗糖量(μg) 0 20 40 60 80 100 然后按顺序向试管内加入1ml 9%苯酚溶液,摇匀,再从管液正面快速加入5ml浓硫酸,摇匀。比色液总体积为8ml,在恒温下放置30min,显色。然后以空白为参比,在485nm 波长下比色测定,以糖含量为横坐标,光密为纵坐标,绘制标准曲线,求出标准直线方程。按表1加入标准的蔗糖溶液,然后按顺序向试管中加入0.5ml蒽酮乙酸乙酯试剂和5ml浓硫酸,充分振荡,立即将试管放入沸水浴中,逐管均准确保温1min,取出后自然冷却至室温,以空白作参比,在630nm波长下测其光密度,以光密度为纵坐标,以糖含量为横坐标,绘制标准曲线,并求出标准线性方程。 1.3.2可溶性糖的提取 取新鲜植物叶片,擦净表面污物,剪碎混匀,称取0.10~0.30g,共3份,或干材料。
蒽酮法测还原糖
总糖的含量的测定(蒽酮法) 一、实验目的 掌握蒽酮比色法测定糖的原理与方法。 二、实验原理 蒽酮比色法是一个快速而简便的测定糖方法。蒽酮可以和游离的己糖或多糖中的己糖基、戊醛糖及己糖醛酸起反应,反应后溶液呈蓝绿色,在620 nm 处有最大吸收。蒽酮可与其他一些糖类发生反应,但显现的颜色不同。当样品中存有含有较多色氨酸的蛋白质时,反应不稳定,呈红色。对于以上特定的糖类反应较稳定。 三、实验器材 1.吸管 2.试管 3.分光光度计 4.水浴锅 5.电炉 6.电子分析天平 四、实验试剂 1.蒽酮试剂:取2 g蒽酮溶于1000 ml体积分数为80 %的硫酸中,当时配制使用。 2.标准葡萄糖溶液(0.1 mg/ml):100 mg葡萄糖溶于蒸馏水并稀释至1000 ml(可滴加几滴甲苯作防腐剂)。 3. 6 mol/l HCl溶液。
4.10 % NaOH溶液:称取10 g NaOH固体,溶于蒸馏水并稀释至100 ml。 五、实验操作 1.制作标准曲线 取干净试管7支,按下表进行操作。 表蒽酮比色法测定糖含量的标准曲线制作 2.样品的处理(见实验四) 取上述实验四的水解液,冷却后用10 % NaOH溶液中和至pH呈中性,然后用蒸馏水定容至100 ml,过滤,取滤液10 ml,用蒸馏水定容于100 ml成稀释1000倍的总糖水解液,用于糖含量的测定。 测定时取1 ml总糖水解液测定还原糖的含量(同标准曲线)。
样品中糖含量的计算: w —糖的质量分数(%); C —从标准曲线上查出的糖质量浓度(mg/ml); V —样品稀释后的体积(ml ); m —样品的质量(mg )。 w= CV m ×100%
植物组织中可溶性糖含量的测定(蒽酮法)
Ⅳ、植物组织中可溶性糖含量的测定(蒽酮法) 一、目的 掌握蒽酮法测定糖的原理和技术。 二、原理 糖类(包括单糖、双糖、寡糖)在浓硫酸存在下,脱水生成糠醛或羟甲基糠醛,然后蒽酮与糠醛或羟甲基糠醛经脱水缩合,生成蓝绿色的糠醛衍生物,颜色深浅与糖浓度成正相关。其反应式如下: 显色反应与反应温度、加热时间、反应系统中水和硫酸比例有关。本实验通过控制反应系统中水和硫酸比例,利用硫酸与水发生水合作用释放的热能,使反应系统自行升温而达到显色效果免去外加热步骤。 蒽酮法具有很高灵敏度,适用于糖的微量测定,且试剂简单,操作简便,因而得到普遍应用。 三、材料、仪器设备及试剂 1.材料:烘干材料粉末(过筛100目)或剪碎混匀鲜样品。 2.仪器设备: 分光光度计;电子分析天平;水浴锅;100ml容量瓶;试管;漏斗;剪刀;移液管;洗耳球等。 3.试剂及配制: 蒽酮试剂:称取蒽酮200mg溶于100ml浓硫酸中。该试剂不能久贮,宜用前配制。 100μg·ml-1 蔗糖标准母液:准确称取蔗糖100mg于烧杯加少量水溶解后,洗入 100ml容量瓶中定容至刻度。 四、实验步骤 1.蔗糖标准曲线制作 1.1取6支试管,编号,按下表配制每管含量为0~100μg蔗糖标准液 加入表中试剂后,向各管沿管壁迅速加入蒽酮试剂6.5ml,并立即摇动使混合均匀,置试管架上室温下显色,冷却后倒入比色杯,以0号管作空白对照,在620nm波长处,以多点校准总量法,制作标准曲线。 2.样品提取 称取干样品粉末100mg或剪碎混匀的鲜样品1g,放入试管中,加入蒸馏水10ml,置于沸水浴中提取20min,冷却后过滤入100ml容量瓶中,以热水冲洗残渣2~3次,一并滤入容量瓶中,待冷至室温,定容至刻度,即为样品待测液。 3.糖含量测定 吸取待测液0.2ml(含糖量30~80μg),加入试管中,再加蒸馏水2.3ml,摇匀。随后沿试管壁迅速加入蒽酮试剂6.5ml,立刻摇动混合均匀,置于试管架上显色,冷却至室温后,以空白管作对照,在620nm波长处,按多点校准定量法测定待测管中提取液糖含量。 五、结果计算
实验8-植物组织中可溶性糖含量的测定(蒽酮比色法)
实验方案 一、实验目的 通过实验,掌握测定萝卜品质的方法 (一)萝卜外部形态的测定 1、实验材料 取鲜样3个∕小区 直尺、蒸馏水、笔、记录本、吸水纸 2、实验方法 .用自来水将各组萝卜洗净后,再用蒸馏水洗涤,擦干表面水分.每个小区取3个重复,用电子天平称量每株的鲜重,用直尺测量植株的茎长、茎粗、叶长,取平均值作为指标值 实验(二) 植物体内可溶性糖含量的测定(蒽酮法) 一、实验目的 了解蒽酮法测定可溶性糖含量的原理;掌握分光光度计的使用二、实验原理 糖类物质是构成植物体的重要组成成分之一,也是新陈代谢的主要原料和贮存物质。不同载培条件,不同成熟度都可以影响水果、蔬菜中糖类的含量。因此对水果、蔬菜中可溶性糖的测定,可以了解和鉴定水果、蔬菜品质的高低。 蒽酮比色定糖法是一个快速而方便的定糖方法,在强酸性条件下,蒽酮可以与游离的或多糖中存在的己糖、戊糖及己糖醛酸(还原性和非还原性)作用生成蓝绿色的糖醛衍生物,其颜色的深浅与糖的含量在一定范围内成正比。蒽酮也可以和其他一些糖类发生反应,但显现的颜色不同。当存在含有较多色氨酸的蛋白质时,反应不稳定,呈现红色。上述特定的糖类物质,反应较稳定。该法特点:灵敏度高,测定量少,快速方便。 三、材料、仪器及试剂
1.材料:植物种子、白菜叶、柑桔 2.仪器:分光光度计;恒温水箱;20ml具塞刻度试管(3支)漏斗;100ml容量瓶;刻度试管;试管架;剪刀;研钵 3.试剂 (1)200μg/ml标准葡萄糖:AR级葡萄糖100mg,蒸馏水溶解,定容至500ml。 (2)蒽酮试剂:1g蒽酮,用乙酸乙酯溶解,定容至50ml,棕色瓶避光处贮藏; (3)浓硫酸 四、实验方法 1.葡萄糖标准曲线的制作 取6支20ml具寒试管,编号,按下表数据配制一系列不同浓度的标准葡萄糖溶液。在每管中均加入0.5ml蒽酮试剂,再缓慢地加入5ml 浓H2SO4,摇匀后,打开试管塞,置沸水浴中煮沸10分钟,取出冷却至室温,在620nm波长下比色,测各管溶液的光密度值(OD),以标 2. 称取1克白菜叶,剪碎,置于研钵中,加入少量蒸馏水,研磨成匀浆,然后转入20ml刻度试管中,用10ml蒸馏水分次洗涤研钵,洗液一并转入刻度试管中。置沸水浴中加盖煮沸10分钟,冷却后过滤,滤液收集于100ml容量瓶中,用蒸馏水定容至刻度,摇匀备用。 3.糖含量测定 用移液管吸收1ml提取液于20ml具塞刻度试管中,加1ml水和0.5ml蒽酮试剂。再缓慢加入5ml浓H2SO4(注意:浓硫酸遇水会产生大量的热!),盖上试管塞后,轻轻摇匀,再置沸水浴中10分钟(比色空白用2ml蒸馏水与0.5ml蒽酮试剂混合,并一同于沸水浴保温10分钟)。冷却至室温后,在波长620nm下比色,记录光密度值。查标准曲线上得知对应的葡萄糖含量(μg)。 五、结果计算 样品含糖量(g/100g鲜重)=查表所得糖含量(μg)×稀释倍数×100/样品重(g)×106 六、注意事项
链霉素生产工艺设计
发酵工厂工艺课程设计 题目:5000t链霉素生产工艺设计 课程名称:发酵工厂工艺设计概论 学院:药学与生物工程学院 班级: 112100101 学号: 20 姓名: 指导老师: 二零一五年五月
目录 1前言 (4) 2设计任务书 (5) 2.1本课程设计的性质、目的 (5) 2.2本课程任务: (5) 2.3基本要求: (5) 2.4 基础数据: (5) 2.5设计内容: (6) 2.6参考数据及公式 (6) 3厂址选择 (7) 3.1厂址选择主要考虑的几个因素 (7) 3.2厂址的最终选择 (7) 3.3厂址卫星图 (8) 4工厂总平面设计 (8) 4.1工厂的平面设计图见附表: (8) 5工艺流程简图及说明论证 (8) 5.1发酵工艺 (8) 5.1.1斜面孢子培养 (8) 5.1.2 摇瓶种子培养 (9) 5.1.3 种子罐扩大培养 (9) 5.2 链霉素发酵条件及中间控制 (9) 5.2.1溶氧的影响及控制 (9) 5.2.2 温度 (10) 5.2.3 pH值 (11) 5.3 提取工艺 (11) 5.4工艺流程简图如下: (12) 6工艺计算 (13) 6.1物料衡算 (13) 6.2热量衡算 (14) 6.2.1.对于生产1000kg链霉素产品,利用直接蒸汽混合加热,蒸汽消耗量为: (14) 6.2.2.发酵罐空罐灭菌时的蒸汽消耗量估算: (15) 6.2.3.发酵罐实罐灭菌保温时的蒸汽消耗量估算: (15) 6.3耗水量的计算 (16) 7发酵车间设备的选型计算 (17) 7.1发酵罐的设计 (17) 7.1.1发酵罐的选型及尺寸 (17) 7.2设备结构的工艺设计 (18) 7.2.1 空气分布器 (18) 7.2.2 挡板 (18) 7.2.3搅拌器设计 (18) 7.2.4电机设计及轴功率的计算 (19) 7.2.5冷却面积的计算与冷却管的设计 (20) 7.2.6 PH测定 (22)
总糖和还原糖的测定——斐林氏法
总糖和还原糖测定方法较多,如3,5—二硝基水杨酸法、碱性铜试剂法、蒽酮比色法、斐林氏法等。这里只介绍斐林氏法。 一、目的 学习掌握生产实践中常用的快速定糖方法。 二、原理 还原糖在碱性溶液中能将Ag+,Hg+,Cu2+,Fe(CN)3-等金属离子还原,而糖本身则氧化成各种羟酸,利用这一特性可以对还原糖进行定量测定。本实验采用斐林试剂热滴定法,氧化剂是斐林试剂,它是由甲乙两种溶液组成,甲液中含有硫酸铜、次甲基蓝;乙液中含有氢氧化钠、酒石酸钾钠和亚铁氰化钾(黄血盐)。当甲乙两液混合时,硫酸铜和氢氧化钠作用形成氢氧化铜沉淀,由于溶液中存在酒石酸钾钠,它和氢氧化铜形成了可溶性络合物。 酒石酸络铜(Ⅱ)钾钠盐在与还原糖共热时,二价铜离子即被还原成一价的氧化亚铜红色沉淀。 此氧化亚铜与试剂中亚铁氰化钾反应生成可溶性的亚铁氰酸络铜(Ⅰ)钾盐。 Cu2O + K4Fe(CN)6 + 3 H2O →K2Cu2Fe(CN)6 + 2 KOH + 2 H2O 亚铁氰化钾亚铁氰酸络铜(Ⅰ)钾盐 斐林试剂中二价铜的还原力比次甲基蓝强,因此所滴入的标准葡萄糖溶液首先使二价铜还原,只有当二价铜被还原完毕后,才能使次甲基蓝(甲烯蓝)还原为无色,测定中以此作为滴定终点。 在测定时先做一对照管(不加样品),用标准葡萄糖滴定求知一定体积斐林试剂中二价铜和次甲基蓝的量,即测定对照管消耗的标准葡萄糖量(A)。再做样品管,样品中还原糖消耗斐林试剂中一部分二价铜,剩余的量再用标准葡萄糖来滴定,即样品消耗的标准葡萄糖量(B)。将(A)减去(B)就可求得样品中还原糖量。 三、器材及试剂: 1.器材: ①山芋粉②广范试纸pH1~12。 ③吸管5毫升(×4),10毫升(×2)④容量瓶100毫升(×3)
蒽酮法测定可溶性糖
植物组织可溶性糖及淀粉测定(蒽酮法) 一、材料、仪器设备及试剂 1.材料 新鲜或烘干的植物叶片 2.仪器设备 分光光度计、水浴锅、刻度试管、刻度吸管。 3.试剂 蒽酮乙酸乙酯试剂:取分析纯蒽酮1g,溶于50ml乙酸乙酯中,贮于棕色瓶中,在黑暗中可保存数周,如有结晶析出,可微热溶解; 9.2mol/L HCIO 浓硫酸(相对密度1.84); l%蔗糖标准液:将分析纯蔗糖在80℃下烘至恒重,精确称取1.000g。加少量水溶解移入100ml容量瓶中,加入0.5ml浓硫酸,用蒸馏水定容至刻度; 100μg蔗糖标准液:精确吸取1%蔗糖标准液1ml加入100ml容量瓶中,加水定容。 淀粉标准溶液:准确称取100mg纯淀粉,放入100ml容量瓶中,加60-70ml热蒸馏水,放入沸水浴中煮沸,冷却后加蒸馏水稀释至刻度,则每ml含淀粉1mg,吸取此液5.0ml,加蒸馏水稀释至50ml,却为每ml含淀粉100g 的标准液。 二、实验步骤 1.标准曲线的制作 取20ml刻度试管11支,从0~10分别编号,按表加人溶液和水,然后按顺序向试管内加入0.5ml蒽酮乙酸乙酯试剂和5ml浓硫酸,充分振荡,,立即将试管放入沸水浴中,逐管准确保温1min,取出后自然冷却至室温,以空白为对照,在630nm波长下测其吸光度。比色液总体积为8ml.以糖含量为横坐标;光密度为纵坐标,绘制标准曲线,求出标准直线方程。 表 试剂 管号 01,23,45,67,89,10 100μg·L-1蔗糖液/ml00.20.40.60.8 1.0 水/ ml 2.0 1.812.6 1.4 1.2 1.0 蔗糖量/μg020********* 2.可溶性糖的提取新鲜植物叶片或干材料,擦净表面污物,剪碎混匀,称取0.10~0.30g ,共3份,分别放入3支刻度试管中,加人5-10ml蒸馏水,塑料薄膜封口,于沸水中提取30min(提取2次),提取液过滤入25ml容量瓶中,反复冲洗试管及残渣,定容至20ml。 3.显色测定:吸取样品提取液0.5ml于20ml刻度试管中,加蒸馏水1.5ml,然后向试管内加入0.5ml蒽酮乙酸乙酯试剂和5ml浓硫酸,充分振荡,立即将试管放入沸水浴中,准 确保温1min,取出后自然冷却至室温,以空白为对照,在630nm波长下测其吸光度。 可溶%)=(C*V/a*n)/(W*106) 式中C:标准方程求得糖量(g) a:吸取样品液体积(ml); V:提取液量hal); n:稀释倍数;
赤藓糖醇的研究进展及其应用
赤藓糖醇的研究进展及其应用 摘要:赤藓糖醇是一种低热量甜味剂,具有热值低、结晶性好、口感好、无致龋性、对糖尿病人安全等特点, 其应用前景极为广泛。本文主要论述了赤藓糖醇的性质、特性、生产及在食品工业中的应用。 关键词:赤藓糖醇;性质;特性;应用;生产 赤藓糖醇是一种采用生物技术生产的新型发酵型低热量甜味剂,1999年6月国际食品添加剂专家委员会(JECFA)批准赤藓糖醇作为食用甜味剂,且无需规定ADI值。目前,赤藓糖醇在美国、日本、澳大利亚、新西兰、新加坡、韩国、墨西哥等国已用于食品生产。2007年6月19日我国卫生部公告批准赤藓糖醇作为甜味剂应用于口香糖、固体饮料、调制乳等食品中。 1 赤藓糖醇的物理及甜味特性 赤藓糖醇在自然界分布十分广泛,海藻、蘑菇以及甜瓜、葡萄、桃等水果类中均含有赤藓糖醇。由于细菌、真菌和酵母也能产生赤藓糖醇,所以在发酵食品果酒、啤酒、酱油中也存在,另外还存在于人和哺乳动物的体液中。 Ergthritol化学名称为1, 2, 3, 4- 丁四醇, 英文名称为1, 2, 3, 4- Butanetetrol, 分子式为C4H10O4,分子量为122.12, 熔点118~122℃沸点329~331℃, 赤藓糖醇的结晶性好, 吸湿性低, 易于粉碎制得粉状产品。在相对湿度90%以上环境中也不吸湿; 赤藓糖醇对热和酸十分稳定, 在一般食品加工条件下, 几乎不会出现褐变或分解现象, 能耐硬糖生产时的高温煎煮而不褐变。赤藓糖醇属于填充型甜味剂, 溶于水时会吸收较多的能量, 溶解热- 97.4J/g, 使用时有一种凉爽的口感特性。其甜味纯正, 甜味特性良好, 与庶糖的甜味特性十分接近, 无不良后苦味。与糖精、阿斯巴甜、安赛蜜共用时的甜味特性也很好, 可掩盖强力甜味剂通常带有不良味感或风味。如赤藓糖醇与甜菊苷以1000: ( 1~7) 混合使用, 可掩盖甜菊苷的苦后味。 2 赤藓糖醇的代谢特性 虽然从结构上看赤藓糖醇是一种多羟基化合物, 但它的分子量很小, 所以在
蒽酮比色法测总糖
[1] 姚立虎,徐茜. 蒽酮比色法测食品总糖含量的简化研究[J]. 食品工业992,03:40-42. 1. 2 试剂 0. 1 mg / mL, 1 葡萄糖标准溶液:准确称取10mg 葡萄糖标准品溶于少量蒸馏水中,溶解后转移至容量瓶中,用蒸馏水定容至100 mL. 蒽酮硫酸溶液:准确称取蕙酮50 mg 于100mL 二烧杯中,加入蒸馏水25 mL, ,缓慢加入98% 质量分数)浓硫酸75 mL, ,边加边搅(于冰水浴中完成),直至蕙酮溶解,冷却至室温后使用(临用新配)。 浓盐酸、浓硫酸、NaOH ,以上试剂均为分析纯,实验用水为蒸馏水。 1. 3 方法 1. 3. 1 显色剂(蒽酮硫醇溶液)用量选择。向试管中加入0. 1 mg / mL 葡萄糖标液0. 1 mL, ,并加入蒸馏水至1m L, ,分别加入不同量的显色剂显色测定,以0. 1 mL, 蒸馏水为空 白对照。 1.3.2 显色时间选择。向10 mL 二试管中加入0. 1mg / mL 葡萄糖标液0. 1 mL 二并加入蒸馏水至1mL, ,在冰水浴中缓慢加入9 mL 显色剂摇匀,改变沸水浴时问,冷却至室温后测体系吸光度。 1.3.3 葡萄搪标准曲线的绘制。改变0. 1 mgmL 葡萄糖标准液和蒸馏水的用量,再分别加入9mL 显色剂,进行显色测定。 1.3.4 正交试验确定提取条件。采用正交试验,考查 4 个影响因素(料液比、盐酸浓度、提取时间、水解时问)对实验的影响,因素水平见表 1.
1.3.5 水溶性总搪的提取。取0. 5 g 棉花纤维于150 mL 圆底烧瓶中,加入30 mL, 蒸馏水,在沸水浴中加热60 mLn, 滤出提取液20 mL 于50 mL 烧瓶中,加 5 mol / L 盐酸 5 mL 继续在沸水浴中加热30 mLn ,冷却后,滴加一滴酚酞,用 5 mol / L, 1 的氧氧化钠中和至中性。 1. 3. 6 水溶性总搪的测定。取提取液 1 mL 于10mL 试管中,在冰水浴中缓慢加入9 mL, 蕙酮硫酸溶液摇匀,在沸水浴中加热9 mLn ,冷却后放置30min 测定吸光度。从标准曲线上查得对应的浓度并计算总糖含量。 2 结果与分析 2. 1 吸收曲线 用紫外刊一见分光光度计在500 ~700 nm 波长范围内进行光谱扫描,结果发现在625 nm 处有最大吸收,故本实验采用625 nm 为测定波长。 2. 2 显色剂用量 由图 1 可以看出,当显色剂用量为9 ml 二时吸光度最大,故实验采用显色剂用量为9 m l。
实验二十一可溶性总糖的测定(蒽酮比色法)
实验二十一可溶性总糖的测定(蒽酮比色法) 一、目的 掌握蒽酮法测定可溶性糖含量的原理和方法。 二、原理强酸可使糖类脱水生成糠醛,生成的糠醛或羟甲基糖醛与蒽酮脱水缩合,形成糠醛的衍生物,呈蓝绿色,该物质在620 nm 处有最大吸收. 在10 -100ug 范围内其颜色的深浅与可溶性糖含量成正比。 这一方法有很高的灵敏度,糖含量在30ug 左右就能进行测定,所以可做为微量测糖之用。一般样品少的情况下,采用这一方法比较合适。 三、仪器、试剂和材料 1 . 仪器 (1)分光光度计 (2 )电子顶载天平 (3 )三角瓶:50m1 X 1 (4 )大试管:9 支 (5)试管架,试管夹 (6 )漏斗,漏斗架 (7 )容量瓶:50rnl X 2 (8 )刻度吸管:1m1X3 ,2m1X1 ,5mlX1 (9 )水浴锅 2 . 试剂 (1)葡萄糖标准液:l00ug/ml (2 )浓硫酸 (3)蒽酮试剂:0.2g 蒽酮溶于100 ml 浓H2SO4 中当日配制使用。 3 . 材料小麦分蘖节。 四、操作步骤 1. 葡萄糖标准曲线的制作
取7支大试管,按下表数据配制一系列不同浓度的葡萄糖溶液: 在每支试管中立即加入蒽酮试剂 4.0m1 ,迅速浸于冰水浴中冷却,各管加完后一起浸于沸水浴中,管口加盖玻璃球,以防蒸发。自水浴重新煮沸起,准确煮沸lOmin 取出,用流水冷却,室温放置10min ,在620 nm波长下比色。以标准葡萄糖含量(ug)作横坐标,以吸光值作纵坐标,作岀标准曲线。 2. 植物样品中可溶性糖的提取 将小麦分蘖节剪碎至2mm以下,准确称取lg,放入50m1三角瓶中,加沸水25m1,在水浴中加盖煮沸10min,冷却后过滤,滤液收集在50m1容量瓶中,定容至刻度。吸取提取液2m1,置另一50m1容量瓶 中,以蒸馏水稀释定容,摇匀测定。 3 .测定 吸取lml已稀释的提取液于大试管中,加入 4.0ml蒽酮试剂,以下操作同标准曲线制作。比色波长 620nm,记录吸光度,在标准曲线上查出葡萄糖的含量(ug )。 查表所得糖含量(ug )乂稀释倍数 五、结果处理 查表所得糖含量Cug)乂稀释倍数心 植物样品含糖壘(%)=: 样品重(町xm% X10° 六、注意事项 1 .该显色反应非常灵敏,溶液中切勿混入纸屑及尘埃。 2 . H 2 SO 4 要用高纯度的。 3. 不同糖类与蒽酮的显色有差异,稳定性也不同。加热、比色时间应严格掌握。 七、思考题 1.用水提取的糖类有哪些? 2 . 制作标准曲线时应注意哪些问题?
发酵液提取工艺的过程
发酵液提取工艺的过程 发酵结束后的发酵液组成情况非常复杂,处理措施与化学合成法明显不同。通常情况下,发酵液中目标物浓度很低,而杂质含量却很高,成份远较化学反应母液情况复杂,大量菌体细胞、培养基、各种蛋白质胶状物、色素、金属离子和其它代谢物等混杂其中,使得发酵液的预处理对于目标物的最终获取非常必要。 1、发酵液预处理的目的是使发酵液中的蛋白质和某些杂质沉淀,以增加滤速,过滤的目的是使菌丝体与发酵液分离,以便从发酵液或菌丝体中提取目标物。预处理阶段主要去除两大类杂质:可溶性黏胶状物质(核酸、杂蛋白、不溶性多糖等)和无机盐(不仅影响成品炽灼残渣,还会影响离子交换法提取目标物的收率)。 确定预处理方法前,首先要明确目标物存在于胞内(菌体)还是胞外(发酵液),以确定弃去和收集的对象;还要结合目标物的稳定性等特点,选择预处理的pH、温度和化学试剂等。对于菌丝体及杂蛋白的处理一般可采用等电点沉淀、变性沉淀、沉淀剂沉淀、加入絮凝剂、加入凝聚剂、吸附以及酶解法去除不溶性多糖等措施,对提取效果和成品质量影响较大的无机杂质主要是Ca2+、Mg2+、Fe3+等高价金属离子,可采用离子交换法、沉淀法等措施去除。加入的预处理试剂除要考虑到处理效果外,还要考虑低毒性、利于环保以及易于从终产品中除去等因素,申报时应说明所采取的措施及加入的试剂,必要时在成品质量研究中检测其残留量。 液-固分离是发酵液预处理的重要步骤,通常采用板框压滤、真空过滤以及离心分离等措施,过滤是各种措施中普遍存在的一个环节,为提高过滤效果、提高滤液质量,通常加入助滤剂,选择助滤剂时除考虑其效果和成本外,无毒,惰性,不与滤液和目标物产生化学反应对于终产品的质量和安全性尤为重要。 预处理后的滤液是生产过程中重要的中间产物,类似于化学反应中的中间体,有必要制订其质量控制标准,比如,一般情况下要澄清、有一定浓度、pH适中,需要说明的是,后续的提取工艺不同,对滤液的质量要求不同,如离子交换法提取目标物时对无机离子、澄清度等方面要求较严格,溶媒法提取时要求滤液蛋白含量较低。总之,经预处理后的滤液控制标准应根据其后的提取工艺综合确定。 2、目标物的提取是采用物理或化学手段从发酵液或菌丝体中得到目标物的浓缩液或粗制品。常用的提取方法有溶媒萃取法、离子交换法、吸附法以及沉淀法。具体采用何种提取方法需结合目标物化学结构特征、产品组份情况、拟采用的终产品精制工艺、终产品质量要求
赤藓糖醇应用
甜味剂赤藓糖醇在低能量或无糖饼干应用 甜味剂赤藓糖醇在低能量或无糖饼干应用 2006年6月30日 10:24来源:山东保龄宝生物技术有限公司应用技术中心作者:杨海军 据资料显示,2004年1~10月,我国饼干产量比去年同期增长16.4%,销售收入同比增加18.7%。饼干市场年增长率为10~15%,2005年中国饼干产量预计可达到170万吨,人均消耗为1公斤,而发达国家的人均消耗量为25公斤,由此可见我国的饼干市场还具有巨大的发展空间。 蔗糖、油脂是制作饼干的主要原料,对于形成饼干特有的组织结构、口感和风味具有相当重要的作用,是生产高品质饼干制品所不可缺少的原料。特别是糖在饼干的生产中,除了能增加甜味、上色、提高保藏性以外,对面团的流变学性质、工艺及产品品质带来很大的影响,糖的适量添加是保证正常的生产工艺及良好的产品品质十分重要的条件。在不添加糖的饼干的生产过程中,由于失去了糖的反水化作用,面粉的吸水率大幅度增加,面粉中的面筋性蛋白质的涨润度大幅度提高,面团的弹性增加,从而使得面团的调制时间延长,同时使辊压成的饼坯韧缩严重,烘烤后的产品表面起泡严重,口感僵硬。这种感官品质的产品很难被患有糖尿病、肥胖症及其他人群愉快的接受。 但是随着现代消费者消费水平的提高,对健康意识的增强,这种“高糖高油脂高热量”的产品已不能符合消费者的需要。饼干产业也向着营养、健康、功能性、低热量等方向发展,无糖饼干、低能早餐饼干以及添加维生素和纤维素的饼干就在这种趋势下应运而生。但是目前有些厂家只是考虑在低能量或无糖饼干中部分地减少油脂和糖的使用量,但是仅是减少油脂和糖的使用量是不够的,还应采用膳食纤维、糖醇、低聚糖、类脂肪等替代物,在减少产品能量、满足部分消费者消费需求的同时,尽可能地模拟出油脂和蔗糖的功能,提高产品的可接受性。 蔗糖的替代,目前主要是采取强力甜味剂与低甜度填充型甜味剂或填充剂相结合的方法。比如低聚糖、糖醇等。然而已有的清淡食品配料还存在许多不足之处:热值降低有限;其副作用限制了用量;溶解性差;口味异常;不耐贮存以及组织和填充性不佳等。近几年新研制开发的功能性食品配料--赤藓糖醇对弥补上述不足取得了一些成功。它不仅能从物理化学方面取代蔗糖而且还可以带来有利于健康的好处,而且使用赤藓糖醇的饼干产品与其同样使用蔗糖为原料的产品相比具有更好的结构紧密性。在饼干中使用的赤藓糖醇,最好是粒度精细(<200um)的结晶,细小的颗粒会给产品带来平滑、圆润的口感。 赤藓糖醇是一种天然的四碳糖醇,也是所有多元糖醇中唯一运用发酵法生产的。赤藓糖醇为白色光亮粉末或结晶,能溶于水,成为无色不黏稠的液体。它是一种独特的低热值填充剂,在现代保健食品中具有很大的应用潜力,它的特性使它特别适合一些需要高比例掺入粉状或结晶状物质的情况,这是其它低热值填充剂之所不及的。 赤藓糖醇具有许多区别于其它同类产品的无与伦比的优越特性,应用在饼干中为产品增加了许多卖点,具体如下:
赤藓糖醇发酵菌种选育及其功能研究进展_柴明艳
赤藓糖醇发酵菌种选育及其功能研究进展 柴明艳 (淄博职业学院,山东淄博255314) 摘 要:赤藓糖醇是一种新型“零”热值纯天然生物糖,属于多元醇类甜味剂,天然存在于多种真菌、果蔬和动物组织 中,具有高稳定性、低能量值、食用安全等优良特性。本文主要就赤藓糖醇发酵生产的菌种选育、合成途径、代谢特征及其生物学功能的研究成果作一概述,为其进一步开发应用提供科学参考。关键词:赤藓糖醇;发酵;生物合成;应用 Research Progress in Microbial Screening on the Fermentation Production and Functions of Erythritol CHAI Ming-yan (Pharmaceutical and Biological Engineering Department of Zibo Vocational Institute ,Zibo 255314,Shandong , China ) Abstract :Erythritol was a new kind of natural biological sugar with low caloric value ,and belongs to polyol sweetener.It was found naturally in a variety of fungi ,fruit ,vegetable and animal tissues with high stability ,low energy value ,food safety other fine features.In this article ,strain selection for fermentation and biological function ,synthesis route ,metabolism of erythritol are reviewed ,providing scientific references for the further development and application of erythritol. Key words :erythritol ;fermentation ;biosynthetic ;application 食品研究与开发 F ood Research And Development 2015年6月 第36卷第11期 DOI :10.3969/j.issn.1005-6521.2015.11.035 基金项目:山东省科技发展计划项目(2011GSF12108) 作者简介:柴明艳(1983—),女(汉),助教,硕士,主要从事生物发酵方面的教研工作。 赤藓糖醇(Erythritol ),又称赤兔草醇、原藻醇,呈白色结晶状粉末,是一种国际新型营养性功能甜味剂,广泛存在于果蔬、真菌及各类发酵食品中,并在人和动物的机体中多有分布[1]。赤藓糖醇具有无副作用、口感佳、防龋齿、对高血糖病人安全,对肠胃道无不良刺激,一般食品加工中无分解和褐变等多种优良特性[2],已被应用到多个行业领域,如医药、食品、化工、保健与化妆品等[3]。 现今,国际上已通用微生物发酵法大批量生产赤藓糖醇。然而,赤藓糖醇发酵生产的理想菌选育、消除终产物抑制现象、提高产率及其生物学功能的研究,仍然是发酵法生产赤藓糖醇工业化需要解决的主要难题。可见, 深入展开赤藓糖醇发酵法生产的技术研究,在世界范围内具有重要的理论价值与科学意义。为此,本文主要就赤藓糖醇发酵生产过程中菌种选育、合成途径及其生物学功能的文献报道作一概述, 以期为相关研究提供科学参考。1赤藓糖醇发酵生产的菌种选育 微生物学中,高产菌株选育的常用方法有自然筛选、 诱变育种与基因工程。自然筛选是获得赤藓糖醇产生菌的常用途径之一,主要是从泥土、蜂巢、蜂蜜、花粉或高糖食品中分离到。微生物诱变育种的常用方法有化学诱变、物理诱变、生物诱变与复合诱变等几种,有关以生物诱变方法获得赤藓糖醇产生菌的研究鲜有报道。基因工程育种主要是利用控制基因改造技术来完成,鉴于微生物中赤藓糖醇的合成途径及其关键酶等问题尚在研究中,故利用基因技术以获得赤藓糖醇高产菌株的研究更是鲜有报道。 与化学合成法相比,微生物发酵法生产赤藓糖醇过程温和而易控制,占有较大的工艺与成本优势,且生产效率非常高,已成为其工业生产的主要方法。为提高赤藓糖醇的产量,可通过发酵菌种选育和发酵工艺优化等方式加以实现。其中,优质菌株是赤藓糖醇发酵生产效率的关键,故需选育高产菌株,使得工艺 专题论述 141
国内赤藓糖醇产量分析及预测
国内赤藓糖醇生产企业生产状况 表5-12007年国内赤藓糖醇生产企业产量分析表 公司产能(吨/年)产量(吨/年)价格(元/吨)进出口包装备注 淄博中食歌瑞生物技术有限公司4500 1500左右36000 50%出口25kg/纸袋由于赤藓糖醇起于日本,现在日本含有赤藓糖醇的化妆品开始投放市场。赤藓糖醇未来有可能取代木糖醇。 山东保龄宝生物技术有限公司1000 800左右36000 有部分出口25kg/纸袋主要销往南方市场。该产品主要适用于保健品行业,糖果等行业。 青岛琅琊台集团股份有限公司800-900 700左右34000 70%出口25kg/纸袋该产品为公司的主导产品,公司的产品销往韩国等地。 分析: 1.目前国内赤藓糖醇生产企业很少,据调研了解,国内有三家,分别是淄博中食歌瑞生物技术有限公司、山东保龄宝生物技术有限公司、青岛琅琊台集团股份有限公司。 2.山东福田药业有限公司赤藓糖醇产品现在正处于研发中,尚未投产。 3.淄博中食歌瑞生物技术有限公司是由中国食品发酵工业研究院与山东中舜科技发展有限公司共同建立的,主导产业为生物工程,主要产品为赤藓糖醇。年产量在1500吨左右,公司的产品销往日本等国家。 4.山东保龄宝生物技术有限公司赤藓糖醇产量比较稳定,年生产在800吨左右,主要是销往南方市场,并有部分出口。 5.青岛琅琊台集团股份有限公司赤藓糖醇产品的年产量在700吨左右。公司该产品产量70%左右用于出口,主要是销往日本、韩国等地。 6.浙江海正药业股份有限公司是国内较早生产赤藓糖醇的企业,赤藓糖醇产品去年已停产。 国内赤藓糖醇生产企业所占市场份额 图5-1国内赤藓糖醇生产企业所占市场份额图 国内赤藓糖醇生产企业所占市场份额图 赤藓糖醇应用领域分析
总糖含量的测定
实验二总糖含量的测定 一、目的: 1.掌握蒽酮法测定可溶性糖含量的原理和方法。 2.学习植物可溶性糖的一种提取方法。 二、原理: 糖类在较高温度下可被浓硫酸作用而脱水生成糠醛或羟甲基糖醛后,与蒽酮 (C 14H 10 O)脱水缩合,形成糠醛的衍生物,呈蓝绿色。该物质在620 nm处有最大吸 收,在150 μg/ml范围内,其颜色的深浅与可溶性糖含量成正比。 这一方法有很高的灵敏度,糖含量在30 μg左右就能进行测定,所以可做为微量测糖之用。一般样品少的情况下,采用这一方法比较合适。 三、仪器、试剂和材料 1.仪器:电热恒温水浴锅,分光光度计,电子天平,容量瓶,刻度吸管等 2.试剂: (1)葡萄糖标准液:l00 μg/ml (2)浓硫酸 (3)蒽酮试剂:0.2 g蒽酮溶于100 ml浓 H 2SO 4 中。当日配制使用。 3.材料:淀粉 四、操作步骤 1.葡萄糖标准曲线的制作 取7支试管,按下表数据配制一系列不同浓度的葡萄糖溶液: 管号 1 2 3 4 5 6 7 葡萄糖标准液(ml)0 0.1 0.2 0.3 0.4 0.6 0.8 蒸馏水(ml) 1 0.9 0.8 0.7 0.6 0.4 0.2 葡萄糖含量(μg)0 10 20 30 40 60 80 在每支试管中立即加入蒽酮试剂4.0m1,迅速浸于冰水浴中冷却,各管加完后一起浸于沸水浴中,管口加盖,以防蒸发。自水浴重新煮沸起,准确煮沸l0 min 取出,用冰浴冷却至室温,在620 nm波长下以第一管为空白,迅速测其余各管 吸光值。以标准葡萄糖含量(μg)为横坐标,以吸光值为纵坐标,作出标准曲线。
2.植物样品中总糖的提取: 精确称取0.5g,置于50 ml三角瓶中,加水15 m1,盐酸10ml,沸水浴20min,定容至100ml,得提取液。取10ml滤液定容至100ml 3.测定 吸取1 ml已稀释的提取液于试管中,加入4.O ml蒽酮试剂,平行三份;空 平均值在标白管以等量蒸馏水取代提取液。以下操作同标准曲线制作。根据A 620 准曲线上查出葡萄糖的含量(μg)。 五、结果处理 C ×V总× D 样品含糖量(%)= ─────────────×100 W ×V测×106 其中:C——在标准曲线上查出的糖含量(μg), V总——提取液总体积(ml), V测——测定时取用体积(ml), D——稀释倍数, W——样品重量(g), 106——样品重量单位由g换算成μg的倍数 六、注意事项: 该法的特点是几乎可测定所有的碳水化合物,不但可测定戊糖与已糖,且可测所有寡糖类和多糖类,包括淀粉、纤维素等(因为反应液中的浓硫酸可把多糖水解成单糖而发生反应),所以用蒽酮法测出的碳水化合物含量,实际上是溶液中全部可溶性碳水化合物总量。在没有必要细致划分各种碳水化合物的情况下,用蒽酮法可以一次测出总量,省去许多麻烦,因此,有特殊的应用价值,但在测定水溶性碳水化合物时,则应注意切勿将样品的未溶解残渣加入反应液中,否则会因为细胞壁中的纤维素、半纤维素等与蒽酮试剂发生反应而增加了测定误差。此外,不同的糖类与蒽酮试剂的显色深度不同,果糖显色最深,葡萄糖次之,半乳糖、甘露糖较浅,五碳糖显色更浅,故测定糖的混合物时,常因不同糖类的比例不同造成误差,但测定单一糖类时则可避免此种误差。 七、思考题: 1.在从山芋粉中提取总糖时,加入盐酸的目的是什么? 2.简述蒽酮比色法测定植物组织中总糖含量的原理。
