ArcGis10.0山顶点提取实验报告
山顶点提取
一、实验数据:在Ex5文件下
·DEM:研究地区DEM数据。
·Result文件夹存放结果数据,包括:
·contour15.shp:15m等高距的等高线图;
·contour75.shp:75m等高距的等高线图;
·hillshade:地形光照晕渲图;
·back:地形背景掩膜;
·Peak.shp:山顶点分布图;
·Peakpoint.mxd:山顶点分布地图文档。
二、实验要求:
1.应用栅格数据空间分析模块中的等高线提取功能,分别提取等高距为15 米和75 米的等高线图,并按标准地形
图绘制等高线方法绘制等高线,作为山顶点提取的地形背景
2.通过邻域分析和栅格计算器提取山顶点
三、实验操作步骤:
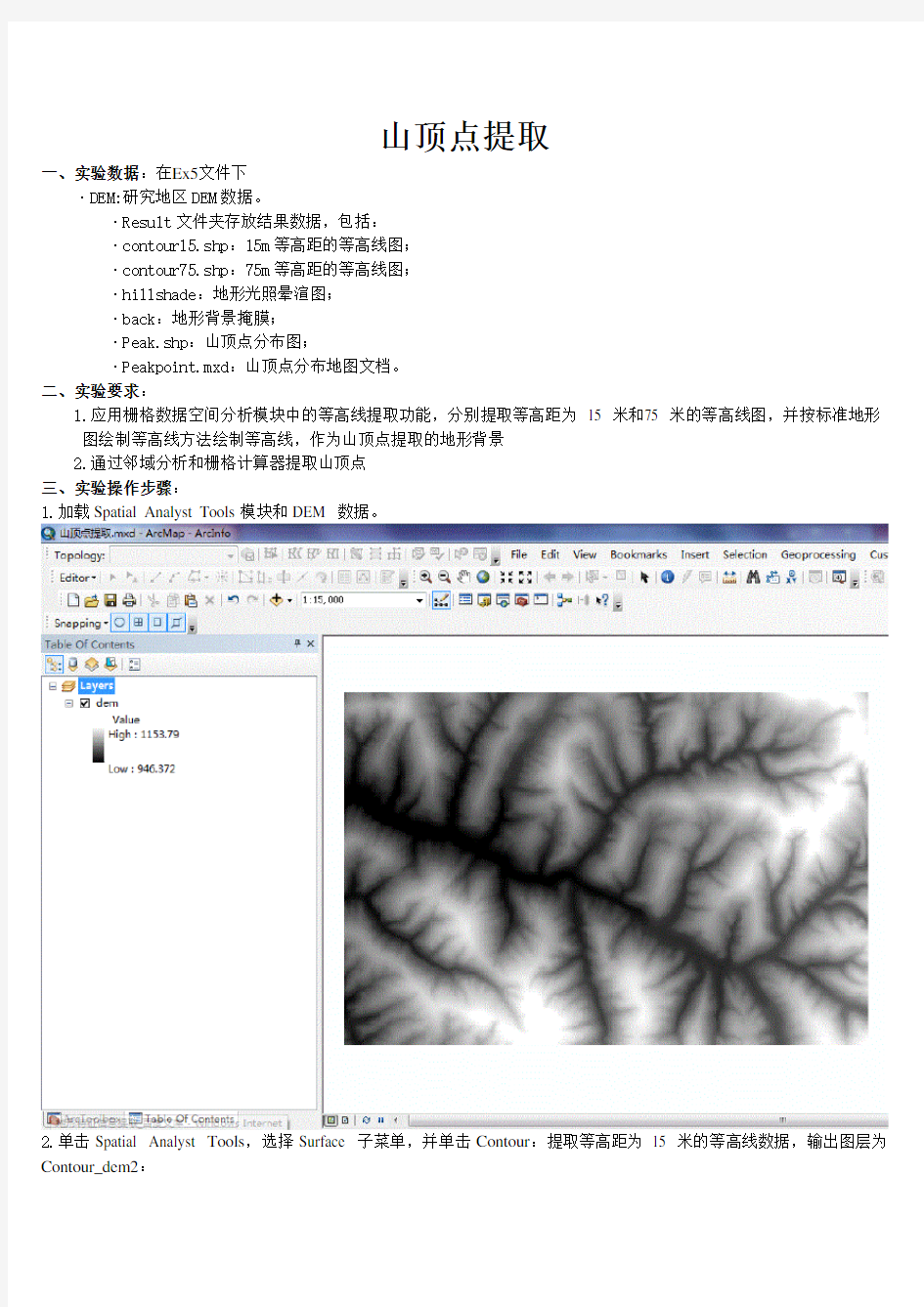
1.加载Spatial Analyst Tools模块和DEM 数据。
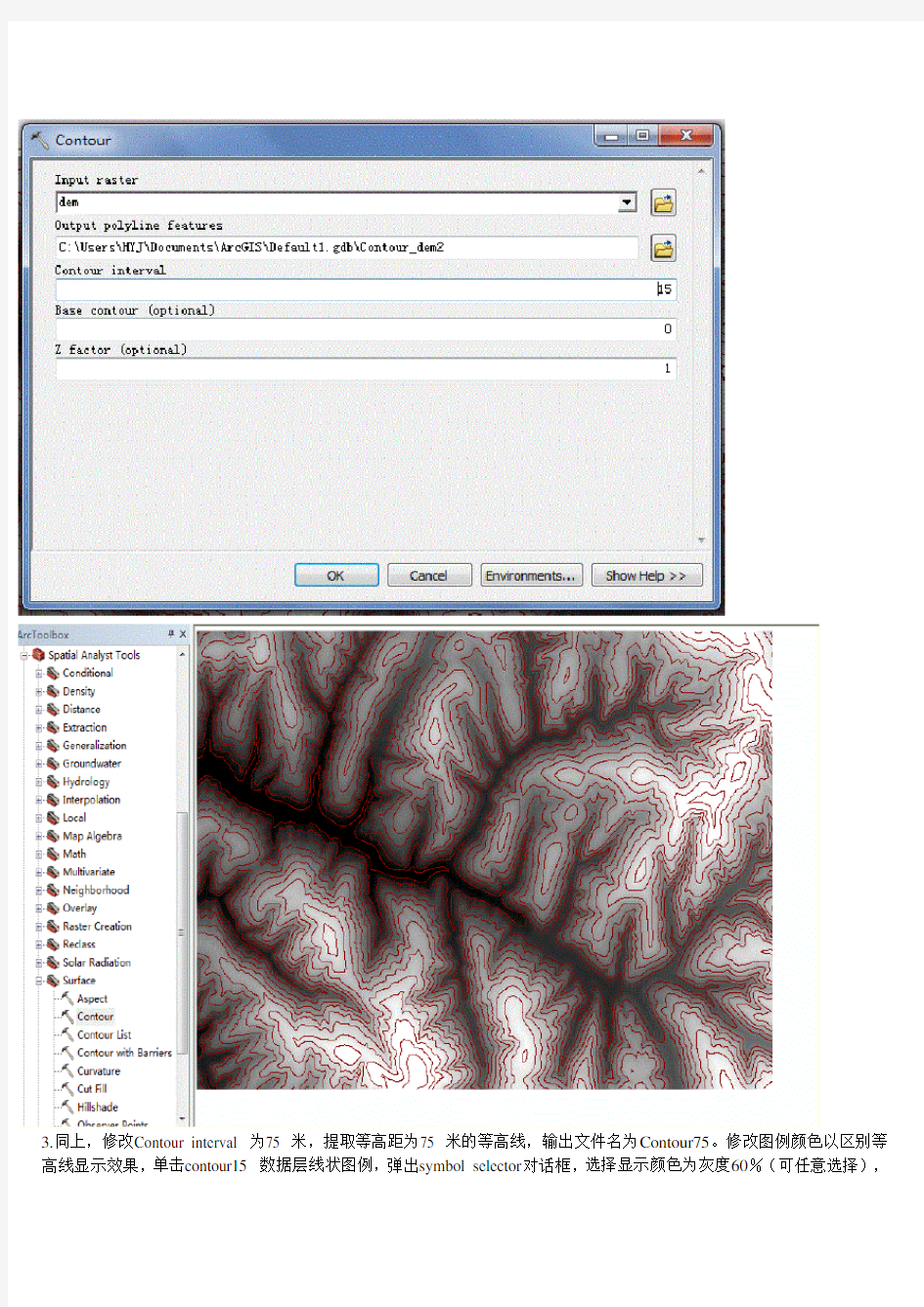
2.单击Spatial Analyst Tools,选择Surface 子菜单,并单击Contour:提取等高距为15 米的等高线数据,输出图层为Contour_dem2:
3.同上,修改Contour interval 为75 米,提取等高距为75 米的等高线,输出文件名为Contour75。修改图例颜色以区别等高线显示效果,单击contour15 数据层线状图例,弹出symbol selector对话框,选择显示颜色为灰度60%(可任意选择),
并点击ok。
4.选择Spatial Analyst Tools下的Surface 子菜单并单击Hillshade,设置输出文件名为Hillshade,其他参数取默认值,提取该地区光照晕渲图,作为等高线三维背景。
5.单击Spatial Analyst Tools下的Map Algebra,选择Raster Calculator,输入计算公式:Back = [DEM]>=0,单击ok。提取有效数据区域,作为等高线三维背景掩膜。
双击back 数据层,在弹出的属性对话框的Display 属性页设置透明度为60%,在symbology属性框中设置其显示颜色为Gray50%,单击
ok
6.按contour75、山顶点提取、rastercalc1、Hillshade 次序放置数据层,生成三维立体等高线图,如下:
7.单击Spatial Analyst Tools,选择Neighborhood中Block Statistics,设置参数如下,单击ok,提取11×11 分析窗口最大值。
8.单击Spatial Analyst Tools下的Map Algebra,选择Raster Calculator,输入计算公式:SD = ([Max] -[DEM])==0,提
取山顶点区域。
9.选择DC 数据层,单击Spatial Analyst Tools,选择Reclass中的Reclassify,设置如下:
何类型选择point,则可输出矢量山顶点数据peak。
符号化显示如下:
叶绿素的提取和分离实验报告
陕西师范大学远程教育学院生物学实验报告 报告题目叶绿素的提取和分离 姓名刘伟 学号 专业生物科学 批次/层次 指导教师 学习中心
叶绿素的提取和分离 一、实验目的 1. 学习叶绿体色素的提取、分离方法。 2. 通过叶绿体色素提取、分离方法的学习了解叶绿体色素的相关理化性质。 3. 为进一步研究各叶绿体色素性质、功能等奠定基础。 二、原理 叶绿体中含有绿色素(包括叶绿素a和叶绿素b)和黄色素(包括胡萝卜素和叶黄素)两大类。它们与类囊体膜蛋白相结合成为色素蛋白复合体。它们的化学结构不同,所以它们的物化性质(如极性、吸收光谱)和在光合作用中的地位和作用也不一样。这两类色素是酯类化合物,都不溶于水,而溶于有机溶剂,故可用乙醇、丙醇等有机溶剂提取。提取液可用色谱分析的原理加以分离。因吸附剂对不同物质的吸附力不同,当用适当的溶剂推动时,混合物中各种成分在两相(固定相和流动相)间具有不同的分配系数,所以移动速度不同,经过一定时间后,可将各种色素分开。 三、材料、仪器设备和试剂 1. 绿色植物如菠菜等的叶片。 2. 研钵、漏斗、三角瓶、剪刀、滴管、康维皿、圆形滤纸(直径11cm)。 3. 试剂:95%乙醇,石英砂,碳酸钙粉,推动剂:按石油醚:丙酮:苯=10:2:1比例配制(v/v) 四、试验步骤 1. 叶绿体色素的提取 (1)取菠菜或其他植物新鲜叶片4-5片(4g左右),洗净,擦干,去掉中脉剪碎,放入研钵中。 (2)研钵中加入少量石英砂及碳酸钙粉,加2-3ml 95%乙醇,研磨至糊状,再加10ml 95%乙醇,然后以漏斗过滤之,残渣用10ml 95%乙醇冲洗,一同过滤于三角瓶中。 2. 叶绿体色素的分离 (1)将11cm的滤纸的一端剪去二侧,中间留一长约1.5cm、宽约0.5cm窄条。 (2)用毛细管取叶绿体色素浓溶液点于窄条上端,用电吹风吹干,如一次点样量不足可反复在色点处点样数次,使色点上有较多的叶绿体色素。 (3)在大试管中加入四氯化碳3-5ml及少许无水硫酸钠。然后将滤纸条固定于软木塞上,插入试管内,使窄端浸入溶剂中,而色点略高于液面,滤纸条边缘不可碰到试管壁,软木塞盖紧,直立于阴暗处层析。 0.5-1小时后,观察色素带分布:最上端橙黄色(胡萝卜素),其次黄色(叶黄素),再崐次 蓝绿素(叶绿素a),最后是黄绿色(叶绿素b)。(4)当展层剂前沿接近滤纸边缘时便可结束实 验,此时可看到不同色素的同心圆环,各色素由内往外的顺序为:叶绿素b(黄绿色)、叶 绿素a(蓝绿色)、叶黄素(鲜黄色)、胡萝卜素(橙黄色),再用铅笔标出各种色素的位置 和名称。
山脊线山谷线提取实验报告
山脊线山谷线提取实验报告 实验内容描述: 山脊线和山谷线构成了地形起伏变化的分界线(骨架线),因此它对于地形地貌研究具有重要意义;另一方面,对于水文物理过程研究而言,由于山脊、山谷分别代表示分水性与汇水性,山脊线和山谷线的提取实质上也是分水线与汇水线的提取。 本次实验通过某区域栅格DEM掌握山脊线和山谷线这两个基本地形特征信息的理论及其基于DEM的提取方法与原理;同时,熟练掌握利用ArcGIS软件对这两个地形特征信息的提取方法。 实验原理: 1.本实验基于规则格网DEM数据使用平面曲率与坡形组合法提取山脊线和山谷线,首先利用DEM数据提取地面的平面曲率及地面的正负地形,取正地形上平面曲率的大值即为山脊,负地形上平面曲率的大值为山谷。实际应用中,由于平面曲率的提取比较繁琐,而坡向变率(SOA)在一定程度上可以很好地表征平面曲率。因此,提取过程中可以SOA代替平面曲率。 2.主要用到以下理论知识: 1)坡向变率:是指在提取坡向基础上,提取坡向的变化率,亦即坡向之坡度(Slope of Aspect,SOA)。它可以很好地反应等高线弯曲程度; 2)反地形DEM数据:求取原始DEM数据层的最大高程值,记为H,通过公式(H-DEM),得到与原来地形相反的DEM数据层,即反地形DEM数据; 3)地面坡向变率SOA:地面坡向变率在所提取的地表坡向矩阵的基础上沿袭坡度的求算原理,提取地表局部微小范围内坡向的最大变化情况。但是SOA在提取过程中在北面坡将会有误差产生,所以要将北坡坡向的坡向变率误差进行纠正,其公式为: SOA=(( [SOA1]+[ SOA2] )-Abs( [SOA1]-[ SOA2] ))/2 其中:SOA1为原始DEM数据层坡向变率,SOA2为反地形DEM数据层坡向变率。 4)焦点统计 5)ArcScan自动矢量化 流程图
果胶提取实验报告1
桔皮中果胶提取技术的试验分析 【摘要】酸浸提法提取果胶具有快速、简便、易于控制、提取率较高等特点,用盐酸浸提、乙醇沉淀法进行了从桔皮中提取果胶的工艺试验。用单因素试验进行工艺参数的优化,其适合的工艺条件是:液料质量比为20;浸提液pH值为2;浸提温度为90℃。 关键词:桔皮果胶提取工艺工艺参 引言:果胶是一种亲水性植物胶,属于多糖类物质,广泛存在于高等植物的根、茎、叶、果的细胞壁中。通常人们所说的果胶系指原果胶、果胶和果胶酸的总称,是一种高分子聚合物,分子量介于20 000-400 000之间。其基本结构是D一吡喃半乳糖醛酸,以1,4甙链连接成的长链,其中部分半乳糖醛酸被甲醇酯化 [1]。 胶凝剂、增稠剂、稳定剂和乳化剂,随着功能性多糖的开发研究,果胶作为水溶性膳食纤维,越来越受到重视。应用必定会越来越广泛[2-4]。我国是柑桔的主要产地,柑桔皮中果胶含量可达10%~30%。从桔皮中提取果胶不仅有极大的工业价值,而且对综合开发、利用柑桔资源,提高原材料利用率,减少环境污染,有重要的实际意义[2,4,6]。果胶的提取一般有酸提取法、离子交换法、微生物法和微波加热处理法等方法[5-9],由于酸提取法具有快速、简便且提取率高的优点,国内外大多采用此法。果胶分离沉淀主要有乙醇沉淀法和盐析法。国内主要采用乙醇沉淀法,而国外多用盐析法或不经沉淀直接喷雾干燥。针对我国情况而言,对乙醇沉淀法已有大量研究,而本实验也是在总结
别人成果的基础上进行对比以及提取工艺条件的优化。 1材料与方法 1.1 材料 桔皮采用成熟新鲜、无病虫果害的晚熟蜜桔,人工取皮,在40℃下干燥,粉碎至1~3 mm,待用。 盐酸、乙醇、氢氧化钠、无水氯化钙、冰醋酸和甲基红,均为化学纯。1.2 果胶提取方法 果胶提取工艺为:原料→洗涤→失活→干燥→粉碎→酸提取→过滤→浓缩→冷却→乙醇沉淀→离心分离→干燥→称量→粉碎→果胶。 剔除腐烂变质、发黑的桔皮,用清水洗净后,放入烧杯中,加水,加热至90 ℃保温5~10 min,使酶失活,捞出桔皮,将桔皮在40 ℃下干燥,切碎。将20 g原料加入用HC1预先配制的、具有一定pH值和温度的酸溶液中,维持所需的温度达到一定的提取时间,并不断搅拌。趁热用布氏漏斗过滤得果胶提取液。将滤液用旋转蒸发仪在60-70 ℃下浓缩至原体积的1/3时为止。果胶浸提液冷却至常温后加入1倍体积的95 乙醇,搅拌、静置2 h,使果胶沉淀析出。用布氏漏斗过滤得粗果胶。在60-70 ℃干燥,粉碎即得果胶粉。随后进行提取物中果胶含量的测定和提取率的计算。 1.3 试验方法 单因素试验,分别研究不同液料质量比对果胶提取率的影响(浸 提液pH值3、温度80℃、浸提时间45 min);不同浸提液pH值对果胶提取率的影响(浸提液温度80℃、液料质量比10、浸提时间45 min);不
普通高中叶绿素提取和分离实验
植物叶绿体中色素的提取与分离实验报告 用具:剪刀一把、干燥的定性滤纸、50ml的烧杯及100ml的烧杯各3个、白纸3张、试管架一个、研钵一个、玻璃漏斗一个、尼龙布或纱布、毛细血管一只、药勺一个、10ml 量筒一只,天平一只,试管3支、纸板一块、棉塞3个、培养皿3个、刻度尺、注射器一只、盖玻片 试剂:丙酮、无水乙醇、层吸液(20份石油醚、2份丙酮、1份苯配置而成)、白沙(二氧化硅)、碳酸钙、碳酸钠 材料:新鲜的紫茎泽兰叶、其他野生植物叶片 背景资料: 1、叶绿素等是脂溶性的有机分子,根据相似相溶的原理,叶绿素等色素分子溶于有机溶剂而不溶于有极性的水。故在研磨和收集叶绿色素时要用丙酮或乙醇等有机溶剂而不用水。 2、叶绿素分布于基粒的片层薄膜上,加入少许二氧化硅是为了磨碎细胞壁、质膜、叶绿体被膜和光合片成,使色素溶解于丙酮中。 3、破碎的细胞中含有草酸等有机酸,叶绿素分子中含有的Mg元素处于不稳定化合太,镁离子与有机酸结合将导致色素分子破坏。加入少许碳酸钙使得钙离子与有机酸结合,减少镁离子的转移,防止研磨时叶绿体色素的破坏。所以在研磨时加入适量的碳酸钙,同时加入碳酸钠的道理亦如此。 4、在过滤时选用脱脂棉或纱布,而不用滤纸。原因主要有下:(1)色素分子比较大,不容易透过滤纸;(2)滤纸有较强的吸附性而使色素吸附在滤纸上,从而降低色素浓度,影响实验效果;(3)叶绿素是脂溶性,根据相似相容的原理,脱脂棉可以减少实验过程中色素的流失,增强实验效果。 5、根据物理学中的毛细现象,画滤纸细线前滤纸必须经过干燥处理,是为了阻止水分子堵塞滤纸中的毛细管而影响层析液的扩散。但如果用火烤的话,会使滤纸纤维变形同时破坏啦毛细管,而影响层析液的扩散。 6、由于液面的不同位置表面张力不同,纸条接近液面时,其边缘的表面的张力较大,层析液沿滤纸边缘扩散过快,而导致色素带分离不整齐的现象。故而,在插入层析液的滤纸条一端剪去两个角。 7、为了防止滤纸条倒入层析液中而使层析实验失败。同时,防止因液体表面张力引起层析液沿滤纸条向上的“壁流”而导致色素溶解。 8、色素分离的原理:纸层析是用滤纸作为载体的一种色层分析法,其原理主要是利用混合物中各组分在;流动相和固定相的分配比(溶解度)的不同而使之分离。滤纸上吸附的水为固定相(滤纸纤维常能吸20%左右的水),有机溶剂如乙醇等为流动相,色素提取液为层析试样。把试样点在滤纸的滤液细线位置上,当流动相溶剂在滤纸的毛细管的作用下,连续不断地沿着滤纸前进通过滤液细线时,试样中各组份便随着流动相溶剂向前移动,并在流动相和固定相溶剂之间连续一次有一次的分配。结果分配比比较大的物质移动速度较快,移动距离较远;分配比较小的物质移动较慢,移动距离较近,试样中各组分分别聚集在滤纸的不同的位置上,从而达到分离的目的。符合我国的资源友好型社会。 操作步骤 1.称取新鲜叶子2g,放入研钵中加丙酮5ml,少许碳酸钙(防止叶绿素被破坏)和石英砂(帮助研磨),研磨成匀浆,再加丙酮5ml,然后以漏斗过滤之,即为色素提取液。
DNA提取及PCR扩增实验报告.doc
PCR扩增及DNA琼脂糖凝胶电泳 刘琳1131428 环境科学 一、实验目的 1.学习并掌握PCR扩增的基本原理与实验技术。 2.对扩增后的DNA进行琼脂糖凝胶电泳试验,并分析相应结果。 二、实验原理 1. PCR扩增 多聚酶链反应(PCR)技术的原理类似于DNA的天然复制过程。在微量离心管中加入适量缓冲液,加入微量模板DNA、四种脱氧核苷酸(dNTP)、耐热T aq聚合酶及两个合成DNA的引物,而后加热使模板DNA在高温下(94℃)变性,双链解链,这是所谓变性阶段。降低溶液温度,使合成引物在低温(55℃)与模板DNA互补退火形成部分双链,这是所谓退火阶段。溶液反应温度升至中温(72℃),在Tap酶作用下,用四种dNTP为原料,引物为复制起点,模板DNA的一条双链在解链和退火之后延伸为两条双链,这是延伸阶段。如此反复,在同一反应体系中可重复高温变性、低温退火和DNA合成这一循环,使产物DNA重复合成,并在重复过程中,前一循环的产物DNA可作为后一循环的模板DNA而参与DNA的合成,使产物DNA的量按指数方式扩增。经过30~40个循环,DNA扩增即可完成。 2. DNA琼脂糖凝胶电泳实验 DNA分子在高于其等电点的溶液中带负电,在电场中向阳极移动。在一定的电场强度下,DNA分子的迁移速度取决于分子筛效应,即分子本身的大小和构型是主要的影响因素。DNA分子的迁移速度与其相对分子量成反比。不同构型的DNA分子的迁移速度不同。该电泳方法以琼脂凝胶作为支持物,利用DNA分子在泳动时的电荷效应和分子筛效应,达到分离混合物的目的。 三、实验材料 仪器:PCR扩增仪、0.2ul薄壁管、1.5ml离心管、移液枪、枪头、微波炉、电泳仪、水平电泳槽、制胶版、紫外透射仪。 试剂:TapDNA聚合酶、dNTP、buffer、两种引物、16S全长DNA样本、无菌ddH2O、模板DNA 、TBE、琼脂糖、EB、显色剂。 四、实验步骤 1. PCR扩增 本次试验选择细菌16S rDNA V3区片段进行扩增。 1.1 根据计算,首先取1.5ml离心管按照 2.5ul 10×Buffer 、1 ul dNTP、0.5 ul 341GC、 0.5 ul 534、0.125 ul Taq、19.375u ddH2O的比例配置足量的PCR反应体系。 1.2 分别向9个薄壁管中分别加入24 ul的反应体系,并分别添加8种不同的模版,并于第9个薄壁管中加入无菌ddH2O作为阴性对照。 1.3 将薄壁管放入PCR扩增仪中,按照预定程序进行PCR扩增。其中循环过程需要达到30~40次。程序如下: 预变性:94℃3min 循环:94℃变性30s 55℃退火30s 72℃延伸30s 末次延伸:72℃5min
叶绿素a测定实验报告
叶绿素a测定实验报告 (一)实验目的及意义 水体富营养化可以通过跟踪监测水中叶绿素的含量来实现,其中叶绿素a是所有叶绿素中含量最高的,因此叶绿素a的测定能示踪水体的富营养化程度。 (二)水样的采集与保存 1.确定具体采样点的位置 2.在采样点将采样瓶及瓶盖用待测水体的水冲洗3-5遍 3.将采样瓶下放到距水面0.5-1m处采集水样2.5L 4.在采样瓶中加保存试剂,每升水样中加1%碳酸镁悬浊液1mL 5.将采样瓶拧上并编号 6.用GPS同步定位采样点的位置 (三)仪器及试剂 仪器: 1.分光光度计 2.比色池:10mm 3.过滤装置:过滤器、微孔滤膜(孔径0.45μm,直径60mm) 4.研钵 5.常用实验设备 试剂: 1.碳酸镁悬浮液:1%。称取1.0g细粉末碳酸镁悬浮于100mL蒸馏水中。每次使用时要充分摇匀 2.乙醇溶液 (四)实验原理 将一定量的试样用微孔滤膜过滤,叶绿素会留在滤膜上,可用乙醇溶液提取。 将提取液离心分离后,测定750、663、645、630mm的吸光度,计算叶绿素的浓度。 (五)实验步骤 1.浓缩:在一定量的试样中添加0.2mL碳酸镁悬浮液,充分搅匀后,用直径60mm 的微孔滤膜吸滤.过滤器内无水分后,还要继续抽吸几分钟.如果要延时提取,可把载有浓缩样品的滤膜放在干燥器里冷冻避光贮存。 2. 提取:将载有浓缩样品的滤膜放入研钵中,加入7mL乙醇溶液至滤纸浸湿的程度,把滤膜研碎,再少量地加乙醇溶液,把滤膜完全研碎,然后用乙醇溶液将已磨碎的滤膜和乙醇溶液洗入带刻度的带塞离心管中,使离心管内提取液的总体积不超过10mL,盖上管塞,置于的暗处浸泡24h。 3.离心:将离心管放入离心机中,以4000r/min速度离心分离20min。将上清液移入标定过的10mL具塞刻度管中,加少量乙醇于原提取液的离心管中,再次悬浮沉淀物并离心,合并上清液。此操作重复2-3次,直至沉淀不含色素为止,最后将上清液定容至10mL。 4.测定:取上清液于10mm的比色池中,以乙醇溶液为对照溶液,读取波长750,663,645和630mm的吸光度。
实验报告氯化钠的提纯实验报告范文_0708
2020 实验报告氯化钠的提纯实验报告 范文_0708 EDUCATION WORD
实验报告氯化钠的提纯实验报告范文_0708 前言语料:温馨提醒,教育,就是实现上述社会功能的最重要的一个独立出来的过程。其目的,就是把之前无数个人有价值的观察、体验、思考中的精华,以浓缩、系统化、易于理解记忆掌握的方式,传递给当下的无数个人,让个人从中获益,丰富自己的人生体验,也支撑整个社会的运作和发展。 本文内容如下:【下载该文档后使用Word打开】 2-2+2+2-2-2+2+2-3+2+2+2- 1.准备实验仪器 2.洗涤 先用洗衣粉水刷洗,再用自来水冲洗,最后用蒸馏水冲洗。 3.称量粗盐 调零,在左、右盘中各放等质量的称量纸,取粗盐称得10.0g。 4.溶解粗盐 将粗盐转入烧杯,加入5ml蒸馏水,用玻璃棒搅拌,放在三脚架上加热溶解。 5.过滤 将滤纸折成圆锥状,置于漏斗中,用蒸馏水润湿,用玻璃棒将气泡赶出。
6.加入BaCl2溶液 待滤液液沸腾,边加边搅拌。 7.静置 继续加BaCl2溶液,直至溶液不再变浑浊。 8.加入NaOH―Na2CO3 待滤液液沸腾,边加边搅拌,用PH试纸检验,直到其值为4 9.过滤 10.纯度检验 称 1.0g粗盐,溶解,取一定量于两小试管中,一支加入NaOH、镁试剂,无天兰色沉淀;另一支加入CH3COOH、(NH4)2C2O4,出现白色沉淀。取过滤好的溶液,同样操作,一支无天兰色沉淀,另一支无沉淀。 11.蒸发、结晶 加热蒸发滤液,不断搅拌至稠状,趁热抽干转入蒸发皿蒸干。 12.称量 冷至室温,称得8.6g. 13.计算产率 产率=(8.6/10)100%=86%. 1.向第一次过滤后的滤液加入BaCl2时,溶液变浑浊(Ba2++SO42-=BaSO4); 2.向第二次过滤后的滤液加入NaOH―Na2CO3溶液时,溶液变浑浊; 3.蒸发结晶时,发出“噗噗”的响声。
氯化钠的提纯实验报告
氯化钠的提纯实验报告 一、实验题目:粗盐制备分析纯氯化钠 二、实验目的: 1.巩固减压过滤,蒸发、浓缩等基本操作; 2.了解沉淀溶解平衡原理的应用; 3.学习在分离提纯物质过程中,定性检验Ca、Mg、SO4等离子是否除尽。 三、实验原理:粗盐中,除含一些不溶性杂志,还含有Ca、Mg、SO4和Fe等可溶性 2+2+2-3+杂质,不溶性杂质可用过滤法出去,可溶性杂质中Ca、Mg、SO4和Fe通过过滤的方 法除去,然后蒸发水分得到较纯净的精盐。 1.BaCl2—NaOH,Na2CO3法 (1)除SO4,加入BaCl2溶液 Ba+SO4=BaSO4 (2)除Ca2+、Mg2+、和Fe3+和过量的Ba2+,加入NaOH —Na2CO3 Ca2++CO32-=CaCO3 Ba2++CO32-=BaCO3 4Mg2++4CO32-+H2O=Mg(OH)2·3MgCO3 (3)除CO32-,加入HCl溶液 CO3+2H=H2O+CO2↑ 四、实验仪器与药品
仪器:托盘天平、药匙、量筒、烧杯、玻璃棒、三脚架、酒精灯、石棉网、火柴、滤纸、漏斗、蒸发皿、坩埚钳、表面皿、PH试纸、抽滤机、铁架台(带铁圈)、小试管、胶头滴管。药品:粗盐、蒸馏水、镁试剂、BaCl2、(NH4)2C2O4、NaOH、HCl、CH3COOH、五、实验装置 2-2+2+2- 2-2+2+2-3+2+2+2- 六、实验步骤 1.准备实验仪器 2.洗涤 先用洗衣粉水刷洗,再用自来水冲洗,最后用蒸馏水冲洗。 3.称量粗盐 调零,在左、右盘中各放等质量的称量纸,取粗盐称得10.0g。 4.溶解粗盐 将粗盐转入烧杯,加入5ml蒸馏水,用玻璃棒搅拌,放在三脚架上加热溶解。 5.过滤 将滤纸折成圆锥状,置于漏斗中,用蒸馏水润湿,用玻璃棒将气泡赶出。 6.加入BaCl2 溶液 待滤液液沸腾,边加边搅拌。 7.静置 继续加BaCl2溶液,直至溶液不再变浑浊。 8.加入NaOH—Na2CO3
叶绿素提取实验
实验二、叶绿体色素的提取、分离与性质分析 一、实验目的 ?掌握叶绿体色素的提取方法;掌握板层析法分离叶绿体色素的原理和步骤;掌握叶绿体色素的部分理化性质。 二、实验原理 (一)叶绿体色素: 1.叶绿素 叶绿素a:叶绿素b=3:1 2.类胡萝卜素 胡萝卜素:叶黄素=2:1 叶绿素:类胡萝卜素=3:1 (二)叶绿素的光学性质 叶绿素a在663nm有吸收峰;叶绿素b 在645nm有吸收峰。但在蓝光区也有一个吸收峰。 胡萝卜素和叶黄素的吸收峰是在蓝光区(440nm)。 三、叶绿素含量测定: 1.取新鲜叶片,擦净组织表面污物,剪碎(去掉中脉)混匀。 2.称取剪碎的新鲜样品1.0g ,放入研钵中,加少量石英砂及2-3ml (或80%丙酮)研成匀浆,继续研磨至组织变白,静置3-5分。 3.取滤纸1张,置漏斗中,用80%丙酮湿润,沿玻棒把提取液倒人漏斗中,过滤到25ml。 4.用滴管吸取80%丙酮,将滤纸上的叶绿体色素全部洗入容量瓶中。 直至滤纸和残渣中无绿色为止。最后用80%丙酮定容至25ml,摇匀。 5.把叶绿体色素提取液倒入比色杯内。以80%丙酮为空白,在波长663nm、645nm下测定吸光度。 6 计算:按下列公式: Ca(mg/L)=12.7OD663-2.69 OD645 Cb (mg/L) =22.9OD645-4.68 OD663 C总(mg/L) = Ca+ Cb分别计算叶绿素a、b的浓度。 四、光合色素鉴定(板层析) ?支持物:硅胶层析板 ?流动相:石油醚:丙酮:(v:v=65:35) ?步骤:1、取板划线 2、点样 3、配展开剂 4、展开 5、前沿到达2/3处时停止,取出凉干并观察各色素带计算Rf值 叶绿素a:蓝绿色;叶绿素b:黄绿色;胡萝卜素:桔黄色 叶黄素:黄色 六:叶绿素前驱物的荧光观察 七、作业 1、计算你的实验中植物叶片中叶绿素的含量。 2.研磨提取叶绿素时,为何要加入CaCO3? 3.画图说明叶绿体色素板层析结果,并解释原因。
颗粒自由沉淀实验报告
建筑与测绘工程学院 《水处理实验设计与技术》 实验报告
实验1 颗粒自由沉淀实验 颗粒自由沉淀实验是研究浓度较低时的单颗粒的沉淀规律。一般是通过沉淀柱静沉实验,获取颗粒沉淀曲线。它不仅具有理论指导意义,而且也是给水排水处理工程中沉砂池设计的重要依据。 一、实验目的 加深对自由沉淀特点、基本概念及沉淀规律的理解。 掌握颗粒自由沉淀实验的方法,并能对实验数据进行分析、整理、计算和绘制颗粒自由沉淀曲线。 二、实验原理 浓度较低的、粒状颗粒的沉淀属于自由沉淀,其特点是静沉过程中颗粒互不干扰、等速下沉,其沉速在层流区符合Stokes (斯托克斯)公式。 但是由于水中颗粒的复杂性,颗粒粒径、颗粒相对密度很难或无法准确地测定,因而沉淀效果、特性无法通过公式求得而是通过静沉实验确定。 由于自由沉淀时颗粒是等速下沉,下沉速度与沉淀高度无关,因而自由沉淀可在一般沉淀柱内进行,但其直径应足够大,一般应使内径D ≥100mm 以免颗粒沉淀受柱壁干扰。 具有大小不同颗粒的悬浮物静沉总去除率η与截留沉速u 0剩余颗粒重量百分率P 的关系如下: ()dP P u u P s ?+-=00 001η ( 1 ) 此种计算方法也称为悬浮物去除率的累积曲线计算法。 设在一水深为H 的沉淀柱内进行自由沉淀实验,如图1所示。实验开始,沉淀时间为0,此时沉淀柱内悬浮物分布是均匀的,即每个断面上颗粒的数量与粒径组成相同,悬浮物浓度为C 0(mg/L ),此时去除率η=0。 实验开始后,不同沉淀时间t i ,颗粒最小沉淀速度u i 相应为: i i t H u = ( 2 ) 此即为t i 时间内从水面下沉到池底(此处为取样点)的最小颗粒d i 所具有的沉速。此时取样点处水样悬浮物浓度为C i ,而: 00 0011η=-=-=-i i i P C C C C C ( 3 ) 此时去除率η0,表示u ≥u i (d ≥d i )的颗粒除去率,而:
叶绿体色素的提取分离理化性质和叶绿素含量的测定
实验报告 植物生理学及实验(甲)实验类型:课程 名称:实验名称:叶绿体色素的提取、分离、理化性质和叶 绿素含量的测定姓名:专业:学 号:指导老师:同组学生姓名: 实验日期:实验地点: 二、实验内容和原理一、实验目的和要求装 四、操作方法与实验步骤三、主要仪器设备订 六、实验结果与分析五、实验数据记录和处理 七、讨论、心得一、实验目的和要求、掌握植物中叶绿体色素的分离和 性质鉴定、定量分析的原理和方法。1 和b的方法及其计算。a2、熟悉在 未经分离的叶绿体色素溶液中测定叶绿素二、实验内容和原理以青菜为 材料,提取和分离叶绿体色素并进行理化性质测定和叶绿素含量分析。 原理如下:80%的乙醇或95%叶绿素和类胡萝卜素均不溶于水而溶于有机溶剂,1、常用的丙酮提取。、皂化反应。叶绿素是二羧酸酯,与强碱反应, 形成绿色的可溶性叶绿素2. 盐,就可与有机溶剂中的类胡萝卜素分开。- COOCHCOO3 Mg + 2KOH C32H30ON4Mg + 2KOH +CH3OH
HONC43230+C20H39OH 、3H+可依次被在酸性或加温条件下,叶-COOCOOCH39 20 绿素卟啉环中的Mg++取代反应。Mg2+, Cu2+ 取代Cu++取代形成褐色的去镁叶绿素和绿色的铜代叶绿素。(H+和H+ ) 取代(Zn2+) 绿色褐色 、叶绿素受光激发,可发出红色荧光,反射光下可见红色荧光。4645其中叶绿素吸收红光和兰紫光,红光区可用于定量分析,5、定量分析。 652可直接用于总量分析。663用于定量叶绿素a,b及总量,而和C最大吸收光谱不同的两个组分的混合液,它们的浓度根据朗伯-比尔定律, *k+C*kOD=Ca*k与吸光值之间有如下的关系: OD=Ca*k+C b2 1g/L和b的80查阅文献得,2b1 b1a1a2b时,比吸收系%丙酮溶液,当浓度为 叶绿素a 值如下。数k k 比吸收系数波长/nm b 叶绿素a 叶绿素 9.27 82.04 663 45.60 645 16.75
粗食盐提纯实验报告
粗食盐提纯 吴心悦 (环境工程163班宁波19) 摘要(1)掌握提纯NaCl的原理和方法 (2)学习溶解、沉淀、常压过滤、减压过滤、蒸发浓缩、结晶和烘干等基本操作。(3)了解Ca2+、Ma2+和SO42-等离子的定性鉴定。 关键词过滤; 乙醇洗涤; 关键词3; pH试纸 1. 引言 粗食盐的提纯和粗食盐中带有离子的定性鉴定。 2. 实验部分 实验原理 粗食盐中含有泥沙等不溶性杂质和溶于水的K+、Ca2+、Ma2+、Fe3+、SO42-、CO32-等可溶性杂质离子。将粗食盐溶于水后,用过滤的方法可除去不溶性杂质,可溶性杂质需加入合适的化学试剂,使之转化为沉淀而过滤除去,其方法是: (1)在粗食盐溶液中加入稍过量的BaCl2溶液,可将SO42-离子转化为BaSO4沉淀,过滤除去SO42-。 Ba2++SO42-====BaSO4↓ (2)向粗食盐溶液中加入NaOH和Na2CO3溶液,使溶液中的Ca2+、Ma2+、Fe3+及过量加入的Ba2+转化为CaCO3、Ma2(OH)2CO3溶液、Fe(OH)3和BaCO3沉淀后过滤除去。 Ca2++CO32-====CaCO3↓ 2Ma2++2OH-+CO32-====Ma2(OH)2CO3↓ Fe3++3OH-====Fe(OH)3↓ Ba2++CO32-====BaCO3↓ (3)用稀HCl溶液调节食盐溶液使pH至2~3,除去过量加入的NaOH和Na2CO3。 H++OH-====H2O 2H++CO32-====CO2↑+H2O 粗食盐中的K+离子不与上述试剂作用,仍留在溶液中。在蒸发和浓缩溶液时,由于NaCl的溶解度小先结晶出来,过滤时,溶解度大而含量少的KCl则留在残液中而被除掉。吸附在NaCl 晶体表面上的HCl可用乙醇洗涤除去。 仪器与试剂 1.仪器设备 循环水SHZ-D(Ⅲ)式真空泵,HH-2恒温水浴锅,托盘天平,烧杯(100mL),量筒(100mL,10mL),漏斗,布氏漏斗,抽滤瓶,漏斗架,蒸发皿,表面皿,酒精灯,试管,玻璃棒,pH试纸,滤纸。 2.试剂 粗食盐,2mol?L-1HCl溶液,2mol?L-1NaOH溶液,1mol?L-1BaCl2溶液,1mol?L-1Na2CO3 溶液,饱和Na2CO3溶液,饱和(NH4)2C2O4溶液,镁试剂(对硝基偶氮间苯二酚),6mol?L-1HAC 溶液,65%乙醇。
叶绿素的提取实验报告
叶绿素的提取及叶绿素铜钠的合成及测定生物资源系食卫101 韦琪(20102023) 指导老师:张倩、刘新梅 一、实验目的 1.从蚕沙中提取叶绿素并计算提取率; 2.研究用叶绿素合成叶绿素铜钠的工艺条件; 3.分析叶绿素铜钠产品的纯度,计算产率; 4.通过试验提高综合能力及练习巩固各种相关操作。 二、实验原理 蚕沙是桑蚕的排泄物,由蚕沙制取天然色素——叶绿素酮钠盐,是国外普遍采用的最佳途径。叶绿素是一种酯,因此不溶于水,而溶于乙醇、丙酮、乙醚等有机溶剂。 叶绿素是植物吸收太阳能进行光合作用的主要色素,叶绿素是一种含有卟吩环的天然色素,在叶绿素的结构中,含有一个由四个吡咯环和四个次甲基交替相联形成的卟吩环.卟吩环闭合的共轭体系提供了包围镁离子(或其它相似离子)的刚性平面.高等植物中含有叶绿素a和叶绿素b分子式如下: 蚕沙中含有丰富的叶绿素,其纯含量达0.8—1.0%,居所有天然色素之首,故可用蚕沙来提取叶绿素,由于叶绿素易溶于乙醚、苯、丙酮、乙醇的脂性溶剂,故可用乙醇、丙酮混合液来提取。所得的叶绿素由于遇热、光、酸、碱等易分解,且又不溶于水。110度左右会分解,故把叶绿素制备成叶绿素铜钠,其性质更稳定溶解性也会有所提高。 叶绿素分子中的镁原子和四个吡咯上的氮原子相结合,环上是双羧酸的酯,一个被四所酯化,另一个被叶醇基所酯化,故可以发生皂化反应生成钠盐:
C55H72MgN4O5 + 2 NaOH →C34H30O5N4MgNa2 + CH3OH + C20H39OH 在酸性介质中,叶绿素钠盐分子中的镁极易被氢原子取代生成褐色的叶绿素酸: C34H30O5N4MgNa2+ 4 H+→C34H34O5N4 + Mg2+ + 2 Na+ 叶绿素酸可与铜盐加热条件下生成叶绿素铜酸析出,将叶绿素铜酸溶于丙酮,再与碱反应就生成叶绿素铜钠盐: C34H34O5N4 + Cu2+→C34H34O5N4Cu + 2 H+ C34H34O5N4Cu + 2 NaOH →C34H34O5N4CuNa2 + 2 H2O 由叶绿素转化成叶绿素铜钠的过程也可用化学反应方程表示: (1)皂化: COOCH3COONa C32H30ON4Mg + 2NaOH → C32H30ON4Mg + CH3OH + C20H39OH COOC20H39 COONa (2)酸化: COONa COOH C32H30ON4Mg + 2H2SO4 → C32H30ON4H2 + MgSO4 + NaSO4 COONa COOH (3)铜代: COOH COOH C32H30ON4H2 + CuSO4 → C32H30ON4Cu + H2SO4 COOH COOH (4)成盐: COOH COONa C32H30ON4Cu + 2NaO H → C32H30ON4Cu + 2H2O COOH COONa 三、实验仪器和试剂 1.仪器:(一个),分液漏斗(2个),250mL锥形瓶(1个),烧杯(100ml、250 mL、 500mL )各1个,容量瓶(100mL、250mL)各1个,蒸馏装置,减 压过滤装置,玻璃棒,电子天平,圆底烧瓶(250mL)2个,酸度计, 分光光度仪(一台)。 2.试剂:(50g)、95%乙醇,丙酮,石油醚,2%~5%NaOH乙醇溶液,硫酸铜溶
利用ArcGIS水文分析工具提取河网的具体操作
利用ArcGIS水文分析工具提取河网的操作ArcGIS 水文分析工具提取河网 DEM包含有多种信息,ArcToolBox提供了利用DEM提取河网的方法,但是操作比较烦琐(帮助可参看Hydrologic analysis sample applications),今天结合我自己的使用将心得写出来与大家分享。提取河网首先要有栅格DEM,可以利用等高线数据转换获得。在此基础上,要经过洼地填平、水流方向计算、水流积聚计算和河网矢量转化这几个不步骤。 1.洼地填平 DEM洼地(水流积聚地)有真是洼地和数据精度不够高所造成的洼地。洼地填平的主要作用是避免DEM 的精度不够高所产生的(假的)水流积聚地。洼地填平使用ArctoolBox->Spatial Analysis Tools->Hydrol ogy->Fill工具。 2.水流方向计算 水流方向计算就可以使用上一步所生成的DEM为源数据了(如果使用未经洼地填平处理的数据,可能会造成精度下降)。这里主要使用ArctoolBox->Spatial Analysis Tools->Flow Direction 工具。输入的DE M采用第一步的Fill1_exam1 3.水流积聚计算 这里主要使用ArctoolBox->Spatial Analysis Tools->Flow Accumulation工具流向。栅格数据就是第二步所获得的数据(FlowDir_fill1)。可以看到,生成的水流积聚栅格已经可以看到所产生的河网了。现在所需要做的就是把这些河网栅格提取出来。可以把产生的河网的支流的象素值作为阀值来提取河网栅格。
4.提取河网栅格 使用spatial analyst中的栅格计算器,将所有大于河网栅格阀值的象素全部提取出来。至于这个阀值是多少因具体情况而定。通常是要大于积聚计算后得到栅格的最低河流象素值。这里采用的是500这个值。最 后生成只有0、1值的栅格数据。其中1表示是河网,0是非河网。 5.生成河网矢量 这里主要使用ArctoolBox->Spatial Analysis Tools->Stream to Feature工具.Input Stream raster 为第 四步只有0、1值的河网栅格。流向栅格使用第二步所生成的栅格数据。
叶绿素实验报告
一、实验目的: 1、了解植物组织中叶绿素分布及性质。 2、掌握测定叶绿素含量的原理和方法。 3、了解紫外分光光度计的用法。 4、了解一阶导数的含义。 5、了解如何如何排除互相干扰。 二、实验原理: 叶绿体中的色素都能够溶解于有机溶剂丙酮中,所以,可以用丙酮提取叶绿体中的色素。 层析液是一种脂溶性很强的有机溶剂。根据叶绿体中的四种色素在层析液中的溶解度不同来进行分离,溶解度高的在滤纸上扩散的快,溶解度低的扩散地慢。溶解度最高的是胡萝卜素,它随层析液在滤纸上扩散得最快,叶黄素和叶绿素a的溶解度次之;叶绿素b的溶解度最低,扩散速度最慢。这样,四种色素就在扩散过程中分离开来。 叶绿素a和叶绿素b的分子结构相似,它们的吸收光谱、荧光激发光谱和发射光谱重叠,用常规分光光度法和荧光方法难以实现其同时测定。但利用一阶导数光谱技术和同步荧光技术,消除了叶绿素a和叶绿素b的光谱干扰,可以同时测定它们的含量。 在600~700之间胡萝卜素一阶导数为零,没有吸收,在某个特定波长下,叶绿素a有一定的导数值,而叶绿素b的导数为零;同理,在另一个特定波长下,叶绿素b有一定的导数值,而叶绿素a的导数值为零。这样可以实现叶绿素b和叶绿素b的同时测定,又不受胡萝卜素的干扰。 三、实验材料: 1、仪器 干燥的定性滤纸、烧杯(100ml)、研钵、玻璃漏斗、分液漏斗、剪刀、小试管、试剂瓶、药勺、量筒(10ml)、天平、试管架、载玻片、铅笔、 直尺、棉花、移液管、洗耳球、毛细吸管、铁架台、胶头滴管、紫外分光 光度计。 2、药品 新鲜的菠菜叶、石英砂、碱式碳酸镁、90%丙酮、层析液(石油醚:丙酮:苯=20:2:1) 四、实验方法与步骤: 1.提取叶绿素中的色素 (1)取几片绿叶,去掉主脉,用天平称取20g叶片,剪碎,放入研钵。 (2)向研钵中加入少许二氧化硅和碳酸钙,进行充分的研磨。用量筒量取15ml丙酮。倒入研钵中,迅速充分研磨。 (3)将研磨液迅速倒入小玻璃漏斗中进行过滤。将滤液收集到一个小试管中,及时用棉塞将试管塞紧。 2.制备过滤纸 取一块预先干燥处理过的定性滤纸,将滤纸剪成长6cm,宽1cm的滤纸条,
【实验报告】氯化钠的提纯实验报告范文
氯化钠的提纯实验报告范文 篇一:粗盐提纯实验报告 一、实验目的: 1.学会化学方法提纯粗盐,同时进一步精制成试剂级纯度的氯化钠提供原料. 2.练习天平的使用,以及加热、溶解、过滤、蒸发和结晶、干燥的基本操作. 3.体会过滤的原理在生活生产等社会实际中的应用. 二、实验原理: 粗盐中含有泥沙等不溶性杂质,以及可溶性杂质如:Ca2+,Mg2+,SO42- 等.不溶性杂质可以用过滤的方法除去,Ca2+,Mg2+,SO42-可以通过化学方法----加试剂使之沉淀,在过滤,然后蒸发水分得到较纯净的精盐. 三、实验仪器和药品: 药品:粗盐,水,盐酸(2N),氢氧化钠(2N),氯化钡(1N),碳酸钠(1N)器材:天平,量筒,烧杯,玻璃棒,药匙,漏斗,铁架台(带铁圈),蒸发皿,酒精灯,坩埚钳,胶头滴管,滤纸,剪刀,火柴,纸片 四、实验操作: 五、实验总结 1.在除去Ca2+,Mg2+,SO42-时,为什么要先加BaCl2溶液,然后加Na2CO3溶液?
2.蒸发前为什么要将粗盐溶液的pH调到4―5? 篇二:粗盐制备分析纯氯化钠实验报告 一、实验题目:粗盐制备分析纯氯化钠 二、实验目的: 1.巩固减压过滤,蒸发、浓缩等基本操作; 2.了解沉淀溶解平衡原理的应用; 3.学习在分离提纯物质过程中,定性检验Ca、Mg、SO4等离子是否除尽。 三、实验原理:粗盐中,除含一些不溶性杂志,还含有Ca、Mg、SO4和Fe 等可溶性 2+2+2-3+杂质,不溶性杂质可用过滤法出去,可溶性杂质中Ca、Mg、SO4和Fe通过过滤的方 法除去,然后蒸发水分得到较纯净的精盐。 1.BaCl2―NaOH,Na2CO3法 (1)除SO4,加入BaCl2溶液 Ba+SO4=BaSO4 (2)除Ca2+、Mg2+、和Fe3+和过量的Ba2+,加入NaOH―Na2CO3 Ca2++CO32-=CaCO3 Ba2++CO32-=BaCO3 4Mg2++4CO32- +H2O=Mg(OH)2?3MgCO3 (3)除CO32-,加入HCl溶液
叶绿素的提取和分离实验报告
叶绿素的提取和分离实 验报告 Company number:【0089WT-8898YT-W8CCB-BUUT-202108】
陕西师范大学远程教育学院 生物学实验报告 报告题目叶绿素的提取和分离 姓名刘伟 学号 专业生物科学 批次/层次 指导教师 学习中心 叶绿素的提取和分离 一、实验目的 1. 学习叶绿体色素的提取、分离方法。 2. 通过叶绿体色素提取、分离方法的学习了解叶绿体色素的相关理化性质。 3. 为进一步研究各叶绿体色素性质、功能等奠定基础。 二、原理 叶绿体中含有绿色素(包括叶绿素a和叶绿素b)和黄色素(包括胡萝卜素和叶黄素)两大类。它们与类囊体膜蛋白相结合成为色素蛋白复合体。它们的化学结构不同,所以它们的物化性质(如极性、吸收光谱)和在光合作用中的地位和作用也不一样。这两类色素是酯类化合物,都不溶于水,而溶于有机溶剂,故可用乙醇、丙醇等有机溶剂提取。提取液可用色谱分析的原理加以分离。因吸附剂对不同物质的吸附力不同,当用适当的溶剂推动时,混合物中各种成分在两相(固定相和流动相)间具有不同的分配系数,所以移动速度不同,经过一定时间后,可将各种色素分开。 三、材料、仪器设备和试剂 1. 绿色植物如菠菜等的叶片。 2. 研钵、漏斗、三角瓶、剪刀、滴管、康维皿、圆形滤纸(直径11cm)。 3. 试剂:95%乙醇,石英砂,碳酸钙粉,推动剂:按石油醚:丙酮:苯=10:2:1比例配制(v/v) 四、试验步骤 1. 叶绿体色素的提取 (1)取菠菜或其他植物新鲜叶片4-5片(4g左右),洗净,擦干,去掉中脉剪碎,放入研钵中。 (2)研钵中加入少量石英砂及碳酸钙粉,加2-3ml 95%乙醇,研磨至糊状,再加10ml 95%乙醇,然后以漏斗过滤之,残渣用10ml 95%乙醇冲洗,一同过滤于三角瓶中。
【实验报告】从菠菜中提取叶绿素实验报告三篇
从菠菜中提取叶绿素实验报告三篇 【实验目的】 1、通过绿色植物色素的提取和分离,了解天然物质的分离提纯与方法。 2、通过薄层色谱分离操作,加深了解微量有机物色谱分离鉴定的原理。 【实验原理】 叶绿色存在两种结构相似的形式即叶绿素a{C55H77O5N4Mg}和叶绿素 b{ C55H70O6N4Mg };胡萝卜素是具有长链结构的共轭多烯,有三种异构体;叶黄素C40H56O2是胡萝卜素的羟基衍生物。当提取时,从上到下颜色依次为:黄绿色,蓝绿色,黄色和橙色。 【实验仪器】 研钵,色谱柱,丙酮,乙醇,乙醚,中性氧化铝,菠菜叶,烧杯,漏斗,玻璃棒,滤纸,剪刀,脱脂棉,纱布。 【实验步骤】 1、称取30g洗净后用滤纸喜感的新鲜菠菜叶,用剪刀剪碎,放入研钵中研磨,研磨时放入少量碳酸钙,防止研磨过猛破坏叶绿素结构,研磨至烂。 2、将研磨碎的菠菜叶转入小烧杯中,加入30mL配好的乙醇乙醚溶液,盖上表面皿,防止有机溶剂蒸发。按小组成员分别浸泡 10,15,20,25,30,35,40,45,50,55分钟。 3、浸泡期间,填充色谱柱,在最下面垫入脱脂棉,再盖上一个小滤纸片,装入氧化铝至4/5处,再盖上一层滤纸片。
4、将烧杯中的菠菜叶连带着有机溶剂用纱布挤入漏斗中,转入分液漏斗,加入10mL水洗涤,除去水层(下层),再用10mL水洗涤一次。 5、将分页漏斗中的溶液慢慢倒入色谱柱中,加几滴丙酮既可以看到颜色变化。 6、洗净仪器,收拾实验室,打扫卫生。 【实验记录】 虽然分层现象不是非常明显,但是还是可以看得见分层现象。 【结果与讨论】 1、做这个实验的时候,我觉得不应该用纱布挤干,因为个人感觉很多色素都被 纱布吸走了,导致后来的实验现象没有很明显,经过对比,没用纱布直接过滤的同学做出的现象比用纱布做的现象要明显的多。 2、有机溶剂往往比较容易挥发,所以加入后要盖上表面皿。 3、此实验浸泡15分钟以后现象就可以很明显,因此以后在课堂上给学生演示的时候浸泡的时间不是越长越好的,15分钟足矣。 4、若最后颜色没有明显的分层,可以加入几滴丙酮帮助分层。 绿色植物如菠菜叶中含有叶绿素(绿)、胡萝卜素(橙)和叶黄素(黄)等多种天然色素。 叶绿素存在两种结构相似的形式即叶绿素a(C55H72O5N4Mg)和叶绿素 b(C55H70O6N4Mg)),差别仅是a中一个甲基被b中的甲酰基所取代。它们都是
(完整版)咖啡因提取及鉴定实验报告
咖啡因提取及鉴定实验报告 题目:茶叶中咖啡因的提取分离及结构鉴定 实验目的: 1. 了解天然产物及其提取的概念和一般分离方法 2. 了解并学会使用回流提取的原理和操作 3. 了解如何用升华法提纯有机固体 4. 对从茶叶中提取咖啡因的整个过程必须了解 咖啡因的理化性质:咖啡因(含结晶水时)是无色针状结晶,味苦,能溶于水(2%)、乙醇(2%)、(氯仿12%)、苯(1%)等,在100℃时即失 去结晶水,并开始升华,120℃升华显著,178 ℃时升华很快, 融点为234.5 ℃,呈弱碱性。在植物中,咖啡因常与有机酸、 丹宁等结合呈盐的形式存在。咖啡因属于甲基黄嘌呤的生物 碱。纯的咖啡因是白色的,强烈苦味的粉状物。它的化学式是 C8H10N4O2。分子量,194.19 。 咖啡因的结构式: 实验原理:本实验从茶叶中提取咖啡因是用适当的溶剂(95%乙醇),在回流装置中连续提取并用蒸馏装置除去乙醇,得到粗制咖啡因,最后通 过升华提纯得到。 实验仪器及试剂:(1)仪器: 两个圆底烧瓶、两个三口烧瓶、一个直行冷凝管、两个1000ml烧杯、 两个500ml烧杯,两个50ml烧杯蒸发皿、玻璃漏斗、蒸馏头、水浴 锅、砂浴锅、温度计(250℃)、滤纸、刮刀、酒精灯、石棉网、电热 套 (2)试剂: 100g茶叶、乙醇(95%)、生石灰 实验步骤: 1.粗提8:00 称量茶叶100g并研碎 9:00 安装回流装置,将称量好的茶叶装入三口烧瓶中,并加入800ml 95%的乙醇。 9:30 开始回流
(1)连续萃取:称取100g绿茶叶,研细,放入回流提取装置中。在三 口烧瓶中加入95%乙醇,用电热套加热,连续提取。当提取液的 颜色变的很淡,立即停止加热。将仪器改成蒸馏装置,回收提取 液中的大部分乙醇。 (3)中和酸除水:残液倒入蒸发皿中,拌入生石灰40 g,在蒸气 浴上加热,不断搅拌,蒸干为止。随着温度升高,从浓绿色溶液变为糊状液。最后变为绿色粉末 (4)焙炒:把蒸发皿放在石棉网上,焙炒片刻,除尽水分。 2、升华 (1)仪器安装:在蒸发皿上放一张用大号针刺有许多小孔的圆 形滤纸,再把一只直径和蒸发皿相当的玻璃漏斗盖在上面,漏斗 颈部疏松地塞一小团棉花
