二元气液平衡数据测定

一、实验目的
1、了解和掌握用双循环气液平衡器测定二元系统气液平衡数据的方法。
2、了解缔合系统气液平衡数据的关联方法,从实验测得的T-p-x-y 数据计算各
组分的活度系数。
3、通过实验了解平衡釜的构造,掌握气液平衡数据的测定方法和技能。
4、掌握二元系统气液平衡相图的绘制。
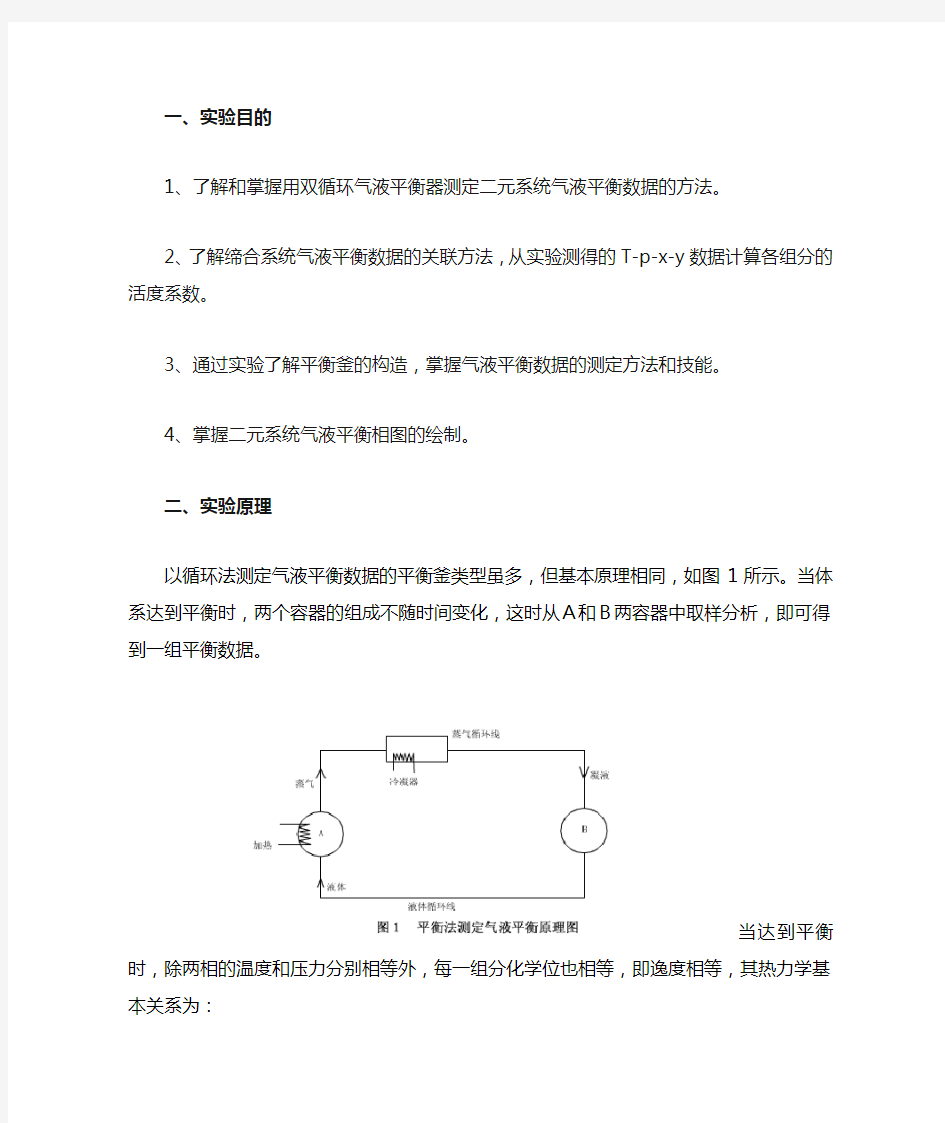
二、实验原理
以循环法测定气液平衡数据的平衡釜类型虽多,但基本原理相同,如图1
所示。当体系达到平衡时,两个容器的组成不随时间变化,这时从A和B两容器
中取样分析,即可得到一组平衡数据。
当达到平衡时,除两相的温度和压力分别相等外,每一组分化学位也相等,即逸
度相等,其热力学基本关系为:
V i
L i f f ??= i
s i i i V i x f py γφ=? (1) 常压下,气相可视为理想气体,1?=v i
φ;再忽略压力对流体逸度的影响,s i s i p f = 从而得出低压下气液平衡关系式为:
py i =γi s i p i x (2)
式中,p ——体系压力(总压);
s i p ——纯组分i 在平衡温度下的饱和蒸汽压,可用Antoine 公式计算;
x i 、y i ——分别为组分i 在液相和气相中的摩尔分率;
γi ——组分i 的活度系数
由实验测得等压下气液平衡数据,则可用
s i
i i i p x py =γ (3) 计算出不同组成下的活度系数。
本实验中活度系数和组成关系采用Wilson 方程关联。Wilson 方程为:
ln γ1=-ln(x 1+Λ12x 2)+x 2(212112x x Λ+Λ -1
21221x x Λ+Λ) (4) ln γ1=-ln(x 2+Λ21x 1)+x 1(
121221x x Λ+Λ -212112x x Λ+Λ) (5) Wilson 方程二元配偶函数Λ12和Λ21采用高斯—牛顿法,由二元气液平衡数
据回归得到。
目标函数选为气相组成误差的平方和,即
F =2221211((j m
j j y y y y ))计实计实-+-∑= (6)
三、实验装置与流程示意图
1.平衡釜一台(平衡釜的选择原则:易于建立平衡、样品用量少、平衡温度测
定准确、气相中不夹带液滴、液相输送不返混及不易爆沸等。本实验用双循环的
小型平衡釜,其结构如图2所示)
2.阿贝折射仪一台
3. 超级恒温槽一台
4.50-100十分之一的标准温度计一支、0-50十分之一标准温度计一支
5.所用试剂(无水甲醇、异丙醇)为分析纯试剂
6. 1ml 注射器、5ml 注射器三支
四、实验步骤
1、测五组二元系统气液平衡标准数据
2、测温套管中倒入甘油,将标准温度计插入套管中,并将其露出部分中间固定
一支温度计,对温度进行校正
3、查整个系统的气密性,以保证实验装置具有良好的气密性,用与系统相连的
100毫升针筒与系统相连,并使系统与大气隔绝,针筒缓缓抽出一点压力,硅油
U型管中的两个液注差不变时(说明系统是密闭的),然后再通大气
4、平衡釜内加入一定浓度的无水甲醇-异丙醇混合溶液约20-30ml,打开冷却水,
安放好加热器,接通电源。开始时缓慢加热,冷凝回流液控制在每秒2 ~ 3滴。
稳定地回流约15分钟,以建立平衡状态
5、达平衡后,需要记录下温度计的读数,并用微量注射器分别取气相样品,测
定其折射率,对照标准曲线得出汽相组成
6、依次加入同量的一种纯物质5ml,重新建立平衡,实验重复5次
7、实验完毕,关掉电源和水源,处理实验数据
五、实验注意事项
1、在注射纯物质时要缓慢注入以免溅出,不能用水洗涤仪器
2、在温度维持恒定时要再加热5分钟保证确实达到平衡
六、实验数据
1、原始数据
2、数据处理
七、实验分析与讨论
1、结果讨论
本次实验从结果来看,甲醇组成折光率的测定结果比较准确,制图的分布点成线性分布。
最后甲醇气相组成的计算值和实验值比较存在一定的误差,实验所测数据比计算值大,实验过程中物料置换操作、气液蒸馏时间的长短都是造成误差的原因。
2、误差分析
实验注射样品液时,注射物料的量测量存在误差,且注射时有液体喷出,这使得实验结果产生误差。
在折光率的测定过程中,读数是存在误差不可避免的,这是误差产生的另外一个因素。
仪器本身对实验数据的采集会产生偏差。
二元液系气液平衡相图
实验二二元液系气液平衡相图 一、实验目的 1、了解环己烷—乙醇系的沸点—组成图 2、由图上得出其最低恒沸温度及最低恒沸组成(含乙醇%) 3、学会使用数字阿贝折射仪 4、学会使用WTS—05数字交流调压器 二、原理 一个完全互溶双液体系的沸点—组成图,表明在气液二相平衡时沸点和二相成分间的关系,它对了解这一体系对行为及分馏过程都有很大的实用价值。 在恒压下完全互溶双液系的沸点与组分关系有下列三种情况:1、溶液沸点介于二纯组分之间;2、溶液有最高恒沸点;3、溶液有最低恒沸点。 图1表示有最低恒沸点,本次实验图形也像如此的样子,A′LB′代表液相线的交点表示在该温度时互成平衡的二相的成份。 绘制沸点—成份图的简单原理如下:当总成份为X的溶液开始蒸馏时,体系的温度沿虚线上升,开始沸腾时成份为Y的气相生成。若气相量很少,x、y二点即代表互成平衡时液气二相成份。继续蒸馏,气相量逐渐增多,沸点沿虚线继续上升,气液二相成份分别在气相和液相线上沿箭头指示方向变化。当二相成份达到某一对数值x′和y′,维持二相的量不变,则体系气液二相又在此成份达到平衡,而二相的物质数量按杠杆原理分配。 本实验利用回流的方法保持气液二相相对量一定,则体系温度恒定。待二相平衡后,取出二相的样品,用阿贝折光仪测定其折射率。得出该温度下气液二相平衡成份的坐标点,改变体系的总成份,再用上法找出一对坐标点,这样测得若干坐标点后,分别按气相点和液相点连成气相线和液相线,即得T—X平衡图。 三、步骤 1、安装接通仪器,打开冷凝水; 2、加入环己烷20ml,蒸馏至沸腾,待小兜有液体后回流三次,温度平衡2—3分钟基本不变,记下温度,关闭调压器; 3、A组加入乙醇0.5ml,用上法测定温度,然后关闭调压器,取出气相,液相的样品,测其折射率,以后分别加入1.0,2.0,4.0,8.0,12.0ml乙醇;
双液系气液平衡相图的绘制(华南师范大学物化实验)
双液系气-液平衡相图的绘制 一、实验目的 (1)用回流冷凝法测定沸点时气相与液相的组成,绘制双液系相图。找出恒沸点混合物的组成及恒沸点的温度。 (2)掌握测定双组分液体的沸点及正常沸点的测定方法。 (3)了解阿贝折射计的构造原理,熟悉掌握阿贝折射计的使用方法。 二、实验原理 2.1液体的沸点 液体的沸点是液体饱和蒸汽压和外压相等时的温度,在外压一定时,纯液体的沸点有一个确定值。 2.2双液系的沸点 双液系的沸点不仅与外压有关,而且还与两种液体的相对含量有关。理想的二组分体系在全部浓度范围内符合拉乌尔定律。结构相似、性质相近的组分间可以形成近似的理想体系,这样可以形成简单的T-x (y )图。大多数情况下,曲线将出现或正或负的偏差。当这一偏差足够大时,在T-x (y )曲线上将出现极大点(负偏差)或极小点(正偏差)。这种最高和最低沸点称为恒沸点,所对应的溶液称为恒沸混合物。 恒定压力下,真实的完全互溶双液系的气-液平衡相图(T -x ),根据体系对拉乌尔定律的偏差情况,可分为3类: (1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯-苯体系,如图1(a)所示。 (2)最大负偏差:存在一个最小蒸汽压值,比两个纯液体的蒸汽压都小,混合物存在着最高沸点,如盐酸—水体系,如图1(b)所示。 (3)最大正偏差:存在一个最大蒸汽压值,比两个纯液体的蒸汽压都大,混合物存在着最低沸点,如水-乙醇体系,如图1(c))所示。 图1. 二组分真实液态混合物气—液平衡相图(T-x 图) 考虑综合因素,实验选择具有最低恒沸点的乙醇-乙酸乙酯双液系。根据相平衡原理,对二组分体系,当压力恒定时,在气液平衡两相区,体系的自由度为1。若温度一定时,则气液亮相的组成也随之而定。当溶液组成一定时,根据杠 t A t A t A t B t B t B t / o C t / o t / o x B x B x B A B A A B B (a) (b) (c)x ' x '
二元液系相图(实验数据分析)
实验名称:二元液系相图 学院:XXXXXXXXXX 班级:XXXXXXXXX 姓名(学号):XXX(XXXXXXXX) 指导教师:XXX 实验时间:XXXXXXXXXXXXXX
二元液系相图 一、实验目的 1.测定环己烷-乙醇系统的沸点组成图(T-X图)。 2.掌握阿贝(Abbe)折光仪的使用方法。 二、实验原理 两种液态物质以任何比例混合都形成均相溶液的系统称这完全 互中溶双液系。在恒定压力下溶液沸点与平衡的气液相组成的关系,可用沸点-组成图(t-x图)表示。 完全互溶双液系的沸点-组成图可分为两三种: 一种为最简单的情况,溶液沸点介于两个纯组分沸点之间,如图6-1所示。纵坐标表示温度,横坐标表示组分B的摩尔分数(x B,y B)。下面一条曲线表示气液平衡时温度(即溶液沸点)与液想组成的关系,称液相线(T-x线)。上面的线表示平衡温度与气相组成的关系,称气相线(T-y线)。若总组成为Z B的系统在压力p及温度t时达到气液两相平衡,其液相组成为x B气相组成为y B(见图6-1)。 另两种类型为具有恒沸点的完全互溶双液系统气液平衡相图,如图6-2所示。其中(a)为具有低恒沸点相图,(b)为具有高恒沸点相图。这两类相图中气相线与液相线在某处相切。相切点对应的温度称为恒沸温度,对应组成的混合物称恒沸混合物。恒沸混合物在恒沸点达气液平衡,平衡的气、液组成相同。同一双液系在不同压力下,恒沸点及恒沸混合物是不同的。
本实验绘制环己烷-乙醇二元液系的T-X图。其方法为将不同组成的溶液于蒸馏仪中进行蒸馏,沸腾平衡后记下温度,依次吸取少量的蒸馏液和蒸出液。分别用阿贝折光计测定其折射率,然后由环己烷-乙醇的折射率-组成标准曲线或其数据表确定相应组成,从而绘制环己烷-乙醇二元液系相图。 三、仪器和试剂 沸点测定仪;取样管;阿贝折光仪。 环己烷(分析纯);无水乙醇(分析纯);环己烷摩尔分数分别为0.2、0.4、0.6、0.8的乙醇溶液。 四、实验步骤 1.纯液体折光率的测定 分别测定乙醇和环己烷的折光率。 2.标准曲线的绘制 测定环己烷摩尔分数分别为0.2、0.4、0.6、0.8的乙醇溶液的折光率,绘制标准曲线。 3.测定沸点-组成数据 1)安装沸点测定仪。 2)溶液配制。 粗略配制环己烷质量百分数分别为0.05、0.1、0.2、0.45、0.55、0.6、0.7、0.8、0.9等组成的环己烷-乙醇溶液约50ml。
二元系统气液平衡数据测定
化工专业实验 实验名称:二元系统气液平衡数据测定学院:化学工程学院 专业:化学工程与工艺 班级:化工092班 姓名:芦亚婷学号09402010206 指导教师:王剑锋 日期:2012年5月14日
一、实验目的 1. 了解和掌握用双循环汽液平衡器测定二元系统气液平衡数据的方法。 2. 了解缔合系统汽—液平衡数据的关联方法,从实验测得的T-p-x-y 数据计算各组分的活度系数。 3. 通过实验了解平衡釜的构造,掌握气液平衡数据的测定方法和技能。 4. 掌握二元系统气液平衡相图的绘制。 二、实验原理 以循环法测定气液平衡数据的平衡虽多,但基本原理相同,如图1所示。当体系达到平衡时,两个容器的组成不随时间变化,这时从A 和B 两容器中取样分析,即可得到一组平衡数据。 冷凝器 凝液 蒸气循环线 蒸气 加热 液体 液体循环线 图1 平衡法测定气液平衡原理图 B A 图1 平衡法测定气液平衡原理图 当达到平衡时,除了两相的温度和压力分别相等外,每一组分化学位也相等,即逸度相等,其热力学基本关系为: V i L i f f = (1) i i i x f py 0i i γφ= 常压下,气相可视为理想气体,再忽略压力对流体逸度的影响,0i i p f = 从而得出低压下气液平衡关系式为: py i =γi 0i p i x (2) 式中,p —体系压力(总压); 0i p —纯组分i 在平衡温度下的饱和蒸汽压,可用Antoine 公式计算; x i 、y i —分别为组分i 在液相和气相中的摩尔分率; γi —组分i 的活度系数 由实验测得等压下气液平衡数据,则可用
【清华】实验2_双液系的气液平衡相图_2006011835
`` 实验2 双液系的气液平衡相图 唐盛昌2006011835 分6 同组实验者:徐培 实验日期:2008-10-9,提交报告日期:2008-10-23 带实验助教:尚培华 1 引言(简明的实验目的/原理) 实验目的: 1.用沸点仪测定在常压下环已烷—乙醇的气液平衡相图。 2.掌握阿贝折射仪的使用方法。 实验原理: 将两种挥发性液体混合,若该二组分的蒸气压不同,则溶液的组成与其平衡气相的组成不同。在压力保持一定,二组分系统气液达到平衡时,表示液态混合物的沸点与平衡时组成关系的相图,称为沸点和组成(T-x)图。沸点和组成(T-x)的关系有下列三种:(1)理想液体混合物或接近理想液体混合物的双液系,其液体混合物的沸点介于两纯物质沸点之间见图5—1(a);(2)各组分蒸气压对拉乌尔定律产生很大的负偏差,其溶液有最高恒沸点见图5—1(b);(3)各组分蒸气压对拉乌尔定律产生很大的正偏差,其溶液有最低恒沸点见图5—1(c)。第(2)、(3)两类溶液在最高或最低恒沸点时的气液两相组成相同,加热蒸发的结果只使气相总量增加,气液相组成及溶液沸点保持不变,这时的温度称恒沸点,相应的组成称恒沸组成。第一类混合物可用一般精馏法分离出这两种纯物质,第(2)、(3)类混合物用一般精馏方法只能分离出一种纯物质和另一种恒沸混合物。 图1 沸点组成图 为了测定二元液系的T-x图,需在气液达到平衡后,同时测定溶液的沸点、气相和液相组成。 本实验是测定具有最低恒沸点的环己烷—乙醇双液系的T-x图。方法是用沸点仪(图2)直接测定一系列不同组成之溶液的气液平衡温度(即沸点),并收集少量馏出液(即气相冷凝液)及吸取少量溶液(即液相),分别用阿贝折射仅测定其折射率。为了求出相应的组成,必须先测定已知组成的溶液的折射率,
汽液平衡数据的测定
实验报告 课程名称: 化工专业实验 指导教师: 勇 成绩:_________ 实验名称: 气液平衡数据的测定 同组学生: 一、实验目的和容 二、实验原理及数据处理依据 三、实验装置与试剂 四、操作方法和实验步骤 五、数据记录及处理 六、实验结论及误差分析 七、分析和讨论 汽液平衡数据是最常用的化工基础数据。许多化工过程如精馏的设计、操作及过程控制等都离不开汽液平衡数据。在热力学研究方面,新的热力学模型的开发,各种热力学模型的比较筛选等也离不开大量精确的汽液平衡实测数据。现在,各类化工杂志每年都有大量的汽液平衡数据及汽液平衡测定研究的文章发表。所以,汽液平衡数据的测定及研究深受化工界人士的重视。 一、实验目的和容 通过测定常压下乙醇—水二元系统汽液平衡数据的实验,使同学们了解、掌握汽液平衡数据测定的方法和技能,熟悉有关仪器的使用方法,将课本上学到的热力学理论知识与实际运用有机地联系在一起。从而既加深对理论知识的理解和掌握,又提高了动手的能力。 气液平衡测定的种类: 由于汽液平衡体系的复杂性及汽液平衡测定技术的不断发展,汽液平衡测定也形成了特点各异的不同种类。按压力分,有常减压汽液平衡和高压汽液平衡。高压汽液平衡测定的技术相对比较复杂,难度较大。常减压汽液平衡测定则相对较易。按形态分,有静态法和动态法。静态法技术相对要简单一些,而动态法测定的技术要复杂一些但测定较快较准。在动态法里又有单循环法和双循环法。双循环法就是让汽相和液相都循环,而单循环只让其中一相(一般是汽相)循环。在一般情况下,常减压汽液平衡都采用双循环,而在高压汽液平衡中,只让汽相强制循环。循环的好处是易于平衡、易于取样分析。 根据对温度及压力的控制情况,有等温法与等压法之分。一般,静态法采用等温测定,动态法的高压汽液平衡测定多采用等温法。 总之,汽液平衡系统特点各异,而测定的方法亦丰富多彩。 本实验采用的是常压下(等压)双循环法测定乙醇—水的汽液平衡数据。 二、实验原理及数据处理依据 以循环法测定汽液平衡数据的平衡器类型很多,但基本原理一致,如图1所示,当体系达到平衡时,a 、b 容器中的组成不随时间而变化,这时从a 和b 两容器中取样分析,可得到一组汽液平衡实验数据。 当达到平衡时,除了两相的压力和温度分别相等外,每一组分的化学 位也相等,即逸度相等,其热力学基本关系为: V i L i f f = (1) i i i i i x f py ογφ= 装 订 线 姓名: 学号: 日期: 2015 地点:
双液系气液平衡相图的绘制
实验三双液系气液平衡相图的绘制姓名:学号: 班级:实验日期:2015年9月21日 提交报告日期:2015年9月28日 1、实验目的 1.了解沸点仪的原理和使用方法。 2.在大气压力下用沸点仪测绘环己烷-乙醇双液系的气相平衡相图。 3.掌握阿贝折射仪的使用方法。 2、实验原理 双液系是指两种液态物质混合而成的物系。双液系可以分为完全互溶双液系、部分互溶双液系和完全不溶双液系。 将两种挥发性液体混合,若该二组分的蒸气压不同,则溶液的组成与其平衡气相的组成不同。在压力保持一定,二组分系统气液达到平衡时,表示液态混合物的沸点与平衡时组成关系的平衡状态图,简称相图。沸点和组成的关系有下列三种:(1)理想液体混合物或接近理想液体混合物的双液系,其液体混合物的沸点介于两纯物质沸点之间;(2)各组分蒸气压对拉乌尔定律产生很大的负偏差,其溶液有最高恒沸点见;(3)各组分蒸气压对拉乌尔定律产生很大的正偏差,其溶液有最低恒沸点。第(2)、(3)两类溶液在最高或最低恒沸点时的气液两相组成相同,加热蒸发的结果只使气相总量增加,气液相组成及溶液沸点保持不变,这时的温度称恒沸点,相应的组成称恒沸组成。第一类混合物可用一般精馏法分离出这两种纯物质,第(2)、(3)类混合物用一般精馏方法只能分离出一种纯物质和另一种恒沸混合物。 为了测定二元液系的相图,需在气液达到平衡后,同时测定溶液的沸点、气相和液相组成。 本实验是测定具有最低恒沸点的环己烷—乙醇双液系的相图。方法是用沸点仪直接测定一系列不同组成之溶液的气液平衡温度(即沸点),并收集少量馏出液(即气相冷凝液)及吸取少量溶液(即液相),分别用阿
编号123456 7 8 贝折射仅测定其折射率。为了求出相应的组成,必须先测定已知组成的溶液的折射率,作出折射率对组成的工作曲线,在此曲线上即可查得对应于样品折射率的组成。 3、实验仪器和试剂 1.仪器 沸点仪1个、加热电源(0.5kW)1台、阿贝折射仪1台、长颈胶头滴管2支、镜头纸、 超级恒温槽、50~10℃温度计1支。 2.药品 乙醇、环己烷、丙酮。 4、实验操作步骤及方法要点 1.启动超级恒温槽的加热和搅拌系统,把超级恒温槽的控制温度调至27℃。 2.测定标准溶液的折射率 用与超级恒温槽相连接的已经恒温的阿贝折射仪测定标准溶液的折射率,作折射率对组成的工作曲线。 3.溶液沸点及气液平衡组成的测定。 往沸点仪中加入20mL乙醇,通冷却水,打开电源并调电压至12V,加热溶液至沸腾。待其温度计上所指示的温度保持恒定后,读下该温度值,同时停止加热,并立即在小泡中取气相冷凝液,迅速测定其折射率,并用另一滴管取少量液相测定其折射率。 接下来,往沸点仪中分别加入1mL、2mL、2mL、2mL、5mL环己烷,并按前述方法测定气液平衡温度和气液两相的折光率。结束后,将沸点仪中溶液倒入回收瓶并用电吹风把沸点仪烘干。 往沸点仪中加入20mL环己烷,经行实验。在之后往沸点仪中分别加入的是1mL、2mL、2mL、2mL、5mL乙醇。 注意:每次测量折射率后,要将折射仪的棱镜打开晾干,以备下次测定用。 5、实验数据 1)原始实验测量数据 大气压力:97.13kPa 室温:25.5℃ 以下数据测定过程中阿贝折射仪(恒温槽)温度为27.0℃。
1.汽液平衡数据测定
实验1 二元体系汽液平衡数据测定 一. 实验目的 1.了解二元体系汽液相平衡数据的测定方法,掌握改进的Rose 平衡釜的使用方法,测定大气压力下乙醇(1)--环己烷(2)体系i i y x P T ---数据。 2.确定液相组分的活度系数与组成关系式中的参数,推算体系恒沸点,计算出不同液相组成下二个组分的活度系数,并进行热力学一致性检验。 3.掌握恒温浴使用方法和用阿贝折光仪分析组成的方法。 二.实验原理 汽液平衡数据实验测定是在一定温度压力下,在已建立汽液相平衡的体系中,分别取出汽相和液相样品,测定其浓度。本实验采用的是广泛使用的循环法,平衡装置利用改进的Rose 釜。所测定的体系为乙醇(1)—环己烷(2),样品分析采用折光法。 汽液平衡数据包括i i y x P T ---。对部分理想体系达到汽液平衡时,有以下关系式: s i i i i P x P y γ= (2-1-1) 将实验测得的i i y x P T ---数据代入上式,计算出实测的i x 与i γ数据,利用i x 与i γ关系式(van Laar 方程或Wilson 方程等)关联,确定方程中参数。根据所得的参数可计算不同浓度下的汽液平衡数据、推算共沸点及进行热力学一致性检验。 三. 实验装置和试剂 实验装置见图 2-1–1,其主体为改进的Rose 平衡釜-一汽液双循环式平衡釜(见图 2-1-2)。 改进的Rose 平衡釜汽液分离部分配有50—100℃精密温度计或热电偶(配XMT —3000数显仪)测量平衡温度,沸腾器的蛇型玻璃管内插有300W电热丝,加热混合液,其加热量由可调变压器控制。 分析仪器:恒温水浴—阿贝折光仪系统,配有CS-501型超级恒温浴和四位数字折光仪。 实验试剂: 无水乙醇(分析纯), 环己烷(分析纯) 四.实验步骤和分析方法 1.制作乙醇(1)-- 环己烷(2)溶液折光系数与组成关系工作曲线(可由教师预先准备):
汽液平衡数据的测定
实验报告 课程名称:化工专业实验指导教师:李勇成绩:_________ 实验名称:气液平衡数据的测定 同组学生姓名: 一、实验目的和内容 二、实验原理及数据处理依据 三、实验装置与试剂 四、操作方法和实验步骤 五、数据记录及处理 六、实验结论及误差分析 七、分析和讨论 汽液平衡数据是最常用的化工基础数据。许多化工过程如精馏的设计、操作及过程控制等都离不开汽液平衡数据。在热力学研究方面,新的热力学模型的开发,各种热力学模型的比较筛选等也离不开大量精确的汽液平衡实测数据。现在,各类化工杂志每年都有大量的汽液平衡数据及汽液平衡测定研究的文章发表。所以,汽液平衡数据的测定及研究深受化工界人士的重视。 一、实验目的和内容 通过测定常压下乙醇—水二元系统汽液平衡数据的实验,使同学们了解、掌握汽液平衡数据测定的方法和技能,熟悉有关仪器的使用方法,将课本上学到的热力学理论知识与实际运用有机地联系在一起。从而既加深对理论知识的理解和掌握,又提高了动手的能力。 气液平衡测定的种类: 由于汽液平衡体系的复杂性及汽液平衡测定技术的不断发展,汽液平衡测定也形成了特点各异的不同种类。按压力分,有常减压汽液平衡和高压汽液平衡。高压汽液平衡测定的技术相对比较复杂,难度较大。常减压汽液平衡测定则相对较易。按形态分,有静态法和动态法。静态法技术相对要简单一些,而动态法测定的技术要复杂一些但测定较快较准。在动态法里又有单循环法和双循环法。双循环法就是让汽相和液相都循环,而单循环只让其中一相(一般是汽相)循环。在一般情况下,常减压汽液平衡都采用双循环,而在高压汽液平衡中,只让汽相强制循环。循环的好处是易于平衡、易于取样分析。 根据对温度及压力的控制情况,有等温法与等压法之分。一般,静态法采用等温测定,动态法的高压汽液平衡测定多采用等温法。 总之,汽液平衡系统特点各异,而测定的方法亦丰富多彩。 本实验采用的是常压下(等压)双循环法测定乙醇—水的汽液平衡数据。 二、实验原理及数据处理依据 以循环法测定汽液平衡数据的平衡器类型很多,但基本原理一致,如图1所示,当体系达到平衡时,a 、b 容器中的组成不随时间而变化,这时从a 和b 两容器中取样分析,可得到一组汽液平衡实验数据。 当达到平衡时,除了两相的压力和温度分别相等外,每一组分的化学 位也相等,即逸度相等,其热力学基本关系为: V i L i f f = (1) i i i i i x f py ογφ=
二元汽液平衡数据
一、实验目的 1.测定甲醇—乙醇二元体系在常压下的气液平衡数据,绘制相图。 2.通过实验了解平衡釜的结构,掌握气液平衡数据的测定方法和技能。 3.掌握气相色谱仪的操作。 4.应用Wilson方程关联实验数据。 二、实验原理 气液平衡数据是化学工业发展新产品、开发新工艺、减少能耗、进行三废处理的重要 基础数据之一。化工生产中的蒸馏和吸收等分离过程设备的设计、改造以及对最佳工 艺条件的选择,都需要精确可靠的气液平衡数据。化工生产过程均涉及相间物质传递,故气液平衡数据的重要性是显而易见的。随着化工生产的不断发展,现有气液平衡数 据远不能满足需要。许多物系的平衡数据,很难由理论直接计算得到,必须由实验测定。相平衡研究的经典方法是首先测定少量的实验数据,然后选择合适的模型关联, 进而计算平衡曲线;这其中,最常用到的是状态方程法和活度系数法。 气液平衡数据实验测定方法有两类,即间接法和直接法。直接法中有静态法、流动法 和循环法等。其中以循环法应用最为广泛。若要测得准确的气液平衡数据,平衡釜的 选择是关键。现已采用的平衡釜形式有多种,且各有特点,应根据待测物系的特征, 选择适当的釜型。平衡釜的选择原则是易于建立平衡、样品用量少、平衡温度测定准确、气相中不夹带液滴、液相不返混及不易爆沸等。用常规的平衡釜测定平衡数据, 需样品量多,测定时间长。本实验用的小型平衡釜主要特点是釜外有真空夹套保温, 釜内液体和气体分别形成循环系统,可观察釜内的实验现象,且样品用量少,达到平 衡速度快。 以循环法测定气液平衡数据的平衡釜类型虽多,但基本原理相同,如图1所示。当体 系达到平衡时,两个容器的组成不随时间变化,这时从A和B两容器中取样分析,即 可得到一组平衡数据。
双液系的气液平衡相图
双液系的气-液平衡相图 1. 简述由实验绘制环己烷-乙醇气-液平衡T-x相图的基本原理。 答:通过测定不同沸点下组分的气、液相的折射率,在标准的工作曲线上找出该折射率对应的浓度,结合其沸点画出平衡相图。 2. 在双液系的气-液平衡相图实验中,作环己烷-乙醇的标准折光率-组成曲线的目的是什么? 答:作标准曲线的目的是通过测气、液相相得折射率从而在标准工作曲线上找出对应的浓度。 3. 用精馏的方法是否可把乙醇和环己烷混合液完全分离,为什么? 答:不能完全分离。因为环己烷-乙醇二组分具有最低恒沸点。 4. 测定纯环己烷和纯乙醇的沸点时,沸点仪中有水或其它物质行吗? 答:有水和其他物质都是不行的。因为有水和其他物质会使所测沸点改变。 5. 为什么工业上常生产95%酒精?只用精馏含水酒精的方法是否可能获得无水酒精? 答:因为水-乙醇二组分具有最低恒沸点,所以工业上常生产95%的酒精。用精馏的方法无法获得无水酒精,只能获得95%的酒精。 6. 在双液系的气-液平衡相图实验中,如何判断气-液相达平衡状态?
答:观察贝克曼温度计的读数,如果读数稳定3-5分钟,说明已达平衡状态。 7. 在双液系的气-液平衡相图实验中,每次加入沸点仪中的环己烷或乙醇是否应按记录表所规定的体积精确计量?为什么? 答:不需要按记录表的加。因为组分的浓度不是按所加物质的量计算得来的,而是通过测折射率间接得到的。 8. 在双液系的气-液平衡相图实验中,在测定沸点时,溶液出现分馏现象,将使绘出的相图图形发生什么变化? 答:出现馏分将使测得的沸点偏高,使相图向上移动。 9. 在双液系的气-液平衡相图实验中,蒸馏器中收集气相冷凝的小球大小对结果有何影响? 答:小球太小难以收集气相,小球太大,小球内的组分更新太慢,产生馏分,导致实验误差。 10. 在双液系的气-液平衡相图实验中,通过测定什么参数来测定双液系气-液平衡时气相和液相的组成? 答:通过测定组分的折射率来测定双液系气-液平衡时气相和液相的组成。 11. 在双液系的气-液平衡相图中,如何通过测定溶液的折光率来求得溶液的组成? 答:通过测得的折射率在标准曲线上找出对应的浓度,根据气、液相平衡浓度与测得的沸点作出平衡相图。
双液系的气—液平衡相图
双液系的气—液平衡相图 一、实验目的 1.绘制在Pθ环已烷—乙醇的气液平衡相图,了解相图和相律基本概念; 2.掌握测定双组分液体的沸点及正常沸点的方法; 3.掌握用折光率确定二元液体的组成方法。 二、实验原理 液体的沸点是指液体的蒸气压和外压相等时的温度,在一定的外压下,纯液体的沸点有确定值。但双液系的沸点不仅与外压有关,而且还与两种液体的相对含量有关。根据相律: 自由度=组分数-相数+2 因此,一个气—液共存的二组分体系,其自由度为2。只要任意再确定一个变量,整个体系的存在状态就可以用二维图形来描述。 两种挥发性液体混合,若该二组分的蒸气压不同,则溶液的组成与其平衡气相的组成不同。在压力保持一定,二组分系统气液达到平衡时,表示液态混合物的沸点与平衡时组成关系的相图,称为沸点和组成(T-x)图。沸点和组成(T-x)的关系有下列三种: (1)理想液体混合物或接近理想液体混合物的双液系,其液体混合物的沸点介于两纯物质沸点之间见图1(a); (2)各组分蒸气压对拉乌尔定律产生很大的负偏差,其溶液有最高恒沸点见图1(b); (3)各组分蒸气压对拉乌尔定律产生很大的正偏差,其溶液有最低恒沸点见图1(c)。 第(2)、(3)两类溶液在最高或最低恒沸点时的气液两相组成相同,加热蒸发的结果只使气相总量增加,气液相组成及溶液沸点保持不变,这时的温度称恒沸点,相应的组成称恒沸组成。
图1. 沸点和组成(T-x)图 本实验是测定具有最低恒沸点的环己烷—乙醇双液系的T-x图。方法是用沸点仪(如图2所示)直接测定一系列不同组成之溶液的气液平衡温度(即沸点),并收集少量馏出液(即气相冷凝液)及吸取少量溶液(即液相),分别用阿贝折光仪测定其折光率。根据已知组成的溶液折光率,作出一定温度下(25℃)该溶液的折光率—组成工作曲线,然后根据测得的样品溶液的气液两相的折光率,在此曲线上即可按描法得到待测未知样品溶液的组成。 图2. 沸点测定仪示意图 三、仪器与药品 沸点测定仪1只丙酮(分析纯) 水银温度计(50~100℃,分度值0.1℃)1支超级恒温水浴1台玻璃温度计(0~100℃,分度值1℃)1支称量瓶(高型)10只
二元液系相图实验报告
二元液系相图 一、实验目的 二、1、用沸点仪测定在常压下环己烷-乙醇的气液平衡相图。 三、2、了解沸点的测定方法。 四、3、掌握阿贝折射仪的测量原理及使用方法。 五、二、实验原理 六、1、液体的沸点是指液体的饱和蒸汽压和外压相等时的温度。在一定外压下,纯液体的沸点有确定的值。但对于完全互溶的双液系,沸点不仅与外压有关,而且还与双液系的组成有关。 七、 八、2、用阿贝折射仪测定气液组成的折光率,来获得气液组成。 三、实验装置
四、仪器及试剂 仪器:EF-03沸点测量仪、阿贝折射仪、沸点仪、取样管 试剂:无水乙醇、环己烷 五、实验步骤 1、安装好干燥的沸点仪。 2、加入纯乙醇30ml左右,盖好瓶塞,使电热丝浸入液体中,温度传感器与液面接触。
3、开冷凝水,将稳流电源调至(1.8-2.0A),接通电热丝,加热至沸腾,待数字温度计上读数恒定后,读下该温度值。 4、关闭电源,停止加热,将干燥的取样管自冷凝管上端插入冷凝液收集小槽中,取气相冷凝液样,迅速用阿贝折射仪测其折光率。 5、用干燥的小滴管取液相液样,用阿贝折射仪测其折光率。 6、分别在沸点仪中加入混合液,1、2、3、4、5、6重复上述操作。 7、根据环己烷-乙醇标准溶液的折射率,将上述数据转换成环己烷的摩尔分数,绘制相图。 8、实验完毕后,关闭冷凝水,关闭电源,整理实验台。 六、阿贝折光仪的使用 1、用擦镜纸将镜面擦干,取样管垂直向下将样品滴加在镜面上,注意不要有气泡,然后将上棱镜合上,关上旋钮。 2、打开遮光板,合上反射镜。 3、轻轻旋转目镜,使视野最清晰。 4、旋转刻度调节手轮(下手轮),使目镜中出现明暗面(中间有色散面),图a。
气液平衡-实验报告解读
化工专业实验报告 实验名称:二元气液平衡数据的测定 实验人员: 同组人 实验地点:天大化工技术实验中心 606 室 实验时间: 2015年4月20日下午14:00 年级: 2014硕;专业:工业催化;组号: 10(装置2);学号:指导教师:______赵老师________ 实验成绩:_____________________
一.实验目的 (1)测定苯-正庚烷二元体系在常压下的气液平衡数据; (2)通过实验了解平衡釜的结构,掌握气液平衡数据的测定方法和技能; (3)应用 Wilson 方程关联实验数据。 二.实验原理 气液平衡数据是化学工业发展新产品、开发新工艺、减少能耗、进行三废处理的重要基础数据之一。化工生产中的蒸馏和吸收等分离过程设备的改造与设计、挖潜与革新以及对最佳工艺条件的选择,都需要精确可靠的气液平衡数据。这是因为化工生产过程都要涉及相间的物质传递,故这种数据的重要性是显而易见的。 平衡数据实验测定方法有两类,即间接法和直接法。直接法中又有静态法、流动法和循环法等。其中循环法应用最为广泛。若要测得准确的气液平衡数据,平衡釜是关键。现已采用的平衡釜形式有多种,而且各有特点,应根据待测物系的特征,选择适当的釜型。用常规的平衡釜测定平衡数据,需样品量多,测定时间长。所以,本实验用的小型平衡釜主要特点是釜外有真空夹套保温,釜内液体和气体分别形成循环系统,可观察釜内的实验现象,且样品用量少,达到平衡速度快,因而实验时间短。 以循环法测定气液平衡数据的平衡釜类型虽多,但基本原理相同,如图 1 所示。当体系达到平衡时,两个容器的组成不随时间变化,这时从 A 和 B 两容器中取样分析,即可得到一组平衡数据。 图1 平衡法测定气液平衡原理图 当达到平衡时,除了两相的压力和温度分别相等外,每一组分的化学位也相等,即逸度相等,其热力学基本关系为:
双液系的气液平衡相图(物理化学实验)
双液系的气液平衡相图 实验者:林澄昱生04 2010030007 同组者:张弯弯 实验日期:2012-03-10 提交日期:2012-03-16 实验指导:刘晓惠 1引言 两种蒸气压不同的挥发性液体在混合之后,其溶液组成与与其平衡气相的组成不同。 在恒外压下,二组分系统达到气液平衡时,表示液态混合物的沸点与平衡时气液两相组成关系的相图,称为沸点和组成(T-x)图。大致分为三大类,包括: (1)理想液体混合物或接近理想液体混合物的双液系,其混合物沸点介于两纯物质沸点之间。见图1(a); (2)各组分蒸气压对拉乌尔定律产生很大的负偏差,有最高恒沸点。见图1(b); (3)各组分蒸汽压对拉乌尔定律产生很大的正偏差,有最低恒沸点。见图2(c)1。 图1 三类沸点组成(T-x)图 本实验为了绘制常压下环己烷-乙醇的气液平衡相图,先利用阿贝折射仪测定一系列已知组成混合溶液及纯液体的折射率,绘制标准曲线,再通过沸点仪测定一系列混合溶液的沸点,收集少量气相冷凝液以及溶液,测定其各自折射率,反查标准曲线得到气液两相的组成,绘得双液系的气液平衡相图。 2实验操作 2.1实验药品、仪器及测试装置示意图 2.1.1实验药品 环己烷,无水乙醇; 2.1.2实验仪器 沸点仪,调压器,温度传感器,锥形瓶,分析天平(AR2140),阿贝折射 仪(型号不明,为靠近恒温箱的一台),恒温箱,胶头滴管,10ml吸量管, 洗耳球; 2.1.3装置示意图
1. 冷却水入口 2. 气相冷凝液贮存小泡 3. 温度传感器 4. 喷嘴 5. 电热丝 6. 调压器2 图2 沸点仪 2.2实验条件 恒温槽温度:26 ℃ 室温:未测 气压:未测 2.3实验操作步骤及方法要点 2.3.1标准曲线的测定及绘制 2.3.1.1标准溶液的配制 取5个干燥、洁净的锥形瓶,编号为1~5,分别称量空瓶质量并记录;依照表1分别量取并加入相应体积的环己烷和无水乙醇,每加 入一种溶液以后称量其质量并记录;得到5份已知组分的标准溶液。 表1 标准溶液的配制方案 通过称量得到的质量,可以计算得到每锥形瓶中液体含有的环己烷质量分数,通过测定其折射率,可以确定特定环己烷质量分数与折 射率的关系;同时,直接量取纯的无水乙醇和环己烷,测定其折射率, 可以绘制在环己烷质量分数在0~1之间的无水乙醇混合溶液与折射率 的关系曲线。 2.3.1.2标准溶液折射率测定 (1)将阿贝折射仪与恒温箱相连,调节反光镜使目镜视野明亮,此 时仪器可以用来测量; (2)用胶头滴管加入待测溶液,在右目镜视野中观察,用右侧旋钮 调节色散程度,使明暗分界线清晰,再用左侧旋钮调节,使明 暗交界线处于叉丝中心。注意接下来实验过程中保证左侧旋钮
二元气液相平衡数据的测定
二元气液相平衡数据的测定 摘要:气液相平衡关系是精馏、吸收等单元操作的基础数据,随着化工生产的不断发展,现有气液相平衡数据远不能满足需求,许多物质的平衡数据,很难由理论直接计算得到,必须由实验测定。平衡数据实验测定方法以循环法应用最为广泛。本实验采用ellis 平衡釜,釜外具有真空夹套保温,可观察釜内的实验现象,在少量样品的情况下,能够迅速地测得平衡数据。 关键词:二元气液相平衡,循环法,苯,乙醇 abstract: gas liquid equilibrium relationship is distillation, absorption unit operation of basic data, with the continuous development of chemical production, the existing gas liquid equilibrium data far cannot satisfy the demand, many material balance data, it is difficult to directly obtained by theory, must by experimental determination. balance data experimental determination method to cycle method used the most widely. this experiment using ellis balance kettle, still outside with vacuum jacketed insulation, can be observed in the kettle experimental phenomenon, in a small amount of sample cases, can quickly measure balance data. keywords: two sap liquid balance, circulation method, stupid, ethanol
气液平衡
汽液平衡数据的测定 汽液平衡数据是最常用的化工基础数据。许多化工过程如精馏的设计、操作及过程控制等都离不开汽液平衡数据。有热力学研究方面,新的热力学模型的开发,各种热力学模型的比较筛选等也离不开大量精确的汽液平衡实测数据。现在,各类化工杂志每年都有大量的汽液平衡数据及汽液平衡测定研究的文章发表。所以汽液平衡数据的测定及研究深受化工界人士的重视 一、实验目的: 通过测定常压下乙醇—水二元系统汽液平衡数据的实验,使同学们了解、掌握汽液平衡数据测定的方法和技能,熟悉有关仪器的使用方法,将课本上学到的热力学理论知识与实际运用有机地联系在一起。从而既加深对理论知识的理解和掌握,又提高了动手的能力。 二、汽液平衡测定和种类: 由于汽液平衡体系的复杂性及汽液平衡测定技术的不断发展,汽液平衡测定也形成了特点各异的不同种类。 按压力分,有常减压汽液平衡和高压所液平衡测定。高压汽液平衡测定的技术相对比较复杂,难度较大。常减压汽液平衡测定则相对较易。 按形态分,有静态法和动态法。静态法技术相对要简单一些,而动态法测定的技术要复杂一些但测定较快较准。 在动态法里又有单循环法和双循环法。双循环法就是让汽相和液相都循环,而单循环只让其中一相(一般是汽相)循环。在一般情况下,常减压汽液平衡都采用双循环,而在高压所液平衡中,只让汽相强制循环。循环的好处是易于平衡、易于取样分析。 根据对温度及压力的控制情况,有等温法与等压法之分。一般,静态法采用等温测定,动态法的高压汽液平等多采用等温法。 总之汽液平衡系统特点各异,而测定的方法亦丰富多彩。 本实验采用的是常压下(等压)双循环法测定乙醇—水的汽液平衡数据。 三、实验原理: 以循环法测定汽液平衡数据的平衡釜有多种形式,但基本原理是一样的。如图书馆所示,当体系达到平衡时,A 和B 两容器中组成不随时间布景为化,这时从A 和B 两容器中取样分析可以得到一组汽液平衡实验数据。 根据下平衡原理,当所液两相达到相平衡时,汽液两相温度压力相等,同时任一组分在各相中的逸度相等,即: v L i i f f =)) 这里 v v i i i f y P =Φ)) 0 L i i i i f r x f =)) 对低压汽液平衡,其汽相可以视为理想气体混合物,即1v i Φ=) ,忽略压力对液体 逸度的影响,即0 i i f P =),从而得出低压下汽液平衡关系式: i i i i Py r x P = 式中 P ——体系压力(总压) i P ——纯组分i 在平衡温度下的饱合蒸汽压。
实验三元液液平衡数据的测定
实验三三元液-液平衡数据的实验测定 液-液平衡数据是液-液萃取塔设计及生产操作的主要依据,平衡数据的获得目前尚依赖于实验测定。在化学工业中,蒸馏、吸收过程的工艺和设备设计都需要准确的液-液平衡数据,此数据对提供最佳化的操作条件,减少能源消耗和降低成本等,都具有重要的意义。尽管有许多体系的平衡数据可以从资料中找到,但这往往是在特定温度和压力下的数据。随着科学的迅速发展,以及新产品,新工艺的开发,许多物系的平衡数据还未经前人测定过,这都需要通过实验测定以满足工程计算的需要。准确的平衡数据还是对这些模型的可靠性进行检验的重要依据。 一、实验目的 (1)?测定醋酸水醋酸乙烯在25℃下的液液平衡数据? (2)?用醋酸-水,醋酸-醋酸乙烯两对二元系的汽-液平衡数据以及醋酸-水二元系的液-液平衡数据,求得的活度系数关联式常数,并推算三元液-液平衡数据,与实验数据比较。? (3)?通过实验,了解三元系液液平衡数据测定方法掌握实验技能,学会三角形相图的绘制。? 二、实验原理 三元液液平衡数据的测定,有两不同的方法。一种方法是配置一定的三元混合物,在恒定温度下搅拌,充分接触,以达到两相平衡;然后静止分层,分别取出两相溶液分析其组成。这种方法可以直接测出平衡连接线数据,但分析常有困难。?另一种方法是先用浊点法测出三元系的溶解度曲线,并确定溶解度曲线上的组成与某一物性(如折光率、密度等)的关系,然后再测定相同温度下平衡接线数据。这时只需要根据已确定的曲线来决定两相的组成。对于醋酸-水-醋酸乙烯这个特定的三元系,由于分析醋酸最为方便,因此采用浊点法测定溶解度曲线,并按此三元溶解度数据,对水层以醋酸及醋酸乙烯为坐标进行标绘,画成曲线,以备测定结线时应用。然后配制一定的三元混合物,经搅拌,静止分层后,分别取出两相样品,?? O-Vac的三元相图示意?分析其中的醋酸含量,有溶解度曲线查出另一组图1?Hac-H 2 分的含量,并用减量法确定第三组分的含量。? 三、实验装置
实验四 三元液-液平衡数据的测定
实验四三元液-液平衡数据的测定 液-液平衡数据是液-液萃取塔设计及生产操作的主要依据,平衡数据的获得目前尚依赖于实验测定。 一、实验目的 (1)测定醋酸水醋酸乙烯在25℃下的液液平衡数据 (2)用醋酸-水,醋酸-醋酸乙烯两对二元系的汽-液平衡数据以及醋酸-水二元系的液-液平衡数据,求得的活度系数关联式常数,并推算三元液-液平衡数据,与实验数据比较。(3)通过实验,了解三元系液液平衡数据测定方法掌握实验技能,学会三角形相图的绘制。 二、实验原理 三元液液平衡数据的测定,有两不同的方法。一种方法是配置一定的三元混合物,在恒定温度下搅拌,充分接触,以达到两相平衡;然后静止分层,分别取出两相溶液分析其组成。这种方法可以直接测出平衡连接线数据,但分析常有困 难。 另一种方法是先用浊点法测出三元系的溶解度曲 线,并确定溶解度曲线上的组成与某一物性(如折光率、 密度等)的关系,然后再测定相同温度下平衡接线数据。 这时只需要根据已确定的曲线来决定两相的组成。对于 醋酸-水-醋酸乙烯这个特定的三元系,由于分析醋酸最 为方便,因此采用浊点法测定溶解度曲线,并按此三元 溶解度数据,对水层以醋酸及醋酸乙烯为坐标进行标 绘,画成曲线,以备测定结线时应用。然后配制一定的 三元混合物,经搅拌,静止分层后,分别取出两相样品,图1 Hac-H2O-Vac的三元相图示意分析其中的醋酸含量,有溶解度曲线查出另一组分的含量,并用减量法确定第三组分的含量。 三、预习与思考 (1)请指出图1溶液的总组成点在A,B,C,D,E点会出现什么现象? (2)何谓平衡联结线.有什么性质? (3)本实验通过怎样的操作达到液液平衡? (4)拟用浓度为0.1mol/L的NaOH定法测定实验系统共轭两相中醋酸组成的方法和计算式。 取样时应注意哪些事项,H2O及V Ac的组成如 何得到? 四、实验装置及流程 (1)木制恒温箱(其结构如图2所示)的作用原理是: 由电加热器加热并用风扇搅动气流,使箱内温度 均匀,温度有半导体温度计测量,并由恒温控制 器控制加热温度。实验前先接通电源进行加热, 使温度达到25℃,并保持恒温。 (2)实验仪器包括电光分析天平,具有侧口的 100mL三角磨口烧瓶及医用注射器等。
完全互溶双液系气液均衡相图的绘制
四川理工学院实验报告 系:材化系 课程名称:简明物理化学实验 日期:2011年4月18日 姓名 学号 实验室 528 专业 材料科学与工程 班号 2009级2班 老师鉴定 实验名称 完全互溶双液系气液平衡相图的绘制 成绩评定 一、实验目的 (1)测定常压下环已烷—乙醇二元系统的气液平衡数据,绘制沸点—组成相图;(2)掌握双组分沸点的测定方法,通过实验进一步理解分馏原理;(3)掌握阿贝折射仪的使用方法。二、实验原理 两种液体物质混合而成的两组分体系称为双液系。根据两组分间溶解度的不同,可分为完全互溶、部分互溶和完全不互溶3种情况。两种挥发性液体混合形成完全互溶体系时,如果该两组分的蒸气压不同,则混合物的组成与平衡时气相的组成不同。当压力保持一定,混合物沸点与两组分的相对含量有关。 恒定压力下,真实的完全互溶双液系的气—液平衡相图(图),根据体系对拉乌x T 尔定律的偏差情况,可分为3类: (1)一般偏差:混合物的沸点介于两种纯组分之间,如甲苯—苯体系 ,如图2.7(a ) 所示。 (2)最大负偏差:存在一个最小蒸气压值,比两个纯液体的蒸气压都小,混合物存在着最高沸点,如盐酸—水体系,如图2.7(b )所示。 (3)最大正偏差:存在一个最大蒸气压值,比两个纯液体的蒸气压都大,混合物存在着最低沸点,如正丙醇—水体系,如图2.7(c )所示。 B B B B (a) (b) (c) 图2.7 二组分真实液态混合物气—液平衡相图(T-x 图) 后两种情况为具有恒沸点的双液系相图。它们在最低或最高恒沸点时的气相和液相组成相同,因而不能像第一类那样通过反复蒸馏的方法而使双液系的两个组分相互分离,而只能采取精馏等方法分离出一种纯物质和另一种恒沸混合物。 为了绘制双液系的T-x 相图,需测定几组原始组成不同的双液系在气—液两相平衡后的沸点和液相、气相的平衡组成。 本实验以环已烷—乙醇为体系,该体系属于上述第3种类型。在沸点仪(如图2.8所示)中蒸馏不同组成的混合物,测定其沸点及相应的气、液二相的组成,即可作出T-x 相图。本实验中气液两相的组成均采用折光率法测定。 折光率是物质的一个特征数值,它与物质的浓度及温度有关,因此在测量物质的折光率
