鱼体内重金属含量的测定

鲅鱼体内重金属含量的测定
海产鱼类是人类所需蛋白质的主要来源之一,海洋鱼类长期生活在低浓度的微量元素水域中,伴随着海域的污染,日积月累,某些重元素将会在鱼体的组织器官中高度地积蓄。重金属就其是否生命新陈代谢中必需元素分为生命必需元素和非生命必需元素。鱼类在生存过程中,从水、食物及沉积物中吸收生命必需元素,与这些吸收途径相似,非生命必需元素也被鱼类吸收并积累在机体组织中,使原来供人们食用的鱼类可能成为浓缩毒物的载体,危及人类健康。
鱼体内重金属含量的测定实验采用原子吸收光谱进行测定。
一.试剂及标准溶液
1. 实验所用HNO3、H2O2 为优级纯,水为蒸馏水。
2. 标准溶液:用金属氧化物或盐类配成1.000mg·mL-1的Cu、Zn、Cd、Pb、Cr的标准储备液,用1%的HNO3稀释成不同浓度的标准溶液。
二.实验步骤
1. 实验所需用鲅鱼采自于农贸市场,测定前先用滤纸吸干鱼体表面的水分,再用医用剪刀分别取肌肉、内脏、肝脏、鳃、鳞、皮,再将同类解剖部分做用匀浆机匀浆。
2. 配制金属离子标准溶液:
金属离子标准溶液:用10ml移液管移取1mg/mL标准储备液至100mL容量瓶中,用去离子水稀释至刻度,摇匀,此溶液含金属离子100μg/mL,再取5mL100μg/mL的溶液于50mL容量瓶中,用去离子水稀释至刻度,摇匀,此溶液含金属离子10μg/mL。
3. 配制金属离子混合标准溶液:
分别在6个50mL容量瓶中加入10μg/mL的标准溶液0、2、4、6、8、10mL,加入2滴浓HNO3,用去离子水稀释至刻度,摇匀,此溶液的浓度分别为0、0.4、0.8、1.2、1.6、2.0μg/mL。
4. 微波消解: 准确称取预处理鱼样0.5g,置于聚四氟乙烯溶样杯中, 加入浓HNO3 10mL后,先用预处理加热仪加热处理,控制温度在100℃左右,消解至大量NO2棕色气体冒尽后,取下溶样杯再加入浓HNO3 2mL,H2O2 2mL,摇匀,装入消解罐中消解(分3档,即: 0.5MPa、1min;1.0 MPa、2min;1.5MPa、3min) 。
待冷却后开盖, 转移至100mL 容量瓶中, 摇匀后待测。
5. 测定标准溶液,绘制标准曲线
设定仪器参数和实验条件,优化好实验条件后,分别测定不同浓度的标准溶液的吸光度。
6. 试样溶液的分析
在与标准溶液的相同的测定条件下,测定试样溶液的吸光度。
7. 与标准相比,分析鱼中所含的重金属的含量是否超标。
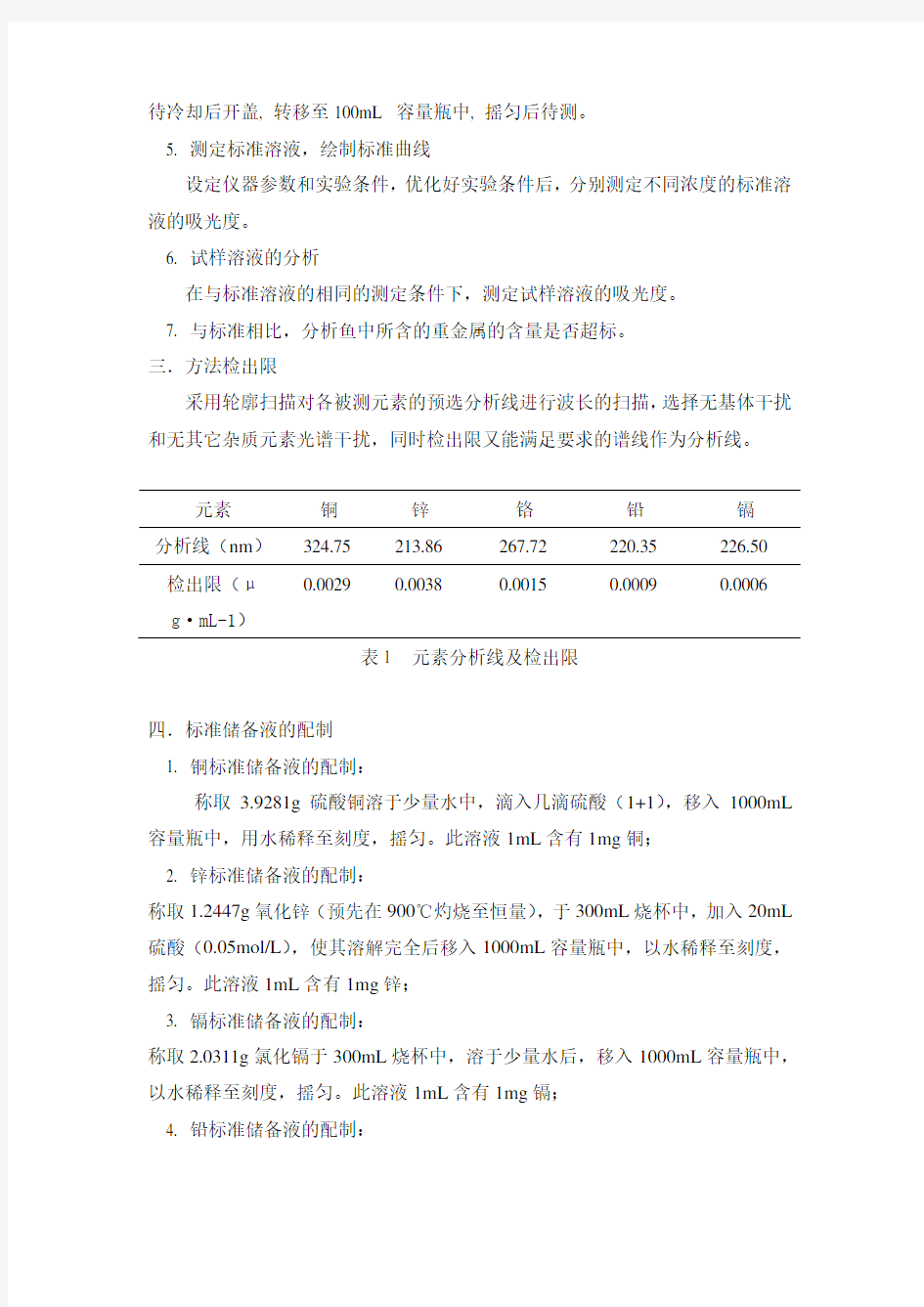
三.方法检出限
采用轮廓扫描对各被测元素的预选分析线进行波长的扫描,选择无基体干扰和无其它杂质元素光谱干扰,同时检出限又能满足要求的谱线作为分析线。
表1 元素分析线及检出限
四.标准储备液的配制
1. 铜标准储备液的配制:
称取3.9281g 硫酸铜溶于少量水中,滴入几滴硫酸(1+1),移入1000mL 容量瓶中,用水稀释至刻度,摇匀。此溶液1mL 含有1mg 铜;
2. 锌标准储备液的配制:
称取1.2447g 氧化锌(预先在900℃灼烧至恒量),于300mL 烧杯中,加入20mL 硫酸(0.05mol/L ),使其溶解完全后移入1000mL 容量瓶中,以水稀释至刻度,摇匀。此溶液1mL 含有1mg 锌;
3. 镉标准储备液的配制:
称取2.0311g 氯化镉于300mL 烧杯中,溶于少量水后,移入1000mL 容量瓶中,以水稀释至刻度,摇匀。此溶液1mL 含有1mg 镉;
4. 铅标准储备液的配制:
元素
铜 锌 铬 铅 镉 分析线(nm )
324.75 213.86 267.72 220.35 226.50 检出限(μ
g ·mL-1) 0.0029 0.0038 0.0015 0.0009 0.0006
精密称取0.1598g硝酸铅(优级纯),加10mL 1.0mol/L硝酸,全部溶解后,移入100mL容量瓶中,以水稀释至刻度,摇匀。此溶液1mL含有1mg铅;
5. 铬标准储备液的配制:
称取优级纯重铬酸钾(110℃烘2h)1.4135g溶于水中,定容至500mL,此溶液为含铬1.0mg/mL的标准储备液。
土壤重金属检测方法汇总
土壤重金属检测方法汇总 摘要:土壤重金属检测是土壤的常规监测项目之一。采用合理的土壤重金属检测方法,能快速有效地对土壤重金属检测和污染评价,并满足土壤的管理和决策需要。本文介绍了几种常用的土壤重金属检测方法,原子荧光光谱法,原子吸收光谱法,电感耦合等离子体发射光谱,激光诱导击穿光谱法和X射线荧光光谱,在介绍各个检测方法特性的同时,就灵敏度,测试范围,精确度,测试样品的数量等优缺点进行了对比。 关键词:土壤;重金属;检测方法 1. 前言 许多研究表明,种植物的质量安全与产地的土壤环境关系密切。重金属一般先进入土壤并积累,种植物通过根系从土壤中吸收,富集重金属,有时也通过叶片上的气孔从空气中吸收气态或尘态的重金属元素[1]。近几年,种植地因农药、肥料、生长素的大量施用及工业“三废”的污染,土壤重金属含量超标较严重且普遍,这不仅毒害土壤-植物系统,降低种植物品质,而且还会通过径流和淋洗作用污染地表水,尤其重要的是通过食物链的方式进入人体内,对于重金属的富集人体难以代谢,最终直接或间接危害人体器官的健康[2]。为此,解决这一难题,建设绿色食品和无公害食品生产基地,要求我们从土壤中的重金属检测分析抓起。本文介绍了土壤重金属的检测方法、并且对比各种方法优缺点。2.土壤中重金属检测方法 2.1 原子荧光光谱法 原子荧光光谱法是以原子在辐射能量分析的发射光谱分析法。利用激发光源发出的特征发射光照射一定浓度的待测元素的原子蒸气,使之产生原子荧光,在一定条件下,荧光强度与被测溶液中待测元素的浓度关系遵循Lambert-Beer定律[3],通过测定荧光的强度即可求出待测样品中该元素的含量。 原子荧光光谱法具有原子吸收和原子发射两种分析方法的优势[4],并且克服了这2种方法在某些地方的不足。该法的优点是灵敏度高,目前已有20多种元素的检出限优于原子吸收光谱法和原子发射光谱法;谱线简单;在低浓度时校准曲线的线性范围宽达3~5个数量级,特别是用激光做激发光源时更佳,但其存在荧光淬灭效应,散射光干扰等问题[5]。该方法主要用于金属元素的测定,在环境科学、高纯物质、矿物、水质监控、生物制品和医学分析等方面有广泛的应用[6]。突出在土壤中的应用如何,以下各方法均是这个问题,相比之下2.5写的比较好
水质重金属检测
分析仪器名词:可跟踪链接拓展知识 ?定性分析?定量分析?常量分析?微量分析?痕量分析 ?分析仪器?电化学[式]分析仪器?光学[式]分析仪器?热学[式]分析仪器?质谱仪器 ?波谱仪器?能谱和射线分析仪器?物性分析仪器?pH值?电导 ?电导率?电池常数?当量电导?标准电极电位?电极电位 ?极谱图?电化学分析法?电容量分析法?电导分析法?电量分析法?电位法?伏安法?极谱法?滴定?电泳法 ?电重量分析法?电导[式]分析器?电量[式]分析器?电位[式]分析器?溶解氧分析器重金属: 重金属有许多种不同的定义,常见的一种定义是密度大于5 g/cm3 的金属,大多数金属 都是重金属。主要是指对生物有明显毒性的重金属元素,如汞、镉、铅、铬、锌、铜、钴、 镍、锡、钡等。有时也会将一些有明显毒性的轻金属元素及非金属元素列入:如砷、铍、锂 与铝。尽管锰、铜、锌等重金属是生命活动所需要的微量元素,但是大部分重金属如汞、铅、 镉等并非生命活动所必须,而且所有重金属超过一定浓度都对人体有毒。 重金属污染主要是指:由于采矿、冶炼、制造产品、排放废水废气、处置固 体废物、利用污水进行灌溉和使用重金属制品的过程中,重金属或者其化合物给 自然环境或者人体带来的损害。 对什么是重金属,目前尚没有严格的统一定义,从环境污染方面所说的重金属,实际上 主要是指汞、镉、铅、铬、砷等金属或类金属,也指具有一定毒性的一般重金属,如铜、锌、 镍、钴、锡等。 我们从自然性、毒性、活性和持久性、生物可分解性、生物累积性,对生物体作用的加 和性等几个方面对重金属的危害稍作论述。 (一)自然性: 长期生活在自然环境中的人类,对于自然物质有较强的适应能力。有人分析了人体中60多 种常见元素的分布规律,发现其中绝大多数元素在人体血液中的百分含量与它们在地壳中的 百分含量极为相似。但是,人类对人工合成的化学物质,其耐受力则要小得多。所以区别污 染物的自然或人工属性,有助于估计它们对人类的危害程度。铅、镉、汞、砷等重金属,是 由于工业活动的发展,引起在人类周围环境中的富集,通过大气、水、食品等进入人体,在 人体某些器官内积累,造成慢性中毒,危害人体健康。 (二)毒性: 决定污染物毒性强弱的主要因素是其物质性质、含量和存在形态。例如铬有二价、三价和六 价三种形式,其中六价铬的毒性很强,而三价铬是人体新陈代谢的重要元素之一。在天然水 体中一般重金属产生毒性的范围大约在1~10mg/L之间,而汞,镉等产生毒性的范围在 0.01~0.001mg/L之间。 (三)时空分布性: 污染物进入环境后,随着水和空气的流动,被稀释扩散,可能造成点源到面源更大范围的污 染,而且在不同空间的位置上,污染物的浓度和强度分布随着时间的变化而不同。 (四)活性和持久性: 活性和持久性表明污染物在环境中的稳定程度。活性高的污染物质,在环境中或在处理过程
土壤中重金属的测定
实验题目土壤中Cu的污染分析实验 一、实验目的与要求 一、实验目的与要求 (1)了解重金属Cu对生物的危害及其迁移影响因素。 (2)了解重金属Cu的污染及迁移影响因素。 (3)掌握土壤消解及其前处理技术。 (4)掌握原子吸收分析土壤中金属元素的方法。 (5)掌握土壤中Cu污染评价方法。 二、实验方案 1.仪器 原子吸收分光光度计 电热板 量筒100mL 烧杯(聚四氟乙烯) 吸量管、50mL比色管、电子天秤 2.试剂 浓硝酸GR、浓盐酸GR、氢氟酸GR、浓高氯酸GR Cu标准储备液、Cu的使用液 3.实验步骤 (1)三份待测土样,约0.5g分别置于3个聚四氟乙烯烧杯; (2)向烧杯加入2ml蒸馏水湿润土样后,再加入10ml HCl并在电热板上加热至近干; (3)往烧杯中加入10ml HNO3,置于电热板上加热至近干; (4)往烧杯中加入5mlHF,置于电热板上加热至近干; (5)往烧杯中加入5mLHClO4,于电热板上加热至冒白烟时取下冷却; (6)取3支50ml具塞比色管,分别向管中加入2mlHNO3,分别对应加入冷却好的消解土样后,再加水稀释至刻度线; (7)如果溶液比较混浊,则要过滤再进行测定。
(8) AAS测定。 三、实验结果与数据处理 Cu标准溶液曲线 各个区域土壤中Cu的含量 mg/kg 教学区 1 2 3 4 5 6 7 8 实(1-2)2 实(1-2)4 实(2-3)1 工(3-4)3 教1 教2 教5 图1 17.83 13.01 24.78 8.56 16.76 6.30 12.49 7.09 生活区 1 2 3 4 5 6 东1 东2 东12 东14 二饭教寓5.49 19.27 6.20 2.11 13.70 16.18 其他区 1 2 3 4 5 6 7 8 行山3 行山4 行山5 体1 体4 南商1 南商4 中心湖1 15.96 7.75 9.93 9.65 8.46 16.80 9.47 9.30 外环区 1 2 3 4 5 6 7 8 外1 外2 外6 外4 公4 公10 农田2 农田4 14.80 14.13 15.53 12.41 59.07 10.88 10.46 24.24 四、结论 1.数据可靠性评价 由图可知标准曲线的相关系数均为R2=0.9995,可知在数据处理的过程中,由标准溶液产生的误差是可忽略不计的。但是本次实验,人为的误差相 当大,在整个实验过程中发现,有好几个组的几个样品都已经蒸干了,这已
环境化学实验(讲义)
环境化学实验(讲义) 课程英文名称:The e xperiment of Environmental Chemistry 课程总学时:17总学分:0.5 推荐使用教材:自编 一、课程教学目标与基本要求: 《环境化学实验》包括环境分析化学、环境污染化学和污染控制化学三部分内容,重点是环境污染化学部分,着重探讨污染物来源及其在环境介质中的存在形态、浓度水平和迁移、转化与降解等环境行为及其影响因素等。通过《环境化学实验》课程的学习,深化《环境化学》课程讲授的基本知识,促进对环境化学领域研究动态及前沿的理解,掌握研究环境化学问题的基本方法和手段,提高实验数据科学分析能力和实验技能,使学生具备初步的独立科研能力。 二、相关教学环节安排 整个教学环节分为“基础实验”和“综合实验”两个部分,增加了以独立科研能力培养为目标的“综合实验”环节。在此环节中,教师设计了多个研究题目供学生参考选择,要求学生在查阅文献的基础上,写出开题报告,并在教师的配合下自行设计实验方案、自行准备实验所需的材料。在研究过程中,实验室(包括仪器设备)向学生开放,在教师的配合下,学生自主进行实验活动。在学期末,学生应完成一篇符合规范的研究论文。 三、课程的主要内容及学时分配 第一部分基础实验 1、有机物的正辛醇—水分配系数5学时 第二部分综合实验 2、水中重金属的污染评价6学时 3、海洋沉积物中砷的污染分析6学时 四、考试要求 依据平时实验进行情况进行考查(包括预习和知识准备情况、实验过程中操作动手能力及判断和解决问题能力、对实验得到的数据结果进行科学思考能力、实验报告的写作水平等)。 五、学习参考书: 1、环境化学实验.董德明,朱利中主编.北京:高等教育出版社,2002. 2、环境化学实验.康春莉,徐自力和冯小凡主编.长春:吉林大学出版社,2000. 3、环境化学实验.孔令仁主编.南京:南京大学出版社,1990. 4、土壤农业化学分析方法.鲁如坤主编.中国农业科技出版社,2000. 实验一有机物的正辛醇—水分配系数
水样中各种重金属的测定
水样中各种重金属的测定方法 1铜、锌、铅、镉的测定火焰原子吸收法(水和废水监测分析方法第四版增补版pp.325-326) 本法适用于测定地下水、地表水、和废水中的铅锌铜镉。 仪器:原子吸收分光光度计 试剂:硝酸,优级纯;高氯酸,优级纯;去离子水; 金属标准储备液:准确称取经稀酸清洗并干燥后的0.5000g光谱重金属,用50ml(1+1)硝酸溶解,必要时加热直至溶解完全。用水稀释至500.0ml,此溶液每毫升含1.00mg金属。 混合标准容液:用0.2%硝酸稀释金属标准储备液配制而成,使配成的混合标准溶液每毫升含镉、铜、铅和锌分别为10.0、50.0、100.0、和10.0μg。 步骤 (1)样品预处理 取100ml水样放入200ml烧杯中,加入硝酸5ml,在电热板上加热消解(不要沸腾)。蒸至10ml左右,加入5ml硝酸和高氯酸2ml,再次蒸至1ml左右。取下冷却,加水溶解残渣,用水定容至100ml。 取0.2%硝酸100ml,按上述相同的程序操作,以此为空白值。(2)样品测定 据表1所列参数选择分析线和调节火焰。仪器用0.2%硝酸调零。吸入空白样和试样,测量其吸光度。扣除空白样吸光度后,从校准曲线上查出试样中的金属浓度。如可能,也从仪器中直接读出试样中的
金属浓度。 表1 元素分析线波长(nm)火焰类型本法测定范围(mg/L)镉228.8 乙炔-空气,氧化型0.05~1 铜324.7 乙炔-空气,氧化型0.05~5 铅283.3 乙炔-空气,氧化型0.2~10 锌213.8 乙炔-空气,氧化型0.05~1 (3)标准曲线 吸取混合标准溶液0, 0.50,1.00, 3.00,5.00和10.00ml,分别放入六个100ml容量瓶中,用0.2%硝酸稀释定容。此混合标准系列各重金属的浓度见表2。接着按样品测定的步骤测量吸光度,用经空白校正的各标准的吸光度对相应的浓度作图,绘制标准曲线。 表2 混合标准使用溶液体积 (ml) 0 0.50 1.00 3.00 5.00 10.00 标准系列各重金属浓度(mg/L)镉0 0.05 0.10 0.30 0.50 1.00 铜0 0.25 0.50 1.50 2.50 5.00 铅0 0.50 1.00 3.00 5.00 10.00 锌0 0.05 0.10 0.30 0.50 1.00 注:定容体积100ml 计算 被测金属(mg/L)= v m 式中:m—从校准曲线上查出或仪器直接读出的被测金属量(μg);
三种土壤重金属快速检测仪的检测原理及方法
三种土壤重金属快速检测仪的检测原理及方法 土壤重金属污染目前是我国面临非常严峻的问题,所以市场上检测土壤重金属仪器层出不穷。 测量土壤重金属目前主要是有下面几种方法: 1、原子吸收光谱法 这种方法是相对比较传统的测量重金属的方法,先将土壤风干,再经过消解处理、定容,之后制备标准溶液,之后上机操作测量。测量原理是利用待测元素的共振辐射,通过其原子蒸汽,测定其吸光度;它有单光束,双光束,双波道,多波道等结构形式。其基本结构包括光源,原子化器,光学系统和检测系统。这种原理测出来相对精度较高,只是测量的时间上相对过长,通常整个过程需要24小时出结果。 2、伏安极谱法 这种方法也是先将土壤风干,再经过消解处理,然后将浸提液放入极谱仪中,直接测量。其原理是通过将一个变化的电压信号施加到电极上,而后测量电极的响应电流来测量重金属的含量,这种方法与原子吸收光谱法相比,测量精度更高,运行成本低,可以做形态分析等。 3、X射线荧光光谱法 X射线荧光光谱分析法利用初级X射线光子或其他微观离子激发待测物质中的原子,使之产生荧光(次级X射线)而进行物质成分分析和化学态研究的方法。这种方式测量土壤重金属无需将土壤进行前处理,测量速度快,精度也能达到ppm 级。非常适合拿到野外走哪儿测哪儿,测量结果还能保存,有些还可以进行GPS 定位,记录什么地方土壤测量的结果是多少。并且测量时不存在任何耗材,无需任何使用成本。目前做的比较好的品牌有托普云农的土壤重金属快速检测仪,设备小巧,配有专门分析土壤模块,所以相对测量精度高。非常适合野外快速测量土壤重金属。 以上介绍的这些测量土壤重金属的方法都是目前市场上相对成熟的测量土壤重金属的方法,也是比较常规的方法。可以根据自己的需要选择合适的土壤重金属检测仪。 仪器名称:托普云农土壤重金属快速检测仪仪器型号:TPJS-B 金属检测仪、便携式重金属检测仪
水质中重金属危害及其检测方法
水质中重金属危害及其检测方法 水质中重金属危害及其检测方法 【摘要】本文概述了水中重金属的危害和测定重金属的常规方法 【关键词】水质;重金属;检测方法 水是人类的生命之源,在没有人为污染的情况,水中的重金属的含量取决于水与土壤、岩石的相互作用,其值一般很低,不会对人体健康造成危害。但随着工业的发展,工矿业废水、生活污水等未经适当处理即向外排放,污染了土壤,废弃物堆放场受流水作用以及富含重金属的大气沉降物输入,都使水中重金属含量急剧升高,导致水受到重金属污染。重金属通过直接饮水、食用被污水灌溉过的蔬菜、粮食等途径,很容易进入人体内,威胁人体健康。 一、重金属的危害 重金属是指密度4.0以上约60种元素或者是密度在5.0以上的45种元素,其中砷、硒是非金属,但是由于它的毒性及其某些性质与重金属非常相似,所以将砷、硒也列入重金属污染物范围内,在环境污染方面所说的重金属更注重它的毒性对生态的危害,主要是指生物毒性显著的汞、镉、铅、铬以及类金属砷,还包括同样具有毒性的重金属锌、铜、钴、镍、锡、钒等污染物。 随着现代工农业的发展,重金属污染问题日趋严重。重金属污染,不同与其它类型污染,具有隐蔽性、长期性和不可逆转性等特点。重金属既可以直接进入大气、水体和土壤,造成各类环境要素的直接污染;也可以在大气、水体和土壤中相互迁移,造成各类环境要素的间接污染。由于重金属不能被微生物降解,在环境中只能发生各种形态之间的相互转化,所以,重金属污染的消除往往更为困难,对生物引起的影响和危害也是人们更为关注的问题。 二、重金属的测定 我国《生活饮用水卫生标准》和《污水综合排放标准》分别对生活饮用水中重金属元素的含量和污水中重金属元素的最高容许排放
水中重金属离子的测定
一、实验目的与要求 1、掌握水的前处理和消解技术。 2、了解水中重金属的测定方法,掌握原子吸收分光光度计的测定技术。 3、了解利用AAS测定水的硬度和测定废水中SO42+。 4、了解水中重金属的种类、危害及有关知识,掌握水中重金属污染分析与评价的方法。 5、掌握水样的处理方法技术,并小结以前的处理方法。通过测定水中Cr、Pb 的含量分析所取水样的污染程度 二、实验方案 1、原理 (1)火焰原子吸收光度法是根据某元素的基态原子对该元素的特征谱线产生选择性吸收来进行测定的分析方法。将试样溶液喷入空气乙炔火焰中,被测的元素化合物在火焰中离解形成原子蒸汽,由锐线光源(元素灯)发射的某元素的特征普线光辐射通过原子蒸汽层的时候,该元素的基态原子对特征普线产生选择性吸收。在一定的条件下,特征普线与被测元素的浓度成正比。通过测定基态原子对选定吸收线的吸光度,确定试样中元素的浓度。 原子吸收法具有很高的灵敏度。每种元素都具有自己为数不多的特征吸收普线,不同元素的测定采用相应的元素灯,因此普线干扰在原子吸收光度法中是少见的。影响原子吸收光度法准确度的主要是基体的化学干扰。由于试样和标准溶液的基体不一样,试样中存在的某种基体常常影响被测元素的原子化效率,如在火焰中形成难离解的化合物,这时就会发生干扰作用。一般说来Cu,Zn,Pb,Cd的基体干扰不是很严重。 (2)干扰及消除。共存元素的干扰受火焰状态和观测高度的影响很大,在实验的时候应该特别注意。因为铬的化合物在火焰中易生成难以熔融和原子化的氧化物,因此一般在试液中加入适量的助熔剂和干扰元素的抑制剂,如NH4Cl(K2S2O7,NH4F,NH4ClO2)。加入NH4Cl可以增加火焰中的氯离子,使铬生成易于挥发和原子化的氯化物,而且NH4Cl还可以抑制Fe,Co,Ni,V,Al,Pb,Mg的干扰。(3)适用范围。本方法可以适用于地表水和废水中总铬的测定,用空气-乙炔火焰的最佳定量分析范围是0.1-5mg/L。最低检测限是0.03mg/L。
蔬菜中重金属含量测定
华南师范大学实验报告 学生姓名学号 专业)年级、班级 课程名称仪器分析实验实验项目蔬菜中重金属(Pb、Cd)含量的测定实验类型□验证□设计□综合实验时间 2011年月日 √ 实验指导老师实验评分 实验题目:蔬菜中重金属(Pb、Cd)含量的测定 引言: 蔬菜中含有丰富的维生素、矿质元素和膳食纤维等多种营养成分,是人们日常生活中必不可少的食物,但随着工业化进程,工业“三废”的排放、农药、化肥的不合理使用等,严重污染了水、土、气,致使菜区生态环境日益恶化,造成蔬菜品质下降,污染物积累,并通过食物链的传递放大作用,从而对整个生态环境以及人类健康带来极大危害。因此对蔬菜中的重金属铅、镉研究具有极大的现实意义。 经查阅文献,发现目前有关铅、镉的测定方法主要有以下几种: 一、光化学法 1、光度法:如国家标准中第三标准法双硫腙比色法测食品中铅含量。它主要是利用PH=8.5~9.0 时,硫离子与双硫腙生成红色配合物,溶于三氯甲烷,加入柠檬酸铵,氰化钾与盐 酸羟铵等,防止铁、铜、锌等杂质离子的干扰,与标准系列比较定量。国际中测镉 的第三法则是用在碱性溶液中镉离子与6-溴苯并噻唑偶氮萘酚形成红色络合物,溶 于三氯甲烷,氰化钾等剧毒物质。因此应用有一定局限性。 2、原子荧光光谱法:准确配制铅镉系列的标准溶液,在实验工作条件下,测定这两个元素的荧光 强度,得到线性回归方程,再将待测样品的荧光强度代入方程即可得到样品 中铅镉浓度。该法快速、简便、准确且灵敏度高。 3、石墨炉原子吸收光谱法:分别准确量取一定量的铅镉储备液,配置一系列标准溶液后按所选工 作仪器条件用原子吸收分光光度计测出各溶液吸光度并制作A-C标准曲线,得出其一元线 性回归方程。再测出一定量试样溶液吸光度,代入回归方程中即可得到铅镉含量。 4、火焰原子吸收法(标准加入法):分别移取适量样品于容量瓶中,分别加入一系列不同体积相同 浓度的铅镉标准溶液,用盐酸定容。使用空气-乙炔火焰,于原子吸收光谱仪波长 283.30nm,228.85nm处分别测量铅镉的吸光度,以标准系列浓度为横坐标,以扣除空白溶 液的吸光度值为纵坐标作图,根据所绘制的直线外延与横轴的交点求出铅镉元素浓度。 5、电感耦合等离子体质谱法(ICP-MS)法:精密吸取铅镉标准储备溶液,用稀硝酸稀释配成含铅
土壤重金属分析仪的操作方法
土壤重金属分析仪的操作方法 食品、土壤、水质逐渐被工业废气、废水、废渣所污染,甚至有些人直接用工业废水浇灌庄稼,造成土壤耕作层内的镉、铜、砷、铬、汞、镍、铁、铝、锌、锰、铜等重金属大量富积、积累,特别是城市郊区现象更为严重;加上大量使用无机化学农药等致使蔬菜和鱼类体内的重金属含量严重超标的情况,不断在人体内积累,导致消费者重金属慢性中毒现象发生,国内已发生多起重金属集体中毒事件,已引起政府的高度重视和社会各界的广泛关注,但是当前重金属测定方法测定速度慢、步骤繁琐且仪器昂贵。基于这种形势,托普云农开发出了重金属快速测定方法,可对蔬菜、食品、土壤、有机肥、烟叶等样品中的铅、砷、铬、镉、汞等进行快速联合测定。 一、土壤重金属分析仪检测原理: (一)样品经消化后,所有形态的重金属(包括砷、铅、镉、铬、汞、镍、铁、铝、锌、锰、铜等)都转化为离子型态,加入相关检测试剂后显色,在一定浓度范围内溶液颜色的深浅与重金属的含量呈比例关系,服从朗伯--比尔定律,再通过仪器进行测定得出含量值,与国家标准农产品安全质量无公害蔬菜安全要求允许限量的标准进行比较,来判断蔬菜样品重金属含量。
(二)各项重金属的检测原理及采用标准 1、重金属砷的检测原理及采用标准 采用国家标准(GB/T5009.11-2003)硼氢化物还原比色法,即样品经消化后,加入碘化钾-硫脲并加热,将五价砷还原为三价砷,在酸性条件下硼氢化钾将三价砷还原为负三价,形成砷化氢导入吸收液中呈黄色,经仪器检测得出砷含量。 2、重金属铅的检测原理及采用标准 采用国家标准(GB/T5009.12-2003)二硫腙比色法,即样品经消化后,在弱碱性条件下,铅离子与二硫腙生成红色络合物,溶于三氯甲烷后,比色测定。 3、重金属铬的检测原理及采用标准 样品经消化后,在二价锰存在条件下,铬离子与二苯碳酰二肼反应生成紫红色络合物,络合物颜色的深浅与六价铬含量呈正比,比色测定可得出铬含量。 4、重金属镉的检测原理及采用标准 采用国家标准(GB/T5009.15-2003)比色法,即样品经消化后,在碱性条件下,镉离子与6-溴苯丙噻唑偶氮萘酚生成红色络合物,溶于三氯甲烷后,比色测定。 5、重金属汞的检测原理及采用标准 采用国家标准(GB/T5009.17-2003)二硫腙比色法,即样品经消化后,在酸性条件下,汞离子与二硫腙生成橙红色络合物,溶于三氯甲烷后,比色测定。 现场测试
水样各种重金属的测定
水样各种重金属的测定 1铜、锌、铅、镉的测定火焰原子吸收法(水和废水监测分析方法第四版增补版pp.325-326) 本法适用于测定地下水、地表水、和废水中的铅锌铜镉。 仪器:原子吸收分光光度计 试剂:硝酸,优级纯;高氯酸,优级纯;去离子水; 金属标准储备液:准确称取经稀酸清洗并干燥后的0.5000g光谱重金属,用50ml(1+1)硝酸溶解,必要时加热直至溶解完全。用水稀释至500.0ml,此溶液每毫升含1.00mg金属。 混合标准容液:用0.2%硝酸稀释金属标准储备液配制而成,使配成的混合标准溶液每毫升含镉、铜、铅和锌分别为10.0、50.0、100.0、和10.0μg。 步骤 (1)样品预处理 取100ml水样放入200ml烧杯中,加入硝酸5ml,在电热板上加热消解(不要沸腾)。蒸至10ml左右,加入5ml硝酸和高氯酸2ml,再次蒸至1ml左右。取下冷却,加水溶解残渣,用水定容至100ml。 取0.2%硝酸100ml,按上述相同的程序操作,以此为空白值。(2)样品测定 据表1所列参数选择分析线和调节火焰。仪器用0.2%硝酸调零。吸入空白样和试样,测量其吸光度。扣除空白样吸光度后,从校准曲线上查出试样中的金属浓度。如可能,也从仪器中直接读出试样中的
金属浓度。 表1 元素分析线波长(nm)火焰类型本法测定范围(mg/L)镉228.8 乙炔-空气,氧化型0.05~1 铜324.7 乙炔-空气,氧化型0.05~5 铅283.3 乙炔-空气,氧化型0.2~10 锌213.8 乙炔-空气,氧化型0.05~1 (3)标准曲线 吸取混合标准溶液0, 0.50,1.00, 3.00,5.00和10.00ml,分别放入六个100ml容量瓶中,用0.2%硝酸稀释定容。此混合标准系列各重金属的浓度见表2。接着按样品测定的步骤测量吸光度,用经空白校正的各标准的吸光度对相应的浓度作图,绘制标准曲线。 表2 混合标准使用溶液体积 (ml) 0 0.50 1.00 3.00 5.00 10.00 标准系列各重金属浓度(mg/L)镉0 0.05 0.10 0.30 0.50 1.00 铜0 0.25 0.50 1.50 2.50 5.00 铅0 0.50 1.00 3.00 5.00 10.00 锌0 0.05 0.10 0.30 0.50 1.00 注:定容体积100ml 计算 被测金属(mg/L)= v m 式中:m—从校准曲线上查出或仪器直接读出的被测金属量(μg);
水中重金属实验报告
《环境化学实验》报告 实验考核标准及得分
题目:水中重金属的污染评价 一、实验目的与要求 1、了解水中重金属的消解与测定方法。 2、掌握原子吸收分光光度计分析技术。 3、了解水体的重金属污染状况,制定相应的污染控制对策 二、实验方案 1、实验原理: 环境污染方面所说的重金属,实际上主要是指汞、镉、铅、铬、砷等金属或类金属,也指具有一定毒性的一般重金属,如铜、锌、镍、钴、锡等。常用火焰原子吸收光度法测定试样中元素的浓度来测重金属浓度。原子吸收光度法是根据物质产生的原子蒸气对特定波长的光的吸收作用来进行定量分析的。元素的气态基态原子外层的电子可以吸收与其发射波长相同的特征谱线。当光源发射的某一特征波长的光通过原子蒸气时,原子中的外层电子将选择性地吸收该元素所能发射的特征波长的谱线,这时,透过原子蒸气的入射光将减弱,其减弱的程度与蒸气中该元素的浓度成正比,吸光度符合吸收定律: A=lg(I0 / I)=KcL 根据这一关系可以用工作曲线法或标准加入法来测定未知溶液中某元素的含量。 原子吸收光度法具有较高的灵敏度。每种元素都有自己为数不多的特征吸收谱线,不同元素的测定采用相应的元素灯,因此,谱线干扰在原子吸收光度法中是少见的。影响原子吸收光度法准确度的主要是基体的化学干扰。由于试样和标准溶液整体的不一致,试样中存在的某些基体常常影响被测元素的原子化效率,如在火焰中形成难于离解的化合物或使离解生成的原子很快重新形成在该火焰温度下不再离解的化合物,这时就发生干扰作用。一般来说,铜、铅、锌、镉的基体干扰不太严重。 2、实验仪器: 3个250mL烧杯、AAS、电热板、100mL比色管 3、试剂 (1)浓硝酸:优级纯 (2)3mol/L盐酸:优级纯 (3)双氧水 (4)10%氯化铵溶液 4、实验步骤 (1)各取3组废水水样50mL放入烧杯中,加入浓硝酸5mL,在电热板上加热消解 (2)蒸至剩余40mL左右,加入5mL浓硝酸和2mL双氧水,继续于电热板上加热消解 (3)蒸至剩余30mL左右,加入2mL10%的氯化铵和10mL 3mol/L的HCl,取下来冷却,待冷却后,装入比色管中,定容到100mL,若溶液比较混浊,则先过滤再测。 (4)用AAS测定并记录数据结果 三、实验结果与数据处理
土壤中重金属全量测定方法
精心整理 精心整理 版本1: 土壤中铜锌镉铬镍铅六中重金属全量一次消解测定方法.用氢氟酸-高氯酸-硝酸消解法,国家标准物质检测值和标准值吻合性很好,方便可行.具体方法: 准确称取0.5克土壤样品(过0.15mm 筛)于四氟坩埚中,加7毫升硝酸+3毫升高氯酸+10毫升氢氟酸加盖,放置过夜(不过夜效果同),电热板上高温档加热(数显的控制温度300~350度)1小时,去盖,加热到近干,冷却到常温,然后再加3毫升硝酸+2毫升盐酸溶题,版本1) 2) 3) 4) 5) 6) 附: 现在一般做法是,砷汞用1+1的王水在沸水煮2小时,加固定剂(含5g/l 重铬酸钾的5%硝酸溶液),在50毫升比色管中,固定,然后用原子荧光光谱仪测定砷汞. 1 土壤消化(王水+HClO 4法) 称取风干土壤(过100目筛)0.1 g (精确到0.0001 g )于消化管中,加数滴水湿润,再加入3 ml HCl 和1 ml HNO 3(或加入配好的王水4~5mL ),盖上小漏斗置于通风橱中浸泡过夜。第二天放入消化炉中,80~90℃消解30 min 、100~110℃消解30 min 、120~130℃消解1 h ,取下置于通风处冷却。
精心整理 加入1 ml HClO4于100~110℃条件下继续消解30 min,120~130℃消解1 h。冷却,转移至20mL容量瓶中,定容,过滤至样品存储瓶中待测。 注:最高温度不可超过130℃。消化管底部只残留少许浅黄色或白色固体残渣时,说明消化已完全。如果还有较多土壤色固体存在,说明消化未完全,应继续120~130℃消化直至完全。 2植物消化(HNO3+H2O2法) 称取待测植物1~2g(具体根据该植物对重金属吸收能力的强弱而定)于消化管中,加入5ml HNO3,盖上小漏斗置于通风橱中浸泡过夜。第二天放入消化炉中,80~90℃消解30 min、100~110℃消解30 min、120~130℃消解1 h,取下置于通风处冷却。加入1 ml H2O2,于100~110℃条件下继续消解30 min,120~130℃消解1 h。冷却,转移至20mL容量瓶中,定容,过滤至样品存储瓶中待测。 精心整理
水体中重金属污染实例
水体中重金属污染实例 1 引言 20世纪70年代以来快速发展的环境磁学,由于其测量简便、快速、经济和无破坏性的特点,被广泛应用于地球科学和环境科学领域.近年来,国内外许多学者利用环境磁学手段对湖泊、河 口和海洋沉积物、城市和交通道路土壤、大气悬浮物及降尘、植物等进行了表征,并探讨了其在 指示重金属、有机化合物污染方面的应用.不少研究发现,在受工业、交通排放显著影响的城市 土壤、大气悬浮颗粒物和降尘中,重金属污染与磁性特征具有显著相关关系,其机制在于工业活动、燃料燃烧、汽车尾气等排放的颗粒污染物中,往往含有亚铁磁性矿物(如Fe3O4),因而利用 磁学方法可以诊断上述物质中的重金属污染情况. 河流沉积物因受水体和大气污染的输入,往往存在重金属污染现象.在河流开放的环境中, 探讨环境磁学对重金属污染的指示,国内近年来已有相关报道,多集中在干旱半干旱区域,而季 风气候控制下的我国南方地区研究较少.这些研究也揭示出河流沉积物磁性参数与重金属污染关 系的复杂性,二者之间并非简单的线性关系.因此,在不同的研究区域,在利用磁学方法进行重 金属污染诊断前,需要对磁性特征的变化因素,及其与重金属污染关联的机制加以分析.我国南 方江浙地区由于工业发达,河流沉积物已遭受不同程度的重金属污染.本研究以浙江省金华市义 乌江城区段边滩沉积物为对象,拟通过系统环境磁学、地球化学、粒度和有机碳分析,旨在探讨 环境磁学方法诊断河流沉积物重金属污染的可行性. 2 材料与方法 2.1 研究区域概况 义乌江位于浙江省中部金华市(119°13′~120°47′E,28°31′~29°41′N)境内,上游 称为东阳江,发源于金华市磐安县龙鸟尖,入义乌接纳南江后,称义乌江,流域面积3407 km2,上游属山区性河流,流至义乌后坡降逐渐平缓.流域地处金衢盆地,属于亚热带季风性湿润气候,年平均气温17°C,年均降水量超过1400 mm,降水季节性差异明显.流域流经的东阳市、义乌市 均为浙中经济重镇和交通中心,经济活动频繁,人口密度大.商品贸易、磁性电子、建筑建材等 产业等是义乌江流域重要经济支柱,经济发展的同时也造成了河流严重的污染. 2.2 样品采集与实验方法 研究样品取自义乌江金华城区建筑艺术公园附近,距离下游拦江橡皮坝5 km左右,洪季和 橡皮坝蓄水期间,采样点为水淹没,物理扰动干扰较小.在枯季(2010年12月)使用PVC管获得 30 cm柱样YW.在实验室用按2 cm间隔逐层取样,得到15个样品.去除样品中植物根系、砂石等 异物杂质后,40 ℃低温下烘干,以备分析.
土壤重金属测定仪器设备
土壤重金属测定仪器设备 怎么检测土壤重金属?有很多方法,比如原子荧光光谱法、电感耦合等离子体发射光谱法、表面增强拉曼光谱法等,不过这些检测方法检测起来过程都比较繁琐,在一定程度上增加了实验人员的劳动强度。因此,需要一种低成本、精度高、时间短的测定土壤重金属解决方案,而TPJS-B土壤重金属测定仪的投入与应用则满足了这一需求。 那么,利用土壤重金属测定仪该如何检测土里的重金属呢? TPJS-B土壤重金属测定仪是由托普云农研发生产的,该仪器能够对土壤中主要重金属汞、镉、铅、铬、锌、铜等元素的含量进行检测,并且该体积较小,重量轻,便于携带,检测人员是可以直接带到野外使用的,并且在野外使用也是不需要准备样品就可直接对土壤分析,整个分析过程仅需80秒,由此可见检测时间很短,与实验室分析相比,不仅降低了样品处置、运输和相应的各类繁杂记录等流程,也降低了单个样品的成本,同时因为节省了大量的时间,因此费用成本的消耗更少。除此之外,该仪器的测量精度很高,可以为土壤环境研究的和污染防治提供重要的数据支撑,全面推进土壤改良工作,保障农作物健康生长。 近几年,随着城市化与工业化,环境污染问题越来越严重,其中土壤重金属污染问题受到社会各界的关注,主要是因为土壤重金属污染更有其隐蔽性和潜伏性,排放的重金属进入到土壤中,对人类的耕地和饮水产生很大的影响。由于重金属在进入人体后会对人体的健康产生很大影响,因此对土壤重金属的检测具有非常大的意义。而在当前农业发展的过程中,利用土壤重金属测定仪来开展土壤重金属检测开始成为十分重要的一项内容,与此同时,具有快速、低成本的现场土壤重金属检测能力,也让其在土壤污染调查和土壤修复中发挥出了应用的作用和效果。
小麦叶片中细胞器中重金属含量测定
小麦叶片中细胞器中重金属含量测定 一实验目的 1了解生物毒性的一般方法。 2掌握匀浆器、原子吸收仪的使用。 3掌握生物样品的处理方法。 二实验原理 湿法消化:使用具有强氧化性酸混合液(如HNO3、HCl、HClO4等),式样共同加热消化,使细胞器中的金属元素锌、铜、镉以离子态溶解在消解液中。 差速离心法:细胞内不同细胞器的比重和大小都不相同,在均匀密度介质中不同离心力下沉降的细胞器组成不同或在梯度介质中离心后分布于不同密度层,根据这一原理,差速离心法或密度梯度离心法就可将细胞内各种组分分离出来。分离流程: 破碎组织(匀浆或研磨)-差速离心或密度梯度离心分离细胞器-结果检验分析 原子吸收分光光度计一般由四大部分组成,即光源(单色锐线辐射源)、试样原子化器、单色仪和数据处理系统(包括光电转换器及相应的检测装置)。 原子化器主要有两大类,即火焰原子化器和电热原子化器。火焰有多种火焰,目前普遍应用的是空气—乙炔火焰。电热原子化器普遍应用的是石墨炉原子化器,因而原子吸收分光光度计,就有火焰原子吸收分光光度计和带石墨炉的原子吸收分光光度计。前者原子化的温度在2100℃~2400℃之间,后者在2900℃~3000℃之间。 火焰原子吸收分光光度计,利用空气—乙炔测定的元素可达30多种,若使用氧化亚氮—乙炔火焰,测定的元素可达70多种。但氧化亚氮—乙炔火焰安全性较差,应用不普遍。空气—乙炔火焰原子吸收分光光度法,一般可检测到PPm 级(10-6),精密度1%左右。国产的火焰原子吸收分光光度计,都可配备各种 型号的氢化物发生器(属电加热原子化器),利用氢化物发生器,可测定砷(As)、锑(Sb)、锗(Ge)、碲(Te)等元素。一般灵敏度在ng/ml级(10-9),相对标准偏差2%左右。汞(Hg)可用冷原子吸收法测定。 石墨炉原子吸收分光光度计,可以测定近50种元素。石墨炉法,进样量少,灵敏度高,有的元素也可以分析到pg/mL级。 三实验内容 1 实验液的预处理。 2 小麦叶片中细胞器中的重金属含量。 四实验仪器设备和材料清单 1 仪器设备:25ml匀浆器,电热板,原子吸收仪,石墨炉原子吸收分光光度计,电子分析天平,离心机;25ml、50ml比色管,离心管,50ml烧杯,50ml、500ml容量瓶,玻璃珠若干,剪刀,镊子。1ml、2ml、5ml、10ml、25ml移液
重金属检测方法
重金属检测方法汇总 重金属检测方法及应用 一、重金属的危害特性 从环境污染方面所说的重金属,实际上主要是指汞、镉、铅、铬、砷等金属或类金属,也指具有一定毒性的一般重金属,如铜、锌、镍、钴、锡等。我们从自然性、毒性、活性和持久性、生物可分解性、生物累积性,对生物体作用的加和性等几个方面对重金属的危害稍作论述。 (一)自然性: 长期生活在自然环境中的人类,对于自然物质有较强的适应能力。有人分析了人体中60多种常见元素的分布规律,发现其中绝大多数元素在人体血液中的百分含量与它们在地壳中的百分含量极为相似。但是,人类对人工合成的化学物质,其耐受力则要小得多。所以区别污染物的自然或人工属性,有助于估计它们对人类的危害程度。铅、镉、汞、砷等重金属,是由于工业活动的发展,引起在人类周围环境中的富集,通过大气、水、食品等进入人体,在人体某些器官内积累,造成慢性中毒,危害人体健康。 (二)毒性: 决定污染物毒性强弱的主要因素是其物质性质、含量和存在形态。例如铬有二价、三价和六价三种形式,其中六价铬的毒性很强,而三价铬是人体新陈代谢的重要元素之一。在天然水体中一般重金属产生毒性的范围大约在1~10mg/L之间,而汞,镉等产生毒性的范围在0.01~0.001mg/L 之间。 (三)时空分布性: 污染物进入环境后,随着水和空气的流动,被稀释扩散,可能造成点源到面源更大范围的污染,而且在不同空间的位置上,污染物的浓度和强度分布随着时间的变化而不同。 (四)活性和持久性: 活性和持久性表明污染物在环境中的稳定程度。活性高的污染物质,在环境中或在处理过程中易发生化学反应,毒性降低,但也可能生成比原来毒性更强的污染物,构成二次污染。如汞可转化成甲基汞,毒性很强。与活性相反,持久性则表示有些污染物质能长期地保持其危害性,如重金属铅、镉等都具有毒性且在自然界难以降解,并可产生生物蓄积,长期威胁人类的健康和生存。 (五)生物可分解性:
土壤重金属测定ICP-MS实验操作步骤
18种元素的测定电感耦合等离子体质谱仪法 1.目的 为了提高电感耦合等离子体质谱仪的利用率和样品处理能力,规范电感耦合等离子体质谱的使用。 2.适用范围 适用于检验中经客户同意采用电感耦合等离子体质谱仪对土壤中Be、Cd、Ce、Co、Cu、La、Bi、Pb、Zn、Li、Mo、Ni、Th、Tl、U、W、Sc、Cr的含量的测定。操作该仪器进行检测人员需执证上岗。 3.职责 本作业指导书由质量技术部归口管理,操作人员应该持证上岗。 4.工作程序 4.1 试剂及仪器 4.1.1 试剂 除另有说明外,所用试剂均为优级纯,水为GB/T 6682规定的一级水。 a. 硝酸、盐酸、氢氟酸、高氯酸均为优级纯; b. 王水(1+1):取750ml盐酸与250ml硝酸混合后,加入1000ml水,摇匀。 c. 氩气(纯度≥99.999%); d. 去离子水:分析用水GB/T 6682中的一级水,电阻率≥18.2МΩ/cm。 e. 标准溶液及内标液均采用有证标准物质,按其证书及GB/T 602标准方法 配制; f. 内标储备液Rh、Re,100ng/mL;In 2O 3 ,100ug/ml 内标工作液Re、Rh由内标储备液用硝酸(1+99)稀释至100ug/ml;内标工 作液In 2O 3 由内标储备液用5%王水稀释至10g/L 内标混合液:取1ml 100ug/ml的Re、Rh混合内标和10ml 10g/L的In内标加入1L容量 瓶中,去离子水定容。
4.1.2 仪器 电感耦合等离子体质谱仪、电子天平(感量0.1mg)、土壤研磨仪。 4.2 分析步骤 4.2.1 试样制备 将采集的土壤样品(一般不少于500g)混匀后用四分法缩分至约100g。缩分后的土样经风干(自然风干或冷冻干燥)后,除去土样中石子和动物残体等异物,用木棒(或玛瑙棒)研压,通过2mm尼龙筛(除去2mm以上的砂砾),混匀。用玛瑙研钵将通过2mm尼龙筛的土样研磨至全部通过100目(孔径0.149mm)尼龙筛,混匀后备用。 4.3 试样消解 称取试样0.1000-0.1500g(精确至0.0001g)于30ml聚四氟乙烯坩埚中,加入8ml混合酸(浓硝酸:氢氟酸:高氯酸=3:3:1),敞口250℃加热至高氯酸冒尽(此时样品已经完全蒸干),断电。待温度降到约180℃趁热加入8ml(1+1)王水,10ml内标混合液,混匀后放置过夜用于ICP上机。次日分取250ul消解液,加入5ml 3%的硝酸溶液,混匀用于ICP-MS上机。其中,ICP-MS测定所用内标为Re、Rh,ICP测定所用内标为In。 4.4 工作曲线的绘制 选择10个合适的地球化学一级标准物质(水系沉积物、土壤),按照4.3步骤,制备相应的溶液,同时制备一份样品空白溶液,按以下仪器工作条件进行测定,并由计算机绘出工作曲线。 4.5 测定 按照ICP-MS仪器的操作规程,调整仪器至最佳工作状态,参考条件为RF功率1388W,冷却气(13.0 L/min)和雾化载气(0.95 L/min),样品以30 r/min速率进样(12滚柱),采样锥孔径为1.0 mm,孔径为0.7 mm截取锥在深度为16.5 mm 处采样,雾化室温度控制在3℃,采用跳峰模式数据采集(单峰采样点数为3),分析过程应用内标,采用ICP-MS分析方法中内标校正定量分析方法测定。待仪器稳定后,按顺序依次对标准溶液、空白溶液和试样溶液进行测定。 4.6 内标
实验六 土壤重金属的测定
实验六土壤重金属的测定 一、研究目的及要求 1.掌握土壤样品布点、采样、运输及保存、前处理技术。 2.掌握分光光度法测定重金属的测定方法。 二、原理 分光光度法 ①锌:本方法适用于测定锌浓度在5-50ug/L的水样。当使用光程长200mm比色皿,试样体积为100mL时,检出限为5ug/L。本方法用四氯化碳萃取,在最大吸光波长535nm时,其摩尔吸光度约为9.3×104L/https://www.360docs.net/doc/a512259389.html,。 在pH为4.0~5.5的乙酸盐缓冲介质中,锌离子与双硫腙形成红色螯合物,用四氯化碳萃取后进行分光光度测定。水样中存在少量铅、铜、汞、镉、钴、铋、镍、金、钯、银、亚锡等金属离子时,对锌的测定有干扰,但可用硫代硫酸钠掩蔽和控制pH值而予以清除,其反应为: ②铜:用盐酸羟胺把二价铜离子还原为亚铜离子,在中性或微酸性溶液中,亚铜离子和2,9-二甲基-1,10-菲啰啉反应生成黄色络合物,在波长457nm处测量吸光度;也可用有机溶剂(包括氯仿-甲醇混合液)萃取,在波长457nm处测量吸光度。 在25mL水溶液或有机溶剂中,含铜量不超过0.15mg时,显色符合比耳定律,该颜色可保持数日。 三、仪器与试剂 3.1仪器 不锈钢锹、标签、牛皮纸、撵土棒、60目土筛、玛瑙研钵、电热板、漏斗、25mL容量瓶、50mL容量瓶、三角瓶。 3.2试剂 1.盐酸(优级纯);
2.硝酸(HNO3),优级纯; 3. 2%硝酸 4. 1+1硝酸 5. 高氯酸(HClO4),优级纯. 四、实验步骤 4.1 现场调查 泮湖花园处距离马路较远,可代表学校内土壤的情况,此处设置一个采样点。 4.2样品采集 采用网格采样法,设5个点,采样深度为0-30cm左右的表层土壤,对各点采集的试样混合后,反复按四分法弃取,收集1kg样品带回实验室。 将所采集土壤样品混匀后用继续用四分法缩分至约100g。缩分后的土样经风干(自然风干或冷冻干燥)后,除去土样中石子和动植物残体等异物,用木棒(或玛瑙棒)研压,通过2mm尼龙筛(除去2mm以上的砂砾),混匀。用玛瑙研钵将通过2mm尼龙筛的土样研磨至全部通过60目(孔径0.25mm)尼龙筛,混匀后备用。 4.3样品前处理 称取0.5~1g土样于50mL锥形瓶中,用水润湿加入10mL盐酸,盖上小漏斗,于通风橱内的电热板上低温加热,使样品初步分解,待蒸发至约剩3mL左右时,取下稍冷,然后加入5mL硝酸,在电热板上100~150℃微沸20min,取下稍冷,再加入5mL高氯酸,电热板上200~250℃左右加热,蒸发至近干,取下冷却,加(1+1)硝酸溶液4mL,在电热板上温热溶解残渣,冷却后移入50mL容量瓶中,冷却后用0.2%的硝酸溶液定容至标线摇匀,备测。 4.4 空白试验 用去离子水代替试样,采用和样品前处理相同的步骤和试剂进行处理,制备1个空白溶液。 4.5 测定 4.5.1分光光度法测定锌 4.5.1.1试剂 本标准所用试剂除另外说明外,均为分析纯试剂,实验中均用不含锌的水。 (1)无锌水:将普通蒸馏水通过阴阳离子交换柱以去除水中锌。 (2)四氯化碳(CCl4)。 (3)盐酸:1.18 g/mL (4)6mol/L盐酸:取100mL 盐酸(5.2.2)用水稀释到600mL。
