细胞信号通路 Diffuse Large B Cell Lymphoma

S h a r e d G C B - & A B C -D L B C L
CELL OF ORIGIN
Naive B cell
Ag
CD79A/B
LYN
PKC β
MAPK/ERK PI3K/AKT
CARD11
BCL10
MALT1
IRF4
MyD88
K4
H3
H3
K27
K27
Transcriptional activators
EZH2SUZ12
Transcriptional repressors
BCL6BCL6-i CD40
CD40L TLR/IL-1R
BTK-i
11%
20-40%
32%
4%
21%25-32%
25%30%21%
30-37%
10%
32%22%
24-30%
11%
10%
29%
NF-κB
IRF4
BCL6 translocation; more frequent in ABC-DLBCL
GCB-DLBCL
ABC-DLBCL
BCL6 translocation
*Based on analysis of 12 cases only
MEF2B BCL6 gene
BCL6 protein
DARK ZONE
Germinal Center
GCB-DLBCL ABC-DLBCL
PMBCL
LIGHT ZONE Centroblast HLA-I loss relieves inhibition on NK
Non-self antigen activates CTL
Centrocyte
T cell
FDC
Plasmablast
Plasma cell
Memory B cell
Thymus
Thymic B cell
IMMUNE ESCAPE
DEREGULATED BCL6 ACTIVITY
CONSTITUTIVE BCR AND NF-κB SIGNALING
ABERRANT HISTONE/
CHROMATIN MODIFICATIONS
G C B -D L B C L
M u t a t i o n s
Loss of function Gain of function D e l e t i o n s
T r a n s l o c a t i o n s
A m p l i c a t i o n s
C N g a i n s
A B C -D L B C L
P M B C L
3232-382921
20-4011820
% of DLBCL
% of subtype
Altered histone/
chromatin modi?cations CREBBP/EP300
MLL2/MLL3Proliferation/Apoptosis
BCL2MYC
miR-17~92Other EZH2
BCL6 BSE1 sites
2p16.1Immune escape
B2M CD58Deregulated BCL6 activity
BCL6MEF2B
34-45
106-12.5221516
30
30-372110
30-454536
3630-4538
33*
25-32
13
24-3026
Signaling TNFRSF14
GNA13SGK1PTEN Constitutive
NF-κB/BCR activity
TNFAIP3MYD88CD79A/B CARD11
Terminal
differentiation block
PRDM1/BLIMP1
Apoptosis
BCL2Other SPIB
JAK/STAT activation
JAK2/JMJD2C
SOCS1STAT6
Cell cycle checkpoint CDKN2A/B
Constitutive NF-κB activity
TNFAIP3Immune escape
PDL1/PDL2
CIITA Deregulated BCL6 activity
BCL6
1311136-11Other FOXO1TP53
MALT1-i
T cell
CD2Non-self Ag
TCR
CD58
NK
CTL
DNA damage response (p53, ATR)Cell cycle arrest (p21)
B cell activation (CD80)Programmed cell death (BCL2)Plasma cell differentiation (BLIMP1)
NK CTL
NF-κB
NF-κB-i
HDAC-i
EZH2-i Lenalidomide JAK/STAT Interferon p38/MAPK
Ag
BCR SYK BTK
HLA-I
Normal
B cell DLBCL
FBXO11A20
PRDM1
CBP/EP300
K4 methylation K27 methylation K27 acetylation
Loss of function genetic lesions
Gain of function genetic lesions
CREBBP
EP300MLL2MLL3Columbia University, New York, NY 10032, USA
See online version for legend and references.
132 Cancer Cell 25, January 13, 2014 ?2014 Elsevier Inc. DOI 10.1016/https://www.360docs.net/doc/be1235615.html,r.2013.12.012
Columbia University, New York, NY 10032, USA
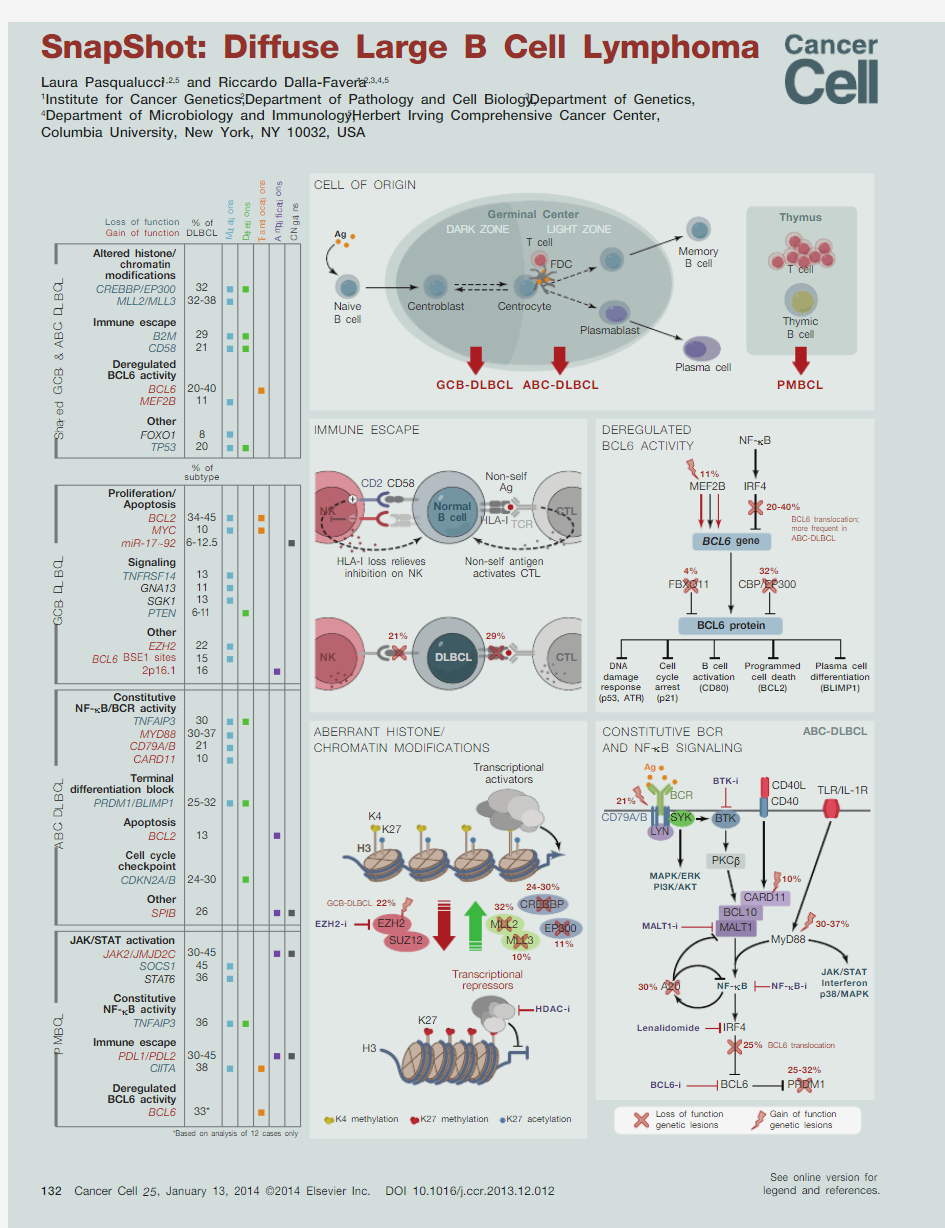
Diffuse large B cell lymphoma (DLBCL) is the most prevalent non-Hodgkin lymphoma (NHL) in adulthood, comprising 30%–40% of all new diagnoses. This aggressive disease can arise de novo or, less frequently, from the clinical evolution of various indolent B cell malignancies. While durable remissions can be achieved in a substantial proportion of cases by combined chemoimmunotherapy, over 30% of patients will not respond to currently available regimens or will relapse with resistant disease.
One explanation for such incomplete therapeutic success is the considerable heterogeneity of this tumor. DLBCL comprises multiple molecular subgroups, which can be recognized by their gene expression profiles and reflect either the stage in B cell development from which the disease originates or the activity of different biological programs, including metabolic dysregulation. DLBCL subgroups differ in the oncogenic pathways that drive them and in their response to treatment. Thus, the recognition of dysregu-lated genes/programs that are critical to the survival of the lymphoma cells is central to the development of rationally targeted therapeutic approaches for DLBCL.
Cell of Origin
Analogous to most B-NHL, DLBCL derives from a mature B cell that has experienced the germinal center (GC) reaction. DLBCLs have been divided into three subgroups based on putative cells of origin. GC B cell-like (GCB)-DLBCL exhibits a transcriptional profile that resembles that of GC B cells, including having elevated expression of BCL6 and the presence of hypermutated immunoglobulin genes with ongoing somatic hypermutation (SHM). Activated B cell-like (ABC)-DLBCL shows several features of BCR-activated B cells entering plasmablastic differentiation; these tumors downregulate the GC-specific program, concomitant with activation of NF-k B and BCR signaling pathways, and upregulate genes required for plasma cell differentiation (e.g., IRF4). Consistent with their late GC origin, ABC-DLBCLs do not show evidence of ongoing SHM. Primary medi-astinal B cell lymphoma (PMBCL) is postulated to arise from a post-GC thymic B cell in the mediastinum and shares histological, molecular, and clinical features with nodular sclerosis Hodgkin lymphoma, including a robust immune/inflammatory cell infiltrate, a distinctive cytokine profile, and constitutive NF-k B activation. An additional 15%–30% of DLBCL cases remain unclassified. Stratification of DLBCL patients according to the cell-of-origin classification was shown to have prognostic significance, with GCB-DLBCL displaying a better overall survival compared to ABC-DLBCL.
Genetic Alterations
Compared to other B cell malignancies, DLBCL shows a significantly higher degree of genomic complexity, typically harboring between 50 and >100 lesions per case, with high variability across patients. These figures, which include point mutations, copy number aberrations, and chromosomal translocations, likely represent an underestimate because sequencing studies performed so far have not interrogated noncoding portions of the genome.
Recent genomic analysis of DLBCL revealed a number of previously unrecognized genes/pathways that are dysregulated by genetic lesions and presumably play central roles in tumor initiation and maintenance. Some of these lesions can be observed in both GCB and ABC subtypes of DLBCL, while others are preferentially associated with individual DLBCL subtypes, suggesting their potential for diagnostic and therapeutic stratification. The following paragraphs focus on the most frequent and well-character-ized alterations (see the table for a comprehensive list).
Alterations Shared Across Subtypes
Inactivating mutations and deletions of the histone acetyltransferases CREBBP/EP300 and the histone methyltransferase MLL2 emerged as the most common genetic lesions in DLBCL, where they may favor tumor development by reprogramming the cancer epigenome. The prevalence of these lesions has therapeutic implications given the potential of histone deacetylase inhibitors to restore physiologic acetylation levels.
A multitude of genetic lesions result in deregulation of BCL6 activity, either directly (chromosomal translocations or mutations abrogating its promoter regulatory sequences) or indirectly, by enhancing the activity of its positive regulator MEF2B, preventing acetylation-mediated inactivation of its function (CREBBP/EP300 mutations/ deletions), or abrogating mechanisms controlling protein degradation (FBXO11 mutations/deletions). Notably, pharmacologic inhibition of BCL6 is lethal to most DLBCL.
DLBCL cells acquire the ability to escape immune surveillance, including CTL-mediated cytotoxicity (through genetic loss of B2M or HLA-I genes) and natural killer cell-mediated death (through loss of the gene encoding the CD58 ligand). In PMBCL, reduced tumor cell immunogenicity is achieved by disruption of the MHC-II transactivator CIITA and amplification of PDL1 and/or PDL2, genes encoding for immunomodulatory proteins.
Most DLBCLs harbor mutations in multiple genes as the result of an aberrant function of the physiologic SHM mechanism. While the causes of this phenomenon are unknown, its widespread activity may have powerful consequences by promoting genomic instability, favoring DNA breaks/chromosomal translocations, and deregulating oncogenes or tumor suppressor genes.
Subtype-Associated Alterations
Translocations resulting in deregulated MYC and BCL2 and gain-of-function mutations in the H3K27 methyltransferase EZH2 are exquisitely restricted to GCB-DLBCL. Also frequent for this subtype, but of unclear functional role, are truncating mutations in TNFRSF14, encoding a TNF-receptor superfamily member, and mutations of GNA13, encoding a G protein involved in Rho GTPase signaling. Importantly, EZH2 inhibitors showed specific activity against EZH2 mutated tumors in preclinical studies.
Constitutive activation of the NF-k B transcription factor represents a hallmark of ABC-DLBCL. The underlying causes are heterogeneous and include gain-of-function muta-tions in several signal transduction components of the BCR (CD79B and CARD11) and Toll-like receptor (MyD88) signaling pathway or loss-of-function mutations in the NF-k B negative regulator TNFAIP3/A20. While specific NF-k B inhibitors are under development, kinase inhibitors that interfere with BCR signaling (e.g., BTK inhibitors) are emerging as a new treatment paradigm for ABC-DLBCL. Impaired plasma cell differentiation is another major transformation mechanism in this subtype, caused by mutually exclusive lesions deregulating BCL6 and inactivating PRDM1/BLIMP1.
In addition to abnormalities leading to constitutive NF-k B responses, several lesions converge on the JAK-STAT signaling pathway preferentially in PMBCL, suggesting a pathogenic role. Moreover, amplification of JAK2 and JMJD2C, encoding for a H3K9 demethylase, may favor epigenetic dysregulation and alter the transcription of multiple genes, including MYC.
RefeRences
Caro, P., Kishan, A.U., Norberg, E., Stanley, I.A., Chapuy, B., Ficarro, S.B., Polak, K., Tondera, D., Gounarides, J., Yin, H., et al. (2012). Cancer Cell 22, 547–560.
Cerchietti, L.C., Ghetu, A.F., Zhu, X., Da Silva, G.F., Zhong, S., Matthews, M., Bunting, K.L., Polo, J.M., Farès, C., Arrowsmith, C.H., et al. (2010). Cancer Cell 17, 400–411.
Challa-Malladi, M., Lieu, Y.K., Califano, O., Holmes, A.B., Bhagat, G., Murty, V.V., Dominguez-Sola, D., Pasqualucci, L., and Dalla-Favera, R. (2011). Cancer Cell 20, 728–740. Monti, S., Savage, K.J., Kutok, J.L., Feuerhake, F., Kurtin, P., Mihm, M., Wu, B., Pasqualucci, L., Neuberg, D., Aguiar, R.C., et al. (2005). Blood 105, 1851–1861.
Morin, R.D., Johnson, N.A., Severson, T.M., Mungall, A.J., An, J., Goya, R., Paul, J.E., Boyle, M., Woolcock, B.W., Kuchenbauer, F., et al. (2010). Nat. Genet. 42, 181–185. Pasqualucci, L., Neumeister, P., Goossens, T., Nanjangud, G., Chaganti, R.S., Küppers, R., and Dalla-Favera, R. (2001). Nature 412, 341–346.
Pasqualucci, L., Dominguez-Sola, D., Chiarenza, A., Fabbri, G., Grunn, A., Trifonov, V., Kasper, L.H., Lerach, S., Tang, H., Ma, J., et al. (2011a). Nature 471, 189–195.
Shaffer, A.L., 3rd, Young, R.M., and Staudt, L.M. (2012). Annu. Rev. Immunol. 30, 565–610.
Steidl, C., and Gascoyne, R.D. (2011). Blood 118, 2659–2669.
132.e1Cancer Cell 25, January 13, 2014 ?2014 Elsevier Inc. DOI 10.1016/https://www.360docs.net/doc/be1235615.html,r.2013.12.012
细胞信号通路大全
1 PPAR信号通路:过氧化物酶体增殖物激活受体( PPARs) 是与维甲酸、类固醇 和甲状腺激素受体相关的配体激活转录因子超家族核激素受体成员。它们作为脂 肪传感器调节脂肪代谢酶的转录。PPARs由PPARα、PPARβ和PPARγ 3种亚型组成。PPARα主要在脂肪酸代谢水平高的组织,如:肝、棕色脂肪、心、肾和骨骼肌表达。他通过调控靶基因的表达而调节机体许多生理功能包括能量代谢、生 长发育等。另外,他还通过调节脂质代谢的生物感受器而调节细胞生长、分化与 凋亡。PPARa同时也是一种磷酸化蛋白,他受多种磷酸化酶的调节包括丝裂原激活蛋白激酶( ERK-和p38.M APK) ,蛋白激酶A和C( PKA,PKC) ,AM PK和糖原合成酶一3( G SK3) 等调控。调控PPARa生长信号的酶报道有M APK、PKA和G SK3。PPARβ广泛表达于各种组织,而PPAR γ主要局限表达在血和棕色脂肪,其他组织如骨骼肌和心肌有少量表达。PPAR-γ在诸如炎症、动脉粥样硬化、胰岛素抵抗和糖代谢调节,以及肿瘤和肥胖等方面均有着举足轻重的作用, 而其众多生物学效应则是通过启动或参与的复杂信号通路予以实现。鉴于目前人 们对PPAR—γ信号通路尚不甚清,PPARs通常是通过与9-cis维甲酸受体( RXR)结合实现其转录活性的。 2 MAPK信号通路:mapk简介:丝裂原激活蛋白激酶(mitogen—activated protein kinase,MAPK)是广泛存在于动植物细胞中的一类丝氨酸/苏氨酸蛋白激酶。作用主要是将细胞外刺激信号转导至细胞及其核内,并引起细胞的生物化学反应(增殖、分化、凋亡、应激等)。 MAPKs家族的亚族 :ERKs(extracellular signal regulated kinase):包括ERK1、ERK2。生长因子、细胞因子或激素激活此通路,介导细胞增殖、分化。 JNKs(c-Jun N-terminal kinase)包括JNK1、JNK2、JNK3。此亚族成员能使 Jun转录因子N末端的两个氨基酸磷酸化而失活,因此称为Jun N末端激酶(JNKs)。物理、化学的因素引起的细胞外环境变化以及致炎细胞因子调节此通路。P38 MAPKs:丝氨酸/络氨酸激酶,包括p38 α、p38β、p38γ、p38δ。p38 MAP K参与多种细胞内信息传递过程 ,能对多种细胞外刺激发生反应,可磷酸化其它细胞质蛋白,并能从胞浆移位至细胞核而调节转录因子的活性来改变基因的表达水平 ,从而介导细胞生长、发育、分化及死亡的全过程。 ERK5:是一种非典型的MAPK通路,也叫大MAPK通路,只有一个成员。它可被各种刺激因素激活。不仅可以通过磷酸化作用使底物活化,并且通过C端的物理性结合作用激活底物。 3 ERBB信号途径:ErbB 蛋白属于跨膜酪氨酸激酶的 EGF 受体家族成员。ErbB 的命名来源于在禽红白血病 B( v-Erb-B) 发现的 EGF 受体的突变体,因而 EGF 受体 亦称为“ ErbB1”。人源 ErbB2 称为HER2, 特指人的 EGF 受体。ErbB 家族的
干货 细胞信号通路图解之MAPK通路【值得珍藏】
干货细胞信号通路图解之MAPK通路【值得珍藏】 科研小助手原创,转载请注明来源。公众号内回复“Cell Signaling Pathway”获取全套信号通路图本文由百度贴吧nosce吧吧主黄杰投稿一、MAPK信号通路: (1)有丝分裂原激活的蛋白激酶(MAPK)是一族在真核生物中非常保守的丝/苏氨酸蛋白激酶,在许多细胞活动中起作用,如生长增殖,细胞分化,细胞运动或死亡。MAPK级联信号传导由3 个不同层次的分子所组成。MAPK被MAPK的激 酶( MAPKK)磷酸化后激活,MAPKK被MAPKK的激酶(MAPKKK )磷酸化而激活。而MAPKKK通过与小GTPase 和/或其他蛋白酶相互作用而被激活,从而将MAPK和细胞 表面的受体以及胞外的信号联系在一起。 (2)许多参与生长和分化的受体都能够激活MAPK/ERK信号通路,比如说受体酪氨酸激酶(RTK),整合素,和离子通道。响应特定信号所涉及到的具体分子会相差很大,但通路的结构是一致的,那就是接头分子(adaptor,如Shc, GRB2, Crk等)将鸟苷酸交换因子(SOS, C3G 等)和受体连接在一起,然后把信号向小GTP 结合蛋白(Ras, Rap1)传递,后者又激活核心的级联反应,这是由一个MAPKKK( Raf) ,一个MAPKK( MEK1/2)和MAPK( Erk)所构成的。活化的ERK 二聚体能调节胞浆中的目标分子,也可以转移到细胞核中,然
后对一系列转录因子进行磷酸化以调节基因表达。SciRes(3)很多外部的刺激都能够激活G蛋白偶联受体(GPCR)。在受体活化以后,G 蛋白将GDP 转换成GTP ,然后结合了GTP的α和β/γ亚基从受体脱离开,启动信号向胞内的传导。与不同亚型的异质三聚体G 蛋白结合的受体可以采取不同 的手段激活小G 蛋白/MAPK级联反应,至少有三个不同家族的酪氨酸激酶参与其中。Src家族激酶响应活化的PI3Kγ,而后者被β/γ亚基激活。它们还能够响应受体的内化,受体酪氨酸激酶的交叉活化,以及有Pyk2 和/或FAK参与的整 合素途径信号。GPCRs同样可以通过PLCβ去激活PKC 和CaMKII ,对下游的MAPK通路可以有激活或抑制的影响。SciRes(4)压力激活的蛋白激酶(Stress-activated protein kinase, SAPK)或称Jun氨基端激酶(Jun amino-terminal kinase, JNK) 是MAPK的家族成员,能被一系列的环境压力,炎症细胞因子,生长因子和GPCR激动剂所激活。压力信号通过Rho家族的小GTP 酶(small GTPase)向这条级联通路传导,这些小GTP酶包括(Rac, Rho, cdc42) 。和其他的MAPK情况一样,靠近膜的激酶是一个MAPKKK,一般 是MEKK1-4 ,或者是一个混合激酶去磷酸化并激活 MKK4(SEK)或MKK7,它们是SAPK/JNK的激酶。另外,MKK4/7也可以被生发中心激酶(germinal center kinase, GCK)以一种GTPase 依赖的方式激活。活化后的
常见的信号通路
1JAK-STAT信号通路 1)JAK与STAT蛋白 JAK-STAT信号通路是近年来发现的一条由细胞因子刺激的信号转导通路,参与细胞的增殖、分化、凋亡以及免疫调节等许多重要的生物学过程。与其它信号通路相比,这条信号通路的传递过程相对简单,它主要由三个成分组成,即酪氨酸激酶相关受体、酪氨酸激酶JAK和转录因子STAT。(1)酪氨酸激酶相关受体(tyrosinekinaseassociatedreceptor) 许多细胞因子和生长因子通过JAK-STAT信号通路来传导信号,这包括白介素2?7(IL-2?7)、GM-CSF(粒细胞/巨噬细胞集落刺激因子)、GH(生 长激素)、EGF(表皮生长因子)、PDGF(血小板衍生因子)以及IFN(干扰素)等等。这些细胞因子和生长因子在细胞膜上有相应的受体。这些受体的共同特点是受体本身不具有激酶活性,但胞内段具有酪氨酸激酶JAK 的结合位点。受体与配体结合后,通过与之相结合的JAK的活化,来磷酸化各种靶蛋白的酪氨酸残基以实现信号从胞外到胞内的转递。 (2)酪氨酸激酶JAK(Januskinase) 很多酪氨酸激酶都是细胞膜受体,它们统称为酪氨酸激酶受体(receptor tyrosinekinase,RTK),而JAK却是一类非跨膜型的酪氨酸激酶。JAK是英文Januskinase的缩写,Janus在罗马神话中是掌管开始和终结的两面神。之所以称为两面神激酶,是因为JAK既能磷酸化与其相结合的细胞因子受体,又能磷酸、JAK1个成员:4蛋白家族共包括JAK结构域的信号分子。SH2化多个含特定
JAK2、JAK3以及Tyk2,它们在结构上有7个JAK同源结构域(JAKhomologydomain,JH),其中JH1结构域为激酶区、JH2结构域是“假”激酶区、JH6和JH7是受体结合区域。 (3)转录因子STAT(signaltransducerandactivatoroftranscription)STAT被称为“信号转导子和转录激活子”。顾名思义,STAT在信号转导和转录激活上发挥了关键性的作用。目前已发现STAT家族的六个成员,即STAT1-STAT6。STAT蛋白在结构上可分为以下几个功能区段:N-端保守序列、DNA结合区、SH3结构域、SH2结构域及C-端的转录激活区。其中,序列上最保守和功能上最重要的区段是SH2结构域,它具有与酪氨酸激酶Src的SH2结构域完全相同的核心序列“GTFLLRFSS”。 2)JAK-STAT信号通路 与其它信号通路相比,JAK-STAT信号通路的传递过程相对简单。信号传 递过程如下:细胞因子与相应的受体结合后引起受体分子的二聚化,这使得与受体偶联的JAK激酶相互接近并通过交互的酪氨酸磷酸化作用而活化。JAK激活后催化受体上的酪氨酸残基发生磷酸化修饰,继而这些磷酸化的酪氨酸位点与周围的氨基酸序列形成“停泊位点”(dockingsite),同时含有SH2结构域的STAT蛋白被招募到这个“停泊位点”。最后,激酶JAK 催化结合在受体上的STAT蛋白发生磷酸化修饰,活化的STAT蛋白以二 聚体的形式进入细胞核内与靶基因结合,调控基因的转录。值得一提的是,一种JAK激酶可以参与多种细胞因子的信号转导过程,一种细胞因子的信号通路也可以激活多个JAK激酶,但细胞因子对激活的STAT分子却具有一定的选择性。例如IL-4激活STAT6,而IL-12 。STAT4却特异性激活
细胞常见信号通路图片合集
目录 actin肌丝 (5) Wnt/LRP6 信号 (7) WNT信号转导 (7) West Nile 西尼罗河病毒 (8) Vitamin C 维生素C在大脑中的作用 (10) 视觉信号转导 (11) VEGF,低氧 (13) TSP-1诱导细胞凋亡 (15) Trka信号转导 (16) dbpb调节mRNA (17) CARM1甲基化 (19) CREB转录因子 (20) TPO信号通路 (21) Toll-Like 受体 (22) TNFR2 信号通路 (24) TNFR1信号通路 (25) IGF-1受体 (26) TNF/Stress相关信号 (27) 共刺激信号 (29) Th1/Th2 细胞分化 (30) TGF beta 信号转导 (32) 端粒、端粒酶与衰老 (33) TACI和BCMA调节B细胞免疫 (35) T辅助细胞的表面受体 (36) T细胞受体信号通路 (37) T细胞受体和CD3复合物 (38) Cardiolipin的合成 (40) Synaptic突触连接中的蛋白 (42) HSP在应激中的调节的作用 (43) Stat3 信号通路 (45) SREBP控制脂质合成 (46) 酪氨酸激酶的调节 (48) Sonic Hedgehog (SHH)受体ptc1调节细胞周期 (51) Sonic Hedgehog (Shh) 信号 (53) SODD/TNFR1信号 (56) AKT/mTOR在骨骼肌肥大中的作用 (58) G蛋白信号转导 (59) IL1受体信号转导 (60) acetyl从线粒体到胞浆过程 (62) 趋化因子chemokine在T细胞极化中的选择性表达 (63) SARS冠状病毒蛋白酶 (65) SARS冠状病毒蛋白酶 (67) Parkin在泛素-蛋白酶体中的作用 (69)
参与细胞信号转导通路的蛋白简写及全拼
参与细胞信号转导通路的蛋白简写及全拼 4E-BP eIF4E binding protein Abl Ableson protein tyrosine kinase ACTR A histone acetyltransferase AIF Programmed cell death protein 8 ANT Adenine nucleotide translocation channel Apaf-1 Apoptotic protease activating factor 1 APP beta-Amyloid precursor protein APPs Acute phase proteins ASIP Agouti switch protein ASK Apoptosis signal-regulating kinase (e.g., ASK1) ATF-2 Activating transcription factor 2 ATM Ataxia telangiectasia?mutated protein kinase ATR ATM and Rad3?related protein kinase Bam32 B-cell adaptor molecule 32 kDa BCAP B-cell adaptor for PI3K Bcl-10 B-cell leukemia 10 protein Bfl-1 Bcl-2-related protein A1 Bid A BH3 domain?only death agonist protein Bimp1 B-lymphocyte-induced maturation protein 1 BLNK B-cell linker protein BRCA Breast cancer growth suppressor protein Btk Brutonís tyrosine kinase C3G Guanine nucleotide?releasing factor 2 CAD Caspase-activated deoxyribonuclease Cam Calmodulin CaMK Calcium/calmodulin-dependent kinase CAP c-Cbl-associated protein Cas p130CAS, Crk-associated substrate Caspase Cysteine proteases with aspartate specificity CBL Cellular homologue of the v-Cbl oncogene CBP CREB binding protein CD19 B-lymphocyte antigen CD19 CD22 B-cell receptor CD22 CD40 B-cell surface antigen CD40 CD45 Leukocyte common antigen, a phospho-tyrosine phosphatase CD5 Lymphocyte antigen CD5 cdc2 Cell division cycle protein 2, CDK1 cdc34 Cell division cycle protein 34, a ubiquitin conjugating (E2) enzyme cdc42 Cell division cycle protein 42, a G-protein CDK Cyclin-dependent kinase Chk Checkpoint kinase CHOP C/EBP homologous protein 10
mTOR信号通路图
mTOR信号通路图 mTOR可对细胞外包括生长因子、胰岛素、营养素、氨基酸、葡萄糖等多种刺激产生应答。它主要通过PI3K/Akt/mTOR途径来实现对细胞生长、细胞周期等多种生理功能的调控作用。正常情况下,结节性脑硬化复合物-1(TSC-1)和TSC-2形成二聚体复合物,是小GTP 酶Rheb(Ras-homolog enriched in brain)的抑制剂,而Rheb是mTOR活化所必需的刺激蛋白,因此TSC-1/TSC-2在正常情况下抑制mTOR的功能。当Akt活化后,它可磷酸化TSC-2的Ser939和Thr1462,抑制了TSC-1/TSC-2复合物的形成,从而解除了对Rheb 的抑制作用,使得mTOR被激活。活化的mTOR通过磷酸化蛋白翻译过程中的某些因子来参与多项细胞功能,其中最主要的是4EBP1和P70S6K。
在整个PI3K/Akt/mTOR信号通路中,有一条十分重要的负反馈调节剂就是10号染色体上缺失与张力蛋白同源的磷酸酶基因(phosphatase and tensin homology deleted on chromosome 10, PTEN)。PTEN是一个肿瘤抑制基因,位于人染色体10q23。它有一个蛋白酪氨酸磷酸酶结构域,在这条通路中可以将PI-3,4-P2与PI-3,4,5-P3去磷酸化,从而负调节PI3K下游AKt/mTOR信号通路的活性。 本信号转导涉及的信号分子主要包括 IRS-1,PI3K,PIP2,PIP3,PDK1,PTEN,Akt,TSC1,TSC2,Rheb,mTOR,Raptor,DEPTOR,GβL,p70S6K,ATG13,4E-BP1,HIF-1,PGC-1α,PPARγ,Sin1,PRR5,Rictor,PKCα,SGK1,PRAS40,FKBP12,Wnt,LRP,Frizzled,Gαq/o,Dvl,Erk,RSK,GSK-3,REDD1,REDD2,AMPK,LKB1,RagA/B,RagC/D等。
KEGG上的信号通路图怎么看
KEGG上的信号通路图怎么看? 提示:请点击标题下方蓝色“实验万事屋”,添加关注后,发“嗯”可以查看我们之前的文章。未经允许,其他公众号不得转载哦! 想要把自己研究的分子扯上明星分子或者明星通路?那是不难,难的是具体到底要怎么去扯,芯片结果啊,生信结果啊,都会给你提示,但真的要具体扯上去,还得看懂那些七七八八的信号通路图。 KEGG Pathway上有着大量的信号通路图,画得一个复杂啊!巨坑爹有没有?曾经有师弟说我之前曾经把Wnt通路描述错了,他师兄告诉他,应该是GSK-3β磷酸化抑制β-Catenin降解,并促进它入核的。在这里,我们只能默默地祝福这位师兄了…… 那我们就用Wnt通路来做例子吧。先上KEGG下载一个Wnt的信号通路图,如下: 绝壁是很高大上的不是么?这要咋看呢?其实这张图上把三个Wnt通路都画上去了,也就是Wnt/β-Catenin(经典Wnt通路),Wnt/PCP(平面的细胞极性途径)和Wnt/Ca2+(Wnt/钙离子)三条信号通路组成,我们就删减一下,就光看经典的Wnt通路,就变成了下面这个模样:
感觉还是很高大上有木有?那就再删减一下,把它变成经典Wnt信号通路的骨架会是什么样呢?就是这样: 简洁明快了吧,但要怎么来看懂这样的图呢?我们来看一下KEGG Pathway的具体图例:
把这些图例用来解释经典Wnt信号通路骨架图,就变成了: 看懂了么?那给你从左到右解释一下: 1)Wnt激活膜上受体,将信号传递到第二信使Dvl,活化的Dvl抑制由Axin、APC 和GSK-3β组成的复合物的活性,使β-catenin不能被GSK-3β磷酸化。 2)磷酸化的β-catenin才可通过泛素化(ubiquitination)而被胞浆内的蛋白酶体所降解,由于非磷酸化的β-catenin不能被蛋白酶体降解,从而导致β-catenin在胞浆内积聚,并移向核内。
第九章 细胞信号转导知识点总结
第九章细胞信号转导 细胞通讯:一个信号产生细胞发出的信息通过介质(又称配体)传递到另一个靶细胞并与其相应的受体相互作用,然后通过信号转导产生靶细胞内一系列的生理生化变化,最终表现为靶细胞整体的生物学效应。 信号传导:是指信号分子从合成的细胞中释放出来,然后进行传递。信号传导强调信号的产生、分泌与传送。 信号转导:是指信号的识别、转移与转换,包括配体与受体的结合、第二信使的产生及其后的级联反应等。信号转导强调信号的接收与接收后信号转换的方式与结果。 受体:是一类能够结合细胞外特异性信号分子并启动细胞反应的蛋白质。 第二信使:细胞外信号分子不能进入细胞,它作用于细胞表面受体,经信号转导,在细胞内产生非蛋白类小分子,这种细胞内信号分子称为第二信使。 分子开关:细胞信号传递级联中,具有关闭和开启信号传递功能的分子。 信号通路:细胞接受外界信号,通过一整套特定机制,将胞外信号转化为胞内信号,最终调节特定基因表达,引起细胞的应答反应,这种反应系列称为细胞信号通路。 G蛋白偶联受体:指配体-受体复合物与靶细胞的作用是要通过与G蛋白的偶联,在细胞内产生第二信使,从而将细胞外信号跨膜传递到胞内影响细胞行为的受体。 cAMP信号通路:细胞外信号与细胞相应受体结合,导致细胞内第二信使cAMP 水平的变化而引起细胞反应的信号通路。 (磷脂酰肌醇信号通路)双信使系统:胞外信号分子与细胞表面G蛋白偶联受体结合,激活膜上的磷脂激酶C,使质膜上的PIP2分解成IP3和DAG两个第二信使,将胞外信号转导为胞内信号,两个第二信使分别激活两种不同的信号通路,即IP3-Ca2+和DAG-PKC途径,实现对胞外信号的应答,因此将这种信号通路称为“双信使系统”。 钙调蛋白:真核细胞中普遍存在的Ca2+应答蛋白。 Ras蛋白:Ras基因的产物,分布于质膜胞质侧,结合GTP时为活化状态,结合GDP时失活状态,因此Ras蛋白属于GTP结合蛋白,具有GTP酶活性,具有分子开关的作用。
细胞信号通路大全
1PPAR信号通路:过氧化物酶体增殖物激活受体(PPARs)是与维甲酸、类固醇和甲状腺激素受 体相关的配体激活转录因子超家族核激素受体成员。它们作 为脂肪传感器调节脂肪代谢酶的转录。PPARs由PPARα、PPARβ和PPARγ3种亚型组成。PPARα主要在脂肪酸代谢水平高的组织,如:肝、棕色脂肪、心、肾和骨骼肌表达。他通过 调控靶基因的表达而调节机体许多生理功能包括能量 代谢、生长发育等。另外,他还通过调节脂质代谢的生物感受器而调节细胞生长、分化与凋亡。PPARa同时也是一种磷酸化蛋白,他受多种磷酸化酶的调节包括丝裂原激活蛋白激酶(ERK-和 p38.MAPK),蛋白激酶A和C(PKA,PKC),AMPK和糖原合成酶一3(GSK3)等调控。调控PPARa 生长信号的酶报道有MAPK、PKA和GSK3。PPARβ广泛表达于各种组织,而PPARγ主 要局限表达在血和棕色脂肪,其他组织如骨骼肌和心肌有少量表达。PPAR-γ在诸如炎症、动 脉粥样硬化、胰岛素抵抗和糖代谢调节,以及肿瘤和肥胖等方面 均有着举足轻重的作用,而其众多生物学效应则是通过启动或参与的复杂信号 通路予以实现。鉴于目前人们对PPAR—γ信号通路尚不甚清,PPARs通常是通过与9-cis维 甲酸受体(RXR)结合实现其转录活性的。 2MAPK信号通路:mapk简介:丝裂原激活蛋白激酶(mitogen—activatedproteinkinase,MAPK)是广泛存在于动植物细胞中的一类丝氨酸/苏氨酸蛋 白激酶。作用主要是将细胞外刺激信号转导至细胞及其核内,并引起细胞的生物化学反 应(增殖、分化、凋亡、应激等)。 MAPKs家族的亚族:ERKs(extracellularsignalregulatedkinase) :包括 ERK1、ERK2。生长因子、细胞因子或激素激活此通路,介导细胞增殖、分化。 JNKs(c-JunN-terminalkinase)包括JNK1、JNK2、JNK3。此亚族成员能使Jun转录因子N末 端的两个氨基酸磷酸化而失活,因此称为JunN末端激酶(JNKs)。物理、化学的因素引起的 细胞外环境变化以及致炎细胞因子调节此通 路。 P38MAPKs:丝氨酸/络氨酸激酶,包括p38α、p38β、p38γ、p38δ。p38MAPK参与多种细胞内信息传递过程,能对多种细胞外刺激发生反应,可磷酸化 其它细胞质蛋白,并能从胞浆移位至细胞核而调节转录因子的活性来改变基因的表达水平,从而 介导细胞生长、发育、分化及死亡的全过程。 ERK5:是一种非典型的MAPK通路,也叫大MAPK通路,只有一个成员。它可 被各种刺激因素激活。不仅可以通过磷酸化作用使底物活化,并且通过C端的物理性结合作用 激活底物。 3ERBB信号途径:ErbB蛋白属于跨膜酪氨酸激酶的EGF受体家族成员。ErbB的命名来源于在禽 红白血病B(v-Erb-B)发现的EGF受体的突变体,因而EGF
Toll样受体信号通路图
Toll样受体信号通路图 TLR家族成员(TLR3除外)诱导的炎症反应都经过一条经典的信号通路(图1),该通路起始于TLRs的一段胞内保守序列—Toll/IL-1受体同源区(Toll/IL-1receptorhomologousregion,TIR).TIR可激活胞内的信号介质—白介素1受体相关蛋白激酶(IL-1Rassociatedkinase,IRAK)IRAK-1和IRAK-4、肿瘤坏死因子受体相关因子6(TNFR-associatedfactor6,TRAF-6)、促分裂原活化蛋白激酶(mitogenactivatedproteinkinase,MAPK)和IκB激酶(IκBkinase,IκK),进而激活核因子κB(nuclearfactorκB,NF-κB),诱导炎症因子的表达。 Toll-liker Receptor Signaling 本信号转导涉及的信号分子主要包括: CD14,MD-2,TRAM,TRIF,TIRAP,MyD88,TLR1,TLR2,TLR3,TLR4,TLR5,TLR6,TLR7,TLR8,TLR9,IRAK-1,IRAK-2,IRAK-4,IRAK-M,TRAF6,TRIAD3A,ST2L,SOCS1,RIG-I,FADD,TOLLIP,RIP1,A20,UEV1A,Ubc13,ECSIT,MEKK-1,TAK1,
TBK1,MKK3/6,p38,TAB1/2,MKK4/7,JNK,IKKα,IKKβ,IKKγ,IKKε,NEMO,IκBα,NF-κB,p65/RelA,Casp-8,IRF-3,IRF-7,MA VS等
细胞信号传导通路
细胞信号传导通路 1. 信息传导通路的基本组成 人体细胞之间的信息转导可通过相邻细胞的直接接触来实现,但更重要的也是更为普遍的则是通过细胞分泌各种化学物质来调节自身和其他细胞的代谢和功能,因此在人体中,信息传导通路通常是由分泌释放信息物质的特定细胞、信息物质(包含细胞间与细胞内的信息物质和运载体、运输路径等)以及靶细胞 (包含特异受体等)等构成。 信号转导通常包括以下步骤: 释放信息物质→信息物质经扩散或血循 环到达靶细胞→与靶细胞的受体特异性 结合→受体对信号进行转换并启动细胞 内信使系统→靶细胞产生生物学效应 【1】。通过这一系列的过程,生物体对外界刺激作出反应。 3. 信息物质及其分类 信息物质可分为细胞间信息物质与细胞内信息分子。 凡由细胞分泌的调节靶细胞生命活动的化学物质统称为细胞间信息物质,即第一信使,按照细胞分泌信息物质的方式又可将细胞间信息物质分为神经递质、内分泌激素、局部化学介质和气体信号分子。在细胞内传递细胞调控信号的化学物质称为细胞内信息物质,其组成多样化。通常将Ca2+、cAMP、cGMP、DAG、IP3、Cer、花生四烯酸及其代谢物等这类在细胞内传递信息的小分子化合物称为第二信使。责细胞核内外信息传递的物质称为第三信使,能与靶基因特异序列结合,发挥着转录因子或转录调节因子的作用。 研究发现一些信息物质能与位于分泌细胞自身的受体结合而起调节作用,称为自分泌信号。如肝癌细胞能分泌多种血管生成因子,其中VEGF是目前发现的刺激肿瘤血管形成最重要的促进因子,研究表示,肿瘤细胞分泌的VEGF除选择性作用于肿瘤血管内皮细胞上的特异性VEGF受体(Flt-1和KDR),通过酪氨酸激酶介导的信号转导,调控内皮细胞分化和血管形成外,肿瘤细胞自身也有VEGF受体的表达,而且针对VEGF及其受体的干预措施可以改变这些肿瘤细胞的体外增殖活性和其他生物学特征,这些研究表示肿瘤中存在VEGF的自分泌机制【2】。自分泌所产生的信息物质也具有其独特而重要的生理功能。4. 受体分类及与受体相关的信息转导途径 受体是细胞膜上或细胞内能识别生物活性分子并与之结合的成分,他能把识别和接受的信号正确无误地放大并传递到细胞内部,进而引起生物学效应。存在于细胞质膜上的受体称为膜受体,化学本质绝大部分是糖镶嵌蛋白;位于胞液和细胞核中的受体称为胞内受体,它们
细胞信号转导练习题 四套题
细胞信号转导 第一套 一、选择题(共10题,每题1分) 1、Ca2+在细胞信号通路中是() A. 胞外信号分子 C. 第二信使 B. 第一信使 D. 第三信使 2、动员细胞内源性Ca2+释放的第二信使分子是()。 A. cAMP C. IP3 B. DAG D. cGMP 3、细胞通讯是通过()进行的。 A. 分泌化学信号分子 C. 间隙连接或胞间连丝 B. 与质膜相结合的信号分子 D. 三种都包括在内 4、Ras蛋白由活化态转变为失活态需要( )的帮助。 A. GTP酶活化蛋白(GAP) C. 生长因子受体结合蛋白2(GRB2) B. 鸟苷酸交换因子(GEF) D. 磷脂酶C-γ(PLCγ) 5、PKC在没有被激活时,游离于细胞质中,一旦被激活就成为膜结合蛋白,这种变化依赖于()。 A. 磷脂和Ca2+ C. DAG和 Ca2+ B. IP3和 Ca2+ D. DAG和磷脂 6、鸟苷酸交换因子(GEF)的作用是()。 A. 抑制Ras蛋白 C. 抑制G蛋白 B. 激活Ras蛋白 D. 激活G蛋白 7、cAMP依赖的蛋白激酶是()。 A. 蛋白激酶G(PKG) C. 蛋白激酶C(PKC) B. 蛋白激酶A(PKA) D. MAPK 8、NO信号分子进行的信号转导通路中的第二信使分子是()。 A. cAMP C. IP3 B. DAG D. cGMP 9、在下列蛋白激酶中,受第二信使DAG激活的是()。 A. PKA C. MAPK B. PKC D. 受体酪氨酸激酶 10、在RTK-Ras蛋白信号通路中,磷酸化的()残基可被细胞内的含有SH2结构域的信号蛋 白所识别并与之结合。 A. Tyr C. Ser B. Thr D. Pro 二、判断题(共10题,每题1分) 11、生成NO的细胞是血管平滑肌细胞。() 12、上皮生长因子(EGF)受体分子具酪氨酸激酶活性位点。() 13、Ras蛋白在cAMP信号通路中起着分子开关的作用。()
最新细胞各种信号通路
最新细胞各种信号通路《Cell》 SnapShots are handy reference guides, carefully designed to highlight the key information on a particular topic on one page. SnapShots present up-to-date tables of nomenclature and glossaries, full signaling pathways, and schematic diagrams of cellular processes.Snapshots in red are FREE[/B]. Actin Regulators I[/url] Actin Regulators II[/url]
Antibiotic Inhibition of Protein Synthesis I[/url] Antibiotic Inhibition of Protein Synthesis II[/url] ENHANCED[/url]
Auxin Signaling and Transport Bacterial Appendages I Bacterial Appendages II B7/CD28 Costimulation
BCL-2 Proteins Ca2+-Calcineurin-NF A T Signaling
Ca2+-Dependent Transcription in Neurons Cell-Cycle Regulators I
细胞信号通路大全
1 PPAR 信号通路:过氧化物酶体增殖物激活受体( PPARs) 是与维甲酸、类固醇和甲状腺激素受体相关的配体激活转录因子超家族核激素受体成员。它们作为脂肪传感器调节脂肪代谢酶的转录。PPARs由PPAR a、PPAR B和PPAR 丫3种亚型组成。PPAR a主要在脂肪酸代谢水平高的组织,如:肝、棕色脂肪、心、肾和骨骼肌表达。他通过调控靶基因的表达而调节机体许多生理功能包括能量代谢、生长发育等。另外,他还通过调节脂质代谢的生物感受器而调节细胞生长、分化与凋亡。PPARa 同时也是一种磷酸化蛋白,他受多种磷酸化酶的调节包括丝裂原激活蛋白激酶(ERK-和p38 . M APK),蛋白激酶A和C( PKA , PKC) , AM PK和糖原合成酶一3( G SK3) 等调控。调控PPARa 生长信号的酶报道有M APK 、PKA和G SK3。PPAR B广泛表达于各种组织,而PPAR 丫主要局限表达在血和棕色脂肪,其他组织如骨骼肌和心肌有少量表达。PPAR- 丫在诸如炎症、动脉粥样硬化、胰岛素抵抗和糖代谢调节,以及肿瘤和肥胖等方面均有着举足轻重的作用,而其众多生物学效应则是通过启动或参与的复杂信号通路予以实现。鉴于目前人们对PPAR―丫信号通路尚不甚清,PPARs通常是通过与9-cis维甲酸受体(RXR) 结合实现其转录活性的。 2 MAPK信号通路:mapk简介丝裂原激活蛋白激酶(mitogen —activated protein kinase ,MAPK )是广泛存在于动植物细胞中的一类丝氨酸/苏氨酸蛋白激酶。作用主要是将细胞外刺激信号转导至细胞及其核内,并引起细胞的生物化学反应(增殖、分化、凋亡、应激等)。 MAPKs 家族的亚族:ERKs (extracellular signal regulated kinase) :包括ERK1、 ERK2。生长因子、细胞因子或激素激活此通路,介导细胞增殖、分化。 JNKs(c-Jun N-terminal kinase) 包括JNK1、JNK2、JNK3。此亚族成员能使 Jun 转录因子N 末端的两个氨基酸磷酸化而失活,因此称为Jun N 末端激酶(JNKs)。物理、化学的因素引起的细胞外环境变化以及致炎细胞因子调节此通路。 P38 MAPKs :丝氨酸/ 络氨酸激酶,包括p38 a、p38 B、p38 丫、p38 3。p38 MAP K 参与多种细胞内信息传递过程,能对多种细胞外刺激发生反应,可磷酸化其它细胞质蛋白,并能从胞浆移位至细胞核而调节转录因子的活性来改变基因的表达水平,从而介导细胞生长、发育、分化及死亡的全过程。 ERK5:是一种非典型的MAPK通路,也叫大MAPK通路,只有一个成员。它可被各种刺激因素激活。不仅可以通过磷酸化作用使底物活化,并且通过 C 端的物理性结合作用激活底物。 3 ERBB信号途径:ErbB蛋白属于跨膜酪氨酸激酶的EGF受体家族成员。ErbB的命名来源于在禽红白血病B( v-Erb-B) 发现的EGF 受体的突变体,因而EGF 受体亦称为“ ErbB1 ” 。人源ErbB2 称为HER2, 特指人的EGF 受体。ErbB 家族的另外两个
pikakt信号通路图谱
p i k a k t信号通路图谱 WTD standardization office【WTD 5AB- WTDK 08- WTD 2C】
P I3K/A K T信号通路 磷脂酰肌醇3-激酶(PI3Ks)信号参与增殖、分化、凋亡和葡萄糖转运等多种细胞功能的调节. 近年来发现, IA型PI3K和其下游分子蛋白激酶B(PKB或Akt)所组成的信号通路与人类肿瘤的发生发展密切相关. 该通路调节肿瘤细胞的增殖和存活, 其活性异常不仅能导致细胞恶性转化, 而且与肿瘤细胞的迁移、黏附、肿瘤血管生成以及细胞外基质的降解等相关, 目前以PI3K-Akt信号通路关键分子为靶点的肿瘤治疗策略正在发展中. 在PI3K家族中, 研究最广泛的是能被细胞表面受体所激活的I型PI3K. 哺乳动物细胞中Ι型PI3K又分为IA和IB两个亚型, 他们分别从酪氨酸激酶连接受体和G蛋白连接受体传递信号.IA 型PI3K是由催化亚单位p110和调节亚单位p85所组成的二聚体蛋白, 具有类脂激酶和蛋白激酶的双重活性.PI3K通过两种方式激活, 一种是与具有磷酸化酪氨酸残基的生长因子受体或连接蛋白相互作用, 引起二聚体构象改变而被激活; 另一种是通过Ras和p110直接结合导致PI3K的活化. PI3K激活的结果是在质膜上产生第二信使PIP3, PIP3与细胞内含有PH结构域的信号蛋白Akt和 PDK1(phosphoinositidedependentkinase-1)结合, 促使PDK1磷酸化Akt蛋白的 Ser308导致Akt的活化. Akt还能通过PDK2(如整合素连接激酶ILK)对其Thr473的磷酸化而被激活.活化的Akt通过磷酸化作用激活或抑制其下游靶蛋白Bad 、 Caspase9、NF-κB、GSK-3、FKHR、 p21Cip1和p27 Kip1等, 进而调节细胞的增殖、分化、凋亡以及迁移等. PI3K-Akt信号通路的活性被类脂磷酸酶PTEN(phosphatase and tensin homolog deleted on chromosome ten)和SHIP(SH2-containing inositol 5-phosphatase)负调节, 他们分别从PIP3的3′和5′去除磷酸而将其转变成PI(4,5)P2和PI(3,4)P2而 降解. 迄今为止, 尚未发现下调Akt活性的特异磷酸酶, 但用磷酸酶抑制剂处理细胞后, 发现Akt的磷酸化和活性均有所增加. 最近发现Akt能被一种C末端调节蛋白(CTMP)所失活, CTMP能结合Akt并通过抑制Akt的磷酸化而阻断下游信号的传递, CTMP的过表达能够逆转v-Akt转化细胞的表型. 热休克蛋白90(HSP90)亦能结合Akt, 阻止Akt被PP2A磷酸酶的去磷酸化而失活, 因此具有保护Akt的作用. 本信号转导涉及的信号分子主要包括 Integrin,FAK,Paxillin,ILK,PIP3,S6,p70S6K,RTK,Gab1,Gab2,IRS-1, PI3K,PTEN,AKT,PDK1,Cytokine Receptor,Jak1,CD19,BCR,Ag,BCAP,Syk,Lyn,GPCR,TSC1,TSC2,Gβγ,GαGTP,PP2A,PHLPP,CTMP,PDCD4,4E-BP1,ATG13,mTORC1,TSC1,TSC2,PRAS40,XIAP,FoxO1,Bim,Bcl-2,Bax,MDM2, p53,Bax,Bad,14-3-3,Wee1,Myt1,p27Kip1,p21Waf1/Cip1,CyclinD1,GSK-3,GS,Bcl-2,mTORC2,LaminA,Tpl2,IKKα,eNOS,GABAAR,Huntingtin,Ataxin-1,PFKFB2,PIP5K,AS160等。
主流信号通路大盘点
PI3K/AKT信号通路
介绍 1987年,Staal等发现小鼠的白血病病毒Akt8可以引起水貂上皮细胞系CCL264出现恶性转化灶,随后在这个反转录病毒中找到了一个癌基因,并命名为丝氨酸/苏氨酸蛋白激酶(Akt)。1991年,3个独立的研究小组分别宣布找到了Akt基因,因其与蛋白激酶A(PKA)及蛋白激酶C(PKC)在结构上相似,因此又被命名为蛋白激酶B(PKB)。1995年,Akt作为磷脂酰肌醇-3-激酶(PI3K,phosphatidylinositol-3-kinase)经多种生长因子活化后的下游靶点被发现,同时第一个Akt底物糖原合成激酶3(glycogen synthesis kinase-3,GSK-3)被确认,分别揭示了PI3K/Akt通路在调控细胞新陈代谢中的重要作用。查看更多 在该信号转导通路中往往会涉及以下信号分子: ntegrin,FAK,Paxillin,ILK,PIP3,S6,p70S6K,RTK,Gab1, Gab2,IRS-1,PI3K,PTEN,AKT,PDK1,CytokineReceptor,Jak1,CD19,BCR,Ag,BCAP,Syk,Lyn,GPCR,TSC1,TSC2,Gβγ, GαGTP,PP2A,PHLPP,CTMP,PDCD4,4E-BP1,ATG13, mTORC1,TSC1,TSC2,PRAS40,XIAP,FoxO1,Bim,Bcl-2,Bax,MDM2,p53,Bax,Bad,14-3-3,Wee1,Myt1,p27Kip1, p21Waf1/Cip1,CyclinD1,GSK-3,GS,Bcl-2,mTORC2,LaminA, Tpl2,IKKα,eNOS,GABAAR,Huntingtin,Ataxin-1,PFKFB2,PIP5K,AS160
第八章 细胞信号转导
第八章细胞信号转导 名词解释 1、蛋白激酶protein kinase 将磷酸基团转移到其他蛋白质上的酶,通常对其他蛋白质的活性具有调节作用。 2、蛋白激酶C protein kinase C 一类多功能的丝氨酸/苏氨酸蛋白激酶家族,可磷酸化多种不同的蛋白质底物。 3、第二信使second messenger 第一信使分子(激素或其他配体)与细胞表面受体结合后,在细胞内产生或释放到细胞内的小分子物质,如cAMP,IP3,钙离子等,有助于信号向胞内进行传递。 4、分子开关molecular switch 细胞信号转导过程中,通过结合GTP与水解GTP,或者通过蛋白质磷酸化与去磷酸化而开启或关闭蛋白质的活性。 5、磷脂酶C phospholipid C 催化PIP2分解产生1,4,5-肌醇三磷酸(IP3)和二酰甘油(DAG)两个第二信使分子。 6、门控通道gated channel 一种离子通道,通过构象改变使溶液中的离子通过或阻止通过。依据引发构象改变的机制的不同,门控通道包括电位门通道和配体门通道两类。 7、神经递质neurotransmitter 突触前端释放的一种化学物质,与突触后靶细胞结合,并改变靶细胞的膜电位。 8、神经生长因子nerves growth factor,NGF 神经元存活所必需的细胞因子 9、受体receptor 任何能与特定信号分子结合的膜蛋白分子,通常导致细胞摄取反应或细胞信号转导。10、受体介导的胞吞作用receptor mediated endocytosis 通过网格蛋白有被小泡从胞外基质摄取特定大分子的途径。被转运的大分子物质与细胞表面互补性的受体结合,形成受体-配体复合物并引发细胞质膜局部内化作用,然后小窝脱离质膜形成有被小泡而将物质吞入细胞内。 11、受体酪氨酸激酶receptor tyrosine kinase,RTK 能将自身或胞质中底物上的酪氨酸残基磷酸化的细胞表面受体。主要参与细胞生长和分化的调控。 12、调节型分泌regulated secretion 细胞中已合成的分泌物质先储存在细胞质周边的分泌泡中,在受到适宜的信号刺激后,才与质膜融合将内容物分泌到细胞表面。 13、细胞通讯cell communication 信号细胞发出的信息传递到靶细胞并与受体相互作用,引起靶细胞产生特异性生物学效应的过程。 14、细胞信号传递cell signaling 通过信号分子与受体的相互作用,将外界信号经细胞质膜传递到细胞内部,通常传递至细胞核,并引发特异性生物学效应的过程。 15、信号转导signal transduction 细胞将外部信号转变为自身应答反应的过程。 16、组成型分泌constitutivesecretion
