除杂题大全
除杂题大全
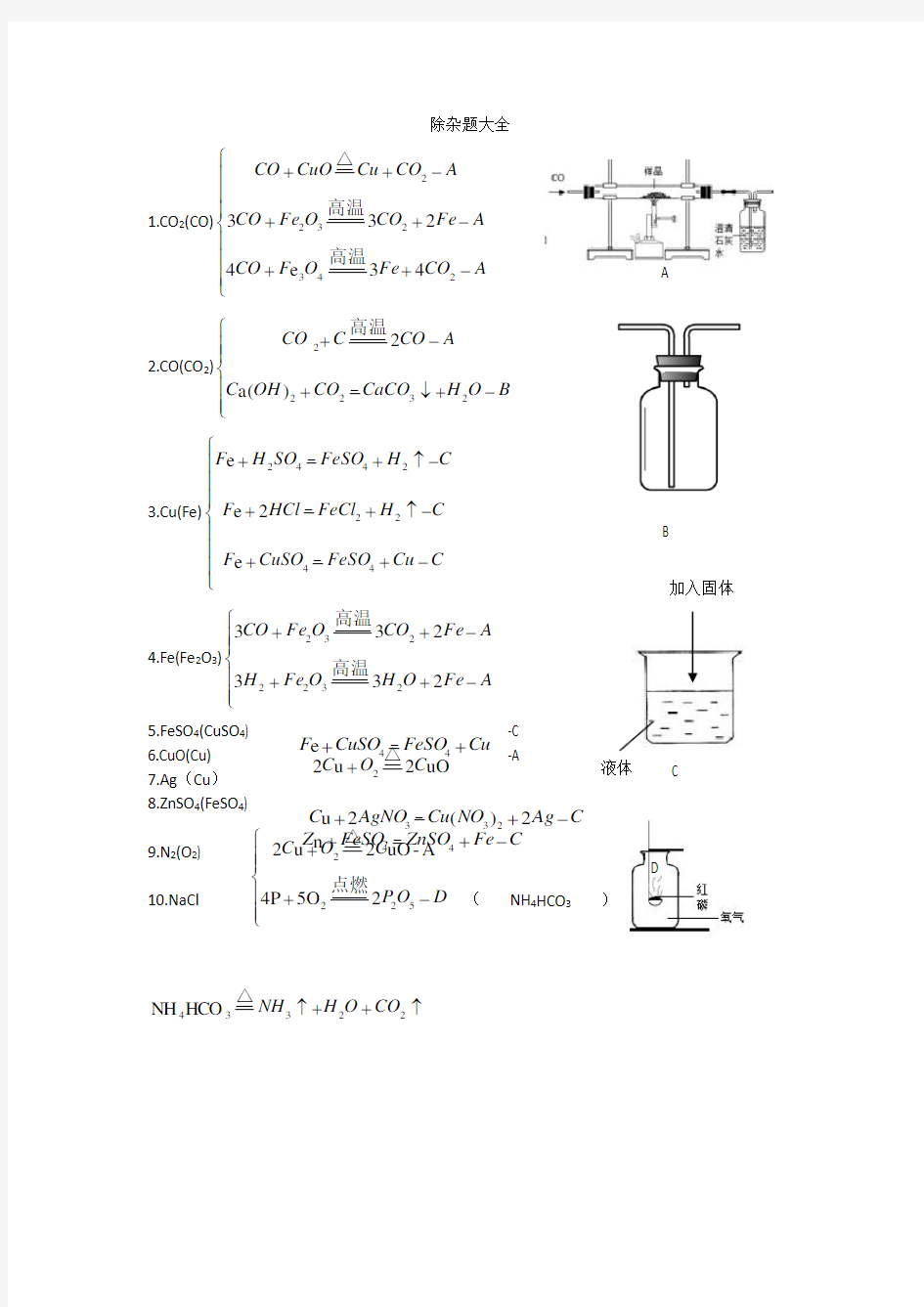
1.CO 2(CO)??????
???-++-++-++A
CO Fe O F CO A Fe CO O Fe CO A CO Cu CuO CO 243232243e 4233高温
高温
△ 2.CO(CO 2)???????-+↓+-+B O H CaCO CO OH C A
CO C CO 23222)(a 2 高温
3.Cu(Fe)????
??
???-++-↑++-↑++C Cu FeSO CuSO F C H FeCl HCl F C H FeSO SO H F 44222442e 2e e
4.Fe(Fe 2O 3)???????-++-++A
Fe O H O Fe H A
Fe CO O Fe CO 2332332322232高温
高温
5.FeSO 4(CuSO 4) -C
6.CuO(Cu)
-A 7.Ag (Cu ) 8.ZnSO 4(FeSO 4)
9.N 2(O 2) (NH 4HCO 3
) 10.NaCl ↑++↑22334HCO NH CO O H NH △
A Cu FeSO
CuSO
F ++
44e C
Ag NO Cu AgNO C -++2)(2u 233C Fe ZnSO FeSO Z -++44n ??????
?-++D O P C O C 522225O 4P A -uO 2u 2点燃
△ B C uO 2u 22
C O C △+
D 液体 加入固体
高中化学学习方法..
高中化学学习方法 大家好,我是王伟川,14级北大化学学院 今天与大家分享化学部分的经验 这部分比较长 因为化学,其实高中不同的三个部分,其应对战略并不完全相同 家长可以先了解,然后后续让孩子看 为什么家长也要看? 因为家长如果对于孩子所学,一无所知,很难和孩子沟通交流,并不需要家长具体了解内容,而是框架性就足够 这样,家长催促孩子复习,就不是快去复习! 而是,你那个元素化学看得如何了? 也方便和老师的沟通 关于高考化学的学习方法,大部分我们所看到的建议与参考,或大同小异,或笼统概括,或蜻蜓点水地说出“归纳很重要、做题也重要”这样的言语却不加细释 乍看之下言简意赅,然而实际上当学生想要学习它的做法时又显得无从下手,不知所措。 我决定从一个高考亲历者的角度出发,还原出当年我自己学习化学过程中的真实心得与经验,将所有的方法与建议都以最详细的方式呈现出来 力求“手把手”地教会学生学习化学的方法。当然,方法因人而异,供各位学弟学妹参考。
很多同学想要学好化学,于是急着去做题、去看书 但是首先我们需要弄清楚的是,高中的化学分为好几个类别 总的来说高中化学通过【图表总结,类比学习的方式梳理知识点】最为有效 然而对每一个类别都有不同的方法来学习,都有自己的知识图表,如果连自己究竟是哪一块最薄弱尚未清楚,所做的努力可能就是事倍功半了。 从知识点上分,高中化学,分为元素化学、有机化学、化学反应原理三个大部分,各种具体的化学实验贯穿其中 基本上,高一上,最多高一下一点点,解决初高中衔接和元素化学高一下进行化学反应原理,这个基本上要一直到高二上 剩下是有机化学 这里我们举一些例子 元素化学是整个高中阶段知识最琐碎的一块内容 所以在这种背景下,显而易见的一个特点就是:元素化学要记的细节特别多,而对于一种元素又要掌握它的多种相关物质,知识点显得杂而碎。 所以我们必须有针对性的给出一些可操作性强的方法: 1.自行绘制物质转化框图——一定要自己书写。 注意,这种总结,框图,你必须自己写,不能是模糊地我记得的!给一张白纸,你自己写下来,梳理出来 比如说,我通过一周的学习,老师把碱金属这一块差不多讲完了
四年级简便计算试题(大全)
计算练习题 姓名 计算下面各题,能简便计算的要简便计算。 158+262+138 375+219+381+225 5001-247-1021-232 (181+2564)+2719 378+44+114+242+222 276+228+353+219 (375+1034)+(966+125) (2130+783+270)+1017 99+999+9999 7755-(2187+755) 2214+638+286 3065-738-1065
899+344 2357-183-317-357 2365-1086-214 计算练习题 姓名 计算下面各题,能简便计算的要简便计算。 1883-398 12×25 75×24 138×25×4 (13×125)×(3×8) (12+24+80)×50
704×25 25×32×125 32×(25+125) 88×125 102×76 58×98 计算练习题 姓名 计算下面各题,能简便计算的要简便计算。 83×102-83×2 98×199 123×18-123×3+85×123 50×(34×4)×3 25×(24+16)178×99+178
79×42+79+79×57 98x101 56x101-56 16800÷120 20x(53+21) 125x(4x8)x25 2356-(1356-721)1235-(780+235)(300+6)x12 计算练习题 姓名 计算下面各题,能简便计算的要简便计算。 25x(4+8) 125x(35+8) (13+24)x8
84x101 504x25 78x102 25x204 99x64 99x16
初中化学除杂专题(可直接打印)
初中化学除杂专题(可直接打印) 一、解除杂题的原则、要领、方法三原则:①不引入新杂质;②不减少被提纯物质的质量;③杂质便于分离。三要领:①根据物理性质或化学性质的差异;②确定除杂质方法;③选择适宜试剂。六种常用方法:方法适用范围或原理举例化学方法化气法与杂质反应生成气体而除去除NaCl中Na2CO3,可加适量稀HCl:Na2CO3+2HCl=2NaCl+ CO2↑+ H2O沉淀法将杂质转化为沉淀过滤除去除去NaOH中的Na2CO3,可加适量的Ca(OH)2:Na2CO3+ Ca(OH)2==CaCO3↓+2NaOH置换法将杂质通过置换反应而除去除Fe SO4中的Cu SO4,可加过量的铁粉,再过滤:CuSO4+Fe==Cu+Fe SO4溶解法将杂质溶于某种试剂而除去除C粉中的CuO粉,可加适量稀硫酸,再过滤:CuO+ H2SO4==CuSO4+ H2O加热法杂质受热易分解,通过加热将杂质除去除CaO中的CaCO3可加热:CaCO3CaO+ CO2↑转化法将杂质通过化学反应转化为主要成分除CO2中的CO,可将气体通过灼热的CuO:CO+CuOCu+CO2 二、常见物质的除杂 一、气体除杂:(括号中为杂质) 1、CO2(含O2):将气体通过灼热的铜网。 2、 CO2(含H2或CO):将气体通过灼热的氧化铜。 3、 O2或CO2或H2(含H2O):将气体通过浓硫酸或氧化钙或氯化钙等干燥剂。
4、 O2或H2或CO(含CO2或SO2):将气体通入氢氧化钠溶液中 二、固体除杂: 1、Cu(含Fe或Mg或Zn):加入足量的稀盐酸或稀硫酸,过滤。(将活泼金属用酸溶解) 2、 Fe(含Cu):用磁铁将铁粉吸引出来。 3、 Cu(含CuO)、Fe(含Fe2O3):高温下与H2或CO反应。(将金属氧化物还原成金属) 4、 CuO(含Cu或C):在空气中灼烧。 5、 CaO(含CaCO3):高温煅烧(CaCO3分解成CaO和CO2) 6、 CaCO3(含CaO):加足量水溶解,过滤,取滤渣。(CaO 与水反应溶于水) 7、 CaCO3(含CaCl2):加足量水溶解,过滤,取滤渣。(CaCl2溶于水,CaCO3不溶于水) 8、 CaCl2(含CaCO3):加足量水溶解,过滤,取滤液蒸发。 9、 Ca(OH)2(含CaO):加足量水。(CaO与水反应生成氢氧化钙) 三、溶液除杂: 1、FeSO4溶液(含H2SO4或CuSO4)、FeCl2溶液(含盐酸或CuCl2):过量铁粉,过滤,取滤液。有关反应:
《三角形》证明题专题训练
《三角形》证明题专题训练 名字_____________ 第一组 简单角度计算 1.如图,∠1=40°,∠2=25°,∠A=35°,求∠BDC 的度数。 2.如图,∠A=80°,∠B=25°,∠C=30°,求∠BDC 的度数。 3.如图,AB ∥CD ,∠BAE=∠DCE=45°,求∠E 的度数. 4.如图,在△ABC 中,∠B=∠C,FD⊥BC,DE⊥AB,∠AFD=158°,求∠EDF 的度数. 第二组 折叠问题 5.如图,将一长方形纸片按如图方法折叠,BC 、BD 为折痕,求∠CBD 的度数; 6.如图,把△ABC 沿DE 折叠,请求出∠A 与∠1+∠2之间的数量关系。 第三组 三角形内角外角平分线夹角 7.如图,△ABC 的两条内角平分线交于点P ,求证:∠P=90°+ ∠A ; 8.如图,△ABC 的两条外角平分线交于点P ,求证:∠P=90°+ ∠A ; 9.如图,△ABC 的一条内角平分线与一条外角平分线交于点P ,求证:∠P= ∠A 第四组 三角形边长大小比较 10.如图,点P 是△ABC 内任意一点,说明:PA+PB+PCA>2 1(AB+BC+AC) ; 11.如图,AC 和BD 相交于点O ,说明:AC+BD >AB+CD 。 第五组 三角形中线平分面积
12.如图,CD 、DE 、EF 分别是△ABC 、△ACD 、△ADE 的中线,若△AFE 的面积为12cm ,求ABC S ?; 13.如图,已知∠1=∠2=∠3,∠FDE=43°,∠DEF=64°,求△ABC 的各内角度数。 14.如图,AD=1,DC=2,AB=4,△ABC 的面积等于△DEC 的面积的2倍,求BE 的长。 15.如图,长方形ABCD 的长为a ,宽为b ,E 、F 分别是BC 和CD 的中点,求四边形ABGD 面积。 第六组 多边形周长 16.如图,在三角形ABC 中,AD 是BC 边上的中线,三角形ABD 的周长比三角形ACD 的周长小5,求出AC 与AB 的边长的差。 17. 如图,六边形ABCDEF 的六个角都是120°,边长AB =2,BC =8,CD =11,DE =6,EF=4,FA=12,求出△PGH 的周长。 第七组 三角板组合 18.如图,把一幅三角板按如图方式放置,求∠1的度数。 19.如图,把一幅三角板按如图方式放置,求两条斜边所形成的钝角α的度数。 20.如图,将两块三角板的直角顶点重合,当三角板AOB 绕点O 旋转时, 写出∠BOC 与∠AOD 之间的数量关系 第八组 三角形一边上角平分线与高线的夹角 21.如图,AF 、AD 分别是?ABC 的高和角平分线,且∠B =36°,∠C=76°,求∠DAF 的度数; 22.如图,在△ABC 中, AD ⊥BC 于D ,AE 平分∠DAC ,∠BAC=800,∠B=600,求∠AEC 的度数. 23. 如图,在△ABC 中, AD ⊥BC 于D ,AE 平分∠DAC ,∠B>∠C ,求证:∠DAE=2 1(∠B-∠C ) 第九组 利用三角形面积相等求底、高 24.如图,AB ⊥BC ,CD ⊥AD ,AB=4cm ,CD=3cm ,AE=5cm ,求CE 的长。 25.如图,AD ⊥BC ,BE ⊥AC ,CF ⊥AB ,BC =16,AD =3,BE =4,CF =6,求△ABC 的周长。 26.如图,△ABC 中,AB=2cm ,BC=4cm ,△ABC 的高AD 与CE 的比是多少? 第十组 方位角中的三角形 27.如图,有甲、乙、丙、丁四个小岛,乙、丙在甲的正东方,丁在丙的正北方,甲岛在丁岛的南偏西52°方向,乙岛在丁岛的南偏东40°方向。丁岛分别在甲岛和乙岛的什么方向;
高中化学计算方法总结:差量法
差量法 差量法是依据化学反应前后的某些变化找出所谓的理论差量(固体质量差、液体质量差、气体体积差、气体物质的量之差等),与反应物或生成物的变化量成正比而建立的一种解题方法。此法将“差量”看作化学方程式右端的一项,将已知差量(实际差量)与化学方程式中的对应差量(理论差量)列成比例,其他解题步骤与按化学方程式列比例解题完全一样。在根据化学方程式的计算中,有时题目给的条件不是某种反应物或生成物的质量,而是反应前后物质的质量的差值,解决此类问题用差量法十分简便。此法的关键是根据化学方程式分析反应前后形成差量的原因(即影响质量变化的因素),找出差量与已知量、未知量间的关系,然后再列比例式求解。 一.固体差量 1.将19 g Na2CO3和NaHCO3的混合物加热至质量不再减少为止,称得剩余固体质量为15.9 g,则原混合物中NaHCO3的质量分数是_____%。44.2%。 二.液体差量 2.用含杂质(杂质不与酸作用,也不溶于水)的铁10 g与50 g稀硫酸完全反应,滤去杂质,所得液体质量为55.4 g,则该铁的纯度是_____%。56%。 三.气体差量 3.将12 g CO和CO2的混合气体通过灼热的氧化铜后,得到气体的总质量为18 g,则原混合气体中CO的质量分数是_____%。87.5%。 四.增减差量 4.在天平左右两边的托盘天平上,各放一个盛有等质量、等溶质质量分数的足量稀硫酸的烧杯,待天平平衡后,向两烧杯中分别加入铁和镁,若要使天平仍保持平衡,则所加铁和镁的质量比是_____。77/81。 五.体积差量 5.在一个6 L的密闭容器中,放入3 L X和2 L Y,在一定条件下发生下列反应:4X(g)+ 3Y(g) 2Q(g)+nR(g),达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小1/3,则该反应的n值是 A.4 B.5 C.6 D.7 6.同温同压下,40 mL CO、CO2和O2的混合气体点燃后,恢复到原来的状况,剩余气体36 mL,则原混合气体中O2不少于 A.4 mL B.8 mL C.10 mL D.12 mL 六.压强差量 7.标准状况下,一容积不变的的密闭容器里充满3 L H2和O2的混合气体,点燃完全反应后,恢复至原状态,压强变为原来的1/2,则原混合气体中H2和O2的体积分别是 __________。2.5,0.5;1,2。 七.巧练 8.有KCl、KBr和KI混合物3.87 g,溶于水配成溶液,向溶液中加入足量的AgNO3溶液,得到的沉淀干燥后是6.63 g,则原混合物中钾元素的质量分数是 A.51% B.40.3% C.32% D.24% 9.将足量的铁粉投入到CuCl2和FeCl3组成的混合液中,充分反应后,过滤洗涤并干燥
小学阶段简便计算及练习题大全(精品)
运算定律与简便计算 (一)加减法运算定律 1.加法交换律 定义:两个加数交换位置,和不变 字母表示:a = a+ + b b 例如:16+23=23+16 546+78=78+546 2.加法结合律 定义:先把前两个数相加,或者先把后两个数相加,和不变。 字母表示:) + a+ = + b + ) c (c ( b a 注意:加法结合律有着广泛的应用,如果其中有两个加数的和刚好是整十、整百、整千的话,那么就可以利用加法交换律将原式中的加数进行调换位置,再将这两个加数结合起来先运算。 例1.用简便方法计算下式: (1)63+16+84 (2)76+15+24 (3)140+639+860 举一反三: (1)46+67+54 (2)680+485+120 (3)155+657+245 3.减法交换律、结合律 注:减法交换律、结合律是由加法交换律和结合律衍生出来的。 减法交换律:如果一个数连续减去两个数,那么后面两个减数的位置可以互换。 字母表示:b - = - a- - c b a c 例2.简便计算:198-75-98 减法结合律:如果一个数连续减去两个数,那么相当于从这个数当中减去后面两个数的和。 字母表示:) - = a+ - - b (c b a c 例3.简便计算:(1)369-45-155 (2)896-580-120
4.拆分、凑整法简便计算 拆分法:当一个数比整百、整千稍微大一些的时候,我们可以把这个数拆分成整百、整千与一个较小数的和,然后利用加减法的交换、结合律进行简便计算。例如:103=100+3,1006=1000+6,… 凑整法:当一个数比整百、整千稍微小一些的时候,我们可以把这个数写成一个整百、整千的数减去一个较小的数的形式,然后利用加减法的运算定律进行简便计算。例如:97=100-3,998=1000-2,… 注意:拆分凑整法在加、减法中的简便不是很明显,但和乘除法的运算定律结合起来就具有很大的简便了。 例4.计算下式,能简便的进行简便计算: (1)89+106 (2)56+98 (3)658+997 随堂练习:计算下式,怎么简便怎么计算 (1)730+895+170 (2)820-456+280 (3)900-456-244 (4)89+997 (5)103-60 (6)458+996 (7)876-580+220 (8)997+840+260 (9)956—197-56 (二)乘除法运算定律 1.乘法交换律 定义:交换两个因数的位置,积不变。 字母表示:a ? b = a? b 例如:85×18=18×85 23×88=88×23 2.乘法结合律 定义:先乘前两个数,或者先乘后两个数,积不变。 字母表示:) ? a? = ? ? b ) ( (c b a c
(完整版)初中化学物质除杂(提纯)专题完整版
除杂(提纯)的原则:不增不减、易分离 除杂(提纯)的原则:三原则:①把杂质除掉、保留原物质,不引入新杂质; ②不减少被提纯物质的质量;③杂质便于分离。 四要领:①根据物理性质或化学性质的差异;②确定除杂质方法; ③选择适宜试剂(注意加入的试剂不能与原物质反应)。 ④如果在具体操作中还应注意所加试剂的量和操作语言的描述。 一.物理方法 1.过滤法:用来除去可溶物和不溶物 常见不溶于水的沉淀有:AgCl、BaCO3、BaSO4、大多数的碳酸盐、以及Cu(OH)2、Fe(OH)3、Al(OH)3等氢氧化物、MnO2等。 例:KCl(AgCl): Na2SO4 (BaSO4): KCl(MnO2): 2、结晶法: 大多数固体物质的溶解度随温度升高而增大,曲线为"陡升型",如KNO3 少数固体物质的溶解度受湿度的影响很小,曲线为"缓升型",如NaCl 极少数固体物质的溶解度随湿度的升高而减小,曲线为"下降型",Ca(OH)2 例:下列混合物适宜用结晶法分离的是( ) A. NaNO3 Na2CO3 B. NaNO3 NaCl C. NaOH Mg(OH)2 D. NaCl BaSO4 3. 磁铁吸引:分离有磁性和无磁性的: 铁粉和硫粉 铜粉和铁粉 4. 洗气法: H2(H2O) CO2(H2O) 二.化学方法:(沉淀法、气体法、置换法、吸收法、其它法) 1.沉淀法:使混合物中的杂质与适当试剂反应,生成沉淀通过过滤而除去。 例:.如何除去下列物质中的杂质(括号内为杂质),用化学方程式表示 NaCl( Na2SO4 )_____________________________________ HCl ( H2SO4 )_____________________________________ HNO3 (HCl ) _____________________________________ NaCl(MgCl2) ____________________________________ 2.气体法:将混合物中的杂质与适当试剂反应变成气体而除去。 一般规律为:CO32-+ 强酸= CO2;NH4+ + OH- = NH3 例:如何除去下列物质中的杂质(括号内为杂质),用化学方程式表示 NaCl( Na2CO3 )____________________________________ Na2SO4(Na2CO3)____________________________________ CaCl2溶液(盐酸) KCl (NH4Cl) ______________________________________ KNO3(KOH) ______________________________________ Na2SO4(NaOH) ___________________________________
全等三角形证明经典题(含答案)
全等三角形证明经典题(含答案) 1. 已知:AB=4,AC=2,D 是BC 中点,111749AD 是整数,求AD 解:延长AD 到E,使AD=DE ∵D 是BC 中点∴BD=DC 在△ACD 和△BDE 中 AD=DE ∠BDE=∠ADCBD=DC ∴△ACD ≌△BDE ∴AC=BE=2∵在△ABE 中AB-BE <AE <AB+BE ∵AB=4即 4-2<2AD <4+21<AD <3∴AD=2 2. 已知:D 是AB 中点,∠ACB=90°,求证:12 CD AB 延长CD 与P ,使D 为CP 中点。连接AP,BP ∵DP=DC,DA=DB ∴ACBP 为平行四边形又∠ACB=90∴平行四边形ACBP 为矩形 ∴AB=CP=1/2AB 3. 已知:BC=DE ,∠B=∠E ,∠C=∠D ,F 是CD 中点,求证:∠1=∠2 4. 5. 证明:连接BF 和EF ∵BC=ED,CF=DF,∠BCF=∠EDF ∴三角形BCF 全等于三角形EDF(边角边)∴BF=EF,∠CBF=∠DEF 连接BE 在三 角形BEF 中,BF=EF ∴∠EBF=∠BEF 。 ∵∠ABC=∠AED 。∴∠ABE=∠AEB 。∴AB=AE 。在三角形ABF 和三角形AEF 中 AB=AE,BF=EF,∠ABF=∠ABE+∠EBF=∠AEB+∠BEF=∠AEF ∴三角形ABF 和三角形AEF 全等。∴∠BAF=∠ EAF(∠1=∠2)。 6. 已知:∠1=∠2,CD=DE ,EF//AB ,求证:EF=AC A D B C
过C 作CG ∥EF 交AD 的延长线于点GCG ∥EF ,可得,∠EFD =CGD DE =DC ∠FDE =∠GDC (对顶角)∴△EFD ≌△CGD EF =CG ∠CGD =∠EFD 又EF ∥AB ∴∠EFD =∠1∠1=∠2 ∴∠CGD =∠2∴△AGC 为等腰三角形,AC =CG 又EF =CG ∴EF =AC 7. 已知:AD 平分∠BAC ,AC=AB+BD ,求证:∠B=2∠ C 证明:延长AB 取点E ,使AE =AC ,连接DE ∵AD 平分∠BAC ∴∠EAD =∠CAD ∵AE =AC ,AD =AD ∴△AED ≌△ACD (SAS ) ∴∠E =∠C ∵AC =AB+BD ∴AE =AB+BD ∵AE =AB+BE ∴BD =BE ∴∠BDE =∠E ∵∠ABC =∠E+∠BDE ∴∠ABC =2∠E ∴∠ABC =2∠C 8. 已知:AC 平分∠BAD ,CE ⊥AB ,∠B+∠D=180°,求证:AE=AD+BE 证明: 在AE 上取F ,使EF =EB ,连接CF ∵CE ⊥AB ∴∠CEB =∠CEF =90° ∵EB =EF ,CE =CE ,∴△CEB ≌△CEF ∴∠B =∠CFE ∵∠B +∠D =180°,∠CFE +∠CFA =180° ∴∠D =∠CFA ∵AC 平分∠BAD ∴∠DAC =∠FAC ∵AC =AC ∴△ADC ≌△AFC (SAS ) ∴AD =AF ∴AE =AF +FE =AD +BE 9. 如图,四边形ABCD 中,AB ∥DC ,BE 、CE 分别平分∠ABC 、∠BCD ,且点E 在AD 上。求证:BC=AB+DC 。 在BC 上截取BF=AB ,连接EF ∵BE 平分∠ABC ∴∠ABE=∠FBE 又∵BE=BE ∴⊿ABE ≌⊿FBE (SAS ) ∴∠A=∠BFE ∵AB//CD ∴∠A+∠D=180o ∵∠BFE+∠CFE=180o ∴∠D=∠CFE 又∵∠DCE=∠FCECE 平分∠BCDCE=CE ∴⊿DCE ≌⊿FCE (AAS )∴CD=CF ∴BC=BF+CF=AB+CD 10. 已知:AB//ED ,∠EAB=∠BDE ,AF=CD ,EF=BC ,求证:∠F=∠C AB ‖ED ,得:∠EAB+∠AED=∠BDE+∠ABD=180度, ∵∠EAB=∠BDE , B A C D F 2 1 E D C B A F E A
高中有机化学计算题方法总结(修正版)
方程式通式 CXHY +(x+ 4y )O2 →xCO2+ 2y H2O CXHYOz +(x+24z y -) O2 →xCO2+2 y H2O 注意 1、有机物的状态:一般地,常温C 1—C 4气态; C 5—C 8液态(新戊烷C 5常温气态, 标况液态); C 9以上固态(不严格) 1、有机物完全燃烧时的耗氧量 【引例】完全燃烧等物质的量的下列有机物,在相同条件下,需要O 2最多的是( B ) A. 乙酸乙酯 CH 3COOC 2H 5 B. 异丁烷 CH(CH 3)3 C. 乙醇 C 2H 5OH D. 葡萄糖 C 6H 12O 6 ①等物质的量的烃C X H Y 完全燃烧时,耗氧量决定于的x+ 4 y 值,此值越大,耗氧量越多; ②等物质的量的烃的含氧衍生物C X H Y O Z 完全燃烧耗氧量决定于的x+24z y -值,此值越大,耗氧量越多; 【注】C X H Y 和C X H Y O Z 混搭比较——把衍生物C X H Y O Z 分子式写成残基·不耗氧的 CO 2 · H 2O 后,剩余残基再跟烃C X H Y 比较。如比较乙烯C 2H 4和乳酸C 3H 6O 3,后者就可写成 C 2H 4?1CO 2?1H 2O ,故等物质的量的二者耗氧量相同。 【练习】燃烧等物质的量的下列各组物质,耗氧量不相同的是( B ) A .乙烷CH 3CH 3与丙酸C 2H 5COOH B .乙烯CH 2=CH 2与乙二醇CH 2OH CH 2OH C .乙炔HC ≡CH 与乙醛CH 3CHO D .乙炔HC ≡CH 与乙二醇CH 2OH CH 2OH 【引例】等质量的下列烃完全燃烧生成CO 2和H 2O 时,耗氧量最多的是( A ) A .C 2H 6 B . C 3H 8 C .C 4H 10 D .C 5H 12 ③等质量的烃CxHy 完全燃烧时,耗氧量决定于x y 的值,此值越大,耗氧量越多; ④等质量的烃的含氧衍生物CxHyOz 完全燃烧时,先化成 Cx Hy ?mCO2?nH2O 的形式,耗 氧量决定于 ' 'x y 的值,此值越大,耗氧量越多;
小学数学五年级上册简便计算练习题集锦
小学数学五年级上册简便计算练习1 请用简便方法计算下列各题 0.25×0.28 0.125×3.2×2.5 35×40.2 0.25×4÷0.25×4 3.5×9.9 3.5×99+3.5 3.5×101-3.5 3.5×9.9+3.5×0.1 3.5×2.7+35×0.73 3.5×2.7-3.5×0.7 (32+5.6)÷0.8 3.5÷0.6-0.5÷0.6 4.9÷3.5 7÷0.25÷4 7÷0.125 ÷8 7.35÷(7.35×0.25) 7.35÷(7.35÷0.25) 7.325-( 5.325+1.7) 3.29+0.73+2.27 3.29-0.73-2.27 7.5+2.5-7.5+2.5 7.325-3.29-3.325 7.325-(5.325+1.7) 7.325-(5.325-1.7)
3.29+0.73-2.29+2.27 3.29×0.25×4 0.125×8.8 63.4÷2.5÷0.4 4.9÷1.4 3.9÷(1.3×5)(7.7+1.54)÷0.7 2.5×2.4 2.7÷45 0.35×1.25×2×0.832.4×0.9+0.1×32.415÷0.25 28.6×101-28.60.86×15.7-0.86×14.7 2.4×102 14-7.32-2.68 2.64+8.67+7.36+11.33 2.31×1.2×0.5(2.5-0.25)×0.49.16×1.5-0.5×9.16 3.6-3.6×0.5 7.6×0.8+0.2×7.60.85×1990.25×8.5×4 0.25×36 0.125×3.2×2.5 35×40.2
初中化学除杂问题与练习题
初中化学除杂问题与练习题
初中化学除杂专题 一、明确目的 物质除杂又叫物质提纯,即把混合物中少量的杂质出去,得到较纯净物质 的过程。明确要得到的是什么物质,除了此物质之外,其它的都不能存在。 二、除杂原则与技巧 简单概括为:不增,不减,易分, 最佳,重在积累。 (1)不增:提纯过程中不能引入新的杂质。 (2)不减:被提纯物质不能减少,如加入试剂只能与杂质反应,不能 与被提纯物反应。 (3)易分:操作简单,容易分离。 (4)最佳:最好在除去杂质的同时能增加被提纯物质的量。 (5)知识重在积累,熟练贯通,灵活运用。尊重事实,合理应用。 三、常用除杂方法: 1、物理方法:过滤法、降温结晶法、蒸发结晶法、利用物质的磁性等。 2、化学方法:沉淀法、气化法、置换法、中和法、吸收法。 三、初中常见物质提纯方法总结 物质杂质除杂方法 CO2O2通过灼热的铜网 CO2CO通过灼热的氧化铜 H2、CO2、O2H2O通过浓硫酸或氯化钙等干燥剂 O2、H2、CO CO2、SO2通入氢氧化钠溶液中洗气CO2HCl通入碳酸氢钠钠溶液中洗气 Cu Fe、Zn加入足量的稀盐酸或稀硫酸,过滤 Fe Cu用磁铁将铁粉吸引出来 Cu CuO加入足量的稀盐酸或稀硫酸,过滤 CuO Cu或C在空气中灼烧 CaO CaCO3高温煅烧 CaCO3CaO加足量水溶解,过滤,取滤渣 CaCO3CaCl2加足量水溶解,过滤,取滤渣 CaCl2 CaCO3加足量水溶解,过滤,取滤液蒸发 NaCl NaHCO 加入足量盐酸,蒸发 3 KNO3 NaCl冷却热饱和溶液 NaCl KNO3蒸发结晶;降温结晶(硝酸钾在水中溶解度随着温度变化 大) NaNO3NaCl加入适量AgNO3过滤 NaCl CuSO4加入适量Ba(OH)2,过滤 NaOH NaCO3加入适量Ca(OH)2,过滤 NaCl Na2SO4加入适量BaCl2溶液,过滤 Na2SO4CuSO4加适量NaOH溶液
三角形的证明测试题(最新版含答案)
第一章三角形的证明检测题 (本试卷满分:100分,时间:90分钟) 一、选择题(每小题3分,共30分) 1.下列命题: ①等腰三角形的角平分线、中线和高重合;②等腰三角形两腰上的高相等; ③等腰三角形的最短边是底边;④等边三角形的高、中线、角平分线都相等; ⑤等腰三角形都是锐角三角形. 其中正确的有() A.1个 B.2个 C.3个 D.4个 2.如图,在△ABC 中,∠BAC =90°,AB =3,AC =4.AD 平分∠BAC 交BC 于点D ,则BD 的长为( ) A.157 B. 125 C. 207 D.215 3. 如图,在△ABC 中,,点D 在AC 边上,且 , 则∠A 的度数为() A. 30° B. 36° C. 45° D. 70° 4.(2015?湖北荆门中考)已知一个等腰三角形的两边长分别是2和4,则该等腰三角形的周长为( ) A.8或10 B.8 C.10 D.6或12 5.如图,已知, , ,下列结论: ①;② ; ③ ;④△ ≌△ . 其中正确的有( ) A.1个 B.2个 C.3个 D.4个 6.在△ABC 中,∠A ∶∠B ∶∠C =1∶2∶3,最短边cm , 则最长边AB 的长是() A.5 cm B.6cm C.5cm D.8 cm 7.如图,已知, ,下列条件 能使△≌△的是( ) A. B. C. D.三个答案都是 8.(2015·陕西中考)如图,在△ABC 中,∠A =36°,AB =AC ,BD 是△ABC 的角平分线,若在边AB 上截取BE =BC ,连接DE ,则图中等腰三角形共有( ) A.2个 B.3个 C.4个 D.5个
高中有机化学计算题方法总结
方程式通式 CXHY +(x+ 4y )O2 →xCO2+ 2y H2O CXHYOz +(x+2 4z y ) O2 →xCO2+2y H2O 注意 1、有机物的状态:一般地,常温C 1—C 4气态; C 5—C 8液态(新戊烷C 5常温气态, 标况液态); C 9以上固态(不严格) 1、有机物完全燃烧时的耗氧量 【引例】完全燃烧等物质的量的下列有机物,在相同条件下,需要O 2最多的是( B ) A. 乙酸乙酯 CH 3COOC 2H 5 B. 异丁烷 CH(CH 3)3 C. 乙醇 C 2H 5OH D. 葡萄糖 C 6H 12O 6 ①等物质的量的烃C X H Y 完全燃烧时,耗氧
量决定于的x+ 4y 值,此值越大,耗氧量 越多; ②等物质的量的烃的含氧衍生物C X H Y O Z 完全燃烧耗氧量决定于的x+2 4z y 值,此值越大,耗氧量越多; 【注】C X H Y 和C X H Y O Z 混搭比较——把衍生物C X H Y O Z 分子式写成残基·不耗氧的 CO 2 · H 2O 后,剩余残基再跟烃C X H Y 比较。如比较乙烯C 2H 4和乳酸C 3H 6O 3,后者就可写成 C 2H 41CO 21H 2O ,故等物质的量的二者耗氧量相同。 【练习】燃烧等物质的量的下列各组物质,耗氧量不相同的是( B ) A .乙烷CH 3CH 3与丙酸C 2H 5COOH B .乙烯CH 2=CH 2与乙二醇CH 2OH CH 2OH C .乙炔HC ≡CH 与乙醛CH 3CHO D .乙炔HC ≡CH 与乙二醇CH 2OH CH 2OH
初中化学除杂专题可直接打印
初中化学除杂题型解题技巧总结 一、解除杂题的原则、要领、方法 三原则:①不引入新杂质;②不减少被提纯物质的质量;③杂质便于分离。 三要领:①根据物理性质或化学性质的差异;②确定除杂质方法;③选择适宜试剂。 二、常见物质的除杂 一、气体除杂:(括号中为杂质) 1.CO2(含O2):将气体通过灼热的铜网。 2.CO2(含H2或CO):将气体通过灼热的氧化铜。 3.O2或CO2或H2(含H2O):将气体通过浓硫酸或氧化钙或氯化钙等干燥剂。 4.O2或H2或CO(含CO2或SO2):将气体通入氢氧化钠溶液中 二、固体除杂: 1.Cu(含Fe或Mg或Zn):加入足量的稀盐酸或稀硫酸,过滤。(将活泼金属用酸溶解)2.Fe(含Cu):用磁铁将铁粉吸引出来。 3.Cu(含CuO)、Fe(含Fe2O3):高温下与H2或CO反应。(将金属氧化物还原成金属)4.CuO(含Cu或C):在空气中灼烧。 5.CaO(含CaCO3):高温煅烧(CaCO3分解成CaO和CO2) 6.CaCO3(含CaO):加足量水溶解,过滤,取滤渣。(CaO与水反应溶于水) 7.CaCO3(含CaCl2):加足量水溶解,过滤,取滤渣。(CaCl2溶于水,CaCO3不溶于水)8.CaCl2(含CaCO3):加足量水溶解,过滤,取滤液蒸发。 9.Ca(OH)2(含CaO):加足量水。(CaO与水反应生成氢氧化钙) 三、溶液除杂: 1.FeSO4溶液(含H2SO4或CuSO4)、FeCl2溶液(含盐酸或CuCl2):过量铁粉,过滤,取滤液。 有关反应:Fe+H2SO4=FeSO4+H2↑;Fe+CuSO4=Cu+ FeSO4
全等三角形证明题(含答案版)
1、如图,四边形AB CD 是边长为2的正方形,点G 是 BC 延长线上一点,连结AG ,点E、F 分别在A G上,连接B E、DF ,∠1=∠2 , ∠3=∠4. (1)证明:△ABE ≌△DAF ; (2)若∠A GB=30°,求E F的长. 【解析】 (1)∵四边形AB CD是正方形, ∴AB=A D, 在△ABE 和△D AF 中,??? ??∠=∠=∠=∠3 41 2DA AB , ∴△ABE ≌△DAF. (2)∵四边形ABC D是正方形, ∴∠1+∠4=90o ∵∠3=∠4, ∴∠1+∠3=90o ∴∠AFD=90o 在正方形ABC D中, AD∥BC , ∴∠1=∠AGB=30o 在Rt △AD F中,∠AFD =90o A D=2 , ∴AF= 3 , DF =1, 由(1)得△ABE ≌△A DF, ∴AE =DF=1, ∴EF=AF -AE=13-. 2、如图, ,AB AC AD BC D AD AE AB DAE DE F =⊥=∠于点,,平分交于点,请你写出图中三对全等三角形,并选取其中一对加以证明. 【解析】 (1)ADB ADC △≌△、 ABD ABE △≌△、AFD AFE △≌△、BFD BFE △≌△、 ABE ACD △≌△(写出其中的三对即 可). (2)以△ADB ≌ADC 为例证明. 证明: ,90AD BC ADB ADC ⊥∴∠=∠=°. 在Rt ADB △和Rt ADC △中, ,,AB AC AD AD == ∴ Rt ADB △≌Rt ADC △. 3、在△ABC 中,AB=CB,∠A BC=90o,F 为AB 延长线上一点,点E 在BC 上,且A E=CF. (1)求证:R t△ABE ≌Rt △C BF ; (2)若∠CAE=30o,求∠ACF 度数. A C B D E F G 1 423
高中化学计算题总结+高考真题
高中化学计算题的解法归纳【知识网络】
【典型例题评析】 例1某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应: A+3B2C。若维持温度和压强不变,当达到平衡时,容器体积为VL,其中C气体的体积占10%,下列推断正确的是(全国高考题) ①原混合气体的体积为1.2VL ②原混合气体的体积为1.1VL ③反应达平衡时气体A消耗掉0.05VL ④反应达平衡时气体B消耗掉0.05VL A.②③ B.②④ C.①③ D.①④ 体积差: 例3将硫酸钾、硫酸铝、硫酸铝钾三种盐混合溶于硫酸酸化的水中,测得c(SO42-)=0.105mol/L、c(Al3+)=0.055mol/L,溶液的pH=2.0(假设溶液中H2SO4完全电离为H+和SO42-),则c(K+)为 (上海高考题) A.0.045mol/L B.0.035mol/L C.0.055mol/L D.0.040mol/L 电荷守恒: )x的水溶液,当阴极上增重a g时,在阳极上同时产生bL氧气(标准状况),例4用惰性电极电解M(NO 3 从而可知M的原子量为 电子守恒: 铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为(上海高考题)A.9.02g B.8.51g C.8.26g D.7.04g
例5将1.92g铜粉与一定量浓硝酸反应,当铜粉完全作用时收集到1.12L(标准状况)。则所消耗硝酸的物质的量是(上海高考题) A.0.12mol B.0.11mol C.0.09mol D.0.08mol 原子守恒|: 例8在一定条件下,将m体积NO和n体积O2同时通入倒立于水中且盛满水的容器内,充分反应后,容器内残留m/2体积的气体,该气体与空气接触后变为红棕色,则m与n的比值为(上海高考题) 方程式叠加 例9 由CO 2、H 2 和CO组成的混合气在同温同压下与氮气的密度相同。则该混合气体中CO 2 、H 2 和CO的体积 比为 (上海高考题) 十字交叉法 例10由锌、铁、铝、镁四种金属中的两种组成的混合物10g,与足量的盐酸反应产生的氢气在标准状况下为11.2L,则混合物中一定含有的金属是(全国高考题) A.锌 B.铁 C.铝 D.镁 例13第ⅡA族元素R的单质及其相应氧化物的混合物12g,加足量水经完全反应后蒸干,得固体16g,试推测该元素可能为(上海高考题) A.Mg B.Ca C.Sr D.Ba 极值法 R---->ROH 2.8/M1=( 3.58-2.8)/17 M1=61 R2O---->2ROH 2.8/(2M2+16)=( 3.58-2. 8)/18 例15在一个密闭容器中,用等物质的量的A和B发生反应:A(g)+2B(g) 。当反应达到平衡时,如果混合气体中A和B的物质的量之和与C的物质的量相等,则此时A的转化率为(全国高考题) A.40% B.50% C.60% D.70% 估算法
初中数学三角形证明题练习及答案
三角形证明题练习 1.如图,在△ABC 中,∠C=90°,AB 的垂直平分线交AB 与D ,交BC 于E ,连接AE ,若CE=5,AC=12,则BE 的长是( ) 2.如图,在△ABC 中,AB=AC ,∠A=36°,BD 、CE 分别是∠ABC 、∠BCD 的角平分线,则图中的等腰三角形有( ) 3.如图,在△ABC 中,AD 是它的角平分线,AB=8cm ,AC=6cm ,则 S △ABD :S △ACD =( ) 4.如图,在△ABC 中,AB=AC ,∠A=40°,AB 的垂直平分线交AB 于点D ,交AC 于点E ,连接BE ,则∠CBE 的度数 为( ) 5.如图,在△ABC 中,AB=AC ,且D 为BC 上一点,CD=AD ,AB=BD ,则∠B 的度数为( ) 6.如图,点O 在直线AB 上,射线OC 平分∠AOD ,若∠AOC=35°,则∠BOD 等于( ) 7.如图,在△ABC 中,∠ACB=90°,BA 的垂直平分线交BC 边于D ,若AB=10,AC=5,则图中等于60°的角的个数是( ) 8.如图,已知BD 是△ABC 的中线,AB=5,BC=3,△ABD 和△BCD 的周长的差是( ) 9.在Rt △ABC 中,如图所示,∠C=90°,∠CAB=60°,AD 平分∠CAB ,点D 到AB 的距离DE=3.8cm ,则BC 等于( ) A . 13 B . 10 C . 12 D . 5 A . 5个 B . 4个 C . 3个 D . 2个 A . 4:3 B . 3:4 C . 16:9 D . 9:16 A . 70° B . 80° C . 40° D . 30° A . 30° B . 36° C . 40° D . 45° A . 145° B . 110° C . 70° D . 35° A . 2 B . 3 C . 4 D . 5 A . 2 B . 3 C . 6 D . 不能确定
高中化学计算题基本计算方法与推断题总结
高中化学计算题基本计算方法与推动总结 推断题解题技巧:看其颜色,观其状态,察其变化。 1. 常见物质的颜色:多数气体为无色,多数固体化合物为白色,多数溶液为无色。 2. 一些特殊物质的颜色: 黑色:MnO2、CuO、Fe3O4、C、FeS(硫化亚铁) 蓝色:CuSO4?5H2O、Cu(OH)2、含Cu2+ 溶液、液态固态O2(淡蓝色) 红色:Cu(亮红色)、Fe2O3(红棕色)、红磷(暗红色) 黄色:硫磺(单质S)、含Fe3+的溶液(棕黄色) 绿色:FeSO4?7H2O、含Fe2+的溶液(浅绿色)、碱式碳酸铜[Cu2(OH)2CO3] 紫黑色:KMnO4 无色气体:N2、CO2、CO、O2、H2、CH4 有色气体:Cl2(黄绿色)、NO2(红棕色) 有刺激性气味的气体:NH3(此气体可使湿润pH试纸变蓝色)、SO2、HCl 有臭鸡蛋气味:H2S 产生酸雾:HCl、HNO3 3. 常见一些变化的判断: ①白色沉淀且不溶于稀硝酸或酸的物质有:BaSO4、AgCl(就这两种物质) ②蓝色沉淀:Cu(OH)2、CuCO3 ③红褐色沉淀:Fe(OH)3 Fe(OH)2为白色絮状沉淀,在空气中很快变成灰绿色沉淀,再变成Fe(OH)3红褐色沉淀 ④沉淀能溶于酸并且有气体(CO2)放出的:不溶的碳酸盐 ⑤沉淀能溶于酸但没气体放出的:不溶的碱 4. 燃烧时的主要现象 ①在氧气中:硫——蓝紫色火焰;铁——火星四射;木炭——发白光。 ②在空气中:镁带——耀眼的白光;红磷——“白烟”; 硫、氢气——淡蓝色火焰;CO、CH4——蓝色火焰 5、酸和对应的酸性氧化物的联系: ①酸性氧化物和酸都可跟碱反应生成盐和水:
简便计算练习题集锦
小学数学五年级上册简便计算练习1请用简便方法计算下列各题 0.25 X 0.28 0.125 X 3.2 X 2.5 35 X 40.2 0.25 X 4-0.25 X 4 3.5 X 9.9 3.5 X 99+3.5 3.5 X 101-3.5 3.5 X 9.9+3.5 X 0.1 3.5 X 2.7+35 X 0.73 3.5 X 2.7-3.5 X 0.7 (32+5.6) 宁0.8 3.5 宁0.6-0.5 宁 0.6 4.9 - 3.5 7 - 0.25 - 4 7 - 0.125 - 8 7.35 - (7.35 X 0.25) 7.35 -(7.35 - 0.25) 7.325-( 5.325+1.7) 3.29+0.73+2.27 3.29-0.73-2.27 7.5+2.5-7.5+2.5 7.325-3.29-3.325 7.325-(5.325+1.7) 7.325-(5.325-1.7)
3.29+0.73-2.29+2.27 3.29 X 0.25 X 4 0.12 5 X 8.8 63.4 - 2.5 - 0.4 4.9 - 1.4 3.9-(1.3 X 5) (7.7 + 1.54) - 0.7 2.5 X 2.4 2.7 - 45 0.35 X 1.25 X 2X 0.8 0.1 X 32.4 15-0.25 14- 7.32 —2.68 (2.5 —0.25) X 0.4 0.86 X 15.7 —0.86 X 14.7 2.64 + 8.67 + 7.36 + 11.33 9.16 X 1.5 —0.5 X 9.16 2.4 X 102 2.31 X 1.2 X 0.5 3.6 —3.6 X 0.5 0.2 X 7.6 0.85 X 199 0.25 X 8.5 X4
