qpcr步骤

范围和适用性
本实验适用于使用StepOnePlus?实时PCR仪对DNA PE、DNA PE Index、SE文库以及Exon Capture组、转录组、表达谱、Small RNA组、表观遗传组等制备的文库进行上机前的精确定量。
摘要
荧光定量PCR实验是以Agilent 2100 Bioanalyzer对文库的检测结果为参照, 使用StepOnePlus?实时PCR仪对文库进行定量,得出待测文库浓度,为之后的Cluster制备提供浓度依据。该实验的主要内容包括:(1)梯度稀释标准品;(2)按实验要求稀释样品;(3)配制反应预混液;(4)加样;(5)设置反应程序;(6)运行实验;(7)分析实验结果,计算待测样品浓度。整个流程需要3-4小时。
缩写词和SOP中专业术语的解释
实验材料及方法
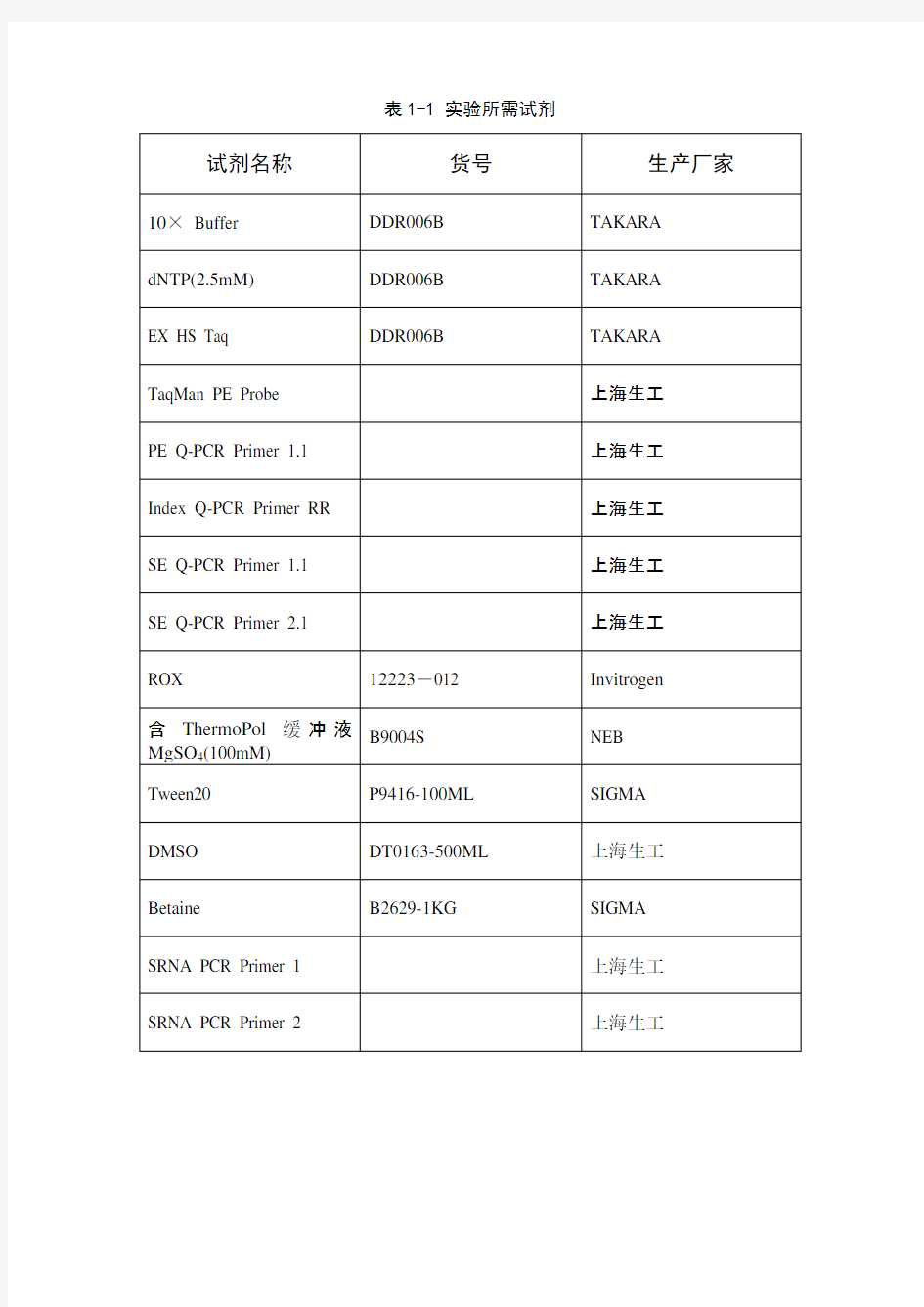
1 实验试剂和耗材
1.1试剂
表1-1 实验所需试剂
1.2 耗材
表1-2 实验所需耗材
2 实验仪器设备
表2-1 实验所需仪器设备
3 实验操作流程
3.1 填写Q-PCR实验登记表
样品的交接按照《质控组样品交接管理规程》执行。实验前,先在“表单准
备区”将要检测的样品在《Q-PCR实验登记表》中填写好,并根据“文库交接检测”文件夹中《____组文库检测结果》中的待测样品的顺序按顺序填到《Q-PCR 实验登记表》上,并在右上角注明批次后打印出来。然后将需要检测的样品的样品名和文库号按照《Q-PCR实验登记表》上的顺序粘贴到“文库核对&存放位置”文件夹中的《文库检测前核对表》Excel表中,等待核对样品信息。
3.2 稀释标准品
开始实验前,到-20℃冰箱和冰柜中将实验所需的标准品和样品取出,并按Q-PCR实验登记表上的顺序排好,并到表单准备区,用扫描枪将样品的文库号扫描到“文库核对&存放位置”文件夹中的《文库检测前核对表》Excel表中进行核对,核对结果为“错错错错”,则样品不正确需重新找取样品信息相同的样品;核对结果为“对”,则样品正确。
1)取5个0.2 ml PCR离心管,分别标记为Std 1、Std 2、Std 3、Std 4和Std 5。标准品多于一种时应标明标准品的名称。
2)分别吸取18 μl超纯水至Std 2、Std 3、Std 4和Std 5离心管。
3)使用新Tip移取2 μl Std 1至装有18 μl 超纯水的Std 2离心管,用Vortex振荡10至15秒,用力用手甩离心管,将壁上的液体甩下。
4)使用新Tip移取2 μl Std 2至装有18 μl 超纯水的Std 3离心管,用Vortex振荡10至15秒,用力用手甩离心管,将壁上的液体甩下。
5)使用新Tip移取2 μl Std 3至装有18 μl 超纯水的Std 4离心管,用Vortex振荡10至15秒,用力用手甩离心管,将壁上的液体甩下。
6)使用新Tip移取2 μl Std 4至装有18 μl 超纯水的Std 5离心管,用Vortex振荡10至15秒,用力用手甩离心管,将壁上的液体甩下。
7)将已稀释的标准品置于4 ℃或冰上。
【注意】
原管(1nM)的标准品要用时从-20 ℃冰箱中的标准品盒子中取出;不用时应及时放回-20 ℃冰箱中,以防降解。
●实验前带上口罩和新手套,并用70%酒精将实验台擦拭一遍。
●移液要准确,振荡要充分,振荡前需检查管盖是否盖严。
●使用超纯水稀释标准品。
3.3 稀释样品
1)如果待测文库是需要混合的Index文库,则先按照《Q-PCR pooling规则》混合好,贴好标签等待检测。
2)取和待测样品数量相同的0.6 ml PCR 离心管,分别标记为待测样品名称或者是样品管盖上的记号。
3)如果待测样品体积小于15ul(如表达谱、Small RNA组的样品),则分别吸取99 μl超纯水至每个离心管中;如果待测样品体积大于15ul,则分别吸取198 μl超纯水至每个离心管中。
4)将待测文库的样品原管充分振荡,短暂离心后,按照Q-PCR实验登记表上的顺序排好,然后分别移取样品溶液至相对应的装有超纯水的离心管中,如果样品体积小于15ul的,则吸取1ul的样品到装有99ul超纯水的离心管中;如果样品体积大于15ul,则吸取2ul样品到装有198ul超纯水的离心管中。振荡10至15秒,短暂离心。
5)将已稀释的样品置于4 ℃或冰上;将样品原管放回-20℃冰柜中的编号盒存放,将样品放到编号盒中腾空的位置,并将样品的文库号用扫描枪录入“文库核对&存放位置”文件夹中的《上机文库存放位置表》Excel表中的对应位置存档。
【注意】
●移液要准确,振荡要充分,振荡前需检查管盖是否盖严,吸取样品后确
保管盖盖严。
●使用的超纯水稀释样品。
3.4 配制反应预混液
1)到隔壁实验室的“Mix配制区”配制反应预混液。取1.5 ml或2 ml离心管,在管盖上标记上Mix,套上锡箔纸。
2)按以下反应体系准备反应预混液(以8个PE样品、1条标准曲线和10个SE样品、2条标准曲线为例):
表3-4-1 PE Mix的配置
*标准品5个浓度各2个反应孔,NTC(无模板对照)1个反应孔,每个样品3个反应孔,2孔用于移液损失,共37孔。
表3-4-2 SE Mix的配置
*2条标准曲线,标准品5个浓度各2个反应孔,NTC(无模板对照)1个反应孔,每个样品3个反应孔,2孔用于移液损失,共53孔。
其中,PE Mix和SE Mix的组分和每孔反应所需的用量如下表:
表3-4-3 PE Mix 表3-4-4 SE Mix
3)上下颠倒离心管混匀或振荡10至15秒,短暂离心。
4)将反应预混液置于4 ℃或冰上。
【注意】
●配制反应预混液必须到“Mix配制区”进行,避免扩增子污染。
●移取PE Mix或SE Mix前,摇晃离心管以彻底混匀。
●使用超纯水配制反应预混液。
●Mix配制区的所有物料,仪器,工具都严禁带到其他区域。
3.5 加样
1)Mix配制好之后,将Mix放在传递窗中,回到稀释样品的实验室,将Mix 从传递窗中取出,并在“点样区”进行加样。
2) 取出96孔国产光学反应板置于基座上。
3)将预先配好地反应预混液加到各反应管孔中,每孔加入9μl 反应预混液。然后按照由A到H、由1到12的顺序向反应孔中加入1 μl 已稀释的标准品、样品和阴性对照,向标准品反应孔中加入 1 μl 梯度稀释的标准品,每个梯度重复两次;向样品反应孔中加入1 μl 已稀释的样品,每个样品重复三次;向无模板对照(NTC)反应孔中加入1 μl 已灭菌超纯水。
4)使用ABI公司配备的封膜工具和光学封口膜(泛特津)封闭反应板。
5)封好膜之后,到荧光定量PCR仪放置的实验室,使用Labnet的MPS-1000微孔板离心机离心反应板,离心时间为4min。离心前注意配平。板子放置时,底部朝外。
6)将反应板装载到StepOnePlus扩增仪以准备运行。
3.6设置反应程序
3.6.1 双击桌面StepOne software v2.0 软件快捷键。
3.6.2 如果有设置好的程序模板,则点击菜单栏的“Open”在“桌面/Q-PCR Results/Q-PCR Templates”里找到和《Q-PCR实验登记表》上名字相同的程序模板,在Experiment Name栏中用“检测人姓名拼音+检测日期+程序名称”命名,然后根据标准品和点样的顺序设置好板位,输入标准品名称和样品名称,并将设置好的程序保存在“桌面/Q-PCR Results/Q-PCR Results”中以检测日期命名的文件夹中。
3.6.3如果没有程序模板的,则在Set Up 列中,单击Advanced Setup ,如图3-1。
图3-1
3.6.3.1 在左侧导航窗格中,单击Experiment Properties :
1)单击 Experiment Name ,然后输入实验名称,如图3-2所示。
2)单击 StepOnePlusTM Instrument(96 well)。
3)选择实验方法,单击 Quantitation-Standard Curve。
4)根据实验选择试剂类型,单击选择 TaqMan Reagents 或 SYBR Green Reagents。
5)为升降温速度选择 Standard (~2 hours to complete a run) ,若使用Fast试剂系列则选择Fast(~40 minutes to complete a run)。
图3-2
3.6.3.2 在左侧导航窗格中,单击Plate Setup :
1)首先设置define Targets and Samples,如图3-3所示,在左侧Define Targets中单击 Target Name 单元格,然后输入靶名称。
2)从 Reporter 下拉菜单中,选择 FAM 或 SYBR。
3)从 Quencher 下拉菜单中,如果 Reporter 选择 SYBR, Quencher 则选择 None,如果Reporter选择FAM,则Quencher选择NFQ-MGB。
4)保留 Color 字段中的默认设置。
5)单击 Sample Name 单元格,根据样品个数增加样品数量(可单击 Add New
Sample)并输入样品名称。
6)保留 Color 字段中的默认设置。
图3-3
7)单击右侧 Assign Targets and Samples,设置反应板布局,如图3-4。
8)在 View Plate Layout 选择反应孔,在 Assign target(s) to the selected wells 单击 Assign 复选框,在 Task 中选择相应的类型(U表示未知样品,S表示标准品,N表示无模板对照),如果选择 S 可在 Quantity 输入相应的标准品浓度。
9)在 View Plate Layout 选择样品反应孔,在 Assign Sample(s) to the selected wells 单击 Assign 相应样品的复选框。
图3-4
3.6.3.3 在左侧导航窗格中,单击 Run Method :
1)单击 Graphical View 选项卡(默认)。
2)单击 Reaction Volume Per Well ,然后输入相应的每个孔的反应体积。
3)单击反应温度或反应时间按需要进行修改,单击延伸阶段反应时间下面的荧光信号采集图标,以确定荧光信号采集的阶段(当图标为灰色时表示未被选中)。
3.6.3.4 将设置好的程序保存在“桌面/Q-PCR Results/Q-PCR Results”中以检测日期命名的文件夹中。
3.7 运行实验
【健康和安全警告】
操作期间,样本加热块温度可能超过100 °C。在样本加热块降温至室温之前,请勿触碰扩增仪。
1)在 Run Status 点击绿色按钮 START RUN,运行实验。
图3-6
2)实验结束后,取出反应板,用一次性PE手套密封后丢在旁边的垃圾桶内(防止荧光染料污染实验室)。
3.8 分析数据
实验结束后,在左侧导航窗格中,单击Analysis :
图3-7
1)单击 Amplification Plot 查看扩增曲线,如图3-7所示。
2)单击 Standard Curve 查看标准曲线的R2值、扩增效率Eff%,如图3-8所示。
图3-8
3)单击右上方View Well Table查看Ct值和浓度,如图3-9。
将数据导出到Excel表中,导出方法为:点击File,选择File菜单中的Export,在弹出的对话框中的Export Properties中勾选Results,然后根据需要设置Export File Name和Export File Location。设置完毕,点击Start Export。数据导出结束后,在弹出的对话框中选择Close Export Tool。
查看数据,由于标准品的浓度范围为0.1pM-1nM,为保证数据的可信度,应剔除超出标准曲线范围的样品梯度浓度。样品都已进行稀释,需要按照稀释度
换算成原浓度再求平均值。
图3-9
4数据管理和记录管理
本实验要求:
1)在Q-PCR实验登记表上填写相应样品的Q-PCR浓度。
2)在“表单准备区”的计算机桌面上的“文库交接检测”文件夹中的《____文
库检测结果》Excel文件中的相应位置填写:标准品、样品的浓度、检测日期、操作人、鉴定人以及结果(是否合格)。样品合格与否的评判标准:①根据上机浓度计算出样品的最低浓度,若样品浓度低于最低浓度则不合格;
②将定量出来的Q-PCR浓度与2100的摩尔浓度相比,如果比值和以往相同
类型的样品的比值相近则合格,相差较大则不合格,需重新定量,并将需重测文库所在行的底色改为灰色;③如果是Pooling文库,则将Q-PCR浓度与理论浓度相比,如果比值在偏差30%以内则合格,相反则不合格,需重新定量,并将需重测文库所在行的底色改为灰色。④如重测结果合格,则填写好重测的样品浓度、检测日期、操作人、鉴定人以及结果(是否合格),并将文库信息底色改为“无填充颜色”;如果重测结果仍然和第一次检测结果一
致,则在“结果(是否合格)”一栏标注“已重测,可上机”,并将文库信息
底色改为“无填充颜色”。
质量评价/质量控制
本实验要求:
1)标准品的和样品的R2值均应在0.995以上,扩增效率Eff%应在80以上.
2)如果是表达谱和Small RNA文库,要求同一样品的三个孔的Ct SD应小于
0.5。
3)如果使用的是Eva Green作为染料,要求melting curve没有杂峰。
要求2)和3)可在QC summary中查看。
参考文献
[1] ABI . Applied Biosystems StepOne? Real-Time PCR System Getting Guide for Standard Curve Experiments[Z].2007-01.
[2] Meyer, M.,Briggs, A W., Maricic,T,.et al. From micrograms to picograms: quantitative PCR reduces the material demands of high-throughput sequencing[J]. Nucleic Acids Res,2008, 36:e5.
[3] Heid,C.A.,Stevens,J.,Livak,K.J.,et al. Real time quantitative PCR[J]. Genome Res, 1996 , 6 : 986 - 994.
附录
1. PE Mix和SE Mix的组分及其含量
2.反应体系与反应条件
1)PE、PE Index文库
附表2-1-1
附表2-1-2
2)DNA 和表观遗传组SE 文库
附表2-3-1
附表2-3-2
3)Small RNA和表达谱SE文库
附表2-4-1
附表2-4-2
附录A 修订记录
