SDS-PAGE电泳标准操作流程
SDS-PAGE电泳标准操作规程(网上)
3.程序:
3.1. 制胶
3.1.1组装胶架将洁净、无水的玻片对齐,形成空腔,插入塑料框的凹槽中,注意箭头向上,并确保下
端平齐。放于制胶架上夹紧,下端紧贴密封条。
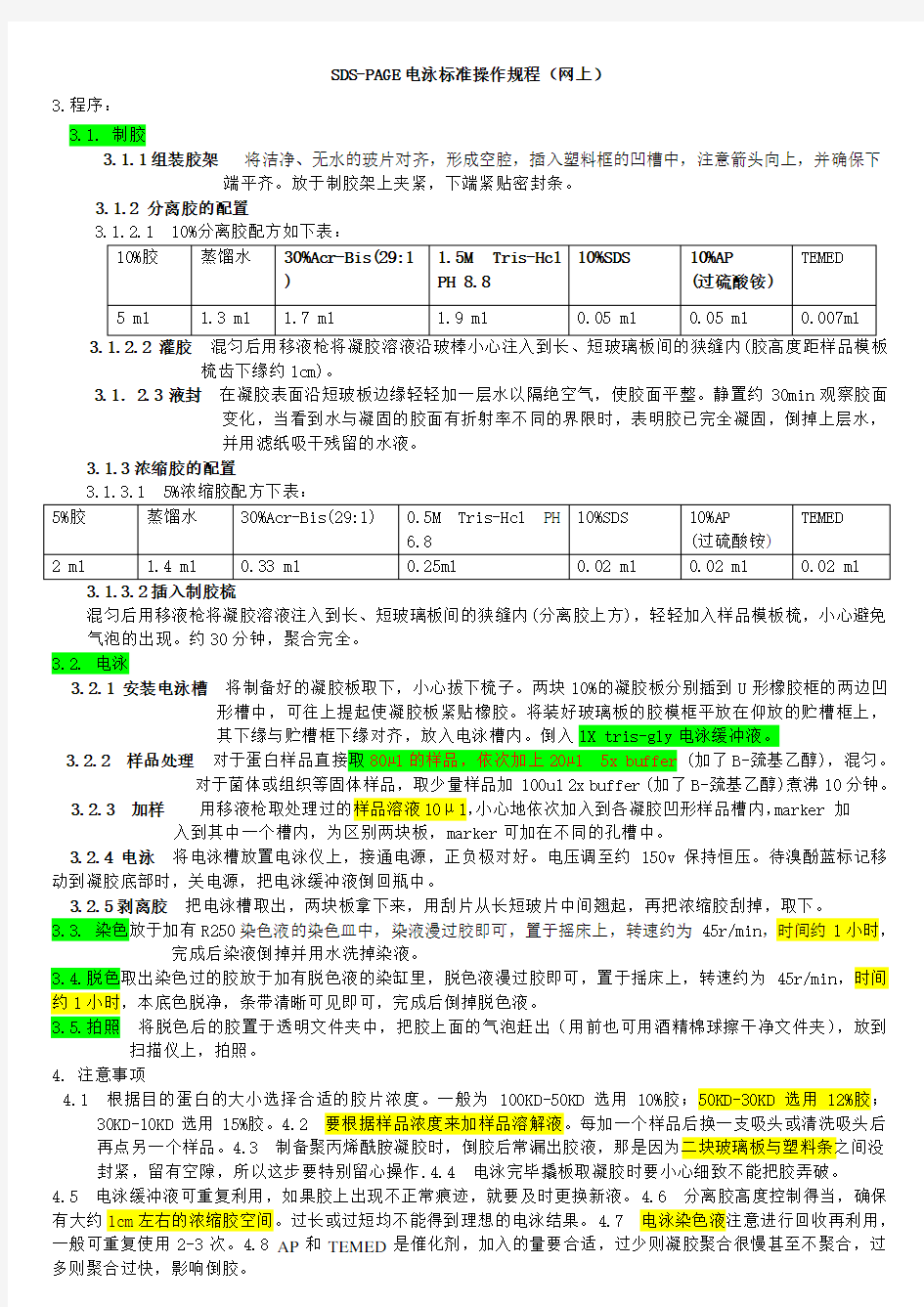
3.1.2 分离胶的配置
梳齿下缘约1cm)。
3.1.2.3液封在凝胶表面沿短玻板边缘轻轻加一层水以隔绝空气,使胶面平整。静置约30min观察胶面
变化,当看到水与凝固的胶面有折射率不同的界限时,表明胶已完全凝固,倒掉上层水,
并用滤纸吸干残留的水液。
3.1.3浓缩胶的配置
3.1.3.1 5%浓缩胶配方下表:
3.1.3.2插入制胶梳
混匀后用移液枪将凝胶溶液注入到长、短玻璃板间的狭缝内(分离胶上方),轻轻加入样品模板梳,小心避免气泡的出现。约30分钟,聚合完全。
3.2. 电泳
3.2.1 安装电泳槽将制备好的凝胶板取下,小心拔下梳子。两块10%的凝胶板分别插到U形橡胶框的两边凹
形槽中,可往上提起使凝胶板紧贴橡胶。将装好玻璃板的胶模框平放在仰放的贮槽框上,
其下缘与贮槽框下缘对齐,放入电泳槽内。倒入1X tris-gly电泳缓冲液。
3.2.2 样品处理对于蛋白样品直接取80μl的样品,依次加上20μl 5x buffer (加了B-巯基乙醇),混匀。
对于菌体或组织等固体样品,取少量样品加100ul 2x buffer (加了B-巯基乙醇)煮沸10分钟。
3.2.3 加样用移液枪取处理过的样品溶液10μl,小心地依次加入到各凝胶凹形样品槽内,marker 加
入到其中一个槽内,为区别两块板,marker可加在不同的孔槽中。
3.2.4 电泳将电泳槽放置电泳仪上,接通电源,正负极对好。电压调至约150v保持恒压。待溴酚蓝标记移动到凝胶底部时,关电源,把电泳缓冲液倒回瓶中。
3.2.5剥离胶把电泳槽取出,两块板拿下来,用刮片从长短玻片中间翘起,再把浓缩胶刮掉,取下。
3.3. 染色放于加有R250染色液的染色皿中,染液漫过胶即可,置于摇床上,转速约为45r/min,时间约1小时,
完成后染液倒掉并用水洗掉染液。
3.4.脱色取出染色过的胶放于加有脱色液的染缸里,脱色液漫过胶即可,置于摇床上,转速约为45r/min,时间约1小时,本底色脱净,条带清晰可见即可,完成后倒掉脱色液。
3.5.拍照将脱色后的胶置于透明文件夹中,把胶上面的气泡赶出(用前也可用酒精棉球擦干净文件夹),放到
扫描仪上,拍照。
4. 注意事项
4.1 根据目的蛋白的大小选择合适的胶片浓度。一般为100KD-50KD选用10%胶;50KD-30KD选用12%胶;
30KD-10KD选用15%胶。4.2 要根据样品浓度来加样品溶解液。每加一个样品后换一支吸头或清洗吸头后再点另一个样品。4.3 制备聚丙烯酰胺凝胶时,倒胶后常漏出胶液,那是因为二块玻璃板与塑料条之间没封紧,留有空隙,所以这步要特别留心操作.4.4 电泳完毕撬板取凝胶时要小心细致不能把胶弄破。
4.5 电泳缓冲液可重复利用,如果胶上出现不正常痕迹,就要及时更换新液。4.6 分离胶高度控制得当,确保有大约1cm左右的浓缩胶空间。过长或过短均不能得到理想的电泳结果。4.7 电泳染色液注意进行回收再利用,一般可重复使用2-3次。4.8 AP和TEMED是催化剂,加入的量要合适,过少则凝胶聚合很慢甚至不聚合,过多则聚合过快,影响倒胶。
操作步骤:
采用垂直式电泳槽装置
1、安装电泳槽
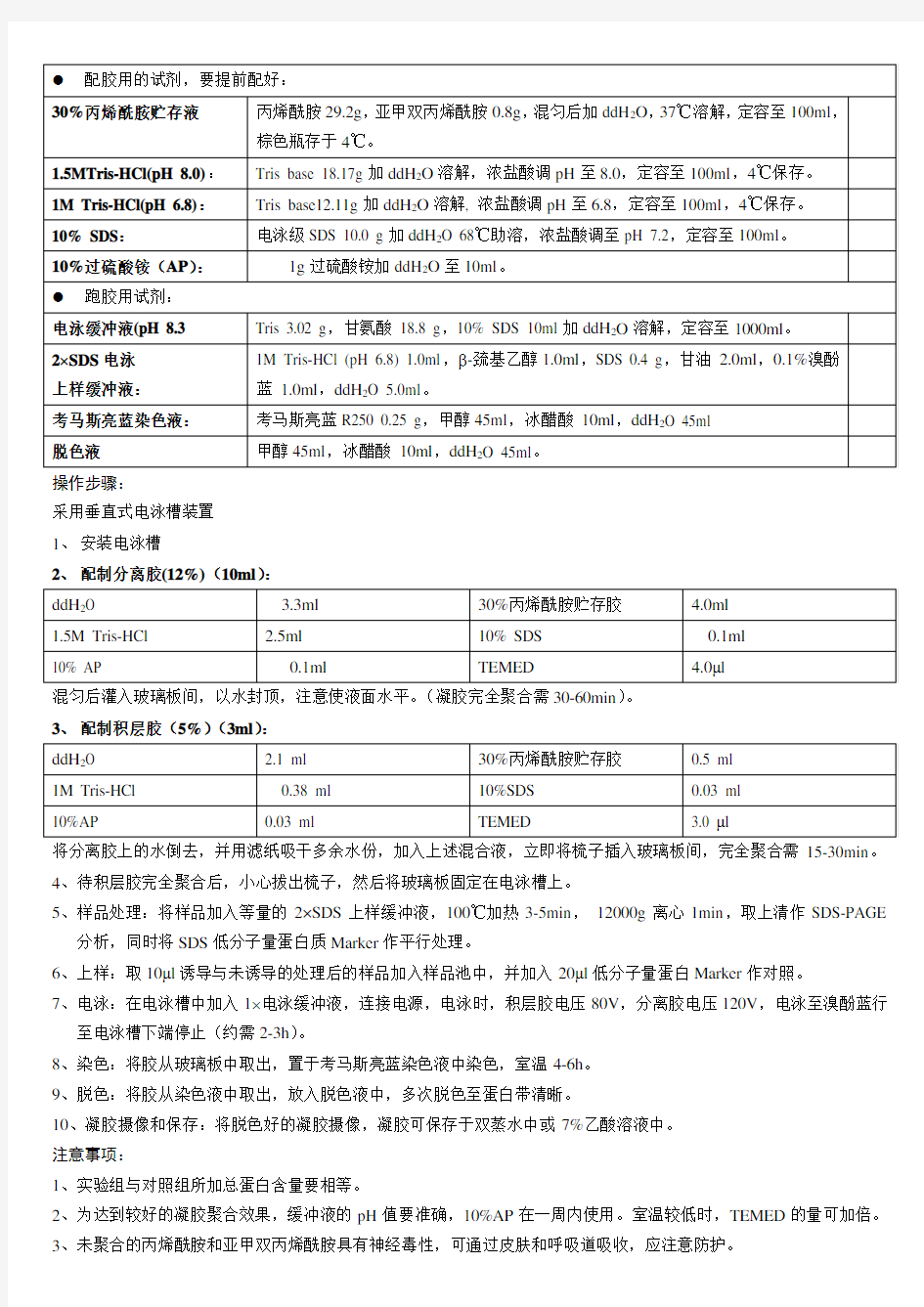
2、配制分离胶(12%)(10ml):
混匀后灌入玻璃板间,以水封顶,注意使液面水平。(凝胶完全聚合需30-60min)。
3、配制积层胶(5%)(3ml):
将分离胶上的水倒去,并用滤纸吸干多余水份,加入上述混合液,立即将梳子插入玻璃板间,完全聚合需15-30min。
4、待积层胶完全聚合后,小心拔出梳子,然后将玻璃板固定在电泳槽上。
5、样品处理:将样品加入等量的2×SDS上样缓冲液,100℃加热3-5min,12000g离心1min,取上清作SDS-PAGE
分析,同时将SDS低分子量蛋白质Marker作平行处理。
6、上样:取10μl诱导与未诱导的处理后的样品加入样品池中,并加入20μl低分子量蛋白Marker作对照。
7、电泳:在电泳槽中加入1?电泳缓冲液,连接电源,电泳时,积层胶电压80V,分离胶电压120V,电泳至溴酚蓝行
至电泳槽下端停止(约需2-3h)。
8、染色:将胶从玻璃板中取出,置于考马斯亮蓝染色液中染色,室温4-6h。
9、脱色:将胶从染色液中取出,放入脱色液中,多次脱色至蛋白带清晰。
10、凝胶摄像和保存:将脱色好的凝胶摄像,凝胶可保存于双蒸水中或7%乙酸溶液中。
注意事项:
1、实验组与对照组所加总蛋白含量要相等。
2、为达到较好的凝胶聚合效果,缓冲液的pH值要准确,10%AP在一周内使用。室温较低时,TEMED的量可加倍。
3、未聚合的丙烯酰胺和亚甲双丙烯酰胺具有神经毒性,可通过皮肤和呼吸道吸收,应注意防护。
周师姐试剂配制:
●30%丙烯酰胺(29:1)配制:称取Acrylamide 29 g、Bisacrylamide 1 g,加入约60 ml的去离子水,充分搅拌溶
解。加去离子水将溶液定容至100 mL,用0.45um滤膜滤去杂质,于中4℃避光保存。
●5×Tris-Glycine电泳缓冲液的配制:称取Tris-base 15.1 g、Glycine 94 g、SDS 5 g置于1 L烧杯中,加入约800
mL的去离子水,搅拌溶解;加去离子水将溶液定容至1 L后,室温保存。
●10 %过硫酸胺(AP)的配制:称取过硫酸胺0.1 g 溶于1.0 mL 灭菌的去离子水中,充分混匀后于4 ℃避光保
存,保存时间不能超过1周。
●10 % SDS的配制:称取SDS 10 g溶于100 mL灭菌的去离子水中并于50℃水浴下溶解,室温保存。如在长
期保存中出现沉淀,水浴溶化后,仍可使用。
● 1.5mol/L Tris-HCl(pH8.8):称取Tris-base 45.43 g,加入约200 mL去离子水,搅拌溶解;用浓盐酸调pH至
8.8,最后用去离子水定容至250 mL,室温下保存。
●0.5mol/L Tris-HCl(pH6.8):称取Tris-base 15.14 g,加入约200 mL去离子水,搅拌溶解;用浓盐酸调pH至
6.8,最后用去离子水定容至250 mL,室温下保存。
●12 % SDS-PAGE 分离胶:30%丙烯酰胺4 mL、去离子水3.3 mL、1.5mol/L Tris-HCl(pH8.8)2.5 mL、10 % AP
100 μL、10 % SDS 100 μL和TEMED 5 μL充分混匀后灌胶。
●15 % SDS-PAGE 分离胶:30%丙烯酰胺5 mL、去离子水2.3 mL、1.5mol/L Tris-HCl(pH8.8)2.5 mL、10 % AP
100 μL、10 % SDS 100 μL和TEMED 5 μL充分混匀后灌胶。
● 5 % SDS-PAGE 浓胶:30%丙烯酰胺0.5 mL、去离子水2.1 mL、0.5mol/L Tris-HCl(pH6.8)0.375 mL、10 % AP
30 μL、10 % SDS 30 μL和TEMED 5 μL充分混匀后灌胶。
●考马斯亮蓝染色液的配制:称取1 g考马斯亮蓝R-250,置于1 L烧杯中;量取250 mL异丙醇加入上述烧杯
中,搅拌溶解;加入100 mL的冰醋酸,搅拌均匀;加入650 mL去离子水,搅拌均匀;用滤纸除去颗粒物质后,室温保存备用。
●脱色液的配制:量取冰醋酸100 mL、乙醇50 mL,加去离子水定溶至1L,搅拌均匀,室温保存备用。
●转移缓冲液的配制:称取Tris-base 1.45 g、甘氨酸7.2 g,加入约200 mL去离子水,搅拌溶解;加入100 mL
甲醇,最后用去离子水定容至500 mL,室温下保存备用。
●洗膜缓冲液(TBST)的配制:称取NaCl 8.8 g、Tris-base 2.42 g,向烧杯中加入约800 mL去离子水,充分搅拌
溶解;用1 M HCl将溶液的pH值调至7.5,加入0.5 mL Tween 20后充分混匀;加去离子水将溶液定容至1 L 后,于4 ℃保存备用。
●封闭缓冲液的配制:称取0.5 g脱脂奶粉溶于10 mL TBST缓冲液中,充分混匀后备用。
0.1 M 甘氨酸缓冲液配制:称取0.75g甘氨酸加入90 mL去离子水,充分溶解后用pH计将pH值调至2.5,用去离子水定容至100mL后用0.22 μm 微孔虑膜过滤除菌后,将其分装并于4 ℃保存备用。
● 1 M Tris-HCl 缓冲液的配制:称取12.1g Tris-base,加入90 mL去离子水,充分溶解后用pH计将pH值调至
7.5,用去离子水定容至100mL备用。
●银染固定液:30 % 的乙醇,10%的乙酸。
●银染氧化液:称取0.7 g高碘酸溶于100 mL去离子水,充分混匀备用。
●银染显色液:浓度为0.005 g/L的柠檬酸,0.02 %的甲醛。
●银氨溶液:浓度为0.67 % 的硝酸银,0.33 %的氨水,0.8 g/L的NaOH。
