脱氢表雄酮硫酸酯与绝经后激素替代治疗_刘雁勇

#综述#
脱氢表雄酮硫酸酯与绝经后激素替代治疗DHEA(S)and their roles in postmenopausal hormone replacement therapy
刘雁勇,左萍萍
L I U Yan-y ong,Z UO Ping-p ing
(中国医学科学院,中国协和医科大学基础医学研究所药理室,北京100005)
=摘要>脱氢表雄酮(DHEA)及其硫酸酯(DH EAS)是由肾上腺皮质分泌的最丰富的甾体激素,DHEA(S)通过与GABA、NMDA等多种受体作用及调节阿片肽分泌等途径发挥缓解抑郁症状、增强体质、调节机体免疫力、改善认知等功能,有关DHEA(S)在绝经后妇女的激素替代治疗中潜在应用价值已引起重视。
=关键词>DH EA(S);激素替代治疗;B-内啡肽;抑郁症
=中图分类号>R711=文献标识码>A=文章编号>1004-3845(2003)05-0301-06
一、前言
科学的发达和医疗水平的提高使人类寿命不断延长,妇女的平均寿命已达70岁以上,意味着将有越来越多的妇女要在雌激素缺乏的状态下继续生活2030年。妇女绝经面临的主要问题是因卵巢功能衰退,雌激素分泌不足,从而出现的泌尿生殖、神经内分泌、心血管、骨骼、代谢及皮肤多系统功能紊乱。对此,采用激素或雌激素替代疗法(H RT,ERT)改善绝经后妇女的健康提高她们的生活质量已取得国际上的共识。该疗法确实具有广泛的应用价值,然而存在着使人顾虑的癌变问题。近年,人们在努力寻找既有特异效果又无致癌可能性的药物,如选择性雌激素受体调节剂(SERM),针对不同靶器官起到雌激素样增效作用。另一方面,内源性的性激素前体的研究与应用近年也取得了令人鼓舞的进展。
脱氢表雄酮及其硫酸酯[DHEA(S)]是肾上腺皮质分泌的最丰富的甾体激素,动物实验结果显示其具有抗肥胖、抗癌、增强免疫作用。其增强体质、改善骨密度、提高机体免疫力等功能已在临床应用中得到证实。DHEA(S)在绝经后妇女的激素替代治疗中潜在应用价值已经引起重视,本文对这方面的进展做一综述。
二、DH EA(S)的生物特性
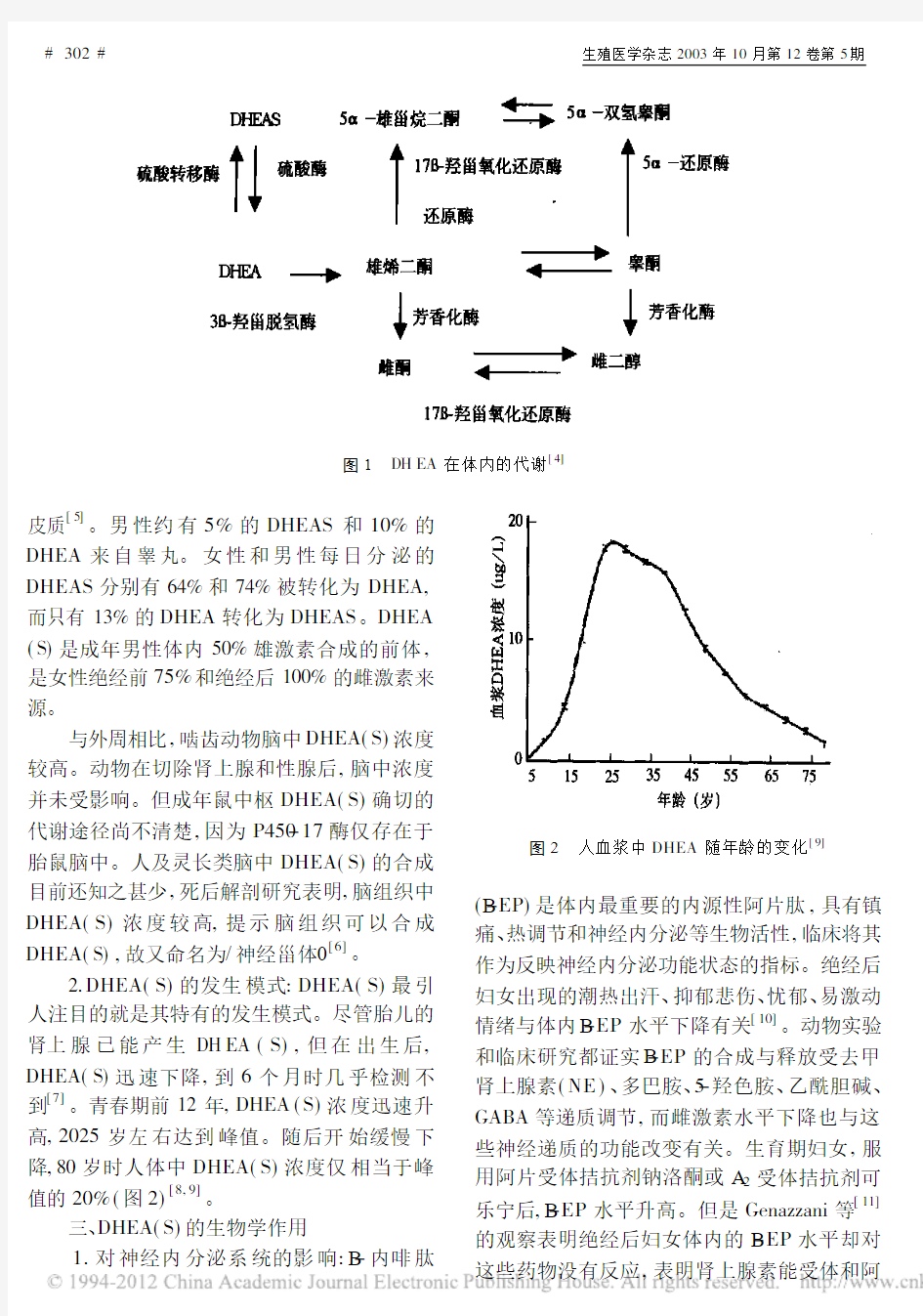
1.DH EA(S)来源及体内转化:DHEA和DHEAS主要来源于肾上腺素皮质[1],其中,只有不到1%的部分以DH EA形式参与血液循环[2]。DHEA半衰期<30min,并呈现明显24h节律性。DHEAS生物半衰期较长(710 h),24h节律性较差[3]。60%80%的DHEAS在肝脏和肾脏中经过硫酸酶作用转化为DH EA 后进入血液循环,其中约10%的DH EA经过硫酸转移酶作用转化为DHEAS,两者之间存在动态平衡。在DH EA代谢过程中产生多种生物活性的甾体化合物如睾酮(T)、5A-双氢睾酮(DHT)、雌二醇(E2)、雌三醇(E3)及雄烯二醇等(图1)[4]。
健康女性肾上腺皮质和卵巢均可合成DHEA(S),但绝经后妇女主要来源于肾上腺
=收稿日期>2002-09-16;=修回日期> 2002-11-13
=基金项目>国家科技部重点973项目(G2000571008)
=作者简介>刘雁勇(1972),男,河南上蔡人,助理研究员.
图1 DH EA 在体内的代谢[4]
皮质[5]
。男性约有5%的DHEAS 和10%的DHEA 来自睾丸。女性和男性每日分泌的DHEAS 分别有64%和74%被转化为DHEA,而只有13%的DHEA 转化为DHEAS 。DHEA (S)是成年男性体内50%雄激素合成的前体,是女性绝经前75%和绝经后100%的雌激素来源。
与外周相比,啮齿动物脑中DHEA(S)浓度较高。动物在切除肾上腺和性腺后,脑中浓度并未受影响。但成年鼠中枢DHEA(S)确切的代谢途径尚不清楚,因为P450-17酶仅存在于胎鼠脑中。人及灵长类脑中DHEA(S)的合成目前还知之甚少,死后解剖研究表明,脑组织中DHEA(S)浓度较高,提示脑组织可以合成DHEA(S),故又命名为/神经甾体0[6]。2.DHEA(S)的发生模式:DHEA(S)最引人注目的就是其特有的发生模式。尽管胎儿的肾上腺已能产生DH EA (S),但在出生后,DHEA(S)迅速下降,到6个月时几乎检测不到[7]。青春期前12年,DHEA (S)浓度迅速升高,2025岁左右达到峰值。随后开始缓慢下降,80岁时人体中DHEA(S)浓度仅相当于峰值的20%(图2)[8,9]
。
三、DHEA(S)的生物学作用
1.对神经内分泌系统的影响:B -内啡肽
图2 人血浆中DHEA 随年龄的变化[9]
(B -EP)是体内最重要的内源性阿片肽,具有镇
痛、热调节和神经内分泌等生物活性,临床将其作为反映神经内分泌功能状态的指标。绝经后妇女出现的潮热出汗、抑郁悲伤、忧郁、易激动情绪与体内B -EP 水平下降有关[10]。动物实验和临床研究都证实B -EP 的合成与释放受去甲肾上腺素(NE )、多巴胺、5-羟色胺、乙酰胆碱、GABA 等递质调节,而雌激素水平下降也与这些神经递质的功能改变有关。生育期妇女,服用阿片受体拮抗剂钠洛酮或A 2受体拮抗剂可乐宁后,B -EP 水平升高。但是Genazzani 等[11]
的观察表明绝经后妇女体内的B -EP 水平却对这些药物没有反应,表明肾上腺素能受体和阿
片受体功能障碍。绝经后妇女服用DHEAS7 d后,血液中的DHEA、DHEAS、T、E2、E3均显著升高,B-EP也恢复了对药物的反应。但是短期治疗效果不明显,经过连续服用DH EA23个月后,临床观察到B-EP显著升高。
2.对神经递质受体的影响:人们认为DHEA(S)首先通过与细胞表面神经递质受体作用,这点有别于经典的甾体激素。DHEA(S)中枢作用研究较多的是对GABA A受体的影响。GABA A受体是一个多亚基组成的配体门控离子通道。通道激活后,Cl-内流增加。巴比妥是其激动剂,而其他抗惊厥药是其拮抗剂。Majewska等[12]和Sousa等[13]指出DHEA(S)是GABA A的负性非竞争性调节剂,DH EA(S)非竞争性阻断培养的鼠神经元的GABA诱导的电流,DHEAS的作用较DHEA强34倍。DHEA(S)作为GABA A受体的拮抗剂可以改善记忆。
除了对GABA A受体的作用,DHEA(S)对脑内Sigma受体也产生影响。Sigma受体在中枢的密度很高,一些抗精神和抗抑郁药与Sig-ma受体具有较高的亲和力[14,15]。选择性Sig-ma激动剂增强大鼠海马CA3神经元对N-甲基-D-天冬氨酸(NM DA)的反应,由于NM DA受体与突触可塑性有关,所以DH EA可能有促进学习记忆的作用。关于DH EA与Sigm a受体作用关系的首次报道是体外研究DHEA对NM DA诱导的海马细胞NE释放的影响。30 nmol/L DH EA增强细胞反应,其作用可被Sig-ma受体拮抗剂阻断,表明DHEA(S)通过激动Sigma受体增强NMDA诱导的神经元兴奋性[16]。DH EA(S)还可以直接增强NM DA受体反应。除作用于GABA A和Sig ma受体外, DHEA(S)还抑制豚鼠海马CA1区锥体细胞Ca2+内流,减少神经元兴奋性[17],与上述结果对比表明DHEA在脑内可能有双向调节作用。
四、DHEA与临床
1.DHEA与抑郁症:DH EA具有增强记忆、抗焦虑、抗抑郁和抗糖皮质激素作用已在哺乳动物实验中得到证实,有人认为DH EA水平过低是导致精神疾患的一个重要因素。现在有关抑郁病人DHEA(S)水平报道较少,但患者脑脊液中促肾上腺皮质释放激素(CRH)、考的松水平显著升高。一种假说认为CRH过度释放导致下丘脑-垂体-肾上腺(HPA)轴功能紊乱,由此产生一系列抑郁病症状。抑郁症患者考的松水平显著升高可能是其认知功能损伤的重要原因[18]。
对816岁的重度抑郁症患者发展阶段测定考的松/DHEA比率,发现其明显升高[19]。但在3例成年抑郁患者却发现较高的DH EAS水平,并有2例DH EAS水平伴随药物治疗进程显著下降[18]。在考的松增高症抑郁症患者中发现DHEA与正常人群相比水平较高,DH EA 日间节律性变化不明显,患者尿中DH EA、考的松水平没有明显差异。高DHEAS水平与年轻妇女抑郁症状相关,而低水平DHEAS与老年妇女抑郁症状相关[20]。Wolkoqitz等[21]观察到6例老年重度抑郁患者使用DHEA(3090 mg/d)14d后,症状得到改善。近年有报道15名中年精神抑郁患者服用DHEA(开始30mg/ d,3周后改为150mg/d,连续再服3周)后,症状明显改善,并且DHEA抗抑郁作用起效很快,大约10d以内[22]。
2.DHEA与认知及身心健康:老年人尤其是DHEA水平较低和存在某种程度记忆下降的人应该是DH EA治疗的适宜人群。研究表明平均年龄54岁的中老年人,50mg/d DH EA 服用3个月后,有82%的女性和67%的男性明显增强体力,自我感觉良好,同时机体胰岛素样生长因子-I(IGF-I)水平明显升高[23]。但是这项研究没有设立评价标准,只是随访得到的结果。在另外一项双盲、安慰剂-对照的研究中,平均年龄70岁的老年人服用50mg/d DH EA 两周或安慰剂,发现对认知没有作用,但能使女性心情改善,而对男性没有作用[24]。但是也有许多DHEA无效的报道。有关研究目前争议较多,尚需进一步观察。
3.DH EA(S)与体质:Nestler等[25]研究了5个健康年轻志愿者服用DHEA1600mg/d 连续28d后对身体脂肪、血脂与胰岛素敏感性的影响,发现服用DHEA后体内脂肪减少了,肌肉力量增强了而体重没有变化。同时血液中总胆固醇、低密度脂蛋白减少,胰岛素敏感性没有改变。M orales等[23]进行一项双盲、安慰剂-对照研究,30名志愿者(13男,17女,4070岁)服用DH EA50mg/d连续3个月,结果安慰剂组与用药组体内脂肪比重、体重没有明显差别。20名绝经后妇女口服DHEA25mg/d12个月后,胰岛素敏感性提高29.55%,高密度脂蛋白水平升高11.61%,低密度脂蛋白下降11. 07%,甘油三酯下降19.60%,但葡萄糖耐受没有改变[26]。
4.DHEA与机体免疫力:动物实验表明DHEA具有增强机体免疫功能的作用。DHEA 及其代谢物-雄烯二醇、雄烯三醇能防止病毒、细菌和寄生虫对小鼠的侵袭。DH EA随年龄而降低,而考的松浓度保持稳定。考的松/DHEA 水平升高导致机体细胞免疫功能受抑制。如T-细胞因子表达水平明显下降,T H1细胞因子IL-2、INF C都减少了,T H2细胞因子IL-4、IL-5、IL-6水平升高[27]。细胞因子表达紊乱削弱了机体对疾病的抵抗力。例如,异常高水平的IL-10往往是机体产生自身抗体的原因,与系统性红斑狼疮有关,同时也是艾滋病、肺结核、黑色素瘤和淋巴瘤的诱发因子。老年大鼠使用DHEA后能降低IL-10表达水平,减少该细胞因子产生的反应,并能恢复T-淋巴细胞因子水平[28]。
人体研究结果一样鼓舞人心。绝经期妇女DHEA补充后,CD4+T H细胞减少,而CD8+ CD56+T K细胞增加,并且自然杀伤细胞活性增强[29]。高龄人群服用DHEA50mg/d20周后,单核巨噬细胞、B细胞、T细胞、可溶性IL-2受体及自然杀伤细胞均有增加[30]。艾滋病患者血浆DHEAS水平随病程进行性下降。在一项对照双盲实验中,14例患者口服DHEA50mg/d连续4个月后,与服用安慰剂的对照组相比,患者血DHEAS及CD4+细胞数目水平均显著升高,显示DH EA的免疫促进作用[31]。
5.DHEA与骨骼健康:通过对120名绝经后妇女(5199岁)的研究表明,其骨密度(BMD)与血清DH EAS水平明显相关。患者补充DHEA50mg/d3个月后,机体DHEA、E2、T 及IGF-I均恢复正常水平,而尿中骨再吸收标志物N-端交联(NT X)减少,表明破骨细胞活性被抑制、溶骨过程停止。血清碱性磷酸酶(BAP)和骨钙素(OC)上升,表明造骨细胞活性增加,骨质再生开始[32]。最近,Baulieu等[33]进行了一项大规模试验,280名老年志愿者(6079岁)服用DHEA50mg/d,为期1年。试验采用双盲法,并设立安慰剂对照。结果发现,70岁以下年龄段老年人体内钙代谢没有明显差异,而70岁以上老人经过DHEA治疗后,血清磷水平下降。85%有不同程度维生素D缺乏症,对照组和治疗组没有差异。男性服用DH EA 以后,无论BMD还是其他生化指标没有明显变化。在女性身上C端交联(CT X)明显下降,而OC和BAP没有变化。在体外培养的人成骨细胞实验表明DHEA可被细胞内芳香化酶转化为雌激素从而发挥维持BMD作用[34]。
五、小结
DHEA(S)是肾上腺皮质分泌的最为丰富的甾体激素,体内水平随年龄增加进行性下降,从而加速一些老年性疾病如糖尿病、骨质疏松等的发生发展。DHEA补充后,能够促进骨骼健康、提高机体免疫力、改善绝经期后妇女躯体和精神反应。关于DHEA的作用机理,人们认为有以下几种途径:(1)通过其特异受体介导发挥作用,但目前有关其受体的报道较少;(2)转化为T或雌激素发挥生理作用;(3)与多种递质受体作用。临床已对DHEA进行了无数次试验研究,而将DH EA作为一种营养补充使用的人更多。到目前为止,有关DHEA副反应的报道很少,但是这并不意味着DHEA就是绝对安全的。今后,国内尚需积累更加深入细致的
调查研究资料。
=参考文献>
[1]Adam JB.Control of secretion and the functi on of C19-
delta5-steriods of the human adrenal gland[J].M ol Cell
Endocri nol,1985,41(1):1-17.
[2]Zumoff B,Rosenfeld RS,S train GW,et al.S ex differ-
ence in the twenty-four hour mean plasma concentration of
dehydroisoandrosterone(DHA)and dehydroisoan-
drosteron e sulfate(DHAS)and the DHA to DHAS rati o
in normal adults[J].J Clin Endocrinol M etab,1980,51
(2):330-333.
[3]Longcope C.Dehydroepiandrosterone metabolism[J].J
Endocri nol,1996,150[S uppl]:s125-127.
[4]Legrain S,M assi en C,Lahlou M,et al.Dehy-
droepiandrosterone replacement adminis tration:pharm-
cokineti c an d pharmacodynamic studies i n healthy elderly
subjects[J].J Clin Endocrinol M etab,2000,85(9):
3208-3217.
[5]Couzinet B,M eduri G,Lecce M G,et al.T he post-
menopausal ovary is not a major androgen-producing gland
[J].J Clin Endocrinol M etab,2001,86(10):5060-5066 [6]Lacrox C,Fiet J,Benais JP,et al.Simul taneous radioim-
munoas sy of progesterone,andro-4-enedione,pre-
nenolone,dehydroepi androsterone and17-hydrox-
yprogesterone in specific regions of human brai n[J].J
Steroid Bioch em,1987,28(3):317-325.
[7]Perretti ED,Forest M G.Pattern of plas m a dehy-
droepiandrosterone sulfate levels in humans from birth to
adulthood:evidence for tes ticular production[J].J Clin
Endocri nol M etab,1978,47(3):572-577.
[8]Gray A,Feldman HA,M ckinlay JB,et al.Age,disease,
and changing sex hormone level s in middle-aged men:re-
sul ts of the M assachusetts male aging study[J].J Clin
Endocri nol M etab,1991,73(5):1016-1025.
[9]Hinson JP,Raven PW.DHEA deficiency syndrome:a
new term for old age[J].J Endocrinol,1999,163(1):1-
5.
[10]S tomati M,Bersi C,Rubino S,et al.Neuroendocri n e ef-
fects of di fferent oestradi o-l progesti n regimens i n post-
menopausal w omen[J].M aturitas,1997,28(2):127-
135.
[11]Genazzani AR,Stomati M,Bernardi F,et al.De-hy-
droepiandrosterone as neurosteriod:neuroendocrine ef-
fects in post-menopausal w omen[J].J Endocrinol Invest,
1999,22[10Suppl]:19-23.
[12]M aj ewska M D.Neurosteroids:endogenous bimodal
modulators of the GABA-A receptor:mechan i sm of action
and physiological significance[J].Neurobiology,1992,38
(4):379-395.
[13]Sousa A,Ticku M K1Interaction of the n eurosteroi d de-
hydroepiandrosterone sulfate w ith the GABA(A)receptor
complex reveal s that it may act via the picrotoxin site[J].
J Pharmacol Exp T her,1997,282(2):827-833.
[14]W alker JM,Bow en WD,Walk er FO,et al.Sigma recep-
tors:biology and functin[J].Pharmacol Rev,1990,42
(4):335-402.
[15]Debonnel G,de M ontigny C.M odulation of NM DA and
dopaminergic neurotrans m i ssions by sigma ligands:poss-i
ble i mplications for th e treatm ent of psychiatric disorders
[J].Life S ci,1996,58(9):721-734.
[16]M onn et FP,M ahe V,Robel P,et al.Neurosteroids,via
si gma receptors,modulate the[H3]noepinephrine release
evoked by N-methy-l D-asparate in the rat hippocampus
[J].Proc Natl Acad S ci USA,1995,92(9):3774-3778.
[17]Irw in RP,Lin SZ,Rogaw ski M A,et al.Steroid potent-i
ation and inhibition of N-methy-l D-asparate receptor-me-
diated intracellular Ca2+response:structure-activity stud-
ies[J].J Pharmacol Exp ther,1994,271(2):677-682.
[18]Takebayashi M,Kagaya A,Uchitom i Y,et al.Plasma
dehydroepiandrosterone sulfate in unipolar major depres-
sion[J].J Neural Transm,1998,105(4-5):537-542. [19]Goodyer IM,H erbert J,Al tham PM,et al.Adrenal se-
cretion during major depression in8-to16-year-old:I.
Altered diurnal rhythms in salivary corti sol and dehy-
droepiandrosterone(DHEA)at presentation[J].Psychol
M ed,1996,26(2):245-256.
[20]M orrison M F,Ten Have T,Freeman EW,et al.
DHEA-S levels and depressive symptoms in a cohort of
African,American and Caucasian women in the late re-
productive years[J].Biol Psychiatry,2001,50(9):705-
711.
[21]W olkow i tz OM,Reus VI,Robert E,et al.Dehy-
droepiandrosterone(DHEA)treatment of depressi on[J].
Biol Psychiatry,1997,41(3):311-318
[22]Bloch M,Schmidt PJ,Danaceau M A,et al.Dehy-
droepiandrosterone treatment of midlife dysthymia[J].
Biol Psychiatry,1999,45(12):1533-1541.
[23]M orales AJ,Nolan JJ,Nelson JC,et al.Effects of re-
placement dose of dehydroepian drosterone in men and
women of advancing age[J].J Clin Endocrinol M etab,
1994,78(6):1360-1367.
[24]Flynn M A,W eaver-Osterholtz D,Sharpe-T i mms KL,et
al.Dehydroepiandrosterone replacement in aging humans
[J].J Clin Endocrinol M etab,1999,84(5):1527-1533.
[25]Neslter JE,Barlascini CO,Clore JN,et al.Dehy-
droepiandrosterone reduces serums low density lipoprotein
levels and body fat but does not alter insulin sensitivity in
normal men[J].J Clin Endocrinol M etab,1988,66(1):
57-61.
[26]Lasco A,Frisina N,M orabi to N,et al.M etabolic effects
of dehydroepiandrosterone replacement therapy in post-
menopausal w omen[J].Eur J Endocrinol,2001,45(4):
457-461.
[27]James K,Premchard N,Skibinska A,et al.IL-6,
DHEA and ageing process[J].M ech Aging Dev,1997,
93(1-3):15-24.
[28]S pencer NFL,Norton SD,Harri son LL,et al.Dysregu-
lation of IL-10production w i th ageing:possible linkage to
the age-associ ated decli ne in DHEA and its sulfate deriva-
tive[J].Exp Gerontol,1996,31(3):393-408.
[29]Cas son PR,Anderen RN,Herrod HG,et al.Oral dehy-
droepiandrosterone in physioligi c doses modulates immune
function in postmenopausal w omen[J].Am J Obstet Gy-
necol,1993,169(6):1536-1539.[30]Khorram O,Vu L,Yen SS.Activation of immune func-
tion by dehydroepiandrosterone(DHEA)in age-advanced
men[J].J Gerontol A Biol Sci M ed Sci,1997,52(1):
M1-7.
[31]Piketty C,Jayle D,Leplege A,et al.Double-blind place-
bo-controlled trial of oral dehydroepiandrosterone i n pa-
tients w ith advanced H IV disease[J].Clin Endocrinol,
2001,55(3):325-330.
[32]Gordon CM,Grace E,Emans SJ,et al.Changes i n bone
turnover markers and menstrual function after short-term
oral DHEA in young w omen w ith anorex i a nervose[J].J
Bone M iner Res,1999,14(1):136-145.
[33]Baulieu EE,T homas G,Legrain S,et al.Dehy-
droepiandrosterone(DHEA),DHEA sulfate,and aging:
contribution of the DH EAge study to a sociobiomedical is-
sue[J].PNAS,2000,97(8):4279-4284.
[34]Takayanagi R,Goto K,Suzuki S,et al.Dehy-
droepiandrosterone(DHEA)as a possible source for es-
trogen formation in bone cells:correlati on betw een bone
mi n eral densi ty and serum DHEA-sulfate concentration in
postmenopausal w omen,and the presence of aromatase to
be enhanced by1,25-dihydroxyvitamin D3in human os-
teoblasts[J].M ech Aging Dev,2002,123(8):1107-
1114.
关于书写作者单位名称的说明
自本刊实行论著文稿同时附中、英文摘要以来,特别是目前全国部分医学院校与综合性大学合并调整后发现,不少作者在投稿时,对所在单位的中、英文名称书写不规范,单位开具推荐信(介绍信)使用的公章与文稿中所书写的不一致。单位名称书写不规范,将影响读者与作者之间的联系,以及文稿发表后文献计量学的统计等工作。为此,本刊就作者单位名称的书写要求如下:(1)作者在投稿时,应列出单位名称的全称,如已归属于综合性大学的单位,应先列出大学名称,之后列出医学院或医院、科室名称。(2)单位的英文名称应根据所在单位统一的英文名称书写。(3)作者在投稿时,单位科研部门开具文稿推荐信的公章内容,需与文稿中所书写的单位名称一致。这一点,特别提请目前已完成院校合并、调整的单位注意。(4)由不同单位共同撰写的文稿,各个单位的名称均需分别列出,由第一作者所在单位开具文稿推荐信。(5)如文稿作者为集体作者,英文摘要的作者项中,应列出本文稿第一整理者(第一执笔者)的姓名及工作单位。(6)如文稿第一作者在投稿后工作单位有变动,英文摘要的作者项中,应同时列出第一作者的原单位及现在单位。
本刊编辑部
内科主治医师内分泌学(专业知识)-试卷6
内科主治医师内分泌学(专业知识)-试卷6 (总分:58.00,做题时间:90分钟) 一、 A4型题(总题数:5,分数:30.00) 男性,14岁。严重口干,多饮、多尿伴遗尿2个月就诊。体检:身高132 cm,体重26 kg。(分数:6.00) (1).初诊时下列哪项检查最能迅速协助筛选(分数:2.00) A.血糖、血酮 B.尿糖、尿酮 C.尿糖、尿比重√ D.血糖、血浆渗透压 E.OGTT 解析: (2).经一系列检查后,患者确诊为中枢性尿崩症,为了进一步明确病因诊断,还应做下列哪项检查(分数: 2.00) A.蝶鞍MRI √ B.禁水一加压试验 C.禁水试验 D.颅骨平片 E.骨龄测定 解析: (3).应用长效尿崩停进行深部肌内注射过程中,应警惕下列哪种情况出现(分数:2.00) A.切勿过量引起水中毒√ B.内脏血管收缩及平滑肌收缩引起腹痛 C.高血压 D.肝损害 E.白细胞减少 解析: 男,30岁,主诉口渴、多饮、多尿1个月,尿比重偏低。(分数:6.00) (1).下列疾病可不予考虑的是(分数:2.00) A.完全性中枢性尿崩症 B.部分性中枢性尿崩症 C.肾性尿崩症 D.原发性醛固酮增多症√ E.慢性肾炎、肾功能不全 解析: (2).为确证此病人有无尿崩症,下列试验应首选(分数:2.00) A.禁水试验 B.测量每日尿总量 C.禁水一加压素联合试验√ D.测血浆渗透压 E.测尿渗透压 解析: (3).在用于鉴别完全性与部分性中枢尿崩症的禁水加压素联合试验中,下列指标最具有鉴别意义的是(分数:2.00) A.禁水后的渗透压测定 B.禁水后的尿比重 C.禁水后的尿量减少程度 D.注射垂体加压素后尿比重比禁水后最高尿比重增加的百分率√
常见生理学缩写
常见生理学缩写 Document number:NOCG-YUNOO-BUYTT-UU986-1986UT
常见生理学缩写: 1、细胞内液(ICF) 2、细胞外液(ECF) 3、组织液或组织间液(ISF) 4、第二信使三磷酸肌醇(IP3) 5、二酰甘油(DG) 6、水孔蛋白(AQP) 7、葡萄糖转运体(GLUT) 8、质膜钙ATP酶(PMCA) 9、肌质网和内质网钙ATP酶(SERCA) 10、低密度脂蛋白(LDL) 11、烟碱型乙酰胆碱受体(nAChR) 12、谷氨酸促离子型受体(iGluR) 13、甘氨酸受体(GlyR) 14、r-氨基丁酸A受体(GABAAR) 15、腺苷酸环化酶(AC) 16、磷脂酶C(PLC) 17、磷脂酶A2(PLA2) 18、磷酸二酯酶(PDE) 19、环磷酸腺苷(cAMP) 20、环磷酸鸟苷(cGMP) 21、花生四烯酸(AA)
22、蛋白激酶A(PKA) 23、蛋白激酶C(PKC) 24、交换蛋白(EPAC) 25、结合蛋白(BP) 26、酪氨酸激酶受体(TKR) 27、酪氨酸激酶结合型受体(TKAR) 28、鸟苷酸环化酶(GC) 29、心房钠尿肽(ANP) 30、脑钠尿肽(BNP) 31、蛋白激酶G(PKG) 32、激素反应元件(HRE) 33、静息电位(RP) 34、动作电位(AP) 35、后去极化电位(ADP) 36、后超极化电位(AHP) 37、微终板电位(MEPP) 38、肌质网(SR) 39、连接肌质网(JSR) 40、红细胞(RBC) 41、白细胞(WBC) 42、血小板(PLT) 43、树突状细胞(DC)
先天性肾上腺皮质增生症新生儿筛查共识
【标准?方案?指南】先天性肾上腺皮质增生症新生儿筛查共识 【标准·方案·指南】先天性肾上腺皮质增生症新生儿筛查共识 作者:中国医师协会青春期医学专业委员会临床遗传学组 中华医学会儿科学分会内分泌遗传代谢学组 先天性肾上腺皮质增生症(congenital adrenal hyperplasia, CAH)为常染色体隐性遗传代谢病,由于类固醇激素合成过程中某种酶(如21-羟化酶、11β-羟化酶、3β-羟类固醇脱氢酶等)的先天性缺陷,导致肾上腺皮质功能减退,部分患儿伴有电解质紊乱及性腺发育异常。21-羟化酶缺乏症(21-hydroxylase deficiency, 21-OHD)为CAH最常见的病因,占90%~95%[1,2];国内外报道发病率1/10 000~1/20 000[1,3,4]。部分患儿在新生儿期可因肾上腺皮质功能危象而危及生命。 国际上新生儿CAH筛查(即21-OHD筛查)起始于1977年,至今已有30多个国家开展了新生儿CAH筛查[1]。我国CAH筛查起步于20世纪90年代初,目前全国有近百家新生儿筛查中心开展了CAH筛查。因新生儿筛查成效显著,可降低新生儿死亡率、减少女婴外生殖器男性化而造成性别误判,改善生长发育[3],因此,在全国普及CAH新生儿筛查已成为必然趋势。为了规范筛查流程、诊断及早期治疗,由中华预防医学会出生缺陷预防与控制专业委员会新生儿筛查学组、中国医师协会青春期医学专业委员会临床遗传学组及中华医学会儿科学分会内分泌遗传代谢学组组织专家进行讨论,就新生儿CAH筛查的规范达成以下共识。 【CAH筛查】 一、CAH筛查的原理及21-OHD分型 21-羟化酶缺乏引起肾上腺皮质合成皮质醇及醛固酮障碍,导致肾上腺皮质功能减退;酶缺乏导致其前体代谢物17-羟孕 酮(17-hydroxyprogesterone)增多,经旁路代谢导致肾上腺雄激素及睾酮产生增多;皮质醇合成障碍反馈性促使垂体促 肾上腺皮质激素(adrenocorticotropin,ACTH)分泌增加,刺激肾上腺皮质增生。临床上21-OHD分为经典型(包括失盐型 及单纯男性化型)与非经典型(轻型或迟发型)[2,5]。新生儿CAH筛查是通过测定干滤纸血片中17-羟孕酮浓度进行21-OHD 筛查,该筛查方法约能检出70%经典型21-OHD患儿[6,7],而非经典型21-OHD难以通过筛查发现[5]。 1.失盐型: 21-羟化酶完全缺乏型(严重型),占75%[3,4]。患儿出生1~4周左右出现呕吐、腹泻、体重不增、脱水、皮肤色素沉着、 难以纠正的低血钠、高血钾、代谢性酸中毒、甚至休克,病死率4%~11.3%[6,8];该型患儿雄激素增高及男性化程度严 重[9]。 2.单纯男性化型: 21-羟化酶活性为正常人的1%~11%[4,8],约占25%。该型患儿体内有失盐倾向,代偿性醛固酮增高使临床无失盐症 状,仅表现为雄激素增高[9,10]。男婴出生时外生殖器多正常,少数阴茎增大,睾丸大小正常;女婴出生时多伴有外生殖 器不同程度男性化(阴蒂肥大,阴唇融合);随着年龄增大,生长加速、骨龄超前,最终矮小。 3.非经典型: 21-羟化酶活性达20%~50%[1,4],中国少见;患儿在儿童后期或青春期出现雄激素增多的体征。
更年期女性如何使用激素替代治疗
更年期女性如何使用激素替代治疗 同济大学附属东方医院2011-12-27发表评论(5人参与)分享 作者:上海市同济大学附属东方医院特需妇产科刘岚 女性生理衰老的基础是卵巢内始基卵泡储备逐渐耗竭,它有一个渐进、累积的过程。 1994年世界卫生组织(WHO)将这一时期命名为“绝经过渡期”,定义为绝经前从临床特征、内分泌、生物学方面开始出现趋向绝经的变化,直至最终月经时止。 绝经是指女性的最后一次月经,只能回顾性确定,当停经达到或超过12个月,则认为卵巢功能真正衰竭,以致月经最终停止。围绝经期是指绝经过渡期至绝经后1年,其激素变化可对全身系统发生影响。其近期影响包括: ?月经改变,表现为月经周期延长、经量减少、月经周期不规则; ?血管舒缩症状,表现为潮热、潮红、出汗; ?神经精神症状,表现为忧郁、焦虑、多疑,常伴有性功能减退; ?泌尿生殖道症状,表现为阴道干燥、性交痛、尿路感染、尿失禁等。 远期影响包括骨质疏松和骨折、血脂升高和心血管疾病、早老性痴呆。 激素替代治疗(HRT)是维持绝经后女性健康的全部策略中的一部分,其用药的基本原则是个体化用药、早期开始治疗。HRT能有效缓解绝经症状、改善泌尿生殖道萎缩、预防骨质疏松,早期使用可能对预防心血管疾病和老年痴呆有一定作用,同时还有其他益处。 对多数女性来说,若在围绝经期就开始激素补充治疗,并在有明确指征的情况下使用,潜在益处很多,风险很小。乳腺癌和绝经后HRT的相关程度仍存在争议。HRT相关乳腺癌发生的可能风险很小(小于每年0.1%,属罕见级别)。应根据围绝经期女性不同的情况、年龄及意愿选择不同的激素补充治疗方案。
HRT的适应证 ?绝经相关症状(A级证据):潮热、盗汗、睡眠障碍、疲倦、情绪不振、易激动、烦躁和轻度抑郁。 ?泌尿生殖道萎缩相关问题(A级证据):阴道干涩、疼痛、排尿困难、反复性阴道炎、性交后膀胱炎、夜尿、尿频和尿急。 ?有骨质疏松症的危险因素(含低骨量)及绝经后骨质疏松症(A级证据)。 绝经后患骨质疏松性骨折的危险因素包括:高龄、低体重、雌激素缺乏(45岁以前绝经或切除双侧卵巢,绝经前闭经一年以上;正在接受激素治疗的女性不在此范围内)、骨密度低、长期低钙摄入、骨折史、骨质疏松症家族史、营养不良、体育运动不足、矫正后仍存在视力缺陷、摔倒史、吸烟、酗酒、痴呆等。 HRT的禁忌证和慎用情况 禁忌证已知或可疑妊娠,原因不明的阴道出血、已知或可疑患有乳腺癌、已知或可疑患有与性激素相关的恶性肿瘤、最近6个月内患有活动性静脉或动脉血栓栓塞性疾病、严重
性激素替代治疗
专题讨论 性激素替代治疗 作者单位:北京协和医院妇产科(100730) E 2mail :xuling @https://www.360docs.net/doc/b618466088.html, 文章编号:1005-2216(2004)08-0449-02 性激素替代治疗的历史 现状和展望 徐 苓 中图分类号:R71 文献标识码:A 近2年关于性激素替代治疗(HRT )的争论真的让人们困惑了。HRT 还能用吗?HRT 的前景到底如何?为此,梳理一下HRT 的历史、现状和未来,或许对减少困惑有所帮助。 1 HRT 的历史:风雨中走过来 1942年结合雌激素(conjugated equine estrogen ,pre 2marin ,倍美力)上市。从此,雌激素补充治疗(ERT )正式用 于临床并被越来越多妇女接受[1]。正当妇女们享受ERT 为她们带来的愉悦和生活质量改善的同时,却发现应用 ERT 的妇女发生子宫内膜癌的风险增加了。性激素替代 治疗遭遇了第一次“恐癌”危机。此次恐慌影响重大而深远,曾一度使ERT 的使用率下降了40%。甚至有人至今仍余悸未消。针对这一问题,1971年国际健康基金会在日内瓦召开了首次关于雌激素替代治疗大会,正式强调了对有子宫的妇女补充雌激素的同时也应周期性地加用孕激素。几十年的临床观察的确证实了联合应用雌、孕激素不再增加子宫内膜癌的风险。HRT 的使用又有所回升[2]。 人们期望并尝试应用HRT 预防绝经后妇女心血管疾病和老年性痴呆。这些发现恰恰迎合了现代女性让青春永驻的良好愿望,HRT 越发受到更多妇女的青睐,甚至出现了对HRT 的过度宣传和盲目滥用。为此,近10年来,在 HRT 领域中开展了一些较大样本的随机对照临床试验和 前瞻性研究,以期获得更好的临床证据,从而对HRT 的利弊关系做出更科学客观的评价。其中,以下三项研究影响较大:在美国进行的心脏与雌、孕激素替代治疗研究(Heart and Estrogen/Progestin Replacement Study ,HERS ),美国妇 女健康研究(Women ’s Health Initiative ,WHI )和英国百万妇女研究(Million Women Study ,MWS )。 1998年,HERS 发现已有冠心病的绝经后妇女应用雌、 孕激素连续联合治疗(HRT )1年时再发心脏病事件的危险 增加,首次提出HRT 不能用作心血管病的二级预防[3],这一发现曾在当时引起震惊。2002年7月WHI 报告用雌、孕激素连续联合治疗分支的中期总结:平均512年的观察发现,与安慰剂组相比接受HRT 的妇女心脏病事件、中风和浸润性乳腺癌的风险分别增加了29%、41%和26%;结肠癌和髋骨骨折的风险分别减少37%和34%。对上述几种风险的综合评价结果是绝经后妇女应用HRT 弊多利少。为此,连续联合HRT 组的试验提前终止[4~6]。WHI 的研究结果再次引起了人们对HRT 的怀疑和恐慌。而 2003年在Lancet 杂志上发表的关于HRT 与乳腺癌关系的 英国百万妇女研究(MWS )[7]结果无疑是对这种恐惧雪上加霜。 2 现状:恐慌过后的冷静思考 这些大型研究的结果值得重视,促使各国专家对HRT 的利弊进行冷静思考和重新审视[8,9]。在对这些研究结果客观分析的同时,也发现了其设计上的局限,故认为这些研究的结论不宜随意扩大范围。对此,各国绝经组织及国际绝经学会均发表了相关的评论[8,9]:(1)WHI 只评价了本研究感兴趣的部分结果,忽略了HRT 的最明显受益,即有效缓解更年期症状。所以,其对HRT 的受益/风险比的评估是不全面的。(2)WHI 研究中80%以上是没有绝经症状的健康老年妇女,并不具备HRT 的适应证。(3)HERS 与 WHI 研究对象平均63~65岁,比常用HRT 人群年龄高10 年左右。年龄越大,心血管疾病和乳腺癌的风险也就越高。 WHI 本身的分析也表明50岁妇女多种疾病的绝对风险仅 为60岁妇女的一半,是70岁妇女的1/4。许多妇女在进入研究时已是上述疾病的亚临床状态。(4)WHI 与HERS 只涉及了应用雌、孕激素连续联合方案组[每日倍美力 01625mg +醋酸甲孕酮(MPA )215mg ]这一特定的药物方 案、特定的药物剂量的情况。尚没有任何依据表明这样的结果可以推广到其他雌激素、其他孕激素、其他剂量、其他途径以及其他方案或其他人种。(5)受临床试验的限制,在 WHI 研究中不能做到用药的个体化。(6)和某些风险相 比,WHI 研究中所阐明的HRT 对各种事件的绝对风险是很低的,甚至低于肥胖对乳腺癌和心血管疾病的风险。(7) MWS 中关于乳腺癌和HRT 的分析是有偏倚的。进入研 究第1年检出的乳腺癌不可能是HRT 所致。(8)值得深思的是在刚刚结束的WHI 中单用雌激素分支7年的结果显示除卒中风险依旧存在外,乳腺癌和心血管病的风险并没有增加[10]。 在冷静思考的基础上,我们重新评估HRT 的风险与
脱氢表雄酮在妇产科领域的应用研究
脱氢表雄酮在妇产科领域的应用研究 张阳阳综述 徐阳审校 【摘要】脱氢表雄酮(DHEA )及其硫酸盐硫酸脱氢表雄酮(DHEAS )是人体内最丰富的甾体物质,其生理作用机制尚不清楚。低水平的DHEA 不仅与年龄有关,而且与糖尿病、心血管疾病、神经及免疫疾病有关。DHEA 的临床应用研究已成为热点, 尤其是在女性中的应用,其临床有效性在国外受到公认,但仍然缺少大量的证据支持DHEA 应用的安全性。DHEA 在女性中的临床研究需要大量设计科学严谨的随机对照试验。综述DHEA 在妇产科的应用。 【关键词】硫酸脱氢表雄酮;卵巢功能早衰;受精,体外;流产;围绝经期 Application of DHEA in Obstetrics and Gynecology ZHANG Yang-yang ,XU Yang.The Reproductive and Genetic Medical Center ,Peking University First Hospital ,Beijing 100034,China 【Abstract 】The mechanism of action of dehydroepiandrosterone (DHEA )and its sulphate DHEAS ,the most abundant sex steroids in human ,are not well understood.Low levels of DHEA are associated not only with the ageing process but also with diabetes mellitus ,cardiovascular diseases and some neurological or immunological diseases.Clinical application and practice of DHEA have been a topic , especially in women.Although its effectiveness has been universally acknowledged , there is scant evidence to support the safety of DHEA in clinical therapy.It is necessary to conduct the adequately powered ,well-designed and randomized ,and placebo-controlled trials to evaluate the clinical application of DHEA. 【Key words 】Dehydroepiandrosterone sulfate ;Ovarian failure ,premature ;Fertilization in vitro ;Abortion ;Perimenopause (J Int Reprod Health蛐Fam Plan ,2012,31:291-294,311) 作者单位:100034北京大学第一医院生殖与遗传医疗中心 ·综述· 1934年Butenandt 和Dannenbaum 成功地从尿中 分离出了脱氢表雄酮(dehydroepiandrosterone ,DHEA ),1944年Munson 发现了DHEA 的硫酸盐———硫酸脱氢表雄酮(dehydroepiandrosterones ,DHEAS )。多年来一直认为DHEA (S )是性激素的惰性前体,其真正生理作用尚不清楚。近年来国内外对DHEA (S )已作了大量的基础与临床研究,表明其具有许多特殊的生物学活性,认为DHEA (S )在精神神经、骨骼、心血管,特别是妇产科领域中有其独特作用。现对DHEA (S )在妇产科的应用进行综述。1 女性体内的DHEA 女性体内的雄激素主要在肾上腺和卵巢合成。肾上腺的甾体化合物DHEA 是人类甾体性激素的重要前体。DHEA 来源于胆固醇,主要在肾上腺皮质网状带合成,是人体血循环中最为丰富的甾体物质。DHEA 的浓度随年龄不断变化,胎儿肾上腺即可产生大量的DHEA ,但出生后迅速下降,直到青春期前两年,DHEA 的浓度可快速上升,到成年时达到顶峰,然后随年龄增长以每年5%的速率下降,至70~80 岁时,循环中的DHEA 浓度只有顶峰时的5%~10%[1], 甚至几乎检测不到[2]。女性DHEA 70%~90%来源于肾上腺皮质,10%~30%来自卵巢,DHEAS 几乎全部来自肾上腺皮质,是女性绝经前50%和绝经后100%的雌激素来源。 DHEA 在肝脏和肾上腺中经过硫酸转移酶作用转化为DHEAS 进入血循环,而DHEAS 只有在外周组织中(卵巢、前列腺、骨骼、脂肪组织及大脑等)经过硫酸酯酶作用转化为DHEA ,才能进一步转化为雄烯二酮、睾酮、双氢睾酮、雌酮和雌二醇(E 2)发挥生物学效应。DHEA 在外周组织中转化为性激素依赖于组织中甾体激素生成和新陈代谢酶系的表达水平。当循环中DHEA 的浓度达到7μg/L 时,其转化为有活性的性激素过程出现酶的饱和,有利于避免女性暴露于过高的性激素水平中。 近年研究表明,DHEA 在人体各器官具有广泛的生理作用,作用机制尚不十分清楚,现在认为主要通过以下3种途径发挥作用:①通过DHEA 特异受体(如神经递质受体)介导发挥作用,但目前有关其受体的报道很少。②在外周组织转化为雄激素或雌激素发挥生理作用。③疏水性的DHEA 与多种大分
更年期激素替代疗法的利弊
更年期激素替代疗法的利弊 女性一般于40 岁以后开始出现卵巢功能减退, 引起雌激素不足, 最终导致绝经前后一 系列躯体和精神心理症状。由于寿命延长, 女性一生中有1 /3 的时间是在绝经后期度过的, 为了提高老年妇女的健康水平和生活质量, 激素替代疗法(HRT) 已越来越成为不可缺少的 保健和治疗手段。自20 世纪60 年代至今, 关于更年期HRT 的基础、临床、流行病学研究发展很快, 人们对它的认识也有了较大的变化, 对其安全性为关注, 特别是HRT 后引起恶性 肿瘤的风险性一直是研究的热点。那么到底应用激素替代是利大还是弊大? 结合研究的进展与人们观念的改变, 我们可以从中得到一些启发。 1 对绝经问题及HRT 的认识 早期人们对HRT 适应症的认识是无选择性的, 认为只有好处没有坏处, 随着经验技术 的提高, 认识的内容发生了变化, 知道了以前并未注意的HRT 的禁忌症和慎用症。通过实践发现, 合理的HRT 能明显缓解和改善更年期综合征,并能有效预防心血管病和骨质疏松症等, 因此病例的选择和适应症的掌握是非常重要的。 2 HRT 的益处 2.1 治疗更年期综合征 HRT 能很好地缓解短期或长期的更年期综合征, 如血管舒缩症状, 阴道及其他泌尿生 殖器官症状和心理或情绪变化。有报道, 50%以上绝经后妇女有潮热、盗汗及失眠等症状, 用药8 周的有效率为90%~95%[2]。 2.2 预防绝经后骨质疏松 绝经后妇女每年丢失2%~3%的皮质骨和5%~8%的髓质骨, 结局即严重的骨质疏松症 ( PMOP) , PMOP 最常引起髋骨骨折。妇女一生中髋骨骨折的危险性大于乳腺癌、子宫内膜癌和卵巢癌的危险性总和, 因此PMOP 成为HRT 的主要治疗目的之一。雌激素和骨细胞相互作用, 调节着控制骨质再形成的细胞因子网络。HRT 可防止骨质过快丢失, 从而稳定了骨密度, 减少骨质疏松性骨折的发生。采用HRT 6 年以上者, 髋骨或腕骨骨折危险可减少50%, 椎骨畸形发生率减少90%, 一旦HRT 停止, 骨质丢失又会加速[3]。 2.3 预防冠心病 绝经后因雌激素缺乏, 血脂代谢失调, 易诱发动脉粥样硬化, 使得绝经后妇女冠心病(CHD) 发生率明显增高。HRT补充生理需要的雌激素, 从而维持正常的血脂代谢, 对心脏有保护作用。 2.4 预防阿尔兹默病 阿尔兹默病(AD) 是最常见的一种老年性痴呆, 女性多患。人脑内具有记忆功能的海马状突起中含有雌激素及其受体, AD 患者中血清硫酸雌酮( 绝经后妇女体内主要的雌激素) 水平较同龄妇女低。目前神经学研究、动物行为研究和人群调查研究均提示雌激素可能对改善AD 患者的认知功能和情绪有益。有人用计算机测试认知速度和认知的准确性, 用正离子发射断层测脑糖代谢, 也发现雌激素可在一定程度上改善认知与记忆功能, 有抗衰老的功 效[6]。一些研究证明HRT与AD存在剂量———效应关系, 认为雌激素使用时间越长、剂量越大、效果越好。但这必然增加副作用, 限制其使用, 影响治疗效果, 矛盾由此产生。 3 HRT 的弊端 目前研究显示, HRT 对绝经后妇女血压与血糖无不良影响, 但对高血压、糖尿病患者应用HRT 尚需谨慎监测。长期应用HRT 是否致癌, 这是人们最关心的问题。目前认为,HRT 不增加生殖道鳞癌的危险, 可能不增加卵巢癌、宫颈、阴道癌的发生。但总的来看, 研究结果中HRT 所引起的癌症风险是增加的多、降低的少。 3.1 冠心病
脱氢表雄酮
脱氢表雄酮 文章目录*一、脱氢表雄酮的基本信息1. 定义2. 专科分类3. 检查分类4. 适用性别5. 是否空腹*二、脱氢表雄酮的正常值和临床意义1. 正常值2. 临床意义*三、脱氢表雄酮的检查过程及注意事项1. 检查过程2. 注意事项*四、脱氢表雄酮的相关疾病和症状1. 相关疾病2. 相关症状*五、脱氢表雄酮的不适宜人群和不良反应1. 不适宜人群2. 不良反应 脱氢表雄酮的基本信息 1、定义血清中去氢表雄酮(dehydroepiandrosterone,DHEA)大部分以硫酸结合物(DHEA-s)的形式存在。大约90%血循环中DHEA-S来自肾上腺皮质网状带,血清中浓度多用于评价疑有肾上腺雄激素分泌过多的情况。血清DHEA-S与24h尿17-酮类固醇的排出量密切相关,临床意义大致相同。 脱氢异雄酮(DHA)系由17α羟孕烯醇酮经17碳链酶作用而成,为雄烯二酮及睾酮的前体,DHA是肾上腺皮质分泌的主要雄激素,此外卵巢与睾丸也有少量产生,分泌量成人平均每日约为 25mg。样品中的DHA与定量的3H-DHA和加入的专一抗体,产生竞争结合,反应平衡,用DCC吸附游离部用,结合部分即可计数,根据标准曲线,可查知未知样品中的含量。 2、专科分类泌尿
3、检查分类血液检查 4、适用性别男女均适用 5、是否空腹空腹 脱氢表雄酮的正常值和临床意义 1、正常值男性:200-3350ng/ml(放免法)。 女性:青春前(男性及女性)100-600ng/ml;绝经前 700-3900ng/ml;绝经后110-610ng/ml。 2、临床意义DHEA-S增高:肾上腺肿瘤、多囊卵巢综合征、迟发型21-羟化酶缺乏的腺皮质增生时DHEA-S常正常。 脱氢表雄酮的检查过程及注意事项 1、检查过程血浆0.1ml,加重蒸水0.5ml、0.1mol/L NaOH 0.2ml、二氯甲烷5ml,于12ml尖底具磨口塞中振摇5min,静放片刻,弃去上层液,加重蒸水1ml洗二氯甲烷振播1min,2500r/min 离心5min,弃去水层液。二氯甲烷吸出双份,每管1ml放置45~50℃水浴中蒸干,每管加3H-DHA50μl,用压缩空气吹干,每管各加1∶1万抗血清0.2ml,摇匀放置冰箱过夜(4℃16~24h)。次日
围绝经期症状与激素替代治疗 (1)
糖尿病患者用HRT时应密切观察血糖,若血糖升高,应停药,且进行内科治疗。(5)胆石症:雌激素可增加胆管胆固醇分泌,降低鹅脱氧胆酸盐池,改变胆汁中胆酸成分,刺激胆固醇酯化,加快乳糜微粒残留物的清除,并增加胆石形成指数。近来研究还发现雌激素抑制Oddi括约肌动力[7]。应用HRT者胆囊切除术RR为211,随应用时间延长(>10年)RR上升为216,HRT被认为是碎石后胆结石复发的一项独立危险因素。绝经后应用HRT胆石症会增加215倍。在用HRT中,出现右上腹疼痛者,应作超声检查,发现胆石症,酌情减量或停药。在随访中出现胆石增大者应停药。 (6)肝肾功能:性激素在体内主要于肝脏内代谢,均为脂溶性物质,经过肝脏代谢形成水溶性物质,然后自肾脏经尿液排出。有严重肝肾功能障碍者禁用HRT,在用药过程中出现肝肾功能损害者应停药。 2 性激素替代治疗的随访和监测 211 监测及随访的目的 用HRT治疗围绝经期综合征有明显疗效,但有短期副反应及长期毒副反应,甚至发生癌变。在用药过程中个体状况会不断发生变化,整个用药过程中需要对药物的安全性和有效性进行随访监测。其目的:(1)判断治疗目的是否达到;(2)个体风险/受益是否发生改变;(3)评价是否需要继续进行HRT或调整方案。212 随访时间 不论哪种制剂及方案均需进行监护,初剂6~8周复查,以后3~6个月复查。了解疗效、依从性、副反应,进行剂量调整或药物更用或停止用药。 213 监测内容 21311 症状随访 胃肠道症状、睡眠障碍等低雌激素引起症状,了解症状有否改善,也可采用Kuppeman及Greene评分进行比较。 21312 一般检查 测血压及体重。 21313 盆腔检查 妇科检查及阴道超声检查(TVS)。绝经后子宫内膜厚度应<4mm,如超过6mm,宜行分段诊刮术。若每周厚度增加>012mm为增生过度。 21314 乳腺监测 患者自查,医师手法检查乳腺,辅助诊断可使用乳腺红外仪、超声仪、钼靶检查仪检查乳腺。21315 心血管监测 测血脂、心电图、心脏彩超、心功能检测等,也可与心内科医师共同随访、监测。 21316 血液化验 性激素、血脂、血糖、肝肾功能等检验。 参考文献 1 邵敬於.性激素的临床应用.上海:复旦大学出版社,2003.377 2 华嘉增.妇女保健新编.上海:复旦大学出版社,2001.194 3 Hendersor BE,Pike MC,Casagrande J T.Breast Cancer and the es2 trogen window https://www.360docs.net/doc/b618466088.html,ncet,1981,2:3632364 4 Lubin F,Ruder AM.Overweight and changes in weight throughout adult life in breast caner.Etiol Am J Epidemiol,1985,122:5292588 5 Rossouw DE,Anderson G L,Prentice RL,et al.Risks and benefits of estrogen plus progestin in healthy postmenopausal women princi2 pal results from the Women’s Health Intiative randomized control2 lecl trial.JAMA,2002,288:321 6 林守清.雌激素对心血管系统功能的保护作用.中国实用妇科与产科杂志,2002,18(12):719 7 陈晨.雌激素、孕激素与消化道.国外医学妇产科学分册,2002, 29(3):184 (2004-04-20收稿 2004-05-16修回) 作者单位:西安交通大学附属第一医院生殖内分泌研究室(710061) E2mail:denjour@https://www.360docs.net/doc/b618466088.html, 文章编号:1005-2216(2004)08-0456-03 围绝经期症状与激素替代治疗 吕淑兰 曹缵孙 中图分类号:R71 文献标识码:A 围绝经期(perimenopausal period)指近绝经时出现与绝经有关的内分泌、生物学和临床特征起至绝经后1年的期间。 1 围绝经期症状 可分为近期症状和远期症状。近期症状主要以植物神经和血管舒缩功能紊乱为主,伴有泌尿生殖系统萎缩。远期症状主要是骨质疏松、老年痴呆和血脂代谢异常[1]。111 月经紊乱 月经的变化常从绝经过渡期开始,表现为无排卵周期增加,月经紊乱。可有以下3种表现:(1)周期延长,经期缩短,继之月经稀发,经量逐渐减少直至自然绝经。(2)周期紊乱,经期延长,经量增多,有时甚至大出血,有时淋漓不断,多需治疗干预,然后逐渐过渡至绝经。(3)少数妇女40岁以后突然出现闭经,此后月经不再来潮。112 血管舒缩症状 最常见且最特殊的是潮热,其次为多汗、心悸、眩晕、胸闷。潮热和多汗是体温调节障碍,也是绝经期特有的症状。表现为日间的潮热和夜间的出汗。出现潮热时患者突然感到面部、颈部与胸部发热,伴有局部皮肤片状发红,大量出汗,汗后又有畏寒。开始发热集中在躯体上部,而后由上而下扩散至全身。持续时间为30s至5min。症状轻者每日发作数次,重者10数次或更多,严重影响患者工作、睡眠和生活。85%的患者此症状可持续1年以上, 25%~50%的人可持续到绝经后5年,约10%~15%的妇女持续10~15年或更长。 113 精神、神经症状 主要精神症状为激动易怒、忧郁、焦虑、多疑、情绪低落和不能自我控制等。 114 泌尿生殖系统萎缩症状 (1)泌尿系统:绝经后因尿道变短、黏膜变薄、括约肌松弛,表现为尿急、尿频、排尿困难、夜尿或张力性尿失禁等。(2)生殖系统:绝经后生殖器
肾上腺皮质功能减退症诊疗指南
肾上腺皮质功能减退症诊疗指南 肾上腺皮质功能减退分为原发性和继发性两大类。继发性是由于下丘脑分泌CRH或垂体分泌的ACTH不足引起,多表现数种垂体激素缺乏的混合改变。原发性又称阿狄森病,以往结核为本病的最常见原因,约占80%。目前与自身免疫破坏有关的特发性肾上腺萎缩是该病最常见的原因。 【诊断】 一、临床表现 (一)醛固酮缺乏:低钠、高钾血症,直立性低血压等 (二)皮质醇缺乏: 1.食欲减退、恶心、呕吐、体重减轻,明显消瘦,虚弱。 2.乏力、淡漠,疲劳、嗜睡。 3.头昏、眼花、血压降低,心音低钝,心脏缩小。 4.低血糖、低钠血症。 5.皮肤粘膜色素沉着,乳晕、关节伸、屈面,掌纹、手背、腰带部位、瘢痕等皮肤皱折处,易受摩擦处及口腔粘
膜上尤为显著。 6.性功能减退。 7.对感染、外伤等应激的抵抗力减弱。 (三)肾上腺危象:应激状态下易于发生 二、辅助检查 (一)实验室检查 1.血液生化:低血钠、高血钾、低血糖、氮质血症。 2.血常规检查:正细胞型正色素性贫血。 3.激素水平测定:基础血、尿皮质醇水平降低,血醛固酮水平可低于正常。 (二)影像学检查X线摄片心脏缩小,结核引起者肾上腺可有钙化,部分患者垂体增大。 三、诊断要点低血钠、高血钾、低血糖、氮质血症、基础血、尿皮质醇水平降低,血醛固酮水平可低于正常。‘ 【鉴别诊断】 注意与慢性消耗性疾病相鉴别。
【治疗】 一、治疗原则适量糖皮质激素替代或补充治疗,终生治疗。当机体处于应激状态时,应适当增量3~10倍。必要时补充盐皮质激素。 二、治疗方案 (一)替代治疗:氢化可的松早饭后(或晨8点)20mg、下午4点10mg,或强的松早饭后(或晨8点)5m g、下午4点 2.5mg。因地塞米松无潴钠作用,故一般不选用。 (二)若应用糖皮质激素足量、食盐足够(每日至少8~10g)而仍感头晕、乏力、血压偏低,可加用盐皮质激素如上午8时9α-氟氢可的松0.05一0.1mg口服。 三、病因治疗如有活动性结核,应积极抗结核治疗 四、危象治疗 (一)静注氢化可的松; (二)补充水、电解质及葡萄糖; (三)对症治疗。
多囊卵巢综合征患者血清睾酮(T)、雌二醇(E2)、脱氢表雄酮(DHEA)表达
多囊卵巢综合征患者血清睾酮(T)、雌二醇(E2)、脱氢表雄酮(DHEA)表达水平与胰岛素抵抗的相关性研究 发表时间:2017-03-24T14:06:20.637Z 来源:《医师在线》2016年12月下第24期作者:赵丽娟张漫文[导读] 分析多囊卵巢综合征(PCOS)患者血清睾酮(T)、雌二醇(E2)、脱氢表雄酮(DHEA)等性激素水平与胰岛素抵抗(IR)的相关性。(武汉市第八医院妇产科;湖北武汉 430014) 【摘要】目的:分析多囊卵巢综合征(PCOS)患者血清睾酮(T)、雌二醇(E2)、脱氢表雄酮(DHEA)等性激素水平与胰岛素抵抗(IR)的相关性。方法:60例PCOS患者根据IR指数(HOMA-IR)分为PCOS伴IR组(n=30例)和PCOS不伴IR组(n=30例),同期选择门诊体检的50例育龄妇女作为对照组,检测各组血清T、E2、DHEA等性激素水平,并分析PCOS患者血清性激素水平与HOMA-IR的相关性。结果:PCOS组血清T、DHEA等性激素水平及HOMA-IR均明显高于对照组(P<0.05),而E2水平明显低于对照组(P<0.05),PCOS伴IR组血清T、DHEA水平及HOMA-IR明显高于PCOS不伴IR组(P<0.05),而血清E2水平比较无显著性差异(P>0.05);PCOS组患者血清T、DHEA水平与IR呈正相关性关系(P<0.05),血清E2水平与IR呈负相关性关系(P>0.05)。结论:PCOS伴IR患者血清T、DHEA水平明显升高,检测其表达水平有助于临床诊治PCOS伴IR。 【关键词】多囊卵巢综合征;胰岛素抵抗;睾酮;雌二醇、脱氢表雄酮 多囊卵巢综合征(PCOS)是常见于育龄妇女的内分泌疾病,其发病率为5%~10%,已成为不孕症的重要原因之一[1]。相关研究认为[2],胰岛素抵抗(IR)在PCOS发生、发展中起到重要的作用,可能是病情的始动因素和中心环节。因此本研究拟分析PCOS患者血清睾酮(T)、雌二醇(E2)、脱氢表雄酮(DHEA)等性激素水平与IR的相关性。 1 资料与方法 1.1 临床资料 选择本院妇产科2012年2月至2015年10月期间住院治疗的60例PCOS患者作为研究对象,同期选择本院门诊健康体检的50例育龄妇女作为对照组,两组在年龄、BMI方面比较无显著性差异(P>0.05)。 1.2 血清性激素水平检测 采用免疫发光法检测各组患者及体检者血清T、E2、DHEA等性激素水平。 1.4 研究分组 采用IR指数(HOMA-IR)为依据评估PCOS患者及健康体检者的IR状态,HOMA-IR=(FPG×FIns)/22.5。60例PCOS患者根据HOMA-IR 分为PCOS伴IR组(HOMA-IR>1.95)和PCOS不伴IR组(HOMA-IR≤1.95)。比较两组患者及对照组血清性激素水平,并分析PCOS患者血清T、E2、DHEA与HOMA-IR的相关性。 1.5 统计学分析 采用SPSS16.0统计学软件分析,计量资料组间比较采用t检验,采用Spearman法分析相关性,以P<0.05表示差异有统计学意义。 2 结果 2.1 各组血清性激素水平与HOMA-IR比较 PCOS组血清T、DHEA等性激素水平及HOMA-IR均明显高于对照组(P<0.05),而E2水平明显低于对照组(P<0.05),PCOS伴IR组血清T、DHEA水平及HOMA-IR明显高于PCOS不伴IR组(P<0.05),而血清E2水平比较无显著性差异(P>0.05),见表1。 注:与对照组比较,*P<0.05;与PCOS不伴IR组比较,#P<0.05。 2.2 血清性激素水平与HOMA-IR的相关性分析 PCOS组患者血清T、DHEA水平与IR呈正相关性关系(r=0.574,0.457,P<0.05),血清E2水平呈负相关性关系(r=-0.527,P<0.05)。 3 讨论 多数研究认为PCOS起病与基因遗传、生活环境、生活习惯等有一定的相关性[3]。PCOS患者常合并有IR与代偿性高胰岛素血症等糖代谢异常现象,前者主要指体内处于生理水平的胰岛素促进脏器组织和细胞吸收、利用葡萄糖的生理学功能明显下降的异常代谢状态,在PCOS的发病机制中占有相当重要的地位[4]。研究认为[5],PCOS患者伴IR的发病机制涉及胰岛素调节葡萄糖生理代谢的脏器组织,IR可使得功能性雄激素表达水平显著性升高;同时还可明显加重垂体促性腺激素分泌的不协调程度,间接导致雄激素表达水平升高;此外还可有效抑制性激素结合球蛋白的合成过程,使得血清游离性激素表达水平明显升高,进而提高机体对性激素的生物利用度。本研究结果显示,PCOS患者均出现胰岛素抵抗及性激素水平紊乱现象。通过分析性激素水平同胰岛素抵抗之间的相关性,可发现患者E2同HOMA-IR呈负相关,且T、DHEA与HOMA-IR呈正相关,显示性激素水平同胰岛素抵抗之间存在相关性。综上所述,PCOS伴IR患者血清T、DHEA水平明显升高,检测其表达水平有助于临床诊治PCOS伴IR。 参考文献: [1]谢铁男,岳瑛.多囊卵巢综合征胰岛素抵抗研究进展[J].吉林大学学报(医学版),2010,36(2):424-428. [2]金华良,王兴娟.胰岛素、瘦素、雄激素与多囊卵巢综合征发病机制研究进展[J].复旦学报(医学版),2010,37(2):236-240. [3]张艳红,杨伟,冯明.抵抗素与胰岛素抵抗、肥胖及2型糖尿病的关系[J].中国全科医学,2011,13(36):4158-4160. [4]杨鉴冰,孙康.多囊卵巢综合症发病因素及论治探讨[J].陕西中医学院学报,2012,35(3):6-8. [5]池艳,何冰,熊承良.多囊卵巢综合征的遗传学病因研究进展[J].中国计划生育学杂志,2014,22(4):277-281.
159系统精讲内分泌、营养、代谢第三节 甲状腺功能亢进症病人的护理
1.某甲状腺功能减退患者,患病半年,规律服药,近日来出现严重便秘,下列护理措施不妥的是 A.进食粗纤维食物,促进肠蠕动 B.每日适度运动 C.适当按摩腹部 D.每日摄入足够水分 E.严禁使用轻泻剂 【答案】:E 【解析】:考察甲减便秘的护理。必要时根据医嘱给予轻泻剂,并观察大便的次数、性质改变。注意观察有无腹胀、腹痛等麻痹性肠梗阻的表现。 2.患者女性,37岁,T3水平降低,诊断为甲状腺功能减退症,该类患者可能会出现哪项除外的内分泌症状 A.性欲减退 B.女性不育 C.溢乳 D.男性阳痿 E.女性月经过少或闭经 【答案】:E 【解析】:考察甲减的临床表现。内分泌系统表现:有性欲减退,女性常月经过多、经期延长和不育,约1/3病人有溢乳;男性出现阳痿。 3.患者女性,34岁,T3、T4水平降低,诊断为甲状腺功能减退症,该患者的体温可表现为
A.低热 B.高热 C.正常 D.偏低 E.以上都不是 【答案】:D 【解析】:考察甲减的临床表现。一般表现有畏寒、少汗、乏力、少言、体温偏低、动作缓慢、食欲减退而体重无明显减轻。 4.患者男性,45岁,基础代谢率低于正常,诊断为甲状腺功能低下,为进一步区分是原发还是继发,可进一步检查下列哪项指标 A.TT3、TT4测定 B.甲状腺131I测定 C.FT3、FT4测定 D.TSH测定 E.rT3测定 【答案】:D 【解析】:考察甲减的辅助检查。原发性性甲状腺功能减退TSH↑,而继发性甲状腺功能减退TSH↓。其它几项检查鉴别意义不大。 5.原发性甲减是指 A.由于下丘脑或垂体疾病所致 B.由于甲状腺本身疾病所致 C.由于下丘脑疾病所致
治疗更年期综合症首选雌激素替代疗法
治疗更年期综合症首选雌激素替代疗法(作者:___________单位: ___________邮编: ___________) 雌激素减少是导致更年期妇女一系列症状与疾病的基础,目前主要采用雌激素替代疗法治疗。有关雌激素替代疗法早在上世纪50年代国外已作大量研究与临床应用。目前在欧美约有20%~30%的50岁以上妇女接受雌激素替代治疗并取得引人瞩目的效果,但在国内妇女接受雌激素替代治疗的比例较低。不少医生与绝经后妇女对雌激素的补充还有疑虑,主要是担心长期使用雌激素治疗可能增加子宫内膜癌或乳腺癌的发生率。近年来国内外许多资料表明,采用孕激素与雌激素合并应用的方法以对抗雌激素对子宫内膜的增殖作用,已使子宫内膜癌的发生率与不用雌激素时相似。激素替代疗法治疗更年期综合征,如何以价低最小服用方便,一直被广大女性最为关注。国外研制的妇复春,虽疗效佳,安全性好,却因天天服药而被许多女性拒绝。我们应用雌激素、孕激素临床观察取得了良好的效果,但对于更年期妇女,特别是症状严重的患者,激素替代疗法(hormonereplacementtherapy,HRT)依靠是一个重要的选择。对于女性,雌激素的巨大作用是任何激素都不能替代的。本文就HRT的应用进行阐述。
1HRT的患者选择 虽然雌激素对于更年期的治疗是特效药物,但并不是所有的患者均适合使作雌激素,以下患者是不适宜使用雌激素进行治疗的:(1)既往有栓塞病史如脑栓塞、心肌梗塞、肺栓塞等;(2)急、慢性脏器功能不全,肝功能不全会延迟雌激素的代谢,导致雌激素蓄积使危险性增加;雌激素会增加醛固酮的分泌,加重心肾功能不全时的水钠潴留;(3)子宫肌瘤、子宫内膜癌、乳腺癌、乳腺纤维囊肿、卵巢癌等雌激素依赖性肿瘤;(4)家族性高脂血症或严重的高血压、糖尿病、胆囊炎患者。 2HRT患者的心理指导 对处于更年期并接受HRT治疗的患者,除了使患者了解有关更年期的常识、消除其紧张情绪之外,还需要对其进行有关HRT知识的指导,使之对HRT的优缺点有比较全面的了解,消除其对使用雌激素治疗可能存在的危险性、特别是对雌激素致癌的担忧。使患者能够配合医生,进行积极治疗及进行自身监护,及早发现预防药物的副作用,将雌激素的有害影响降到最低。 3HRT使用的药物 3.1雌激素目前对更年期治疗多选用天然雌激素,因为其对肝脏代谢影响小,且具有抗氧化作用,天然雌激素包括雌二醇、雌三醇、孕马雌酮(倍美力)及戊酸雌二醇(补佳乐)等。我国合成的尼尔雌醇维尼安使一种雌三醇的长效制剂。倍美力每天0.625mg或补佳乐每天1mg 是HRT的生理补充量。而维尼安每半月服用2mg左右但单独使用雌激
