有机化学官能团
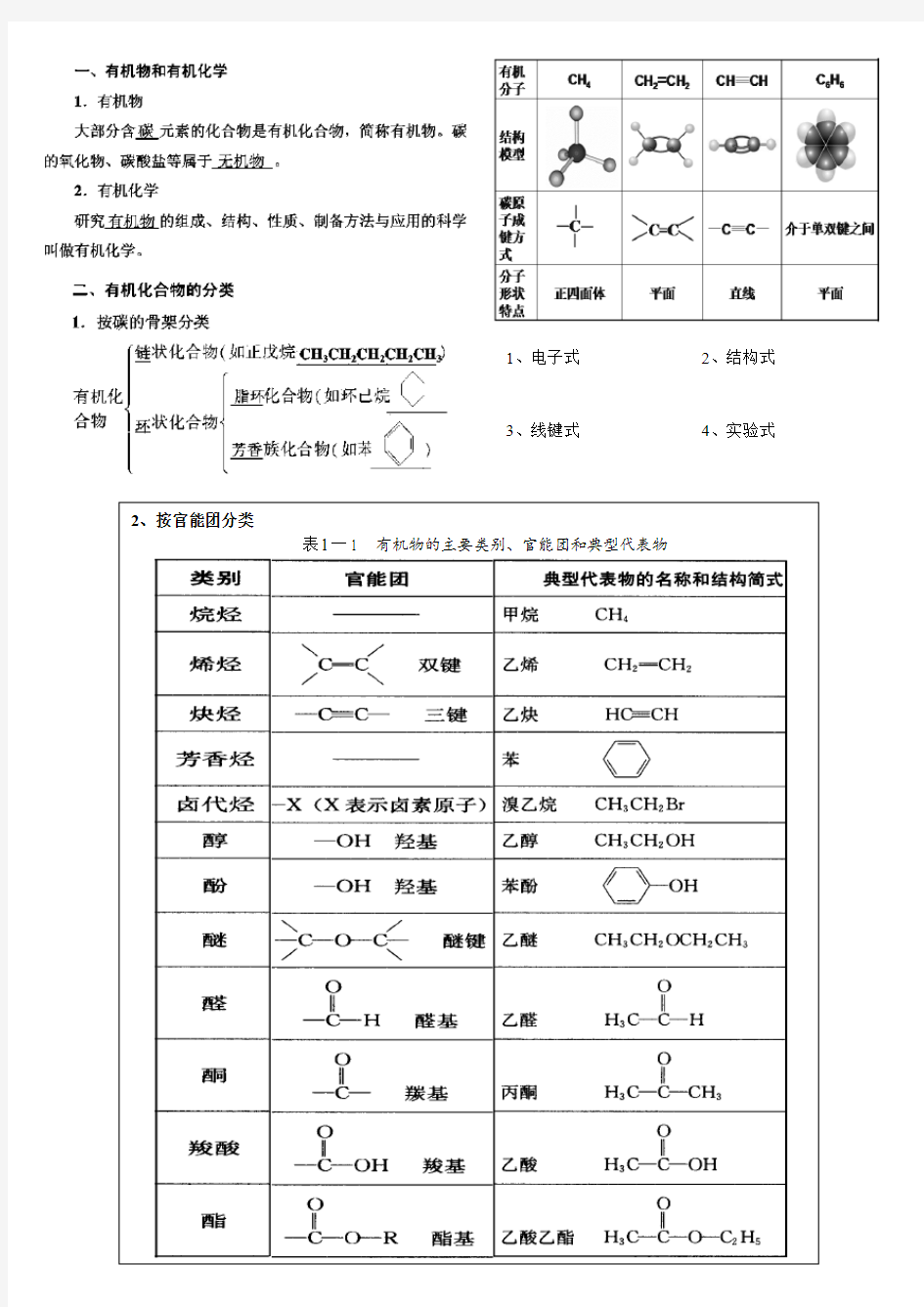

2、按官能团分类
表
l一1有机物的主要类别、官能团和典型代表物
1、电子式
2、结构式
3、线键式
4、实验式
同分异构体:(碳链异构、官能团异构)
注意:同分异构体不仅存在于有机化合物中,也存在于无机化合物中。甚至有机化合物与无机化合物之间也存在同分异构体,如无机物氰酸铵[NH 4CNO]和有机物尿素[CO(NH 2)2]。
同系物:结构相似,分子组成上相差一个或若干个CH 2原子团的物质,互称为同系物。如甲烷和乙烷。
有机物命名:
烷烃可以根据分子里所含碳原子数目来命名。碳原子数在十以内的用甲、乙、丙、丁、戊、己、庚、辛、壬、癸来表示。例如,CH 4叫甲烷,C 5H 12叫戊烷。碳原子数在十以上的用数字来表示。例如,C 17H 36叫十七烷。前面提到的戊烷的三种异构体,可用“正”“异”“新”来区别,这种命名方法叫习惯命名法。由于烷烃分子中碳原子数目越多,结构越复杂,同分异构体的数目也越多,习惯命名法在实际应用上有很大的局限性。因此,在有机化学中广泛采用系统命名法。下面以带支链的烷烃为例,初步介绍系统命名法的命名步骤。 (1)选定分子中最长的碳链为主链,按主链中碳原子数目称作“某烷”。
(2)选主链中离支链最近的一端为起点,用l ,2,3等阿拉伯数字依次给主链上的各个碳原子编号定位,以确定支链在主链中的位置。例如:
(3)将支链的名称写在主链名称的前面,在支链的前面用阿拉伯数字注明它在主链上所处的位置,并在数字与名称之间用一短线隔开。例如,用系统命名法对异戊烷命名:
2—甲基丁烷
(4)如果主链上有相同的支链,可以将支链合并起来,用“二”“三”等数字表示支链的个数。两个表示支链位置的阿拉伯数字之间需用“,”隔开。
① 同分异构现象:化合物具有相同分子式,不同结构式的现象,叫做同分异构现象。 ② 同分异构体:具有同分异构现象的化合物之间,互称为同分异构体。
同分异构体之间异同:
分子组成相同、分子量相同、分子式相同
有机化学官能团
精品 2、按官能团分类 表l 一1 有机物的主要类别、官能团和典型代表物 1、电子式 2、结构式 3、线键式 4、实验式
同分异构体:(碳链异构、官能团异构) ①同分异构现象:化合物具有相同分子式,不同结构式的现象,叫做同分异构现象。 ②同分异构体:具有同分异构现象的化合物之间,互称为同分异构体。 同分异构体之间异同: 分子组成相同、分子量相同、分子式相 同 注意:同分异构体不仅存在于有机化合物中,也存在于无机化合物中。甚至有机化合物与无机化合物之间也存在同分异构体,如无机物氰酸铵[NH4CNO]和有机物尿素[CO(NH2)2]。 同系物:结构相似,分子组成上相差一个或若干个CH2原子团的物质,互称为同系物。如甲烷和乙烷。 有机物命名: 烷烃可以根据分子里所含碳原子数目来命名。碳原子数在十以内的用甲、乙、丙、丁、戊、己、庚、辛、壬、癸来表示。例如,CH4叫甲烷,C5H12叫戊烷。碳原子数在十以上的用数字来表示。例如,C17H36叫十七烷。前面提到的戊烷的三种异构体,可用“正”“异”“新”来区别,这种命名方法叫习惯命名法。由于烷烃分子中碳原子数目越多,结构越复杂,同分异构体的数目也越多,习惯命名法在实际应用上有很大的局限性。因此,在有机化学中广泛采用系统命名法。下面以带支链的烷烃为例,初步介绍系统命名法的命名步骤。 (1)选定分子中最长的碳链为主链,按主链中碳原子数目称作“某烷”。 (2)选主链中离支链最近的一端为起点,用l,2,3等阿拉伯数字依次给主链上的各个碳原子编号定位,以确定支链在主链中的位置。例如: (3)将支链的名称写在主链名称的前面,在支链的前面用阿拉伯数字注明它在主链上所处的位置,并在数字与名称之间用一短线隔开。例如,用系统命名法对异戊烷命名: 2—甲基丁烷 (4)如果主链上有相同的支链,可以将支链合并起来,用“二”“三”等数字表示支链的个数。两个表示支链位置的阿拉伯数字之间需用“,”隔开。 如有侵权请联系告知删除,感谢你们的配合! 精品
高中有机化学中各种官能团的性质
高中有机化学中各种官能团的性质 1。卤化烃:官能团,卤原子在碱的溶液中发生“水解反应”,生成醇在碱的醇溶液中发生“消去反应”,得到不饱和烃 2。醇:官能团,醇羟基能与钠反应,产生氢气能发生消去得到不饱和烃(与羟基相连的碳直接相连的碳原子上如果没有氢原子,不能发生消去)能与羧酸发生酯化反应能被催化氧化成醛(伯醇氧化成醛,仲醇氧化成酮,叔醇不能被催化氧化) 3。醛:官能团,醛基能与银氨溶液发生银镜反应能与新制的氢氧化铜溶液反应生成红色沉淀能被氧化成羧酸能被加氢还原成醇 4。酚,官能团,酚羟基具有酸性能钠反应得到氢气酚羟基使苯环性质更活泼,苯环上易发生取代,酚羟基在苯环上是邻对位定位基能与羧酸发生酯化 5。羧酸,官能团,羧基具有酸性(一般酸性强于碳酸)能与钠反应得到氢气不能被还原成醛(注意是“不能”)能与醇发生酯化反应 6。酯,官能团,酯基能发生水解得到酸和醇 醇、酚:羟基(-OH);伯醇羟基可以消去生成碳碳双键,酚羟基可以和NaOH反应生成水,与Na2CO3反应生成NaHCO3,二者都可以和金属钠反应生成氢气 醛:醛基(-CHO);可以发生银镜反应,可以和斐林试剂反应氧化成羧基。与氢气加成生成羟基。 酮:羰基(>C=O);可以与氢气加成生成羟基 羧酸:羧基(-COOH);酸性,与NaOH反应生成水,与NaHCO3、Na2CO3反应生成二氧化碳 硝基化合物:硝基(-NO2); 胺:氨基(-NH2). 弱碱性 烯烃:双键(>C=C<)加成反应。 炔烃:三键(-C≡C-)加成反应 醚:醚键(-O-)可以由醇羟基脱水形成 磺酸:磺基(-SO3H)酸性,可由浓硫酸取代生成 腈:氰基(-CN) 酯: 酯 (-COO-) 水解生成羧基与羟基,醇、酚与羧酸反应生成 注: 苯环不是官能团,但在芳香烃中,苯基(C6H5-)具有官能团的性质。苯基是过去的提法,现在都不认为苯基是官能团
(完整版)高中有机化学常见官能团
烷烃——无官能团: 1.一般C4及以下是气态,C5以上为液态。 2.化学性质稳定,不能使酸性高锰酸钾溶液,溴水等褪色。 3.可以和卤素(氯气和溴)发生取代反应,生成卤代烃和相应的卤化氢,条件光照。 4.烷烃在高温下可以发生裂解,例如甲烷在高温下裂解为碳和氢气。烯烃——官能团:碳碳双键 1.性质活泼,可使酸性高锰酸钾溶液褪色。 2.可使溴水或溴的四氯化碳溶液褪色,发生加成反应,生成邻二溴代烷,例如乙烯和溴加成生成1,2-二溴乙烷。 3.酸催化下和水加成生成醇,如乙烯在浓硫酸催化下和水加成生成乙醇。 4.烯烃加成符合马氏规则,即氢一般加在氢多的那个C上。 5.乙烯在银或铜等催化下可以被空气氧化为环氧乙烷。 6.烯烃可以在镍等催化剂存在下和氢气加成生成烷烃 7.烯烃可以发生加聚反应生成高聚物,如聚乙烯,聚丙烯,聚苯乙烯等。 实验室制乙烯通过乙醇在浓硫酸作用下脱水生成,条件170℃。 炔烃——官能团:碳碳三键 1.性质与烯烃相似,主要发生加成反应。也可让高锰酸钾,溴水等褪色。 2.炔烃加水生成的产物为烯醇,烯醇不稳定,会重排成醛或酮。如乙
炔加水生成乙烯醇,乙烯醇不稳定会重拍生成乙醛。 3.乙炔和氯化氢加成的产物为氯乙烯,加聚反应后得到聚氯乙烯。 4.炔烃加成同样符合马氏规则 5.实验室制乙炔主要通过电石水解制的(用饱和食盐水)。 芳香烃——含有苯环的烃。 1.苯的性质很稳定,类似烷烃,不与酸性高锰酸钾,溴的四氯化碳反应,与溴水发生萃取(物理变化)。 2.苯可以发生一系列取代反应,主要有: 和氯,溴等卤素取代,生成氯苯或溴苯和相应的卤化氢(条件:液溴,铁或三溴化铁催化,不可用溴水。) 和浓硝酸,浓硫酸的混合物发生硝化反应,生成硝基苯和水。条件加热。 和浓硫酸反应生成苯磺酸,条件加热。 3.苯可以加氢生成环己烷。 4.苯的同系物的性质不同,取代基性质活泼,只要和苯环直接相连的碳上有氢,就可以被酸性高锰酸钾溶液氧化为苯甲酸。如甲苯可以使酸性高锰酸钾溶液褪色,被氧化为苯甲酸。无论取代基有多长,氧化产物都为苯甲酸。 5.苯分子中所有原子都在同一平面上。 6.苯环中不存在碳碳双键,六个碳原子之间的键完全相同,是一种特殊的大π键。
官能团的性质及有机化学知识总结大全
有机物官能团与性质 [知识归纳] —R —OH 其中: 1、能使KMnO4褪色的有机物: 烯烃、炔烃、苯的同系物、醇、酚、醛、葡萄糖、麦芽糖、油脂 2、能使Br2水褪色的有机物:烯烃、炔烃、酚、醛、葡萄糖、麦芽糖、油脂 3、能与Na反应产生H2的有机物:醇、酚、羧酸、氨基酸、葡萄糖 4、具有酸性(能与NaOH、Na2CO3反应)的有机物:酚、羧酸、氨基酸 5、能发生银镜反应或与新制Cu(OH)2反应的有机物: 醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖 6、既有氧化性,又有还原性的有机物:醛、烯烃、炔烃 7、能发生颜色(显色)反应的有机物:
[有机合成的常规方法] 1.引入官能团: ①引入-X 的方法:烯、炔的加成,烷、苯及其同系物的取代 ②引入-OH 的方法:烯加水,醛、酮加氢,醛的氧化、酯的水解、卤代烃的水解、糖分解为乙醇和CO 2 ③引入C=C 的方法:醇、卤代烃的消去,炔的不完全加成,*醇氧化引入C=O 2.消除官能团 ①消除双键方法:加成反应 ②消除羟基方法:消去、氧化、酯化 ③消除醛基方法:还原和氧化 3.有机反应类型 常见的有机反应类型有取代(包括酯化、水解)、加成、加聚、消去、氧化、还原等。能够发生各种反应类型的常见物质如下: ①烷烃、芳香烃与X 2的反应 (1)取代反应 ②羧酸与醇的酯化反应 ③酯的水解反应 ①不饱和烃与H 2、X 2、HX (2)加成反应 的反应 ②醛与H 2的反应 (3)加聚反应:烯烃、炔烃在一定条件下的聚合反应。 C H COOH O O O O C H 2CH 2Br Br C H 2CH O O C OCH 2CH 2O C []n CHO
常见的有机化学基团名称翻译
有机化学基团名称翻译 A 伸乙烷合萘基;伸二氢苊基 acenaphtheneylene 亚乙烷合萘基;亚二氢苊 基 acenaphthenylidene 醋酰胺基;乙酰胺基 acetamido; acetamino 乙炔基 acetenyl;ethynyl 乙酰乙酰基 acetoacetyl 丙酮基 acetonyl 亚丙酮基 acetonylidene 乙酰氧基 acetoxy 乙酰基 acetyl 乙酰亚胺基 acetylimino 酸硝基 aci-nitro 吖啶基 acridinyl 丙烯酰基 acrylyl; acryloyl 己二酰基 adipoyl; adipyl 脲[基]羰基;脲甲酰基 allophanyl; allophanoyl 烯丙基 allyl 甲脒基 amidino; guanyl 酰胺基 amido 酰胺草酰基;草酰胺酰基 amidoxalyl; oxamoyl 胺基 amino 戊基 amyl; pentyl 伸戊基 amylene 亚戊基 amylidene 亚戊基 amylidene; pentylidene 苯胺基 anilino 大茴香亚甲基;对甲氧苯亚甲基;对甲氧亚苄 基 anisal; anisylidene 甲氧苯胺基 anisidino 大茴香酰基;对甲氧苯甲酰基;对甲氧苄酰 基 anisoyl 大茴香亚甲基;对甲氧亚苄基;对甲氧苯亚甲 基 anisylidene; p-methoxybenzylidene; anisal 邻胺苯甲酰基;邻胺苄酰基 anthraniloyl; anthranoyl 蒽基 anthranyl; anthryl 蒽醌基 anthraquinonyl 伸蒽基;次蒽基 anthrylene 精胺酰基 arginyl 亚胂酸基 arsinico 胂基 arsino 胂酸基 arsono 亚胂基 arsylene 细辛基;2,4,5-三甲氧苯基 asaryl; 2,4,5-trimethoxyphenyl 天[门]冬酰胺酰基 asparaginyl; asparagyl 天[门]冬胺酰基 aspartyl 阿托酰基;颠茄酰基;2-苯丙烯酰基 atropoyl 壬二酰基 azelaxyl 迭氮基;三氮基 azido; triazo 偶氮亚胺基 azimino; azimido 次偶氮基 azino 偶氮基 azo 氧偶氮基 azoxy B 苯亚甲基;亚苄基 benzal 苯甲酰胺基;苄酰胺基 benzamido 苯亚磺酰基 benzene sulfinyl; phenylsulfinyl 苯磺酰胺基 benzenesulfonamido 苯磺酰基 benzenesulfonyl 次苄基 benzenyl; benzylidyne 二苯甲基 benzhydryl; diphenylmethyl 二苯亚甲基 benzhydrylidene; diphenylmethylene 联苯胺基 benzidino 亚苄基;苯亚甲基 benzilidene 二苯羟乙酰基 benziloyl 苯并咪唑基 benzimidazolyl
有机化学之官能团性质总结
类别通式官能团代表物分子结构结点主要化学性质 卤代烃一卤代烃: R—X 多元饱和卤代烃: C n H2n+2-m X m 卤原子 —X C2H5Br (Mr:109) 卤素原子直接与烃基 结合 β-碳上要有氢原子才 能发生消去反应 1.与NaOH水溶液共热发生取代(水 解)反应生成醇 2.与NaOH醇溶液共热发生消去反应 生成烯 3.在碱性条件下,水解更彻底,若卤 原子与苯环相连,则难水解 醇一元醇: R—OH 饱和多元醇: C n H2n+2O m 醇羟基 —OH CH3OH (Mr:32) C2H5OH (Mr:46) 羟基直接与链烃基结 合,O—H及C—O 均有极性。 β-碳上有氢原子才能 发生消去反应。 α-碳上有氢原子才能 被催化氧化,伯醇氧 化为醛,仲醇氧化为 酮,叔醇不能被催化 氧化。 1.跟活泼金属反应产生H2 2.跟卤化氢或浓氢卤酸发生取代反应 生成卤代烃 3.脱水反应:存在浓H2SO4 140℃分子间脱水成醚 170℃分子内脱水生成烯 4.催化氧化为醛或酮 5.去掉氢,发生酯化反应 6.能被重铬酸钾酸性溶液氧化,由橙 红色变为绿色 醚R—O—R′醚键C2H5O C2H5 (Mr:74) C—O键有极性 性质稳定,一般不与酸、碱、氧化剂 反应 酚C n H n O 酚羟基 —OH (Mr:94)C6H5OH —OH直接与苯环上 的碳相连,受苯环影 响能微弱电离。 1.弱酸性,比碳酸还弱 2.与浓溴水发生取代反应生成白色沉 淀,在浓H2SO4存在下,可与硝酸 生成三硝基苯酚 3.遇FeCl3呈紫色 4.易被氧化 醛C n H2n O 醛基 HCHO (Mr:30) (Mr:44)CH3CHO HCHO相当于两个 —CHO 有极性、能加成 1.与H2、HCN等加成为醇 2.被氧化剂(O2、多伦试剂、斐林试剂、 酸性高锰酸钾溴水等)氧化为羧酸 3.能发生银镜反应,能与新制的氢 氧化铜悬浊液反应 酮CnH2n O 羰基(Mr:58) CH3COCH3 有极性、能加成 与H2、HCN加成为醇 不能被氧化剂氧化为羧酸 羧酸C n H2n O2羧基(Mr:60)CH3COOH (醋酸乙酸) 受羰基影响,O—H能 电离出H+,受羟基影 响不能被加成。 1.具有酸的通性 2.酯化反应时脱去羟基,不能被H2 加成 3.能与含—NH2物质缩去水生成酰胺 (肽键) 4.醋酸能使苯酚钠变浑浊 5.甲酸既有酸的性质,又有醛的性质 酯C n H2n O2酯基HCOOCH3 (Mr:60) 酯基中的碳氧单键易 断裂 1.发生水解反应生成羧酸和醇 2.也可发生醇解反应生成新酯和新醇 硝酸酯RONO2硝酸酯基 —ONO2 不稳定易爆炸 硝基化合 物R—NO2硝基—NO2一硝基化合物较稳定 一般不易被氧化剂氧化,但多硝基化 合物易爆炸 氨基酸RCH(NH)COOH 氨基—NH2 羧基 H2NCH2COOH —NH2能以配位键结 合H+;—COOH能部 两性化合物
常见有机化合物官能团
常见有机化合物官能团 1. 苯基 苯(benzene, C6H6)有机化合物,是组成结构最简单的芳 香烃,在常温下为一种无色、有甜味的透明液体,并具有强烈的芳香气味。可燃,有毒,为IARC 第一类致癌物。苯具有的环系叫苯环,是最简单的芳环。苯分子去掉一个氢以后的结构叫苯基,用Ph 表示。因此苯也可表示为PhH 2. 羟基羟基,又称氢氧基。是由一个氧原子和一个氢原子相连组成的一价原子团,化学式-OH。 在无机物中在无机物中,通常含有羟基的为含氧酸或其的酸式盐。含羟基的物质溶解于水会电离出氢离子,因此含羟基的物质水溶液多成偏酸性。 在有机物中在有机化学的系统命名中,在简单烃基后跟着羟基的称作醇,而糖类多为多羟基醛或酮。 羟基直接连在苯环上的称作酚。 具体命名见OH 原子团的命名注:乙醇为非电解质,不显酸 性。 羟基的性质 1. 还原性,可被氧化成醛或酮或羧酸
2. 弱酸性,醇羟基与钠反应生成醇钠,酚羟基与氢氧化钠反应生成酚钠 3. 可发生消去反应,如乙醇脱水生成乙烯 OH 原子团的命名此原子团在有机化合物中称为羟基,是醇( ROH )、酚(ArOH )等分子中的官能团;在无机化合物水溶液中以带负电荷的离子形式存在(OH-1 ),称为氢氧根。当羟基与苯环相连形成苯酚时,可使苯环致活,显弱酸性。再进基主要进入其邻位、对位。 羟基与氢氧根的区别在很多情况下,由于在示性式中,羟基和氢氧根的写法相同,因此羟基很容易和氢氧根混淆。 虽然氢氧根和羟基均为原子团,但羟基为官能团,而氢氧根为离子。而且含氢氧根的物质在水溶液中呈碱性,而含羟基的物质的水溶液则多呈偏酸性。氢氧根和羟基在有机化学上的共性是亲核性。 有机合成中羟基的保护羟基是有机化学中最常见的官能团之一,无论是醇羟基还是酚羟基均容易被多种氧化剂所氧化。因此在多官能团化合物 的合成过程中,羟基或者部分羟基需要先被保护,阻止它参与反应,在适当的步骤中再被转化。 3. 烃基
完整word版高中有机化学常见官能团
无官能团:烷烃—— C4以上为液态。及以下是气态,C51.一般 2.化学性质稳定,不能使酸性高锰酸钾溶液,溴水等褪色。可以和卤素(氯气和溴)发生取代反应,生成卤代烃和相应的卤化3. 氢,条件光照。4.烷烃在高温下可以发生裂解,例如甲烷在高温下裂解为碳和氢气。 烯烃——官能团:碳碳双键 1.性质活泼,可使酸性高锰酸钾溶液褪色。 2.可使溴水或溴的四氯化碳溶液褪色,发生加成反应,生成邻二溴代烷,例如乙烯和溴加成生成1,2-二溴乙烷。 3.酸催化下和水加成生成醇,如乙烯在浓硫酸催化下和水加成生成乙醇。 4.烯烃加成符合马氏规则,即氢一般加在氢多的那个C上。 5.乙烯在银或铜等催化下可以被空气氧化为环氧乙烷。 6.烯烃可以在镍等催化剂存在下和氢气加成生成烷烃 7.烯烃可以发生加聚反应生成高聚物,如聚乙烯,聚丙烯,聚苯乙烯等。 实验室制乙烯通过乙醇在浓硫酸作用下脱水生成,条件170℃。 炔烃——官能团:碳碳三键 1.性质与烯烃相似,主要发生加成反应。也可让高锰酸钾,溴水等褪色。 炔烃加水生成的产物为烯醇,烯醇不稳定,会重排成醛或酮。如乙
炔加水生成乙烯醇,乙烯醇不稳定会重拍生成乙醛。 3.乙炔和氯化氢加成的产物为氯乙烯,加聚反应后得到聚氯乙烯。 4.炔烃加成同样符合马氏规则 5.实验室制乙炔主要通过电石水解制的(用饱和食盐水)。 芳香烃——含有苯环的烃。 1.苯的性质很稳定,类似烷烃,不与酸性高锰酸钾,溴的四氯化碳反应,与溴水发生萃取(物理变化)。 2.苯可以发生一系列取代反应,主要有: 和氯,溴等卤素取代,生成氯苯或溴苯和相应的卤化氢(条件:液溴,铁或三溴化铁催化,不可用溴水。) 和浓硝酸,浓硫酸的混合物发生硝化反应,生成硝基苯和水。条件加热。 和浓硫酸反应生成苯磺酸,条件加热。 3.苯可以加氢生成环己烷。 4.苯的同系物的性质不同,取代基性质活泼,只要和苯环直接相连的碳上有氢,就可以被酸性高锰酸钾溶液氧化为苯甲酸。如甲苯可以使酸性高锰酸钾溶液褪色,被氧化为苯甲酸。无论取代基有多长,氧化产物都为苯甲酸。 5.苯分子中所有原子都在同一平面上。 6.苯环中不存在碳碳双键,六个碳原子之间的键完全相同,是一种特
高中有机化学中的官能团及其鉴别_2
高中有机化学中常见官能团 对于有机化学来说,最重要的莫过于官能团,官能团是决定有机物的化学性质的原子或原子团,有机物因为有不同的官能团,性质会发生改变,因此对于官能团的了解成了一大难点。 一、什么是有机物 在了解官能团之前,我们必须要先判断什么才算的上是有机物,是只要含有碳的化合物都是有机物吗?非也,有机物是指含碳的化合物,但除CO2,CO,H2CO3,硫酸盐,金属碳化物(CaC2)等。 比如天然气的主要成分甲烷是最简单的烷烃,甲醇是最简单的醇,乙烯是最简单的烯烃。它们都是有机化合物。而对于结构简式为HO—CO—OH则不是有机物,因为这是碳酸的结构简式。 二、高中有机化学中有哪些常见官能团及其化学性质 在高中有机化学的学习中我们遇到过许多的官能团,现在将其归类: 1。卤化烃:官能团,卤原子(CI等) 在碱的溶液中发生“水解反应”,生成醇 在碱的醇溶液中发生“消去反应”,得到不饱和烃 2。醇:官能团,醇羟基(-OH) 能与钠反应,产生氢气 能发生消去得到不饱和烃(与羟基相连的碳直接相连的碳原子上如果没有氢原子,不能发生消去) 能与羧酸发生酯化反应 能被催化氧化成醛(伯醇氧化成醛,仲醇氧化成酮,叔醇不能被催化氧化) 3。醛:官能团,醛基(—CHO) 能与银氨溶液发生银镜反应 能与新制的氢氧化铜溶液反应生成红色沉淀 能被氧化成羧酸 能被加氢还原成醇 4。酚,官能团,酚羟基(—OH) 具有酸性 能钠反应得到氢气 酚羟基使苯环性质更活泼,苯环上易发生取代,酚羟基在苯环上是邻对位定位基 能与羧酸发生酯化 5。羧酸,官能团,羧基(—COOH) 具有酸性(一般酸性强于碳酸)
能与钠反应得到氢气 不能被还原成醛 能与醇发生酯化反应 6。酯,官能团,酯基(—COOR) 能发生水解得到酸和醇 三、实验室鉴别官能团的方法①如何鉴别羟基和羧基 装置:试管,Na 2CO 3 药品,胶头滴管,装有乙醇和乙酸的试剂瓶 过程:a.用胶头滴管吸取同等份量的乙醇和乙酸,分别滴入两支试管; b.将Na 2CO 3 分别滴入装有乙醇和乙酸的试管,观察现象 现象:装有乙酸的试管开始冒出气泡,装有乙醇的试管无现象 结论:乙酸中的羧基具有酸性能和碱性氧化物反应,乙醇中的羟基不具有酸性 方程式:Na2CO3+2CH3COOH=2CH3COONa+CO2↑ ②如何鉴别甲酸和乙酸 装置:试管,胶头滴管 过程:a. 制备银氨溶液:在洁净的试管里加入1mL2%的硝酸银溶液,然后一边摇动试管,一边逐滴滴入2%的稀氨水,只最初产生的沉淀恰好溶解为止 b.分别向盛有银氨溶液的两个试管中加入等分量的甲酸和乙酸 现象:有甲酸的试管内壁上附着一层光亮如镜的金属银 结论:甲酸既具有羧基的结构,又有醛基的结构,因此表现出与它的同系物不同的一些特性。因为具有醛基,故有还原性,能发生银镜反应 方程式:HCOOH + 2Ag(NH3)2OH -→(NH4)2CO3 + 2Ag↓ +2NH3 +H2O ③如何鉴别醛基 (两种方案) <1>装置:试管 过程:a. 制备银氨溶液:在洁净的试管里加入1mL2%的硝酸银溶液,然后一边摇动试管,一边逐滴滴入2%的稀氨水,只最初产生的沉淀恰好溶解为止 b. 滴入3滴乙醛,振荡后把试管放在热水中温热。 现象:试管内壁上附着一层光亮如镜的金属银 结论:硝酸银与氨水生成的银氨溶液中含有氢氧化二氨合银,这是一种弱氧化剂,它能把乙醛氧化成乙酸,乙酸又与氨反应生成乙酸氨,而银离子被还原成金属银。还原生成的银附着在试管壁上,形成银镜。 方程式:CH3CHO+2Ag(NH3)2+ 2OH-→CH3COONH4+2Ag↓+3NH3+H2O <2>装置:试管 过程:a.制备新制氢氧化铜溶液:取一定量的氢氧化钠溶液,滴入几滴硫酸铜溶液,得到蓝色的悬浊液
有机化学官能团性质整理
苏教版高二有机化学官能团性质整理 分类:烷、烯、炔、苯、卤化烃、醇、酚、醚、醛、酮、羧酸、酯、氨基酸 由结构(官能团)推测性质: 能发生取代反应的有:-C n H2n-i、苯环、-X、-O H-C O O H-C00-(酯基)其中:能酯化的有:-OH -COOH 能水解的有:-X、-COO-(酯基) 苯环上的取代:①苯及其同系物:与液溴反应,FeBr a作催化剂②酚类:与浓溴水反应 能发生加成反应的有:苯环、C=C gC -CHO羰基(后三个主要是与H加成)其中:能加聚的有: C=C、AC、(-CHO羰基) 能发生消去反应的有:-X (B -C上有H)、-OH (B -C上有H) 能发生氧化反应的有:醇-OH(a -C上有H)、酚-OH -CHO C=C AC、R-GH (R为烃基;直 接与苯环相连的C上有H)燃烧除外(大部分有机物都能燃烧,均为氧化反应) 能与酸性高锰酸钾反应(使其褪色)的有:同上 能发生还原反应的有:苯环、C=C A C -CHO羰基(以上均为上氢还原,属加成反应)能与H反应的有:同上能与溴水反应的有:C=C C酚类(苯环上-OH的邻、对位上至少有一个位置有H)、-CHO 能与Na反应的有:醇-OH 酚-OH -COOH 能与NaO阪应的有:酚-OH -COOH 能与NaCO反应的有:酚-OH -COOH 能与NaHC3反应的有:-COOH 体现酸性的有:酚-OH (不能使指示剂变色)、-COOH(可使指示剂变色) 体现碱性的有:-NH 能与FeCl a反应的有:酚-OH 附下表
苏教版高二有机化学官能团性质整理注:此表中的氧化反应不包含燃烧反应
高中化学常见官能团地性质总结材料
标准文档 实用文案常见官能团的性质 一. 中学有机化合物分类及常见官能团名称和主要性质
标准文档 实用文案 注:烷烃中的烷基,芳香烃中的苯基都不是官能团。 二. 有机官能团的化学性质与有机基本反应 1. 氧化反应 (1)燃烧。凡是含碳氢的有机化合物燃烧都生成二氧化碳和水。 烃的燃烧通式: 烃的含氧衍生物的燃烧通式: (2)被酸性高锰酸钾氧化。能使酸性高锰酸钾褪色的有机物有: ①不饱和烃、不饱和烃的衍生物(含碳碳双键、碳碳三键); ②苯的同系物(苯基上的烃基易被氧化); ③含醛基的有机物:醛、甲酸、甲酸酯、甲酸盐、葡萄糖; ④石油产品(裂解气、裂化气)。 (3)羟基的催化氧化。某些含羟基的有机物在催化剂的作用下,能被氧气氧化成醛或酮。 当与羟基相连的碳原子上有两个氢原子时,羟基能被氧化成醛基。如: 22232232CHCHOHOCuCHCHOHO 当与羟基相连的碳原子上有一个氢原子时,羟基能被氧化成羰基(碳氧双键)。如:
标准文档 实用文案当与羟基相连的碳原子上没有氢原子时,羟基不能被氧化。 (4)醛基的氧化。有机物中的醛基,不仅可以被氧气氧化成羧基;而且还能被两种弱氧化剂(银氨离子和铜离子)氧化成羧基。 醛基被氧气氧化。如: 22323CHCHOOCHCOOH?????催化剂? ??AgNH32氧化。如: 银镜反应,醛基被?? ??CHCHOAgNHOHCHCOONHAgNHHO33234322223??????????????()△ 醛基被Cu OH()2氧化。如: CHCHOCuOHCHCOOHCuOHO3232222???????()? 2. 取代反应。 有机物分子中的某些原子或原子团被其他原子或原子团所代替的反应叫做取代反应。中学常见的取代反应有: (1)烷烃与卤素单质在光照下的取代。如: CHClCHClHCl423?????光 (2)苯与苯的同系物与卤素单质、浓硝酸等的取代。如: (3)酚与浓溴水的取代。如: (4)酯化反应。酸和醇在浓硫酸作用下生成酯和水的反应,其实质是羧基与羟基生成酯基和水的反应。如: CHCH OH CHCOOH323?CH COOCH CHHO3232? (5)水解反应。水分子中的?OH或?H取代有机化合物中的原子或原子团的反应叫水解反应。
有机化学官能团高效记忆(表格)
高中常见有机化合物结构与性质总结 物质类别特征结构(官能团)断键位置反应类型试剂条件反应产物烷烃取代X2,光照 烯烃 加成 X2的CCl4溶液 HX H2O,催化剂 加成,还原H2,催化剂 加聚一定条件 ——氧化酸性KMnO4溶液酸性KMnO4溶液褪色 炔烃或 加成 X2的CCl4溶液或 HX,催化剂,加热或加成,还原H2,催化剂或 ——氧化酸性KMnO4溶液酸性KMnO4溶液褪色 芳香烃 取代 X2,FeX3 HNO3,浓H2SO4,加热 加成3H2H2,Ni,加热 取代 HNO3,浓H2SO4,加热 氧化酸性KMnO4溶液 C C H H C C C C X X C C X H C C OH H C C C H H X NO2 R R NO2 NO2 O2N R H H H C H COOH C H H C H H C H X C H X C X X C X X C C H H C C H X C C X X C C C C C C C C H C X C C ]n [ C
物质类别 特征结构(官能团) 断键位置 反应类型 试剂条件 反应产物 卤代烃 —X 取代 NaOH 水溶液(催),加热 消去 NaOH 乙醇溶液(催), 加热 醇 —OH 取代、置换 Na 取代、酯化 羧酸—COOH ,浓H 2SO 4,加热 氧化 O 2,Cu ,加热 取代 浓HX 溶液,加热 消去 浓H 2SO 4,加热 —CH 2—OH —— 氧化 酸性KMnO 4溶液(或酸性K 2Cr 2O 7溶液) —COOH 酚 取代 溴水 取代、置换 Na 中和 NaOH 溶液 —— 氧化 空气 —— 醛 氧化 O 2,催化剂,加热 (或银氨溶液, 或新制 Cu(OH)2 浊液) 羧 加成、还原 H 2,催化剂,加热 羧酸 取代、置换 Na 中和 NaOH 溶液 取代、酯化 醇,浓H 2SO 4,加热 酯 取代、水解 稀H 2SO 4,加热 (或NaOH 溶液,加热) O H ONa OH OH H H H OH Br Br Br O C H ONa C O O C C C C X C O C H H H C O OH C C OH C H O C O H ONa C O OH C O O C R O OH C O H C OH H H C O H C O OH C O C O H C C X C OH C C C X H O C R O HO R OH C O O C R O
药物化学常见官能团
人0 Xfi 甲 It 草 幺子弍:cooph 胪J2分矣:WSffl *0u 乙氢甲It 耳 分子式:COOK 年屋分类:wsm 0-CH ) *宙:甲丘甲離華 分子式:COOMa 舗產分空:進荃GO COOH 命屋分类: 名 ?: isnJLILM 分子弍:CO(t-Bu) 严厘分类:樓生团 NH 2 塔祢:毎基甲毎基 牙子式:CONH2 胪雇分类:碳基团 "乞 件 名练:异丁 It 狂 分子式:CO(i-Pr) 序酌类:碳荃团 幺祢:乙醉基 另子式:COCH3 所斥分类:O 团 兔?u 宋甲配狂 毎子5:! COPh 豹压分芬:儀荃团 名洽:甲tt^;IE£ 分子式:CHO 所斥分类:os 名冻:★甲狂 分子式:CH2Ph 斯应分癸:襪荃团 RT 名 W : B£ 分子北:CN 所?分as :审棊0= R£H 名祢:乙決基 分子弍:C2H 所匡分卒:谑菇团 Q '5° 名称:三 分孑式:CPh3 所舄分类:碳基匡 名越U 三异丙荃甲基 分孑式:C(i-Pr)3 所床分类:蘇因 CI R ------------ I CI 名三気甲基 分?式:ccim 所廂分类:碳至因 R --------- F r 名称:三気甲基 分子式:CF3 所耳分类:蘇因 名粽:魅內基 分子式:CH=CH2CH2 所泾分25 :強芝团 名稼:乙垛基 分子式:CH=CH2 所至分2$:审棊01 名称:魚甲能基 牙子式:COCI 子居分 类:WSS
R H^C 名徐:异戊基分子式:i-Am 所雇分 类:碳链 平3 R - H3 CH3 名徐:叔丁基分子式:t-Bu 所雇分类:谀链 R I CH3 名徐:仲丁基分子式:s-Bu 所層分类:碳涟 R CH3 H CH3名務:异丁 基分子式:I-BU 所属分类:碳链 CH3 T CH3 名称:异丙基分子式:i-Pr 所 犀分类:碳链 n/W1 名称:正戊基外子式:n?C5 所雇分类:谀 链 名探:正丁基 份孑式:n?C4 所属分类:碳链 :心 名称:正丙基 分子式:n?C3 所犀分类:碳 链 攵徐:环主基分子式:C-C8 所属分类:碳环 乂徐:环霞基 分孑式:C-C7 所属分类:碳环 X称:茏基 分子式:bpn 所属分类:碳环 兔徐:茂基 分子式:C- C5P 所属分类:碳环 名徐:环己基分子式:c? C6 所属分类:碳环名徐:环戊基 分子式:c<5 所属分类:碳环 □ 名徐:环丁基 分子式:c? C4 所属分类:碳环 △ 名青:环丙基 分子式:c<3 所属分类:碳环
(完整版)高一化学必修2有机化学知识点归纳(二)
高一化学必修2 有机化学知识点归纳(二) 一、有机物的结构与性质 1、官能团的定义:决定有机化合物主要化学性质的原子、原子团或化学键。 2、常见的各类有机物的官能团,结构特点及主要化学性质 (1)烷烃 A) 官能团:无 ;通式:C n H 2n +2;代表物:CH 4 B) 结构特点:键角为109°28′,空间正四面体分子。烷烃分子中的每个C 原子的四个价键也都如此。 C) 化学性质: ①取代反应(与卤素单质、在光照条件下) , ,……。 ②燃烧 ③热裂解 (2)烯烃: A) 官能团: ;通式:C n H 2n (n ≥2);代表物:H 2C=CH 2 B) 结构特点:键角为120°。双键碳原子与其所连接的四个原子共平面。 C) 化学性质: ①加成反应(与X 2、H 2、HX 、H 2O 等) ②加聚反应(与自身、其他烯烃) ③燃烧 (3)炔烃: A) 官能团:—C≡C— ;通式:C n H 2n —2(n ≥2);代表物:HC≡CH B) 结构特点:碳碳叁键与单键间的键角为180°。两个叁键碳原子与其所连接的两个原子在同一条直线上。 CH 4 + Cl 2CH 3Cl + HCl 光 CH 3Cl + Cl 2 CH 2Cl 2 + HCl 光 CH 4 + 2O 2 CO 2 + 2H 2O 点燃 CH 4 C + 2H 2 高温 隔绝空气 C=C CH 2=CH 2 + HX CH 3CH 2X 催化剂 CH 2=CH 2 + 3O 2 2CO 2 + 2H 2O 点燃 n CH 2=CH 2 CH 2—CH 2 n 催化剂 CH 2=CH 2 + H 2O CH 3CH 2OH 催化剂 加热、加压 CH 2=CH 2 + Br 2BrCH 2CH 2Br CCl 4 原子:—X 原子团(基):—OH 、—CHO (醛基)、—COOH (羧基)、C 6H 5— 等 化学键: 、 —C ≡C — C=C 官能团
常见化学官能团
含氧官能团不同的碳氧键会因其中原子程度的不同而有性质上的差异。sp2杂化的氧原子有,而sp3则有。 分类官能团名称化学式结构式英文前缀英文后缀例子 卤代甲酰基RCOX haloformyl- -oyl halide ROH hydroxy- -ol RCOR' keto-, oxo- -one
RCHO aldo- -al ROCOOR alkyl carbonate RCOO?carboxy- -oate RCOOH carboxy- -oic acid ROR' alkoxy- alkyl alkyl ether RCOOR' alkyl alkan oate ROOH hydroperoxy- alkyl hydroperoxide
ROOR peroxy- alkyl peroxide []含氮官能团 分类官能团名称化学式结构式英文前缀英文后缀例子 -amide RCONR 2carboxamido- -amine RNH 2amino- R NH amino- -amine 2 N amino- -amine R 3
R N+ammonio- -ammonium 4 RC(=NH)R' imino- -imine RC(=NR)R'imino- -imine RC(=NH)H imino- -imine RC(=NR')H imino- -imine RC(=O)NC(=O)R' imido- -imide alkyl azide RN 3azido- R' azo- -diazene RN 2 ROCN cyanato- alkyl cyanate RNC isocyano- alkyl isocyanide
有机化学的官能团性质反应类型
高中化学所有有机化学的官能团性质,反应类型,引入官能团,反应条件 一、卤基(卤原子):水解也称取代(氢氧化钠溶液),消去(氢氧化钠醇溶液) 酚羟基:显色(Fecl3) 羧基:与醇发生酯化(浓硫酸加热)还原(+H2)中与 醇羟基:酯化,取代,消去 CC双键与叁建:加成,聚合反应(加聚) 羰基:银镜 酯基:水解(生成醇与羧酸) 苯基:加成,取代,磺化,硝化 都能发生氧化反应(+O2点燃) 同时带羟基与羧基的化合物还能发生缩聚 取代反应:有机物分子里的某些原子或原子团被其她原子或原子团所代替的反应。 加成反应:有机物分子里不饱与的碳原子跟其她原子或原子团直接结合的反应。 聚合反应:一种单体通过不饱与键相互加成而形成高分子化合物的反应。 加聚反应:一种或多种单体通过不饱与键相互加成而形成高分子化合物的反应。 消去反应:从一个分子脱去一个小分子(如水、卤化氢),因而生成不饱与化合物的反应。 氧化反应:有机物得氧或去氢的反应。 还原反应:有机物加氢或去氧的反应。 酯化反应:醇与酸起作用生成酯与水的反应。 水解反应:化合物与水反应生成两种或多种物质的反应(有卤代烃、酯、糖等) 1、氧化反应:有机物得氧或去氢的反应。甲烷燃烧CH4+2O2→CO2+2H2O(条件为点燃) 甲烷隔绝空气高温分解甲烷分解很复杂,以下就是最终分解。CH4→C+2H2(条件为高温高压,催化剂) 乙烯燃烧 CH2=CH2+3O2→2CO2+2H2O(条件为点燃) 乙炔燃烧C2H2+3O2→2CO2+H2O (条件为点燃) 苯燃烧 2C6H6+15O2→12CO2+6H2O (条件为点燃) 乙醇完全燃烧的方程式C2H5OH+3O2→2CO2+3H2O (条件为点燃) 乙醇的催化氧化的方程式2CH3CH2OH+O2→2CH3CHO+2H2O(条件为催化剂)(这就是总方程式) 2、取代反应:有机物分子里的某些原子或原子团被其她原子或原子团所代替的反应。 甲烷与氯气发生取代反应CH4+Cl2→CH3Cl+HCl CH3Cl+Cl2→CH2Cl2+HCl CH2Cl2+Cl2→CHCl3+HCl CHCl3+Cl2→CCl4+HCl (条件都为光照。 ) 苯与液溴的取代C6H6+Br2→C6H5Br+HBr 苯与浓硫酸浓硝酸 C6H6+HNO3→C6H5NO2+H2O (条件为浓硫酸) 实验室制甲烷CH3COONa+NaOH→Na2CO3+CH4(条件就是CaO 加热) 3 加成反应:有机物分子里不饱与的碳原子跟其她原子或原子团直接结合的反应。 乙烯与溴水CH2=CH2+Br2→CH2Br-CH2Br 乙烯与水CH2=CH2+H20→CH3CH2OH (条件为催化剂) 乙烯与氯化氢CH2=CH2+HCl→CH3-CH2Cl 乙烯与氢气CH2=CH2+H2→CH3-CH3 (条件为催化剂) 乙炔与溴水C2H2+2Br2→C2H2Br4 乙炔与氯化氢两步反应:C2H2+HCl→C2H3Cl--------C2H3Cl+HCl→C2H4Cl2 乙炔与氢气两步反应:C2H2+H2→C2H4→C2H2+2H2→C2H6 (条件为催化剂) 苯与氢气C6H6+3H2→C6H12 (条件为催化剂) 4、聚合反应:一种单体通过不饱与键相互加成而形成高分子化合物的反应。 乙烯聚合nCH2=CH2→-[-CH2-CH2-]n- (条件为催化剂) 氯乙烯聚合nCH2=CHCl→-[-CH2-CHCl-]n- (条件为催化剂)
2020届高三化学有机复习专题(二):官能团的性质
2020届高三化学有机复习专题(二):官能团的性质 【考纲解读】 学习有机化学确实是学习官能团,考纲中对官能团的要求是:把握 ..官能团的名称和结构,了解官能团在化合物中的作 用,把握 ..要紧官能团的性质和要紧化学反应,并能结合同系物的概念加以应用。 【知识梳理】 1、官能团 (1)定义: (2)常见官能团: 官能团化学性质(写方程式) -C=C-以乙烯为例1.加成反应:(与H2、X2、HX、H2O等) 2.氧化反应:能燃烧、使酸性KMnO4褪色3.加聚反应: -C≡C-以乙炔为例1.加成反应:(与H2、X2、HX、H2O等)如:乙炔使溴水褪色2.氧化反应:能燃烧、使酸性KMnO4褪色 -OH(醇) 以乙醇为例1.与爽朗金属(Na)的反应 2.取代反应:(1)与HX (2)分子间脱水: 3.氧化反应:①燃烧:②催化氧化: 4.消去反应: 5.酯化反应: 注意:醇氧化规律(和消去规律) (1)R-CH2OH → R-CHO (2)-OH所连碳上连两个烃基,氧化得酮 (3)-OH所连碳上连三个烃基,不能被催化氧化 -OH(酚) 以苯酚为例1.弱酸性: (1)与爽朗金属反应放H2(2)与NaOH:(酸性:H2CO3>苯酚>HCO3-) 2.取代反应: 3.与FeCl3的显色反应: 4、强还原性,能够被氧化。 5、能够和氢气加成。 -X 以溴乙烷为例1取代反应:2消去反应: -CHO 以乙醛为例1.加成反应: 2.氧化反应:(1)能燃烧 (2)催化氧化: (3)被新制Cu(OH)2、银氨溶液氧化: -COOH 以乙酸为例1.弱酸性:(酸性:R-COOH>H2CO3) RCOOH RCOO-+H+具有酸的通性。 2.酯化反应:R-OH+R,-COOH R,COOR+H2O 〔O〕
化学选修5常见官能团及其性质
一、烷烃——无官能团: 1、一般C4及以下是气态,C5以上为液态。 2、化学性质稳定,不能使酸性高锰酸钾溶液(氧化)、溴水等褪色。 3、可以和卤素(如液溴、氯气)发生取代反应,生成卤代烃和相应的卤化氢,条件:光照 4、烷烃在高温下可以发生裂解,例如甲烷在高温下裂解为碳和氢气。 二、烯烃——官能团:碳碳双键 1、性质或拨,可使酸性高锰酸钾溶液褪色,可使溴水或溴的四氯化碳溶液褪色(加成,生成二溴代烷)。 2、酸催化下和水加成生成醇,如乙烯在浓硫酸催化下和水加成生成乙醇。 3、烯烃加成符合马氏规则,氢一般加在氢多的那个C上。 4、乙烯在银或铜等催化下可以被空气氧化为环氧乙烷。 5、烯烃可以在镍等催化剂存在下和氢气加成生成烷烃。 6、烯烃可以发生加聚反应生成高聚物,如聚乙烯、聚丙烯、聚苯乙烯等。 7、实验室制乙烯通过乙醇在浓硫酸作用下脱水生成,条件170℃。 三、炔烃——官能团:碳碳三键 1、性质与烯烃相似,主要发生加成反应。也可以让高锰酸钾,溴水等褪色。 2、炔烃加水生成的产物为稀醇,稀醇不稳定,会重排成醛或酮。如乙炔加水生成乙烯醇,乙烯醇不稳定会重排成乙醛。 3、乙炔和氯化氢加成的产物为氯乙烯,加聚反应后得到聚氯乙烯。 4、炔烃加成同样符合马氏规则。 5、实验室制乙炔主要通过电石水解制得(用的饱和食盐水)。 四、芳香烃——含有苯环的烃 1、苯的性质很稳定,类似烷烃,不与酸性高锰酸钾溶液,溴的四氯化碳反应,但可与溴水发生萃取(物理反应)。 2、苯可以发生一系列取代反应,主要有: 和氯,溴等卤素取代,生成氯苯或溴苯等相应的卤化烃(条件:液溴、铁或三溴化铁催化,不可用溴水)。 和浓硝酸,浓硝酸的混合物发生硝化反应,生成硝基苯和水。条件:加热。 和浓硫酸反应生成苯磺酸,条件:加热。 3、苯可以加氢生成环己烷。 4、苯的同系物的性质不同,取代基性质活波,只要和苯环直接相连的碳上有氢,就可以被酸性高锰酸钾溶液氧化为苯甲酸。如甲苯可以使酸性高锰酸钾溶液褪色,被氧化为苯甲酸。无论取代基有多长,氧化产物都为苯甲酸。 5、苯分子中所有原子都在同一平面上。 6、苯环中不存在碳碳双键,六个碳原子之间的键完全相同。是一种特殊的大π键。 五、卤代烃——官能团:卤素原子 1、全部难溶于水,除一氯甲烷,一溴甲烷为气体外,其余均为液体或固体。 2、卤代烃可在碱性的水溶液中水解,生成醇。如溴乙烷在氢氧化钠水溶液中水解,生成乙醇。 3、卤代烃可以在氢氧化钠醇溶液中发生消去反应,生成烯烃,前提是卤素原子连接的碳原
最新高中有机化学所有官能团
官能团,是决定有机化合物的化学性质的原子或原子团。常见官能团烯烃、醇、酚、醚、醛、酮等。有机化学反应主要发生在官能团上,官能团对有机物的性质起决定作用,-X、-OH、-CHO、-COOH、-NO2、-SO3H、-NH2、RCO-,这些官能团就决定了有机物中的卤代烃、醇或酚、醛、羧酸、硝基化合物或亚硝酸酯、磺酸类有机物、胺类、酰胺类的化学性质。 官能团是决定有机化合物的化学性质的原子或原子团。常见官能团: 官能团的定义:●烷烃:碳碳单键(C—C)(每个C各有三键) 【注】碳碳单键不是官能团,其异构是碳链异构 ●烯烃:碳碳双键(>C=C<)加成反应、氧化反应。(具有面式结构,即双键及其所连接的原子在同一平面内) ●炔烃:碳碳叁键(-C≡C-)加成反应。(具有线式结构,即三键及其所连接的原子在同一直线上) ●卤代烃:卤素原子(-X),X代表卤族元素(F,Cl,Br,I); ●醇、酚:羟基(-OH);伯醇羟基可以消去生成碳碳双键,酚羟基可以和NaOH反应生成水,与Na2CO3反应生成NaHCO3,二者都可以和金属钠反应生成氢气. ●醚:醚键(-C-O-C-)可以由醇羟基脱水形成。最简单的醚是甲醚(二甲醚DME) ●硫醚:(-S-)由硫化钾(或钠)与卤代烃或硫酸酯反应而得易氧化生成亚砜或砜,与卤代烃作用生成锍盐(硫翁盐)。分子中硫原子影响下,α-碳原子可形成碳正、负离子或碳自由基。 ●醛:醛基(-CHO);可以发生银镜反应,可以和斐林试剂反应氧化成羧基。与氢气加成生成羟基。 ●酮:羰基(>C=O);可以与氢气加成生成羟基。由于氧的强吸电子性,碳原子上易发生亲核加成反应。其它常见化学反应包括:亲核还原反应,羟醛缩合反应。 ●羧酸:羧基(-COOH);酸性,与NaOH反应生成水(中和反应),与NaHCO3、Na2CO3反应生成二氧化碳,与醇发生酯化反应 ●酯: 酯(-COO-) 在酸性条件下水解生成羧酸与醇(不完全反应),碱性条件下生成盐与醇(完全反应)。 ●硝基化合物:硝基(-NO2);亚硝基(-NO) ●胺:氨基(-NH2). 弱碱性 ●磺酸:磺基(-SO3H)酸性,可由浓硫酸取代生成 ●酰:(-CO-)有机化合物分子中的氮、氧、碳等原子上引入酰基的反应统称为酰化 HO-NO2硝酸 -NO2 硝酰基 HO-SO2-OH硫酸 R-SO2-磺酰基 ●腈:氰基(-C≡N)氰化物中碱金属氰化物易溶于水,水解呈碱性 ●胩:异氰基(-NC) ●腙:(=C=NNH2)醛或酮的羰基与肼或取代肼缩合 ●巯基:(-SH)弱酸性,易被氧化 ●膦:(-PH2)由磷化氢的氢原子部分或全部被烃基取代 ●肟:【(醛肟:RH>C=N-OH)(酮肟:RR’>C=N-OH)】醛或酮的羰基和烃胺中的氨基缩合 ●环氧基:-CH(O)CH-
