镁和铝

第五讲镁和铝
【知识要点】
一、镁和铝的性质
1.铝热剂、铝热反应
某些金属氧化物粉末,与铝粉混合后在较高温度下剧烈反应生成Al2O3和其它金属并放出大量的热的反应,叫铝热反应。能作铝热剂的不只是Fe2O3,还可以是V2O5、Cr2O3、MnO2等与Al粉形成铝热剂,铝热反应较多的应用于生产上,如:焊接钢轨,熔炼难熔金属V、Cr等。
2.镁、铝在自然界中均以化合态存在,铝是地壳里存在最多的金属元素。工业上用电解熔融的MgCl2制取Mg,用电解熔融的Al2O3制取Al。
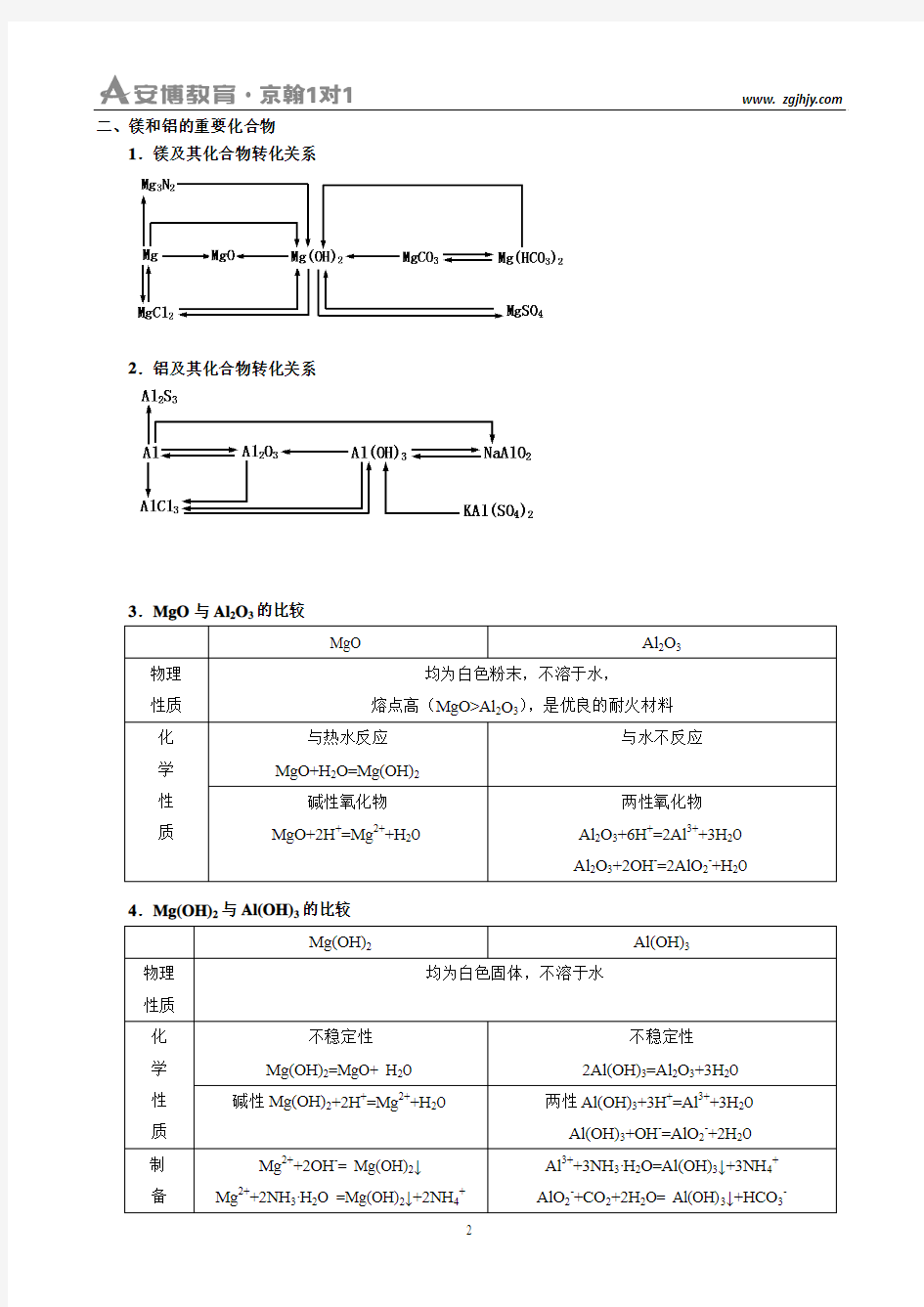
二、镁和铝的重要化合物
1.镁及其化合物转化关系
2.铝及其化合物转化关系
3.MgO与Al2O3的比较
4.Mg(OH)2与Al(OH)3的比较
5.两性物质与物质的两性
两性物质指即能与酸反应,又能与碱作用生成盐和水的化合物,如Al2O3、ZnO、Zn(OH)2、Al(OH)3、氨基酸、蛋白质等。
物质的两性,如强碱弱酸盐(NaHCO3、KHS、Na2HPO4等)弱酸弱碱盐(CH3COONH4、NH4HS)等,既能与强酸反应,又能与强碱作用,但只能说这种物质的性质有两性,不能将它们称为两性物质,因为这些化合物不是由本身直接电离出的H+和OH-参加反应,并且生成物不全是盐和水。
Al既能与酸作用,又能与强碱溶液反应,但不属于两性物质,也不能说它具有两性。
三、合金与复盐
1.合金的组成成份,可以是不同的金属,也可以是金属和非金属。一般来说,合金的硬度一般比它的各成份金属的大,如硬铝(含少量的Cu、Mg、Mn、Si等);合金的熔点比它的各成份金属的熔点都低,如K~Na合金可以作原子反应堆的导热剂。
2.复盐可以看作是两种简单的盐复合而成的,但复盐属于纯净物,复盐与普通正盐或酸式盐的区别在于复盐电离时,可以电离出两种不同的金属离子(或一种是铵根离子)。
例如:KAl(SO4)2=K++Al3++2SO42- (两种金属离子)
明矾【KAl(SO4)2·12H2O】、光卤石【KCl·MgCl2·6H2O】等均为复盐。
络盐:指含有络离子的盐类,象Na3AlF6,[Ag(NH3)2]OH等,络盐中络离子在溶液中十分稳定,很难电离。如:Na3AlF6=3Na++AlF6-,这是络盐与复盐的明显区别。
【典型例题】
例1.下列叙述中,正确的是()
A.某物质中只含有一种元素,该物质一定是纯净物
B.某晶体中含有阳离子,则必定含有阴离子
C.金属晶体的自由电子属整个晶体所共有
D.金属晶体发生形变时其内部金属离子与自由电子的相互作用消失了
例2.将相同质量的镁条分别在①氧气中②空气中③氮气中④二氧化碳中完全燃烧,燃烧后所得固体产物的质量由小到大的顺序是()
A.②①③④B.④①②③C.③②①④D.③①②④
例3.如何用化学方法除去下列物质中的杂质,写出有关的化学方程式:
(1)铝中含少量的镁(2)镁中含少量的铝
例4.下列各组离子在溶液中可以大量共存,且加入氨水后也不产生沉淀的是()A.Na+ Ba2+ Cl- SO42-B.K+ AlO2- NO3- OH-
C.H+ NH4+ Al3+ SO42-D.H+ Cl- CH3COO- NO3-
例5.下列离子方程式正确的是()
A.稀硫酸与氢氧化钡溶液反应H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.硫酸铝溶液中滴入氨水Al3++3OH-=Al(OH)3↓
C.碳酸氢镁溶液中加入氢氧化钠溶液Mg2++2HCO3-+4OH-=Mg(OH)2↓+CO32-+2H2O
D.硝酸铝溶液中滴加少量的氢氧化钠溶液Al3++3OH-=Al(OH)3↓
例6.某复盐的化学式A x B(ED4)y·z H2O,已知x、y、z均为正整数,且x+y+z=10,用该晶体完成下列实验:①称取晶体40.2g,加热至质量不再改变,质量减少了10.8g,②将剩余固体溶于水,配成200mL溶液,取出20mL,向其中加入过量的Ba(OH)2溶液,ED4离子和B离子完全沉淀,经测定为5.24g,③将沉淀物加到足量的盐酸中,固体质量又减少了0.580g。
试通过计算和推理回答A、B是何种元素及晶体的化学式。
例7.向已知含有Zn2+的溶液中滴加氨水,有白色沉淀Zn(OH)2生成,继续滴加氨水使其过量,沉淀溶解,生成了[Zn(NH3)4](OH)2。此外Zn(OH)2即可溶于盐酸,又可溶于NaOH溶液,生成ZnO22-,所以Zn(OH)2是一种两性氢氧化物。
现有四种离子,每组有两种金属离子。请各选一种试剂,将它们两者分开。可供选择的试剂有:A.硫酸B.盐酸C.硝酸D.氢氧化钠溶液E.氨水
根据上述内容填写下表:
【经典练习】
1.将一定质量的Mg、Zn、Al混合物与足量稀H2SO4反应,生成H2 2.8 L(标准状况),原混合物中的质量可能是()
A.2 g B.14 g C.8 g D.10 g
2.将某物质的量的镁和铝相混合,取等质量的该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是()
A.3 mol·L-1 HCl B.4 mol·L-1的HNO3
C.8 mol·L-1 NaOH D.18 mol·L-1的H2SO4
3.人的纯净的胃液是一种强酸性液体,pH 在0.9~1.5左右,氢氧化铝是一种治疗胃液过多的胃药的主要成分,目前这种胃药已不常用,原因主要是 ( )
A .长期摄入铝元素不利于人体健康
B .它不能中和胃液
C .它不易溶于胃液
D .它的疗效太差
4.下列气体逐渐通入NaAlO 2溶液中,开始时产生沉淀,继续通入气体时沉淀又溶解,该气体是 ( )
A .NO 2
B .NO
C .CO 2
D .H 2S
5.在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量。下列表示氢氧化钠加入量(x)与溶液中沉淀物的量(y )的关系示意图中正确的是 ( )
6.在氯化镁和硫酸镁的混合液中,若Mg 2+
与Cl -
的物质的量浓度之比为4∶3时,下列判断正确的是( )
A .溶液中Mg 2+
与SO -24的物质的量浓度相等 B .溶液中Mg 2+
与SO -
24物质的量浓度之比为5∶
8 C .溶液中Mg 2+
与SO -24物质的量浓度之比为8∶
5 D .溶液中氯化镁和硫酸镁物质的量相等
7.将AlCl 3溶液和NaOH 溶液等体积混合得到的沉淀物和溶液中所含铝元素的质量相等,则原AlCl 3溶液和NaOH 溶液物质的量浓度之比可能是 ( )
A .2∶3
B .1∶3
C .1∶4
D .2∶7
8.mg 钠、铝混合物,放入ng 水中,反应停止后,仍有不溶物ag ,则溶液中溶质为 ( )
A .NaOH
B .NaAlO 2
C .NaOH 和NaAlO 2
D .无法确定
9.将铝粉放入烧碱溶液中,若反应过程中有1.5 mol 电子发生转移,则参加反应的水为( )
A .9g
B .18g
C .0.5mol
D .
6
1
mol
10.将物质X 逐渐加入Y 溶液中,生成沉淀物质的量n 2与所加X 的物质的量n 1的关系如图所示。符合图
示情况的是 ( )
11.在50mL bmol·L-1 AlCl3溶液中加入50mL amol·L-1NaOH溶液。
(1)当a≤3b时,生成Al(OH)3沉淀的物质的量为。
(2)当a、b满足条件时,先有沉淀,后又有部分沉淀溶解,此时Al(OH)3的质量为g。
12.有铝粉和四氧化三铁组成的铝热剂,在隔绝空气的条件下灼烧,使之充分反应。将所得混合物研细并分成两等份,分别投入过量的烧碱溶液和盐酸中。充分反应后,前者消耗mmol NaOH,放出气体0.336 L;后者消耗nmolHCl,放出气体V L。若将等质量的这种铝热剂中的铝粉与足量的稀硫酸作用,可得3.36 L 气体(气体体积均在标准状况下测定。)求:
(1)该铝热剂的质量分数。
(2)m、n、V的值。
13.在标准状况下进行甲、乙、丙三组实验,三组各取30mL同浓度的盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
(1)甲组实验中,盐酸(填“过量”“适量”或“不足量”),理由是。乙组实验中,盐酸(填“过量”“适量”或“不足量”),理由是。要算出盐酸的物质的量浓度,题中可作计算依据的数据是,求得的盐酸的物质的量浓度为。
(2)求合金中Mg、Al的物质的量之比,题中可作计算依据的数据是,求得的Mg、Al的物质的量之比为。
(3)在丙组实验之后,向容器中加入1mol·L-1的氢氧化钠溶液,能使合金中的铝恰好溶解,不形成含铝的沉淀,并使Mg2+刚好沉淀完全,再过滤出不溶固体,求滤液中各溶质的物质的量和所加入氢氧化钠溶液的体积(写计算过程)。
