五水硫酸铜热重分析
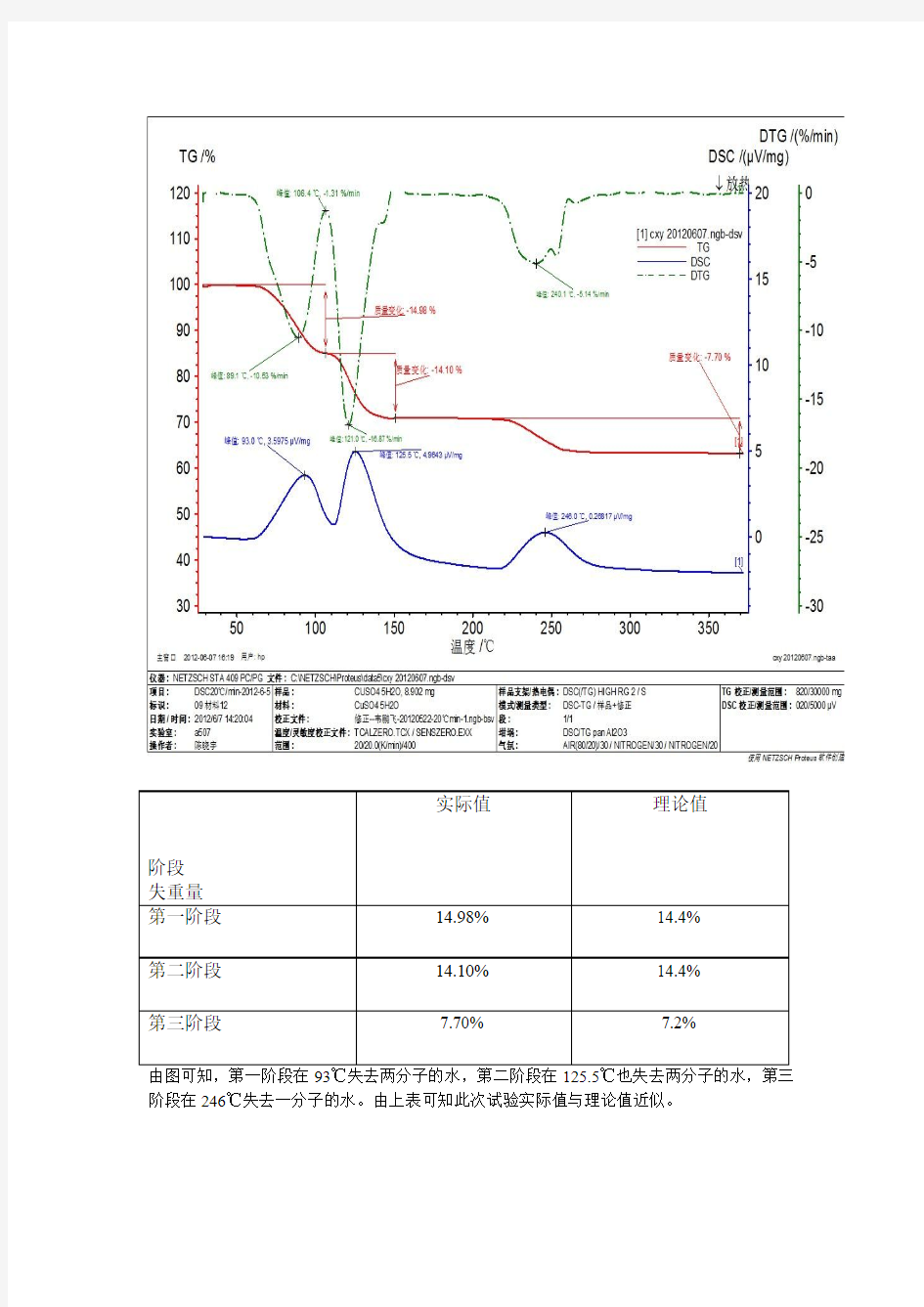
实际值理论值
阶段
失重量
第一阶段14.98% 14.4%
第二阶段14.10% 14.4%
第三阶段7.70% 7.2%
由图可知,第一阶段在93℃失去两分子的水,第二阶段在125.5℃也失去两分子的水,第三
阶段在246℃失去一分子的水。由上表可知此次试验实际值与理论值近似。
热重分析
高聚物的差热热重分析DTA/TG原理 高聚物的差热热重分析DTA/TG原理 差热分析,简称DTA,是将被测试样加热或冷却时,由于温度导致试样内部产生物理或化学变化,追踪热量变化的一种分析方法。热重分析,简称TG,是将被测试样加热,由于温度导致试样重量变化的分析方法。综合热分析仪是具有微机数据处理系统的热重—差热联用热分析仪器,是一种在程序温度(等速升降温、恒温和循环)控制下,测量物质的质量和热量随温度变化的分析仪器。常用以测定物质在熔融、相变、分解、化合、凝固、脱水、蒸发、升华等特定温度下发生的热量和质量变化,广泛应用于无机、有机、石化、建材、化纤、冶金、陶瓷、制药等领域,是国防、科研、大专院校、工矿企业等单位研究不同温度下物质物理、化学变化的重要分析仪器。差热分析作为一种重要的热分析手段已广为应用,它可以研究高聚物对热敏感的各种化学及物理过程,物理变化如:玻璃化转变、晶型转变、结晶过程、熔融、纯度变化等;化学变化如:加聚反应、缩聚反应、硫化、环化、交联、固化、氧化、热分解、辐射变化等。需指出,由于高聚物的物理或化学变化对热敏感的特性是很复杂的,所以常需要结合其它实验方法如动态力学试验、气质联用等对差热分析热谱图进行深入研究,从而进一步探讨高聚物的结构和性能间的关系。 仪器由热天平主机、加热炉、冷却风扇、微机温控单元、天平放大单元、微分单元、差热放大单元、接口单元、气氛控制单元、PC微机、打印机等组成。 实验时,将试样和惰性参比物(在测定的温度范围内不产生热效应的热惰性物质,常用?-氧化铝、石英粉、硅油等)置于温度均匀分布的坩埚(样品池)的适当位置,将坩埚(样品池)组合于加热炉中,控制其等速升温或降温。在此变温过程中,若试样发生物理或化学变化,则在对应的温度下吸收或放出热量改变其温度,使试样和参比物之间产生一定的温度(ΔT)。将ΔT 放大,记录试样与参比物的温度ΔT随温度T的变化,即ΔT~T曲线。此曲线通常称为差热曲线或差热热谱。 刚开始加热时,试样和参比物以相同温度升温,不产生温度差ΔT=0,差热曲线上为平直的基线。当温度上升到试样产产玻璃化转时,大分子的链段开始运动。试样的热容发生明显的变化,由于热容增大需要吸收更多的热量,因而试样的温度落后于参比物的温度,产生了温度差,于是差热曲线上方出现一个转折,该转折对应的温度,即玻璃化转变温度(Tg)若试样是能结晶的并处于过冷的无定形状态,则在玻璃温度以上的适当温度进行结晶,同时放出大量的热量,此时试样温度较参比物上升快,差热曲线上表现为放热峰。再进一步加热,晶体开始熔融面需要吸收热量,试样温度暂时停止上升,与参比物之间产生了温度差,其差热曲线在相反方向出现吸热峰。当熔融完成后,加于试样的热能在使试样温度升高,直到等于参比物的温度,于是二者的温度差又为零,回复到基线位置,将熔融峰顶点对应的温度记作熔点(T m);继续加热试样可能发生其他变化,如氧化、分解(氧化是放热反应,分解是吸热反应)。因此,根据差热曲线可以确定高聚物的转变和特征温度。
热重分析实验报告
热重分析实验报告
————————————————————————————————作者: ————————————————————————————————日期: ?
材料与建筑工程学院实验报告 课程名称: 材料物理性能 专业:材料科学与工程 班级: 2013级本科 姓名:张学书 学号: 3
指导老师:谢礼兰老师 贵州师范大学学生实验报告 成绩 实验一:STA449F3同步热分析仪的结构原理及操作方法 一、实验目的 1、熟悉同步热分析仪的基本原理。 2、了解STA449 F3型同步热分析仪的构造原理及性能。 3、学习STA449 F3型同步热分析仪的操作方法。 二、实验原理 差示扫描量热法(DSC)是指在加热的过程中,测量被测物质与参比物之间的能量差与温度之间的关系的一种方法技术。图1-1为功率补偿式DSC仪器示意图:
图1-1 功率补偿式D SC 示意图 1.温度程序控制器; 2.气氛控制;3.差热放大器;4.功率补偿放大器;5.记录仪 当试样发生热效应时,譬如放热,试样温度高于参比物温度,放置在它们下面的一组差示热电偶产生温差电势U ΔT ,经差热放大器放大后送入功率补偿放大器,功率补偿放大器自动调节补偿加热丝的电流,使试样下面的电流Is减小,参比物下面的电流IR 增大,而Is +IR 保持恒定。降低试样的温度,增高参比物的温度,使试样和参比物之间的温差ΔT 趋于零。上述热量补偿能及时,迅速完成,使试样和参比物的温度始终维持相同。 设两边的补偿加热丝的电阻值相同,即RS =RR=R,补偿电热丝上的电功率为PS=IR 和P R=IR 。当样品没有热效应时,PS=P R;当样品存在热效应时,PS 和PR 的差ΔP能反映样品放(吸)热的功率: ΔP= PS-PR= IR -IR=(I S+IR)( I S-IR)R =(IS+IR ) ΔV =I ΔV? (1) 由于总电流IS+IR 为恒定,所以样品的放(吸)热的功率ΔP只和ΔV 成正比, 3 1 2 4 5
五水硫酸铜的制备和质量分数的测定
五水硫酸铜的制备和质量分数的测定 一、实验目的 1.了解由不活泼金属与酸作用制备盐的方法; 2.学习重结晶法提纯物质的原理与方法; 3.学习水浴加热、蒸发、浓缩,固体灼烧等基本操作; 4.掌握硫酸铜晶体(CuSO4·5H2O)质量分数的测定方法。 二、实验用品 仪器材料:电炉,烧杯,蒸发皿,玻璃棒,坩埚钳,水浴锅,布氏漏斗,吸滤瓶,真空泵,泥三角,托盘天平,碘量瓶,碱式滴定管,滴定台,蝴蝶夹,表面皿,滤纸。 固体药品: 铜屑,碘化钾。 液体药品: 3mol·L-1硫酸,浓硝酸,无水乙醇,淀粉(0.5%),0.1mol·L-1硫代硫酸钠标准溶液,去离子水。 三、实验原理 硫酸铜晶体(CuSO4·5H2O)俗称明矾或胆矾,它是一种蓝色的斜方晶体,是制备其他铜化合物的重要原料,也是电镀和纺织品媒染剂的原料。硫酸铜溶液具有一定的杀菌能力,加在贮水池或游泳池中可防止藻类的生长。它与石灰乳混合而得到的溶液,称为波尔多液,常用于消灭果树和番茄的虫害。 铜是不活泼金属,不能直接和稀硫酸发生反应制备硫酸铜,必须加入氧化剂。在浓硝酸和稀硫酸的混合液中,浓硝酸将铜氧化成Cu2+,Cu2+与SO42-结合得到硫酸铜: Cu+2HNO3+H2SO4CuSO4+2NO2+2H2O 未反应的铜屑(不溶性杂质)用倾滗法除去。利用硝酸铜的溶解度在0~100℃范围内均大于硫酸铜溶解度的性质,溶液经蒸发浓缩析出硫酸铜,经过滤与可溶性杂质硝酸铜分离,得到粗产品。 硫酸铜的溶解度随温度升高而增大,可用重结晶法提纯。在粗产品硫酸铜中,加适量水,加热成饱和溶液,趁热过滤除去不溶性杂质。滤液冷却,析出硫酸铜晶体,过滤,与可溶性杂质分离,得到纯的硫酸铜晶体。
热重分析实验报告
热重分析实验报告 南昌大学实验报告 学生姓名: _______ 学号: _______专业班级:__________ 实验类型:?演示?验证 ?综合?设计?创新实验日期:2013-04-09 实验成绩: 热重分析 一、实验目的 1.了解热重分析法的基本原理和差热分析仪的基本构造; 2.掌握热重分析仪的使用方法; 3.测定硫酸铜晶体试样的差热谱图,并根据所得到的差热谱图,分析样品在加热过程中发生的化学变化。 二、实验原理 热重法(TG)是在程序控制温度的条件下测量物质的质量与温度关系的一种技术。热重分析仪主要由天平、炉子、程序控温系统、记录系统等几个部分构成。最常用的测量的原理有两种,即变位法和零位法。所谓变位法,是根据天平梁倾斜度与质量变化成比例的关系,用差动变压器等检知倾斜度,并自动记录。零位法是采用差动变压器法、光学法测定天平梁的倾斜度,然后去调整安装在天平系统和磁场中线圈的电流,使线圈转动恢复天平梁的倾斜,即所谓零位法。由于线圈转动所施加的力与质量变化成比例,这个力又与线圈中的电流成比例,因此只需测量并记录电流的变化,便可得到质量变化的曲线。 热重实验仪器主要由记录天平、炉子、程序控温装置、记录仪器和支撑器等几个部分组成,其中最主要的组成部分是记录天平,它基本上与一台优质的分析天平相同,如准确度、重现性、抗震性能、反应性、结构坚固程度以及适应环境温度
变化的能力等都有较高的要求。记录天平根据动作方式可以分为两大类:偏转型和指零型,无论哪种方式都是将测量到的重量变化用适当的转换器变成与重量变化成比例的电信号,并可以将得到的连续记录转换成其他方式,如原始数据的微分、积分、对数或者其他函数等,用来对实验的多方面热分析。在上述方法中又以指零型天平中的电化学法适应性更强。发生重量变化时,天平梁发生偏转,梁中心的纽带同时被拉紧,光电检测元件的偏转输出变大,导致吸引线圈中电流的改变。在天平一端悬挂着一根位于吸引线圈中的磁棒,能通过自动调节线圈电流时天平梁保持平衡态,吸引线圈中的电流变化与样品的重量变化成正比,由计算机自动采集数据得到 TG 曲线。燃烧失重速率曲线 DTG 可以通过对曲线的数学分析得到。 热重分析原理如下图所示: 三、实验仪器及试剂 HCT-2 型 TG-DTA 综合热分析仪、镊子、五水硫酸铜晶体等 四、实验步骤 1、打开炉子,将左右两个陶瓷杆放入瓷坩埚容器,关好炉子在操作界面上调零。 2、将坩埚放在天平上称量,记下数值P1,然后将测试样放入已称坩埚中称量,记下试样的初始质量。 3、将称好的样品坩埚放入加热炉中吊盘内。 4、调整炉温,选择好升温速率。 5、开启冷却水,通入惰性气体。 6、启动电炉电源,使电源按给定的速率升温。 7、观察测温表,每隔一定时间开启天平一次,读取并记录质量数值。 8、测试完毕,切断电源,待温度降低至100摄氏度时切断冷却水。 五、实验结果及数据处理
大学化学实验 五水硫酸铜的制备
实验二五水硫酸铜的制备 一.实验目的 1. 学习由不活泼金属与酸作用制备盐的方法及重结晶法提纯物质。 2.练习和掌握台天平、蒸发皿、坩埚钳、表面皿的使用。 3.学会倾滗法,减压过滤,溶解和结晶;固体的灼烧。 二.实验原理 1.制备原理:Cu + 2HNO3 + H2SO4 =CuSO4 +2NO2(↑) + 2H 2O CuSO4 +5H2O = CuSO4·5H2O 铜是不活泼金属,不能直接和稀硫酸发生反应制备硫酸铜,必须加入氧化剂。在浓硝酸和稀硫酸的混合液中,浓硝酸将铜氧化成Cu2+,Cu2+与SO42-结合得到产物硫酸铜。 2.提纯原理: 未反应的铜屑(不溶性杂质)用倾滗法除去。利用硝酸铜的溶解度在273K~373K范围内均大于硫酸铜溶解度的性质,溶液经蒸发浓缩后析出硫酸铜,经过滤与可溶性杂质硝酸铜分离,得到粗产品。 硫酸铜的溶解度随温度升高而增大,可用重结晶法提纯。在粗产品硫酸铜中,加适量水,加热成饱和溶液,趁热过
滤除去不溶性杂质。滤液冷却,析出硫酸铜,过滤,与可溶性杂质分离,得到纯的硫酸铜。
T/K273293313333353373 五水硫酸 23.132.044.661.883.8114.0 铜 硝酸铜83.5125.0163.0182.0208.0247.0 三.主要仪器与试剂 1 仪器烧杯量筒热过滤漏斗减压过滤装置台称坩埚钳,蒸发皿。 2 试剂Cu (s) 、H2SO4、HNO3(2.5mol/L; 0.5mol/L) 四.操作步骤
五.实验结果及分析 结果:1.上述得到的粗产品的重量为:5.30g 2.重结晶后得到的产品重量为:2.39 g 分析:1. Cu —CuSO4 —CuSO4·5H2O(s) 64 160 250 1.5g 3.75g 5.86g 产率= 5.30g/5.86g×100% = 90.4% 2.理论重结晶率为:(8 3. 8g-27.5g)/83.8*100%=67.2% 实际重结晶率为:2.39 / 5.30 * 100% = 45.1% (在283K与353k时的溶解度分别为27.5g/100g水、83.8g/100g水) 六.讨论 ●:1.列举从铜制备的其他方法,并加以评述。 答:由铜制备硫酸铜时铜的价态升高了,因此各种制备方法的共同点是找一个氧化剂。氧化剂不同,制备上有差异,因此,每一种制备方法均有优缺点,请根据此思路考虑其他制备方法。同样由铜制备氯化铜、醋酸铜的关键也是找氧化剂,只是酸根不同而已。
实验二 热重-差热分析法
实验二热重-差热分析法 一、实验目的 1.掌握热重和差热分析的基本原理。 2.学习热重和差热分析仪的操作。 3.学会定性解释差热谱图。 4.用差热仪测定绘制CuSO4·5H2O的DTA曲线,分析其水分子的脱去顺序。 二、实验原理 差热分析(DTA)是在程序控制温度下,建立被测量物质和参比物的温度差与温度关系的一种技术。数学表达式为 △T=Ts-Tr=f(T或t) 其中:Ts ,Tr分别代表试样及参比物温度;T是程序温度;t是时间。记录的曲线叫差热曲线或DTA曲线。
本实验以α – Al2O3作为参比物质,记录CuSO4·5H2O的DTA曲线,从而考察其失去五分子结晶水的情况。 物质受热时,发生化学变化,质量也就随之改变,测定物质质量的变化也就随之改变,测定物质质量的变化就可研究其变化过程, 热重法(TG)是在程序控制温度下,测量物质质量与温度关系的一种技术,热重法实验得到的曲线称为热重曲线(TG曲线)。 三、实验仪器: 差热分析仪 由加热炉、试样容器、热电偶、温度控制系统及放大、记录系统等部分组成。 四、实验步骤: 1.依次开启稳压电源、工作站、气体流量计、主机(开关均在后面)、电脑,打开氮气瓶,使之压力为0.5MP。 2.打开炉子,手动在左右两个陶瓷杆放入铝坩埚容器,关好炉子,在操作界面上调零,仪器自动扣除了空坩埚的重量。 3.打开炉子取出样品坩埚容器将约5-10mg的样品研成粉末放入铝坩埚容器。 4.打开软件TA-60WS Collection Monitor 点击measure,出现measure parameter,在这里我们可以设置所需要的程序温度,然后点击Start,要我们文件保存在哪里。 5.单击Start。 6.仪器测定结束。 四、结果处理 1.仪器结束后,打开软件TA60,找到要保存的结果文件。 2.依次找到重量线,热线,程序升温线。
由胆矾精制五水硫酸铜
由胆矾精制五水硫酸铜 一、实验目的 1.掌握电子秤的使用方法。 2.了解结晶过程基本知识。 3.掌握结晶与重结晶提纯物质的原理和方法。 4.掌握固体的加热溶解、水浴蒸发浓缩、热过滤、结晶与重结晶基本操作。 5.复习常压过滤、减压过滤。 二、基本原理 本实验是以工业硫酸铜(俗名胆矾)为原料,精制五水硫酸铜。工业胆矾含有不溶性杂质及Fe3+、Fe2+和Cl-等可溶性杂质。不溶性杂质可用过滤方法除去。可溶性杂质由于其含量较少,在结晶和重结晶过程中留在母液中而除去。 当把CuSO4溶液水浴蒸发浓缩时,当浓缩到溶质浓度大于在该温度下溶质的饱和溶解度时,会析出晶体。当采用水浴蒸发浓缩和不断搅拌时,溶液表面的蒸发作用导致其浓度较大、温度较低而首先结晶,逐渐形成一层晶膜。若冷却此溶液,就会有大量的晶体析出,从而达到分离和提纯的目的。 重结晶是根据CuSO4·5H2O的溶解度随温度升高而增大的性质,在近沸时将晶体溶解至近饱和溶液,然后在室温下冷却析出晶体的过程,使夹杂在晶体中的杂质留在母液中,从而得到较纯的五水硫酸铜晶体。 三、仪器、药品 电子称、滤纸、玻璃漏斗(短颈)、布氏漏斗、抽滤瓶、电炉 工业硫酸铜,H2SO4 (3mol·dm-3),乙醇(95%),25%硫氰酸钾溶液 四、实验步骤 1.胆矾中不溶性杂质的去除。 称取20.0g胆矾于烧杯中,加入40cm3水,加热、搅拌至充分溶解,趁热过滤除去不溶性杂质。 2.CuSO4·5H2O的结晶提纯 将滤液转入蒸发皿内,加入2~3滴3mol·dm-3 H2SO4使溶液酸化。水
浴蒸发浓缩至溶液表面形成薄层晶膜(过饱和,注意观察现象),冷却至 室温,减压过滤,得到粗硫酸铜,称重,量取母液体积并回收、另存备 用。 3.CuSO4·5H2O重结晶提纯 取0.5g粗硫酸铜晶体留作鉴别比较用。 其余粗硫酸铜晶体转入小烧杯中,按每克粗硫酸铜加入1cm3水的比例分批加入去离子水(先加入80% v/v水),再滴加7~8滴3mol·dm-3 H2SO4,加热近沸,若晶体溶解不完全,再逐滴加入水(剩余的20%水)至沸腾时晶体刚好全部溶解(若发现有不溶物,则需再次热过滤)。溶液 冷却至室温后减压过滤,用5cm3乙醇洗涤晶体1~2次。取出晶体、晾干、称量并计算产率。量取母液的体积并回收,回收产品。 五、讨论 1.通过比较胆矾、粗硫酸铜、提纯硫酸铜晶体说明提纯效果。 2.通过比较胆矾溶液(取少量胆矾溶于水)与粗硫酸铜、提纯硫酸铜母液 溶液的颜色,说明提纯效果。 3.计算产率(分别以工业硫酸铜(胆矾)原料计算结晶提纯的粗硫酸铜产 率,以粗硫酸铜计算重结晶产率),进行物料总平衡计算,说明产率低 的原因。 (提问:(1)为何要使用减压过滤?——加快过滤速度,把产物抽干。)(2)量取母液体积的目的:计算物料平衡用。 六、思考题 1.结晶与重结晶分离提纯物质的根据是什么?如果被提纯物质是NaCl而 不是CuSO4·5H2O,实验操作上有何区别? 2.结晶与重结晶有何联系和区别?实验操作上有何不同?为什么? 3.水浴浓缩速度较慢,开始时可以搅拌加速蒸发,但临近结晶时能否这样 做? 4.如果室温较低,你准备采用什么措施使热过滤能顺利进行? 5.浓缩和重结晶过程为何要加入少量H2SO4?(防止Fe3+水解) 6.沉淀物未能铺满布氏漏斗底部、滤饼出现裂缝、沉淀层疏松不实,对抽
实验差热热重
实验5 热重、差热分析实验 一.实验目的与基本要求 1.在固相反应中,通过对材料基本性质的了解,利用其基本性质参数,试设计出一条合理的温度曲线,利用综合热分析仪(ZRY-1P、ZRY-2P)对其进行测试分析,通过对比,得到最优烧结方案。 2.理解热重分析和差热分析的基本原理。 3.了解高温综合热分析仪(ZRY-2P)的组成及组成各系统的基本工作原理。 4.掌握高温综合热分析仪的具体测量方法。 5.当各种固体氧化物、盐类发生熔融、相变、分解、化合、脱水、凝固、蒸发、升华等特定过程时,对其进行热重分析和差热分析。 6.对实验数据进行处理,根据得到的一系列热重曲线(TG)、微分热重曲线(DTG)和差热曲线(DTA),对物质发生的具体过程进行热分析。 二.实验原理与温度曲线的设计 固相反应是一系列合金、传统硅酸盐材料以及新型无机功能材料生产过程中的基础反应。固相反应是固体参与直接化学反应并起化学变化,同时至少在固体内部或外部的一个过程中起控制作用的反应。固相反应除固体间的反应外也包括有气、液相参与的反应。例如金属氧化、碳酸盐、硝酸盐和草酸盐等的热分解反应、粘土矿物的脱水反应以及煤的干馏等反应。 固相反应的共同特点有:首先,固体质点(原子、离子或分子)间具有很大的作用键力,故固态物质的反应活性通常较低,速度较慢。其次,在低温时固体在化学上一般是不活泼的,因而固相反应通常需在高温下进行。而且由于反应发生在非均一系统,传热和传质过程都对反应速度有重要影响。而伴随反应的进行,反应物和产物的物理化学性质将会变化,并导致固体内部温度和反应物浓度分布及其物性的变化,这都可能对传热、传质和化学反应过程产生影响。 在具体的反应中为了得到预定的产物,使反应向着希望的方向进行,各种固体氧化物、盐类发生熔融、相变、分解、化合、脱水、凝固、蒸发、升华等特定过程需要适当的温度和持续时间,在对具体反应物基本性质的了解,利用其基本性质参数的基础上,试设计出一条适宜的温度曲线,利用高温综合热分析仪(ZRY-2P)对其进行测试,通过对实验结果的分析比较,得到最优温度方案。 综合热分析仪是具有微机数据处理系统的热重-差热联用热分析仪器,是一种在程序温度(等速升温、
胆矾中硫酸铜含量的测定
胆矾中硫酸铜含量的测定 一、实验目的 1、巩固铜盐中铜的测定方法,并借此测定胆矾中硫酸铜含量 2、进一步掌握铜盐中铜的测定原理和碘量法的测定方法 3、熟练掌握Na 2S 2 O 3 溶液的配制及标定 4、巩固终点的判断及观察 二、实验原理 在弱酸性条件下(PH=3~4),Cu2+与过量I-作用生成不溶性的CuI沉淀,同时析出与之计量相当的I 2 : 2Cu2+ + 5I- = 2CuI(沉淀)+ I 3 - 生成的I 2,再用Na 2 S 2 O 3 标准溶液滴定,以淀粉为指示剂,滴定至蓝色恰好褪 去为终点。 2S 2O 3 2- + I 3 - = S 4 O 6 2- + 3I- 这里的I-既是Cu2+的还原剂和沉淀剂,也是I 2 的络合剂。 由于CuI沉淀表面会吸附一些I 2,使其无法被Na 2 S 2 O 3 滴定,造成终点提前, 结果偏低。为此在滴定至临近终点时加入KSCN或NH 4 SCN ,使CuI转化为溶解度更小的CuSCN: CuI(沉淀)+ SCN- = CuSCN(沉淀)+I- 而CuSCN不吸附I 2,因而消除了由I 2 被吸附而造成的误差,提高测定结果的准 确度。 根据Na 2S 2 O 3 标准溶液的浓度,消耗的体积,及试样重量,就可以计算出胆 矾中硫酸铜含量: 2Cu2+ ~ I 3- ~2S 2 O 3 2- nCu2+=(CV)S 2O 3 2- =nCuSO 4 mCuSO 4 =(CV)S 2 O 3 2-.M CuSO 4 W%=(CV)S 2O 3 2-.M CuSO 4 /m s X 100% 三、所用试剂 K 2Cr 2 O 7 (s)、Na 2 S 2 O 3 .5H 2 O(s)、Na 2 CO 3 (s)、HCl溶液6mol.L-1
五水硫酸铜
五水硫酸铜 2℃03g20℃33.7g80℃444.6g6℃60.8g8018℃.3g8 s etp3取室温下称溶解多3g度右的硫左铜,酸溶1于00l热水中m(验实所用的水不能中是来自水可,以饮是用,水荐推屈臣蒸氏馏水),搅使拌完其溶解全。入倒干净玻璃的容中器,上盖盖子,置一天静 s te4如p你发现完全果冷却,容后底部器有大量晶碎,有完整的小没晶,体就重复s那et3,原p可因能是却冷快、过中水有质杂者在或却过程冷中频繁动扰溶液如。你果得了几个到整的完晶体小(称为晶)核请那行进一步 下s tep5到得晶核,你了就以可真正开始的你体培养晶!首了先你
配要较大量的饱置溶和(液就是也溶解固体达最到大法无续再溶继溶的)液2(0m0l),然当你一步上余的剩溶应液并入此该步骤的液中溶具。的配置常温体饱溶和液方法的:称取是温下溶室解度多g2右左硫酸铜的溶解在20,m0l热水,中全完冷却后滤(这一步你过可能得到好也晶的核),保留滤,液剩余固的放入一个体密塑封料瓶,中放入。这个水塑瓶的料的是保目存你后分离以得到的酸铜固硫体,且并可以时得到同室温的饱下硫酸和溶液铜。 step6晶体养一般有两培方法:杯底或种者挂。如果悬你不想用细挂住晶体,线么那可采用直接把晶以核放杯在的方底,但这种法法方对酸铜来硫说会影晶体的形状,响所建以采用悬挂的方议法。(当然你可以也种两法方试都试一将)个稍大一一的晶核点(-2c1)m用线栓细紧系死扣,,且将并的线另端一系在个细一竹签。上系体的晶标是准不能让:晶在自体然状况掉落,线长下该满应足晶全体部入烧杯液浸以下。面 stpe系7好了晶,体不忙要着入溶液。放为这因你的时液可能
五水硫酸铜的制备1
五水硫酸铜的制备 一、实验目的 1、掌握用废铜与硫酸作用制备五水硫酸铜的制备方法 2、练习溶解、浓缩、蒸发、结晶、过滤及重结晶等基本操作 二、实验原理 铜是不活泼金属,不能直接和稀硫酸发生反应制备硫酸铜,必须加入氧化剂。在浓硝酸和稀硫酸的混合液中,浓硝酸将铜氧化成Cu2+,Cu2+与SO42-结合得到硫酸铜: Cu + 2HNO3 + H2SO4 == == CuSO4 + 2NO2 + 2H2O 未反应的铜屑(不溶性杂质)用倾滗法除去。利用硝酸铜的溶解度在0~100℃范围内均大于硫酸铜溶解度的性质,溶液经蒸发浓缩析出硫酸铜,经过滤与可溶性杂质硝酸铜分离,得到粗产品。 硫酸铜的溶解度随温度升高而增大,可用重结晶法提纯。在粗产品硫酸铜中,加适量水,加热成饱和溶液,趁热过滤除去不溶性杂质。滤液冷却,析出硫酸铜,过滤,与可溶性杂质分离,得到纯的硫酸铜。 五、实验步骤 1、进实验室;(思考题1) 2、称量1.5g铜屑,灼烧至表面呈现黑色,冷却;(思考题2) 3、加5.5mL3mol·L-1硫酸,2.5mL浓硝酸,反应平稳后水浴加热,补加2.5mL3mol·L-1硫酸, 0.5mL浓硝酸;(思考题3 思考题4 思考题5 思考题6 思考题7) 4、铜近于完全溶解后,趁热倾滗法分离;(思考题8 思考题9 思考题10) 5、水浴加热,蒸发浓缩至结晶膜出现;(思考题11) 6、冷却、过滤;(思考题12) 7、粗产品以1.2mL水/g的比例,加热溶于水,趁热过滤; (思考题13 思考题14 思考题15 思考题16 思考题17)
8、滤液冷却、过滤、晾干,得到纯净的硫酸铜晶体。 9、称重,计算产率。 思考题3:什么时候补加稀硫酸、浓硝酸? 思考题4:第一次加完酸后,为什么要等反应平稳后才水浴加热、而且要在蒸发皿上盖表面皿?思考题5:为什么要缓慢、分批的加浓硝酸? 思考题6:为什么用3mol·L-1的硫酸? 思考题7:为什么不用浓硫酸与铜反应制备五水硫酸铜? 思考题8:为什么要趁热用倾滗法转移溶液? 思考题9:为什么可用倾滗法转移溶液,此步骤的目的是什么? 思考题10:如何判断铜屑已经近于反应完? 思考题12:如何判断蒸发皿内的溶液已冷却?为什么要冷却后才能过滤,此操作的目的是什么?思考题13:重结晶的最高产率是多少,产率过高、过低的原因是什么? 思考题14:什么情况下趁热过滤得到的滤液还要水浴蒸发,为什么会出现此情况? 思考题15:说明硫酸铜重结晶中趁热过滤的操作要领,如何达到? 六、存在的问题 1、灼烧时,蒸发皿裂了,直到水浴加热时水发蓝才发现; 2、加错酸或加的酸量不对; 3、水浴加热进行反应的过程中,硫酸铜析出了; 4、反应时间已经很长了,但蒸发皿内仍有未反应的铜(比较多的量); 5、倾滗法转移溶液时,出现大量硫酸铜晶体; 6、粗产品过滤时,滤瓶中又有晶体析出; 7、重结晶趁热过滤时,滤纸上有硫酸铜晶体; 8、粗产品带绿色;桌面太乱。 七、深入讨论 1、由铜制备硫酸铜的其他方法 由铜制备硫酸铜时铜的价态升高了,因此各种制备方法的共同点是找一个氧化剂。氧化剂不同,制备上有差异,因此,每一种制备方法均有优缺点,请根据此思路考虑其他制备方法。 同样由铜制备氯化铜、醋酸铜的关键也是找氧化剂,只是酸根不同而已。 2、蒸发浓缩溶液可以用直接加热也可以用水浴加热的方法,如何进行选择? 首先由溶剂、溶质的性质决定。如加热由易燃、沸点在353K以下的有机溶剂组成的溶液时,用水浴加热方便安全。 溶质的热稳定性、氧化还原稳定性也决定了加热的方式。如五水硫酸铜受热时分解(热稳定性)CuSO4·5H2O = CuSO4·3H2O + 2H2O (375K) CuSO4·3H2O = CuSO4·H2O + 2H2O (386K) CuSO4·H2O = CuSO4 + H2O (531K) 实验者对蒸发速度的要求是其次的考虑,当希望溶液平稳地蒸发,也用水浴加热,沸腾后溶液不会溅出,当然,蒸发速度相对要慢些。 3、是否所有的物质都可以用重结晶方法提纯 不是,适用于重结晶法提纯的物质应具备随温度变化溶解度变化较大的性质,如硝酸钾、五水硫酸铜等,这样提纯后的产率较大。 还有一种重结晶法是提纯物质在不同温度下的溶解度差别不是很大时采用,可以稍多加一些水,加热溶解,趁热过滤后,再加热蒸发至表面出现晶体(刚达到饱和),随即冷却结晶。 对在不同温度下溶解度差别不大的物质如氯化钠,则不能用重结晶法提纯,否则提纯产率太低。
草酸钙的热重差热分析
草酸钙的热重差热分析文件排版存档编号:[UYTR-OUPT28-KBNTL98-UYNN208]
综合热分析法测定草酸钙 【实验目的】 (1)掌握热重-差热分析原理和ZCT-A型综合热分析仪的操作方法,了解其应用范围。 (2)对草酸钙进行热重及差热分析,测量化学分解反应过程中的分解温度。 (3)测量物质在加热过程中所发生的物理化学变化,绘制相应曲线,从而研究材料的反应过程。 【实验原理】 热分析是物理化学分析的基本方法之一。综合热分析研究物质在加热过程中发生相变或其他物理化学变化时所伴随的能量、质量和体积等一系列的变化,可以确定其变化的实质或鉴定矿物。热分析技术种类很多,比较常用的方法有(1)差热法(DTA),(2)热重法(TG)[包括微分热重(DTG)],(3)差示扫描量热法(DSC)。 (1)热重分析 热重分析是在程序控制温度下,测量物质质量与温度关系的一种技术。热重法实验得到的曲线称为热重(TG)曲线。TG曲线以温度作横坐标,以试样的失重作纵坐标,显示试样的绝对质量随温度的恒定升高而发生的一系列变化。这些变化表征了试样在不同温度范围内发生的挥发组分的挥发,以及在不同温度范围内发生的分解产物的挥发。如图1、图 2 CaC 2O 4 ·H 2 O的热重曲线,有三个非常明显的失重阶段。第一个阶段表 示水分子的失去,第二个阶段表示CaC 2O 4 分解为CaCO 3 ,第三个阶段表示
CaCO 3分解为CaO 。当然,CaC 2O 4·H 2O 的热失重比较典型,在实际上许多 物质的热重曲线很可能是无法如次明了地区分为各个阶段的,甚至会成为一条连续变化地曲线。这时,测定曲线在各个温度范围内的变化速率就显得格外重要,它是热重曲线的一阶导数,称为微分热重曲线[图1也现示出了CaC 2O 4·H 2O 的微分热重曲线(DTG )]。微分热重曲线能很好地 显示这些速率地变化。 图1 CaC 2O 4·H 2O 的TG-DSC 曲线(文献图) 图2 CaC 2O 4·H 2O 的TG 曲线(文献图) (2)差热分析(DTA )和差示扫描量热分析(DSC ) 差热分析(DTA )是在试样与参比物处于控制速率下进行加热或冷却地环境中,在相同地温度条件时,记录两者之间地温度差随时间或温度地变化。差示扫描量热分析(DSC )记录地则是在二者之间建立零温度差所需地能量随时间或温度的变化。 差热分析和差示扫描量热分析所得到的谱图或曲线常画成在恒定加热或冷却的速率下随时间或温度变化的形式,其横坐标相应于时间或温度,作差热分析测量时,纵坐标为试样与参比物之温差,而作差示扫描量热分析时,纵坐标为试样池与参比池之功率差(d ΔC/dt )。从图1可以看出,CaC 2O 4·H 2O 的DSC 曲线(DTA 曲线与DSC 曲线相似)有三个向 上的峰,分别表示CaC 2O 4·H 2O 热分解时发生了三个吸热反应。所以DSC (或DTA )反映的是所测试样在不同的温度范围内发生的一系列伴随着热现象的物理或化学变化。换言之,凡是有热量变化的物理和化学现象都
草酸钙的热重 差热分析
综合热分析法测定草酸钙 【实验目的】 (1)掌握热重-差热分析原理和ZCT-A型综合热分析仪的操作方法,了解其应用范围。 (2)对草酸钙进行热重及差热分析,测量化学分解反应过程中的分解温度。 (3)测量物质在加热过程中所发生的物理化学变化,绘制相应曲线,从而研究材料的反应过程。 【实验原理】 热分析是物理化学分析的基本方法之一。综合热分析研究物质在加热过程中发生相变或其他物理化学变化时所伴随的能量、质量和体积等一系列的变化,可以确定其变化的实质或鉴定矿物。热分析技术种类很多,比较常用的方法有(1)差热法(DTA),(2)热重法(TG)[包括微分热重(DTG)],(3)差示扫描量热法(DSC)。 (1)热重分析 热重分析是在程序控制温度下,测量物质质量与温度关系的一种技术。热重法实验得到的曲线称为热重(TG)曲线。TG曲线以温度作横坐标,以试样的失重作纵坐标,显示试样的绝对质量随温度的恒定升高而发生的一系列变化。这些变化表征了试样在不同温度范围内发生的挥发组分的挥发,以及在不同温度范围内发生的分解产物的挥发。如 图1、图2 CaC 2O 4 ·H 2 O的热重曲线,有三个非常明显的失重阶段。第一个阶段表示水分 子的失去,第二个阶段表示CaC 2O 4 分解为CaCO 3 ,第三个阶段表示CaCO 3 分解为CaO。当然, CaC 2O 4 ·H 2 O的热失重比较典型,在实际上许多物质的热重曲线很可能是无法如次明了地 区分为各个阶段的,甚至会成为一条连续变化地曲线。这时,测定曲线在各个温度范围内的变化速率就显得格外重要,它是热重曲线的一阶导数,称为微分热重曲线[图1也现 示出了CaC 2O 4 ·H 2 O的微分热重曲线(DTG)]。微分热重曲线能很好地显示这些速率地变 化。 图1 CaC 2O 4 ·H 2 O的TG-DSC曲线(文献图) 图2 CaC 2O 4 ·H 2 O的TG曲线(文献图) (2)差热分析(DTA)和差示扫描量热分析(DSC) 差热分析(DTA)是在试样与参比物处于控制速率下进行加热或冷却地环境中,在相同地温度条件时,记录两者之间地温度差随时间或温度地变化。差示扫描量热分析(DSC)
认识蓝矾--五水硫酸铜
世上无难事,只要肯攀登 认识蓝矾--五水硫酸铜 五水硫酸铜,俗称蓝矾、胆矾或铜矾,化学方程式为CuSO4-5H2O,为蓝色晶体。无水硫酸铜在常温常压下很稳定,不潮解,在干燥空气中会逐渐风化,加热至45℃时失去二分子结晶水,110℃时失去四分子结晶水,150℃时失去全部结晶水而成无水物。无水物也易吸水转变为五水硫酸铜。常利用这一特性来检验某些液态有机物中是否含有微量水分。将五水硫酸铜加热至650℃高温,可分解为黑色氧化铜、二氧化硫及氧气。 胆矾是天然的含水硫酸铜,是分布很广的一种硫酸盐矿物。它是铜的硫化物被氧分解后形成的次生矿物。胆矾产于铜矿床的氧化带,也经常出现在矿井的巷道内壁和支柱上,这是由矿井中的水结晶而成的。胆矾的晶体成板状或短柱状,这些晶体集合在一起则呈粒状、块状、纤维状、钟乳状、皮壳状等。它们具有漂亮的蓝色,但如果暴露在干燥的空气中会由于失去水而变成不透明的浅绿白色粉末。同时胆矾极易溶于水。胆矾是颜料、电池、杀虫剂、木材防腐等方面的化工原料。 预处理饲料级沙状无水硫酸铜,除具有硫酸铜的功能外还具有在使用过程中,粉尘较少,大大地减少环境污染和对工人皮肤、呼吸道的刺激;同时更能保证预混料中铜的添加量。流动性较好,在生产过程中混合均匀度较好;同时不易出现结块现象。本品在生产过程中,因为不添加任何载体,故不存在与其它物质接触而产生的物理、化学变化。由于在预混合饲料、饲料中,与维生素、氨基酸等营养物质的接触面较小,从而减少对上述营养物质的破坏。由于本品属沙粒状,与空气接触面小,故可以减少铜离子的氧化,从而提高其效价。游离酸含量低。硫酸铜晶体中每一组铜离子、硫酸根离子与结晶水分子的个数是1:10,呈蓝色,在加热的条件下,结晶水可全部失去,硫酸铜晶体变
实验二-五水合硫酸铜的制备
实验二五水合硫酸铜的制备 一、实验目的 1、掌握用废铜与硫酸作用制备五水硫酸铜的制备方法 2、练习溶解、浓缩、蒸发、结晶、过滤及重结晶等基本操作 3、巩固台秤、量筒、pH试纸的使用等基本操作。 二、实验原理 制备方法: 方案1 Cu + 2HNO3 + H2SO4 == CuSO4 + 2NO2↑+ 2H2O 方案2 Cu + H2O2 + H2SO4 == CuSO4 + 2H2O 方案3 Cu + O2 == 2CuO CuO+ H2SO4 == CuSO4 + H2O 重结晶法提纯:由于废铜屑不纯,所得CuSO4溶液中常含有一些不溶性杂质或可溶性杂质,不溶性杂质可过滤除去,可溶性杂质常用化学方法去除。 由于五水硫酸铜在水中的溶解度随温度升高而明显增大,因此,硫酸铜粗产品中的杂质可通过重结晶法提纯使杂质留在母液中,从而得到纯度较高的硫酸铜晶体。 三、实验步骤 1.制备五水硫酸铜粗品 (1)废铜屑预处理 称取2.0 g铜屑放于150 mL锥形瓶中,加入10% Na2CO3溶液10 mL,加热煮沸,除去表面油污,倾析法除去碱液,用水洗净。 (2)简单流程 加入 6 mol/L H2SO4溶液10 mL→缓慢滴加30% H2O2 3~4 mL→水浴加热(反应温度保持在40~50 ℃)→反应完全后(若有过量铜屑,补加稀H2SO4和H2O2)→加热煮沸2分钟→趁热抽滤(弃去不溶性杂质)→将溶液转移到蒸发皿中→调pH1~2(为什么?)→水浴加热浓缩至表面有晶膜出现(能否蒸干?)→取下蒸发皿→冷却至室温→抽滤→得到五水硫酸铜粗产品→晾干或吸干→称量→计算产率(回收母液) 2.重结晶法提纯五水硫酸铜 粗产品∶水= 1∶1.2(质量比),加少量稀H2SO4,调pH为1~2,加热使其全部溶解,趁热过滤(若无不溶性杂质,可不过滤),滤液自然冷却至室温(若无晶体析出,水浴加热浓缩至表面出现晶膜),抽滤,用少量无水乙醇洗涤产品,抽滤。将产品转移至干净的表面皿上,用吸水纸吸干,称量,计算收率(回收母液)。 [数据记录与处理] 三、注意事项 1.双氧水应缓慢分次滴加。 2.趁热过滤时,应先洗净过滤装置并预热;将滤纸准备好,待抽滤时再润湿。 3.水浴加热浓缩至表面有晶膜出现即可,不可将溶液蒸干。 4.浓缩液自然冷却至室温。 5.重结晶时,调pH为1~2,加入水的量不能太多。 6.回收产品和母液。 四、问题讨论 1.蒸发时为什么要将溶液的pH调至1~2? 2.制备和提纯五水硫酸铜实验中,加热浓缩溶液时,是否可将溶液蒸干?为什么? 3.如果不用水浴加热,直接加热蒸发,是否能得到纯净的五水硫酸铜?
热重分析及综合热分析
实验七 热重分析及综合热分析 一、目的与要求 1.了解热重分析的仪器装置及实验技术。 2.了解差热分析的仪器装置及实验技术。 3熟悉综合热分析的特点,掌握综合热曲线的分析方法。 4.测绘矿物的热重曲线和差热分析曲线,解释曲线变化的原因。 二、原理 1 热重分析的仪器结构与分析方法 热重分析法是在程序控制温度下,测量物质的质量随温度变化的一种实验技术。 热重分析通常有静态法和动态法两种类型。 静态法又称等温热重法,是在恒温下测定物质质量变化与温度的关系,通常把试样在各给定温度加热至恒重。该法比较准确,常用来研究固相物质热分解的反应速度和测定反应速度常数。 动态法又称非等温热重法,是在程序升温下测定物质质量变化与温度的关系,采用连续升温连续称重的方式。该法简便,易于与其他热分析法组合在一起,实际中采用较多。 热重分析仪的基本结构由精密天平、加热炉及温控单元组成。如图1所示:加热炉由温控加热单元按给定速度升温,并由温度读数表记录温度,炉中试样质量变化可由天平记录。 由热重分析记录的质量变化对温度的关系曲线称热重曲线(TG 曲线)。曲线的纵坐标为质量,横坐标为温度。例如固体热分解反应A (固)→B (固)+C (气)的典型热重曲线如图2所示。 图2 固体热分解反应的热重曲线 图中T i 为起始温度,即累计质量变化达到热天平可以检测时的温度。T f 为终止温度,即累计质量变化达到最大值时的温度。 图1 热重分析仪原理
热重曲线上质量基本不变的部分称为基线或平台,如图2中ab 、cd 部分。 若试样初始质量为W 0,失重后试样质量为W 1,则失重百分数为(W 0-W 1)/W 0×100%。 许多物质在加热过程中会在某温度发生分解、脱水、氧化、还原和升华等物理化学变化而出现质量变化,发生质量变化的温度及质量变化百分数随着物质的结构及组成而异,因而可以利用物质的热重曲线来研究物质的热变化过程,如试样的组成、热稳定性、热分解温度、热分解产物和热分解动力学等。例如含有一个结晶水的草酸钙(CaC 2O 4·H 2O )的热重曲线如图3,CaC 2O 4·H 2O 在100℃以前没有失重现象,其热重曲线呈水平状,为TG 曲线的第一个平台。在100℃和200℃之间失重并开始出现第二个平台。这一步的失重量占试样总质量的12.3%,正好相当于每molCaC 2O 4·H 2O 失掉1molH 2O ,因此这一步的热分解应按 O H O CaC O H ·O CaC 242℃ 200℃100242 ~ +????→? 进行。在400℃和500℃之间失重并开始呈现第三个平台,其失重量占试样总质量的18.5%,相当于每molCaC 2O 4分解出1molCO ,因此这一步的热分解应按 CO CaCO O CaC 3℃500 ℃40042~ +????→? 进行。在600℃和800℃之间失重并出现第四个平台,其失重量占试样总质量的30%,正好相当于每molCaC 2O 4分解出1molCO 2,因此这一步的热分解应按 2℃800 ℃60042CO CaO O CaC ~ +????→? 进行。 可见借助热重曲线可推断反应机理及产物。 图3 CaC 2O 4·H 2O 的热重曲线 2、综合热分析 DTA 、DSC 、TG 等各种单功能的热分析仪若相互组装在一起,就可以变成多功能的综合热分析仪,如DTA -TG 、DSC -TG 、DTA -TMA (热机械分析)、DTA -TG -DTG (微商热重分析)组合在一起。综合热分析仪的优点是在完全相同的实验条件下,即在同一次实验中可以获得多种信息,比如进行DTA -TG -DTG 综合热分析可以一次同时获得差热曲线、热重曲线和微商热重曲线。根据在相同的实验条件下得到的关于试样热变化的多种信息,就可以比较顺利地得出符合实际的判断。 综合热分析的实验方法与DTA 、DSC 、TG 的实验方法基本类同,在样品测试前选择好测量方式和相应量程,调整好记录零点,就可在给定的升温速度下测定样品,得出综合热曲线。 综合热曲线实际上是各单功能热曲线测绘在同一张记录纸上,因此,各单功能标准热曲线可以作为综合热曲线中各个曲线的标准。利用综合热曲线进行矿物鉴定或解释峰谷产生的
五水硫酸铜的制备
.实验目的 1.学习由不活泼金属与酸作用制备盐的方法及重结晶法提纯物质。 2.练习和掌握台天平、蒸发皿、坩埚钳、表面皿的使用。 3.学会倾滗法,减压过滤,溶解和结晶;固体的灼烧。 二.实验原理 1.希9备原理:Cu + 2HNO + H 2SQ =CuSO +2NO2( T) + 2H 2O CuSO4 +5H2O = CuSO 5H2O 铜是不活泼金属,不能直接和稀硫酸发生反应9备硫酸铜,必须加入氧化剂。在浓硝酸和稀硫酸的混合液中,浓硝酸将铜氧化成ciT, cf+与SO2-结合得到产物硫酸铜。 2. 提纯原理: 未反应的铜屑(不溶性杂质)用倾滗法除去。利用硝酸铜的溶解度在273K?373K 范围内均大于硫酸铜溶解度的性质,溶液经蒸发浓缩后析出硫酸铜,经过滤与可溶性杂质硝酸铜分离,得到粗产品。 硫酸铜的溶解度随温度升高而增大,可用重结晶法提纯。在粗产品硫酸铜 中,加适量水,加热成饱和溶液,趁热过滤除去不溶性杂质。滤液冷却,析出 硫酸铜,过滤,与可溶性杂质分离,得到纯的硫酸铜。 T/K 273 293 313 333 353 373
五水硫酸铜 硝酸铜 三?主要仪器与试剂 1仪器烧杯量筒热过滤漏斗减压过滤装置台称坩埚钳,蒸发皿。 2 试剂Cu (s) 、H2SQ、HNOL; L) 四?操作步骤
结果:1.上述得到的粗产品的重量为:5.30g 2.重结晶后得到的产品重量为:2.39 g 分析:1. Cu —CuSQ —CuSQ ? 5H2O(s) 64 160 250 1.5g 3.75g 5.86g 产率=5.30g/5.86g x 100% = % 2.理论重结晶率为:(8 3. 8g-27.5g)/*100%=% 实际重结晶率为:/ * 100% = % (在283K与353k时的溶解度分别为27.5g/100g水、83.8g/100g水) 六.讨论 ?:1. 列举从铜制备的其他方法,并加以评述答:由铜制备硫酸铜时铜的价态升高了,
